Method Article
Synthèse efficace des benzènes polyfonctionnalisés dans l'eau par l'intermédiaire de Benzannulation de Persulfate-promotionné de ' , composés insaturés et alkynes
Dans cet article
Résumé
Un benzannulation sans métal persulfate-favorisé de composés et d'alkynes insaturés de persulfate-promouvoir de l'eau vers la synthèse des benzènes polyfonctionnalisés sans précédent est rapporté.
Résumé
Les réactions de benzannulation représentent un protocole efficace pour transformer les blocs de construction acycliques en squelettes de benzène structurellement variés. Malgré les approches classiques et récentes à l'égard des benzènes fonctionnalisés, les méthodes sans métal d'eau demeurent un défi et représentent une occasion d'élargir encore plus l'ensemble d'outils utilisés pour synthétiser les composés de benzène polysubstitué. Ce protocole décrit une configuration expérimentale opérationnellement simple pour explorer la benzannulation des composés insaturés et des alkynes pour permettre des anneaux fonctionnels sans précédent de benzène dans des rendements élevés. Le persulfate d'ammonium est le réactif de choix et apporte des avantages notables comme stabilité et maniabilité facile. En outre, l'utilisation de l'eau comme solvant et l'absence de métaux confèrent une plus grande durabilité à la méthode. Une procédure de mise en place modifiée qui évite l'utilisation d'agents de séchage ajoute également de la commodité au protocole. La purification des produits est effectuée à l'aide d'un seul bouchon de silice. La portée du substrat est actuellement limitée aux alkynes terminales et aux composés aliphatiques insaturés.
Introduction
Les benzènes fonctionnalisés sont sans doute les précurseurs les plus utilisés en chimie organique synthétique1,2. Ils figurent dans le courant dominant des produits pharmaceutiques, des produits naturels et des matières organiques fonctionnelles. Des approches puissantes ont été rapportées pour la construction de dérivés polysubstitués de benzène et parmi elles, les méthodes bien établies comme substitution nucléophile ou électrophilique aromatique3,les réactions de couplagecroisé 4 et la métalation dirigée5 sont des approches répandues. Néanmoins, l'application généralisée de ces stratégies peut être entravée par une portée de substrat limitée, des problèmes de réaction excessive et de regiosélectivité.
Les réactions de cyclisation de Tandem représentent une alternative très attrayante aux méthodes classiques pour la construction rapide des benzènes fonctionnalisés d'une manière atome-économique6,7,8. Dans ce cadre, les réactions de benzannulation représentent un protocole approprié pour transformer efficacement les blocs de construction acycliques en squelettes de benzène précieux. Cette classe de réaction est une méthodologie polyvalente comportant une variété de matières premières chimiques, de mécanismes et de conditions expérimentales9,10,11.
L'objectif de notre étude est de développer un protocole simple et pratique pour une réaction benzannulation pour générer des anneaux de benzène fonctionnalisés sans précédent. À cette fin, nous avons entrepris d'explorer une benzannulation sans métal et parvoie use d'eau utilisant des matières premières chimiques bon marché (composés insaturés et alkynes).
Plusieurs avantages par rapport aux méthodes rapportées dans la littérature peuvent être soulignés. Les transformations sans métal ont tous les attributs nécessaires pour répondre aux exigences du développement durable. Pour ne citer que quelques-uns, il n'est pas nécessaire d'éliminer les traces métalliques coûteuses et difficiles des produits désirés; les réactions sont moins sensibles à l'oxygène et à l'humidité, ce qui facilite sa manipulation et le processus global est normalement moins coûteux12. Les sels de persulfate sont stables, faciles à manipuler et ne génèrent que du sulfate comme sous-produit, ce qui ajoute de l'élan à l'initiative de chimie verte pour minimiser la pollution des déchets13. L'eau est considérée comme un solvant vert approprié pour les réactions organiques : elle est non toxique, non inflammable, a une odeur très faible et est disponible à faible coût. Même les composés organiques insolubles de l'eau peuvent être employés utilisant « sur l'eau »14 suspensions aqueuses et ces protocoles synthétiques simples ont gagné l'attention croissante au cours des années.
Nos conditions de réaction optimisées et notre procédure simple de mise en place/purification donnent accès à plusieurs anneaux de benzène fonctionnalisés qui offrent une multitude d'opportunités pour une fonctionnalisation ultérieure.
Protocole
CAUTION : Consultez les fiches de données sur la sécurité des matériaux (SDM) avant l'utilisation des produits chimiques dans le présent processus. Utilisez l'équipement de protection individuelle (EPI) approprié, y compris des lunettes de sécurité, une blouse de laboratoire et des gants nitriles, car plusieurs réactifs et solvants sont toxiques, corrosifs ou inflammables. Effectuer toutes les réactions dans une hotte de fumée. Les liquides utilisés dans ce protocole sont transférés par micropipette.
1. Réaction de Benzannulation utilisant des alkynes et des composés insaturés
- Ajouter 2,0 ml d'eau distillée dans un tube à essai de 15 ml (1 cm de diamètre) contenant une barre d'agitation. Séquentiellement, ajouter la phénylacétylène (220 l, 2,00 mmol, 2,0 equiv.), 2-cyclohexen-1-one (96,8 l, 1,00 mmol, 1,0 equiv.) et l'ammonium persulfate (1,5 mL d'une solution aqueuse fraîchement préparée 1,3 M, 2,00 mmol, 2 ev.).
- Plafonner le tube à l'aide d'un septum en caoutchouc et y insérer une aiguille pour éviter une éventuelle accumulation de pression pendant le chauffage.
- Placer le tube dans un bloc chauffant en aluminium sur une plaque chauffante et le chauffer à 85 oC sous un remuement vigoureux (1150 tr/min) pendant 8 h.
- Pour suivre la progression de la réaction, prenez un 50 L-aliquot du milieu de réaction et transférez-le à une fiole conique de 1,5 ml. Ajouter 50 l'acétate d'éthyle au flacon et le secouer. Recueillir la couche supérieure organique avec un tube capillaire et l'analyser par TLC.
REMARQUE : Les progrès de réaction sont vérifiés par TLC comparant la disparition de la tache composée insaturée à l'apparition du produit sous la lumière UV (254 nm). L'analyse de TLC est exécutée avec des plaques en verre silica-enduites et développée avec 92:8 hexanes/acétate éthyle. Rf valeurs: phénylacetylène 0,68; 2-cyclohexen-1-1 0,23; produit 3e à 0,26.
CAUTION : Le phénylacétylène et le 2-cyclohexen-1-one sont des irritants inflammables, extrêmement toxiques et bénins. Le persulfate d'ammonium est corrosif et peut irriter les muqueuses.
2. Extraction de travail et de purification
- Refroidir le mélange de réaction à température ambiante et ajouter l'acétate d'éthyle (1 ml) dans le tube à essai. Remuer la suspension pendant environ 1 min, puis la centrifuger à 2 336 g à température ambiante pendant 1 min. Retirez la couche supérieure organique à l'aide d'une pipette Pasteur et transférez-la sur une fiole à fond rond. Répétez cette étape deux fois.
REMARQUE : L'étape de centrifugation évite l'utilisation d'agents de séchage et casse facilement toute émulsion éventuelle. - Concentrez la solution sous pression réduite à l'aide d'un évaporateur rotatif pour obtenir un pétrole brut.
- Ajouter 55 ml d'un mélange d'hexanes/acétate d'éthyle à un rapport de 92:8 dans un Becker contenant 7,5 g de SiO2 (taille de pore 60 , taille de 35-70 m de particules, pour la chromatographie flash). Remuer le flacon pour obtenir une boue homogène. Transférer la boue sur une colonne (40 mm de diamètre interne) et emballer la colonne en évanant le solvant. Si nécessaire, elute une fois de plus pour enlever les bulles de la phase stationnaire.
- Dissoudre le pétrole brut dans une quantité minimale d'acétate d'éthyle, puis transférer cette solution à la colonne. En utilisant le même 55 ml d'un mélange 92:8 hexanes/acétate d'éthyle, élichez le matériau, collecte zappai les effluents de colonne dans des tubes à essai et suivant par TLC pour obtenir le produit pur désiré.
- Concentrez la solution sous pression réduite sur un évaporateur rotatif et retirez les volatiles finaux sous vide élevé pendant au moins 1 h. Analyser un échantillon du produit purifié par 1H et 13C NMR à l'aide du CDCl3.
CAUTION : L'acétate d'éthyle et les hexanes sont inflammables. La poudre de SiO2 est un irritant respiratoire.
Résultats
Le benzène polysubstitué (3b, Figure 1) a été isolé comme une huile incolore (0,2741 g, 0,920 mmol, 92% de rendement) en utilisant notre protocole. La structure et la pureté peuvent être évaluées dans lesspectres 1 H et 13C NMR présentés dans la figure 2 et la figure 3. Les pics pour les protons aromatiques sur l'anneau central de benzène (8,37 et 7,72 ppm) ont été utilisés comme signaux diagnostiques pour la formation du produit.
6,8-diphenyl-3,4-dihydronaphthalen-1(2H)-un (3b). Rf 0,26 (92:8 hexanes/éthyle acétate); 1H RMN (500 MHz, Chloroform-d): 8,37 euros (d, J 2,26 Hz, 1H), 7,72 (d, J - 2,26 Hz, 1H), 7,67 (dd, J - 8,28, 1,51 Hz, 2H), 7,49-7,37 (m, 8H), 2,89 (t, J - 6,02 Hz, 2H), 2,72 (ap t, J - 6,02 Hz, 2H), 2,09 (quint, J 6,02 Hz, 2H). 13C RMN (125MHz, Chloroform-d): 23,19, 28,01, 39.02, 124.86, 127.00, 127.46, 127.64, 128.35, 128.85, 129.19, 133.17, 133.41, 139.13, 139.78, 140.81, 142.51, 198.60. HRMS m/z (ESI): calcd. pour C22H19O [M-H] 299.1436, trouvé 299.1420.
Plusieurs anneaux de benzène polysubstitués ont été préparés à des rendements élevés à l'aide de notre protocole (figure 1). 15 Tous les produits ont été analysés par 1H et 13C NMR, ainsi que par spectrométrie de masse à haute résolution (HRMS) afin de les caractériser pleinement.
L'analyse GC peut être utilisée comme méthode alternative pour la détection des produits; bien que l'analyse TLC fonctionne aussi efficacement. Tous les produits sont UV-active et tache en présence de la solution aqueuse de base KMnO4. Un bouchon de silice est suffisant pour la purification des produits.
Des rendements optimaux ont été obtenus en utilisant un rapport de 2:1 pour les alkynes et les composés insaturés, respectivement; 2 équiv. de persulfate d'ammonium et 85 oC comme température de réaction. Dans le processus d'optimisation, la réaction entre la phénylacétylène 1a et la fumaronitrile 2a a été choisie comme réaction modèle (tableau 1). L'augmentation de la quantité de composé insaturé a conduit à un résultat inférieur(tableau 1, entrée 3). Des variations de la quantité de (NH4)2S2O8 ont été testées et dans chaque scénario une diminution de la production de 3a a été observée (tableau 1, entrées 4 et 5). La modification de la température de réaction à 25 oC a entraîné un arrêt complet de la réactivité(tableau 1,entrée 6). L'augmentation de la température de réaction à 95 oC n'a pas amélioré le rendement(tableau 1,entrée 7).

Figure 1 : Régime général et portée de la transformation. Conditions générales: 2 ml d'eau, 1 (2,0 mmol), 2 (1,0 mmol), (NH4)S2O8 (2,0 mmol, solution aqueuse 1,3 M), 85 oC, 8 h. Rendements des produits isolés. a (en) Utilisation de 4.0 mmol de (NH4)S2O8, temps de réaction de 24 h. Ce chiffre a été modifié à partir de de Souza et al.15Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : 1RmNH H de 3b. Spectre obtenu en CDCl3 à 400 MHz. Ce chiffre a été modifié à partir de de Souza etal.15. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : 13C RMN de 3b. Spectre obtenu en CDCl3 à 400 MHz. Ce chiffre a été modifié à partir de de Souza etal.15. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
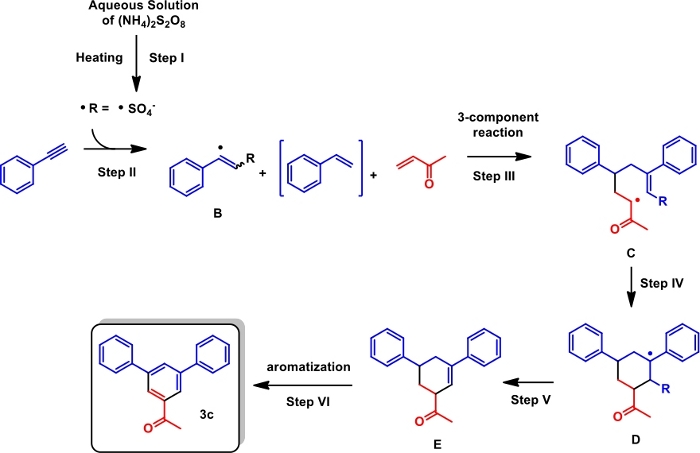
Figure 4 : Mécanisme de réaction proposé. Ce chiffre a été modifié à partir de de Souza etal.15. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
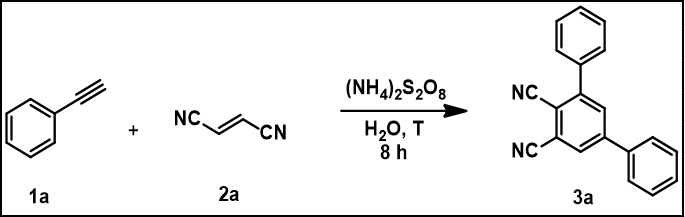 | ||||
| Entréed'un | Ratio 1a:2a | NH4S2O8 | Température | Rendement (%)b |
| (Equiv) | (T, C) | |||
| 1 | 1:1 | 2.0 | 85 | 69 |
| 2 | 2:1 | 2.0 | 85 | 90 |
| 3 | 1:2 | 2.0 | 85 | 65 |
| 4 | 2:1 | 1.0 | 85 | 56 |
| 5 | 2:1 | 3.0 | 85 | 72 |
| 6 | 2:1 | 2.0 | 25 | 0 |
| 7 | 2:1 | 2.0 | 95 | 88 |
| a (en) Conditions générales pour l'optimisation: Dans la séquence, 1,0 ml d'eau, 1a (0,5 ou 1,0 mmol), 2a (0,5 ou 1,0 mmol), (NH4)2S2O8, 8 h bRendement du produit isolé. | ||||
Tableau 1. Optimisation des conditions de réaction. Ce tableau a été modifié à partir de de Souza et coll.15
Discussion
La méthode rapportée ci-contre a été conçue pour être une configuration expérimentale très simple et douce pour la synthèse des benzènes polyfonctionnsés dans l'eau15. Dans nos conditions, nous avons pu observer d'excellents rendements pour les produits grâce à l'utilisation de persulfate d'ammonium. Une solution aqueuse de persulfate fraîchement préparée devrait être employée ; cependant, le persulfate d'ammonium solide peut également être employé sans perte de rendement. L'attention à la température du milieu de réaction est obligatoire. Une augmentation de 10 oC au-delà de la température optimisée (85 oC) a un effet délétère sur le rendement (tableau 1, entrée 7)15. Le temps de réaction peut être augmenté sans affecter en évidence le rendement. Pendant la réaction, une aiguille doit être insérée dans le septum pour soulager la pression éventuelle dans le tube.
Nous avons remarqué que la réaction impliquant l'alkyne riche en électrons 1-ethynyl-4-methoxybenzene était lente, nous avons donc décidé d'utiliser 4 équiv. de persulfate d'ammonium pendant 24 heures de temps de réaction pour atteindre un rendement adéquat (3d, Figure 1).
La mise en place de ce protocole implique une étape de centrifugation et une étape d'extraction à l'aide d'acétate d'éthyle. L'étape de centrifugation rend l'ensemble du processus d'isolement beaucoup plus facile puisque toute émulsion éventuelle formée peut être brisée rapidement. Il évite également l'utilisation d'agents de séchage car la séparation des phases aqueuse et organique se produit plus efficacement. Nous avons choisi l'acétate d'éthyle pour des raisons durables16; néanmoins, d'autres solvants communs pour l'extraction peuvent également être utilisés.
Nous n'avons observé aucune purification provocante pour les produits ; ainsi, un bouchon de silice a été employé rendant l'ensemble du processus plus attrayant sur les plan opérationnel et économique. La plupart des produits ont été purifiés à l'aide de 92:8 (hexanes/acétate d'éthyle). (3d, Figure 1) a été purifié à l'aide de 80:20 (hexanes/éthyle acétate) et (3e, figure 1) a été purifié à l'aide de 90:10 (hexanes/éthyle acétate).
Ce protocole simple fournit une gamme d'anneaux de benzène fonctionnalisés dans des rendements élevés ; cependant, la méthode est actuellement limitée aux alkynes terminales et aux composés aliphatiques insaturés. 15 Les alkynes internes n'ont pas fourni les produits ciblés. Dans la réaction employant 4-phenylbut-3-yn-2-ol, une réduction formelle du triple lien s'est produite pendant la transformation tandis que le diméthyle mais-2-ynedioate a donné un produit de cyclotrimerization. La cétone aromatique, insaturée 4-phenylbut-3-en-2-one a en effet donné le produit, mais il n'était pas séparable en employant seulement un bouchon de silice. Comme nous visions à employer la plus faible quantité possible de silice et de solvants et, par conséquent, réduire le facteur E17, nous avons classé ce substrat comme infructueux afin de préserver la durabilité de la transformation. Actuellement, nous étudions des modifications dans la procédure afin d'atteindre également ces substrats.
Nous avons ensuite suggéré un mécanisme de réaction possible pour la conversion(figure 4, en utilisant le phénylacétylène et la cétone de vinyle de méthyle comme substrats représentatifs). Une solution aqueuse de (NH4)2S2O8 sous chauffage produit du sulfate radical (Figure 4, étape I). Un tel radical est enclin à ajouter à la phénylacétylène fournissant radical B et styrène provenant du radical B (étape II). La cétone de vinyle de méthyle, le radical B et le styrène participent à une réaction à 3 composants pour donner le C radical (étape III). La cyclisation de C fournit radical D (Étape IV). L'élimination des rendements radicaux De Olefin E (Étape V) et l'aromatisation ultérieure permet la formation du produit ciblé (étape VI).
En résumé, notre protocole est une méthode pratique pour explorer la réaction de benzannulation sans métal dans l'eau répondant aux exigences de la chimie durable et plaidant en faveur d'installations expérimentales opérationnellement simples.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous remercions Fundaçao de Amparo à Pesquisa do Estado de Sao Paulo (FAPESP, Sao Paulo, Brésil) pour son soutien financier (Grant FAPESP 2017/18400-6). Cette étude a été financée en partie par le Coordenaçao de Aperfeiçoamento de Pessoal de N'vel Supérieur - Brasil (CAPES) - Code financier 001.
matériels
| Name | Company | Catalog Number | Comments |
| Ammonium persulfate | Vetec | 276 | |
| Chloroform-D, (D, 99.8%) | Sigma Aldrich | 570699-50G | |
| 2-cyclohexen-1-one >95% | Sigma Aldrich | C102814-25ML | |
| Ethyl Acetate, 99.9% | Synth | 01A1010.01.BJ | ACS |
| Hexanes, 98.5% | Synth | 01H1007.01.BJ | ACS |
| Phenylacetylene 98% | Sigma Aldrich | 117706-25ML | |
| Silica Gel (SiO2) | Fluka | 60738-5KG | pore size 60 Å, 35-70 μm particle size |
| Thin-layer chromatography plates | Macherey-Nagel | 818333 | 0.20 mm silica gel 60 with fluorescent indicator UV254 |
Références
- New Trends in Cross-Coupling. Theory and Applications. Colacot, T. J. , Royal Society of Chemistry. Cambridge, UK. (2015).
- Hassan, J., Sévignon, M., Gozzi, C., Schulz, E., Lemaire, M. Aryl-Aryl Bond Formation One Century after the Discovery of the Ullmann Reaction. Chemical Reviews. 102 (5), 1359(2002).
- Snieckus, V. Directed Aromatic Functionalization and references therein. Beilstein Journal of Organic Chemistry. 7, 1215-1218 (2011).
- Ashenhurst, J. Intermolecular oxidative cross-coupling of arenes. Chemical Society Reviews. 39 (2), 540-548 (2010).
- Reich, H. Role of Organolithium Aggregates and Mixed Aggregates in Organolithium Mechanisms. Chemical Reviews. 113 (9), 7130-7178 (2013).
- van Otterlo, W. A. L., de Koning, C. B. Metathesis in the Synthesis of Aromatic Compounds. Chemical Reviews. 109, 3743-3782 (2009).
- Zhou, P., Huang, L. B., Jiang, H. F., Wang, A. Z., Li, X. W. Highly Chemoselective Palladium-Catalyzed Cross-Trimerization between Alkyne and Alkenes Leading to 1,3,5-Trienes or 1,2,4,5-Tetrasubstituted Benzenes with Dioxygen. Journal of Organic Chemistry. 75, 8279-8282 (2010).
- Li, S., Wu, X. X., Chen, S. Base-promoted direct synthesis of functionalized N-arylindoles via the cascade reactions of allenic ketones with indoles. Organic and Biomolecular Chemistry. 17, 789-793 (2019).
- Maezono, S. M. B., Poudel, T. N., Lee, Y. One-pot construction of sterically challenging and diverse polyarylphenols via transition-metal-free benzannulation and their potent in vitro antioxidant activity. Organic and Biomolecular Chemistry. 15, 2052-2062 (2017).
- Shu, W. M., Zheng, K. L., Ma, J. R., Wu, A. X. Transition-Metal-Free Multicomponent Benzannulation Reactions for the Construction of Polysubstituted Benzene Derivatives. Organic Letters. 17, 5216-5219 (2015).
- Jiang, L., et al. Secondary amine-catalyzed [3 benzannulation to access polysubstituted benzenes through iminium activation. Synthetic Communications. 48, 336-343 (2018).
- Scalable Green Chemistry. Case Studies from the Pharmaceutical Industry. Koening, S. G. , CRC Press. Florida, USA. (2013).
- Modern Oxidation Methods. Backvall, J. E. , Wiley-VCH. Weinhein, DE. (2004).
- Narayan, S., et al. "On Water": Unique Reactivity of Organic Compounds in Aqueous Suspension. Angewandte Chemie International Edition. 44, 3275-3277 (2005).
- de Souza, G. F. P., Salles, A. G. Persulfate-Mediated Synthesis of Polyfunctionalized Benzenes in Water via Benzannulation of Alkynes and α,β-Unsaturated Compounds. Green Chemistry. , https://doi-org.remotexs.ntu.edu.sg/10.1039/c9gc02193k (2019).
- Prat, D., Wells, A., Hayler, J., Sneddon, H., McElroy, C. R., Abou-Shehada, S., Dunn, P. J. CHEM21 Selection Guide of Classical- and Less Classical-Solvents. Green Chemistry. 18, 288-296 (2015).
- Sheldon, R. A. Metrics of Green Chemistry and Sustainability: Past, Present, and Future. ACS Sustainable Chemistry & Engineering. 6, 32-48 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon