Method Article
Développer des hybrides Photosensitizer-Cobaloxime pour la production H2 à propulsion solaire dans des conditions aérobiques aqueuses
Dans cet article
Résumé
Nous avons directement incorporé un colorant organique à base de stilbene dans un noyau de cobaloxime pour générer un dyade photoensiton-catalyseur pour la production photocatalytique H2. Nous avons également développé une configuration expérimentale simple pour évaluer la production de H2 à la lumière par des assemblages photocatalytiques.
Résumé
Le développement de dispositifs de production photocatalytiques H2 est l'une des étapes clés de la construction d'une infrastructure mondiale d'énergie renouvelable basée sur H2. Un certain nombre d'assemblages photoactifs ont vu le jour où un testeur de photosensibilisant et des catalyseurs de production H2 à base de cobaloxime travaillent en tandem pour convertir l'énergie lumineuse en liaisons chimiques H-H. Cependant, l'instabilité à long terme de ces assemblages et le besoin de sources de protons dangereux ont limité leur utilisation. Ici, dans ce travail, nous avons intégré un colorant organique à base de stilbene dans la périphérie d'un noyau de cobaloxime via un lien distinct de pyridine axiale. Cette stratégie nous a permis de développer une structure hybride photoensito-catalyseur avec le même cadre moléculaire. Dans cet article, nous avons expliqué la procédure détaillée de synthèse de cette molécule hybride en plus de sa caractérisation chimique complète. Les études structurelles et optiques ont montré une interaction électronique intense entre le noyau de cobaloxime et le photosensibilisant organique. Le cobaloxime était actif pour la production de H2 même en présence de l'eau comme source de protons. Ici, nous avons développé un système simple hermétique relié à un détecteur H2 en ligne pour l'étude de l'activité photocatalytique par ce complexe hybride. Cette dyade photoensito-catalyseur présente dans la configuration expérimentale a produit continuellement H2 une fois qu'il a été exposé dans la lumière naturelle du soleil. Cette production photocatalytique H2 par le complexe hybride a été observée dans le média de mélange aqueous/organique en présence d'un donneur d'électron sacrilet dans des conditions aérobies complètes. Ainsi, ce système de mesure de la photocatalyse ainsi que le dyade photoensitois-catalyseur fournissent un aperçu précieux pour le développement de la prochaine génération photocatalytique H2 dispositifs de production.
Introduction
Dans le monde moderne, les combustibles fossiles comme le charbon, le pétrole et le gaz naturel fournissent une part de l'énergie. Cependant, ils produisent une quantité abondante de CO2 pendant la récolte d'énergie pour avoir un impact négatif sur le climat mondial1. Dans les années à venir, une forte augmentation de la demande d'énergie est prévue dans le monde entier suite à la croissance continue de la population et à l'amélioration constante du mode de vie humain. Ainsi, il existe une recherche active d'une ressource énergétique alternative appropriée pour répondre aux besoins énergétiques mondiaux. Les ressources en énergie renouvelable comme l'énergie solaire, éolienne et marémotrice sont apparues comme l'une des meilleures solutions grâce à leur processus de transduction d'énergie zéro carbone respectueux de l'environnement2. Cependant, la nature intermittente de ces ressources énergétiques a jusqu'à présent limité leur application étendue. Une solution possible de ce problème peut être trouvée dans la biologie ; l'énergie solaire est efficacement transformée en énergie chimique pendant la photosynthèse3. Suite à cet indice, les chercheurs ont développé des stratégies photosynthétiques artificielles pour stocker l'énergie solaire en liaisons chimiques à la suite d'un certain nombre de réactions d'activation de petites molécules4,5. La molécule H2 a été considérée comme l'un des vecteurs chimiques les plus attrayants en raison de leur forte densité énergétique et la simplicité de leur transformation chimique6,7.
La présence d'un photoensisateur et d'un catalyseur de production H2 est essentielle pour une configuration de production H2 active pilotée par l'énergie solaire. Ici, dans ce travail, nous nous concentrerons sur le cobaloxime complexe moléculaire à base de cobalt pour le segment catalytique. Typiquement, un centre de cobalt hexa-coordonné est lié dans une géométrie planaire carrée N4, dérivée du diméthylglyoxime (dmg) ligands, dans les cobaloximes. Les Cl complémentaires- ions, molécules de solvant (comme l'eau ou l'acétonitrile) ou les dérivés de la pyridine se ligate dans les positions axiales résiduelles8. Les cobaloximes sont connus depuis longtemps pour l'électrocatalyse active de production H2 et leur réactivité peut être réglée en appliquant des fonctionnalités variables sur la pyridine axiale9,10,11,12 . Les synthèses relativement simples, la tolérance à l'oxygène dans des conditions catalytiques et la réponse catalytique modérée des cobaloximes ont incité les chercheurs à explorer leur réactivité de production photocatalytique H2. Le groupe Hawecker a été le pionnier dans la démonstration de l'activité de production de la lumière H2 des cobaloximes en utilisant Ru (polypyridyl) à base de photosensibilisants13. Eisenberg et ses collègues ont utilisé des photosensibilisants inorganiques à base de platine (Pt) pour induire la production photocatalytique H2 en tandem avec des catalyseurs de cobaloxime14,15. Plus tard, le groupe Che a utilisé des photosensiateurs organo-or pour reproduire une activité similaire16. Fontecave et Artero ont élargi la gamme de photosensibilisants en appliquant des molécules à base d'iridium (Ir)17. Les applications pratiques de ces systèmes photocatalytiques se dirigeaient vers un barrage routier en raison de l'utilisation de photosensibilisants coûteux à base de métal. Les groupes de recherche Eisenberg et Sun ont répliqué qu'en concevant indépendamment des systèmes de production H2 à base de colorant organique18,19. Malgré le succès de la production de H2 par tous ces systèmes, il a été observé que les rotations catalytiques globales étaient relativement lentes20. Dans tous ces cas, les molécules de photosensibilisant et de cobaloxime ont été ajoutées comme moieties séparées dans la solution, et le manque de communication directe entre eux pourrait avoir entravé l'efficacité globale du système. Un certain nombre de dyades photosensibilisant-cobaloxime ont été développées pour corriger ce problème, où une variété de photosensibilisants ont été directement liés avec le noyau de cobaloxime par l'intermédiaire de la pyridine axiale ligand21,22,23 ,24,25,26. Sun et ses collègues ont même réussi à développer un dispositif sans métal noble en introduisant un motif Zn-porphyrine comme un photoensitizer24. Récemment, Ott et ses collègues ont réussi à intégrer le catalyseur de cobaloxime dans un cadre organique métallique (MOF) qui a affiché photocatalytique H2 production en présence de colorant organique27. Cependant, l'inclusion des photosensibilisants de poids moléculaire élevé dans le cadre de cobaloxime a réduit la solubilité de l'eau tout en affectant la stabilité à long terme des dyades dans des conditions catalytiques. La stabilité des dyades actives dans des conditions aqueuses pendant la catalyse est cruciale car l'eau omniprésente est une source attrayante de protons pendant la catalyse. Ainsi, il est grand besoin de développer un système de dyade baigneuse soluble et aérée de photoensitois-cobaloxime afin d'établir une configuration de production H2 efficace et économique axée sur la photo.
Ici, dans ce travail, nous avons ancré un colorant organique à base de stilbene28 comme photoensibilisant au noyau de cobaloxime via le linker de pyridine axiale (Figure 1). Le poids moléculaire léger du colorant a assuré la solubilité améliorée de l'eau de la dyade. Cette molécule hybride stilbene-cobaloxime a été caractérisée en détail par spectroscopie optique et 1H NMR avec son élucidation unique de structure de cristal. Les données électrochimiques ont indiqué la production électrocatalytique active De2 par le motif de cobaloxime même avec le colorant organique joint. Ce complexe hybride a présenté une production importante de H2 à propulsion photo lorsqu'il est exposé à la lumière directe du soleil en présence d'un donneur d'électrons sacrificiel approprié dans une solution 30:70 water/DMF (N,N-dimethylformamide) sans aucune dégradation de la solution structure hybride complétée par des études de spectroscopie optique. Un dispositif photocatalytique simple, composé d'un détecteur H2, a été employé pendant la photocatalyse du complexe hybride qui a démontré la production continue du gaz H2 sous l'état aquaérobie aqueux sans n'importe quelle période préliminaire de décalage. Ainsi, ce complexe hybride a le potentiel de devenir la base pour développer la prochaine génération de catalyseurs de production H2 à énergie solaire pour une utilisation efficace des énergies renouvelables.
Protocole
1. Synthèse de l'hybride photoensito-catalyseur
-
Synthèse du précurseur catalyseur Co(dmg)2Cl2 complexe
REMARQUE : Ce complexe a été synthétisé à la suite de la version modifiée de la procédure29signalée .- Dissoudre 232 mg (1 mmol) de diméthylglyoxime (dmg) ligand (deux équivalents dans cette réaction) dans 27 ml d'acétone.
- Dissoudre 118 mg (0,5 mmol) de CoCl26H2O (un équivalent dans cette réaction) dans 3 ml d'eau déionisée séparément qui produit une solution de couleur rose.
- Ajouter la solution coCl2 aqueuse goutte sage à la solution d'acétone contenant dmg avec agitation continue à température ambiante.
- Surveillez de près le changement de la couleur de la solution, qui se transformera séquentiellement en couleur verte bleuâtre après l'ajout de métal.
- Continuer la réaction pendant 2 h.
- Filtrer le mélange de réaction à travers un papier filtre de 40e année et maintenir le filtrate à 4 oC pendant la nuit.
- Le lendemain, obtenir le précipité de couleur verte de Co(dmg)2Cl2 complexe (cobaloxime) de la solution et le filtrer à travers le papier filtre de grade 40.
- Séchez l'échantillon sous l'air.
-
Synthèse de l'hybride photosensibilisant (PS)-cobaloxime
REMARQUE : Le photosensitoiseur à base de stilbene (PS) a été synthétisé selon la méthode28signalée. Les étapes suivantes ont été suivies pour la synthèse du complexe hybride PS-catalyseur.- Ajouter 100 mg (0,277 mmol) de cobaloxime (un équivalent) (synthétisé à l'étape 1) dans 5 ml de méthanol. Il formera une suspension verte.
- Ajouter 38 l (0,277 mmol) de base de triéthylamine (TEA) (un équivalent) à la suspension verte avec une agitation continue. La solution deviendra brun transparent après 1 min.
- Ajouter 65 mg (0,277 mmol) de colorant stilbène solide (un équivalent) à la solution de cobalt ajoutée TEA précédemment mentionnée dans le méthanol.
- Continuer l'agitation pendant 3 h. Surveiller de près le changement dans la solution, qui produira séquentiellement le précipité brun-rougeâtre de l'hybride PS-cobaloxime.
- Filtrer le précipité brun-rougeâtre avec du papier filtre de grade 40 et le laver avec une quantité abondante de méthanol froid (20 ml).
- Dissoudre le précipité dans le chloroforme (10 ml) et recueillir le filtrate brun-rougeâtre.
- Évaporer le filtrate sous pression réduite à l'aide d'un rotavapor à température ambiante.
- Recueillir le produit brun-rougeâtre solide [rendement observé : 76 mg (65 %)]
- Recrystallisez le produit à partir de la solution chloroforme à température ambiante, où le chloroforme s'évapore lentement pour produire des cristaux brun-rougeâtre du complexe.
2. Caractérisation de l'hybride photosensibilisant-cobaloxime
- Caractérisation du RMN
- Dissoudre 5,0 mg du complexe hybride PS-Cobaloxime purifié dans 650 L de d6-DMSO.
- Enregistrez le 1H RMN dans le spectromètre RMN à température ambiante.
REMARQUE : 1H signaux RMN, dans les unités de 'ppm) avec le nombre correspondant de protons, leur identité, et le modèle de division en parenthèses (s - singlet, d 'doublet, m ' multiplet), sont comme suit: 1H NMR: 2.34 (12H, -dmg-CH3, s), 2,97 (6H, -dye-N-(CH3)2, s), 6,74 (2H, colorant-aromatique, d), 6,84 (1H, allylic-H, d), 7,48 (5H, quatre colorants aromatiques, un allylic-H, m), 7,82 (2H, colorant-aromatique, d), 18,47 (2H,d-NOmgH).
- Spectroscopie UV-Vis
- Préparer une solution de 1,0 mM du complexe PS-cobaloxime dans N,N-dimethylformamide (DMF) en ajoutant la quantité correctement pesée du complexe dans le solvant.
- Diluer la solution 10 fois avec dMF vierge pour générer une solution de 0,1 mM du complexe hybride en DMF.
- Diluer encore 5 fois avec du DMF vierge pour générer une solution de 20 millions de dollars du complexe hybride en DMF.
- Enregistrez les spectres optiques de la solution complexe PS-cobaloxime de 20 M à l'aide d'un spectrophotomètre.
REMARQUE : Les pics UV-Vis (/nm), avec le coefficient d'extinction molaire correspondant (1cm-1) en parenthèses, sont les suivants : 266 (13400) et 425 (14600).
- Détermination de la structure cristalline unique
- Préparer un échantillon concentré de 0,2 M du complexe hybride PS-catalyseur dans 5 ml de chloroforme. Cultivez des cristaux brun-rougeâtre (cubique) du complexe à partir de cette solution chloroforme sur 3 jours.
- Sélectionnez un cristal approprié du complexe et montez sur une cryo-boucle à l'aide d'un cryoprotecteur (p. ex., huile de Paratone).
- Recueillir les données de diffraction de cristal unique pour le complexe hybride à 298 K sur le diffractomètre.
- Appliquer la correction d'absorption empirique aux données en utilisant la méthode multi-scan dans la programmation SADABS30.
- Résoudre la structure par des méthodes directes avec SHELXS-97 et affiner par la matrice complète les méthodes les moins carrées sur F2 en utilisant le SHELXL-201431.
- Études électrochimiques
-
Préparation de l'échantillon
- Préparer une solution de 1 mM du complexe hybride PS-catalyseur dans le DMF de qualité HPLC contenant 0,1 M de fluorure d'ammonium tétra-N-butyle(n-Bu4N-F-/TBAF).
- Placer 2 ml de la solution d'échantillon préparée à l'étape 1 dans la cellule électrochimique (volume 5 ml).
- Purger le gaz N2 à travers la solution pendant 30 min pour éliminer l'oxygène.
-
Préparation d'électrodes
- Polissez l'électrode de travail de carbone-disque vitreux de 1 mm de diamètre avec la pâte d'alumine de 0,25 m préparée dans l'eau sur un coussin de polissage.
- Rincer soigneusement l'électrode polie avec une grande quantité d'eau déionisée.
- Placez l'électrode de travail propre dans la cellule électrochimique.
- Placez l'électrode de référence Ag/AgCl (en 1.0 M AgNO3) et l'électrode de compteur de platine (Pt) dans la cellule électrochimique.
- Connectez toutes les électrodes en conséquence au potentiostat.
-
Collecte de données
- Arrêtez la purge du gaz N2 avant l'expérience électrochimique.
- Maintenir un flux continu de N2 au-dessus de la solution d'échantillon dans la cellule électrochimique.
- Enregistrer les voltammogrammes cycliques (CV) de l'échantillon à partir de la direction anodique à la direction cathodique avec un taux d'analyse approprié (0,1 V/s taux d'analyse a été utilisé dans cette expérience).
- Répétez l'expérience ci-dessus en ajoutant des quantités appropriées d'eau (30 % d'eau dans le DMF) et d'acide trifluroacétique (TFA) (8 L de 10x tTF propre dilué), respectivement.
- Ajouter du ferrocène à la solution de l'échantillon et enregistrer le CV correspondant. Ajuster l'échelle potentielle avec le couple de ferrocène (FeCp2'/0 '0V vs Ferrocene) pour toutes les données recueillies. Ainsi, toutes les valeurs potentielles mentionnées dans ce travail ont été référencées en interne contre le couple Ferrocene.
-
Préparation de l'échantillon
3. Catalytique H2 production par l'hybride photoensito-catalyseur en plein soleil
-
Photocatalytique H2 production par le complexe hybride PS-catalyseur
- Préparer un complexe hybride PS-catalyseur de 0,2 mM dans 10 ml d'eau De 70 m30 (pH 7, tampon 0,1 MES) dans un tube à essai à deux cous.
- Ajouter 1 mL de triéthanolamine (TEOA) comme donneur d'électrons sacrificiel à la solution de l'échantillon.
- Fermez les deux ouvertures du tube à essai avec le septum étanche à l'air.
- Connectez cette configuration avec le détecteur H2 avec des connexions appropriées de tuyauterie.
REMARQUE : Le détecteur H2 a deux connexions de tube. L'un d'eux agit comme l'entrée qui passe par un détecteur intégré pour mesurer la quantité de H2 (en unités ppm) présents dans l'échantillon. L'échantillon de gaz mesuré se connecte ensuite au vaisseau de réaction par le tube de sortie. - Placez l'ensemble sous la lumière du soleil pendant 30 min et surveillez le taux de production H2 via le détecteur.
-
Surveillance de la production de H2 à l'énergie solaire par chromatographie gazeuse (GC)
- Recueillir 1 ml de gaz de l'espace de tête par l'intermédiaire de seringues étanches au gaz.
- Injecter le gaz collecté dans l'instrument de chromatographie gazeuse (GC).
- Surveillez le chromatographe à gaz qui en résulte.
- Injecter 1 ml de gaz de l'espace de tête prélevé sur un échantillon témoin placé dans l'obscurité.
- Injecter 1 ml de gaz à partir d'un mélange de gaz standard calibré contenant 1 % H2.
Résultats
Dans ce travail, un complexe hybride de photosensiton-cobaloxime de stilbene (C1) a été synthétisé avec succès en ancrant le colorant organique (L1) motif dérivé de pyridine comme ligand axial au noyau de cobalt. Les données 1H NMR du complexe hybride ont clairement démontré la présence des protons de cobaloxime et organiques de colorant dans le même complexe. Comme le montre la figure 2, la région aliphatique en apodu a mis en évidence la présence de signaux de protons de méthyle lié à l'oxyme et de stilbene N-diméthyl dans des proportions appropriées à 2,34 et 2,97, respectivement. Les signaux aromatiques et uniques de protons allié du squelette de stilbene ont été aperçus dans la région de 6,74-7,82 (ppm), qui a été mise en évidence en détail dans l'encours de la figure 2. La stabilité du noyau de cobaloxime a été illustrée par la présence de la liaison intramoléculaire d'hydrogène dans la moiety d'oxyme dans la région de champ lointain (12.47 '(ppm))11. Les spectres optiques du complexe hybride C1 présentaient deux signaux majeurs (Figure 3). Dans la région UV, un signal distinct a été observé à 266 nm. Ce signal ressemblait à la transition caractéristique de l'oxime. Une autre transition optique a été remarquée pour C1 dans la région visible à 425 nm. Ce signal est significativement décalé par rapport à la transition typique de 2012 degrés observée pour le composé de stilbènes(maximum 385 nm) (figure 3)32. Cette transition observée en C1 a peut-être une contribution significative de la transition de ligand de npyrdine'u2012Co(III) au transfert de charge métallique (LMCT), analogue à des cobaloximes axiales similaires liées à la pyrine29,33. La ligature entre le motif de pyridine dérivé du stilbène et le cobaloxime a été définitivement vérifiée avec les données de structure cristalline unique de C1. Comme le montre la figure 4, la distance d'obligations n'u2012Co critiques a été mesurée à 1,965 euro, similaire aux obligations axiales typiques npyrdine'u2012Co9. Les anneaux aromatiques ainsi que le groupe allié sont restés dans le même plan dans le complexe hybride C1 qui assurent une conjugaison allongée dans la moiety stilbene. Les détails des collections de données cristallines et des paramètres de perfectionnement des données sont donnés dans le tableau 1. Le fichier d'information cristallographique complet (CIF) du complexe hybride PS-catalyseur a été déposé dans le centre de données cristallographiques de Cambridge (CCDC No: 1883987)34.
Une expérience de voltamétrie cyclique (CV) a été réalisée avec le complexe PS-catalyseur-hybride C1 regardant avec un balayage cathodique dans la gamme de 0.5 V à -1.8 V dans DMF (figure 5). Un signal de réduction irréversible a été observé à -1,0 V (vs. Fc-/0)suivi de deux signaux réversibles successifs à -1,3 et -1,5 V. Le premier signal réducteur peut être attribué comme réduction à base de métal Co(III/II) tandis que les signaux réversibles ont été attribués aux processus stoichiométriques redox au cadre de teinture organique aromatique32. C1 a démontré un signal catalytique distinct à -1,25 V lorsque l'eau a été ajoutée à la solution. La production électrocatalytique H2 était probablement responsable de ce comportement catalytique cathodique. Cette hypothèse a été corroborée par une augmentation graduelle de cette réponse catalytique à la suite de l'ajout de l'AFE dans la même solution (figure 5). La fréquence de rotation (TOF) pour ces réponses catalytiques a été compilée en utilisant l'équation suivante :

où jechat - courant catalytique, ip - courant stoichiométrique, n - nombre d'électrons impliqués dans ce processus, R - constante de gaz universel, T - température en K, F - 1 Faraday, et le taux de balayage. La production tOF pour H2 en présence d'eau et de TFA aqueux était respectivement de 30 s-1 et 172 s-1. L'expérience chronocoulométrique complémentaire (électrolyse en vrac) a été utilisée avec la chromatographie gazeuse complémentaire (GC) pour fournir d'autres preuves de la production de H2 au cours de l'étape catalytique avec 70% d'efficacité faradaique (détails dans section supplémentaire, Figure S1).
L'activité de production H2 du noyau de cobaloxime dans C1 a été étudiée plus avant au cours des études photo-catalytiques. Dans cette expérience, C1 a été chargé dans un récipient hermétique contenant 30:70 d'eau/DMF solvant avec le donneur d'électron sacrificiel TEOA. Ce système a été connecté au capteur H2 et exposé à la lumière naturelle du soleil (densité de puissance de 100 mW/cm2) (Figure 6). Comme le montre la figure 7, le complexe hybride ps-catalyseur C1 a affiché une production catalytique H2 immédiatement après l'exposition au soleil. Dans ce cas, une augmentation presque linéaire de la production photocatalytique H2 a été observée au fil du temps. L'identité et la pureté du gaz photo-généré accumulé dans l'espace de tête de l'ensemble a été validée par la chromatographie gazeuse (GC). Comme l'illustre la figure 8, à l'énergie solaire, la production H2 a été confirmée par les résultats du GC. Le changement minimal des spectres optiques comparatifs a démontré la stabilité de C1 au cours de cette expérience (Figure S2).
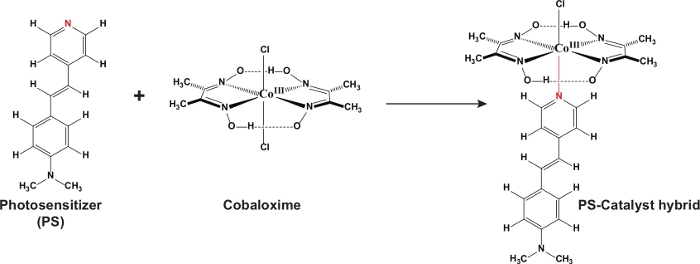
Figure 1 : Plan de réaction. Le schéma représente la voie synthétique pour le complexe hybride PS-catalyseur. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : 1spectre sINM H du complexe hybride PS-catalyseur C1. Ce chiffre affiche le 1H NMR du complexe hybride PS-catalyseur enregistré en d6-DMSO à température ambiante. La région aliphatique se compose de groupes oximé-méthyles (12 H, a), et de groupes N-méthyles liés au PS (6 H, b) (trace noire). La région aromatique se compose de 10 H, contenant à la fois aromatiques (c, d, e, f) et allylic (g et h) protoms. Les protons d'oxyme (NOH) sont les protons les plus abattus (i) (trace rouge). L'enset met en évidence le motif de fractionnement détaillé des protons aromatiques (traces bleues) et alloliques (trace verte). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Spectres optiques comparatifs. Les spectres comparatifs Uv-vis de PS (trace noire), précurseur de cobaloxime (trace rouge), et PS-catalyseur dyade C1 (trace bleue) enregistré dans DMF à température ambiante. La formation du complexe hybride a nettement changé de rouge la bande de LMCT, tandis que la transition de l'U2012 est restée la même. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Structure en cristal unique de photoensitois-Cobaloxime hybride C1. Représentation ORTEP pour C1 avec 50% de probabilité d'ellipsoïdes thermiques. Les atomes de carbone (gris), d'hydrogène (blanc), d'oxygène (rouge), d'azote (bleu ciel), de chlore (vert) et de cobalt (bleu profond) sont représentés dans les chiffres en conséquence. Une molécule chloroforme a été trouvée à l'intérieur du réseau de cristal, mais elle est omise ici pour plus de clarté. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Voltammogrammes cycliques comparatifs. Les voltammogrammes cycliques comparatifs (CV) de 1 mM C1 dans seulement DMF (trace noire), en présence de 30:70 eau/DMF (trace bleue), et en présence de 16 TFA équivalents dans 30:70 eau/DMF (trace rouge) ont été montrés dans la figure. Les scans ont été effectués en présence de 0,1 M tétra-N-butyl ammonium fluorure(n-Bu4N-F-F / TBAF) comme support électrolyte en utilisant 1mm d'électrode de travail disque de carbone vitreux, Ag /AgCl (en 1,0 M AgNO3) électrode de référence et électrode de compteur de platine (Pt)-fil à température ambiante avec 0.1 V/scan. La direction d'analyse initiale est indiquée avec la flèche noire horizontale. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
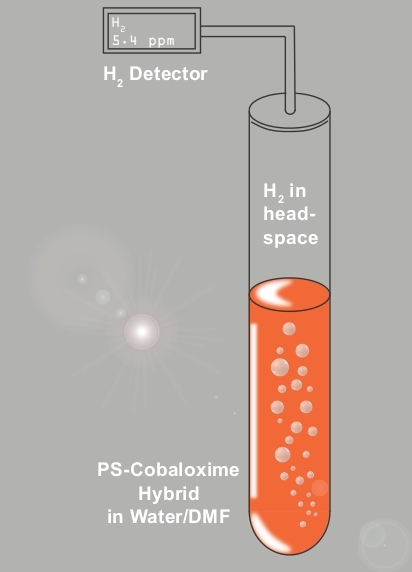
Figure 6 : Système de surveillance de la production photocatalytique H2. La représentation schématique de la mise en place expérimentale, composée d'un détecteur H2 en ligne, utilisé pour la surveillance continue de la production H2 par le dyad photoensibiïde-cobaloxime C1 sous la lumière naturelle du soleil et l'aérobie complet condition. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
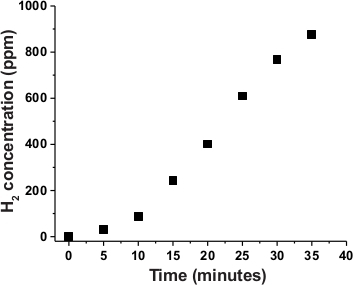
Figure 7 : Production Photocatalytique H2 par C1 au fil du temps. L'accumulation de H2 au fil du temps au cours de la photocatalyse naturelle axée sur la lumière du soleil par le complexe hybride photonsitohés-cobaloxime C1 tel que détecté par le détecteur H2 en ligne. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 8 : Données comparatives sur la chromatographie des gaz. Données comparatives sur la chromatographie gazeuse (GC) enregistrées pour le gaz spatial de la tête recueilli à partir de la dyade c1 de photoensitois-cobaloxime placée sous la lumière du soleil foncée (trace noire) et naturelle (trace bleue). La trace rouge signifiait le signal de l'échantillon de mélange de gaz d'étalonnage De 1 % H2. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 9 : Schéma photocatalytique pour la production H2 par C1. Possible cycle de production photo-catalytique H2 pour le complexe hybride PS-catalyseur C1. Ce mécanisme suit vraisemblablement la séquence d'excitation du photosensitizer, transfère l'électron excité au catalyseur par l'intermédiaire du lien, et la catalyse de production de H2 au centre catalytique réduit. Le photoenside cationique retourne à l'état de sol en acceptant l'électron du donneur d'électrons sacrificiel. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Matériel supplémentaire. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le stilbene moiety de stilbene de photosensibilisant organique a été avec succès incorporé dans le noyau de cobaloxime par l'intermédiaire du lien axial de pyridine (figure 1). Cette stratégie nous a permis de concevoir un complexe hybride photoensiton-cobaloxime C1. La présence de l'oxyme et du colorant organique dans le même cadre moléculaire était évidente à partir de la structure cristalline unique du C1 (Figure 4). Les fonctionnalités de phényl et de pyridine du motif stilbene existaient dans le même plan par l'intermédiaire d'une conjugaison allongée à travers le groupe allié. L'interaction entre ces groupes variables du colorant organique s'est poursuivie même dans la phase de solution, comme l'ont confirmé les données de 1H NMR (figure 2). La molécule de stilbene a contenu un groupe d'amine de diméthyle qui peut montrer une poussée forte d'électron par l'intermédiaire du réseau aromatique-alliéconjug conjugué au pyridine N-terminal32. On s'attendait à ce que cette interaction électronique améliore la propriété de don de la N-pyridine vers le centre de cobalt dans le complexe axially coordonné de Cobaloxime C1. L'altération distincte de la bande lcustrique lMCT du noyau de cobaloxime ainsi que le décalage rouge de la transition du motif stilbene dans C1 indique que l'interaction électronique entre les modules de métal et de photoensitoiseur (Figure 3).
Les données électrochimiques ont mis en évidence la production active De2 par ce photoensibilisant-cobaloxime hybride C1 en présence d'eau (Figure 5). Ces données suggèrent que (a) le noyau de cobaloxime dans C1 a conservé son activité intrinsèque de production H2 même en présence de colorant organique dans sa périphérie et (b) l'eau peut agir comme source de proton pendant la catalyse. Ces résultats ont conduit à l'enquête sur la production photocatalytique H2 par C1. Au cours de cette expérience, une solution aqueuse/DMF de C1, contenant un donneur d'électrons sacrificiel TEOA, a été exposée à la lumière naturelle du soleil dans un état aérobie et la configuration étanche à l'air complète a été reliée à un détecteur H2 en ligne ( Figure 6). Une accumulation continue de H2 a été remarquée au cours de cette expérience sans aucune période de décalage, mettant en évidence la production de H2 photo-conduite par C1 (Figure 7). La production de H2 pendant les conditions photocatalytiques a été encore corroborée par les expériences complémentaires du GC (figure 8). Cette production de H2 à l'énergie solaire par C1 suit peut-être le cycle catalytique typique observé pour les dispositifs photocatalytiques à base de cobaloxie qui est illustré à la figure 921. Des études antérieures menées par Eisenberg et coll. ont également soutenu le cycle photocatalytique proposé35,36,37.
La configuration expérimentale développée au cours de ce projet peut être utilisée pour filtrer un certain nombre de systèmes photocatalytiques en variant les combinaisons de photosensimideurs, catalyseurs, donneur d'électrons sacrificiels, et les ingrédients de la solution. Il y a une application potentielle de ce système dans des conditions de réaction larges car il est fonctionnel en présence de la lumière du soleil normale. Cette configuration simple peut également être utilisée en couple avec des configurations laser variables pour l'analyse approfondie de l'activité photocatalytique. Ici, nous avons incorporé le colorant de stilbene avec le complexe de cobaloxime pour produire l'hybride de production photocatalytique modéré de H2. Leur réactivité peut être modifiée davantage en installant des fonctionnalités de base inspirées par les enzymes sur le squelette complexe afin d'améliorer davantage le taux de change des protons, une étape critique pour le cycle catalytique38,39,40 . Cette première génération de photosensiizer-catalyseur adduct fournit un efficace, peu coûteux, et vert solaire H2 voie de production par rapport aux autres techniques existantes de génération H2 41. Par conséquent, la stratégie de conception des photocatalyseurs et la technique de détection de production H2 pilotée par l'énergie solaire ouvriront la voie au développement d'assemblages photo-actifs de prochaine génération pour rénover le circuit des énergies renouvelables.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Le soutien financier a été fourni par l'IIT Gandhinagar et le gouvernement de l'Inde. Nous tenons également à remercier le financement extra-muros fourni par le Conseil de recherche en sciences et en génie (SERB) (fichier no. EMR/2015/002462).
matériels
| Name | Company | Catalog Number | Comments |
| 1 mm diameter glassy carbon disc electrode | ALS Co., Limited, Japan | 2412 | 1 |
| Acetone | SD fine chemicals | 25214L10 | 27 mL |
| Ag/AgCl reference electrode | ALS Co., Limited, Japan | 12171 | 1 |
| Co(dmg)2Cl2 | Lab synthesised | NA | 100 mg |
| CoCl2.6H2O | Sigma Aldrich | C2644 | 118 mg |
| d6 dmso | Leonid Chemicals | D034EAS | 650 µL |
| Deionized water from water purification system | NA | NA | 500 mL |
| Dimethyl formamide | SRL Chemicals | 93186 | 5 mL |
| Dimethyl glyoxime | Sigma Aldrich | 40390 | 232 mg |
| Gas-tight syringe | SGE syringe Leur lock | 21964 | 1 |
| MES Buffer | Sigma | M8250 | 195 mg |
| Methanol | Finar | 67-56-1 | 15 mL |
| Platinum counter electrode | ALS Co., Limited, Japan | 2222 | 1 |
| Stilbene Dye | Lab synthesised | NA | 65 mg |
| TBAF(Tetra-n-butylammonium fluoride) | TCI Chemicals | T1338 | 20 mg |
| Triethanolamine | Finar | 102-71-6 | 1 mL |
| Triethylamine | Sigma Aldrich | T0886 | 38 µL |
| Trifluoroacetic acid | Finar | 76-05-1 | 10 µL |
| Whatman filter paper | GE Healthcare | 1001125 | 2 |
Références
- Chu, S., Majumdar, A. Opportunities and challenges for a sustainable energy future. Nature. 488 (7411), 294-303 (2012).
- Lewis, N. S., Nocera, D. G. Powering the planet: Chemical challenges in solar energy utilization. Proceedings of the National Academy of Sciences of the United States of America. 103 (43), 15729-15735 (2006).
- Faunce, T. A., et al. Energy and environment policy case for a global project on artificial photosynthesis. Energy and Environmental Science. 6 (3), 695-698 (2013).
- Artero, V., Fontecave, M. Solar fuels generation and molecular systems: is it homogeneous or heterogeneous catalysis. Chemical Society Reviews. 42 (6), 2338-2356 (2013).
- Artero, V. Bioinspired catalytic materials for energy-relevant conversions. Nature Energy. 2, 17131 (2017).
- Ball, M., Wietschel, M. The future of hydrogen - opportunities and challenges. International Journal of Hydrogen Energy. 34 (2), 615-627 (2009).
- da Silva Veras, T., Mozer, T. S., da Costa Rubim Messeder dos Santos, D., da Silva César, A. Hydrogen: Trends, production and characterization of the main process worldwide. International Journal of Hydrogen Energy. 42 (4), 2018-2033 (2017).
- Artero, V., Fontecave, M. Some general principles for designing electrocatalysts with hydrogenase activity. Coordination Chemistry Reviews. 249 (15), 1518-1535 (2005).
- Razavet, M., Artero, V., Fontecave, M. Proton Electroreduction Catalyzed by Cobaloximes: Functional Models for Hydrogenases. Inorganic Chemistry. 44 (13), 4786-4795 (2005).
- Landrou, G., Panagiotopoulos, A. A., Ladomenou, K., Coutsolelos, A. G. Photochemical hydrogen evolution using Sn-porphyrin as photosensitizer and a series of Cobaloximes as catalysts. Journal of Porphyrins and Phthalocyanines. 20, 534-541 (2016).
- Panagiotopoulos, A., Ladomenou, K., Sun, D., Artero, V., Coutsolelos, A. G. Photochemical hydrogen production and cobaloximes: the influence of the cobalt axial N-ligand on the system stability. Dalton Transactions. 45 (15), 6732-6738 (2016).
- Wakerley, D., Reisner, E. Development and understanding of cobaloxime activity through electrochemical molecular catalyst screening. Physical Chemistry Chemical Physics. 16 (12), 5739-5746 (2014).
- Hawecker, J., Lehn, J. M., Ziessel, R. Efficient homogeneous photochemical hydrogen generation and water reduction mediated by cobaloxime or macrocyclic cobalt complexes. Nouveau Journal de Chimie. 7 (5), 271-277 (1983).
- Du, P., Knowles, K., Eisenberg, R. A Homogeneous System for the Photogeneration of Hydrogen from Water Based on a Platinum(II) Terpyridyl Acetylide Chromophore and a Molecular Cobalt Catalyst. Journal of the American Chemical Society. 130 (38), 12576-12577 (2008).
- Du, P., Schneider, J., Luo, G., Brennessel, W. W., Eisenberg, R. Visible Light-Driven Hydrogen Production from Aqueous Protons Catalyzed by Molecular Cobaloxime Catalysts. Inorganic Chemistry. 48 (11), 4952-4962 (2009).
- To, W. P., et al. Luminescent Organogold(III) Complexes with Long-Lived Triplet Excited States for Light-Induced Oxidative C-H Bond Functionalization and Hydrogen Production. Angewandte Chemie International Edition. 51 (11), 2654-2657 (2012).
- Zhang, P., et al. Phosphine Coordination to a Cobalt Diimine–Dioxime Catalyst Increases Stability during Light-Driven H2 Production. Inorganic Chemistry. 51 (4), 2115-2120 (2012).
- McCormick, T. M., et al. Reductive Side of Water Splitting in Artificial Photosynthesis: New Homogeneous Photosystems of Great Activity and Mechanistic Insight. Journal of the American Chemical Society. 132 (44), 15480-15483 (2010).
- Zhang, P., et al. Photocatalytic Hydrogen Production from Water by Noble-Metal-Free Molecular Catalyst Systems Containing Rose Bengal and the Cobaloximes of BFx-Bridged Oxime Ligands. The Journal of Physical Chemistry C. 114 (37), 15868-15874 (2010).
- Dalle, K. E., Warnan, J., Leung, J. J., Reuillard, B., Karmel, I. S., Reisner, E. Electro- and Solar-Driven Fuel Synthesis with First Row Transition Metal Complexes. Chemical Reviews. 119 (4), 2752 (2019).
- Fihri, A., Artero, V., Razavet, M., Baffert, C., Leibl, W., Fontecave, M. Cobaloxime-Based Photocatalytic Devices for Hydrogen Production. Angewandte Chemie International Edition. 47 (3), 564-567 (2008).
- Li, C., Wang, M., Pan, J., Zhang, P., Zhang, R., Sun, L. Photochemical hydrogen production catalyzed by polypyridyl ruthenium-cobaloxime heterobinuclear complexes with different bridges. Journal of Organometallic Chemistry. 694 (17), 2814-2819 (2009).
- Mulfort, K. L., Tiede, D. M. Supramolecular Cobaloxime Assemblies for H2 Photocatalysis: An Initial Solution State Structure-Function Analysis. The Journal of Physical Chemistry B. 114 (45), 14572-14581 (2010).
- Zhang, P., Wang, M., Li, C., Li, X., Dong, J., Sun, L. Photochemical H2 production with noble-metal-free molecular devices comprising a porphyrin photosensitizer and a cobaloxime catalyst. Chemical Communications. 46 (46), 8806-8808 (2009).
- McCormick, T. M., Han, Z., Weinberg, D. J., Brennessel, W. W., Holland, P. L., Eisenberg, R. Impact of Ligand Exchange in Hydrogen Production from Cobaloxime-Containing Photocatalytic Systems. Inorganic Chemistry. 50 (21), 10660-10666 (2011).
- Veldkamp, B., Han, W. S., Dyar, S., Eaton, S., Ratner, M., Wasielewski, M. Photoinitiated multi-step charge separation and ultrafast charge transfer induced dissociation in a pyridyl -linked photosensitizer-cobaloxime assembly. Energy & Environmental Science. 6 (6), 1917-1928 (2013).
- Roy, S., Bhunia, A., Schuth, N., Haumann, M., Ott, S. Light-driven hydrogen evolution catalyzed by a cobaloxime catalyst incorporated in a MIL-101(Cr) metal-organic framework. Sustainable Energy & Fuels. 2 (6), 1148-1152 (2018).
- Song, T., Yu, J., Cui, Y., Yang, Y., Qian, G. Encapsulation of dyes in metal-organic frameworks and their tunable nonlinear optical properties. Dalton Transactions. 45 (10), 4218-4223 (2016).
- Schrauzer, G. N., Parshall, G. W., Wonchoba, E. R. Bis(Dimethylglyoximato)Cobalt Complexes: ("Cobaloximes"). Inorganic Syntheses. , 61-70 (2007).
- Sheldrick, G. M. Program for Empirical Absorption Correction of Area Detector Data. Sadabs. , (1996).
- Gruene, T., Hahn, H. W., Luebben, A. V., Meilleur, F., Sheldrick, G. M. Refinement of macromolecular structures against neutron data with SHELXL2013. Journal of Applied Crystallography. 47, 462-466 (2014).
- Kumari, B., Paramasivam, M., Dutta, A., Kanvah, S. Emission and Color Tuning of Cyanostilbenes and White Light Emission. ACS Omega. 3 (12), 17376-17385 (2018).
- Schrauzer, G. N., Lee, L. P., Sibert, J. W. Alkylcobalamins and alkylcobaloximes. Electronic structure, spectra, and mechanism of photodealkylation. Journal of the American Chemical Society. 92 (10), 2997-3005 (1970).
- Groom, C. R., Bruno, I. J., Lightfoot, M. P., Ward, S. C. The Cambridge Structural Database. Acta Crystallographica Section B, Structural Science, Crystal Engineering and Materials. 72, 171-179 (2016).
- Das, A., Han, Z., Haghighi, M. G., Eisenberg, R. Photogeneration of hydrogen from water using CdSe nanocrystals demonstrating the importance of surface exchange. Proceedings of the National Academy of Sciences of the United States of America. 110 (42), 16716-16723 (2013).
- Das, A., Han, Z., Brennessel, W. W., Holland, P. L., Eisenberg, R. Nickel Complexes for Robust Light-Driven and Electrocatalytic Hydrogen Production from Water. ACS Catalysis. 5 (3), 1397-1406 (2015).
- Eckenhoff, W. T., Eisenberg, R. Molecular systems for light driven hydrogen production. Dalton Transactions. 41 (42), 13004-13021 (2012).
- Dutta, A., Appel, A. M., Shaw, W. J. Designing electrochemically reversible H 2 oxidation and production catalysts. Nature Reviews Chemistry. 2 (9), 244 (2018).
- Savéant, J. M. Proton Relays in Molecular Catalysis of Electrochemical Reactions: Origin and Limitations of the Boosting Effect. Angewandte Chemie International Edition. 58 (7), 2125-2128 (2019).
- Khandelwal, S., Zamader, A., Nagayach, V., Dolui, D., Mir, A. Q., Dutta, A. Inclusion of Peripheral Basic Groups Activates Dormant Cobalt-Based Molecular Complexes for Catalytic H2 Evolution in Water. ACS Catalysis. , 2334-2344 (2019).
- Staffell, I., et al. The role of hydrogen and fuel cells in the global energy system. Energy & Environmental Science. 12 (2), 463-491 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon