Method Article
Étude simultanée du recrutement des sous-populations de Monocyte sous flux In Vitro
Dans cet article
Résumé
Nous présentons ici un protocole intégré qui mesure la sous-population de monocyte traite sous flux in vitro par l’utilisation de marqueurs de surface spécifiques et la microscopie confocal fluorescence. Ce protocole peut être utilisé pour explorer les étapes séquentielles de recrutement aussi bien quant à profil autres sous-types de leucocytes à l’aide d’autres marqueurs de surface spécifiques.
Résumé
Le recrutement des monocytes du sang vers les tissus périphériques ciblés est essentiels pour le processus inflammatoire au cours de la lésion tissulaire, le développement de tumeurs et les maladies auto-immunes. Ceci est facilité grâce à un processus de capture de libre circulation sur la surface luminale de cellules endothéliales activées, suivie de leur migration transendothéliale et de l’adhérence (transmigration) dans le tissu sous-jacent affecté. Cependant, les mécanismes qui prennent en charge le recrutement préférentiel et contextuelle des sous-populations de monocytes ne sont pas encore pleinement compris. Par conséquent, nous avons développé une méthode qui permet le recrutement des sous-populations de monocyte différents en même temps visualisé et calculées sous flux. Cette méthode basée sur l’imagerie confocale Time-lapse, permettant de distinguer sans ambiguïté les monocytes adhérentes et réincarnés. Ici, nous décrivons comment cette méthode peut être utilisée pour étudier simultanément la cascade de recrutement des monocytes pro-angiogénique et non-angiogéniques in vitro. En outre, cette méthode peut être étendue afin d’étudier les différentes étapes du recrutement de trois populations de monocytes.
Introduction
Monocytes constituent une composante phagocytaire de l’immunité innée qui est essentielle pour la lutte contre les agents pathogènes, nettoyer les tissus endommagés, l’angiogenèse et la pathophysiologie de nombreuses maladies dont les cancers1,2,3 . Les monocytes sont des cellules dérivées de la moelle osseuse composées de populations hétérogènes qui circulent dans le sang, mais peuvent être recrutées sur le site de l’inflammation dans les tissus périphériques par le biais de mécanismes moléculaires spécifiques. Les cascades de recrutement des monocytes, en ce qui concerne les leucocytes en général, implique différentes étapes, y compris la capture, rouler, ramper, arrestation, la migration transendothéliale (transmigration) et migration à travers la paroi des vaisseaux (membrane basale et peinture murale 4de cellules). Ces mesures concernent principalement induite par l’inflammation des molécules sur la surface endothéliale luminale comme sélectines, ligands glycoprotéine, chimiokines, molécules d’adhésion intercellulaire et jonctionnel et leurs récepteurs sur leucocytes comme sélectine ligands et les intégrines. Voies de trafic à travers les jonctions de cellules endothéliales (paracellulaires) ou par l’intermédiaire de l’organisme de cellules endothélial (transcellulaire) peuvent être utilisés par les leucocytes de franchir la barrière endothéliale5. Tandis que les monocytes ont historiquement été documentés à transmigrer la voie transcellulaire, divergences potentielles dans leur voie migratoire ont été proposés comme monocytes ne sont plus considérés comme une population homogène de cellules. Il est maintenant évident que la diversité des monocytes peuvent être définies par chacun de leurs différences et points communs, en ce qui concerne leur extravasation distinctive cascades3,6. Par conséquent, afin de distinguer sans ambiguïté les sous-populations de monocytes, il est crucial de visualiser, et le processus de phénotype le comportement de chacun de ces différentes sous-populations lors du recrutement.
Monocytes d’être humain, porc, rat et souris ont été subdivisées en sous-populations phénotypiques avec certaines fonctions attribuées et les comportements migratoires spécifiques7,8,9. Par exemple, chez les humains, monocytes se divisent en trois sous-ensembles basés sur leur expression superficielle de CD14, un corécepteur pour lipopolysaccharide bactérien et CD16, les récepteurs Fc-gamma III. Sous-populations de monocyte humain incluent CD14 classique+CD16-, les intermédiaires CD14+CD16+ et non-classique CD14dimCD16+ cellules6,9. Le CD14 classique+CD16– monocytes se sont avérées être principalement inflammatoire alors que la piscine du CD16+ monocytes trouvées collectivement de présenter TIE2 expression et on fonction10. Régulièrement, la stimulation des cellules endothéliales par des cytokines inflammatoires telles que la nécrose de tumeur humaine facteur α (TNF) ou l’interleukine (il-1) beta (inflammation conventionnelle) est suffisante pour déclencher le recrutement complet de CD14 classique+CD16 – monocytes. Cependant, des actions simultanées de facteur de croissance endothélial vasculaire (VEGF) A et de TNFα (inflammation d’axée sur les facteurs angiogéniques) sont nécessaires pour provoquer la transmigration de le CD16+ on piscine de monocytes3. Historiquement, le système traditionnel de Transwell sous des conditions statiques, la chambre de flux de plaques parallèles et les chambres de débit µ-diapositive ont été utilisées pour analyser quantitativement le recrutement de la population à un moment en vitro11 un leucocyte ,12,13. Tandis que ces protocoles ont été validés, une méthode plus robuste permettant l’analyse simultanée de plusieurs sous-populations de monocyte serait considérée comme plus perspicace. Ces méthodes doivent tenir compte des interactions multiples et les différentes fréquences de chaque population respective et également fournir une interprétation mécaniste des similarités et des spécificités pour les cascades de recrutement qui définissent chaque monocyte sous-ensemble.
Nous présentons ici une méthode basée sur l’imagerie Time-lapse de recrutement de monocytes sous flux qui permet les cascades migrateurs des sous-populations de monocyte différents à étudier simultanément à l’aide de la microscopie confocale. Cette méthode intègre certaines caractéristiques essentielles qui imitent l’inflammation des cellules endothéliales, ainsi que l’hémodynamique des monocytes dans les veinules post capillaires, en circulation l’emplacement principal du recrutement des leucocytes in vivo. La méthode proposée utilise des cellules endothéliales de veine ombilicale humaine (HUVEC), qui sont générés par un protocole bien établi d’isolement du humaine de cordons ombilicaux. Cette ressource clinique a l’avantage d’être facilement disponible comme sous-produit biologique, tout en fournissant également un rendement raisonnable des cellules endothéliales qui peuvent être isolés dans la veine ombilicale. Nous avons également utilisé les colorants fluorescents et immunofluorescence d’établir une distinction entre les différents composants cellulaires et microscopie confocale de définir sans ambiguïté le monocyte positionnement (luminal vs abluminal) au fil du temps. Le protocole présenté ici a été développé pour mesurer simultanément les niveaux de la transmigration des sous-populations de monocytes. En outre, il convient de noter que cette méthode peut être étendue afin d’étudier les autres sous-populations de leucocytes et le processus de recrutement par l’utilisation de différents biomarqueurs et l’étiquetage.
Protocole
Matériel humain ont été utilisés avec le consentement éclairé des donneurs volontaires et conformément à la Suisse les comités d’éthique sur la recherche clinique.
1. isolement et gel des ombilical humain de la veine des cellules endothéliales (HUVEC)
- Ajouter 5 mL de solution d’enrobage dans une fiole de T75 (0,1 mg/mL collagène G et 0,2 % de gélatine dans du PBS solution saline tamponnée au phosphate à pH 7,4) pendant 30 min à 37 ° C avant de lancer l’isolement HUVEC.
- Nettoyer le cordon avec du PBS, essuyer avec une compresse stérile et placez-le dans une boîte de Pétri stérile de 20 cm. Couper les extrémités du cordon avec des ciseaux stériles.
- Identifier la grande veine unique et les deux petites artères. Insérez doucement une canule avec un robinet à trois voies en annexe dans les extrémités de la veine à l’extrémité de la corde.
- Serrez le cordon et la connexion de la canule solidement avec une longueur de fil.
- Perfuse le cordon deux fois avec 20 mL de milieu RPMI contenant 100 U/mL de pénicilline, 100 U/mL de streptomycine et 250 ng/mL d’amphotéricine B pour laver des veines du cordon. Ce processus rend l’aspect du cordon, plus blanches et plus claire. Vider la veine avant l’ajout de collagénase en recueillant le RPMI avec une seringue à une extrémité.
- Perfuse la veine avec 12 mL de 1 mg/mL collagénase type j’ai (0,22 µm filtré).
- Fermez le robinet d’arrêt sur le câble se termine et incuber le cordon à 37 ° C pendant 12 min.
- Massez délicatement le cordon pour détacher des cellules endothéliales de la lumière de la veine.
- Prenez 30 mL de RPMI contenant 10 % de sérum de veau foetal avec une seringue de 50 mL et connectez-le à une extrémité du cordon ombilical.
- Connecter une seringue vide de 50 mL à l’autre extrémité du cordon ombilical
- Ouvrir le robinet et perfuse la veine d’un bout tout en recueillant réciproquement de l’autre extrémité.
Remarque : La suspension recueillie contient des cellules endothéliales. - Centrifuger cette suspension cellulaire à 200 x g pendant 5 min.
- Jeter le surnageant et remettre en suspension le culot cellulaire avec 10 mL de milieu M199 complet (M199 suppléments contenant 20 % FCS, la croissance de cellules endothéliales 15 µg/mL, 100 µg/mL Héparine sodique, hydrocortisone 0,5 de µM, 10 µg/mL d’acide L-ascorbique, 100 U/mL de pénicilline, 100 U/mL streptomycine et 250 ng/mL amphotéricine B).
- Enlever la solution de revêtement de la fiole T75 et rincez une fois avec du PBS.
- Graines les cellules récoltées étape 1.13 dans le ballon T75 et placez-le dans l’incubateur à 37 ° C, avec 5 % de CO2.
- Le lendemain, rincer le ballon 3 fois avec le milieu M199 complet pour enlever résiduelle des culots globulaires et puis changer le milieu tous les 2 jours jusqu’au confluent.
- Au confluent de 80 à 90 %, rincer la monocouche HUVEC fois avec 5 mL de PBS et détacher les cellules avec 5 mL de trypsine de 0,05 % à 1 mM EDTA à 37 ° C pendant 5 min. Ajouter 4 mL de M199 et 1 mL de FCS pour arrêter l’action de la trypsine. Rincer le ballon pour détacher tous HUVEC.
- Prélever une partie aliquote de 50 µL d’être utilisés pour la coloration de la VE-cadhérine, PECAM-1 et gp38 et d’analyser par cytométrie de flux pour vérifier la pureté HUVEC.
- Recueillir le reste des HUVEC étape 1.18 dans un tube de 15 mL et centrifuger à 200 x g pendant 5 min à température ambiante.
- Jeter le surnageant de l’étape 1.19, resuspendre le culot dans de la solution (FCS contenant 10 % DMSO) à une densité de 5 x 105 cellules/mL dans des cryotubes et congeler à-80 ° C ou dans l’azote liquide jusqu'à utilisation.
-
Pour vérifier la pureté HUVEC :
- Ajouter 1 µL d’anticorps de VE-cadhérine-FITC anti-humain, 1 µL d’anticorps PECAM1-PE anti-humain et 1 µL d’anticorps Podoplanin-APC anti-humain à l’aliquote de 50 µL de HUVEC recueillie à l’étape 1.18.
- Incuber à température ambiante pendant 10 min.
- Ajouter 100 µL de PBS et centrifuger à 400 x g pendant 30 s.
- Jeter le surnageant et remettre en suspension dans 100 µL de PBS. Données peuvent maintenant être acquis par des techniques de cytométrie en flux.
Remarque : HUVEC sont positives pour la VE-cadhérine et PECAM-1 et négatif pour les Podoplanin.
2. HUVEC dégivrage
Remarque : Utilisez des HUVEC à passage bas pour les expériences (maximum 5 passages).
- Enduire une fiole T75 avec 1 mL de la solution de revêtement à 37 ° C pendant 30 min.
- Defreeze HUVEC à 37 ° C pendant 2 min et remettre en suspension les cellules dans 10 mL de M199 complet rapidement.
- Centrifuger les cellules à 200 x g à température ambiante pendant 5 min et éliminer le surnageant.
- Resuspendre le culot cellulaire dans 10 mL de M199 complet.
- Transférer la suspension cellulaire dans la fiole revêtue. Placer la fiole dans l’incubateur à 37 ° C, avec 5 % de CO2. Changer le milieu de culture cellulaire tous les 2 jours.
3. HUVEC Culture à 0,4 µ-Slide chambre
- Cinq jours avant le début de l’expérience de flux, enduire préalablement les chambres d’un Dia 0,4 µ avec 30 µL de PBS contenant du collagène de 0,1 mg/mL G, 0,2 % de gélatine à 37 ° C pendant 30 min.
- Laver les chambres avec 100 µL de PBS.
- Détacher les cellules d’un HUVEC confluentes de 80 à 90 % d’une fiole de T75.
- Rincez HUVEC avec 5 mL de PBS et détacher avec 5 mL de trypsine de 0,05 % à 37 ° C pendant 5 min.
- Rincer et recueillent la suspension cellulaire dans M199 complet et compter les cellules de la méthode la plus pratique. Centrifuger à 200 x g pendant 5 min à température ambiante.
- Resuspendre le culot cellulaire à 106 cellules/mL et distribuer 30 µL (30 000 cellules) par chambre.
- Incuber les cellules dans un incubateur à 37 ° C, avec 5 % de CO2 pendant 1 h.
- Ajouter 150 µL de M199 complète dans chaque chambre et la culture des cellules pendant 5 jours dans l’incubateur à 37 ° C et 5 % de CO2. Changer le milieu tous les 2 jours.
4. HUVEC coloration pour dosage de recrutement de monocytes sous flux
- Préparer le milieu étiquetage fait de M199 et 1 µM de CMFDA (5-chloromethylfluorescein diacétate) et le réchauffer à 37 ° C pendant 5 min avant marquage cellulaire.
- HUVEC laver deux fois avec le milieu M199 chauffé à 37 ° C.
- Remettez le milieu 30 µL de réchauffé milieu étiquetage contenant 1 µM de CMFDA et placez dans l’incubateur à 37 ° C et 5 % de CO2 pendant 10 min.
- Laver une fois avec M199 complet et incuber les cellules avec M199 complète dans l’incubateur à 37 ° C et 5 % de CO2 pendant 30 min.
Remarque : Il est important d’éliminer toutes traces de sérum avant l’addition de la solution d’étiquetage, dans le cas contraire, vous pourrez modifier HUVEC coloration. - Remplacer le support avec M199 complet contenant soit TNFα humain (500 U/mL) ou un mélange de TNFα humain (500 U/mL) avec VEGFA humaine (1 µg/mL) pendant 6 h dans un incubateur à 37 ° C et 5 % de CO2.
5. isolement des Monocytes humains Pan et la coloration des sous-populations
- Utiliser une couche leuco-plaquettaire du concentré de sang humain, ou 20 mL de sang fraîchement isolée, recueilli le jour de l’expérience dans les tubes vacutainer EDTA.
- Diluer le sang en PBS-1 mM EDTA (1:1) et Pipeter doucement 20 mL du sang dilué sur le dessus de la 20 mL de média gradient de densité. Centrifuger à 400 g pendant 30 min à température ambiante avec accélération lente et sans frein.
- Recueillir les cellules mononucléées du sang périphérique (PBMC)-couche de plaquettes (entre médias gradient de densité et de couches de plasma) dans un nouveau tube de 50 mL contenant 40 mL de PBS - 1 mM EDTA. Supérieure à 50 mL de PBS - 1 mM EDTA.
- Centrifuger à 200 x g à température ambiante pendant 5 min. éliminer le surnageant.
- Resuspendre le culot cellulaire avec 10 mL de tampon de coloration (PBS - 1 mM EDTA contenant 0,5 % d’albumine sérique bovine BSA).
- Centrifuger à 200 x g à température ambiante pendant 5 min. éliminer le surnageant.
- Répétez les étapes 5.5 et 5.6.
- Resuspendre le culot cellulaire avec 10 mL de tampon de coloration. Prélever une partie aliquote de 10 µL pour un nombre de cellules.
- Contrôler les populations de PBMC et compter les cellules rapidement avec un cytomètre en flux.
Remarque : Les populations de lymphocytes et monocytes caractéristiques peuvent être observées (Figure 1 a). 50 mL de sang humain frais attendons sur 50-100 x 106 PBMC. -
Pour le recrutement de CD14 + versus CD14-PBMC sous flux:
- Laver le culot trois fois avec le tampon de flux (M199 contenant 0,5 % de BSA) et remettre en suspension les cellules mononucléaires dans le tampon courant à 6 x 106 cellules / mL.
- Faire des aliquots de 200 µL pour chaque dosage. Incuber à 37 ° C jusqu'à 20 min avant le dosage.
- Ajouter 5 µL d’anti-CD14-PE et Hoechst 33342 à une concentration finale de 2 µM à chaque aliquote. Mélanger et laisser incuber à 37 ° C pendant 10 min.
- Centrifuger l’aliquote à 400 x g pendant 30 s.
- Jeter le surnageant et Resuspendre le culot avec 200 µL de tampon de flux.
-
Pour le recrutement des sous-populations de monocyte sous flux:
- Isoler les monocytes avec un kit d’isolation de monocyte pan conformément aux instructions du fabricant.
Remarque : Le protocole suivant est de 50 x 106 cellules. Il peut évoluer vers le haut ou vers le bas aussi longtemps que c’est dans les recommandations du fabricant. - Centrifuger la suspension PBMC à 200 x g à température ambiante pendant 5 min.
- Jeter le surnageant et Resuspendre le culot avec 400 µL de tampon de coloration.
- Ajouter 50 µL de réactif de blocage des récepteurs Fc et 50 µL d’anticorps Pan Monocyte cocktail.
- Incuber à température ambiante pendant 10 min.
- Ajouter 400 µL de tampon et 100 µL d’anticorps anti-biotine conjugué de billes magnétiques de coloration. Incuber à température ambiante pendant 15 minutes.
- Ajouter 2 mL de tampon de coloration et d’utiliser une colonne de MACS LS couplée avec un aimant.
- Placer la colonne LS sur l’aimant et ajouter 1 mL de tampon de coloration. Jeter le cheminement.
- Passer la suspension PBMC dans la colonne et rassembler l’écoulement clair, bien que contenant des monocytes pan dans un nouveau tube de 15 mL.
- Ajouter de la mémoire tampon de marquage vers le haut à 5 mL.
- Prélever une partie aliquote et vérifier la qualité de l’isolement de monocytes avec un cytomètre en flux.
- Déterminer le nombre de monocytes de pan.
Remarque : Seulement la population monocytes peut être observée (Figure 1 b). - Centrifuger le reste des monocytes à l’étape 5.11.11 à 200 x g pendant 5 min.
- Jeter le surnageant.
- Resuspendre le culot dans 5 mL de tampon de flux (M199 contenant 0,5 % de BSA).
- Répétez les 5.11.13 à 5.11.14 deux fois pour éliminer toute trace d’EDTA.
- Isoler les monocytes avec un kit d’isolation de monocyte pan conformément aux instructions du fabricant.
- Faire suspension de monocytes dans le flux de la mémoire tampon (M199 avec 0,5 % de BSA) 6 x 106 cellules/ml.
- Faire des aliquots de 200 µL de monocytes pour chaque série de tests de recrutement.
- Conservez l’aliquote à 37 ° C dans l’incubateur jusqu'à 20 min avant l’injection.
- Ajouter 5 µL de l’anticorps anti-CD16-PE et Hoechst 33342 (finale de 2 µM) à chaque aliquote.
- Mélanger et laisser incuber à 37 ° C pendant 10 min.
- Centrifuger l’aliquote à 400 x g pendant 30 s.
- Jeter le surnageant et Resuspendre le culot avec 250 µL de tampon de flux.
- Ajouter 30 µL de la suspension de monocytes dans une chambre de la diapositive à servir pour définir les paramètres d’acquisition sur la microscopie confocale.
- Empêcher les aliquotes de suspension monocyte étape 5.18 à 37 ° C.
Remarque : Cette suspension est prête à être injecté dans le système d’écoulement.
6. préparation du système fluidique
- Veiller à ce que l’incubateur de cellules pour l’imagerie à 37 ° C.
Remarque : Un schéma du système de débit est donné à la Figure 2. - Assembler la partie de tube i : insérer un raccord Luer connecteur mâle à une extrémité d’un morceau de tube de silicone (8 cm long et 3 mm d’épaisseur) et branchez l’autre extrémité à un ensemble d’injection de Luer en ligne. Connectez le connecteur Luer ce dernier à un morceau de tube de silicone (40 cm et 3 mm d’épaisseur) à une extrémité.
Remarque : Éventuellement, un robinet 3 voies relié à une seringue de 5 mL peut être inséré entre le jeu d’injection de Luer en ligne et le tuyau pour l’enlèvement de bulle air éventuelle de silicone. - Assembler la partie tube II : Connectez une seringue de 20 mL à une extrémité d’une longueur de tuyauterie de silicone (1 m de long et 3 mm d’épaisseur). Insérer un raccord Luer connecteur mâle à l’autre extrémité du tuyau.
- Branchez la partie I et partie tube II en insérant les mâles de connecteur Luer à un manchon de verrouillage Luer femelle (Figure 2 a).
- Mettre l’extrémité libre du tuyau silicone dans le réservoir contenant le tampon de flux (M199 + 0,5 % de BSA) chauffé à 37 ° C.
- Tirez sur le piston de la seringue de 20 mL pour remplir le tube avec le tampon du flux.
- Placer la seringue sur la pompe et le fixer.
- Mettre la pompe en retirer mode (par opposition à infuser) et spécifier le débit.
- Déterminer le débit selon la diapositive IBIDI utilisé en utilisant la formule suivante :

Remarque : Le facteur de la diapositive est tributaire de la diapositive IBIDI utilisée pour l’expérience. Pour le µ-slide j’ai0,4 Luer lock utilisé dans cet exemple, le facteur de la diapositive est 131,6. Pour facteurs de diapositive spécifique, consultez le site Web de compagnie14. La viscosité de tampon de flux est 0,0072 dyn.s/cm2. Contrainte de cisaillement dans les veinules post capillaires est environ 0,5 dynes/cm2. -
Connecter la diapositive (Figure 2 b) :
- Serrer le tube de silicone autour le manchon de verrouillage Luer femelle et débrancher les deux mâles de connecteur Luer le coupleur.
- Connectez-les à des réservoirs de la diapositive contenant stimulée HUVEC et remplissez-le de médium. Éviter les bulles d’air au cours de cette étape.
- Enlever les pinces, puis assurez-vous que la connexion n’est pas une fuite.
- Placez la lame au microscope pour l’imagerie Time-lapse et démarrer la pompe.
7. Time-lapse imagerie du recrutement de monocytes sous flux par microscopie confocale
- Utiliser un objectif 40 x (voir Table des matières) pour l’imagerie.
- Activer la 405 nm (noyaux de monocyte bleu), 488 nm (cellules endothéliales vertes) et 561 nm (rouge CD16 + sous-ensemble) lasers.
- Utilisez la chambre qui contient les monocytes pour définir les paramètres d’acquisition.
Remarque : Pour détecter les monocytes non-transmigré et réincarnés, le sténopé et l’intensité du laser 405 nm sont attachées hautes. Ainsi, non-transmigré monocytes sont légèrement visibles dans le plan basal. Monocytes réincarnés mais peut présentent une superficie non colorée autour du noyau correspondant à l’espace de nouveau occupé sous les cellules endothéliales. - Placez la chambre à acquérir sous le microscope.
- Choisissez 3 champs de vues au sein de 1 cm de rayon pour l’imagerie confocale multi-positions.
- Définir la basale et les parties apicales des cellules endothéliales
- Mettre une z-pile sur la plage de µm de 10 – 12 (étape de 0,5 µm). Exécuter une Time-lapse acquisition toutes les 1 min.
- Après 3 min de l’imagerie, injecter 200 µL de la suspension de monocyte (6 x 106 cellules/mL) par l’orifice d’injection en ligne Luer.
Remarque : Rapidement les monocytes apparaissent dans le plan focal apical, respecter et commencer la transmigration (transit entre l’apicale et le plan basal). - Image pendant au moins 30 min. Une fois terminé, arrêtez d’imagerie et arrêter l’écoulement. Clamper la tubulure pour Débranchez-les de la diapositive.
- Difficulté la diapositive avec 4 % de paraformaldéhyde à 4 ° C pendant 10 min.
- Laver la lame avec du PBS et stocker la diapositive à 4 ° C pour une analyse ultérieure si nécessaire.
8. analyser les données avec ImageJ
- Compter le nombre de totales monocytes adhérentes dans chaque domaine. Déterminer le nombre de cellules par mm2.
- Compter les monocytes réincarnés qui sont présents dans le plan basal sous les cellules endothéliales et identifiés par la présence d’un trou noir (dans le canal vert) autour du noyau.
- Séparer le nombre de leucocytes réincarnés par le nombre total de leucocytes adhérentes. Le taux de la transmigration est présenté sous forme de pourcentage des monocytes adhérentes.
- À titre d’illustration, l’apicale et les côtés basales peuvent être affichées simultanément pour illustrer les événements qui se produisent dans chacun de ces compartiments endothéliales.
Résultats
Détermination de l’état d’activation de HUVEC induite par le TNFα
La bio-activité de la cytokine inflammatoire TNFα peut être varier selon le lot et la réplétion du cycle gel-dégel. Il est important de vérifier l’état d’activation des HUVEC avec traitement de TNFα. Cela pourrait être interprété par coloration en parallèle quelques échantillons de HUVEC confluente pour l’induction inflammatoire des sélectines, ICAM-1 et VCAM-115,16,17. Une façon plus facile et plus simple de vérifier l’état d’activation des HUVEC après traitement de TNFα est le changement morphologique affiché par les cellules endothéliales sous stress inflammatoire. Comme illustré à la Figure 3, HUVEC s’allongent après 6 h en présence de TNFα par rapport aux cellules non stimulées. Élongation similaire est observée lorsque HUVECs sont stimulés par un mélange de TNFα et VEGFA. Enregistrement de l’état d’activation des HUVEC est importante car les résultats définitifs de la transmigration des monocytes dépendra de la qualité de l’activation des cellules endothéliales.
Transmigration de monocyte rend un arrêt caractéristique dans les cellules endothéliales
Pour étudier la transmigration de monocyte sous flux, nous avons utilisé la microscopie confocale avec des cellules endothéliales colorées en vert avec CMFDA et les noyaux des monocytes isolés teintés en bleu avec le colorant de Hoechst 33342 perméable à la cellule (Figure 4). Le Time-lapse imagerie confocale a permis la visualisation des monocytes à l’avion apicale, où leur phénotype pourrait être évaluée (Figure 4 a- C, 1 de film supplémentaire). Migration des cellules subissant la transmigration s’installe à l’espace intercellulaire correspondant aux jonctions cellule-cellule avant qu’ils ont disparu de l’avion apicale et est apparu dans le plan de base. Les cellules réincarnés présentent un trou noir autour du noyau correspondant aux formes monocyte. Cette forme changée constamment au cours de la migration des monocytes sous les cellules endothéliales (Figure 4 a-C, films supplémentaires 2-3). Ce trou noir dynamique fait par le corps de monocyte sous les cellules endothéliales et le positionnement de monocyte, a permis l’identification sans ambiguïté des cellules réincarnés. Quantification du recrutement de monocytes au fil du temps ont montré l’adhérence des monocytes suivie de transmigration (Figure 4-E). Bien que les leucocytes peuvent extravasate à travers les routes les transcellulaire et paracellulaire, nous avons pu observer seulement la transmigration paracellulaire sous flux avec cette méthode. Ceci est conforme à nos précédentes observations3,11,18,19.
Facteur angiogénique piloté par inflammation favorise la transmigration des monocytes CD16 +
En utilisant cette méthode, nous avons analysé la transmigration des humains on versus non-angiogénique monocytes à travers une monocouche endothéliale stimulée par les cytokines inflammatoires TNFα seul ou en combinaison avec le facteur angiogénique VEGFA. Monocytes humains on peuvent être identifiés par l’expression de CD16 ou TIE2 sur leur surface. Ici, les anticorps anti-CD16-PE servait à discriminer entre pro - et non-angiogénique monocytes. Comme le montre la Figure 5 a-B (Supplemental films 4-5), le taux de transmigration de CD16+ monocytes est faible lorsque les cellules endothéliales sont stimulées avec TNFα seulement. Toutefois, ce taux a augmenté lorsque les cellules endothéliales sont stimulées en même temps avec le TNFα et VEGFA (Figure 5Films supplémentaires-E, 6-7). Le taux de transmigration des monocytes non-angiogénique était aussi élevé dans les deux conditions inflammatoires. Pour les deux sous-populations de cellules, la transmigration est produite exclusivement par l’intermédiaire de la voie paracellulaire. Cette méthode permet donc les aptitudes de transmigration des différentes populations monocytaire à étudier en même temps.
La pureté des monocytes affecte l’efficacité de la transmigration
Les cellules mononucléaires de sang périphérique sont composées de cellules T, lymphocytes B, les cellules NK et les monocytes. La méthode d’isolement de monocyte utilisée ici exige l’épuisement des autres populations de leucocytes de PBMC. Pour comprendre comment le manque de pureté de monocyte influe sur les résultats, nous avons utilisé les PBMC et colorés pour pan-monocytes avec un anticorps anti-CD14-PE avant d’effectuer le test de recrutement sous flux. Comme illustré à la Figure 6, stimulation HUVEC TNFα ou TNFα + VEGFA induit la transmigration de seulement la population de monocytes. Les autres leucocytes composée de cellules T, lymphocytes B et les cellules NK ne pas transmigrer sous TNFα ou TNFα + VEGFA. En effet, il a été établi que ces leucocytes ont besoin d’autres signaux de transmigration. Ainsi, un isolement inefficace des monocytes conduira à une sous-estimation de la transmigration de monocyte, comme les autres leucocytes seraient comptées comme monocytes. Cela conduirait à un résultat erroné sur la transmigration de monocytes, en raison de la contamination de la population avec les autres leucocytes monocytes.

Figure 1 : profilage des monocytes isolés par cytométrie. (A) analyse de la morphologie des PBMC avant épuisement de lymphocytes. La taille (forward scatter : FSC) et de la granularité (diffusion latérale : SSC) du sang périphérique des cellules mononucléaires ont été déterminées par cytométrie en flux. (B) la taille et la granularité des monocytes isolés ont été déterminées par cytométrie en flux, après épuisement de lymphocytes. Une isolation efficace des monocytes montre un épuisement complet de la population lymphocytaire. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : schéma du système fluidique. (A) aperçu schématique du système perfusion avant et après la connexion de la lame et le montage sur le pousse-seringue. (B) schéma du processus de connexion la diapositive avec le tube à l’aide de pinces. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
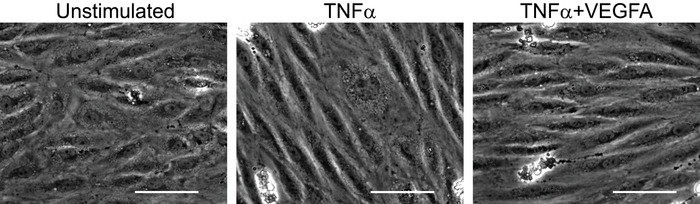
Figure 3 : vérification de l’activation efficace des cellules endothéliales. L’activation des HUVEC par stimuli inflammatoires a été vérifiée par l’analyse de la forme des cellules à l’aide de la microscopie à contraste de phase. Après 6 heures de traitement, HUVEC présente une morphologie allongée quand ils sont stimulés avec TNFα (500 U/mL) ou un mélange de TNFα (500 U/mL) + VEGFA (1 µg/mL) par rapport aux cellules non stimulées. Ce changement morphologique des HUVEC après la stimulation inflammatoire est un indicateur facile à détecter de l’activation de la cellule, qui devrait être assurée pour l’analyse de l’écoulement. Echelle = 120 µm s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Identification des monocytes réincarnés par microscopie confocale. (A) schéma de transmigration de monocytes avec les vues prévus aux plans basales et apicales. Les noyaux des monocytes colorées avec Hoechst 33342 sont tracées en bleu, et les formes théoriques des monocytes sont représentés avec des lignes en pointillés autour des noyaux. Dans la vue basale, les monocytes plats réincarnés figurent d’occuper un espace sous endothélial. Cet espace s’affiche comme un trou noir qui entoure le noyau de monocyte images confocales. (B) la localisation d’un monocyte avant et après la transmigration. Les vues orthogonales sont indiqués, et l’apparition d’un trou noir (délimité par la ligne en pointillés blanche) peut être observée après la migration des monocytes au compartiment abluminal endothéliale. Une flèche rouge indique la position d’un monocyte avant la transmigration et la pointe de flèche blanche indique la même cellule après la transmigration. Les vues orthogonales montrent que les monocytes réincarné sous la cellule endothéliale. Echelle = 40 µm. (C) Time-lapse séquences d’images (de 0 à 20 min) supplémentaires de recrutement de monocytes. Les points de vue apicales et basales sont indiqués. Les séquences complètes peuvent être vu dans la films 1, 2 et 3. Carrés rouges mettent en évidence un monocyte réincarné avec un noyau bleu. Le trou noir correspondant au corps plat de la monocyte sous la cellule endothéliale est délimité par une ligne en pointillés jaune. Echelle = 40 µm. (D) Quantification de l’adhérence des monocytes à stimulée par le TNFα versus non stimulés HUVEC au fil du temps. (E) Quantification du taux de monocytes transmigration au fil du temps. N = 3 réplicats biologiques. Données sont présentées sous forme de moyenne ± S.D. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
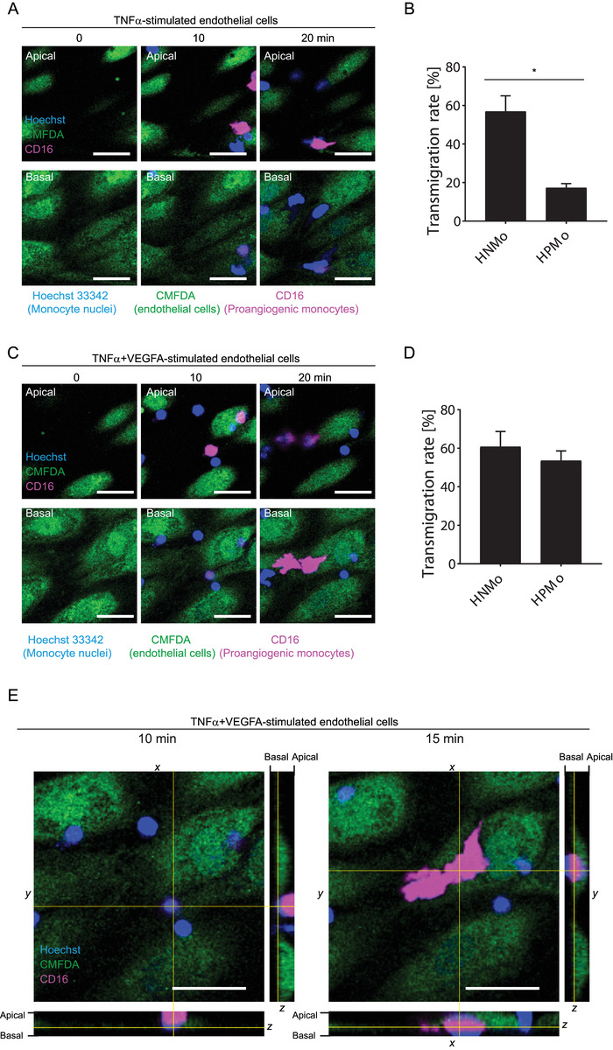
Figure 5 : enquête simultanée de la transmigration des sous-populations de monocyte sous flux. (A) les séquences d’images Time-lapse (de 0 à 20 min) le recrutement des monocytes on (CD16+) et non-angiogénique monocytes au fil du temps par le biais de HUVEC TNFα-activé. Echelle = 40 µm ; les points de vue apicales et basales sont indiqués. Les séquences complètes peuvent être vu dans Supplemental Movie 4 pour apicale et Supplemental Movie 5 vues basale. (B) analyse quantitative de la transmigration des monocytes humains on (HPMo : CD16 +) et les monocytes humains non-angiogénique (HNMo) à travers une monocouche HUVEC TNFα-activé. N = 4 réplicats biologiques, données sont présentées sous forme de moyenne ± S.D. * p < 0,05 ; Test de Mann-Whitney. (C), Time-lapse image séquences (de 0 à 20 min) le recrutement des monocytes on et non-angiogénique heures supplémentaires par le biais de HUVEC activés par le TNFα + VEGFA. Echelle = 40 µm ; les points de vue apicales et basales sont indiqués. Les séquences complètes peuvent être vu dans 6 de film supplémentaire pour apicale et Supplemental film 7 vues basale. (D) quantification de la transmigration des monocytes humains on (HPMo : CD16 +) et les monocytes humains non-angiogénique (HNMo : CD16-) par le biais de monocouche HUVEC activés par le TNFα + VEGFA. N = 4 réplicats biologiques, données sont présentées sous forme de moyenne ± S.D. * p < 0,05 ; Test de Mann-Whitney. (E) monocytes de localisation du CD16+ avant (10 min) et après la transmigration (15 min) par le biais de HUVEC stimulée par le TNFα + VEGFA. Les vues orthogonales sont indiqués. Echelle = 40 µm s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
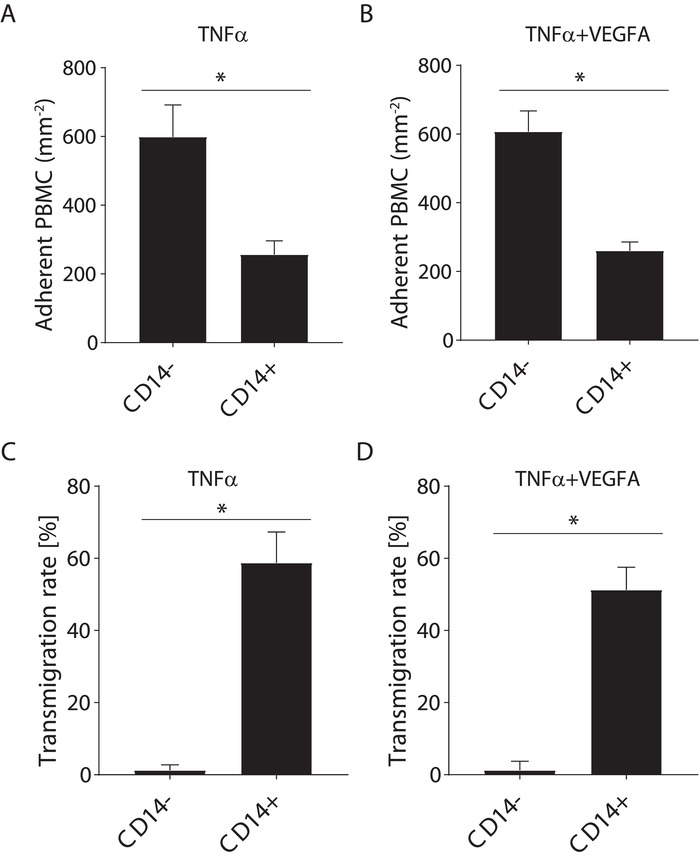
Figure 6 : Enquête simultanée de la transmigration de CD14 + versus CD14 - PBMC sous flux. (A) adhésion de CD14+versus CD14– PBMC à HUVEC TNFα-activé sous flux. (B) adhésion de CD14+versus CD14– PBMC à HUVEC TNFα + VEGFA activé sous flux. Transmigration (C) taux (%) de CD14+versus CD14– PBMC par HUVEC TNFα-activé sous flux. (D) Transmigration taux (%) de CD14+versus CD14– PBMC par HUVEC TNFα + VEGFA activé sous flux. Les données sont moyenne ± S.D. N = 4 réplicats biologiques. * p < 0,05 ; Test de Mann-Whitney. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Supplémentaire film 1 : vue sur le plan d’apical de recrutement pan-monocyte sous flux. Vue développée du recrutement de monocytes pan sous flux au plan apical. HUVEC ont été colorées avec CMFDA et les noyaux des monocytes étaient tachés vivre avec Hoechst 33342. Echelle = 50 µm s’il vous plaît cliquez ici pour télécharger ce fichier.
2 film supplémentaire : vue sur le plan de base de recrutement pan-monocyte sous flux. Vue développée du recrutement de monocytes pan sous flux dans le plan de base. HUVEC ont été colorées avec CMFDA et les noyaux des monocytes étaient tachés vivre avec Hoechst 33342. Echelle = 50 µm s’il vous plaît cliquez ici pour télécharger ce fichier.
Supplémentaire Movie 3 : projection maximale de z-piles de recrutement pan-monocyte sous flux. Vue développée du recrutement de monocytes pan sous flux comme indiqué dans la demande de films 1 et 2. HUVEC ont été colorées avec CMFDA et les noyaux des monocytes étaient tachés vivre avec Hoechst 33342. Echelle = 50 µm s’il vous plaît cliquez ici pour télécharger ce fichier.
Supplémentaire Movie 4 : vue sur le plan d’apical du recrutement des sous-populations de monocytes à TNFα-activé HUVEC. Vue sur le plan d’apical du recrutement simultané des sous-populations de monocyte sous flux étendu HUVEC TNFα-activé sous flux. HUVEC ont été colorées avec CMFDA et les noyaux des monocytes étaient tachés vivre avec Hoechst 33342. Sous-populations de monocyte humain on ont été identifiées par l’expression en surface de CD16. Echelle = 30 µm. s’il vous plaît cliquez ici pour télécharger ce fichier.
Supplémentaire Movie 5 : vue sur le plan de base du recrutement des sous-populations de monocytes à TNFα-activé HUVEC. Agrandie, sur le plan de base, du recrutement simultané des sous-populations de monocyte sous flux d’HUVEC TNFα-activé sous flux. HUVEC ont été colorées avec CMFDA et les noyaux des monocytes étaient tachés vivre avec Hoechst 33342. La sous-population de monocyte (HPMo) on humaine a été identifiée par l’expression en surface de CD16. Echelle = 30 µm. s’il vous plaît cliquez ici pour télécharger ce fichier.
Supplémentaire film 6 : vue sur le plan d’apical du recrutement des sous-populations de monocytes à TNFα+ HUVEC activé VEGFA. Agrandie, sur le plan d’apical, du recrutement simultané des sous-populations de monocyte sous flux d’HUVEC TNFα + VEGFA activé sous flux. HUVEC ont été colorées avec CMFDA et les noyaux des monocytes étaient tachés vivre avec Hoechst 33342. La sous-population des monocytes humains on a été identifiée par l’expression en surface de CD16. Echelle = 30 µm s’il vous plaît cliquez ici pour télécharger ce fichier.
Supplémentaire film 7 : vue sur le plan de base du recrutement des sous-populations de monocytes à TNFα+ HUVEC activé VEGFA. Agrandie, au plan de base, du recrutement simultané des sous-populations de monocyte sous flux d’HUVEC TNFα + VEGFA activé sous flux. HUVEC ont été colorées avec CMFDA et les noyaux des monocytes étaient tachés vivre avec Hoechst 33342. La sous-population de monocyte (HPMo) on humaine a été identifiée par l’expression en surface de CD16. Echelle = 30 µm s’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Nous rapportons ici une méthode décrivant une étude de comment les sous-populations de monocyte transmigrer par le biais de la monocouche endothéliale enflammée. La méthode discutée utilisé la microscopie confocale au lieu de la microscopie à contraste de phase, qui est également utilisée pour étudier le recrutement des monocytes sous flux3,11,19. Un des principaux avantages de l’utilisation de la microscopie confocale pour imagerie Time-lapse est la capacité de distinguer sans ambiguïté la transmigration et forte adhésion des monocytes. Bien que la méthode d’axée sur la microscopie à contraste de phase est également robuste, elle exige expertise afin d’éviter le mélange des cellules réincarnés et fortement adhérentes. Dans ce cas, il faut établir des critères stricts pour analyse afin de faire une nette différence entre ces deux États de la cascade de recrutement de monocytes. En outre, il est également important d’effectuer une analyse de point de terminaison par microscopie confocale afin de confirmer les tendances globales observées par la microscopie en contraste de phase. Ainsi, l’utilisation directe de la microscopie confocale à enquêter sur le recrutement des monocytes sous flux fournit des résultats clairs sur l’état réel de transmigration des monocytes capturés.
Parmi les principaux goulets d’étranglement dans l’exécution de recrutement des leucocytes dosages sous flux et à l’aide d’un microscope à contraste de phase est le temps passé pour effectuer l’analyse et le suivi des cellules individuelles de la capture de transmigration à travers la jonction cellule-cellule. Automatisation d’une telle analyse est possible, mais difficile à réaliser en raison des similitudes de contraste de phase entre les monocytes rampants et réincarnés. Ici, nous montrons à l’aide de la microscopie confocale que transmigration de monocyte était accompagnée d’un abandon des cellules endothéliales de coloration dans le plan de base correspondant à la forme des monocytes réincarnés sous HUVEC. Ce positionnement a été confirmé par la projection orthogonale. La transition de la localisation de monocyte a eu lieu exclusivement entre les jonctions cellule-cellule indicatives d’une transmigration paracellulaire. Cela est compatible avec nos données antérieures, qui ont montré que sous flux in vitro, monocytes transmigrer exclusivement par voie paracellulaire HUVEC3,18. En complément de la méthode proposée ici, il est possible d’utiliser non-blocage des anticorps contre les protéines jonctionnelles comme VE-cadhérine, confitures ou PECAM1 pour la photo les sites potentiels de transmigration de monocyte (paracellulaire vs transcellulaire). Nous avons confirmé que les formes noires qui entourent les noyaux de monocyte sont une caractéristique robuste des cellules réincarnés et un événement simple qui peut être détecté par le logiciel. Même si une cellule manuelle système de comptage est démontrée ici, la formation de la forme noire autour du noyau de leucocytes est un critère qui pourrait servir à définir la transmigration des leucocytes dans l’analyse automatisée, économisant ainsi beaucoup de temps. Nous travaillons actuellement sur le développement d’une application automatisée pour une telle analyse.
La fluorescence et la microscopie confocale ont été précédemment utilisés dans l’étude du recrutement des leucocytes. Toutefois, ils ne servaient pas à enquêter sur le recrutement des différentes sous-populations simultanément. Ici, nous vous proposons une modalité d’utilisation de la microscopie confocale pour étudier le recrutement des sous-types de leucocyte simultanément dans le microenvironnement de la même. Nous montrons que la microscopie confocale permet d’étudier simultanément les comportements migratoires des sous-populations de monocyte différents. À titre d’exemple, nous avons utilisé expression CD16 pour distinguer les monocytes on et non-angiogénique afin d’étudier la capacité de la transmigration des deux sous-populations dans différents contextes inflammatoires. Conforme à notre publication récente, à l’aide de la modalité de la microscopie confocale, nous avons montré que le taux de transmigration de CD16+ monocytes est plus faible lorsque la couche de cellules endothéliales est stimulée que par TNFα3. Toutefois, la combinaison de TNFα et VEGFA conduit à une augmentation de transmigration des monocytes on. Le taux de transmigration était aussi élevé pour les non-angiogénique CD16 monocytes– dans les deux conditions inflammatoires. Nous avons déjà montré que le monocyte coloration avec l’anticorps anti-CD16 ne présentait pas un effet significatif sur la transmigration, ceci confirmant par l’analyse des monocytes sans étiquette après l’essai de la transmigration, à l’aide de la microscopie confocale3. Toutefois, pour nouveaux sous-types de leucocytes ou anticorps utilisés pour les marquer, l’effet d’étiquetage doit être évaluée. En utilisant cette méthode, jusqu'à trois différentes populations de leucocytes peuvent être simultanément étudiées. Cela pourrait être des sous-populations qui sont des types de cellules immunitaires fonctionnellement distinctes ou similaire. Bien que l’accent est mis sur la transmigration de monocyte, autres étapes de leur recrutement peuvent également doser par cette méthode, y compris le comportement de la cellule avant de transmigration, telles que la capture et la migration directionalité. Transmigration des événements tels que rétention d’abluminal et de la transmigration inverse peuvent également être étudiées pour les populations de leucocytes différent, comme une extension de cette méthode. Une des limites est la mauvaise détection de la coloration dans le canal rouge sombre en Time-lapse imagerie, ainsi que quelques débordements des signaux de fluorescence qui réduisent la résolution de z-pile. Cela était principalement lié à l’instrument utilisé pour l’imagerie confocale. L’utilisation de déconvolution d’images pourrait éventuellement aider afin d’améliorer la qualité de l’image et permet une analyse des différentes étapes du recrutement leucocytaire.
Pour étudier le recrutement des leucocytes dans des conditions optimales, il est important de vérifier l’état d’activation de la couche de cellules endothéliales. En effet, une carence activation des cellules endothéliales conduit à une réduction globale dans l’adhérence des monocytes et de la transmigration. Activation des cellules endothéliales peut être vérifiée en analysant le niveau d’expression des molécules d’adhérence sur la surface des cellules endothéliales comme ICAM1 et VCAM1. Le niveau de ces adhérence molécules doivent être augmentées par rapport aux cellules endothéliales non stimulées. Si aucun changement n’est détectable dans ces molécules d’adhérence endothéliale, la HUVEC cultivée peut être considéré comme non activé. Évaluer le niveau d’expression des molécules d’adhésion peut constituer un bon contrôle quantitatif entre différentes expériences à l’aide du même lot de HUVEC. Toutefois, le niveau d’expression de ces molécules d’adhésion peut également varier entre les différentes cultures primaires de cellules endothéliales limitant l’examen d’un seuil global de ICAM1 ou VCAM1. Le changement de forme des cellules endothéliales macrovasculaires comme HUVEC est également un bon indicateur de leur activation. Ce dernier changement de phénotype permet une évaluation rapide et qualitative de l’activation des HUVEC. Cependant, l’analyse de molécules d’adhérence peut être un meilleur choix pour les cellules microvasculaires qui ne se présentent pas forme-changement majeur lors de l’activation avec des cytokines inflammatoires.
Pour des études mécanistes, témoins négatifs pertinents de transmigration de monocyte peuvent être effectuées en utilisant des anticorps contre les molécules d’adhérence endothéliales comme ICAM1, VCAM1 ou leucocytes surface tels que Leukocyte Function-associated Antigen (LFA) -1. L’utilisation d’un contrôle négatif pertinent est essentielle pour cette étude mécanistique des monocytes car ils expriment des récepteurs Fc sur leurs surfaces cellulaires. La pureté des monocytes après l’isolement est aussi importante, pour éviter toute contamination par les autres populations de leucocytes et une sous-estimation du taux de transmigration de monocyte. Un autre paramètre essentiel est la température, qui doit être réglé à 37 ° C pendant tous les essais afin de s’assurer que toutes les observations expérimentales sont pertinentes et traduire par conséquent humain in vivo cellule traite.
Déclarations de divulgation
Les auteurs n’ont aucun intérêt financier concurrentes.
Remerciements
Nous remercions le Dr Paul Bradfield pour lecture de manuscrit et des rétroactions. A. S. a reçu un soutien financier de la Sir Jules Thorn Charitable Overseas Trust Reg.,
matériels
| Name | Company | Catalog Number | Comments |
| Tissue Culture Flasks 75 cm2 | TPP | 90076 | Routine culture of isolated HUVEC |
| µ-Slide VI 0.4 | IBIDI | 80606 | |
| Centrifuge Tubes 15 mL | TPP | 191015 | |
| Centrifuge Tubes 50 mL | TPP | 191050 | |
| Collagen G | Biochrom | L 7213 | For coating of cell culture flasks |
| Gelatin | Sigma-Aldrich | 1393 | For coating of cell culture flasks |
| Dulbecco’s Phosphate Buffered Saline (without MgCl2 and CaCl2) | Sigma-Aldrich | D8537 | |
| Dulbecco’s Phosphate Buffered Saline (with MgCl2 and CaCl2) | Sigma-Aldrich | D8662 | |
| RPMI-1640 Medium | Sigma-Aldrich | R8758 | |
| 3-Way Stopcocks | BIO-RAD | 7328103 | |
| penicillin 10,000 μ/mL streptomycine 10,000 μg/mL fungizone 25 μ/mL | AMIMED | 4-02F00-H | |
| Collagenase type 1 | Worthington | LS004216 | |
| Medium 199 1x avec Earle's salts, L-Glutamine, 25 mM Hepes | GIBCO | 22340020 | |
| Bovine Albumin Fraction V | ThermoFisher | 15260037 | |
| Endothelial Cell Growth Supplement, 150 mg | Millipore | 02-102 | |
| Heparin Sodium | Sigma-Aldrich | H3149RT | |
| Hydrocortisone | Sigma-Aldrich | H6909 | |
| L-Ascorbic acid | Sigma-Aldrich | A 4544 | |
| EDTA disodium salt dihydrate C10H14N2Na2O8 · 2H2O | APPLICHEM | A2937.0500 | |
| CD144 (VE-Cadherin), human recombinant clone: REA199, FITC | Miltenyi Biotech | 130-100-713 | AB_2655150 |
| CD31-PE antibody, human recombinant clone: REA730, PE | Miltenyi Biotech | 130-110-807 | AB_2657280 |
| Anti-Podoplanin-APC, human recombinantclone: REA446, APC | Miltenyi Biotech | 130-107-016 | AB_2653263 |
| BD Accuri C6 Plus | BD Bioscience | ||
| µ-Slide I Luer | IBIDI | 80176 | |
| CMFDA (5-chloromethylfluorescein diacetate) | ThermoFisher | C2925 | |
| Recombinant human TNFα | Peprotech | 300-01A | |
| Recombinant human VEGFA | Peprotech | 100-20 | |
| NE-1000 Programmable Syringe Pump | KF Technology | NE-1000 | |
| Ficoll Paque Plus | GE Healthcare | 17-1440-02 | |
| Anti-human CD14-PE, human recombinant clone: REA599, PE | Miltenyi Biotech | 130-110-519 | AB_2655051 |
| Pan Monocyte Isolation Kit, human | Miltenyi Biotech | 130-096-537 | |
| Anti-human CD16-PE, human recombinant clone: REA423, PE | Miltenyi Biotech | 130-106-762 | AB_2655403 |
| LS columns | Miltenyi Biotech | 130-042-401 | |
| QuadroMACS Separator | Miltenyi Biotech | 130-090-976 | |
| Hoechst 33342, Trihydrochloride, Trihydrate | ThermoFisher | H1399 | |
| Silicone tubing | IBIDI | 10841 | |
| Elbow Luer Connector | IBIDI | 10802 | |
| Female Luer Lock Coupler | IBIDI | 10823 | |
| Luer Lock Connector Female | IBIDI | 10825 | |
| In-line Luer Injection Port | IBIDI | 10820 | |
| Ar1 confocal microscope | Nikon | ||
| 40x objective | Nikon | 40x 0.6 CFI ELWD S Plane Fluor WD:3.6-2.8mm correction 0-2mm | |
| ImageJ Software | NIH |
Références
- Auffray, C., Sieweke, M. H., Geissmann, F. Blood Monocytes: Development, Heterogeneity, and Relationship with Dendritic Cells. Annual Review of Immunology. 27 (1), 669-692 (2009).
- De Palma, M., Venneri, M. A., Roca, C., Naldini, L. Targeting exogenous genes to tumor angiogenesis by transplantation of genetically modified hematopoietic stem cells. Nature Medicine. 9 (6), 789-795 (2003).
- Sidibe, A., et al. Angiogenic factor-driven inflammation promotes extravasation of human proangiogenic monocytes to tumours. Nature Communications. 9 (1), 355(2018).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Review Immunology. 7 (9), 678-689 (2007).
- Nourshargh, S., Alon, R. Leukocyte Migration into Inflamed Tissues. Immunity. 41 (5), 694-707 (2014).
- Cros, J., et al. Human CD14dim monocytes patrol and sense nucleic acids and viruses via TLR7 and TLR8 receptors. Immunity. 33 (3), 375-386 (2010).
- Geissmann, F., Jung, S., Littman, D. R. Blood monocytes consist of two principal subsets with distinct migratory properties. Immunity. 19 (1), 71-82 (2003).
- Chamorro, S., et al. In vitro differentiation of porcine blood CD163− and CD163+ monocytes into functional dendritic cells. Immunobiology. 209 (1-2), 57-65 (2004).
- Passlick, B., Flieger, D., Ziegler-Heitbrock, H. Identification and characterization of a novel monocyte subpopulation in human peripheral blood. Blood. 74 (7), (1989).
- Venneri, M. A., et al. Identification of proangiogenic TIE2-expressing monocytes (TEMs) in human peripheral blood and cancer. Blood. 109 (12), 5276-5285 (2007).
- Bradfield, P. F., et al. JAM-C regulates unidirectional monocyte transendothelial migration in inflammation. Blood. 110 (7), 2545-2555 (2007).
- Schenkel, A. R., Mamdouh, Z., Muller, W. A. Locomotion of monocytes on endothelium is a critical step during extravasation. Nature Immunology. 5 (4), 393-400 (2004).
- Luu, N. T., Rainger, G. E., Nash, G. B. Kinetics of the different steps during neutrophil migration through cultured endothelial monolayers treated with tumour necrosis factor-alpha. Journal Vascular Research. 36 (6), 477-485 (1999).
- ibidi GmbH. Shear Stress and Shear Rates for ibidi µ-Slides - Based on Numerical Calculations. , (2014).
- Yang, L., Froio, R. M., Sciuto, T. E., Dvorak, A. M., Alon, R., Luscinskas, F. W. ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-alpha-activated vascular endothelium under flow. Blood. 106 (2), 584-592 (2005).
- Yang, C. -R., Hsieh, S. -L., Ho, F. -M., Lin, W. -W. Decoy receptor 3 increases monocyte adhesion to endothelial cells via NF-kappa B-dependent up-regulation of intercellular adhesion molecule-1, VCAM-1, and IL-8 expression. Journal of Immunology. 174 (3), Baltimore, Md. 1647-1656 (2005).
- Wong, D., Dorovini-Zis, K. Expression of vascular cell adhesion molecule-1 (VCAM-1) by human brain microvessel endothelial cells in primary culture. Microvascular Research. 49 (3), 325-339 (1995).
- Bradfield, P. F., Nourshargh, S., Aurrand-Lions, M., Imhof, B. A. JAM family and related proteins in leukocyte migration (Vestweber series). Arteriosclerosis Thrombosis and Vascular Biology. 27 (10), 2104-2112 (2007).
- Bradfield, P. F., et al. Divergent JAM-C Expression Accelerates Monocyte-Derived Cell Exit from Atherosclerotic Plaques. PLoS One. 11 (7), e0159679(2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon