Method Article
体外流动下单核细胞亚群的同时研究
摘要
在这里, 我们提出了一个综合协议, 测量单核细胞亚群贩运在流在体外使用特定的表面标记和共聚焦荧光显微镜。该协议可用于探索顺序招募步骤, 以及使用其他特定的表面标记来描述其他白细胞亚型。
摘要
在组织损伤、肿瘤发育和自身免疫性疾病的过程中, 从血液中招募单核细胞到靶向外周组织对炎症过程至关重要。这是通过捕获过程从自由流动到腔表面的激活内皮细胞, 其次是他们的粘附和内皮迁移 (转移) 到底层受影响的组织。然而, 支持优先和与上下文相关的单核细胞亚群招募的机制仍未得到充分理解。因此, 我们开发了一种方法, 允许在流量下同时对不同单核细胞亚群的招募进行可视化和测量。这种基于延时共聚焦成像的方法允许在粘附体和迁移单核细胞之间进行明确的区分。在这里, 我们描述了如何使用这种方法可以同时研究招募的亲血管生成和非血管生成单核细胞在体外。此外, 这种方法还可以推广到研究最多三个单核细胞种群的不同招募步骤。
引言
单核细胞是先天免疫的吞噬成分, 对于对抗病原体、清理受损组织、血管生成以及包括癌症在内的许多疾病的病理生理学至关重要..单核细胞是由异质亚群组成的骨髓细胞, 在血液中循环, 但可以通过特定的分子机制被招募到外周组织的炎症部位。与一般白细胞一样, 单核细胞的招募级联涉及不同的步骤, 包括捕获、滚动、爬行、逮捕、内皮迁移 (转移) 和通过血管壁 (基底膜和壁画) 的迁移单元格)4。这些步骤主要涉及炎症引起的内皮腔表面的分子, 如选择、糖蛋白配体、趋化因子、细胞间和结合粘附分子, 以及它们对白细胞的受体, 如选择性配体和整合。通过内皮细胞连接 (脱细胞后) 或通过内皮细胞体 (跨细胞) 的贩运途径可被白细胞用于跨越内皮屏障5。虽然历史上有记录表明单核细胞通过跨细胞途径迁移, 但由于单核细胞不再被视为同质细胞群, 它们迁移途径中的潜在差异已被提出。现在越来越清楚的是, 单核细胞多样性可以通过它们的每一个差异和共性来定义, 就它们独特的外渗级联 3,6。因此, 为了明确区分单核细胞亚群, 在招募过程中, 将这些不同亚群的行为形象化和表型是至关重要的。
将人、猪、大鼠和小鼠的单核细胞细分为表型亚群, 具有一定的归因功能和特定的迁移行为7,8,9。例如, 在人类中, 单核细胞可以根据其表面表达的 cd14 (细菌脂多糖的核心受体) 和 cd16 (fc-γ受体 iii) 分为三个子集。人类单核细胞亚群包括经典 cd14+cd16-、中间 cd14+cd16+和非经典 cd14 暗淡 cd16+细胞6,9。经典 cd14+cd16-单核细胞主要具有炎症性, 而 cd16 + 单核细胞池被共同发现为 tie2表达和血管生成功能10。持续, 内皮细胞刺激与炎症细胞因子, 如人类肿瘤坏死因子 (tnf) α或白细胞介素 (il-1)beta (常规炎症) 足以引发经典 cd14+cd16 的完全招募-单核细胞然而, 血管内皮生长因子 (vegf) a 和 tnfα (血管生成因子引起的炎症) 同时作用, 是引发 cd16 + 单核细胞血管生成池 3的迁移.从历史上看, 传统的跨井系统在静态条件下, 平行板流动室和μ-滑动流室已被用来定量分析在体外一次招募一个白细胞群 11 ,12,13。虽然这些方案已经得到验证, 一个更强大的方法, 允许同时分析多个单核细胞亚群将被认为更有见地。这种方法必须考虑到多个相互作用和每个群体的不同频率, 并提供机械地理解定义每个单核细胞的招募级联的相似性和特殊性子集。
本文提出了一种基于流动过程中单核细胞招募延时成像的方法, 该方法可以利用共聚焦显微镜同时研究不同单核细胞亚群的迁移级联。该方法结合了某些关键特征, 模仿内皮细胞炎症, 以及在毛细血管后静脉循环单核细胞的血流动力学, 白细胞在体内招募的主要位置。该方法使用人脐静脉内皮细胞 (huvec), 这是通过与人脐带分离的既定协议产生的。这种临床资源的优点是很容易作为生物副产品获得, 同时也提供了一个合理的内皮细胞产量, 可以从脐静脉分离。我们还使用荧光染料和免疫荧光来区分不同的细胞成分, 并使用共聚焦显微镜明确定义单核细胞定位 (腔内与烧黑细胞) 随着时间的推移。本文所介绍的协议是为了同时测量单核细胞亚群的迁移水平而制定的。此外, 应当指出, 这种方法可以通过使用不同的生物标志物和标签, 扩大到研究其他白细胞亚群和招募过程。
研究方案
人类材料是在自愿捐助者知情同意的情况下, 根据瑞士临床研究道德委员会使用的。
1. 人脐静脉内皮细胞的分离和冷冻 (huvec)
- 在 ph 为7.4 的情况下, 在 ph 为7.4 的情况下, 在 ph 值7.4 下, 在 t75 瓶中加入5毫升的涂层溶液, 在37°c 下进行30分钟的涂装液。
- 用 pbs 清洁绳子, 用无菌压缩器擦拭, 并将其放入20厘米的无菌培养皿中。用无菌剪刀剪断绳子的两端。
- 识别单个大静脉和两条小动脉。轻轻地将带有三通的插管插入脐带末端的静脉四肢。
- 用一定的电线将电源线和插管连接牢固地拧紧。
- 用含有 100 u\ ml 青霉素、100 umml 链霉素和 250 ng/mL 两性霉素 b 的 rpmi 介质的 20 ml 完美地使用两种电源线来清洗脐带的静脉。这个过程使绳子的外观更白, 更清晰。在胶原酶添加之前, 用注射器在一端收集 rpmi, 将静脉清空。
- 用 i 型 1 mgml 胶原酶 (0.22μm 过滤) 的 12 ml 完美利用静脉。
- 关闭电源线末端的塞子, 在37°c 下孵育电源线12分钟。
- 轻轻按摩脐带, 将内皮细胞从静脉腔中分离。
- 取30毫升的 rpmi 含有10% 的胎儿小牛血清与50毫升注射器, 并将其连接到脐带的一端。
- 将一个空的50毫升注射器连接到脐带的另一端
- 打开塞子, 从一端灌注静脉, 同时从另一端相互收集。
请注意:收集到的悬浮液中含有内皮细胞。 - 将此细胞悬浮液以 200 x g离心5分钟。
- 丢弃上清液, 用10毫升的完整 mL 培养基重新悬浮细胞颗粒 (mL 含有 20% fcs, 15μgml 内皮细胞生长补充剂, 100μgml 肝素钠, 0.5μm 氢化可的松, 10μgml l-抗坏血酸, 100 u/ml 青霉素, 100 u/ml链霉素和 250 ngml 两性霉素 b)。
- 从 t75 烧瓶中取出涂层溶液, 并用 pbs 冲洗一次。
- 将从步骤1.13 中收集的细胞放入 t75 烧瓶中, 并将其放入37°c 的孵化器中, 其中5% 的co 2。
- 第二天, 用完整的 m199 培养基冲洗烧瓶 3次, 去除残留的红血球, 然后每2天更换一次, 直到融合。
- 在80–90% 的融合时, 用5毫升的 pbs 冲洗 huvec 单层一次, 并在13°c 的 1 mm edta 中用5毫升的500% 胰蛋白酶分离细胞 5分钟, 加入4毫升的 mL 和1毫升的 fcs, 以阻止胰蛋白酶的作用。冲洗烧瓶, 将所有 huvec 分离。
- 收集50μl 的脂肪, 用于 ve-cadherin、pecam-1 和 gp38 的染色, 并通过流式细胞仪分析, 以检查 huvec 的纯度。
- 在 200 x g 的15毫升管和离心机中收集1.18 步中的 huvec 剩余部分, 在室温下5分钟。
- 从步骤1.19 中丢弃上清液, 以 5 x 10 5 细胞/冷冻槽中的密度重新悬浮冷冻溶液中的细胞颗粒 (fcs 中含有 10% dmso), 并在-80°c 或液氮中冷冻, 直至使用.
-
要检查 huvec 的纯度:
- 在步骤1.18 中采集的 50μl huvec 抗体中加入1μl 的抗人 ve-cadherin-fitc 抗体, 将1μl 的抗人 pecam1-pe 抗体和1μl 的抗人类 Podoplanin-APC 抗体添加到该抗体中。
- 在室温下孵化10分钟。
- 在 400 x g 的情况下添加100μl 的 pbs 和离心机, 为 30秒.
- 丢弃上清液, 在100μl 的 pbs 中重新悬浮。现在可以通过流式细胞仪技术获取数据。
请注意:huvec 对 ve-cadherin 和 pecam-1 呈阳性, 对 podoplanin 呈阴性。
2. huvec 除霜
请注意:在低通道下使用 huvec 进行实验 (最多5个通道)。
- 在37°c 下, 用1毫升的涂层溶液涂上 t75 烧瓶30分钟。
- 在37°c 下快速解冻 huvec 2分钟, 并在完整 mL 的10毫升中重新悬浮细胞。
- 在室温下以 200 x克离心细胞 5分钟, 并丢弃上清液。
- 在完整的 mL 的10毫升中重新使用细胞颗粒。
- 将电池悬浮液转移到预涂布瓶中。将烧瓶放入37°c 的孵化器中, 采用5% 的 co2.每2天改变一次细胞培养培养基。
3. 0.4 μ-sut 室中的 huvec 培养
- 在开始流动实验前 5天, 在37°c 下, 用30μl 的 pbs 预涂上0.4μl 的室, 其中含有 0.1 mg/ml 胶原蛋白 g, 0.2% 明胶在37°c 下, 时间为30分钟。
- 用100μl 的 pbs 清洗腔。
- 从 t75 烧瓶的80–90% 的融合 huvec 中分离细胞。
- 用5毫升的 pbs 冲洗 huvec, 用5毫升的0.05% 胰蛋白酶在37°c 下分离5分钟。
- 在完整的 m199 中冲洗和收集细胞悬浮液, 并用最方便的方法计数细胞。在室温下以 200 x g 离心5分钟。
- 将细胞颗粒在 106 细胞中重新移植, 每个腔内分配 30μl (30, 000 细胞)。
- 在37°c 的孵化器中孵育细胞, 用5% 的 co2 孵育 1小时。
- 在每个腔中加入150μl 的完整 m199, 并在37°c 和 5% co 2 的孵化器中培养细胞 5天.每2天更换一次介质。
4. huvec 染色用于流动下单核细胞的招募检测
- 准备由 m199 和1μm 的 cmfda (5-氯甲基荧光素二乙酸酯) 制成的标记介质, 并在37°c 加热5分钟后再贴上标签。
- 用在37°c 加热的 m199 介质清洗 huvec 两次。
- 将该培养基更换为含有 1μm cmfda 的30μl 的加热标记介质, 并在37°c 和 5% co 2 处放入孵化器中10分钟。
- 用完整的 m199 清洗一次, 并在37°c 和 5% co 2 的孵化器中用完整的 m199 孵育细胞 30分钟。
请注意:重要的是要在添加标签溶液之前去除血清的所有痕迹, 否则可能会改变 huvec 染色。 - 将介质替换为含有人类 tnfα (500 uml) 或人 tnfα (500 u/ml) 与人 vegfa (1μgml) 混合在37°c 和 5% co2 的孵化器中6小时的完整 m199.
5. 人的泛单核细胞的分离和亚群的染色
- 使用在 edta 真空管中收集的浓缩人体血液的蓬松涂层, 或20毫升新分离的人体血液。
- 稀释 pbs-1 mm edta (1:1) 中的血液, 并在密度梯度介质的20毫升顶部轻轻输送20毫升稀释的血液。在室温下, 以 400 x g离心 30分钟, 加速缓慢, 无需刹车。
- 将外周血单个核细胞 (pbmc)-血小板层 (密度梯度介质与等离子体层之间) 收集到含有 40ml pbs-1 mm edta 的 50 ml 管中。使用 pbs-1 mL edta 顶部高达50毫升。
- 在室温下离心 5分钟, 丢弃上清液。
- 用10毫升染色缓冲液 (pbs-1 mm edta 含有0.5% 的牛血清白蛋白 bsa) 对细胞颗粒进行再利用。
- 在室温下离心 5分钟, 丢弃上清液。
- 重复步骤5.5 和5.6。
- 用10毫升染色缓冲液重新弹性细胞颗粒。取10μl 的 aliquot 进行细胞计数。
- 用流式细胞仪快速检查 pbmc 的数量和细胞计数。
请注意:可以观察到典型的淋巴细胞和单核细胞群 (图 1 a)。从50毫升的新鲜人类血液预计约 50-100 x10 6 pbmc。 -
对于招聘 cd14+ 与 cd14-pbmcmc 的招聘, 流量如下:
- 用流动缓冲液 (mL 含有 0.5% bsa) 清洗三次颗粒, 并在流动缓冲液中重新悬浮单个核细胞, 每毫升 6 x10 6细胞。
- 为每种检测制作200μl 的等价物。在37°c 下进行培养, 直到检测前20分钟。
- 在每个浓度为2微米的最终浓度为2μm 的情况下, 加入5μl 的抗 cd14-pe 和 hoechst 33342。在37°c 下混合孵育10分钟。
- 以 400 x g 离心 30分钟.
- 丢弃上清液, 用200μl 的流动缓冲液重新悬浮颗粒。
-
对于在流动的单核细胞亚群的招募:
- 根据制造商的指示, 用平底锅单核细胞隔离试剂盒隔离单核细胞。
请注意:下面的隔离协议适用于 50 x 106个单元。只要是在制造商的建议范围内, 就可以放大或缩小它。 - 在室温下以 200 x克离心 pbmc 悬浮液5分钟。
- 丢弃上清液, 用400μl 染色缓冲液重新悬浮颗粒。
- 加入50μl 的 fc 受体阻滞剂和50μl 的潘单核细胞抗体鸡尾酒。
- 在室温下孵化10分钟。
- 加入400μl 染色缓冲液和100μl 磁珠共轭抗生物素抗体。在室温下孵化15分钟。
- 添加2毫升染色缓冲液, 并使用与磁铁耦合的 mL ls 柱。
- 将 ls 列放在磁铁上, 加入1毫升的染色缓冲液。放弃流通。
- 通过柱内 pbmc 悬浮液, 通过在一个新的 15 ml 管中含有盘单核细胞, 收集清晰的流量。
- 添加染色缓冲液, 最多可达5毫升。
- 取一个脂肪, 并检查单核细胞分离的质量与流式细胞仪。
- 确定平底锅单核细胞计数。
请注意:只能观察到单核细胞群(图 1b)。 - 将步骤5.11.11 的其余单核细胞以 200 x g离心5分钟。
- 放弃上清液。
- 在5毫升的流动缓冲液 (mL 含有 0.5% bsa) 中重新选择细胞颗粒。
- 重复 5.11.13 5.11.14 两次, 以消除 edta 的任何痕迹。
- 根据制造商的指示, 用平底锅单核细胞隔离试剂盒隔离单核细胞。
- 在流动缓冲液 (m199 与 0.5% bsa) 中, 在 6 x10 6 细胞/ml 中进行单核细胞悬浮液。
- 每次招募时, 可制作200μl 单核细胞。
- 将脂肪保持在37°c 的孵化器中, 直到注射前20分钟。
- 在每个算法上加入5μl 的抗 cd16-pe 抗体和 hoechst 33342 (2μm 最终抗体)。
- 在37°c 下混合孵育10分钟。
- 以 400 x g 离心 30分钟.
- 丢弃上清液, 用250μl 的流动缓冲液重新悬浮颗粒。
- 在滑块的一个腔中加入30μl 的单核细胞悬浮液, 用于在共聚焦显微镜上设置采集参数。
- 在37°c 下保持步骤5.18 中的单核细胞悬浮液等价物。
请注意:此悬架已准备好在流系统中注入。
6. 流体系统的制备
- 确保用于成像的细胞孵化器设置为37°c。
请注意:流系统的示意图如图 2所示。 - 组装管材部分 i: 将 luer 连接器男插入一块硅胶管的一端 (8 厘米长, 3 毫米厚), 并将另一端连接到在线 luer 注塑装置。将后一个 luer 连接器连接到一端的硅胶管 (40 厘米和3毫米厚)。
请注意:(可选) 可在在线 luer 注塑装置和硅胶管之间插入连接到5毫升注射器的三通水龙头, 以便最终去除气泡。 - 组装管材第二部分: 将20毫升注射器连接到硅胶管长度 (1 米长和3毫米厚) 的一端。将 luer 连接器与管材的另一端插入。
- 通过将 luer 连接器男性插入女性 luer 锁耦合器连接第一部分和第二部分管 (图 2a)。
- 将硅胶管的自由端放入含有流动缓冲液 (m199 + 0.5% bsa) 的储罐中, 在37°c 加热。
- 拉上20毫升注射器的柱塞, 将油管填充流动缓冲器。
- 将注射器放在泵上并固定。
- 将泵设置为抽取模式 (而不是注入), 并指定流速。
- 使用以下公式, 根据使用的 bidi 幻灯片确定流量:

注意: 幻灯片因子取决于用于实验的 bidi 幻灯片。对于本例中使用的μ-幻灯片 i 0.4 luer锁, 幻灯片因子为131.6。有关特定幻灯片因素, 请参阅公司网站14。流动缓冲粘度为 0.0072 dyn.n. s/cm2。后毛细血管静脉的剪切应力约为 0.5 dyncm2. -
连接幻灯片 (图 2b):
- 夹紧硅胶管周围的女性卢尔锁耦合器, 并断开两个卢尔连接器男性从耦合器。
- 将它们连接到含有受激 huvec 的滑块的储层, 并用培养基填充。在此步骤中避免气泡。
- 取下夹子, 确保连接没有泄漏。
- 将幻灯片置于显微镜下, 进行延时成像, 然后启动泵。
7. 共聚焦显微镜下单核细胞在流动中的延时成像
- 使用40x 的目标 (参见材料表) 进行成像。
- 激活 405 nm (蓝色单核核)、405 nm (绿色内皮细胞) 和 561 nm (红色 cd16 + 子集) 激光。
- 使用包含单核细胞的腔来设置采集参数。
请注意:为了检测非迁移和迁移的单核细胞, 激光 405 nm 的针孔和强度都被设置得很高。因此, 非迁移单核细胞在基础计划中略显可见。然而, 只有迁移的单核细胞呈现一个未染色的区域周围的细胞核对应的新的空间占去的内皮细胞之下。 - 将要获得的腔置于显微镜下。
- 选择1厘米半径范围内的3个视场, 进行多位置共聚焦成像。
- 定义内皮细胞的基部和顶端侧
- 将 z 堆栈设置为10–12微米范围 (0.5μm 步骤)。每1分钟运行一次延时采集。
- 成像3分钟后, 通过在线卢尔注射液口注入200μl 单核细胞悬浮液 (6x106 细胞/毫升)。
请注意:快速单核细胞出现在顶端的焦点平面上, 粘附并开始迁移 (从顶端过渡到基底计划)。 - 图像至少30分钟。完成后, 停止成像并停止流动。夹紧管道, 使其与滑梯断开。
- 在4°c 下, 用4% 的甲醛固定幻灯片10分钟。
- 使用 pbs 清洗幻灯片, 并将幻灯片存放在 4°c, 以便在需要时进行进一步分析。
8. 使用映像分析数据 j
- 数一数每个领域的总粘附单核细胞的数量。确定每毫米2的细胞计数。
- 计数迁移的单核细胞存在于内皮细胞下面的基础计划中, 并通过细胞核周围存在一个黑洞 (在绿色通道中) 来识别。
- 将迁移的白细胞计数除以粘附白细胞的总数。迁移率表现为粘附单核细胞的百分比。
- 为了说明, 顶端和基部的两侧可以同时显示, 以说明发生在每个内皮隔间的事件。
结果
tnfα诱导 huvec 活化状态的测定
炎症细胞因子 tnfα的生物活性可根据冻融循环的批次和重复而变化。tnfα治疗对 huvec 的活化状态进行检查是非常重要的。这可以通过平行染色的一些融合 huvec 样品进行炎症诱导选择, icam-1 和 vcam-115,16,17。一种更简便的方法来检查 tnfα治疗后 huvec 的激活状态是内皮细胞在炎症应激下表现出的形态变化。如图 3所示, 与未受刺激的细胞相比, 在 tnfα存在的情况下, huvec 在6小时后伸长。当 huvec 受到 tnfα和 vegfa 的混合刺激时, 也会观察到类似的伸长率。记录 huvec 的活化状态是很重要的, 因为单核细胞的迁移的最终结果将取决于内皮细胞活化的质量。
单核细胞转染使内皮细胞有特征性停运
为了研究单核细胞在流动下的迁移, 我们使用了用 cmfda 染色的内皮细胞和用细胞渗透道33342染料染色的孤立单核细胞的细胞核 (图 4)。延时共聚焦成像允许在顶端平面上的单核细胞的可视化, 在那里可以评估它们的表型 (图 4a-c, 补充电影 1)。正在进行迁移的迁移细胞在从顶端平面消失并出现在基部平面之前, 移动到与细胞连接相对应的细胞间空间。被迁移的细胞在细胞核周围呈现一个与单核细胞形状相对应的黑洞。这种形状在内皮细胞下的单核细胞迁移过程中不断改变 (图 4a-c, 补充电影 2-3)。这种由内皮细胞下的单核细胞体形成的动态黑洞, 以及单核细胞的定位, 使得迁移细胞的明确识别成为可能。随着时间的推移, 单核细胞招募量显示单核细胞粘附, 然后是迁移 (图 4d-e)。虽然白细胞可以通过细胞外和细胞外的途径外渗, 我们只能观察到在流动下的细胞外迁移与这种方法。这与我们先前的意见3、11、18、19是一致的。
血管生成因子引起的炎症促进 cd16 + 单核细胞的迁移
利用该方法, 我们分析了人类血管生成与非血管生成单核细胞的迁移通过内皮单层刺激的炎症细胞因子 tnfα单独或结合血管生成因子 vegfa。人类血管生成单核细胞可以通过其表面 cd16 或 tie2 的表达来识别。在这里, 抗 cd16-pe 抗体被用来区分原生和非血管生成单核细胞。如图 5a-b(补充电影 4-5)所示, 仅用 tnfα刺激内皮细胞时, cd16+单核细胞的迁移率较低。然而, 当内皮细胞与 tnfα和 vegfa 同时刺激时, 这一比率增加 (图 5c-e, 补充电影 6-7)。在这两种炎症条件下, 非血管生成单核细胞的迁移率同样很高。对于这两个细胞亚群, 输血完全是通过细胞后的途径进行的。因此, 这种方法可以同时研究不同单核细胞种群的迁移能力。
单核细胞的纯度对转染效率的影响
外周血单个核细胞由 t 细胞、b 细胞、nk 细胞和单核细胞组成。这里使用的单核细胞分离方法要求 pbmc 耗尽其他白细胞群。为了了解单核细胞纯度的缺乏对结果的影响, 我们在进行流动下的招募试验之前, 使用了 pbmc 和具有抗 cd14-pe 抗体的泛单核细胞染色。如图 6所示, tnfα或 tnfα+ vegfa 刺激导致仅单核细胞种群的迁移。由 t 细胞、b 细胞和 nk 细胞组成的其他白细胞在 tnfα或 tnfα+ vegfa 下没有迁移。事实上, 有文献记载, 这些白细胞需要其他信号来进行输血。因此, 对单核细胞的低效分离将导致对单核细胞迁移的低估, 因为其他白细胞将被视为单核细胞。这将导致单核细胞迁移的错误结果, 由于单核细胞群与其他白细胞的污染。

图 1: 流式细胞仪分析分离单核细胞。(a) 淋巴细胞耗尽前 pbmc 的形态分析。采用流式细胞仪测定外周血单个核细胞的大小 (正向散射: fsc) 和粒度 (侧向散射: ssc)。(b) 淋巴细胞耗尽后, 流式细胞仪测定分离单核细胞的大小和粒度。单核细胞的有效分离显示淋巴细胞群的完全枯竭。请点击这里查看此图的较大版本.

图 2: 流体系统示意图.(a) 在连接滑块和安装在注射器泵上之前和之后的灌注系统示意图。(b) 使用夹具将滑块与油管连接的过程示意图。请点击这里查看此图的较大版本.
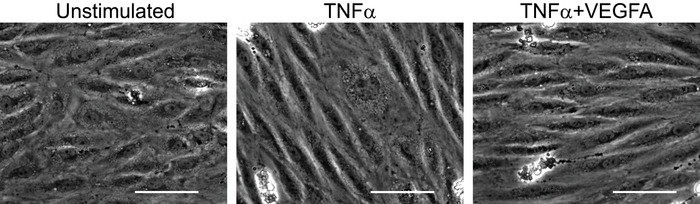
图 3: 检查内皮细胞的有效激活.采用相对比显微镜分析细胞形态, 检查炎症刺激对 huvec 的活化作用。经过6小时的处理, 与未受刺激的细胞相比, 在 tnfα (500 uml) 或 tnfα (500 uml) + vegfa (1μgl) 的混合刺激下, huvec 呈现拉长的形态。炎症刺激后 huvec 的这一形态变化是细胞活化的一个易于检测的指标, 应确保流动检测。刻度栏 = 120μm 请点击此处查看此图的较大版本.

图 4: 用共聚焦显微镜鉴定迁移的单核细胞.(a) 单核细胞迁移图, 其预期视图在顶端和基面上。用 hoechst 33342 染色的单核细胞的细胞核被描绘为蓝色, 单核细胞的理论形状被描绘为在细胞核周围的虚线。在基底视图中, 被迁移的扁平单核细胞被显示为在内皮细胞下占据一个空间。这个空间在共聚焦图像上表现为一个黑洞, 围绕着单核核。(b) 单核细胞在迁移前后的定位。显示了正交视图, 并观察到一个黑洞的外观 (用白色虚线划定) 后, 单核细胞迁移到内皮性室。红色箭头表示单核细胞在移植前的位置, 白色箭头表示移植后相同的细胞。正交试验结果表明, 迁移的单核细胞位于内皮细胞下方。刻度杆 = 40μm (c) 单核细胞招募加班延时延时延时延时图像序列 (从0分钟到 20分钟)。显示了顶端和基本视图。完整的序列可以在补充电影 1, 2 和 3中看到。红色方块突出了一个带蓝色细胞核的迁移单核细胞。与内皮细胞下单核细胞扁平体相对应的黑洞是用一条黄线划定的。结垢杆 = 40μm. (d) 随着时间的推移, 单核细胞对 tnfα受激的粘附与未受刺激的 huvec 的数量. (e) 单核细胞随次迁移率的定量。n = 3个生物复制。数据显示为平均值± s. d. 请点击此处查看此图的较大版本.
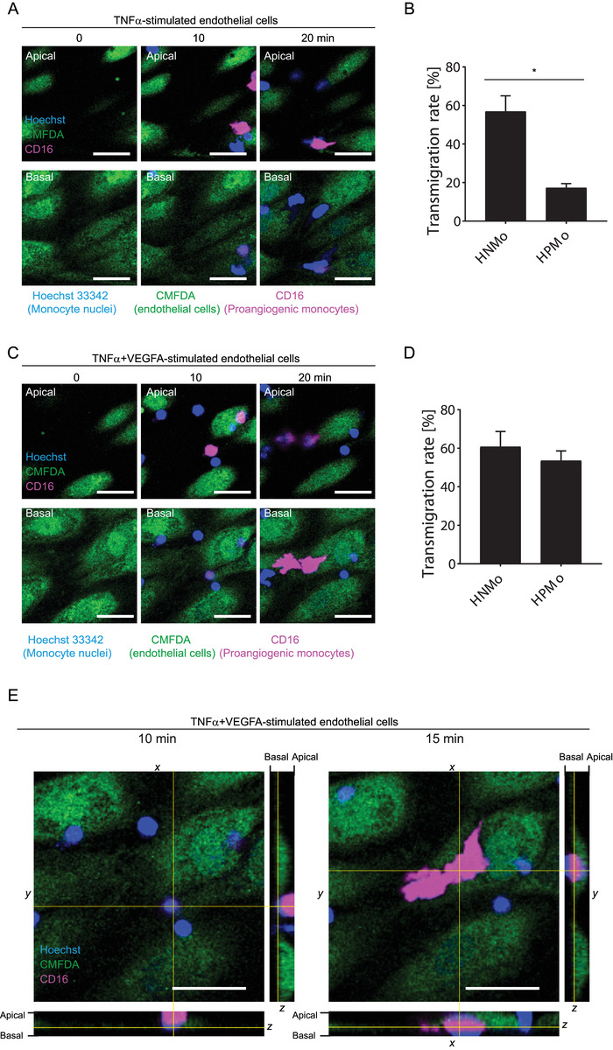
图 5: 同时研究流动下单核细胞亚群的迁移.(a) 随着时间的推移, 通过 tnfα激活的 huvec 招募血管生成单核细胞 (cd16+) 和非血管生成单核细胞的延时图像序列 (从0分钟到 20分钟)。刻度杆 = 40μm;显示了顶端和基本的视图。完整的序列可以看到在补充电影4的顶端和补充电影 5的基础视图。(b) 通过 tnfα激活的 huvec 单层对人类血管生成单核细胞 (hpmco:cd16+) 和人类非血管生成单核细胞 (hnmo) 的迁移进行定量。n = 4个生物复制, 数据显示为平均值±s. d. * p & lt; 0.05;曼恩-惠特尼测试。(c) 通过 tnfα + vegfa 激活的 huvec 加班的血管生成和非血管生成单核细胞的招募时滞图像序列 (从0分钟到 20分钟)。刻度杆 = 40μm;显示了顶端和基本的视图。完整的序列可以看到在补充电影6的顶端和补充电影 7的基础视图。(d) 通过 tnfα + vegfa 激活的 huvec 单层对人类血管生成单核细胞 (hpmo:cd16 +) 和人类非血管生成单核细胞 (hnmo:cd16--) 的迁移进行定量。n = 4个生物复制, 数据显示为平均值±s. d. * p & lt; 0.05;曼恩-惠特尼测试。(e) cd16 + 单核细胞在 (10分钟) 和 (15分钟) 迁移之前和之后通过 tnfα + vegfa 刺激的 huvec 进行定位。将显示正交视图。刻度栏 = 40μm 请点击此处查看此图的较大版本.
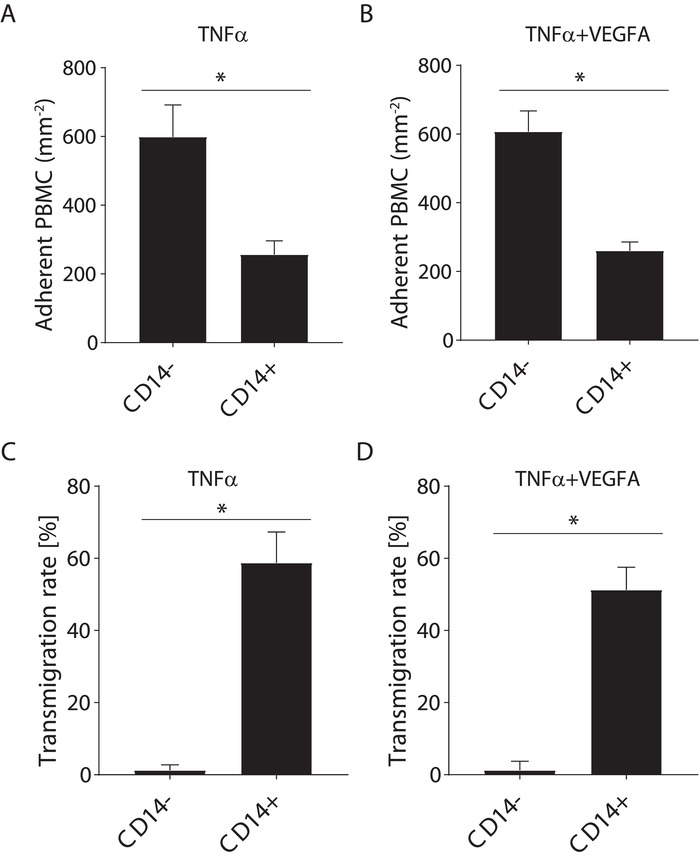
图 6:d. 同时调查 cd14+ 与流中的 cd14-pbmc 的迁移。cd14+与 cd14-pbmcc在流动下粘附 tnfα激活的 huvec.(b) cd14+ 与cd14-pbmc 在流动下对 tnfα+ vegfa 激活的 huvec 的粘附。(c) cd14 + 与 cd14-pbmcm的迁移率 (%) 在流量下通过 tnfα激活的 huvec。(d) cd14+与 cd14-pbmcmc 通过 tnfα + vegfa 激活的 huvec的迁移率 (%)。数据为平均值±s. d. n = 4个生物复制。* p & lt; 0.05;曼恩-惠特尼测试。请点击这里查看此图的较大版本.
补充电影 1: 在泛单核细胞招募的顶端平面上查看流动.在顶端平面流动下招募泛单核细胞的扩展视图。huvec 被 cmfda 染色, 单核细胞的细胞核被 hoechst 33342 染色。刻度栏 = 50μm请点击这里下载此文件.
补充电影 2: 在泛单核细胞招募的基面上查看流动.在基部平面动的平底锅单核细胞的招募的扩展视图。huvec 被 cmfda 染色, 单核细胞的细胞核被 hoechst 33342 染色。刻度栏 = 50μm请点击这里下载此文件.
补充电影 3: 最大投影的 z 堆栈的泛单核细胞招募流动.如补充电影1和2所示, 扩展了在流动下招募平底锅单核细胞的观点。huvec 被 cmfda 染色, 单核细胞的细胞核被 hoechst 33342 染色。刻度栏 = 50μm请点击这里下载此文件.
补充电影 4: 在顶端平面上查看 tnfα激活的huvec 单核细胞亚群的吸收.在顶端平面的顶面同时招募单核细胞亚群在流动下 tnfα激活的 huvec 流动。huvec 被 cmfda 染色, 单核细胞的细胞核被 hoechst 33342 染色。通过 cd16 的表面表达, 确定了人的血管生成单核细胞亚群。刻度栏 = 30μm. 请点击此处下载此文件.
补充电影 5: 在选择单核细胞亚细胞亚群的基础平面上查看tnfα激活 huvec.在基面上, 扩大视图, 即同时招募流中的单核细胞亚群, 使其成为流动下的 tnfα激活的 huvec。huvec 被 cmfda 染色, 单核细胞的细胞核被 hoechst 33342 染色。通过 cd16 的表面表达, 鉴定了人的血管生成单核细胞 (hpo) 亚群。刻度栏 = 30μm. 请点击此处下载此文件.
补充电影 6: 在顶端平面上查看 tnfα+vegfa 激活的 huvec 单核细胞亚群的顶端平面.在顶端平面上, 扩展视图, 即在流量下同时招募单核细胞亚群, 以 tnfα + vegfa 激活的 huvec 在流动下。huvec 被 cmfda 染色, 单核细胞的细胞核被 hoechst 33342 染色。通过 cd16 的表面表达, 确定了人的血管生成单核细胞亚群。刻度栏 = 30μm请点击这里下载此文件.
补充电影 7: 在基础平面上查看 tnfα+vegfa 激活的 huvec 单核细胞亚群的招募.在基面上, 扩展视图, 同时招募流中的单核细胞亚群, 使其在流动下被 tnfα + vegfa 激活的 huvec。huvec 被 cmfda 染色, 单核细胞的细胞核被 hoechst 33342 染色。通过 cd16 的表面表达, 鉴定了人的血管生成单核细胞 (hpo) 亚群。刻度栏 = 30μm请点击这里下载此文件.
讨论
在这里, 我们报告了一个方法详细介绍了单核细胞亚群如何通过发炎的内皮单层迁移的研究。讨论的方法采用共聚焦显微镜代替相对比显微镜, 也用于研究流3、11、19 下单核细胞的招募。使用共聚焦显微镜进行延时成像的一个主要优点是能够明确区分单核细胞的迁移和强粘附。虽然基于相对比显微镜的方法也很稳健, 但它需要专业知识, 以避免混合迁移的细胞和强烈粘附的细胞。在这种情况下, 需要建立严格的分析标准, 以便在单核细胞招募级联的这两种状态之间做出明确的区别。此外, 还必须通过共聚焦显微镜进行端点分析, 以确认通过相位对比显微镜观察到的全球趋势。因此, 直接使用共聚焦显微镜来研究单核细胞在流动下的招募, 为捕获单核细胞的实际迁移状态提供了明确的结果。
在流动下进行白细胞招募检测和使用相对比显微镜的主要瓶颈之一是用于进行分析和跟踪单个细胞从捕获到通过细胞细胞连接的迁移所花费的时间。这种分析的自动化是可能的, 但由于爬行和迁移单核细胞之间的相位对比相似性, 很难执行。本文用共聚焦显微镜观察表明, 单核细胞迁移伴随着与 huvec 下迁移单核细胞形状相对应的基底平面内皮细胞染色的终止。正交投影证实了这一定位。单核细胞定位的转变完全发生在细胞间的连接之间, 表明细胞外迁移。这与我们之前的数据是一致的, 该数据显示, 在体外流动下, 单核细胞完全通过带 huvec3,18的细胞外途径迁移。为了补充这里提出的方法, 可以对连接蛋白 (如 ve-cadherin、jam 或 pecam1) 使用非阻断抗体, 以反映单核细胞转移 (细胞外与跨细胞) 的潜在位点。我们已经证实, 围绕单核细胞核的黑色形状是一个强大的特征, 迁移细胞和一个简单的事件, 可以检测到的软件。尽管这里演示了一个手动细胞计数系统, 白细胞核周围的黑色形状形成是一个标准, 可用于定义白细胞在自动分析中的迁移, 从而节省大量的时间。我们目前正在开发用于此类分析的自动化应用程序。
荧光和共聚焦显微镜以前用于白细胞的招募研究。然而, 它们没有被用来同时调查不同亚人口的招募情况。在这里, 我们提出了一种方法, 使用共聚焦显微镜, 以研究在同一微环境中同时招募白细胞亚型。我们表明, 共聚焦显微镜可用于同时研究不同单核细胞亚群的迁移行为。例如, 我们使用 cd16 表达来区分血管生成和非血管生成单核细胞, 以研究两个亚群在不同炎症环境下的迁移能力。与我们最近的出版物一致, 通过使用共聚焦显微镜模式, 我们已经表明, 当只有 tnfα3刺激内皮细胞单层时, cd16+单核细胞的迁移率较低.然而, tnfα和 vegfa 的结合导致血管生成单核细胞的迁移增加。在这两种炎症条件下, 非血管生成 cd16-单核细胞的转染率同样很高。我们以前已经证明, 单核细胞染色与抗 cd16 抗体没有表现出任何显著的影响, 这证实了通过分析未标记单核细胞后的转移试验, 使用共聚焦显微镜3。然而, 对于新的白细胞亚型或用于标记它们的抗体, 标记效果需要评估。使用这种方法, 最多可以同时研究三个不同的白细胞群。这可能是功能不同或相似的免疫细胞类型的亚群。虽然这里的重点是单核细胞的迁移, 他们的招募的其他步骤也可以通过这种方法进行分析, 包括细胞在迁移前的行为, 如捕获, 和迁移方向。作为这种方法的延伸, 也可以研究不同白细胞群的输血后事件, 如腔切除和反向迁移。其中一个限制是, 在延时成像中, 远红通道中的染色检测不足, 以及一些荧光信号溢出, 从而降低了 z 堆栈分辨率。这主要与用于共聚焦成像的仪器有关。使用图像反卷积最终可以帮助提高图像质量, 并允许进一步分析白细胞招募的不同步骤。
为了研究在最佳条件下的白细胞吸收, 检查内皮细胞单层的活化状态是非常重要的。事实上, 内皮细胞激活不足会导致全球单核细胞粘附和移植减少。通过分析 icam1 和 vcam1 等内皮细胞表面粘附分子的表达水平, 可以检测内皮细胞的活化。与未受刺激的内皮细胞相比, 这些粘附分子的水平必须提高。如果在这些内皮粘附分子中没有检测到任何变化, 培养的 huvec 可以被认为是不激活的。评估粘附分子的表达水平可以构成一个良好的定量控制之间的不同实验使用同一批 huvec。然而, 这些粘附分子的表达水平也可能因内皮细胞的不同原代培养而异, 从而限制了 icam1 或 vcam1 的全球阈值的考虑。huvec 等大血管内皮细胞形态的变化也是其激活的一个很好的指标。后一种表型的变化允许对 huvec 激活进行快速定性评估。然而, 对粘附分子的分析可能是微血管细胞的更好选择, 这些细胞在使用炎症细胞因子激活时不会显示出重大的形状变化。
对于机械研究, 单核细胞转染的相关阴性对照可以通过使用针对内皮粘附分子 (如 icam1、vcam1) 或白细胞表面 (如白细胞功能相关抗原 (lfa)-1 的抗体进行。使用相关的负控制对于单核细胞中的机械研究至关重要, 因为它们在细胞表面表达 fc 受体。分离后单核细胞的纯度也很重要, 以避免其他白细胞群的污染和对单核细胞迁移率的低估。另一个关键参数是温度, 所有检测都需要设置在 37°c, 以确保所有实验观测都是相关的, 并相应地转化为人体体内细胞贩运.
披露声明
作者没有相互竞争的经济利益。
致谢
我们感谢保罗·布拉德菲尔德博士的手稿阅读和反馈。a. s. 得到了朱尔斯·索恩爵士慈善海外信托委员会的财政支持。
材料
| Name | Company | Catalog Number | Comments |
| Tissue Culture Flasks 75 cm2 | TPP | 90076 | Routine culture of isolated HUVEC |
| µ-Slide VI 0.4 | IBIDI | 80606 | |
| Centrifuge Tubes 15 mL | TPP | 191015 | |
| Centrifuge Tubes 50 mL | TPP | 191050 | |
| Collagen G | Biochrom | L 7213 | For coating of cell culture flasks |
| Gelatin | Sigma-Aldrich | 1393 | For coating of cell culture flasks |
| Dulbecco’s Phosphate Buffered Saline (without MgCl2 and CaCl2) | Sigma-Aldrich | D8537 | |
| Dulbecco’s Phosphate Buffered Saline (with MgCl2 and CaCl2) | Sigma-Aldrich | D8662 | |
| RPMI-1640 Medium | Sigma-Aldrich | R8758 | |
| 3-Way Stopcocks | BIO-RAD | 7328103 | |
| penicillin 10,000 μ/mL streptomycine 10,000 μg/mL fungizone 25 μ/mL | AMIMED | 4-02F00-H | |
| Collagenase type 1 | Worthington | LS004216 | |
| Medium 199 1x avec Earle's salts, L-Glutamine, 25 mM Hepes | GIBCO | 22340020 | |
| Bovine Albumin Fraction V | ThermoFisher | 15260037 | |
| Endothelial Cell Growth Supplement, 150 mg | Millipore | 02-102 | |
| Heparin Sodium | Sigma-Aldrich | H3149RT | |
| Hydrocortisone | Sigma-Aldrich | H6909 | |
| L-Ascorbic acid | Sigma-Aldrich | A 4544 | |
| EDTA disodium salt dihydrate C10H14N2Na2O8 · 2H2O | APPLICHEM | A2937.0500 | |
| CD144 (VE-Cadherin), human recombinant clone: REA199, FITC | Miltenyi Biotech | 130-100-713 | AB_2655150 |
| CD31-PE antibody, human recombinant clone: REA730, PE | Miltenyi Biotech | 130-110-807 | AB_2657280 |
| Anti-Podoplanin-APC, human recombinantclone: REA446, APC | Miltenyi Biotech | 130-107-016 | AB_2653263 |
| BD Accuri C6 Plus | BD Bioscience | ||
| µ-Slide I Luer | IBIDI | 80176 | |
| CMFDA (5-chloromethylfluorescein diacetate) | ThermoFisher | C2925 | |
| Recombinant human TNFα | Peprotech | 300-01A | |
| Recombinant human VEGFA | Peprotech | 100-20 | |
| NE-1000 Programmable Syringe Pump | KF Technology | NE-1000 | |
| Ficoll Paque Plus | GE Healthcare | 17-1440-02 | |
| Anti-human CD14-PE, human recombinant clone: REA599, PE | Miltenyi Biotech | 130-110-519 | AB_2655051 |
| Pan Monocyte Isolation Kit, human | Miltenyi Biotech | 130-096-537 | |
| Anti-human CD16-PE, human recombinant clone: REA423, PE | Miltenyi Biotech | 130-106-762 | AB_2655403 |
| LS columns | Miltenyi Biotech | 130-042-401 | |
| QuadroMACS Separator | Miltenyi Biotech | 130-090-976 | |
| Hoechst 33342, Trihydrochloride, Trihydrate | ThermoFisher | H1399 | |
| Silicone tubing | IBIDI | 10841 | |
| Elbow Luer Connector | IBIDI | 10802 | |
| Female Luer Lock Coupler | IBIDI | 10823 | |
| Luer Lock Connector Female | IBIDI | 10825 | |
| In-line Luer Injection Port | IBIDI | 10820 | |
| Ar1 confocal microscope | Nikon | ||
| 40x objective | Nikon | 40x 0.6 CFI ELWD S Plane Fluor WD:3.6-2.8mm correction 0-2mm | |
| ImageJ Software | NIH |
参考文献
- Auffray, C., Sieweke, M. H., Geissmann, F. Blood Monocytes: Development, Heterogeneity, and Relationship with Dendritic Cells. Annual Review of Immunology. 27 (1), 669-692 (2009).
- De Palma, M., Venneri, M. A., Roca, C., Naldini, L. Targeting exogenous genes to tumor angiogenesis by transplantation of genetically modified hematopoietic stem cells. Nature Medicine. 9 (6), 789-795 (2003).
- Sidibe, A., et al. Angiogenic factor-driven inflammation promotes extravasation of human proangiogenic monocytes to tumours. Nature Communications. 9 (1), 355(2018).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Review Immunology. 7 (9), 678-689 (2007).
- Nourshargh, S., Alon, R. Leukocyte Migration into Inflamed Tissues. Immunity. 41 (5), 694-707 (2014).
- Cros, J., et al. Human CD14dim monocytes patrol and sense nucleic acids and viruses via TLR7 and TLR8 receptors. Immunity. 33 (3), 375-386 (2010).
- Geissmann, F., Jung, S., Littman, D. R. Blood monocytes consist of two principal subsets with distinct migratory properties. Immunity. 19 (1), 71-82 (2003).
- Chamorro, S., et al. In vitro differentiation of porcine blood CD163− and CD163+ monocytes into functional dendritic cells. Immunobiology. 209 (1-2), 57-65 (2004).
- Passlick, B., Flieger, D., Ziegler-Heitbrock, H. Identification and characterization of a novel monocyte subpopulation in human peripheral blood. Blood. 74 (7), (1989).
- Venneri, M. A., et al. Identification of proangiogenic TIE2-expressing monocytes (TEMs) in human peripheral blood and cancer. Blood. 109 (12), 5276-5285 (2007).
- Bradfield, P. F., et al. JAM-C regulates unidirectional monocyte transendothelial migration in inflammation. Blood. 110 (7), 2545-2555 (2007).
- Schenkel, A. R., Mamdouh, Z., Muller, W. A. Locomotion of monocytes on endothelium is a critical step during extravasation. Nature Immunology. 5 (4), 393-400 (2004).
- Luu, N. T., Rainger, G. E., Nash, G. B. Kinetics of the different steps during neutrophil migration through cultured endothelial monolayers treated with tumour necrosis factor-alpha. Journal Vascular Research. 36 (6), 477-485 (1999).
- ibidi GmbH. Shear Stress and Shear Rates for ibidi µ-Slides - Based on Numerical Calculations. , (2014).
- Yang, L., Froio, R. M., Sciuto, T. E., Dvorak, A. M., Alon, R., Luscinskas, F. W. ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-alpha-activated vascular endothelium under flow. Blood. 106 (2), 584-592 (2005).
- Yang, C. -R., Hsieh, S. -L., Ho, F. -M., Lin, W. -W. Decoy receptor 3 increases monocyte adhesion to endothelial cells via NF-kappa B-dependent up-regulation of intercellular adhesion molecule-1, VCAM-1, and IL-8 expression. Journal of Immunology. 174 (3), Baltimore, Md. 1647-1656 (2005).
- Wong, D., Dorovini-Zis, K. Expression of vascular cell adhesion molecule-1 (VCAM-1) by human brain microvessel endothelial cells in primary culture. Microvascular Research. 49 (3), 325-339 (1995).
- Bradfield, P. F., Nourshargh, S., Aurrand-Lions, M., Imhof, B. A. JAM family and related proteins in leukocyte migration (Vestweber series). Arteriosclerosis Thrombosis and Vascular Biology. 27 (10), 2104-2112 (2007).
- Bradfield, P. F., et al. Divergent JAM-C Expression Accelerates Monocyte-Derived Cell Exit from Atherosclerotic Plaques. PLoS One. 11 (7), e0159679(2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。