Method Article
Évaluation du profil métabolique des cellules leucémiques primaires
Dans cet article
Résumé
Nous présentons ici un protocole pour l’isolement des cellules leucémiques de leucémie patients la moelle osseuse et l’analyse de leur état métabolique. Évaluation du profil métabolique des cellules leucémiques primaires pourrait aider à mieux caractériser la demande des cellules primaires et pourrait mener à une médecine plus personnalisée.
Résumé
L’exigence métabolique des cellules cancéreuses peut influencer négativement la survie et l’efficacité du traitement. De nos jours, ciblage pharmaceutique des voies métaboliques est testée dans plusieurs types de tumeurs. Ainsi, la caractérisation de l’installation métabolique de cellules du cancer est inévitable afin de cibler la bonne voie afin d’améliorer le résultat global des patients. Malheureusement, dans la majorité des cancers, les cellules malignes sont assez difficiles à obtenir en plus grand nombre et la biopsie de tissu est requise. La leucémie est une exception, où un nombre suffisant de cellules leucémiques peut être isolé dans la moelle osseuse. Ici, nous fournissons un protocole détaillé pour l’isolement des cellules leucémiques de leucémie patients la moelle osseuse et l’analyse ultérieure de leur état métabolique avec analyseur de flux extracellulaire. Les cellules leucémiques sont isolés par le gradient de densité, ce qui n’altère pas leur validité. La prochaine étape de la culture aide à se régénérer, donc l’état métabolique mesuré est l’état des cellules dans des conditions optimales. Ce protocole permet d’obtenir des résultats cohérents et bien standardisées, qui pourraient être utilisées pour la thérapie personnalisée.
Introduction
Le profil métabolique est l’une des principales caractéristiques des cellules et bioénergétique altérée sont désormais considérés comme une des caractéristiques du cancer1,2,3. En outre, les changements dans les paramètres métaboliques pourraient servir dans le traitement du cancer en ciblant les voies de transduction de signal ou de la machinerie enzymatique de cancer des cellules4,5,6. Sachant la prédisposition métabolique des cellules cancéreuses est donc un avantage et peut aider à améliorer le traitement actuel.
Il y a une abondance de méthodes déjà éprouvées qui peuvent évaluer l’activité métabolique des cellules en culture. Au sujet de la glycolyse, l’absorption du glucose est mesurable par le marquage radioactif, à l’aide de 2-NBDG (2-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-yl)Amino)-2-Deoxyglucose) ou taux de lactate extracellulaire mesurée par voie enzymatique7,8. Taux d’oxydation de l’acide gras est un autre paramètre métabolique mesuré par palmitate isotopiquement étiquetés9,10. Taux de consommation d’oxygène est une méthode largement utilisée pour la détermination de l’activité mitochondriale dans les cellules11,12, ainsi que de la membrane mitochondriale potentiel évaluation13,14, ATP/ADP (adénosine Adénosine-triphosphate/5′ 5′-diphosphate) ratio mesure15 ou total intracellulaire ATP mesure16. Voies qui régulent les processus métaboliques de signalisation peut être déterminée par des analyses quantitatives de protéine et peut améliorer la compréhension des mesures métaboliques17,18,19.
Cependant, toutes ces méthodes mesurent seul ou, dans le meilleur scénario, quelques paramètres métaboliques dans un échantillon en même temps. Ce qui est important, la mesure simultanée des taux de consommation d’oxygène (OCR) et taux d’acidification extracellulaire (ECAR) est possible par l’analyse de flux extracellulaire par, par exemple, Seahorse XFp Analyzer. L’OCR est un indicateur de la respiration mitochondriale et ECAR est principalement le résultat de la glycolyse (nous ne pouvons ignorer le CO2 production élever éventuellement ECAR de cellules avec une activité élevée de la phosphorylation oxydative)20. Jusqu’ici, les divers types de cellules ont été étudiés en utilisant ces analyseurs21,22,23.
Nous décrivons ici le protocole pour l’analyse de flux extracellulaire de blastes primaires (cellules de la leucémie dérivés le stade hématopoïétique immature) de patients atteints de leucémie. Au meilleur de notre connaissance, un protocole spécifique Blasts primaire n’est pas disponible encore.
Protocole
Tous les échantillons ont été obtenus avec l’informed consent des parents ou les tuteurs des enfants et l’approbation du Comité d’éthique de l’Université Charles à Prague, en République tchèque, l’étude aucun. NV15-28848A.
1. préparation des réactifs
- Préparer 500 mL de PBS en dissolvant 137 mM NaCl, KCl 2,7 mM, 4,3 mM Na2HPO4, 1,47 mM KH2PO4, ddH2O. ajuster le pH à 7,4 avec HCl. stériliser à l’autoclave.
- Préparation de 100 mL de milieu RPMI : milieu RPMI-1640 avec L-Alanyl-Glutamine additionné de 10 % sérum fœtal (SVF), la pénicilline (100 U/mL) et la streptomycine (100 μg/mL).
- Préparation de 50 mL de 0,1 M NaHCO3 dans l’eau distillée. Ajuster le pH à 8.1, filtre stériliser (0,22 μm) et conserver à 4 ° C.
Remarque : Pour les deux plaques d’analyseur de flux extracellulaire 8 puits, préparez 250 μL de 0,1 M NaHCO3 pH 8,1. - Préparer 1 mL de 2 M de D-glucose dans de l’eau distillée. Filtre à stériliser (0,22 μm) et conserver à-20 ° C.
- Préparer 100 μL de 1 mM oligomycine A dans l’éthanol. Filtre à stériliser (0,22 μm) et conserver à-20 ° C.
- Préparez 250 μL de 1 M 2-désoxy-D-glucose (2-DG) en minimes DMEM (milieu de l’aigle de la modification de Dulbecco). Chauffé à 37 ° C et ajuster le pH à 7,4 (procédez à la mesure de pH à 37 ° C). Filtre à stériliser (0,22 μm) et conserver à-20 ° C.
- Préparer 100 μL de 1 mM FCCP (carbonyl cyanide-p-trifluoromethoxyphenylhydrazone) dans le DMSO. Filtre à stériliser (0,22 μm) et conserver à-20 ° C.
- Préparer 100 μL de 1 mM la roténone dans l’éthanol. Filtre à stériliser (0,22 μm) et conserver à-20 ° C.
- Préparer 100 μL de 1 mg/mL l’antimycine A dans l’éthanol. Filtre à stériliser (0,22 μm) et conserver à-20 ° C.
- Juste avant l’utilisation, préparer 10 mL de milieu de stress test de la glycolyse. Chauffer DMEM minime à 37 ° C dans un bain d’eau et ajuster le pH à 7,4 (procédez à la mesure de pH à 37 ° C).
- Avant l’utilisation, préparer 10 mL de milieu d’épreuve de stress cellulaire Mito avec BSA. Supplément minimum DMEM avec 2 mM de L-glutamine, 10 mM de D-glucose, 1 mM HEPES (pH 7,4), pyruvate de 1 mM et 0,1 % de BSA (albumine sérique bovine). Chauffé à 37 ° C dans un bain d’eau et ajuster le pH à 7,4 (procédez à la mesure de pH à 37 ° C).
- Avant l’utilisation, préparer 10 mL de milieu d’épreuve de stress cellulaire Mito sans BSA. Supplément minimum DMEM avec 2 mM de L-glutamine, 10 mM de D-glucose, 1 mM HEPES (pH 7,4) et pyruvate de 1 mM. Chaud moyen de stress test cellule Mito sans BSA à 37 ° C dans un bain d’eau et ajuster le pH à 7,4 (procédez à la mesure de pH à 37 ° C).
NOTE : BSA est ajouté au milieu de stress test cellule Mito parce que les cellules répondent mieux à FCCP lorsque le milieu est additionné de BSA (conditions différentes ont été testées). Milieu de stress test de Mito cellulaire sans BSA est utilisé pour les ports de chargement que le fabricant ne recommande pas à l’aide de BSA dans le milieu.
2. isolement des cellules mononucléaires de la moelle osseuse
NOTE : Idéalement, mesure de l’état métabolique des cellules leucémiques primaires devrait commencer immédiatement après l’isolement collection et cellule de la moelle osseuse. Néanmoins, les données pertinentes pourraient également provenir de cellules isolées après les centres de transport entre autre hématologie en République tchèque. Effectuer toutes les étapes intermédiaires dans une hotte de vitroplants stérile.
- Échauffement de PBS et le milieu de gradient de densité à la température ambiante.
- Diluer l’échantillon de la moelle osseuse du patient de leucémie avec du PBS, dans un rapport de 1:1. S’assurer que l’échantillon contient au moins 80 % de blastes leucémiques.
- Déterminer le pourcentage de blastes en cytométrie de flux à l’aide des marqueurs spécifiques de CD pour la caractérisation des types de cellules lymphoblastiques. Après la séparation de gradient de densité, détecter les acides nucléiques des évènements positifs avec un colorant nucléaire afin d’établir le nombre d’éléments globaux.
- Ensuite, déterminez à l’aide de marqueurs CD spécifiques pour chaque type de leucémie des cellules leucémiques : B-ALL (CD19, CD45), LLA-T (CD3, CD4, CD8, CD5, CD7, CD99) et AML (CD45, CD33 et des marqueurs myéloïdes spécifiques)24. Divisez le nombre de cellules leucémiques positifs pour les marqueurs CD spécifiques par toutes les cellules nucléaires pour déterminer le pourcentage de cellules blastiques de leucémie.
Remarque : La moelle osseuse doit être prélevé dans les tubes avec des anticoagulants. - Soigneusement la couche 6 mL d’échantillon dilué la moelle osseuse plus 6 mL du milieu de gradient de densité dans un tube conique de 15 mL. Centrifuger à 400 g pour 35 min à 4 ° C dans un rotor oscillant-seau sans le frein.
Remarque : Plus grand volume de l’échantillon peut être divisé en plusieurs parties aliquotes ou tube conique de 50 mL peut être utilisé avec la plus grande quantité de milieu de gradient de densité. - À l’aide d’une pipette Pasteur, transvaser avec soin la couche interphase qui se compose de cellules mononuclées (Figure 1) dans un nouveau tube conique de 50 mL à 5 mL de PBS. Centrifuger à 400 × g pendant 10 min à 4 ° C dans un rotor oscillant-seau.
NOTE : Transfert de toutes les couches de cellules mononucléées dans un tube conique unique de 50 mL à 5 mL de PBS. - Aspirer le surnageant et Resuspendre le culot dans 2 mL de PBS stérile. Compter les cellules à l’aide d’un hémocytomètre.
Remarque : Le nombre de cellules leucémiques dans 1 mL de l’aspiration de moelle osseuse diffère considérablement parmi les patients25.
3. une nuit culture de cellules mononucléées
Remarque : Effectuez toutes les étapes intermédiaires dans une hotte de vitroplants stérile.
- Préparer deux flacons T75 avec 20 mL de milieu RPMI. Dans chaque fiole, ajouter 30 x 106 isolé des cellules mononucléaires. Incuber les cellules avec le ballon debout pour les 16-24 heures à 5 % de CO2 et 37 ° C.
4. préparation des plaques de revêtement adhésif cellulaires
- Recouvrir deux plaques d’analyseur de flux extracellulaire 8 puits.
Remarque : Effectuer le revêtement sous une hotte de vitroplants stérile. - Ajouter 2,2 μL d’adhésif de la cellule (densité : 2,54 mg/ml) à 250 μL de 0,1 M NaHCO3pH 8,1 et prélever immédiatement 12,5 μL de la solution dans chaque puits.
NOTE : Solutions mères adhésives cellule peut se distinguent par leur densité, régler le volume de NaHCO3 complété en conséquence. - Laisser les plaques s’asseoir dans la hotte pendant environ 20 min, puis aspirer l’adhésif de la cellule et laver chaque bien deux fois à l’aide de 200 μL d’eau stérile. Laisser reposer dans le capot avec le couvercle ouvert jusqu'à ce que les puits sont à secs.
- Utilisez les plaques tout de suite ou économiser jusqu'à 1 semaine à 4 ° C avec la jante enveloppée dans le film de paraffine pour éviter la condensation. Veiller à ce que les plaques sont réchauffés à la température ambiante (pendant environ 20 min) dans le capot avant d’ensemencer les cellules.
5. l’hydratation de la cartouche de sonde
NOTE : Hydrater deux cartouches d’analyseur de flux extracellulaire 8 puits.
- Séparer la plaque de l’utilité et la cartouche de la sonde. Placez la cartouche de capteur à l’envers sur le banc de laboratoire.
- Remplir chaque puits de la plaque de l’utilitaire avec 200 μL calibrant. Remplir chaque fossé autour de l’extérieur des puits avec 400 μl de degré.
- Retourner la cartouche de la sonde à la plaque de l’utilitaire qui contient maintenant le degré.
- Placer la cartouche dans un humidifié, non-CO2, incubateur de 37 ° C pendant la nuit.
- Allumez l’analyseur de flux extracellulaire et laissez-le chauffer à 37 ° C pendant la nuit.
6. ensemencement de cellules en cellules enduit adhésif plaques
Remarque : Pour que la glycolyse stress test, utilisez glycolyse stress test moyenne. Pour le test de stress cellulaire Mito, utilisez milieu d’épreuve de stress cellulaire Mito avec BSA.
- Cellules de semence pour le test de stress de la glycolyse et le test de stress cellulaire Mito en plaques distinctes. Pour chaque essai, utiliser des cellules d’un ballon avec une culture.
- Centrifuger les cellules à 200 x g pendant 5 min à température ambiante. Remettre en suspension des cellules dans 1 mL de milieu approprié et les compter.
- Ajouter 4 x 106 de cellules vivantes pour le volume final de 400 ml (utilisation de support approprié).
- Plaque 50 μl de la suspension cellulaire dans les puits B-G. S’assurer que 500 000 cellules sont ensemencées dans un puits.
Remarque : Il est crucial d’exactement 500 000 cellules / puits de graines comme aucun autre normalisation n’est réalisée. De cette façon, les résultats de différents patients peuvent être comparés. Le nombre optimal de répétitions est de six, comme il est décrit ici. En utilisant moins de répétitions n’est pas recommandée, car les cellules primaires pourrait se comporter parfois par erreur. - Ajouter 180 μl du milieu approprié dans les puits A et H (ces puits servira une correction de fond).
- Centrifuger la plaque à 400 x g pendant 5 min à température ambiante avec frein réglé sur 1.
- Ajouter 130 μL de milieu approprié aux puits B-G en deux plaques d’analyseur de flux extracellulaire 8 puits lentement et soigneusement. Vérifier visuellement que les cellules sont stablement adhérées au fond des puits par Regarde un sous le microscope.
- Placer la plaque dans un humidifié, non-CO2, incubateur de 37 ° C pendant 30 min.
7. chargement de la cartouche de capteur
- Pour le test de stress de la glycolyse, préparez 250 μL chacun de 100 mM de glucose, 20 μM oligomycine A et 1 M 2-DG, tous dans le milieu d’épreuve de stress de glycolyse.
- Pour le test de stress cellulaire Mito, préparer 250 μL chacun de 20 μM oligomycine A, 15 μM FCCP, 30 μM FCCP et un mélange de 10 μM roténone et 10 μg/ml l’antimycine A, tous dans le milieu d’épreuve de stress cellulaire Mito sans BSA.
Remarque : Injecter deux concentrations de FCCP dans un dosage est recommandé car il n’est pas matériel suffisamment patients pour le titrage FCCP. Néanmoins, la concentration doit être déterminée par le chercheur. - Charger les composés dans les ports injecteur approprié de la cartouche comme suit (tableau 1) :
8. mise en place du programme
- Pour le test de stress de la glycolyse, mis en place le programme tel que décrit dans le tableau 2.
- Pour le test de stress cellulaire Mito, mis en place le programme tel que décrit dans le tableau 3.
- Démarrez le programme. Remettez la plaque calibrant avec la plaque de test (lorsque vous êtes invité).
9. évaluation et interprétation des résultats
- Dans les résultats des stress tests glycolyse, soustraire la valeur ECAR plus bas après l’injection de 2-DG de toutes les autres valeurs ECAR.
Remarque : Cette valeur la plus basse représente l’acidification non-glycolytique. Généralement, la valeur la plus basse est de la mesure 4 deth . - Calculer l’acidification basale, glycolyse, glycolyse maximale et glycolytiques réserve paramètres de fonction glycolytique (Figure 2 a). Après avoir soustrait la valeur la plus basse ECAR, calculer l’acidification basale comme moyen d’ECAR depuis les premiers points de trois mesure (omettre la première valeur ECAR si elle diffère sensiblement des deux autres), calculer la glycolyse comme moyen d’ECAR de trois mesures points après injection de glucose et calculer la glycolyse maximale qu’une moyenne de ECAR de mesure trois points après l’oligomycine une injection. Calculer Glycolytic réserve comme glycolyse maximale moins glycolyse.
NOTE : Également pour le calcul de la glycolyse maximale, utiliser la valeur la plus élevée ECAR depuis les trois points de mesure. - Dans les résultats des tests de stress cellulaire Mito, soustraire la valeur d’OCR le plus bas après l’injection de roténone / l’antimycine A de toutes les autres valeurs de l’OCR.
- Calculer la respiration basale, ATP production, respiration maximale et paramètres de capacité de réserve de la fonction mitochondriale (Figure 2 b). Après avoir soustrait la plus petite valeur de OCR, calculer la respiration de base comme moyen d’OCR depuis les premiers points de trois mesures.
Remarque : La respiration maximale est la plus haute valeur OCR après injection FCCP. - Pour le calcul de la production d’ATP, soustraire la moyenne des trois points de mesure OCR après injection oligomycine A partir de la respiration de base. Calculer la capacité de réserve comme la respiration maximale moins la respiration de base.
NOTE : Toujours calculer la respiration maximale de la valeur plus élevée de l’OCR, quelle que soit la concentration FCCP utilisée.
Résultats
La figure 3 montre les courbes après test d’effort de la glycolyse et mesures de stress test cellule Mito de blastes leucémiques du BCP-ALL (leucémie lymphoblastique aiguë de la B-cellule précurseur) et les patients AML (leucémie myéloïde aiguë). Le calcul des paramètres métaboliques de ces mesures est également indiqué. 500 000 cellules / puits ont été ensemencées et toutes les mesures ont été effectuées en hexaplicates.
Dans le test de stress de la glycolyse, le milieu de base seulement est utilisé, afin que les cellules sont privées d’éléments nutritifs. Le premier paramètre obtenu est l’acidification basale, qui devrait tenir compte de la quantité de glucose stocké dans les cellules. Après la première injection, ECAR est augmenté depuis que les cellules utilisent le glucose et peuvent fermenter pour le lactate. L’oligomycine A dans la deuxième injection inhibe l’ATP-synthase et dirige ainsi les cellules pour produire de l’ATP par la glycolyse. Cela devrait plus provoquer une élévation de ECAR. Injection de 2-DG inhibe complètement la glycolyse et ECAR gouttes.
Dans le test de stress cellulaire Mito, un milieu additionné de glutamine et de glucose sont utilisés, afin que les cellules ne sont pas privés de tous les nutriments et le paramètre de la respiration de base reflète leur état métabolique basal. Après la première injection avec oligomycine A, cellules inhibent la respiration mitochondriale et basculer vers la glycolyse qui est représentée comme une diminution de l’OCR. FCCP (l’injection de deuxième et troisième), d’autre part, découple la production d’ATP de la respiration, afin que les cellules maintenant consomment de l’oxygène à un taux maximal et la montée de OCR à sa valeur la plus élevée. La dernière injection du mélange de roténone et antimycine A inhibe complètement la respiration mitochondriale et OCR est réduite proche de zéro.

Figure 1 : centrifugation en gradient de densité de l’échantillon de moelle osseuse. Les cellules mononucléaires enrichis pour les cellules leucémiques sont séparés par milieu de gradient de densité. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : contour de glycolyse stress test et test de stress cellulaire Mito (A) résultat exemplaire de glycolyse stress test. (B) résultat exemplaire de test de stress cellulaire Mito. Les paramètres sont indiqués dans les courbes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
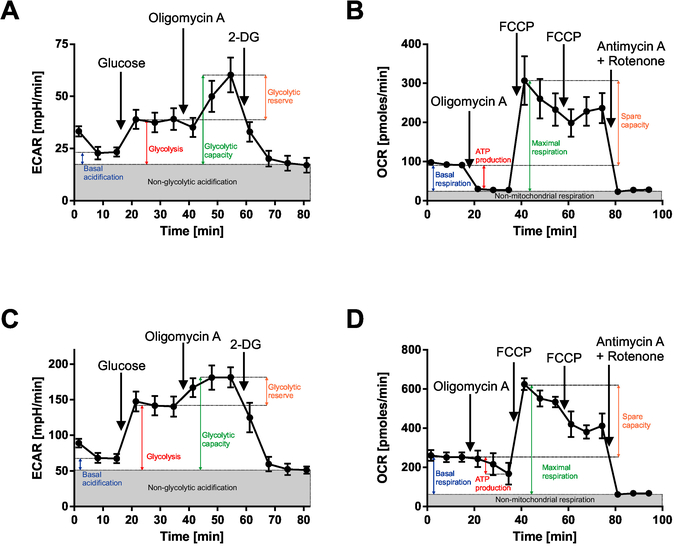
Figure 3 : analyse de flux extracellulaire de blastes leucémiques du BCP-ALL (A, B) et le patient de l’AML (B, C). (A et C) résultats des stress tests glycolyse. Veuillez noter que le premier point de mesure peut différer sensiblement du reste et devrait être exclu de l’analyse dans cette affaire. (B et D) résultats des tests de stress cellulaire Mito. Les paramètres sont indiqués dans les courbes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Port | Test de stress de la glycolyse | Test de stress cellulaire mito | ||
| Chargement au port | Concentration finale dans les puits | Chargement au port | Concentration finale dans les puits | |
| A | 20 μL de glucose 100 mM | 10 mM de glucose | 20 μL de 20 μM oligomycine A | 2 μM oligomycine A |
| B | 22 μL de 20 μM oligomycine A | 2 μM oligomycine A | 22 μL de 15 μM FCCP | FCCP 1,5 ΜM |
| C | 25 μL de 1 M 2-DG | 100 mM 2-DG | 25 μL de 30 μM FCCP | FCCP 4,5 ΜM |
| D | X | 25 μL de 10 μM roténone et 10 μg/ml l’antimycine A | 1 μM roténone et 1 μg/ml l’antimycine A | |
Tableau 1 : Composé de volumes.
| Étape | Paramètres |
| Calibration | Automatique |
| Équilibration | Automatique |
| Mesure de référence | Trois fois : mélanger – 3 min, attente – 0 min, mesure – 3 min |
| Injection du port A | Injection |
| Mesure | Trois fois : mélanger – 3 min, attente – 0 min, mesure – 3 min |
| Injection du port B | Injection |
| Mesure | Trois fois : mélanger – 3 min, attente – 0 min, mesure – 3 min |
| Injection du port C | Injection |
| Mesure | Quatre fois : mélanger – 3 min, attente – 0 min, mesure – 3 min |
Tableau 2 : Programme pour l’épreuve d’effort de la glycolyse.
| Étape | Paramètres |
| Calibration | Automatique |
| Équilibration | Automatique |
| Mesure de référence | Trois fois : mélanger – 3 min, attente – 0 min, mesure – 3 min |
| Injection du port A | Injection |
| Mesure | Trois fois : mélanger – 3 min, attente – 0 min, mesure – 3 min |
| Injection du port B | Injection |
| Mesure | Trois fois : mélanger – 3 min, attente – 0 min, mesure – 3 min |
| Injection du port C | Injection |
| Mesure | Trois fois : mélanger – 3 min, attente – 0 min, mesure – 3 min |
| Injection du port D | Injection |
| Mesure | Trois fois : mélanger – 3 min, attente – 0 min, mesure – 3 min |
Tableau 3 : Programme de test de stress cellulaire Mito.
Discussion
Le protocole décrit ci-dessus permet la mesure de l’activité métabolique évaluée par OCR et ECAR valeurs dans les blastes leucémiques primaires provenant de patients atteints de leucémie lymphoblastique aiguë (LLA) ou leucémie myéloïde aiguë (LMA). L’avantage de la mesure à l’aide d’un analyseur de flux extracellulaire, c’est qu’il permet la détection du profil métabolique dans le temps réel dans les cellules vivantes. Essentiellement, toutes les étapes du protocole fourni pourraient être ajusté selon le type de cellule, on envisage d’étudier. Ici, nous allons discuter des paramètres les plus importants qui pourraient influer sur les résultats et pourraient fournir moins de valeurs optimales.
La première étape vers l’optimisation est une comparaison des données obtenues par frais vs matériels gelés matériel. La capacité de mesurer l’activité métabolique du matériau gelé permettrait des études rétrospectives sur des échantillons de patients conservés dans la Banque de l’azote liquide. Dans le cas de tous les échantillons, nous avons pu détecter une activité métabolique compatible uniquement à partir de la matière fraîche tandis que les cellules AML ont été également mesurées après hors gel avec des résultats optimaux.
La deuxième étape vers l’optimisation est la culture de blastes leucémiques primaires. Nous avons testé l’activité métabolique des cellules directement après la séparation de gradient de densité (sans culture) ou après une nuit de culture. Même si les cellules après la séparation de gradient de densité semblait viable et vitale au microscope, leur activité métabolique a été altérée. Dans l’ensemble des valeurs ECAR et OCR sont plus faibles et en outre, après l’injection, OCR ou ECAR valeurs ne répondent pas optimale comme ils le faisaient dans les cellules cultivées.
Culture dans des conditions différentes peut également influencer les résultats. En utilisant l’insuline transferrine sodium sélénite supplément (ITS) est considéré comme une bonne pratique quand cultiver primaire explosions8, mais ce supplément interfère avec l’activité métabolique des cellules. Au cours de la cellule Mito stress test, blastes leucémiques cultivées avec ITS ne répondaient pas aux oligomycine A (OCR devrait diminuer afin de calculer la respiration liée à l’ATP). Nous avons aussi essayé de cultiver des cellules avec des cellules souches mésenchymateuses (CSM), mais dans ce cas, OCR et ECAR valeurs ont été inférieurs comparés aux cellules cultivées sans MSCs. En résumé, cultivant blastes primaires de patients atteints de leucémie dans RPMI moyenne avec 10 % FBS est la meilleure option.
Les patients convenable pour la caractérisation de leur profil métabolique doivent répondre à certains critères qui, sur la limite d’une part le nombre d’échantillons analysés, mais d’autre part, donneront des résultats pertinents. Nous avons mesuré la fonction métabolique des patients avec une cellularité élevée (pour une mesure nous avons ensemencé 500 000 cellules par puits dans hexaplicate) et que des échantillons avec 80 et un pourcentage plus élevé de blastes leucémiques pouvaient être mesurés pour éviter la détection de non spécifique activité métabolique d’autres types de cellules présents dans la suspension.
Une des étapes cruciales dans l’analyse des données est la normalisation, afin que les paramètres métaboliques entre différents échantillons leucémiques pourraient être comparés. Conformément à nos précédentes expériences réalisées avec des lignées de cellules leucémiques, nous avons constaté que la normalisation au nombre des cellules donne les meilleurs résultats. Le nombre spécifique de cellules / puits doit être déterminé par le chercheur et dépend de la taille et l’activité métabolique des cellules testées.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier les centres d’hématologie pédiatrique tchèque. Ce travail a été soutenu par la subvention du ministère de la santé (NV15-28848A), ministère de la santé de l’Université l’hôpital Motol, République tchèque, Prague, République tchèque 00064203 et par le ministère de l’éducation, jeunesse et Sports NPU I nr. LO1604.
matériels
| Name | Company | Catalog Number | Comments |
| RPMI 1640 Medium, GlutaMAX Supplement | Gibco, ThermoFisher Scientific | 61870-010 | |
| Fetal Bovine Serum | Biosera | FB-1001/100 | |
| Antibiotic-Antimycotic (100x) | Gibco, ThermoFisher Scientific | 15240-062 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761-500G | |
| D-(+) Glucose | Sigma-Aldrich | G7021-100G | |
| Oligomycin A | Sigma-Aldrich | 75351-5MG | |
| 2-Deoxy-D-glucose | Sigma-Aldrich | D8375-1G | |
| FCCP | Sigma-Aldrich | C2920-10MG | |
| DMSO | Sigma-Aldrich | D8418-100ML | |
| Rotenone | Sigma-Aldrich | R8875-1G | |
| Antimycin A from Streptomyces sp. | Sigma-Aldrich | A8674-25MG | |
| Seahorse XF Base Medium, 100 mL | Agilent Technologies | 103193-100 | |
| L-glutamine solution, 200 mM | Sigma-Aldrich | G7513-100ML | |
| HEPES solution, 1 M, pH 7.0-7.6 | Sigma-Aldrich | H0887-100ML | |
| Sodium pyruvate | Sigma-Aldrich | P5280-25G | |
| Bovine Serum Albumin | Sigma-Aldrich | A2153-10G | |
| Ficoll-Paque Plus | Sigma-Aldrich | GE17-1440-02 | Density gradient medium |
| Seahorse XFp FluxPak | Agilent Technologies | 103022-100 | |
| Corning™ Cell-Tak Cell and Tissue Adhesive | ThermoFisher Scientific | CB40240 | |
| Seahorse Analyzer XFp | Agilent Technologies | S7802A | |
| Seahorse XFp Cell Culture Miniplate | Agilent Technologies | 103025-100 |
Références
- DeBerardinis, R. J., Lum, J. J., Hatzivassiliou, G., Thompson, C. B. The Biology of Cancer: Metabolic Reprogramming Fuels Cell Growth and Proliferation. Cell Metabolism. 7, 11-20 (2008).
- Ward, P. S., Thompson, C. B. Metabolic Reprogramming: A Cancer Hallmark Even Warburg Did Not Anticipate. Cancer Cell. 21, 297-308 (2012).
- Pavlova, N. N., Thompson, C. B. The Emerging Hallmarks of Cancer Metabolism. Cell Metabolism. 23, 27-47 (2016).
- Wise, D. R., Thompson, C. B. Glutamine addiction: a new therapeutic target in cancer. Trends in Biochemical Sciences. 35, 427-433 (2010).
- Kroemer, G., Pouyssegur, J. Tumor Cell Metabolism: Cancer's Achilles' Heel. Cancer Cell. 13, 472-482 (2008).
- Liberti, M. V., et al. A Predictive Model for Selective Targeting of the Warburg Effect through GAPDH Inhibition with a Natural Product. Cell Metabolism. 26, 648-659 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807(2015).
- Hermanova, I., et al. Pharmacological inhibition of fatty-acid oxidation synergistically enhances the effect of l-asparaginase in childhood ALL cells. Leukemia. 30, 209-218 (2016).
- Malandrino, M. I., et al. Enhanced fatty acid oxidation in adipocytes and macrophages reduces lipid-induced triglyceride accumulation and inflammation. American Journal of Physiology-Endocrinology and Metabolism. 308, E756-E769 (2015).
- Patella, F., et al. Proteomics-based metabolic modeling reveals that fatty acid oxidation (FAO) controls endothelial cell (EC) permeability. Molecular & Cellular Proteomics: MCP. 14, 621-634 (2015).
- Chowdhury, S. R., Djordjevic, J., Albensi, B. C., Fernyhough, P. Simultaneous evaluation of substrate-dependent oxygen consumption rates and mitochondrial membrane potential by TMRM and safranin in cortical mitochondria. Bioscience Reports. 36, e00286(2015).
- Simonnet, H., Vigneron, A., Pouysségur, J. Conventional Techniques to Monitor Mitochondrial Oxygen Consumption. Methods in Enzymology. 542, 151-161 (2014).
- Martínez-Reyes, I., et al. TCA Cycle and Mitochondrial Membrane Potential Are Necessary for Diverse Biological Functions. Molecular Cell. 61, 199-209 (2016).
- Sukumar, M., et al. Mitochondrial Membrane Potential Identifies Cells with Enhanced Stemness for Cellular Therapy. Cell Metabolism. 23, 63-76 (2016).
- Wundenberg, T., Grabinski, N., Lin, H., Mayr, G. W. Discovery of InsP6-kinases as InsP6-dephosphorylating enzymes provides a new mechanism of cytosolic InsP6 degradation driven by the cellular ATP/ADP ratio. The Biochemical Journal. 462, 173-184 (2014).
- Morciano, G., et al. Use of luciferase probes to measure ATP in living cells and animals. Nature Protocols. 12, 1542-1562 (2017).
- Chau, M. D. L., Gao, J., Yang, Q., Wu, Z., Gromada, J. Fibroblast growth factor 21 regulates energy metabolism by activating the AMPK-SIRT1-PGC-1alpha pathway. Proceedings of the National Academy of Sciences of the United States of America. , 12553-12558 (2010).
- Lee, K. -H., et al. Targeting energy metabolic and oncogenic signaling pathways in triple-negative breast cancer by a novel adenosine monophosphate-activated protein kinase (AMPK) activator. The Journal of Biological Chemistry. 286, 39247-39258 (2011).
- Godlewski, J., et al. MicroRNA-451 Regulates LKB1/AMPK Signaling and Allows Adaptation to Metabolic Stress in Glioma Cells. Molecular Cell. 37, 620-632 (2010).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7, 1068-1085 (2012).
- Kaplon, J., et al. A key role for mitochondrial gatekeeper pyruvate dehydrogenase in oncogene-induced senescence. Nature. 498, 109-112 (2013).
- Pardee, T. S., et al. A phase I study of the first-in-class antimitochondrial metabolism agent, CPI-613, in patients with advanced hematologic malignancies. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 20, 5255-5264 (2014).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death and Differentiation. 24, 1239-1252 (2017).
- Hrušák, O., Porwit-MacDonald, A. Antigen expression patterns reflecting genotype of acute leukemias. Leukemia. 16, 1233-1258 (2002).
- Amin, H. M., et al. Having a higher blast percentage in circulation than bone marrow: clinical implications in myelodysplastic syndrome and acute lymphoid and myeloid leukemias. Leukemia. 19, 1567-1572 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon