Method Article
Bewertung des metabolischen Profils der primäre Leukämie-Zellen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll für die Isolierung der leukämischen Zellen aus dem Knochenmark Leukämie Patienten und Analyse ihrer metabolischen Zustand. Bewertung des metabolischen Profils der primäre Leukämie-Zellen könnte dazu beitragen, um die Nachfrage von Primärzellen besser zu charakterisieren und könnte bis zu mehr personalisierte Medizin.
Zusammenfassung
Die metabolische Anforderung von Krebszellen kann überleben und die Wirksamkeit der Behandlung negativ beeinflussen. Heutzutage ist die pharmazeutische Ausrichtung der Stoffwechselwege in vielen Arten von Tumoren getestet. Charakterisierung von Krebs Zelle metabolische Setup ist also unumgänglich, um gezielt den richtigen Weg, um das Gesamtergebnis des Patienten zu verbessern. Leider in der Mehrzahl der Krebserkrankungen, die bösartigen Zellen sind ziemlich schwierig, in größerer Zahl zu erhalten und die Gewebeentnahme ist erforderlich. Leukämie ist eine Ausnahme, wo eine ausreichende Anzahl an leukämischen Zellen aus dem Knochenmark isoliert werden. Hier bieten wir ein detailliertes Protokoll für die Isolierung der leukämischen Zellen aus dem Knochenmark Leukämie Patienten und anschließende Analyse ihrer metabolischen Zustand mit extrazellulären Flux-Analyzer. Leukämischen Zellen sind durch die Dichtegradienten isoliert, die ihre Lebensfähigkeit nicht beeinträchtigt. Anbau als nächstes hilft sie zu regenerieren, damit der metabolische Zustand gemessen ist der Zustand der Zellen unter optimalen Bedingungen. Dieses Protokoll ermöglicht konsistente, gut standardisierte Ergebnisse, die für die personalisierte Therapie genutzt werden könnten.
Einleitung
Die metabolischen Profils ist eines der Hauptmerkmale von Zellen und veränderten Bioenergetik gelten jetzt als eines der Markenzeichen von Krebs1,2,3. Darüber hinaus könnten Veränderungen im Stoffwechsel-Setup bei der Behandlung von Krebs durch gezielte Transduktion Signalwege oder enzymatische Maschinerie der Krebs Zellen4,5,6verwendet werden. Zu wissen, die metabolische Veranlagung von Krebszellen ist also ein Vorteil und kann helfen, die aktuelle Therapie zu verbessern.
Es gibt eine Fülle von bereits etablierten Methoden, die die Stoffwechselaktivität der Zellen in Kultur beurteilen können. Über Glykolyse, Glukoseaufnahme kann gemessen werden durch die radioaktive Markierung mit 2-NBDG (2-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-yl)Amino)-2-Deoxyglucose) oder extrazellulären Laktatwerte gemessen enzymatisch7,8. Fettsäure-Oxidationsrate ist ein anderer metabolischer Parameter gemessen isotopisch beschriftete Palmitat9,10. Sauerstoff-Verbrauch ist eine Methode zur Bestimmung der mitochondrialen Aktivität in den Zellen11,12, zusammen mit der mitochondrialen Membran mögliche Bewertung13,14, ATP/ADP (Adenosin am meisten benutzt 5 '-Triphosphat/Adenosin-5′-diphosphat) Verhältnis Messung15 oder insgesamt intrazellulären ATP Messung16. Signalwege, die bekanntermaßen Stoffwechselvorgänge regulieren konnte vom Protein Quantifizierungen festgestellt werden und kann das Verständnis der metabolischen Messungen17,18,19verbessern.
Aber alle diese Methoden messen nur eine oder im besten Fall ein paar metabolische Parametern in einer Probe gleichzeitig. Wichtig ist, kann die gleichzeitige Messung der Sauerstoff-Verbrauch (OCR) und extrazelluläre Übersäuerung (ECAR) durch die extrazelluläre Flux-Analyse durch, z.B. Seepferdchen XFp Analyzer erreicht werden. OCR ist ein Indikator für die mitochondriale Atmung und ECAR ist vor allem das Ergebnis der Glykolyse (CO2 -Produktion möglicherweise erhebt ECAR Zellen mit hohen Oxidative Phosphorylierung Tätigkeit können wir nicht ignorieren)20. Bisher wurden verschiedene Zelltypen untersucht, mit diesen Analysatoren21,22,23.
Hier beschreiben wir das Protokoll für die extrazelluläre Flussmittel Analyse der primären Blasten (Leukämiezellen abgeleitet aus den unreifen hämatopoetische Phase) von Leukämie-Patienten. Nach bestem Wissen und gewissen ist ein spezielles Protokoll für primäre Blasten noch nicht verfügbar.
Protokoll
Alle Proben stammen die Patienteneinverständnis der Eltern oder Erziehungsberechtigten der Kinder mit Zustimmung der Ethikkommission der Karlsuniversität in Prag, Tschechische Republik, die Studie keine. NV15-28848A.
1. Vorbereitung der Reagenzien
- Bereiten Sie 500 mL PBS durch Auflösen von 137 mM NaCl, 2,7 mM KCl, 4,3 mM Na2HPO4, 1,47 mM KH2PO4in DdH2O. anpassen der pH-Wert 7,4 mit HCl. entkeimen durch Autoklavieren vor.
- 100 mL RPMI Medium vorbereiten: RPMI-1640 Medium mit L-Alanyl-Glutamin ergänzt mit 10 % fetalen bovine Serum (FBS), Penicillin (100 U/mL) und Streptomycin (100 μg/mL).
- 50 mL 0,1 M Nahco33 in destilliertem Wasser vorzubereiten. Stellen Sie den pH-Wert auf 8.1, Filter (0,22 μm) zu sterilisieren und Lagerung bei 4 ° C.
Hinweis: Für zwei 8-Brunnen extrazelluläre Flussmittel Analyzer Platten, bereiten Sie 250 μl 0.1 M Nahco33 pH 8.1 vor. - Bereiten Sie 1 mL 2 M D-Glucose in destilliertem Wasser. Filter (0,22 μm) zu sterilisieren und Lagerung bei-20 ° C.
- Bereiten Sie 100 μl 1 mm Oligomycin A in Ethanol. Filter (0,22 μm) zu sterilisieren und Lagerung bei-20 ° C.
- Bereiten Sie 250 μL 1 M 2-Deoxy-D-Glucose (2-DG) in minimalen DMEM (Dulbeccos geändert Eagle Medium). Auf 37 ° C warm und passen Sie den pH auf 7,4 (durchführen von pH-Messung bei 37 ° C). Filter (0,22 μm) zu sterilisieren und Lagerung bei-20 ° C.
- Bereiten Sie 100 μl 1 mm FCCP (Carbonyl Zyanid-p-Trifluoromethoxyphenylhydrazone) in DMSO. Filter (0,22 μm) zu sterilisieren und Lagerung bei-20 ° C.
- Bereiten Sie 100 μl 1 mm Rotenon in Ethanol. Filter (0,22 μm) zu sterilisieren und Lagerung bei-20 ° C.
- Bereiten Sie 100 μL von 1 mg/mL Antimycin A in Ethanol. Filter (0,22 μm) zu sterilisieren und Lagerung bei-20 ° C.
- Kurz vor dem Gebrauch bereiten Sie 10 mL der Glykolyse Stresstest Medium vor. Erwärmen Sie minimale DMEM auf 37 ° C im Wasserbad und passen Sie den pH auf 7,4 (durchführen von pH-Messung bei 37 ° C).
- Bereiten Sie vor dem Gebrauch 10 mL Zelle Mito Stresstest Medium mit BSA. Minimale DMEM mit 2 mM L-Glutamin, 10 mM D-Glucose, 1 mM HEPES (pH-Wert 7,4), 1 mM Pyruvat und 0,1 % BSA (bovine Serum Albumin) ergänzen. Auf 37 ° C im Wasserbad erwärmen Sie und passen Sie den pH auf 7,4 (durchführen von pH-Messung bei 37 ° C).
- Bereiten Sie vor dem Gebrauch 10 mL Zelle Mito Stresstest Medium ohne BSA. Minimale DMEM mit 2 mM L-Glutamin, 10 mM D-Glucose, 1 mM HEPES (pH 7,4) ergänzen und 1 mM Pyruvat. Erwärmen Sie Zelle Mito Stresstest Medium ohne BSA auf 37 ° C im Wasserbad und passen Sie den pH auf 7,4 (durchführen von pH-Messung bei 37 ° C).
Hinweis: BSA auf der Zelle Mito Stresstest Medium hinzugefügt, da die Zellen besser auf FCCP zu reagieren, wenn das Medium mit BSA ergänzt wird (verschiedene Bedingungen getestet wurden). Zelle Mito Stresstest Medium ohne BSA dient zum Laden der Häfen, wie vom Hersteller nicht empfohlen wird mit BSA im Medium.
2. Isolierung von mononukleären Zellen aus dem Knochenmark
Hinweis: Im Idealfall sollte Messung der metabolischen Zustand des primären Leukämie-Zellen sofort nach Knochenmark Sammlung und Zelle Isolation starten. Dennoch konnte relevante Daten auch ermittelt werden, aus den Zellen isoliert nach Transport von anderen Hämatologie-in der Tschechischen Republik Zentren. Führen Sie alle Teilschritte in eine sterile Gewebekultur Kapuze.
- PBS und das Dichte Gradienten Medium auf Zimmertemperatur aufwärmen.
- Verdünnen der Knochenmarkprobe Leukämie-Patienten mit PBS, in einem Verhältnis von 1:1. Stellen Sie sicher, dass die Probe mindestens 80 % der leukämischen Blasten enthält.
- Bestimmen Sie den Anteil der Blasten durch Durchflusszytometrie mit bestimmten CD-Markern für Immunophenotype Charakterisierung von Zelltypen. Nach gradient Dichtetrennung Nukleinsäure-positive Ereignisse mit einem nuklearen Farbstoff zu erkennen um die gesamte Zellzahl zu etablieren.
- Bestimmen Sie anschließend mit speziellen CD-Markern für jede Art von Leukämie Leukämie-Zellen: B-ALL (CD19, CD45), T-ALL (CD3, CD4, CD8, CD5, CD7, CD99) und AML (CD45, CD33 und spezifische myeloischer Marker)24. Teilen Sie die Zahl der Leukämiezellen für spezifische CD Marker positiv von allen nuklearen Zellen zu bestimmen, den Anteil der Leukämiezellen Blast.
Hinweis: Das Knochenmark hat in die Röhrchen mit Antikoagulanzien gesammelt werden. - Sorgfältig Schicht 6 mL verdünnten Knochenmarkprobe über 6 mL des Dichte Gradienten Mediums in einem 15 mL konische Röhrchen. Zentrifugieren Sie bei 400 X g für 35 min bei 4 ° C in ein Schwingen-Eimer-Rotor ohne Bremse.
Hinweis: Größere Volumen der Probe konnte in mehr Aliquote unterteilt werden oder 50 mL konische Rohr mit der größeren Dichte Gradienten Medium eingesetzt werden. - Übertragen Sie die Interphase-Schicht besteht aus mononukleären Zellen (Abbildung 1) mit einer Pasteurpipette, sorgfältig auf eine neue konische 50 mL-Tube mit 5 mL PBS werden. Zentrifugieren Sie bei 400 × g für 10 min bei 4 ° C in ein Schwingen-Eimer-Rotor.
Hinweis: Übertragen Sie alle mononukleären Zellschichten in ein einzelnes 50 mL konische Röhrchen mit 5 mL PBS - Den Überstand abgesaugt und Aufschwemmen der Zelle Pellet in 2 mL sterile PBS. Zählen Sie die Zellen mit einem Hemocytometer.
Hinweis: Die Zahl der Leukämiezellen in 1 mL von angesaugte Knochenmark unterscheidet sich erheblich zwischen Patienten25.
3. Übernachtung Kultivierung von mononukleären Zellen
Hinweis: Führen Sie alle Teilschritte in einem sterilen Gewebekultur-Haube.
- Bereiten Sie zwei T75 Fläschchen mit 20 mL RPMI. Fügen Sie zu jedem Kolben 30 x 106 isoliert mononukleären Zellen hinzu. Inkubieren Sie die Zellen mit den Kolben aufstehen für 16 – 24 h um 5 % CO2 und 37 ° c
4. Vorbereitung der Zellplatten Klebstoff beschichtet
- Zwei 8-Brunnen extrazelluläre Flussmittel Analyzer Platten zu beschichten.
Hinweis: Führen Sie die Beschichtung in einem sterilen Gewebekultur-Haube. - 2.2 μL der Zelle Klebstoff hinzufügen (Dichte: 2,54 mg/ml) zu 250 μl 0.1 M Nahco33, pH 8,1 und Pipette sofort 12,5 μl der Lösung in jede Vertiefung.
Hinweis: Lager Klebelösungen Zelle kann unterscheiden sich in ihrer Dichte, die Lautstärke entsprechend Nahco33 hinzugefügt. - Lassen Sie die Platten sitzen in der Haube für ca. 20 min, dann Aspirieren des Zelle Klebstoffs und jeweils gut zweimal mit 200 μL steriles Wasser zu waschen. Lassen Sie es sich in der Haube bei geöffnetem Deckel bis Brunnen trocken sind.
- Verwenden Sie die Platten direkt oder sparen Sie bis zu 1 Woche bei 4 ° C mit der Felge in Paraffin Film zur Vermeidung von Kondensation gewickelt. Sicherstellen Sie, dass die Platten auf bei Raumtemperatur (ca. 20 min) in der Haube erwärmt werden vor der Aussaat der Zellen.
5. die Hydratation der Sensorkassette
Hinweis: Hydrat zwei 8-Brunnen extrazelluläre Flussmittel Analyzer Patronen.
- Trennen Sie das Dienstprogramm-Platte und der Sensorkassette. Legen Sie die Sensor-Steckmodul umgedreht auf dem Labortisch.
- Füllen Sie jeweils auch der Dienstprogramm-Platte mit 200 μL Kalibrator. Füllen Sie jeder Graben um die Außenseite der Brunnen mit 400 μl der Kalibrator.
- Das Dienstprogramm-Platte, die jetzt den Kalibrator enthält zurückzukehren Sie der Sensorkassette.
- Legen Sie die Patrone Versammlung in eine befeuchtete, nicht-CO2, 37 ° C Inkubator über Nacht.
- Schalten Sie den extrazellulären Flux-Analyzer und lassen Sie es warm auf 37 ° C über Nacht.
(6) Aussaat Zellen in Zellplatten Klebstoff beschichtet
Hinweis: Für die Glykolyse Stresstest, verwenden Sie Glykolyse Stresstest Medium. Verwenden Sie für Zelle Mito Stresstest Zelle Mito Stresstest Medium mit BSA.
- Samenzellen für die Glykolyse-Stress-Test und die Zelle Mito Stresstest in separaten Platten. Verwenden Sie für jeden Test Zellen aus einer Flasche mit Übernachtung Kultur.
- Zentrifugieren Sie Zellen bei 200 X g für 5 min bei Raumtemperatur. Zellen in 1 mL des entsprechenden Mediums Aufschwemmen und sie zählen.
- Der letzte Band der 400 μl (Verwendung in anderer geeigneter Form) 4 x 106 von lebenden Zellen hinzufügen.
- Platte 50 μL der Zellsuspension in Brunnen B-G. Sicherstellen Sie, dass in einem gut 500.000 Zellen ausgesät werden.
Anmerkung: Es ist wichtig, genau 500.000 Zellen pro Bohrloch Saatgut wie keine andere Normalisierung durchgeführt wird. Auf diese Weise können die Ergebnisse von anderen Patienten verglichen werden. Die optimale Anzahl von Wiederholungen ist sechs, wie hier beschrieben ist. Mit weniger Wiederholungen wird nicht empfohlen, da Primärzellen manchmal fälschlicherweise Verhalten konnten. - Fügen Sie 180 μL des entsprechenden Mediums in Vertiefungen A und H (diese Brunnen dienen als eine Hintergrundkorrektur).
- Zentrifugieren Sie die Platte 400 X g für 5 min bei Raumtemperatur mit Bremse auf 1 gesetzt.
- Brunnen B-G in zwei 8-Brunnen extrazelluläre Flussmittel Analyzer Platten fügen Sie 130 μL des entsprechenden Mediums langsam und vorsichtig hinzu. Bestätigen Sie visuell, dass die Zellen durch Betrachtung unter dem Mikroskop stabil auf den Boden der Näpfchen eingehalten werden.
- Stellen Sie die Platte in eine feuchte, nicht-CO2und 37 ° C Inkubator für 30 min.
7. laden die Sensor-Steckmodul
- Bereiten Sie für den Stresstest Glykolyse 250 μL jeder der 100 mM Glukose, 20 μM Oligomycin A und 1 M 2-DG, alles in Glykolyse Stresstest Medium.
- Die Zelle Mito-Stress-Test Vorbereitung 250 μL jeder von 20 μM Oligomycin A, 15 μM FCCP, 30 μM FCCP und einer Mischung von 10 μM Rotenon und 10 μg/ml Antimycin A, alle in Zelle Mito Stresstest Medium ohne BSA.
Hinweis: Injektion von zwei Konzentrationen von FCCP in einem Assay wird empfohlen, da es nicht genug Patienten Material für die FCCP Titration. Dennoch sollten die Konzentrationen der Forscher ermittelt werden. - Laden Sie die Verbindungen in den entsprechenden Injektor Häfen der Patrone wie folgt (Tabelle 1):
8. Einrichten des Programms
- Richten Sie für den Stresstest Glykolyse das Programm wie in Tabelle 2beschrieben.
- Richten Sie für die Zelle Mito-Stress-Test das Programm wie in Tabelle 3beschrieben.
- Starten Sie das Programm. Die Kalibrator Platte mit der Assay-Platte (Aufforderung) zu ersetzen.
9. Auswertung und Interpretation der Ergebnisse
- In die Glykolyse Stresstest-Ergebnisse Subtrahieren des niedrigsten ECAR-Wertes nach 2-DG Injektion von anderen ECAR-Werten.
Hinweis: Dieser niedrigsten Wert stellt die nicht-glykolytische Übersäuerung. In der Regel ist der niedrigste Wert von 4th -Messung. - Berechnen Sie basale Versauerung, Glykolyse, maximale Glykolyse und glykolytische Reserve Parameter von glykolytische Funktion (Abbildung 2A). Nach Abzug des niedrigsten Wertes der ECAR, berechnen basale Versauerung als Mittel der ECAR aus den ersten drei Messpunkten (weglassen den ersten ECAR Wert, es unterscheidet sich wesentlich von den anderen beiden), Glykolyse als Mittel der ECAR aus drei Messung berechnen Punkte nach Glukose-Injektion und maximale Glykolyse zu berechnen, wie ein Mittelwert von ECAR aus drei Messungen nach Oligomycin eine Injektion weist. Berechnen Sie Glycolytic Reserve als maximale Glykolyse minus Glykolyse.
Hinweis: Alternativ für maximale Glykolyse Berechnung verwenden Sie den höchsten ECAR-Wert aus den drei Punkten gemessen. - Subtrahieren Sie in die Zelle Mito Stresstest-Ergebnisse den niedrigsten Wert der OCR nach Rotenone/Antimycin A Injektion von anderen OCR-Werten.
- Basalen Atmung, ATP-Produktion, maximale Atmung und Kapazitätsreserven Parameter von mitochondrialen Funktion (Abb. 2 b) zu berechnen. Nach Abzug des niedrigsten Wertes der OCR, basale Atmung als Mittel der OCR aus den ersten drei Messpunkten zu berechnen.
Hinweis: Maximale Atmung ist der höchste Wert der OCR nach FCCP Injektion. - Subtrahieren Sie für die ATP-Produktion-Berechnung den Mittelwert der drei OCR Messpunkte nach Oligomycin A Injektion von basaler Atmung. Freie Kapazitäten als die maximale Atmung abzüglich der basalen Atmung zu berechnen.
Hinweis: Berechnen Sie immer die maximale Atmung aus der OCR Wert, unabhängig von der verwendeten Konzentration FCCP.
Ergebnisse
Abbildung 3 zeigt die Kurven nach Glykolyse Stresstest und Zelle Mito Stresstest Messungen der leukämischen Blasten aus dem BCP-ALL (B-Zelle Vorläufer akute lymphoblastische Leukämie) und AML (akute myeloische Leukämie) Patienten. Die Berechnung der metabolischen Parametern aus diesen Messungen wird ebenfalls angezeigt. 500.000 Zellen pro Bohrloch wurden ausgesät und alle Messungen erfolgten in Hexaplicates.
In der Glykolyse-Stress-Test ist das nur basale Medium genutzt, so dass die Zellen Nährstoffe beraubt werden. Der erste Parameter erhalten ist die basale Übersäuerung, die die Menge an Glukose in Zellen gespeichert widerspiegeln sollte. Nach der ersten Injektion ist ECAR erhöht, da Zellen Glukose zu nutzen und um Laktat gären können. Oligomycin A in der zweiten Injektion hemmt die ATP-Synthase und damit die Zellen ATP produzieren überwiegend über Glykolyse leitet. Dadurch sollte weiter Höhe von ECAR. Injektion von 2-DG vollständig hemmt Glykolyse und ECAR sinkt.
In der Zelle Mito-Stress-Test ein Medium ergänzt mit Glutamin und Glukose verwendet werden, so dass die Zellen sind nicht alle Nährstoffe beraubt und der basalen Atmung Parameter spiegelt ihre basalen metabolischen Zustand. Nach der ersten Injektion mit Oligomycin A Zellen hemmen mitochondriale Atmung und wechseln Sie zur Glykolyse, die als eine Abnahme von OCR dargestellt wird. FCCP (der zweiten und dritten Injektion), entkoppelt auf der anderen Seite ATP-Produktion von Atmung, so dass die Zellen jetzt Sauerstoff mit einer maximalen Rate und OCR-Aufstieg auf den höchsten Wert verbrauchen. Die letzte Injektion Rotenon und Antimycin A-Gemisch vollständig hemmt die mitochondriale Atmung und OCR ist nahe Null gesunken.

Abbildung 1: Dichte Gradienten Zentrifugation von der Knochenmarkprobe. Mononukleäre Zellen für leukämischen Zellen angereichert werden durch Dichte Gradienten Medium getrennt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Gliederung der Glykolyse Stresstest und Zelle Mito Stress Test (A) vorbildliche Ergebnis der Glykolyse-Stress-Test. (B) vorbildliche Ergebnis der Zelle Mito-Stress-Test. Parameter werden in den Kurven angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
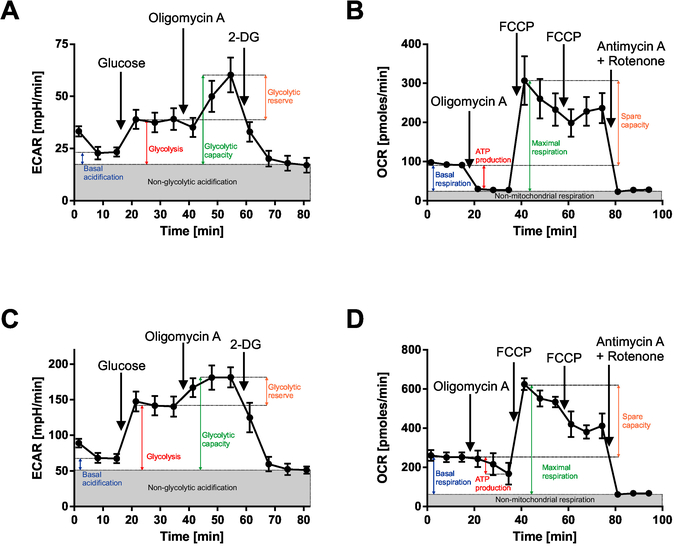
Abbildung 3: extrazelluläre Flussmittel Analyse der leukämischen Blasten von BCP-ALL (A, B) und AML (B, C) Patient. (A und C) Glykolyse Stresstest-Ergebnisse. Bitte beachten Sie, dass der erste Messpunkt erheblich vom Rest unterscheiden kann und in diesem Fall aus der Analyse ausgeschlossen werden sollte. (B und D) Zelle Mito-Stresstest-Ergebnisse. Parameter werden in den Kurven angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Hafen | Glykolyse-Stress-test | Zelle-Mito-Stress-test | ||
| Laden zum Hafen | Endkonzentration in den Vertiefungen | Laden zum Hafen | Endkonzentration in den Vertiefungen | |
| A | 20 μl der 100 mM Glukose | 10 mM Glukose | 20 μL von 20 μM Oligomycin A | 2 μM Oligomycin A |
| B | 22 μL von 20 μM Oligomycin A | 2 μM Oligomycin A | 22 μL von 15 μM FCCP | 1.5 ΜM FCCP |
| C | 25 μL 1 M 2-DG | 100 mM 2-DG | 25 μL von 30 μM FCCP | 4,5 ΜM FCCP |
| D | X | 25 μL von 10 μM Rotenon und 10 μg/ml Antimycin A | 1 μM Rotenon und 1 μg/ml Antimycin A | |
Tabelle 1: Zusammengesetzte Bände.
| Schritt | Einstellungen |
| Kalibrierung | Automatisch |
| Gleichgewichtherstellung | Automatisch |
| Baseline-Messung | Dreimal: Mix-3 min, warten – 0 min, Maßnahme-3 min |
| Injektion von Anschluß A | Injektion |
| Messung | Dreimal: Mix-3 min, warten – 0 min, Maßnahme-3 min |
| Injektion von Port B | Injektion |
| Messung | Dreimal: Mix-3 min, warten – 0 min, Maßnahme-3 min |
| Injektion von Port C | Injektion |
| Messung | Vier Mal: Mix-3 min, warten – 0 min, Maßnahme-3 min |
Tabelle 2: Programm für Glykolyse Stresstest.
| Schritt | Einstellungen |
| Kalibrierung | Automatisch |
| Gleichgewichtherstellung | Automatisch |
| Baseline-Messung | Dreimal: Mix-3 min, warten – 0 min, Maßnahme-3 min |
| Injektion von Anschluß A | Injektion |
| Messung | Dreimal: Mix-3 min, warten – 0 min, Maßnahme-3 min |
| Injektion von Port B | Injektion |
| Messung | Dreimal: Mix-3 min, warten – 0 min, Maßnahme-3 min |
| Injektion von Port C | Injektion |
| Messung | Dreimal: Mix-3 min, warten – 0 min, Maßnahme-3 min |
| Injektion von Port D | Injektion |
| Messung | Dreimal: Mix-3 min, warten – 0 min, Maßnahme-3 min |
Tabelle 3: Programm für Zelle Mito-Stress-Test.
Diskussion
Das oben beschriebene Protokoll ermöglicht die Messung der Stoffwechselaktivität von OCR und ECAR Werte in primären leukämischen Blasten abgeleitet von Patienten mit akute lymphoblastische Leukämie (ALL) bewertet oder akute myeloische Leukämie (AML). Der Vorteil der Messung mit einer extrazellulären Flux-Analyzer ist, dass es die Erkennung von metabolischen Profils in Echtzeit in lebenden Zellen ermöglicht. Jeder Schritt in das angegebene Protokoll konnte im wesentlichen je nach Zelltyp angepasst werden, was man studieren will. Hier besprechen wir die wichtigsten Parameter die Ergebnisse beeinflussen könnten und könnte weniger als optimalen Werte liefern.
Der erste Schritt zur Optimierung war ein Vergleich der Daten aus frischem Material Vs eingefroren Material. Die Fähigkeit, die metabolische Aktivität aus dem gefrorenen Material messen würde Retrospektive Studien Patienten Proben in flüssigem Stickstoff Bank gespeicherten ermöglichen. Bei allen Proben konnten wir konsistente Stoffwechselaktivität nur aus frischem Material zu erkennen, während AML Zellen auch nach de-Gefrieren mit optimalen Ergebnissen gemessen wurden.
Der zweite Schritt zur Optimierung ist der Anbau von primären leukämischen Blasten. Wir haben die Stoffwechselaktivität der Zellen direkt nach der gradient Dichtetrennung (ohne Kultivierung) oder Kultivierung über Nacht getestet. Auch wenn die Zellen nach der gradient Dichtetrennung lebensfähig und vital unter dem Mikroskop sah, ihre Stoffwechselaktivität beeinträchtigt wurde. Insgesamt waren ECAR und OCR Werte niedriger und auch nach der Injektion, OCR oder ECAR Werte reagierte nicht optimal wie in kultivierten Zellen.
Anbau unter verschiedenen Bedingungen kann auch die Ergebnisse beeinflussen. Mit Insulin Transferrin Natrium Selenit Ergänzung (ITS) gilt als eine gute Praxis beim Anbau von primären8 Blasten, aber diese Ergänzung die Stoffwechselaktivität der Zellen stört. Während Zelle Mito Belastungstests leukämischen Blasten kultiviert mit ITS reagierte nicht auf Oligomycin A (OCR sollte verringern, um ATP-linked Atmung zu berechnen). Wir haben auch versucht, die Zellen mit mesenchymalen Stammzellen (MSC) gemeinsam zu kultivieren, aber in diesem Fall OCR und ECAR Werte wurden niedriger verglichen und die Zellen ohne MSCs kultiviert. Zusammenfassend lässt sich sagen, Anbau von primären Blasten von Leukämie-Patienten in RPMI Medium mit 10 % FBS ist die beste Option.
Geeignet für die Charakterisierung des metabolischen Profils des Patienten müssen bestimmte Kriterien erfüllen, die auf einer Hand begrenzen die Anzahl der getesteten Proben aber andererseits relevante Ergebnisse zu erhalten. Wir haben die metabolische Funktion des Patienten mit hohen Zellularität gemessen (für eine Messung wir 500.000 Zellen ausgesät / pro Brunnen in Hexaplicate) und nur Proben mit 80 und einen höheren Anteil an leukämischen Blasten gemessen werden können, um die Erkennung von unspezifischen zu vermeiden metabolische Aktivität von anderen Zelltypen in der Suspension vorhanden.
Einer der entscheidenden Schritte in der Datenanalyse ist die Normalisierung, so dass Stoffwechselparameter zwischen verschiedenen leukämischen Proben verglichen werden konnten. Nach unserer vorherigen Experimenten mit leukämischen Zelllinien fanden wir, dass die Normierung auf die Anzahl der Zellen die besten Ergebnisse liefert. Die konkrete Anzahl der Zellen pro Bohrloch muss der Forscher bestimmt werden und hängt von der Größe und Stoffwechselaktivität der getesteten Zellen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir möchten den tschechischen Pediatric Hematology Zentren zu danken. Diese Arbeit wurde unterstützt durch Grant des Gesundheitsministeriums (NV15-28848A), vom Gesundheitsministerium der Tschechischen Republik, University Hospital Motol, Prag, Tschechische Republik 00064203 und vom Ministerium für Bildung, Jugend und Sport NPU ich nr. LO1604.
Materialien
| Name | Company | Catalog Number | Comments |
| RPMI 1640 Medium, GlutaMAX Supplement | Gibco, ThermoFisher Scientific | 61870-010 | |
| Fetal Bovine Serum | Biosera | FB-1001/100 | |
| Antibiotic-Antimycotic (100x) | Gibco, ThermoFisher Scientific | 15240-062 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761-500G | |
| D-(+) Glucose | Sigma-Aldrich | G7021-100G | |
| Oligomycin A | Sigma-Aldrich | 75351-5MG | |
| 2-Deoxy-D-glucose | Sigma-Aldrich | D8375-1G | |
| FCCP | Sigma-Aldrich | C2920-10MG | |
| DMSO | Sigma-Aldrich | D8418-100ML | |
| Rotenone | Sigma-Aldrich | R8875-1G | |
| Antimycin A from Streptomyces sp. | Sigma-Aldrich | A8674-25MG | |
| Seahorse XF Base Medium, 100 mL | Agilent Technologies | 103193-100 | |
| L-glutamine solution, 200 mM | Sigma-Aldrich | G7513-100ML | |
| HEPES solution, 1 M, pH 7.0-7.6 | Sigma-Aldrich | H0887-100ML | |
| Sodium pyruvate | Sigma-Aldrich | P5280-25G | |
| Bovine Serum Albumin | Sigma-Aldrich | A2153-10G | |
| Ficoll-Paque Plus | Sigma-Aldrich | GE17-1440-02 | Density gradient medium |
| Seahorse XFp FluxPak | Agilent Technologies | 103022-100 | |
| Corning™ Cell-Tak Cell and Tissue Adhesive | ThermoFisher Scientific | CB40240 | |
| Seahorse Analyzer XFp | Agilent Technologies | S7802A | |
| Seahorse XFp Cell Culture Miniplate | Agilent Technologies | 103025-100 |
Referenzen
- DeBerardinis, R. J., Lum, J. J., Hatzivassiliou, G., Thompson, C. B. The Biology of Cancer: Metabolic Reprogramming Fuels Cell Growth and Proliferation. Cell Metabolism. 7, 11-20 (2008).
- Ward, P. S., Thompson, C. B. Metabolic Reprogramming: A Cancer Hallmark Even Warburg Did Not Anticipate. Cancer Cell. 21, 297-308 (2012).
- Pavlova, N. N., Thompson, C. B. The Emerging Hallmarks of Cancer Metabolism. Cell Metabolism. 23, 27-47 (2016).
- Wise, D. R., Thompson, C. B. Glutamine addiction: a new therapeutic target in cancer. Trends in Biochemical Sciences. 35, 427-433 (2010).
- Kroemer, G., Pouyssegur, J. Tumor Cell Metabolism: Cancer's Achilles' Heel. Cancer Cell. 13, 472-482 (2008).
- Liberti, M. V., et al. A Predictive Model for Selective Targeting of the Warburg Effect through GAPDH Inhibition with a Natural Product. Cell Metabolism. 26, 648-659 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807(2015).
- Hermanova, I., et al. Pharmacological inhibition of fatty-acid oxidation synergistically enhances the effect of l-asparaginase in childhood ALL cells. Leukemia. 30, 209-218 (2016).
- Malandrino, M. I., et al. Enhanced fatty acid oxidation in adipocytes and macrophages reduces lipid-induced triglyceride accumulation and inflammation. American Journal of Physiology-Endocrinology and Metabolism. 308, E756-E769 (2015).
- Patella, F., et al. Proteomics-based metabolic modeling reveals that fatty acid oxidation (FAO) controls endothelial cell (EC) permeability. Molecular & Cellular Proteomics: MCP. 14, 621-634 (2015).
- Chowdhury, S. R., Djordjevic, J., Albensi, B. C., Fernyhough, P. Simultaneous evaluation of substrate-dependent oxygen consumption rates and mitochondrial membrane potential by TMRM and safranin in cortical mitochondria. Bioscience Reports. 36, e00286(2015).
- Simonnet, H., Vigneron, A., Pouysségur, J. Conventional Techniques to Monitor Mitochondrial Oxygen Consumption. Methods in Enzymology. 542, 151-161 (2014).
- Martínez-Reyes, I., et al. TCA Cycle and Mitochondrial Membrane Potential Are Necessary for Diverse Biological Functions. Molecular Cell. 61, 199-209 (2016).
- Sukumar, M., et al. Mitochondrial Membrane Potential Identifies Cells with Enhanced Stemness for Cellular Therapy. Cell Metabolism. 23, 63-76 (2016).
- Wundenberg, T., Grabinski, N., Lin, H., Mayr, G. W. Discovery of InsP6-kinases as InsP6-dephosphorylating enzymes provides a new mechanism of cytosolic InsP6 degradation driven by the cellular ATP/ADP ratio. The Biochemical Journal. 462, 173-184 (2014).
- Morciano, G., et al. Use of luciferase probes to measure ATP in living cells and animals. Nature Protocols. 12, 1542-1562 (2017).
- Chau, M. D. L., Gao, J., Yang, Q., Wu, Z., Gromada, J. Fibroblast growth factor 21 regulates energy metabolism by activating the AMPK-SIRT1-PGC-1alpha pathway. Proceedings of the National Academy of Sciences of the United States of America. , 12553-12558 (2010).
- Lee, K. -H., et al. Targeting energy metabolic and oncogenic signaling pathways in triple-negative breast cancer by a novel adenosine monophosphate-activated protein kinase (AMPK) activator. The Journal of Biological Chemistry. 286, 39247-39258 (2011).
- Godlewski, J., et al. MicroRNA-451 Regulates LKB1/AMPK Signaling and Allows Adaptation to Metabolic Stress in Glioma Cells. Molecular Cell. 37, 620-632 (2010).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7, 1068-1085 (2012).
- Kaplon, J., et al. A key role for mitochondrial gatekeeper pyruvate dehydrogenase in oncogene-induced senescence. Nature. 498, 109-112 (2013).
- Pardee, T. S., et al. A phase I study of the first-in-class antimitochondrial metabolism agent, CPI-613, in patients with advanced hematologic malignancies. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 20, 5255-5264 (2014).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death and Differentiation. 24, 1239-1252 (2017).
- Hrušák, O., Porwit-MacDonald, A. Antigen expression patterns reflecting genotype of acute leukemias. Leukemia. 16, 1233-1258 (2002).
- Amin, H. M., et al. Having a higher blast percentage in circulation than bone marrow: clinical implications in myelodysplastic syndrome and acute lymphoid and myeloid leukemias. Leukemia. 19, 1567-1572 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten