Method Article
Fractionnement subcellulaire de spécimens gastro-intestinal fraîches ou congelées
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici un protocole pour effectuer un simple fractionnement cellulaire pour la séparation subcellulaire des protéines cytoplasmiques et nucléaires dans des biopsies intestinales humaines fraîches ou congelées.
Résumé
Le but du présent protocole est de fractionner le tissu intestinal humain obtenu par endoscopie en compartiments nucléaires et cytoplasmiques pour l’analyse de la localisation des protéines spécifiques ou complexes de protéines dans les États de différents tissus (c'est-à-dire, en bonne santé contre la maladie). Cette méthode est utile pour le fractionnement des deux échantillons de tissu intestinal frais et surgelés ; Il est facilement accessible pour tous les laboratoires et pas beaucoup de temps.
Introduction
Les protéines participent à presque toutes les fonctions biologiques dans une cellule et toute variation dans leur structure, la quantité ou la localisation peut conduire à un scénario de pathogène. Méthodes de fractionnement des échantillons tissulaires sont une approche utile pour réduire la complexité des maladies liées à des analyses de protéines. Certaines études utilisent des informations de localisation de protéine ou enrichissent une protéine d’un compartiment cellulaire spécifique, un protocole pour le fractionnement des protéines intactes reproductible est donc utile de répondre à certaines questions biologiques. Déterminer la localisation sous-cellulaire des protéines et la surveillance de leurs interactions à basale ou redistribution compartimentale et pathologiques permettra d’identifier les maladies liées à des différences fonctionnelles1,2. Ainsi, cette méthode vise de façon reproductible fractionner des biopsies de tissu intestinal, frais et surgelés, en compartiments subcellulaires cytoplasmiques et nucléaires.
Des échantillons de biopsie intestinale sont régulièrement obtenus au cours de l’endoscopie procédures3 (Figure 1) et peuvent être utilisés efficacement pour la quantification des protéines ou des études de l’immunoprécipitation. Étant donné que les échantillons de tissus d’intestinales épithéliales contiendra des protéines qui peuvent être directement impliqués dans la pathogenèse de la maladie4, biopsies intestinales sont une source très précieuse pour l’identification réussie des propres à la maladie intestinale protéines. Des échantillons de tissus de surgelés, patient stockée ainsi que les renseignements cliniques sont des ressources utiles pour l’analyse des protéines, et une préparation simple et reproductible est un enjeu important de fournir des informations parcellaires cellule à l’aide de montants limitatifs de surgelés tissu5.
Il existe plusieurs kits disponibles dans le commerce pour la séparation des fractions cellulaires, mais ceux-ci sont plus chers et généralement plus long que le protocole présenté ici. Protocoles basés sur la centrifugation en gradient de plusieurs étapes et des gradients continus ont également servis antérieurement pour le fractionnement des divers compartiments cellulaires dans différents tissus6,7. Cependant, maintenir l’uniformité des gradients continus est souvent une tâche difficile. Protocoles similaires basées sur la lyse séquentielle des membranes ont été décrits précédemment mais dont ils ont besoin en général de plus de deux tampons et les mains à l’heure n’est plus8 .
Lorsque des échantillons de tissus de fractionnement, garder à l’esprit que le tissu des échantillons présents cellule-cellule et cellule-matrice des interactions qui ne sont pas présentes dans les cellules cultivées et important lors de l’extraction de protéines. La ventilation correcte entre cellules et matrice extracellulaire sans affecter la qualité de la protéine sera un facteur essentiel dans le tissu intestinal protéine isolement9. Dans ce protocole, cellule-cellule et cellule-matrice de contacts sont d’abord cassés, libérant les cellules et qui permet la mémoire tampon atteindre les cellules individuelles. Pour éviter les protéines-compartiment mélangés avant le fractionnement, la rupture des contacts doit se faire sans altérer l’intégrité des cellules ou les membranes nucléaires.
En raison de l’enrichissement de diverses protéases dans la muqueuse intestinale10, il est important de contrôler la dégradation des protéines durant l’extraction. Pour minimiser la dégradation potentielle de la protéine, inhibiteur de la protéase multiples doit être inclus dans les tampons d’extraction de protéine. En outre, si des extraits vont être utilisés pour les tests fonctionnels, il est essentiel pour éviter la dénaturation des protéines ou de protéolyse, car cela provoquerait une perte de protéines activité11. À cet effet, le protocole est réalisé à 4 ° C et fluorure phénylméthylsulfonyle fraîches (PMSF) est ajouté pour les tampons à une concentration finale de 0,1 mM juste avant de les utiliser davantage inhibe la protéolyse.
La première étape de fractionnement cellulaire est désorganisation tissulaire et la lyse cellulaire. Tel que mentionné précédemment, l’objectif est de séparer les cellules et la pause que les ouvrir avec le minimum de dommages. Échantillons de tissu intestinal doivent être homogénéisés, et les cellules lysées pour atteindre maximale rupture de la membrane cellulaire. Dans ce protocole, nous utilisons un mélangeur motorisé pilon pour briser le tissu intestinal qui est homogénéisé dans secondes au moyen d’action Vortex à haute vitesse. Après homogénéisation, les cellules des tissus sont incubés dans une mémoire tampon hypotonique qui fera éclater la membrane cellulaire, mais gardera les noyaux intacts, suivie par l’ajout d’un détergent non dénaturants (nonyl phenoxypolyethoxylethanol) et un court vortex pour séparer les noyaux de la fraction cytoplasmique. Après l’enlèvement du cytoplasme, la membrane du noyau cellulaire est fait irruption dans un tampon hypertonique avec agitation.
La méthode présentée ici est une méthode appropriée pour le fractionnement subcellulaire des frais et congelés des biopsies intestinales qui ont été obtenus au cours de procédures endoscopiques et comprise entre 2 et 10 mg en poids. Le protocole est simple et reproductible et pourrait être effectué à l’aide de matériel de laboratoire de base et des réactifs en moins d’une heure.
Protocole
Cette étude a été approuvée par le Comité d’éthique de Cruces University Hospital et analyses ont été effectuées après que le consentement éclairé a été obtenu de tous les sujets ou leurs parents.
1. biopsie Collection
Remarque : Les spécimens de biopsie du duodénum distal des patients sont obtenues au cours de l’endoscopie diagnostic systématique gérer les biopsies qui vont entre 2 et 10 mg de poids. Tissu biopsié est un tissu complex composé de différents types de cellules dont les cellules épithéliales, immunitaires et endothéliales. Gastroentérologie clinique effectuer l’endoscopie qui suit établit des lignes directrices cliniques.
- Placer la biopsie sur un papier filtre stérile juste après l’endoscopie.
- Forceps permet de transférer les biopsies dans des tubes de 1,5 mL, tremper avec du PBS et placez-le dans un cryotube.
- Garder les tubes sur la glace jusqu'à ce qu’ils arrivent au laboratoire.
- Commencer le traitement des biopsies frais immédiatement.
- Pour les biopsies congelés, flash geler la biopsie contenant des tubes et conserver dans l’azote liquide jusqu'à l’utilisation.
Remarque : Il est important de conserver l’échantillon congelé jusqu'à ce que le tampon complété froid 1 est ajouté.
2. préparation du tampon
Remarque : Avant de commencer, compléter les tampons comme suit.
- Ajouter 1 millimètre DTT (concentration finale) et la protéase et phosphatase inhibiteur de cocktail (1 x concentration finale) au tampon hypotonique 1 et hypertonique tampon 2 (tableau 1).
- Préparer le 1,5 mL de tampon 1 et 150 µL de tampon 2 par exemple. TNT n’empêchera l’oxydation des échantillons.
- Préparer des noyaux de tampon de lavage en ajoutant 1 % de détergent (nonyl phenoxypolyethoxylethanol) à une concentration finale de 0,1 % au tampon déjà complétée 1. Préparer 1 mL de tampon de lavage des noyaux par exemple.
3. biopsie homogénéisation
-
Biopsies fraîches
- Placez le pilon jetable dans le mélangeur motorisé. Veiller à ce que le pilon atteint le fond du tube.
- Prendre la biopsie le cryotube et le placer dans un tube de 1,5 mL avec un embout de la pipette.
- Ajouter 200 µL de tampon complété 1 dans le tube de 1,5 mL.
- Homogénéiser la biopsie avec le pilon jusqu'à ce que le tissu est complètement perturbé et le maintenir sur la glace.
- Une fois que toutes les biopsies sont homogénéisés, passez à l’étape 4.
Remarque : Pilons jetables doivent être changés entre les biopsies.
-
Biopsies congelés
ATTENTION : Manipuler l’azote liquide avec soin ; contact de l’azote liquide avec la peau ou les yeux peut causer des blessures graves de congélation. Protéger les mains et les yeux toujours lorsque vous travaillez avec de l’azote liquide.- Prenez quelques azote liquide dans une boîte pour stocker les cryotubes provient du réservoir d’azote.
- Trouver la biopsie dans le réservoir d’azote et placer le cryotube dans la boîte avec l’azote liquide. Répétez cette étape pour toutes les biopsies.
- Transférer la biopsie de la cryotube dans un tube de 1,5 mL.
Remarque : Les Biopsies seront attachés au tube congelé. Poussez la biopsie avec une pointe de pipette stérile si elle se détache du tube. - Ajouter 200 µL de tampon complété 1.
- Homogénéiser le tissu avec le pilon et le mortier jusqu'à ce que le tissu est complètement perturbé, maintenir la température à 4 ° C tout au long de toute la procédure.
Remarque : Ne pas laisser les biopsies à décongeler avant d’ajouter de la mémoire tampon.
4. cytoplasme isolement
- Incuber la biopsie homogénéisée sur glace pendant 10 min.
- Ajouter 10 µL de 1 % de détergent (nonyl phenoxypolyethoxylethanol) pour chaque échantillon à une concentration finale de 0,05 %.
NOTE : Les cellules seront gonflent et éclatent par lyse osmotique car la lessive va perturber la membrane cellulaire. - Incuber 5 minutes sur la glace.
- Vortex brièvement et centrifuger à 400 x g à 4 ° c pendant 2 min.
- Après avoir mélangé au Vortex, éliminer le surnageant et le transférer dans un nouveau tube propre 1,5 mL ; Il s’agit de la fraction cytoplasmique. Ne jetez pas le culot.
5. nucléaire isolement
- Resuspendre le culot de l’étape précédente avec 200 µL de tampon de lavage des noyaux.
- Centrifuger le tube pendant 2 min à 400 x g et 4 ° C.
- Jeter le surnageant et répétez la procédure de nettoyage deux fois plus.
Remarque : Les lavages supprimera la contamination cytoplasmique dans la fraction nucléaire. - Après le troisième lavage, resuspendre le culot dans 100 µL de tampon 2.
- Vigoureusement l’échantillon à 4 ° c pendant 30 min. par ailleurs, incuber l’échantillon sur la glace et vortex toutes les 5 min.
- Après agitation, centrifuger l’échantillon pendant 10 min à la vitesse supérieure (> 12 000 x g) et 4 ° C.
- Après agitation, transvaser le surnageant dans un nouveau 1.5 propre. tube de mL. Il s’agit de la fraction nucléaire.
6. Quantification des protéines
Remarque : Quantifier les protéines avec un kit de dosage bicinchoninic acid (BCA) protéine. La concentration des protéines dans les fractions se situe entre 0,5 et 5 µg/µL, étant plus bas dans la fraction nucléaire (voir le tableau 2 pour les concentrations de protéines résultantes de biopsies de 2 mg).
- Préparer la courbe d’étalonnage avec le suivant de montants (µg) d’albumine sérique bovine (BSA)12: 0-0.5-1-2-3-4-5-6.
- Préparer les réactifs nécessaires à l’utilisation de 100 µL de mixage final de BCA par échantillon.
- Pipeter 2 µL de chaque fraction de protéine dans une plaque 96 puits, ajouter le mélange de la BCA et suivez les instructions du fabricant pour la lecture.
Résultats
La figure 1 montre une coloration de l’hématoxyline éosine d’une section de biopsie intestinale avec villosités intactes et les structures de la crypte.
Les résultats représentatifs du fractionnement nucléaire et cytoplasmique utilisant ce protocole sont indiquées dans les Figures 2 et 3. Dans l’expérience illustré à la Figure 2, une nouvelle (Fh) et un gelée (Fz) biopsie ont été fractionnés simultanément selon le protocole présenté ici et une tache occidentale a été réalisée à l’aide de 20 μg de chaque échantillon. Les concentrations de protéine dans chaque fraction et la biopsie sont indiquées dans le tableau 2, et les concentrations de protéines ne sont pas très différentes entre la fraîcheur et le tissu congelé. Le rendement des protéines extraites les biopsies de 2 mg est d’environ 3-4 µg/µL dans la fraction cytoplasmique et environ 1,5 µg/µL dans la fraction nucléaire. Pour vérifier la pureté des fractions, HSP90 et tubuline ont été utilisés comme un témoins cytoplasmique et HDAC1 et H3 comme un contrôle nucléaire13. Il peut être observé que HSP90 et tubuline sont primaires situées dans le cytoplasme et HDAC1 et H3 sont situés dans le noyau avec un mélange très minime entre les deux fractions. Pour déterminer si le protocole affecte la mort cellulaire, nous avons effacé aussi la présence de la caspase 3. De la Figure 2, les deux échantillons présentent une coloration très minime pour la caspase 3 confirmant que la procédure n’affecte pas la voie de la mort cellulaire même après congélation les biopsies flash. Il a été également analysée si modifications protéiques sont maintenues après la procédure, alors que les protéines peuvent être utilisés pour des tests fonctionnels en aval. PhosphoSTAT1 a été utilisé pour la coloration car la biopsie congelée utilisée dans ce fractionnement provenait d’une personne avec une maladie inflammatoire intestinale ; ce n’est pas vrai pour la biopsie fraîche. Comme prévu, phosphoSTAT1 se trouve dans le cytoplasme de la biopsie congelé, confirmant que les modifications des protéines sont maintenues après fractionnement.
La reproductibilité de la méthode à l’aide de biopsies congelés est illustrée à la Figure 3. Une tache occidentale ont été effectuée après fractionnement de trois indépendants gelé les biopsies et les fractions sont propres à des protéines de compartiment minimal (Figure 3 a) de mélange : HSP90 situé dans la fraction cytoplasmique et HDCA1 dans la fraction nucléaire. En outre, la protéine XPO1 qui est présente dans les deux fractions nucléaires et cytoplasmiques14 était également effacée. On peut constater que les niveaux de XPO1 quantifiée par ImageJ sont stables dans chacune des fractions (Figure 3 b), confirmant la reproductibilité des résultats à l’aide de biopsies différentes.
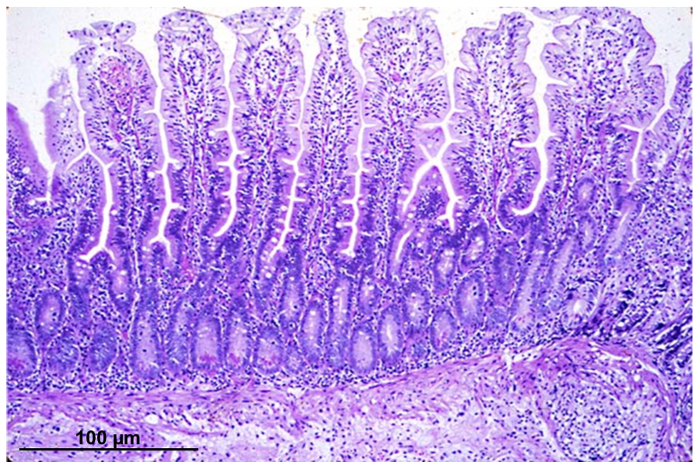
Figure 1 : Micrographie léger d’une section épithéliale intestinale, colorée avec l’éosine hématoxyline, une biopsie acquis par procédure endoscopique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Représentant Western blot d’un fractionnement subcellulaire réalisée dans une douce (Fh) et une biopsie (Fz) congelée. HSP90 et tubuline ont été utilisés comme contrôles cytoplasmiques et HDAC1 et H3 comme témoins nucléaires. La présence de CASP3 et phosphoSTAT3 ont également été évalués.
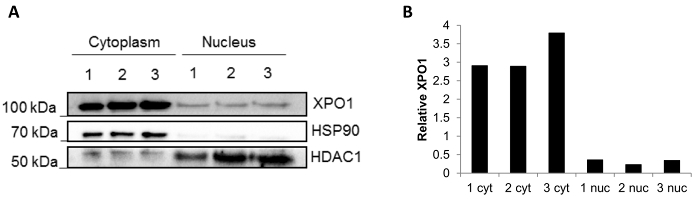
Figure 3 : Résultats de fractionnement de trois indépendants congelés des biopsies. (A) représentant Western blot d’un fractionnement subcellulaire effectué dans trois biopsies congelés (1, 2 et 3). HSP90 a été utilisé comme contrôle cytoplasmique et HDAC1 sous forme de contrôle nucléaire. La localisation de XPO1 a également été évaluée. (B) la quantification Relative de XPO1 chacune de la fraction faite à l’aide de logiciels ImageJ. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Mémoire tampon | Composants | Notes |
| Tampon hypotonique 1 | 10 millimètres HEPES pH 7,9 | tampon/échantillon de 1,5 ml |
| 10 mM KCl | ||
| nmM 0.1 EDTA | ||
| Hypertonique tampon 2 | 20 millimètres HEPES pH 7,9 | 150 µl tampon/échantillon |
| 400 mM NaCl | ||
| 0,1 mM EDTA | ||
| * Remarque : Les tampons peuvent être stockés à 4 ° c pendant un mois. | ||
| ** Note : Tampons doivent être suppléés avec inhibiteurs de protéinase et phosphatase et sur la TNT avant utilisation | ||
Tableau 1 : Composition du tampon.
| Frais | Congelés | |
| Cytoplasme | 2,975 | 4,612 |
| Noyau | 1.516 | 1.385 |
Tableau 2 : Concentration de protéines de chacune des fractions dans une biopsie de frais et congelés 2 mg utilisé dans la Figure 2; concentration est présentée en μg/μL.
Discussion
Le protocole décrit ici est utilisé pour le fractionnement nucléaire et cytoplasmique des biopsies de l’intestin. Les protéines purifiées sont non dénaturés et peut être utilisés non seulement dans l’analyse par western blot comme montré dans la Figure 2 et 3 , mais aussi dans les essais nécessitant des protéines pliées natif comme immunoprécipitation, analyse de décalage de mobilité électrophorétique (EMSA) ou électrophorèse en natif sur gel de polyacrylamide (PAGE).
La méthode décrite s’appuie sur l’homogénéisation mécanique du tissu avec lyse osmotique d’éclater la membrane de la cellule sans affecter la membrane nucléaire. Il en résulte un fractionnement propre des deux protéines cytoplasmiques et nucléaires à utiliser pour les analyses en aval. Il est important de contrôler la dégradation des protéines au cours du processus par l’addition d’inhibiteurs de la protéine et de la phosphatase. En outre, si les protéines extraites doivent être utilisés pour des tests fonctionnels en aval, il est également important d’éviter la dénaturation et la protéolyse des échantillons. Les processus doivent être effectués à 4 ° C et PMSF devrait aussi être ajouté aux tampons.
La procédure décrite dans le présent protocole est simple et abordable, et le temps de traitement d’échantillon est minime. Des problèmes tels que les longs délais de traitement et l’utilisation des kits de fractionnement coûteux ne sont pas contraintes par le présent protocole.
Biopsies fraîches ou congelées fois utilisable dans ce protocole, avec biopsies congelés qui donne des résultats tout à fait propre et reproductible de fractionnement comme on le voit dans la Figure 2 et 3. S’il y a contamination de compartiment, le temps de lyse cellulaire peut être réduit pour éviter le rejet du nucléaire dans le cytoplasme et étapes de lavage peut être ajoutée pour éviter toute contamination cytoplasmique dans le compartiment nucléaire.
La possibilité d’utiliser des tissus congelés d’analyse indépendant pour les fractions de protéines nucléaires et cytoplasmiques peut accroître nos connaissances sur les maladies inflammatoires intestinales dans lequel sont stockés les biopsies congelés. En outre, cette technique pourrait être adaptée à d’autres types de tissus humains acquis par des biopsies. Le volume des tampons utilisés doit être modifié en fonction de la taille de la biopsie.
Le protocole décrit ici est conçu pour générer des fractions de tissu reproductible ; Cependant, certaine variabilité intrinsèque au sein de l’échantillon, y compris la taille et l’état du tissu peuvent conduire aux écarts par rapport à la quantité de protéines et de la distribution gérés dans chaque fraction.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Auteurs reconnaissent l’aide de Ander Lopez et Miren Telletxea pour l’enregistrement et le montage vidéo. ACR est financé par une bourse de Ikerbasque et un projet de recherche de Asociación de Celiacos Madrid (ACM). JRB est financé par le projet ISCIII-PI16/00258 et cofinancé par l’Union européenne FEDER/FSE « Un moyen de faire de l’Europe ». EST financé par une subvention de projet de recherche 2015111068 du département Basque de la santé. GRI et AJM sont pris en charge par des subventions de bourse prédoctorale de l’UPV/EHU et le ministère de l’éducation de Basque, respectivement.
matériels
| Name | Company | Catalog Number | Comments |
| HEPES | Sigma Aldrich | H4034-1kg | |
| KCl | Sigma Aldrich | P9333-1kg | |
| EDTA | Sigma Aldrich | E9884-100G | |
| NaCl | Sigma Aldrich | 5588886-1kg | |
| DTT | Sigma Aldrich | 10197777001 | |
| PMSF | Thermo Scientific | 36978 | |
| Proteinase and phosphatase inhibitors | Thermo Scientific | A32959 | |
| NP-40 | Sigma Aldrich | CA-630 | Detergent |
| BCA assay | Thermo Scientific | 23227 | Protein quantification kit |
| Disposable plastic pestles | Sigma Aldrich | Z359947-100EA | |
| Dounce homogeneizer | VWR | 431-0100 | |
| Microcentrifuge | Eppendorf | 5415-R | |
| Shacker | IKA | MS3 basic |
Références
- Cox, B., Emili, A. Tissue subcellular fractionation and protein extraction for use in mass-spectrometry-based proteomics. Nature Protocols. 1 (4), 1872-1878 (2006).
- Itzhak, D. N., Tyanova, S., Cox, J., Borner, G. H. Global, quantitative and dynamic mapping of protein subcellular localization. eLife. 5, (2016).
- Preedy, V. R., Watson, R. R., Ronald, R. . Methods in disease investigating the gastrointestinal tract. , (1998).
- Alex, P., Gucek, M., Li, X. Applications of proteomics in the study of inflammatory bowel diseases: Current status and future directions with available technologies. Inflammatory bowel diseases. 15 (4), 616-629 (2009).
- Ericsson, C., Franzén, B., Nistér, M. Frozen tissue biobanks. Tissue handling, cryopreservation, extraction, and use for proteomic analysis. Acta oncologica (Stockholm, Sweden). 45 (6), 643-661 (2006).
- Hoffmann, K., et al. New application of a subcellular fractionation method to kidney and testis for the determination of conjugated linoleic acid in selected cell organelles of healthy and cancerous human tissues. Analytical and Bioanalytical Chemistry. 381 (6), 1138-1144 (2005).
- Foster, L. J., et al. A Mammalian Organelle Map by Protein Correlation Profiling. Cell. 125 (1), 187-199 (2006).
- Baghirova, S., Hughes, B. G., Hendzel, M. J., Schulz, R. Sequential fractionation and isolation of subcellular proteins from tissue or cultured cells. MethodsX. 2, e440-e445 (2015).
- Börner, A., et al. Subcellular protein extraction from human pancreatic cancer tissues. BioTechniques. 46 (4), 297-304 (2009).
- Antalis, T. M., Shea-Donohue, T., Vogel, S. N., Sears, C., Fasano, A. Mechanisms of disease: protease functions in intestinal mucosal pathobiology. Nature clinical practice. Gastroenterology. 4 (7), 393-402 (2007).
- Cutler, P. . Protein purification protocols. , (2004).
- Walker, J. M. The Bicinchoninic Acid (BCA) Assay for Protein Quantitation. The Protein Protocols Handbook. , 11-14 (1996).
- McLane, L. M., et al. Differential localization of T-bet and Eomes in CD8 T cell memory populations. Journal of immunology (Baltimore, Md.: 1950). 190 (7), 3207-3215 (2013).
- Nguyen, K. T., Holloway, M. P., Altura, R. A. The CRM1 nuclear export protein in normal development and disease. International journal of biochemistry and molecular biology. 3 (2), 137-151 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon