Method Article
تجزئة سوبسيلولار من العينات المعدية المعوية الطازجة والمجمدة
* These authors contributed equally
In This Article
Summary
نقدم هنا، بروتوكول القيام تجزئة خلوية بسيطة لفصل سوبسيلولار من البروتينات هيولى والنووية في الخزعات المعوية البشرية الطازجة والمجمدة.
Abstract
والغرض من هذا البروتوكول يجزئ الأنسجة المعوية البشرية التي حصل عليها التنظير في المقصورات النووية وهيولي لتحليل التعريب من بروتينات محددة أو مجمعات البروتين في الأنسجة مختلف الدول (أي، صحية مقابل المرض). يعد هذا الأسلوب مفيداً لتجزئة كلا عينات الأنسجة المعوية الطازجة والمجمدة؛ ومن الوصول إليها بسهولة لجميع المختبرات ولا تستغرق وقتاً طويلاً.
Introduction
البروتينات المشاركة في ما يقرب من جميع الوظائف البيولوجية داخل خلية وأي اختلاف في هيكل أو الكمية أو مكان يمكن أن يؤدي إلى سيناريو المسببة للأمراض. أساليب وجود عينة الأنسجة نهجاً مفيداً الحد من تعقيد المرض ذات الصلة بتحليل البروتين. بعض الدراسات استخدام البروتين التعريب المعلومات أو إثراء بروتين من حجرة الهاتف خلوي محددة، ذلك بروتوكول لتجزئة استنساخه من البروتينات سليمة مفيدة للرد على بعض الأسئلة البيولوجية. تحديد الترجمة سوبسيلولار للبروتينات والرصد على إعادة توزيع مقسم أو التفاعلات في القاعدية وظروف المرض سيساعد على تحديد الأمراض المتعلقة بالاختلافات الوظيفية1،2. وبالتالي، يهدف هذا الأسلوب إلى تكاثر يجزئ خزعات الأنسجة المعوية، الطازجة والمجمدة، في مقصورات سوبسيلولار هيولى والنووية على حد سواء.
عينات خزعة الأمعاء بشكل روتيني يتم الحصول عليها من خلال إجراءات التنظير3 (الشكل 1)، ويمكن استخدامه بفعالية لتحديد مقدار البروتين أو الدراسات إيمونوبريسيبيتيشن. سوف تحتوي على عينات الأنسجة من الأمعاء الظهارية البروتينات التي قد تكون ضالعة مباشرة في إمراضية المرض4، عينات خزعة الأمعاء مصدرا قيماً للغاية لتحديد هوية الناجحة الخاصة بالأمراض المعوية البروتينات. عينات الأنسجة المجمدة، والمريض المخزنة جنبا إلى جنب مع المعلومات السريرية موارد مفيدة لتحليل البروتين، وإعداد نموذج بسيط واستنساخه مسألة أساسية لتوفير معلومات الخلية يغلب استخدام المبالغ المقيدة لتجميد 5من الأنسجة.
هناك عدة مجموعات المتاحة تجارياً للفصل بين كسور الخلوية، ولكن هذه أكثر تكلفة وعموما أكثر استهلاكاً للوقت من البروتوكول المعروضة هنا. استناداً إلى بروتوكولات متعددة الخطوات المتدرجة الطرد المركزي وكما استخدمت التدرجات المستمر سابقا لتجزئة المقصورات الخلوية المتنوعة في أنسجة مختلفة6،7. ومع ذلك، الحفاظ على الاتساق بين التدرجات المستمر غالباً ما مهمة صعبة. بروتوكولات مماثلة تستند إلى تحلل متسلسل للأغشية وقد وصفت سابقا ولكن يحتاجون عادة اثنين أو أكثر من المخازن المؤقتة والأيدي في الوقت المحدد هو أطول8 .
عند تجزئة عينات الأنسجة، إلا يغيب عن البال أن النسيج عينات التفاعلات خلية خلية وخلية المصفوفة الحالية التي غير موجودة في الخلايا المستزرعة وهامة عند الشروع في استخراج البروتين. انهيار السليم بين الخلايا والمصفوفة خارج الخلية دون التأثير على نوعية البروتين سيكون عاملاً حاسما في عزل بروتين الأنسجة المعوية9. في هذا البروتوكول، جهات الاتصال خلية خلية وخلية المصفوفة أولاً مكسورة، الإفراج عن الخلايا ويسمح المخزن المؤقت للوصول إلى الخلايا الفردية. لتجنب البروتين-حجرة خلط قبل تجزئة، يجب أن يحدث انهيار الاتصالات دون تغيير سلامة الخلايا أو الأغشية النووية.
سبب إثراء البروتياز المختلفة في مخاطية الأمعاء10، من المهم مراقبة تدهور البروتين أثناء الاستخراج. للحد من تدهور البروتين المحتملة، يجب تضمين مثبط البروتياز متعددة في مخازن استخراج البروتين. بالإضافة إلى ذلك، إذا مقتطفات ذاهبون لاستخدامها لفحوصات الوظيفية، من الضروري لتجنب تمسخ البروتينات أو بروتيوليسيس لأن هذا سوف يسبب خسارة في نشاط البروتين11. ولهذا الغرض، يتم تنفيذ البروتوكول في 4 درجات مئوية وفلوريد فينيلميثيلسولفونيل الطازج (بمسف) يتم إضافة إلى المخازن المؤقتة بتركيز 0.1 مم فقط قبل استخدامها لتمنع كذلك proteolysis نهائية.
هو الخطوة الأولى في وجود خلية اختلال الأنسجة وتحلل الخلية. وكما ذكر سابقا، يتمثل الهدف في تصنيف الخلايا وكسر لهم فتح مع الحد الأدنى من الضرر. يجب أن يكون تجانس عينات الأنسجة المعوية، وتفكيك الخلايا لتحقيق الحد الأقصى من الكسر من غشاء الخلية. في هذا البروتوكول، نستخدم خلاط مدقة يجهز لكسر الأنسجة المعوية الذي هو تجانس في غضون ثوان عن طريق عمل فورتيكسينج عالية السرعة. بعد التجانس، هي المحتضنة خلايا الأنسجة في المخزن مؤقت ناقص التوتر الذي سوف تنفجر غشاء الخلية ولكن سوف تبقى النواة سليمة، تليها إضافة منظفات غير يشوه (نونيل فينوكسيبوليثوكسيليثانول) ودوامه قصيرة لفصل النوى من الكسر هيولى. بعد إزالة السيتوبلازم، غشاء نواة الخلية هو اقتحام حاجز مكثف مع الهز.
طريقة المقدمة هنا هي طريقة مناسبة لتجزئة سوبسيلولار من الخزعات المعوية الطازجة والمجمدة التي تم الحصول عليها خلال المنظار وتتراوح بين 2 و 10 ميكروغرام في الوزن. البروتوكول سهل واستنساخه، ويمكن أن يؤديها باستخدام المعدات المختبرية الأساسية والمواد الكاشفة في أقل من ساعة.
Protocol
وأقر "مجلس أخلاقيات مستشفى جامعة كروسيس" هذه الدراسة وأجريت التحاليل بعد أن تم الحصول على الموافقة المستنيرة من جميع المواضيع أو أولياء أمورهم.
1-خزعة جمع
ملاحظة: خزعة عينات من العفج القاصي من المرضى يتم الحصول عليها أثناء التنظير التشخيص الروتينية إدارة الخزعات التي تتراوح بين 2 و 10 ميكروغرام في الوزن. فحص الأنسجة نسيج معقد يتألف من أنواع الخلايا المختلفة بما في ذلك الخلايا الظهارية، ومحصنة وبطانية. أخصائي أمراض الباطنة السريرية إجراء التنظير يلي المبادئ التوجيهية السريرية.
- ضع الخزعة في ورقة تصفية عقيمة فقط بعد التنظير.
- استخدام الملقط لنقل الخزعات في أنابيب 1.5 مل ونقع عليها مع برنامج تلفزيوني، ووضعه في كريوتوبي.
- تبقى أنابيب على الجليد حتى وصولها المختبر.
- بدء تجهيز خزعات جديدة فورا.
- الخزعات المجمدة، فلاش تجميد خزعة تحتوي على أنابيب وتخزينها في النتروجين السائل حتى الاستخدام.
ملاحظة: من المهم أن تبقى العينة المجمدة حتى تتم إضافة المخزن المؤقت تستكمل الباردة 1.
2. إعداد المخزن المؤقت
ملاحظة: قبل البدء، الملحق المخازن المؤقتة على النحو التالي.
- أضف 1 مم DTT (تركيز النهائية) ومبطلات والفوسفاتيز المانع كوكتيل (1 × التركيز النهائي) إلى المخزن المؤقت ناقص التوتر 1 ومكثف المخزن المؤقت 2 (الجدول 1).
- إعداد 1.5 مل من المخزن المؤقت 1 و 150 ميليلتر من المخزن المؤقت 2 كل عينة. سيتم منع DTT أكسدة العينات.
- إعداد الأنوية يغسل المخزن المؤقت عن طريق إضافة المنظفات 1% (نونيل فينوكسيبوليثوكسيليثانول) بتركيز 0.1% إلى المخزن المؤقت تستكمل الفعل 1 نهائي. إعداد 1 مل من المخزن المؤقت ليغسل النوى كل عينة.
3-خزعة التجانس
-
خزعات جديدة
- ضع مدقة المتاح في خلاط يجهز. ضمان وصول المدقة إلى الجزء السفلي من الأنبوب.
- إخراج الخزعة من كريوتوبي ووضعه في أنبوب 1.5 مل مع تلميح ماصة.
- إضافة 200 ميليلتر لتستكمل المخزن المؤقت 1 إلى أنبوب 1.5 مل.
- مجانسة الخزعة مع المدقة حتى الأنسجة معطلة تماما وإبقائه على الجليد.
- حالما يتم تجانس جميع خزعات المضي قدما في الخطوة 4.
ملاحظة: يجب تغيير المدقات المتاح بين الخزعات.
-
الخزعات المجمدة
تنبيه: تعامل مع النتروجين السائل بعناية؛ اتصال النتروجين السائل مع الجلد أو العينين قد تسبب إصابة تجميد خطيرة. حماية اليدين والعينين دائماً عند العمل مع النتروجين السائل.- تأخذ بعض النتروجين السائل في مربع لتخزين كريوتوبيس استردادها من خزان النتروجين.
- البحث عن الخزعة في خزان النتروجين ووضع في كريوتوبي في المربع مع النتروجين السائل. كرر هذه الخطوة لكل خزعات.
- نقل الخزعة من كريوتوبي إلى أنبوب 1.5 مل.
ملاحظة: سوف يتم إرفاق خزعات لأنبوب المجمدة. دفع الخزعة مع تلميح ماصة معقمة حيث أنه سيتم فصل من الأنبوب. - إضافة 200 ميليلتر لتستكمل المخزن المؤقت 1.
- مجانسة الأنسجة باستخدام مدقة وهاون حتى الأنسجة معطلة تماما، والحفاظ على درجة حرارة 4 درجة مئوية طوال جميع الإجراء.
ملاحظة: لا تدع خزعات ذوبان الجليد قبل إضافة المخزن المؤقت.
4-السيتوبلازم العزلة
- احتضان خزعة المتجانس على الجليد لمدة 10 دقائق.
- إضافة 10 ميليلتر من المنظفات 1% (نونيل فينوكسيبوليثوكسيليثانول) لكل عينة إلى نهائي تركز 0.05%.
ملاحظة: سوف تضخم الخلايا وانفجر قبل تحلل ناضح كما سيتم تعطيل خفيف المنظفات غشاء الخلية. - تبني على الجليد لمدة 5 دقائق.
- الدوامة بإيجاز وأجهزة الطرد المركزي في ز 400 x في 4 ˚C ل 2 دقيقة.
- وبعد فورتيكسينج، إزالة المادة طافية ونقلها إلى أنبوب مل 1.5 نظيفة جديدة؛ وسوف يكون هذا الكسر هيولى. عدم تجاهل بيليه.
5-المجال النووي العزلة
- ريسوسبيند بيليه من الخطوة السابقة مع 200 ميليلتر نوى غسل المخزن المؤقت.
- الطرد المركزي في أنبوب لمدة 2 دقيقة على 400 x ز و 4 درجات مئوية.
- تجاهل المادة طافية وكرر الإجراء الغسيل مرتين أخريين.
ملاحظة: يغسل إلى إزالة التلوث هيولى في الكسر النووية. - بعد الغسيل الثالث، ريسوسبيند بيليه في 100 ميليلتر من المخزن المؤقت 2.
- هزة العينة بقوة في ˚C 4 عن 30 دقيقة بدلاً من ذلك، احتضان العينة على الجليد ودوامه كل 5 دقائق.
- بعد الهز، الطرد المركزي العينة لمدة 10 دقائق في سرعة قصوى (> 12,000 س ز) و 4 درجة مئوية.
- وبعد فورتيكسينج، بتحويل المادة طافية إلى 1.5 نظيفة جديدة. أنبوب مل. وسيكون هذا الكسر النووية.
6-البروتين الكمي
ملاحظة: تحديد كمية البروتينات مع عدة مقايسة بروتين (اتفاق التعاون الأساسي) حمض بيسينتشونينيك. تركيز البروتينات في الكسور وسوف تتراوح بين 0.5 و 5 ميكروغرام/ميليلتر، عن انخفاض في الكسر النووي (انظر الجدول 2 لتركيزات البروتين الناتجة من خزعات 2 مغ).
- إعداد منحنى قياسي مع ألبومين المصل البقري (BSA) التالي المبالغ (ميكروغرام)12: 0-0.5-1-2-3-4-5-6.
- إعداد الكواشف اللازمة لاستخدام 100 ميليلتر من المزيج اتفاق التعاون الأساسي النهائي كل عينة.
- "الماصة؛" 2 ميليلتر من كل جزء من البروتين في طبق جيدا 96 وإضافة مزيج اتفاق التعاون الأساسي واتبع إرشادات الشركة المصنعة للقراءة.
النتائج
ويبين الشكل 1 ثم توضع تلطيخ قسم خزعة الأمعاء مع الزوائد سليمة وهياكل سرداب.
وتظهر نتائج الممثل وجود النووي وهيولي استخدام هذا البروتوكول في الأرقام 2 و 3. في هذه التجربة هو مبين في الشكل 2، طازجة (Fh) ومجمدة (Fz) خزعة كانت في الوقت نفسه مجزأ بعد البروتوكول المعروضة هنا، ووصمة عار غربية أجرى باستخدام 20 ميكروغرام لكل عينة. تركيزات البروتين في كل جزء وخزعة مبينة في الجدول 2، وتركيزات البروتين ليست مختلفة جداً بين الطازجة والمجمدة الأنسجة. عائد البروتينات المستخرجة من خزعات 2 مغ حول 3-4 ميكروغرام/ميليلتر في الكسر هيولى وحوالي 1.5 ميكروغرام/ميليلتر في الكسر النووية. للتحقق من نقاء الكسور، واستخدمت HSP90 وتوبولين كوضع ضوابط هيولى و HDAC1 و H3 كضوابط نووية13. يمكن ملاحظة أن HSP90 وتوبولين الأولية الموجودة في السيتوبلازم و HDAC1 و H3 موجودة في النواة مع خلط ضئيلة جداً بين الكسور اثنين. لتقييم ما إذا كان البروتوكول يؤثر موت الخلية، ونحن أيضا مسح لوجود كاسباسي 3. من الشكل 2، يقدم كل العينات تلطيخ ضئيلة جداً ل caspase 3 تؤكد أن الإجراء لا يؤثر في مسار موت الخلية حتى بعد فلاش تجميد في الخزعات. قد تم أيضا تحليل إذا حوفظ على التعديلات البروتين بعد هذا الإجراء، حيث يمكن استخدام البروتينات لفحوصات الوظيفية المتلقين للمعلومات. واستخدمت PhosphoSTAT1 لتلطيخ خزعة المجمدة المستخدمة في تجزئة هذه جاءت من فرد مع شرط التهابات معوية؛ وهذا ليس صحيحاً لخزعة الطازجة. كما هو متوقع، phosphoSTAT1 الموجود في السيتوبلازم الخزعة المجمدة، تأكيد الحفاظ على التعديلات البروتين بعد تجزئة.
ويرد في الشكل 3إمكانية تكرار نتائج أسلوب استخدام الخزعات المجمدة. أنجز وصمة عار غربية بعد تجزئة المستقلة الثلاثة المجمدة الخزعات، والكسور نظيفة مع البروتين حجرة أدنى خلط (الشكل 3A): HSP90 الموجودة في جزء هيولى و HDCA1 في الكسر النووية. بالإضافة إلى ذلك، كما تم مسح البروتين XPO1 الموجودة في كلا الكسور النووية وهيولي14 . ويمكن ملاحظة أن مستويات XPO1 الكمية التي إيماجيج مستقرة في كل جزء (الشكل 3B)، مما يؤكد إمكانية تكرار نتائج النتائج باستخدام الخزعات مختلفة.
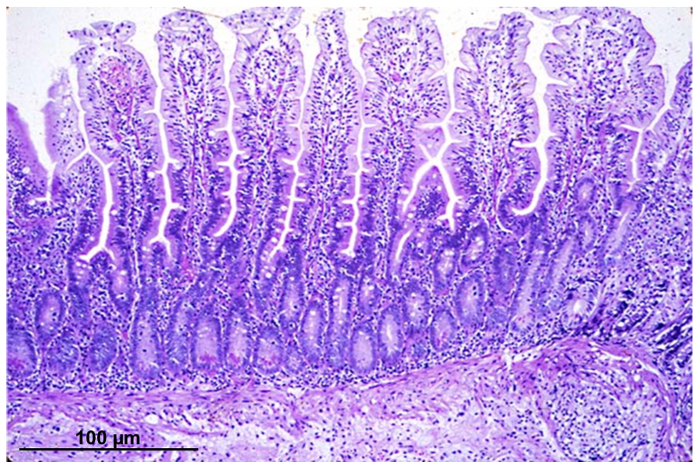
الشكل 1 : صورة مجهرية الخفيفة قسم الظهارية المعوية، ملطخة الهيماتوكسيلين ويوزين، من خزعة المكتسبة بالمنظار الداخلي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 : وصمة عار الغربية الممثل وجود سوبسيلولار أداؤها في خزعة (Fz) مجمدة وطازجة (Fh). واستخدمت HSP90 وتوبولين كعناصر تحكم هيولى و HDAC1 و H3 الضوابط النووية. كما تم تقييم وجود CASP3 و phosphoSTAT3.
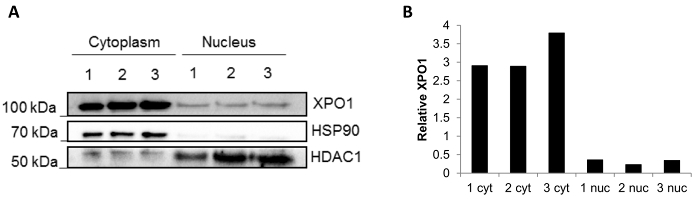
الشكل 3 : وجود نتائج المستقلة الثلاثة المجمدة الخزعات. (أ) وصمة عار الغربية الممثل وجود سوبسيلولار أجريت في ثلاث خزعات المجمدة (1 و 2 و 3). كعنصر تحكم هيولى و HDAC1 كعنصر تحكم نووية HSP90. كما تم تقييم تعريب XPO1. (ب) التحديد الكمي النسبي من XPO1 في كل من الكسر القيام به باستخدام البرمجيات إيماجيج. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| المخزن المؤقت | المكونات | وتلاحظ |
| ناقص التوتر المخزن المؤقت 1 | 10 ملم حبيس الأس الهيدروجيني 7.9 | المخزن المؤقت 1.5 مل/عينة |
| 10 ملم بوكل | ||
| يدتا نم 0.1 | ||
| المخزن المؤقت مكثف 2 | 20 مم حبيس الأس الهيدروجيني 7.9 | 150 ميليلتر المخزن المؤقت/عينة |
| 400 مم كلوريد الصوديوم | ||
| مم 0.1 يدتا | ||
| * ملاحظة: يمكن تخزين المخازن المؤقتة في 4ºC لمدة شهر. | ||
| * * ملاحظة: المخازن المؤقتة يجب أن تستكمل بمثبطات البروتيناز والفوسفاتيز و DTT قبل الاستخدام | ||
الجدول 1: تكوين المخزن المؤقت.
| جديدة | المجمدة | |
| السيتوبلازم | 2.975 | 4.612 |
| نواة | 1.516 | 1.385 |
الجدول 2: البروتين تركيز كل من الكسور في خزعة الطازجة والمجمدة 2 مغ المستخدمة في الشكل 2؛ ويتضمن تركيز ميكروغرام/ميكروليتر.
Discussion
يستخدم بروتوكول الموصوفة هنا لتجزئة النووية وحشوية من الخزعات المعوية. البروتينات المنقاة هي عدم التشويه والتحريف ويمكن استخدامه ليس فقط في تحليل لطخة غربية كما هو مبين في الشكل 2 و 3 ولكن أيضا في الاختبارات التي تتطلب البروتينات مطوية أصلي مثل إيمونوبريسيبيتيشن، تنقل الغرواني الكهربي التحول المقايسة (أمسا) أو أصلي polyacrylamide هلام التفريد (صفحة).
الأسلوب وصف يعتمد على تجانس النسيج جنبا إلى جنب مع تحلل ناضح اندفاع غشاء الخلية دون التأثير على الغشاء النووي الميكانيكية. والنتيجة تجزئة نظيفة من البروتينات هيولى والنووية لاستخدامها لتحليل المتلقين للمعلومات. من المهم مراقبة تدهور البروتينات أثناء العملية بإضافة مثبطات البروتين والفوسفاتيز. وعلاوة على ذلك، إذا البروتينات المستخرجة التي ستستخدم لفحوصات الوظيفية المصب، من المهم أيضا تجنب تمسخ وبروتيوليسيس من العينات. ينبغي أن تجري العمليات في 4 درجات مئوية وتضاف بمسف أيضا للمخازن المؤقتة.
الإجراء الموصوفة في هذا البروتوكول بسيطة وميسورة، ووقت التجهيز بعينه الحد الأدنى. المشاكل مثل أوقات المعالجة منذ فترة طويلة، واستخدام مجموعات تجزئة مكلفة لا قيود في هذا البروتوكول.
الخزعات طازجة ومجمدة على حد سواء استخدامها في هذا البروتوكول، مع الخزعات المجمدة إعطاء نتائج تجزئة جداً نظيفة واستنساخه كما هو مبين في الشكل 2 و 3. إذا لم يكن هناك حجرة التلوث، يمكن تخفيض الوقت تحلل الخلية لتجنب إطلاق النووي إلى السيتوبلازم والغسيل خطوات يمكن أن تضاف إلى تجنب التلوث هيولى في حجرة النووية.
يمكن زيادة إمكانية استخدام الأنسجة المجمدة لتحليل مستقل للكسور البروتين النووي وهيولي معرفتنا حول أمراض التهاب الأمعاء يتم فيه تخزين الخزعات المجمدة. وعلاوة على ذلك، هذا الأسلوب يمكن تكييفها وفقا لأنواع أخرى من الأنسجة البشرية المكتسبة من الخزعات. يجب أن يتم تعديل حجم المخازن المؤقتة المستخدمة تبعاً لحجم الخزعة.
تم تصميم البروتوكول هو موضح هنا لتوليد أنسجة استنساخه الكسور؛ ومع ذلك، بعض التغيرات الجوهرية ضمن العينة، بما في ذلك الحجم وحالة الأنسجة يمكن أن يؤدي إلى انحرافات في كمية البروتين والتوزيع التي تدار في كل جزء.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
المؤلف تقر مساعدة لوبيز أندير وميرين تيليتكسيا لتسجيل الفيديو وتحريرها. وتمول ACR زمالة إيكيرباسك ومشروع بحثي من رابطة سيلياكوس دي مدريد (ACM). جرب الممولة من مشروع إيسسيي-PI16/00258 والممول من "الاتحاد الأوروبي" سيطلب/كلية العلوم التربوية "طريقة لجعل أوروبا". من هو ممول بمنحه مشروع بحوث 2015111068 من "وزارة الصحة إقليم الباسك". سيبحث و AJM معتمدة بمنح زمالة بريدوكتورال من UPV/اهو وإدارة التعليم في إقليم الباسك، على التوالي.
Materials
| Name | Company | Catalog Number | Comments |
| HEPES | Sigma Aldrich | H4034-1kg | |
| KCl | Sigma Aldrich | P9333-1kg | |
| EDTA | Sigma Aldrich | E9884-100G | |
| NaCl | Sigma Aldrich | 5588886-1kg | |
| DTT | Sigma Aldrich | 10197777001 | |
| PMSF | Thermo Scientific | 36978 | |
| Proteinase and phosphatase inhibitors | Thermo Scientific | A32959 | |
| NP-40 | Sigma Aldrich | CA-630 | Detergent |
| BCA assay | Thermo Scientific | 23227 | Protein quantification kit |
| Disposable plastic pestles | Sigma Aldrich | Z359947-100EA | |
| Dounce homogeneizer | VWR | 431-0100 | |
| Microcentrifuge | Eppendorf | 5415-R | |
| Shacker | IKA | MS3 basic |
References
- Cox, B., Emili, A. Tissue subcellular fractionation and protein extraction for use in mass-spectrometry-based proteomics. Nature Protocols. 1 (4), 1872-1878 (2006).
- Itzhak, D. N., Tyanova, S., Cox, J., Borner, G. H. Global, quantitative and dynamic mapping of protein subcellular localization. eLife. 5, (2016).
- Preedy, V. R., Watson, R. R., Ronald, R. Methods in disease investigating the gastrointestinal tract. , Greenwich Medical Media. (1998).
- Alex, P., Gucek, M., Li, X. Applications of proteomics in the study of inflammatory bowel diseases: Current status and future directions with available technologies. Inflammatory bowel diseases. 15 (4), 616-629 (2009).
- Ericsson, C., Franzén, B., Nistér, M. Frozen tissue biobanks. Tissue handling, cryopreservation, extraction, and use for proteomic analysis. Acta oncologica (Stockholm, Sweden). 45 (6), 643-661 (2006).
- Hoffmann, K., et al. New application of a subcellular fractionation method to kidney and testis for the determination of conjugated linoleic acid in selected cell organelles of healthy and cancerous human tissues. Analytical and Bioanalytical Chemistry. 381 (6), 1138-1144 (2005).
- Foster, L. J., et al. A Mammalian Organelle Map by Protein Correlation Profiling. Cell. 125 (1), 187-199 (2006).
- Baghirova, S., Hughes, B. G., Hendzel, M. J., Schulz, R. Sequential fractionation and isolation of subcellular proteins from tissue or cultured cells. MethodsX. 2, e440-e445 (2015).
- Börner, A., et al. Subcellular protein extraction from human pancreatic cancer tissues. BioTechniques. 46 (4), 297-304 (2009).
- Antalis, T. M., Shea-Donohue, T., Vogel, S. N., Sears, C., Fasano, A. Mechanisms of disease: protease functions in intestinal mucosal pathobiology. Nature clinical practice. Gastroenterology. 4 (7), 393-402 (2007).
- Cutler, P. Protein purification protocols. , Humana Press. (2004).
- Walker, J. M. The Bicinchoninic Acid (BCA) Assay for Protein Quantitation. The Protein Protocols Handbook. , 11-14 (1996).
- McLane, L. M., et al. Differential localization of T-bet and Eomes in CD8 T cell memory populations. Journal of immunology (Baltimore, Md.: 1950). 190 (7), 3207-3215 (2013).
- Nguyen, K. T., Holloway, M. P., Altura, R. A. The CRM1 nuclear export protein in normal development and disease. International journal of biochemistry and molecular biology. 3 (2), 137-151 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved