Method Article
Subzellulären Fraktionierung von frischen und gefrorenen Magen-Darm-Proben
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll, um eine einfache zelluläre Fraktionierung für die subzelluläre Trennung der zytoplasmatischen und nukleare Proteine im menschlichen frisch- und Gefrierfleisch intestinalen Biopsien durchführen.
Zusammenfassung
Dieses Protokoll soll menschliche Darmgewebe erhalten durch Endoskopie in Kern- und zytoplasmatischen Fächer für die Lokalisierung Analyse spezifischer Proteine oder Proteinkomplexe in verschiedene Gewebe Staaten (z. B. gesunde fraktionieren vs. Krankheit). Diese Methode ist nützlich für die Fraktionierung von beiden frischen und gefrorenen Darm Gewebeproben; Es ist leicht zugänglich für alle Laboratorien und nicht zeitaufwendig.
Einleitung
Proteine an nahezu alle biologischen Funktionen innerhalb einer Zelle und Abweichungen in Struktur, Menge oder Lage zu einem pathogenen Szenario führen kann. Fraktionierung Beispielmethoden Gewebe sind ein sinnvoller Ansatz zur Verringerung der Komplexität der Krankheit im Zusammenhang mit Protein-Analysen. Einige Studien Protein Lokalisierung Informationen verwenden oder ein Protein aus einem spezifischen zellulären Fach zu bereichern, so ein Protokoll für reproduzierbare Fraktionierung von intakten Proteinen sinnvoll, bestimmte biologische Fragen zu beantworten. Bestimmung der subzellulären Lokalisierung von Proteinen und Überwachung ihrer Substruktur Umverteilung oder Wechselwirkungen bei basalen und Erkrankungen werden dazu beitragen, die Krankheit zu identifizieren im Zusammenhang mit funktionalen Unterschiede1,2. Diese Methode soll somit reproduzierbar Darmgewebe Biopsien, frisch und gefroren, in zytoplasmatischen und nukleare subzelluläre Kompartimente fraktionieren.
Intestinale Biopsie Proben werden routinemäßig während der Endoskopie Verfahren3 (Abbildung 1) gewonnen und können effektiv für Protein Quantifizierung oder Immunopräzipitation Studien verwendet werden. Da Gewebeproben von intestinalen epithelialen Proteine enthält, die direkt an der Krankheit Pathogenese4beteiligt sein können, sind intestinale Biopsie Proben eine sehr wertvolle Quelle für die erfolgreiche Identifikation des intestinalen krankheitsspezifische Proteine. Gespeicherten gefrorenen, geduldige Gewebeproben zusammen mit den klinischen Angaben sind nützliche Quellen für Protein-Analyse und eine einfache und reproduzierbare Probenvorbereitung ist ein Schlüsselthema Zelle lag mit einschränkenden Mengen von Informationen eingefroren Gewebe-5.
Es gibt mehrere handelsüblichen Kits für die Trennung von zellulären Brüche, aber diese sind teurer und in der Regel mehr Zeit in Anspruch als das Protokoll hier vorgestellten. Protokolle basierend auf mehreren Schritten Steigung Zentrifugierung und kontinuierliche Farbverläufe haben auch bereits genutzt, für die Fraktionierung von unterschiedlichen zellularen Fächern in verschiedenen Geweben6,7. Die Konsistenz von kontinuierlichen Gradienten ist jedoch oft eine schwierige Aufgabe. Ähnliche Protokolle basierend auf die sequentielle Lyse von Membranen wurden bisher beschrieben, aber sie brauchen in der Regel mehr als zwei Puffer und die Hände auf Zeit ist länger8 .
Wenn Gewebeproben Fraktionierung, denken Sie daran, dass Gewebe Proben anwesende Zell-Zell und Zelle-Matrix Interaktionen, die nicht in kultivierten Zellen vorhanden und wichtig sind, wenn zur Proteingewinnung voran. Die richtige Aufteilung zwischen Zellen und extrazellulären Matrix ohne die Proteinqualität wird ein kritischer Faktor im Darmgewebe Protein isoliert9sein. In diesem Protokoll sind Zell-Zell und Zellmatrix Kontakte zuerst gebrochen, Freigabe der Zellen und damit des Puffers, die einzelnen Zellen zu erreichen. Um Protein-Fach vor Fraktionierung Vermischung zu vermeiden, muss die Aufteilung der Kontakte auftreten, ohne dass die Integrität der Zellen oder der Kernmembran.
Durch die Anreicherung von verschiedenen Proteasen in der Darmschleimhaut10ist es wichtig, den Proteinabbau während der Extraktion zu kontrollieren. Um die potenziellen Proteinabbau zu minimieren, muss mehrere Protease-Inhibitor in die Protein-Extraktion-Puffer enthalten sein. Darüber hinaus Wenn Extrakte für funktionelle Assays verwendet werden sollen, ist es wesentlich, der Denaturierung von Proteinen oder Proteolyse zu vermeiden, da dies einen Verlust von Protein Aktivität11führt. Zu diesem Zweck des Protokolls erfolgt bei 4 ° C und frische Phenylmethylsulfonyl Fluorid (PMSF) wird hinzugefügt, um die Puffer auf eine Endkonzentration von 0,1 mM nur vor der Anwendung weiter Proteolyse zu hemmen.
Der erste Schritt in Zelle Fraktionierung ist Gewebe Störungen und Zelle Lysis. Wie bereits erwähnt, ist das Ziel zu disaggregieren der Zellen und die Pause, die sie mit minimaler Beschädigung zu öffnen. Darm Gewebeproben homogenisiert werden müssen, und die Zellen lysiert, um maximale Bruch der Zellmembran zu erreichen. In diesem Protokoll verwenden wir einen motorisierte Stößel-Mixer, um das Darmgewebe zu brechen, die innerhalb von Sekunden durch high-Speed Bereich handeln homogenisiert wird. Nach der Homogenisierung sind Gewebezellen in eine Hypotonische Puffer inkubiert, die platzt die Zellmembran aber halten die Zellkerne intakt, gefolgt durch Zugabe von einem nicht Denaturierung Reinigungsmittel (Nonyl Phenoxypolyethoxylethanol) und eine kurze Vortex Kernen zu trennen aus der zytoplasmatischen Bruchteil. Nach dem Entfernen des Zytoplasmas ist die Zellmembran Kerne in einen hypertonen Puffer mit zitternden platzen.
Die hier vorgestellte Methode ist eine geeignete Methode für die subzellulären Fraktionierung von frischen und gefrorenen intestinalen Biopsien, die während der endoskopischen Verfahren und liegen zwischen 2 und 10 mg an Gewicht gewonnen haben. Das Protokoll ist einfach und reproduzierbar und mit grundlegenden Laborgeräte und Reagenzien in weniger als einer Stunde durchgeführt werden konnte.
Protokoll
Diese Studie wurde vom Cruces University Hospital Ethics Board genehmigt und Analysen wurden durchgeführt, nach Einwilligung aus allen Fächern bzw. deren Eltern.
1. Biopsie Sammlung
Hinweis: Gewebeproben aus der distalen Zwölffingerdarm des Patienten während der Routinediagnostik Endoskopie Verwaltung Biopsien dieses Bereichs zwischen 2 und 10 mg Gewicht erhalten. Biopsiert Gewebe ist ein komplexes Gewebe bestehend aus verschiedenen Zelltypen, einschließlich der epitheliale, Immun- und endotheliale Zellen. Klinischen Gastroenterologen durchführen der Endoskopie folgenden klinischen Leitlinien.
- Ort der Biopsie auf ein steriles Filterpapier nur nach der Endoskopie.
- Verwenden Sie Zange zum Übertragen der Biopsien in 1,5 mL Tuben, Tränken sie mit PBS und legen Sie es in ein Cryotube.
- Halten Sie Röhren auf Eis, bis im Labor eintreffen.
- Mit der Verarbeitung von frischen Biopsien sofort beginnen.
- Für gefrorene Biopsien Blitz einfrieren die Biopsie mit Röhren und in flüssigem Stickstoff bis zu seiner Verwendung zu speichern.
Hinweis: Es ist wichtig, dass die Probe eingefroren, bis der kalte ergänzte Puffer 1 hinzugefügt wird.
2. Puffer Vorbereitung
Hinweis: Bevor Sie beginnen, ergänzen Sie die Puffer wie folgt.
- Fügen Sie 1 mM DTT (Endkonzentration) und Protease und Phosphatase-Inhibitor cocktail (1 x Endkonzentration) auf die hypotone Puffer 1 und hypertonen Puffer 2 (Tabelle 1).
- 1,5 mL Puffer 1 und 150 µL Puffer 2 pro Probe vorbereiten. DVB-t-verhindert die Oxidation der Proben.
- Bereiten Sie Kerne Waschpuffer durch Zugabe von 1 % Waschmittel (Nonyl Phenoxypolyethoxylethanol), eine Endkonzentration von 0,1 % auf den bereits ergänzt Puffer 1. Bereiten Sie 1 mL Waschpuffer Kerne pro Probe.
(3) Biopsie Homogenisierung
-
Frische Biopsien
- Legen Sie die Einweg-Stößel im motorisierten Mixer. Sicherstellen Sie, dass die Stößel den Boden des Rohres erreicht.
- Nehmen Sie die Biopsie aus der Cryotube heraus und legen Sie sie in eine 1,5 mL-Tube mit einer PIPETTENSPITZE.
- Der 1,5 mL Tube 200 µL ergänzt Puffer 1 hinzufügen.
- Homogenisieren Sie die Biopsie mit dem Stößel zu, bis das Gewebe vollständig unterbrochen wird, und halten sie auf dem Eis.
- Nachdem alle Biopsien homogenisiert werden mit Schritt 4 fortfahren.
Hinweis: Einweg-Stößel müssen zwischen Biopsien geändert werden.
-
Gefrorene Biopsien
Achtung: Gehen Sie vorsichtig mit flüssigem Stickstoff; Kontakt von flüssigem Stickstoff mit Haut oder Augen kann einfrieren Verletzungen führen. Schützen Sie Hände und Augen, immer beim Arbeiten mit flüssigem Stickstoff.- Nehmen Sie einige flüssigen Stickstoff in einer Box zum Aufbewahren der Cryoröhrchen aus der Stickstofftank abgerufen werden.
- Finden Sie die Biopsie in der Stickstofftank und platzieren Sie die Cryotube in der Box mit flüssigem Stickstoff. Wiederholen Sie diesen Schritt für alle Biopsien.
- Übertragen Sie die Biopsie von der Cryotube auf eine 1,5 mL-Tube.
Hinweis: Biopsien werden am zugefrorenen Rohr befestigt werden. Drücken Sie die Biopsie mit einer sterilen PIPETTENSPITZE, so dass es aus der Tube lösen wird. - Fügen Sie 200 µL ergänzt Puffer 1.
- Das Gewebe mit Stößel und Mörser, bis das Gewebe vollständig unterbrochen wird, die Temperatur bei 4 ° C während des Verfahrens zu homogenisieren.
Hinweis: Lassen Sie nicht Auftauen vor dem Hinzufügen des Puffers Biopsien.
(4) Zytoplasma Isolation
- Inkubieren Sie die homogenisierte Biopsie für 10 min auf Eis.
- Jede Probe, eine Endkonzentration von 0,05 % 10 µL 1 % Waschmittel (Nonyl Phenoxypolyethoxylethanol) hinzufügen.
Hinweis: Zellen werden anschwellen und platzen durch osmotische Lyse, da die Feinwaschmittel der Zellmembran stören wird. - 5 Minuten auf dem Eis inkubieren.
- Vortex kurz und Zentrifuge bei 400 X g bei 4 ° c für 2 min.
- Nach dem aufschütteln Entfernen des Überstands und überträgt es auf eine neue saubere 1,5 mL Tube; Dies wird den zytoplasmatischen Bruch sein. Entsorgen Sie die Tablette nicht.
(5) nukleare Isolation
- Die Pellets aus dem vorherigen Schritt mit 200 µL Waschpuffer Kerne aufzuwirbeln.
- Zentrifugieren Sie das Rohr für 2 min bei 400 x g und 4 ° C.
- Den überstand verwerfen und des Waschvorgangs noch zweimal zu wiederholen.
Hinweis: Waschungen werden in der nuklearen Bruchteil zytoplasmatischen Verunreinigungen entfernen. - Aufschwemmen Sie nach der dritten Wäsche das Pellet in 100 µL Puffer 2.
- Die Probe kräftig schütteln bei 4 ° c für 30 min. Alternativ, die Probe auf Eis und Wirbel alle 5 min inkubieren.
- Nach dem schütteln, Zentrifugieren die Probe für 10 min bei Höchstgeschwindigkeit (> 12.000 x g) und 4 ° C.
- Nach dem aufschütteln übertragen des Überstands in eine neue saubere 1,5. mL-Tube. Dies wird den nuklearen Bruch sein.
(6) Protein Quantifizierung
Hinweis: Quantifizierung der Proteine mit einem Bicinchoninic Säure (BCA) Protein Assay Kit. Die Konzentration der Proteine in den Fraktionen werden zwischen 0,5 und 5 µg/µL, tiefer in die nukleare Bruchteil Bereich (siehe Tabelle 2 für proteinkonzentrationen von 2 mg Biopsien).
- Bereiten Sie eine Standardkurve mit den folgenden Rinderserumalbumin (BSA) Mengen (µg)12: 0-0.5-1-2-3-4-5-6.
- Bereiten Sie die Reagenzien 100 µL der BCA Endmischung pro Probe verwenden musste.
- Pipette 2 µL der einzelnen Protein-Fraktionen in einer 96-well-Platte, die BCA-Mischung hinzufügen und folgen Sie den Anweisungen des Herstellers für die Lesung.
Ergebnisse
Abbildung 1 zeigt eine Hämatoxylin-Eosin Färbung eines intestinale Biopsie-Sektion mit intakten Zotten und Krypta Strukturen.
Repräsentative Ergebnisse der nuklearen und zytoplasmatischen Fraktionierung unter Verwendung dieses Protokolls sind in den Abbildungen 2 und 3gezeigt. Im Experiment gezeigt in Abbildung 2, ein frisches (Fh) und einem gefrorenen (Fz) Biopsie wurden gleichzeitig fraktioniert nach dem hier vorgestellten Protokoll und ein western-Blot erfolgte mittels 20 μg jeder Probe. Proteinkonzentrationen in jedem Bruchteil und Biopsie sind in Tabelle 2dargestellt, und der proteinkonzentrationen unterscheiden zwischen der frischen und gefrorenen Gewebes. Die Ausbeute an Protein 2 mg Biopsien entnommen wird um 3-4 µg/µL in der zytoplasmatischen Bruch und ca. 1,5 µg/µL im nuklearen Bruch. Überprüfen Sie die Reinheit der Fraktionen HSP90 und Tubulin dienten als eine cytoplasmatische Bedienelemente und HDAC1 und H3 als eine nukleare Kontrollen13. Es ist festzustellen, dass HSP90 und Tubulin primäre befindet sich im Zytoplasma sind und HDAC1 und H3 sich im Zellkern befinden mit minimaler Vermischung zwischen den beiden Fraktionen. Um festzustellen, ob das Protokoll Zelltod betrifft, ausgelöscht wir auch auf das Vorhandensein von Caspase-3. Aus Abbildung 2präsentieren beide Proben eine sehr geringe Färbung für Caspase 3 bestätigt, dass das Verfahren den Zelle Tod Weg auch nach Blitz Einfrieren der Biopsien nicht beeinflusst. Es war auch analysiert, wenn Protein Änderungen nach dem Eingriff erhalten bleiben, sodass Proteine für nachgeschaltete funktionelle Assays verwendet werden können. PhosphoSTAT1 diente zur Färbung wie ein Individuum mit einem Darm entzündliche Erkrankung die gefrorenen Biopsie in dieser Fraktionierung verwendet herkommt; Dies gilt nicht für die frischen Biopsie. Wie erwartet, befindet sich phosphoSTAT1 im Zytoplasma der gefrorenen Biopsie, bestätigt, dass die Protein-Änderungen nach der Fraktionierung gepflegt werden.
Die Reproduzierbarkeit der Methode mit gefrorenen Biopsien ist in Abbildung 3dargestellt. Ein western-Blot nach Fraktionierung von drei unabhängigen eingefroren Biopsien durchgeführt wurde, und die Fraktionen sind sauber mit minimalen Fach Protein mischen (Abbildung 3A): HSP90 befindet sich in der zytoplasmatischen Bruchteil und HDCA1 in der nuklearen Bruch. Darüber hinaus wurde auch das XPO1-Protein, das in beiden nuklearen und zytoplasmatischen Fraktionen14 vorhanden ist ausgelöscht. Es ist festzustellen, dass das Niveau der XPO1 von ImageJ quantifiziert stabil in jeder Bruchteil (Abb. 3 b), Reproduzierbarkeit der Ergebnisse mit verschiedenen Biopsien bestätigt sind.
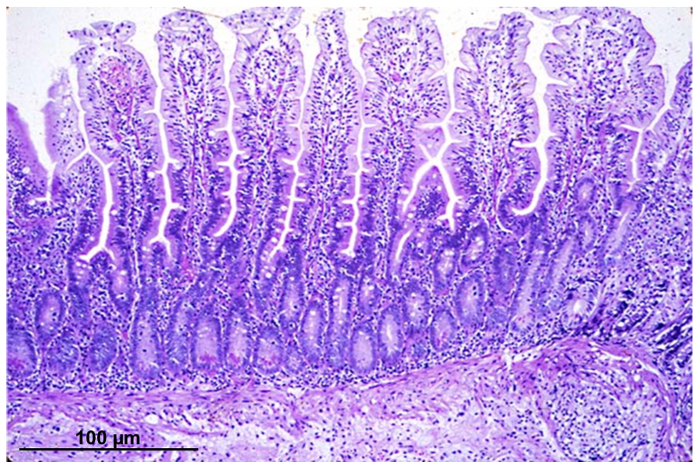
Abbildung 1 : Leichte Schliffbild einer intestinalen epithelialen Abschnitt, gefärbt mit Hämatoxylin-Eosin, aus einer Biopsie durch endoskopische Verfahren erworben. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Vertreter Western Blot der subzellulären Fraktionierung in ein frisches (Fh) und eine gefrorene (Fz) Biopsie durchgeführt. HSP90 und Tubulin dienten als zytoplasmatischen Kontrollen und HDAC1 und H3 als nukleare Steuerelemente. Das Vorhandensein von CASP3 und phosphoSTAT3 wurden ebenfalls bewertet.
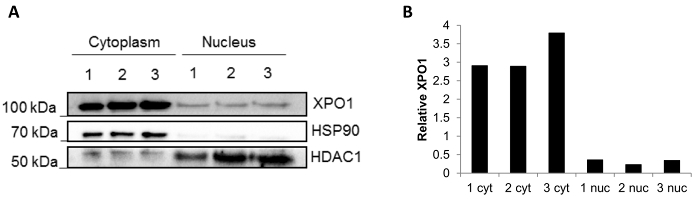
Abbildung 3 : Fraktionierung Ergebnisse aus drei Biopsien eingefroren. (A) Vertreter Western Blot der subzellulären Fraktionierung in drei gefrorenen Biopsien (1, 2 und 3) durchgeführt. HSP90 diente als eine cytoplasmatische Steuerung und HDAC1 als nukleare Kontrolle. Die Lokalisierung des XPO1 wurde ebenfalls bewertet. (B) Relative Quantifizierung der XPO1 in jedem der Fraktion getan mit ImageJ-Software. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Puffer | Komponenten | Notizen |
| Hypotone Puffer 1 | 10 mM HEPES pH 7,9 | 1,5 ml Puffer/Probe |
| 10 mM KCl | ||
| 0.1 NmM EDTA | ||
| Hypertone Puffer 2 | 20 mM HEPES pH 7,9 | 150 µl Puffer/Probe |
| 400 mM NaCl | ||
| 0,1 mM EDTA | ||
| * Hinweis: Puffer können im 4 für einen Monat aufbewahrt werden. | ||
| ** Hinweis: Puffer müssen vor Gebrauch mit Proteinase und Phosphatase-Inhibitoren und DVB-t ergänzt werden | ||
Tabelle 1: Puffer Zusammensetzung.
| Frisch | Gefroren | |
| Zytoplasma | 2.975 | 4.612 |
| Kern | 1.516 | 1.385 |
Tabelle 2: Protein-Konzentration der einzelnen Fraktionen in einer frischen und gefrorenen 2 mg Biopsie verwendet in Abbildung 2; Konzentration ist in μg/μL vorgestellt.
Diskussion
Das hier beschriebene Protokoll wird für die Kern- und zytoplasmatischen Fraktionierung von intestinalen Biopsien verwendet. Der gereinigten Proteine sind nicht denaturiert und kann verwendet werden, nicht nur in der western-Blot Analyse wie in Abbildung 2 und 3 , aber auch in Tests erfordern Native gefaltete Proteine wie Immunopräzipitation, elektrophoretische Mobilität Verschiebung Assay (EMSA) dargestellt oder Native Polyacrylamid Gelelektrophorese (PAGE).
Die beschriebene Methode stützt sich auf mechanische Homogenisierung des Gewebes zusammen mit osmotischen Lyse der Zellmembran platzt ohne Auswirkungen auf die Kernmembran. Das Ergebnis ist eine saubere Fraktionierung der zytoplasmatischen und nukleare Proteine für nachgelagerte Analysen verwendet werden. Es ist wichtig, den Abbau der Proteine während des Prozesses durch die Zugabe von Eiweiß und Phosphatase-Inhibitoren zu kontrollieren. Darüber hinaus sollen extrahierten Proteine für nachgeschaltete funktionelle Assays verwendet werden, ist es auch wichtig, Denaturierung und Proteolyse der Proben zu vermeiden. Die Prozesse sollten durchgeführt werden, bei 4 ° C und PMSF sollten auch die Puffer hinzugefügt werden.
In diesem Protokoll beschriebene Verfahren ist einfach und erschwinglich, und die Probe Bearbeitungszeit ist minimal. Probleme wie lange Bearbeitungszeiten und die Verwendung von teuren Fraktionierung Kits sind keine Einschränkungen in diesem Protokoll.
Frische und gefrorene Biopsien können beide in diesem Protokoll mit gefrorenen Biopsien ziemlich sauber und reproduzierbar Fraktionierung Ergebnisse wie in Abbildung 2 und 3verwendet werden. Ist Fach-Kontamination, die Zelle Lyse Zeit reduziert werden, um die Freigabe des nuklearen an Zytoplasma zu vermeiden und Waschschritte kann zur Vermeidung von zytoplasmatischen Kontaminationen in der nuklearen Fach hinzugefügt werden.
Die Möglichkeit der Verwendung von gefrorenen Gewebe für die unabhängige Analyse für nukleare und zytoplasmatischen Proteinfraktionen kann unser Wissen über entzündliche Darmerkrankungen erhöhen, in dem gefrorenen Biopsien gespeichert sind. Darüber hinaus könnte diese Technik auf andere Arten von menschlichem Gewebe durch Biopsien erworben angepasst werden. Das Volumen des verwendeten Puffer muss geändert werden, abhängig von der Größe der Biopsie.
Das hier beschriebene Protokoll soll reproduzierbar Gewebe Brüche zu erzeugen; jedoch kann einige innere Variabilität innerhalb der Probe, einschließlich der Größe und den Status des Gewebes zu Abweichungen in der Protein-Menge und Verteilung in jede Fraktion verwaltet führen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Autoren erkennen die Hilfe von Ander Lopez und Miren Telletxea für video aufnehmen und bearbeiten. ACR ist von einer Ikerbasque Gemeinschaft und ein Forschungsprojekt von Asociación de Celiacos Madrid (ACM) finanziert. JRB wird finanziert durch Projekt ISCIII-PI16/00258 und kofinanziert von der Europäischen Union EFRE/ESF "A Way to Europa machen". IST ein Projekt Forschungsstipendium 2015111068 der baskischen Gesundheitsministerium finanziert. IRG und AJM werden durch predoctoral Gemeinschaft Zuschüsse aus der UPV/EHU und das baskische Department of Education unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| HEPES | Sigma Aldrich | H4034-1kg | |
| KCl | Sigma Aldrich | P9333-1kg | |
| EDTA | Sigma Aldrich | E9884-100G | |
| NaCl | Sigma Aldrich | 5588886-1kg | |
| DTT | Sigma Aldrich | 10197777001 | |
| PMSF | Thermo Scientific | 36978 | |
| Proteinase and phosphatase inhibitors | Thermo Scientific | A32959 | |
| NP-40 | Sigma Aldrich | CA-630 | Detergent |
| BCA assay | Thermo Scientific | 23227 | Protein quantification kit |
| Disposable plastic pestles | Sigma Aldrich | Z359947-100EA | |
| Dounce homogeneizer | VWR | 431-0100 | |
| Microcentrifuge | Eppendorf | 5415-R | |
| Shacker | IKA | MS3 basic |
Referenzen
- Cox, B., Emili, A. Tissue subcellular fractionation and protein extraction for use in mass-spectrometry-based proteomics. Nature Protocols. 1 (4), 1872-1878 (2006).
- Itzhak, D. N., Tyanova, S., Cox, J., Borner, G. H. Global, quantitative and dynamic mapping of protein subcellular localization. eLife. 5, (2016).
- Preedy, V. R., Watson, R. R., Ronald, R. . Methods in disease investigating the gastrointestinal tract. , (1998).
- Alex, P., Gucek, M., Li, X. Applications of proteomics in the study of inflammatory bowel diseases: Current status and future directions with available technologies. Inflammatory bowel diseases. 15 (4), 616-629 (2009).
- Ericsson, C., Franzén, B., Nistér, M. Frozen tissue biobanks. Tissue handling, cryopreservation, extraction, and use for proteomic analysis. Acta oncologica (Stockholm, Sweden). 45 (6), 643-661 (2006).
- Hoffmann, K., et al. New application of a subcellular fractionation method to kidney and testis for the determination of conjugated linoleic acid in selected cell organelles of healthy and cancerous human tissues. Analytical and Bioanalytical Chemistry. 381 (6), 1138-1144 (2005).
- Foster, L. J., et al. A Mammalian Organelle Map by Protein Correlation Profiling. Cell. 125 (1), 187-199 (2006).
- Baghirova, S., Hughes, B. G., Hendzel, M. J., Schulz, R. Sequential fractionation and isolation of subcellular proteins from tissue or cultured cells. MethodsX. 2, e440-e445 (2015).
- Börner, A., et al. Subcellular protein extraction from human pancreatic cancer tissues. BioTechniques. 46 (4), 297-304 (2009).
- Antalis, T. M., Shea-Donohue, T., Vogel, S. N., Sears, C., Fasano, A. Mechanisms of disease: protease functions in intestinal mucosal pathobiology. Nature clinical practice. Gastroenterology. 4 (7), 393-402 (2007).
- Cutler, P. . Protein purification protocols. , (2004).
- Walker, J. M. The Bicinchoninic Acid (BCA) Assay for Protein Quantitation. The Protein Protocols Handbook. , 11-14 (1996).
- McLane, L. M., et al. Differential localization of T-bet and Eomes in CD8 T cell memory populations. Journal of immunology (Baltimore, Md.: 1950). 190 (7), 3207-3215 (2013).
- Nguyen, K. T., Holloway, M. P., Altura, R. A. The CRM1 nuclear export protein in normal development and disease. International journal of biochemistry and molecular biology. 3 (2), 137-151 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten