Method Article
Puces microfluidiques pour diffusion de lumière dynamique Diffraction de rayons x de cristaux In Situ et In Situ pour série cristallographie
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit en détail comment fabriquer et utiliser des dispositifs microfluidiques pour la collecte de données de diffraction des rayons x à la température ambiante. En outre, il décrit comment contrôler la cristallisation de protéines en diffusion dynamique de la lumière et comment traiter et analyser des données de diffraction a obtenu.
Résumé
Ce protocole décrit la fabrication des dispositifs microfluidiques avec faible bruit de fond des rayons x optimisé pour goniomètre basé cible fixe série cristallographie. Les dispositifs sont inspire de la colle époxy à l’aide de lithographie douce et conviennent pour des expériences in situ de diffraction des rayons x à température ambiante. Les puits d’échantillon sont balconnet sur deux côtés avec fenêtres de feuille polymérique polyimide qui permettent la collecte de données de diffraction avec faible bruit de fond des rayons x. Cette méthode de fabrication est peu exigeant et peu coûteux. Après l’approvisionnement d’une plaquette de maître SU-8, tous de fabrication peut être complétée à l’extérieur de la salle blanche dans un environnement de laboratoire de recherche typique. Le protocole de conception et fabrication de puce utiliser robinetterie capillaire à microfluidically diviser une réaction aqueuse définie nanolitres taille goutelettes. Ce mécanisme de chargement permet d’éviter la perte d’échantillon de morts-volume du canal et peut facilement être effectué manuellement sans l’aide de pompes ou autres équipements pour actionnement fluide. Nous décrivons comment isolé nanolitres taille gouttes d’une solution protéique peut être contrôlée in situ de la dynamique de la lumière diffusion contrôle protéine crystal nucléation et croissance. Après que cristaux adaptés est cultivés, diffraction des rayons x complet des ensembles de données peuvent être collectées à l’aide de goniomètre basé sur place fixée cible série diffraction à température ambiante. Le protocole prévoit des scripts personnalisés pour traiter des ensembles de données de diffraction en utilisant une suite d’outils logiciels de résoudre et d’affiner la structure cristalline de protéine. Cette approche évite les objets éventuellement induites lors de cryoconservation ou manuel à cristaux de manutention dans les expériences de diffraction conventionnelle. Nous présentons et comparer trois structures de protéines qui ont été résolus à l’aide de petits cristaux avec des dimensions d’environ 10 à 20 µm, cultivé dans la puce. Par cristallisation et diffractant in situ, manipulation et donc mécanique des perturbations des cristaux fragiles est réduit au minimum. Le protocole détaille comment fabriquer une puce de microfluidique transparent aux rayons x personnalisée adaptée aux in situ série cristallographie. Comme presque chaque cristal peut être utilisé pour la collecte de données de diffraction, ces puces microfluidiques sont une méthode de livraison de cristal très efficace.
Introduction
Il est essentiel de comprendre sa fonctionnalité de connaître la structure 3D d’une protéine. Résolution atomique près de structures sont jusqu'à présent plus souvent obtenues par cristallographie aux rayons x. Cette technique expose des cristaux de protéine à rayons x et les patrons de diffraction qui en résultent sont ensuite analysées pour le raffinement et la détermination de la structure. En diffraction traditionnel, un ensemble de données complet de diffraction est rapporté d’un cristal unique, idéalement large, à des températures cryogéniques. Ces cristaux, cependant, n’est généralement pas trivial de croître, et les conditions de la cryo-préservation appropriée peut devenir difficile en soi et peut parfois également provoquer des déviations par rapport à la structure de la protéine native5.
Laser à électrons libres aux rayons x (FEL) et les faisceaux de rayonnement synchrotron, les progrès technologiques récents ont permis de résoudre les structures des cristaux plus petits, comme nouveaux faisceaux micro-focalisation, accrue aux rayons x des rondins brilliance et amélioration des détecteurs de rayons x est devenu disponible6,7. En général, les petits cristaux est plus faciles à poussent plus grandes et défauts des cristaux libres8,9. Cependant, les petits cristaux souffre de radiolésions radiographie beaucoup plus rapide que de grands cristaux. C’est parce que par rapport à un gros cristal, une plus forte dose de rayons x doit être projetée dans un plus petit volume de cristal à diffracter à résolution comparable. Par conséquent, protection même cryogénique n’est souvent pas suffisante pour enregistrer un ensemble de données complet de diffraction d’un nom unique.
Pour surmonter cet obstacle, cristallographie de la série est devenue la méthode de choix pour collecter et fusionner des patrons de diffraction de nombreux microcristaux orientés au hasard pour obtenir un ensemble de données complet. Les rayons des dommages induits crystal sont minimisé en répartissant la dose totale de rayons x utilisés pour résoudre une structure protéique au cours d’un grand nombre de cristaux5,10. Dans un ' diffracter auparavant détruire ' FEL expérimenter, chaque cristal est utilisé uniquement pour une exposition à l’aide d’impulsions de rayons x de femto-seconde. Micro-focus faisceaux à des sources de rayonnement synchrotron troisième génération à son tour peut effectuer cristallographie série avec quelques millisecondes court13,de12,de11,avec des rayons x d’expositions14. Sans une oscillation de cristal ou de rotation au cours de la collecte de données, cependant, seulement des réflexions de Bragg partielles peuvent être enregistrées et donc des dizaines de milliers ou plusieurs patrons de diffraction sont normalement exigées pour la détermination de structure15. A ce jour, un éventail de méthodes de livraison des échantillons a été développé pour la série cristallographie, comme récemment révisé14,16,17,18,19. Parmi ceux, plusieurs cibles fixes basée livraison d’échantillon stratégies ont été combinées avec succès avec rotation de cristal au cours d’expositions aux rayons x telle que significativement moins patrons de diffraction peuvent fournir également des ensembles de données complets tout en également consommer moins échantillon par rapport à la cristallographie série classique expériences où les images fixes sont enregistrement7,16,20,21,22,23 , 24.
Nous présentons un protocole visant à fabriquer des dispositifs microfluidiques avec faible bruit de fond des rayons x. Les dispositifs sont inspire de la colle époxy 5 min à l’aide de lithographie douce et conviennent pour des expériences de diffraction des rayons x in situ à la température ambiante qui profitent de l’intégration de la préparation des échantillons directement dans la mise en place des rayons x, selon le cas avec résolution temporelle des études qui suivent cinétique induite par le mélange18,19. Canaux microfluidiques est balconnet sur les deux côtés avec une feuille de polymère polyimide, résultant dans windows x-ray avec une épaisseur combinée d’environ 16 µm qui permettent pour l’imagerie de fond faible aux rayons x. Tous les matériaux utilisés fournissent la bonne résistance aux solvant. Cette méthode de fabrication est relativement simple et peu coûteuse. Après l’approvisionnement d’une plaquette de maître SU-8, tous de fabrication peut être complétée à l’extérieur de la salle blanche dans un laboratoire recherche typique.
Dans un exemple d’application, nous décrivons puces pour goniomètre basé cible fixe série cristallographie. Tout d’abord, les considérations de conception et fabrication pour l’utilisation de valves capillaire à microfluidically diviser une réaction aqueuse dans un certain nombre de gouttelettes nanolitres de taille sont discutées. Ce mécanisme de chargement permet d’éviter la perte d’échantillon de morts-volume du canal et fractionnement peut facilement être effectué manuellement sans l’aide de pompes ou autres équipements pour actionnement fluide. Ces gouttes isolées nanolitres taille de solution protéique sont surveillés in situ à l’aide de diffusion dynamique de la lumière (DLS) contrôle protéine crystal nucléation et croissance. Il a été précédemment démontré que DLS mesures peuvent être réalisées dans les dispositifs microfluidiques consistant en une structure de polydiméthylsiloxane (PDMS) collée sur un verre diapositive25,26. Parce que la couche de polyimide a une forte transmission de longueurs d’onde plus de 550 nm, l’approche peut être étendue aux Mensurations en jetons transparents de radiographie ainsi, lorsque vous utilisez un de27,de longueur d’onde laser approprié28. Basé sur les résultats DLS, nucléation initiale peut être observée, et autre évaporation goutte peut être arrêtée pour obtenir des cristaux de protéines moins nombreux mais plus gros.
Après que suffisamment de cristaux est cultivés, ensembles de données complets de diffraction des rayons x peuvent ensuite être collectées à l’aide de goniomètre basé sur place fixée cible série diffraction à température ambiante. Ensembles de données de diffraction sont traitées à l’aide d’une suite d’outils logiciels et des scripts personnalisés pour résoudre la structure cristalline de protéine. Cette technique évite les objets souvent induites au cours de la cryo-préservation utilisée dans des expériences de diffraction conventionnelle.
Nous comparons trois structures de protéine cible qui ont été résolus en utilisant environ 10 à 20 µm petits cristaux cultivés dans la puce au mieux puis 2 résolution Å. Par cristallisation et diffractant in situ, manipulation et donc mécanique des perturbations des cristaux fragiles est réduit au minimum. Ce protocole peut être appliqué pour des cristaux de protéines qui diffracter à haute résolution ainsi que la faible résolution (1,7 Å à 3,0 Å). Comme presque chaque cristal peut être utilisé pour la diffraction, petit échantillon est gaspillée, ce qui en fait une méthode de livraison de cristal très efficace.
Ce protocole prévoit un guide détaillé sur comment préparer les puces microfluidiques transparent aux rayons x en situ protéine cristallisation et diffraction de collecte de données. La procédure a été soigneusement conçue pour bénéficier de microfluidique précision sans nécessiter des équipements sophistiqués dans le laboratoire. En outre, la collecte de données à la source de rayonnement synchrotron peut être effectuée sans nécessiter un goniomètre spécialisé ou un humidificateur pour faciliter la reproduction des résultats par des non-spécialistes. La technique présentée peut être appliquée milliseconde série cristallographie collecte de données à température ambiante tout en gardant les radiolésions minime et sans introduire de stress aux cristaux après une croissance de manutention cryo-protection ou cristal. Par conséquent, la méthode décrite est adaptée pour tout projet de cristallisation de protéines.
Protocole
1. conception et Fabrication de maître à puce
- Conception du masque
- Un aperçu des géométries de canal souhaité à l’aide d’un logiciel de dessin CAD adapté. Pour chaque couche de résine photosensible, préparez un masque individuel. Tous les modèles utilisés dans le présent protocole sont décrits en détail dans la section résultats et sont disponibles sous AutoCad ". DWG "format dans le fichier complémentaire 1.
Remarque : Pour la construction d’appareils tout-PDMS, le ratio d’aspect canal hauteur et la largeur ne doit pas dépasser 01:10 pour empêcher l’effondrement de la chaîne. Les film polyimide et résine époxy durci sont plus robustes et en principe devraient permettre également des proportions plus élevées. Toutefois, nous ne dépassait volontairement pas le 01:10 ratio, ainsi que premières conceptions pourrait être prototypée en tant que dispositifs traditionnels de PDMS. - Traduire par émulsion film photomasks fichiers DAO. Utilisez une résolution nominale de k DPI 64 pour permettre des fonctions précises jusqu'à environ 5 µm taille.
NOTE : Ceci est possible grâce à un service commercial. Services d’imagerie peuvent préférer des différentes conventions de dessin pour simplifier la conversion de fichiers pour l’imagerie du masque. Veuillez vous renseigner sur les conventions de dessin préférées dès le départ pour éviter tout ennui laborieux tournage pendant la conversion. Masques avec fonctionnalités transparentes sur fond noir seront patron SU8 photorésine caractéristiques sur la plaquette à rendement fonctionnel PDMS microcanaux au cours de la moulure de la réplique. À son tour, noirs caractéristiques sur les masques de fond transparent sont nécessaires pour préparer les moules PDMS adapté pour la fabrication de puce aux rayons x. Nous vous recommandons de commander les deux polarités du masque pour permettre début validation de conception et de prototypage fabriquer des dispositifs PDMS avant de traduire la conception en jetons de rayons x.
- Un aperçu des géométries de canal souhaité à l’aide d’un logiciel de dessin CAD adapté. Pour chaque couche de résine photosensible, préparez un masque individuel. Tous les modèles utilisés dans le présent protocole sont décrits en détail dans la section résultats et sont disponibles sous AutoCad ". DWG "format dans le fichier complémentaire 1.
- Fabrication de maître SU8
NOTE : C’est le seul processus qui doit être effectuée dans une salle blanche. Si l’équipement cleanroom critique n’est pas disponible, l’étape complète peut être sous-traitées à des entreprises de service de fonderie MEMS livrer prêt à motifs SU8 maîtres. SU8 processus selon l’instruction de feuille de données. Mesures 1.2.1 à 1.2.4 résument le déroulement général de fabrication maître SU8, avec les paramètres complets pour la conception de puces de radiographie tri-couche énumérés au tableau 1. Une introduction à multicouches SU8 alignement a été publié précédemment29.- Verser environ 1 mL de SU8 résister sur le manteau de wafer et spin 3 pouces le SU8 jusqu'à l’épaisseur désirée à l’aide de vitesse d’essorage appropriée et l’heure spécifiées dans le tableau 1 (Figure 1, étape 1). Pré cuire la résine photosensible selon l’épaisseur de la couche à 65 ° C et 95 ° C pendant quelques minutes chaque. Effectuer la précuisson pour solidifier SU8 pour éviter qu’il s’en tenir à la photolithographie et pour améliorer l’adhérence de résister au substrat (Figure 1, étape 2).
- Exposer la résine photosensible à la lumière UV, tel que spécifié dans le tableau 1 suivi d’un post-exposure-cuire au four à 95 ° C pour terminer catalytiquement la photoréaction initialisée lors de l’exposition (Figure 1, échelon 3).
- Répétez ces étapes pour chaque couche ultérieure. Puis aligner les masques de la couche ultérieure avec le maître à l’aide d’un aligneur de masque et pied à coulisse alignement marques29.
- Laver toutes les vierges SU8 résister en développant la plaquette en acétate d’éther méthylique propylèneglycol (PGMEA), jusqu'à ce qu’isopropanol rinçage n’est plus révèle des précipitations laiteuses (Figure 1, étape 4). Sécher la plaquette avec de l’azote sous pression.
NOTE : Isopropanol est un solvant pauvre pour SU8 et ses précipitations signifie résiduel demeure non polymérisée.
- Fabrication de moule PDMS
- Placer un morceau de papier d’aluminium (15 × 15 cm) dans une boîte de Pétri (10 cm) et le capitaine SU8 sur la feuille d’aluminium dans la boîte de Pétri pour faciliter le retrait du maître après durcissement de PDMS.
- Mélanger silicone base avec polymérisation agent (10:1), résultant d’un montant total de 25 g, vigoureusement avec une spatule dans un bocal ou un mélangeur mécanique. Une plaquette de 3 pouces dans une boîte de Pétri (10 cm) consomme environ 25 g de PDMS se traduire par une dalle épaisse de 5 mm.
- Versez pré-mélangés PDMS sur le SU8-master (Figure 1, échelon 5) jusqu'à une hauteur de 4 mm. déshydrater le PDMS pendant 5 min pour enlever les bulles d’air jusqu'à ce que no, ou seulement quelques bulles restent sur la surface PDMS.
- Guérir le PDMS dans une étuve à 70 ° C pendant 1 h. Puis découpez le PDMS guéri avec un scalpel et décoller doucement le moule PDMS du maître SU8 (Figure 1, étape 6). Couper tout le chemin vers le bas pour le maître afin d’éviter les fissures PDMS pendant l’épluchage.
- En option : Préparer les tranches transversales des moules PDMS pour confirmer que tous les SU8-couches sur le maître ont l’épaisseur désirée (Figure 1). Dépistage précoce d’agencement de microfluidique canal peut être effectuée tous les jetons de PDMS.
Remarque : Un réplique-moulés PDMS peuvent être collé directement sur un substrat de verre après le découpage des ports d’accès (étape 3.3) dans le PDMS grâce à l’activation de plasma O2 à l’aide de 20 s, 0,4 mbar O2, 50 W, 13,56 MHz. Tel que mentionné à la Section 1.2., cela nécessite en face mask polarité et par conséquent de wafer esquisse pour la fabrication de puces de rayons x.
2. in Situ aux rayons x puce Fabrication
- Diluer les deux précurseurs de résine époxy dans l’éthanol à une concentration d’éthanol final de 40 % en poids. Une masse totale de 0,25 g de chaque précurseur de résine époxy en éthanol est suffisante pour un morceau de2 cm 1.
NOTE : Ce qui réduit la viscosité de l’époxy 5 min qui en résulte pour simplifier les bulles de mélange et le moulage de la réplique le moule et pour réduire au minimum l’épaisseur de la couche finale époxy durci. L’éthanol s’évapore par le PDMS pendant l’étape de polymérisation. - Dégazer le moule PDMS dans un dessiccateur à vide pendant 30 min, afin qu’elle peut absorber de petites bulles d’air de la résine époxy lors de l’étape de moulage.
- Couper à environ 70 × 70 mm et span autour un 75 × 50 mm verre diapositive à l’aide de ruban adhésif pour obtenir une surface plane et rigide avec le ruban adhésif sur la face arrière du profil de polyimide. Plasma activer la grille avec 50 W, 13,56 MHz, 0,4 mbar O2 plasma pendant 20 s, puis incuber le slide feuille complète dans une solution aqueuse de 1 vol % (3-aminopropyl) trimethoxysilane (APTS) ou (3-glycidyloxypropyl) trimethoxysilane (TP) pendant 5 min à 20 ° C.
- Bien mélanger les deux solutions de précurseur époxy éthanol dilué pour garantir un comportement durcissement optimal. Récupérez la chambre à vide de PDMS-moules et placez-les sur une surface plane. Puis rapidement déposer une goutte de résine mixte sur chaque microstructure sur le moule à l’aide d’une micropipette (environ 10 µL par 1 cm2 de microstructures) (Figure 1, étape 7 a).
- Récupérer le "sandwich" de la feuille-slide polyimide de la solution aqueuse de silane de (APTS ou GTPS). Sécher la feuille avec l’air comprimé ou azote.
- Placez le sandwich aluminium-verre-slide de polyimide préparés sur la résine époxy déposés (Figure 1, étape 7 b). Appuyez fermement sur la lame de verre montée sur les profils de polyimide contre le moule PDMS. Placez une feuille de métal sur la lame de verre puis dépôt poids de jusqu'à 1,4 N/cm2 pression pendant 1 heure, pendant que l’époxy résine sèche à température ambiante.
Remarque : Dans l’idéal, sans résine reste sur la grille dans les domaines où les structures dans le moule ont la hauteur maximale. Ils correspondent à des puits de cristallisation où la cristallisation s’effectue par la suite.- Facultatif : Si un moulage précis de petits éléments est critique, le moule PDMS peut être renforcé avec une armature en aluminium au cours de la moulure étape31.
- Retirez la lame de verre avec le film polyimide et l’époxy à motifs de ce peeling du moule de PDMS (étape1 de la Figure 8). Plasma activer le côté motif époxy avec 50 W, 13,56 MHz, 0,4 mbar O2 plasma pendant 20 s.
- Après la suppression du profil de la chambre de plasma en polyimide, incuber l’aluminium époxy à motifs dans une solution de % aqueux APTS (ou TP) vol 1 pendant 5 min à 20 ° C. De la même manière, préparer une feuille de polyimide non modelés deuxième avec la complémentaire 1 vol % TP (ou APTS) activation du silane. Après l’incubation, sécher la feuille structurée et non structurée à l’air sous pression.
- Positionner l’époxy côté face vers le haut sur une surface plane, à l’aide de la tension superficielle d’une goutte d’eau dessous comme médiateur afin d’éviter de friser de la feuille tout en assurant une planéité maximale. Placez ensuite la seconde feuille de polyimide activés sur le dessus et délicatement strie avec votre doigt, d’un coin à l’opposé pour les faire coller et pour éviter la formation de bulles.
3. l’accès des Ports pour livraison fluide
- Préparer 4 mm épaisseur dalles PDMS dans une boîte de pétri selon étapes 1.3.1 à 1.3.3 sans utiliser le SU8-master. Couper la galette en blocs PDMS de taille appropriée pour couvrir tous les ports d’entrée dans la puce, sans couvrir les compartiments individuels de la cristallisation de la puce.
- Plasma activer tous les deux, la puce et le PDMS bloquer dans 50 W, 13,56 MHz, 0,4 mbar O2 plasma pendant 20 s. Pour la liaison chimique, puis incuber chaque partie en 1 vol % APTS ou fermeture solution aqueuse pendant 5 min à 20 ° C. Chaque partie avec de l’air sous pression à sec, puis appuyez sur la dalle PDMS sur le morceau de papier d’aluminium.
- Pour améliorer le collage, placer la puce sur une dalle PDMS plate et recouvrez-le d’une feuille de plastique, suivie d’une lame de verre propre et un bloc de métal. Enfin, déposer des poids pour appliquer jusqu'à 1,4 N/cm2 pression pendant environ 1 h.
- Percer des trous d’accès avec un poinçon de biopsie de 0,75 mm dans chaque position où les orifices d’entrée et de sortie sont marqués dans la conception de puce et sceller le dos avec du ruban adhésif. La puce est maintenant accessible pour tout les tubes avec un diamètre extérieur correspondant au diamètre du trou (comme décrit à l’étape 4.2).
4. traitement extérieur
- Préparer un 01:20 dilution 9 wt % polymère fluoré du stock de fluoro-solvant à une concentration finale de 0,45 % en poids. Placez les dilutions et les solutions mères dans un réfrigérateur dans l’obscurité à 4 ° C.
- Charger le 01:20 fluoropolymère dilution dans une seringue de 1 mL Luer lock. Attacher une 27 × 5/8" aiguille de la seringue, puis un tube PTFE à l’aiguille.
- Raccordez le tuyau à la sortie de puce aux rayons x et injecter la solution de travail de polymère fluoré préparée à l’étape 4.1 jusqu'à ce que tous les canaux sont remplis.
- Placer la puce avec le côté plat vers le bas sur une plaque chauffante de 190 ° C pendant 5 min évaporer tout solvant pour déposer le fluoropolymère dans une couche mince.
Remarque : Lorsque vous utilisez une nouvelle géométrie, vérifiez si les canaux ont été obstrué avec fluoropolymère au cours de ce procédé de revêtement. Dans l’affirmative, encore diluer la solution mère.
5. préparation de la protéine
- Peser la thaumatine lyophilisée et dissoudre dans une solution tampon figurant au tableau 2 pour le volume approprié pour obtenir une concentration finale de protéine de mg 40 mL-1.
- Dialyser glucose isomérase contre le tampon figurant au tableau 2 , conformément au protocole du fabricant.
- Préparer le thioredoxin de protéine comme décrit plus haut par Schubert et al. 30.
- Vérifier les concentrations de protéine finale par photométrie en utilisant les coefficients d’extinction résumées dans le tableau 2, calculé par le logiciel ProtParam32.
- Préparer toutes les solutions à l’aide de l’eau ultrapure et les filtrer avec un filtre de 0,2 µm.
- Centrifuger les solutions protéiques à 20 ° C à 16100 x g pendant 15 minutes et prendre le surnageant pour des expériences de cristallisation.
6. protéine cristallisation dans la puce de rayons x
- Pour cristalliser les protéines dans les puces microfluidiques, mélanger une quantité égale de solution de protéine et precipitant. La concentration de protéines, la composition du tampon et precipitant composition sont résumées dans le tableau 2. Préparer un volume total de près de 20 µL à remplir une puce microfluidique.
- Immédiatement après le mélange, injecter la solution à l’orifice de la puce via une seringue, couplé à une 27 × 5/8" aiguille et le tube PTFE avec 0,75 mm de diamètre externe (détaillé dans l’étape 4.2).
Remarque : La procédure de remplissage pour le schéma série nécessite un amorçage préalable de la puce avec de l’huile de fluoré, qui se fait plus facile en chargeant l’huile fluorés de l’orifice de sortie avant d’injecter la solution de cristallisation dans l’orifice d’entrée. Toutes les étapes de chargement doivent être surveillées à l’aide d’un microscope pour contrôler la pression appliquée seringue et le débit correspondant. » - Après que la puce est remplie, séparer les compartiments individuels cristallisation en injectant fluorés huile dans l’orifice d’admission de la puce. Sceller la puce en bloquant tous les ports d’entrée et de sortie de la puce. Cela peut être fait en insérant un trombone.
NOTE : Parce que les compartiments de cristallisation sont remplis par la solution de protéine/précipitant, l’huile fluorés seulement remplit le canal d’admission de la puce, sans affecter la solution dans les compartiments de la cristallisation. - Pour mimer une cinétique de cristallisation de diffusion vapeur, placer la puce hermétique à température ambiante et une atmosphère normale afin de permettre la goutte dans le compartiment de cristallisation pour réduire l’évaporation de l’eau à travers le film polyimide.
- Après crystal on observe la formation via un microscope ou mesures DLS (étape 7), transférer la puce microfluidique complète dans la solution appropriée, precipitant, s’arrêter plus loin évaporation provenant des puits de cristallisation jusqu'à la diffraction des rayons x expérience est réalisée.
7. dynamique lumière Scattering Measurements in cristallisation Wells dans la puce
NOTE : DLS mesures ont été effectuées avec une laser une puissance de 100 mW, une longueur d’onde de 660 nm et la lumière diffusée a été détecté à un angle de diffusion de 142°. Parce que l’échantillon étudié toutes les solutions ont été aqueuses l’indice de réfraction de l’eau (n = 1,33) a été utilisé dans tous les calculs.
- Place la microfluidique puce dans le dans le support de plaque format SBS de l’instrument de listes de distribution à l’aide de l’adaptateur indiqué au point 8.1. Insérez l’adaptateur dans l’appareil.
- Ajustez soigneusement la mise au point du laser à l’intérieur d’un compartiment de la puce microfluidique en utilisant le moteur x - y-, z-scène. Parce que la puce microfluidique est très mince, ajustez le niveau z en appliquant les étapes petit incrément.
Remarque : Un réglage correct est confirmé par une interception élevée et une queue lisse de la fonction d’autocorrélation résultant de la mesure de DLS. Un fichier de calibration peut être créé pour correspondre à la position de chaque cristallisation individuelle bien dans la puce microfluidique, permettant des mesures automatisées de DLS dans plusieurs compartiments au fil du temps. - Effectuer chaque mesure DLS à 293 K pour 30 s et répéter la mesure toutes les 5 min jusqu'à la fin de l’expérience de la cristallisation.
NOTE : Nucléation Initial peut être suivie de la distribution de rayon des mesures DLS au fil du temps et la formation de cristaux réussie peut être suivie en parallèle par le microscope intégré du lecteur de plaque DLS.
8. collecte de données de diffraction
- Adaptateurs pour beamline goniomètres
- Imprimer les cartes pour le goniomètre de plaque pour positionner et tournez les morceaux de rayons x au cours de la collecte de données cristallographiques.
- Fabriquer les adaptateurs pour le goniomètre base sur une imprimante 3D de passe-temps de qualité en utilisant les paramètres par défaut, tel que recommandé par le fabricant.
Remarque : Les cartes ont été conçues à l’aide d’un système 3D-CAD, mais les fichiers coordonnées des adaptateurs sont attachées dans '. STL'-format de fichier dans le supplément. - Fixer les morceaux de rayons x à la carte à l’aide de ruban adhésif double face.
-
in situ la cristallographie aux rayons x
- Recueillir des données de diffraction en utilisant une taille de faisceau de 10 × 5 µm (FWHM de profil gaussien) à 296 K. utilisation de rayons x avec une énergie de 12,8 keV et un flux de 2,2 · 1011 photons · s-1 dans le faisceau atténué et les patrons de diffraction record avec détecteur à pixels Pilatus 6 M hybride.
NOTE : Dispositifs microfluidiques contenant thaumatine, cristaux de glucose isomérase ou thioredoxin est utilisés pour in situ aux rayons x cristallographique des expériences à l’EMBL beamline P14 du synchrotron PETRA III. Flux et taille de focus faisceau disponibles peuvent différer à d’autres sources de rayons x. Le nombre de cristaux de protéines exposées, le nombre de patrons de diffraction enregistrées de chaque cristal, la gamme d’angle d’oscillation par l’exposition et la durée d’exposition est résumé dans le tableau 3. - Processus d’ensembles de deux patron de diffraction consécutives individuellement à l’aide du programme XDS33. Utilisez le script bash « xds.sh » trouvé dans le supplément.
- Créer des fichiers HKL pour chaque jeu de données de tous les cristaux et l’échelle à l’aide du logiciel XSCALE33. Utilisez le script bash « xscale.sh » dans le supplément pour créer un fichier d’entrée pour XSCALE.
NOTE : Seulement les datasets de cristaux ayant des coefficients de corrélation supérieur à 90 %, ce qui indique un degré élevé d’isomorphisme, devrait faire évoluer. Le critère conservateur ‹I/σ (I) › (> 2) doit être utilisé pour déterminer la coquille de résolution plus élevée. Remplacement moléculaire en utilisant le programme MOLREP34 à la suite de CCP435 peut être utilisé pour obtenir les phases pour l’autre modèle de construction en utilisant les coordonnées 3D de la protéine Data Bank (PDB) indiquées au tableau 3. - Affiner toutes les structures isotopique à l’aide de Refmac535,36 et utiliser FOULQUE37 pour l’inspection visuelle du modèle final.
Remarque : Les molécules du solvant s’ajouteront automatiquement pendant le processus de raffinement et doivent être vérifiés afin de confirmer les positions chimiquement raisonnables. Tous les modèles doivent être inspectés afin d’identifier les valeurs aberrantes Ramachandran.
- Recueillir des données de diffraction en utilisant une taille de faisceau de 10 × 5 µm (FWHM de profil gaussien) à 296 K. utilisation de rayons x avec une énergie de 12,8 keV et un flux de 2,2 · 1011 photons · s-1 dans le faisceau atténué et les patrons de diffraction record avec détecteur à pixels Pilatus 6 M hybride.
9. évaluation des données
- Dommages de rayonnement
- Analyser la désintégration du pouvoir de diffraction au fil du temps en utilisant une méthode décrite par Owen et al.,38. Pour cela, calculer la somme totale de valeur (fourni par XDS33) de toutes les réflexions indexées de chaque jeu de données de diffraction évalués (2 schéma de diffraction consécutifs), à utiliser comme valeur de référence. Utiliser le script bash « ISigma.sh » le supplément.
- Normaliser le pouvoir de diffraction de chaque jeu de données à la puissance moyenne de diffraction du premier jeu de données.
- Analyser le changement des valeurs Rmeas au fil du temps en prenant les valeurs de Rmeas des fichiers Correct.LP obtenus de XDS33 (bash script « Rmeas.sh » à partir du supplément).
- Orientation cristalline
- Déterminer les angles d’Euler pour obtenir des informations sur la distribution des orientations en ce qui concerne le système de coordonnées du laboratoire réseau cristallin. Calculer les angles d’Euler de la matrice d’orientation XDS donnée dans le fichier de sortie XPARM39 à l’aide du logiciel Matlab. Utiliser le script bash « rotation_matrix.sh » pour extraire la matrice de rotation de chaque cristal provient du fichier XPARM. Utilisez le fichier de sortie en tant qu’entrée dans Matlab pour calculer les angles d’Euler en utilisant le rotro2eu.m de fonction Matlab (fichier supplémentaire).
NOTE : Une description détaillée du calcul a été publiée par Zarrine-alysson et al.40. - Convertir les angles d’Euler obtenues des radians en degrés. Les angles d’Euler obtenues pour tous les avions de trois rotation (xy, xz et zy) en classes de 10° du groupe et tracer en utilisant le logiciel origine9.
- Déterminer les angles d’Euler pour obtenir des informations sur la distribution des orientations en ce qui concerne le système de coordonnées du laboratoire réseau cristallin. Calculer les angles d’Euler de la matrice d’orientation XDS donnée dans le fichier de sortie XPARM39 à l’aide du logiciel Matlab. Utiliser le script bash « rotation_matrix.sh » pour extraire la matrice de rotation de chaque cristal provient du fichier XPARM. Utilisez le fichier de sortie en tant qu’entrée dans Matlab pour calculer les angles d’Euler en utilisant le rotro2eu.m de fonction Matlab (fichier supplémentaire).
Résultats
Epoxy est un matériau de remplissage excellent pour la fabrication de puce aux rayons x. C’est pas cher, simple et robuste au processus sans nécessiter d’outils spécialisés (Figure 1). Réduisant la viscosité époxy avec 40 % d’éthanol wt dilution d’il a facilité l’élimination des excès de résine au-dessus du puits de cristallisation, résultant dans windows définis de rayons x. Dilutions plus élevées de l’éthanol a abouti à des défauts dans la résine polymérisée. En analysant les coupes de puce aux rayons x, nous avons déterminé l’épaisseur totale de fenêtre des deux parties pour être environ 19 µm d’épaisseur, qui est très proche de l’épaisseur nominale des foils polyimide usagé de 2 × 7,5 µm (Figure 2)
Essais de cristallisation ont été isolés en nanolitre taille plusieurs réaction compartiments chacune, à l’aide d’un mécanisme de soupape capillaire comme décrit plus haut41. Cette technique de chargement « magasin-alors-créer » évite la perte d’échantillon de morts-volume du canal et peut facilement être effectuée manuellement, éliminant le besoin d’utiliser des pompes ou autres équipements pour actionnement fluide42. La puce est apprêtée avec de l’huile fluorés avant de charger l’échantillon aqueux. La tension superficielle à l’interface huile / eau huile d’amorçage et les résultats de l’échantillon aqueux à une différence de pression au niveau de l’interface. Cette pression de Laplace dépend à la fois le rayon de courbure et la tension superficielle de l’interface. Afin de minimiser son énergie, l’interface doit réduire sa surface, ce qui équivaut à maximiser ses principaux rayons de courbure à volume constant. Une interface de faible courbure dans un large canal a une plus faible pression de Laplace puis une interface de grande courbure dans un segment étroit canal. Par conséquent, la prise de l’échantillon passe préférentiellement et traverse l’ensemble du canal au lieu de traversant les restrictions de soupapes étroit de capillaire de dérivation. Enfin, la prise d’échantillon est suivie par les hydrocarbures fluorés pour séparer les puits échantillon en gouttelettes indépendants.
Robuste et fiable de chargement a été réalisé avec des débits jusqu'à 1 mL/h, un numéro de série et un arrangement bien parallèle (Figure 3). Dans la layout « série », bien des constrictions soupape d’admission et capillaire sont séquentiellement reliées par un canal de dérivation31. En revanche, dans la disposition « parallèle », deux canaux principaux séparés connecter toutes les arrivées bien ou capillaire vannes seulement43. Ces deux notions d’arrangement ont été précédemment combinées avec contrôle de la formulation à la composition de l’écran, qui est un aspect utile dans la cristallisation de protéines43,44. La conception de série a seulement deux ports fluides, une entrée et une sortie. Il a moins de ports liquides et pour cette raison, il est plus simple à construire et à exploiter. La disposition parallèle possède 4 ports fluides, 2 pour la voie principale reliant les puits et 2 pour relier les vannes capillaires pour laisser l’air ou évacuation de l’excès d’huile. Chargement peut donc aller de l’avant des deux côtés du chenal principal. Cette disposition a globalement abaisser la résistance à l’écoulement d’un nombre égal de puits en raison de sa dérivation plus courte. Il est donc mieux adapté pour les appareils à bractées vers le haut avec un grand nombre de puits. En outre, les puits d’échantillon sont orientés plus près ensemble, qui offre des avantages pour automatisé d’imagerie.
Exemple complet bien chargement a été observée pour les deux mises en page, si soit construit comme une deux-hauteur ou une conception de trois-hauteur. Dans une conception de deux-hauteur, l’échantillon bien et les canaux de dérivation sont de même hauteur. La conception de trois-hauteur nécessite un troisième masque, canaux de dérivation une couche supplémentaire de SU8 et une étape de l’alignement davantage à s’assurer que les puits d’échantillon deviennent plus élevés que la précédente. Cette différence de hauteur favorise l’entrée du liquide de l’échantillon dans le puits à travers le capillaire même principe qui arrête l’écoulement au niveau des constrictions de robinetterie. Ici, le plafond bien plus élevé correspond à une basse pression de Laplace du ménisque et écoulement le long de la rocade direction avancée est favorisée seulement après que puits ont complètement remplies telles que les constrictions vanne obstrue l’écoulement et détourner vers le bas de la route de contournement. Cependant, chargement réussi ne requiert pas strictement les puits plus élevé que le bypass comme robinetterie capillaire approprié peut également être réalisé en ajustant les largeurs de voie en conséquence. Néanmoins, dans notre expérience, les puits supérieurs effectué beaucoup plus robuste et défaut de chargement libre a été observée à jusqu'à dix fois débits plus élevés dans toutes les conceptions de trois-hauteur par rapport à leurs équivalents deux-hauteur. Cet effet est plus prononcé dans la disposition parallèle.
Pour imiter la vapeur diffusion cinétique de cristallisation, la perméabilité finie de la feuille de polyimide a été exploitée pour contrôler l’évaporation de l’eau au fil du temps. Taux d’évaporation expérimentaux ont été quantifiés en surveillant le changement du volume de la goutte au fil du temps en égalisant la surface de la goutte et bien hauteur (Figure 4). L’évaporation des puits de cristallisation dans la puce de rayons x ne procède pas de façon linéaire, comme une surface qui se rétrécit de la goutte qui coïncide avec l’augmentation des résultats de la concentration en soluté dans un taux d’évaporation réduite au fil du temps,45. L’évaporation initiale suivie un taux approximativement linéaire d’environ 0,5 h nL-1 dans les puits de la géométrie de mise en série.
Pour mieux comprendre la cinétique de cristallisation, mesures de DLS ont été effectuées dans les puits de cristallisation de la puce microfluidique. Pour les mesures initiales de DLS, une puce PDMS collée sur une lame de verre a été utilisée pour prévoir mieux les propriétés optiques de l’expérience de diffusion de la lumière. Cette puce avait les mêmes dimensions bien que la puce de rayons x. PDMS a une perméabilité plus élevée de vapeur d’eau que le polyimide des fenêtres polyimide dans la puce de rayons x45. Étant donné que les flux évolue linéairement avec la distance, la trajectoire de l’évaporation d’un polyimide fenêtré bien peut correspondre avec une fenêtre PDMS correspondante d’épaisseur appropriée.
DLS résultats montrent que la distribution de rayon change au fil du temps (Figure 4 a-B), ce qui démontre que les mesures de DLS permettent de détecter la nucléation initiale avant premières particules cristallines sont observées. Cette information peut servir à nucléée et la croissance des monocristaux par puits en extérieur réglant le taux d’évaporation et donc les niveaux de sursaturation à un stade précoce de la nucléation46.
La puce de rayons x a été fixée sur un adaptateur 3D imprimé pour le goniomètre de plaque compatible SBS à la source de rayonnement EMBL du synchrotron P14 à PETRA III (Figure 5 a). Par ailleurs, un plus petit gabarit imprimé 3D peut servir à copeaux de Mont radiographie standard beamline goniomètres21. Thaumatine cristaux ont une taille de 10 à 20 µm (Figure 5 b) et diffracter jusqu'à une résolution de 2.0 Å (Figure 5). Comme prévu, la contribution de fond aux rayons x des deux fenêtres polyimide minces feuilles de la puce de rayons x est limitée aux cercles de dispersion de polymère polyimide à 11 Å (2θ ~ 5°) et 33 Å (2θ ~ 1,7 °) pour la longueur d’onde des rayons x de 0,97 Å. Ces deux anneaux ne dérangez pas le traitement des données. Un dataset total avec 83 thaumatine cristaux ont été recueilli et 10 patrons de diffraction sont enregistrées à chaque cristal avec une rotation de 1° au cours de chaque image. Traitement des données et paramètres de raffinement, ainsi que les statistiques de la thaumatine dataset sont répertoriés et par rapport aux deux autres ensembles de données de glucose isomérase et thiorédoxine qui ont également étaient collectées in situ sont répertoriés dans le tableau 3 et Tableau 4.
La décroissance de l’intensité de la puissance de diffraction normalisée au fil du temps a été étudiée par scission du dataset thaumatine dans cinq séries de données sup (deux patrons de diffraction ont été utilisés par sous-ensemble pour maintenir des ensembles de données complets). Comme le montre la Figure 6 b, le pouvoir de diffraction a commencé à diminuer après le premier dataset sub et était inférieure à 50 % dans le quatrième dataset sous. En conséquence, les valeurs Rmeas des sous ensembles de données sont également en augmentation au fil du temps, indiquant les radiolésions rayons x lors de la collecte de données. Nous émettons l’hypothèse que les radicaux libres générés au cours de l’exposition aux rayons x rapidement dégrader cristaux voisins dans le même compartiment de réaction. Par exemple, ces dommages secondaires de rayons x a été que moins prononcé dans une approche expérimentale connexe, où les cristaux ont été distribués sur une surface beaucoup plus importante dans un "sandwich" de polyimide21. Pour minimiser les dégâts de radiographie générale, seul un petit nombre de patrons de diffraction d’un cristal particulière doit être recueilli à la température ambiante. En outre, qu’un seul cristal de protéine unique doit être exposé chaque compartiment de la puce microfluidique. Néanmoins, tous les modèles de structure raffinées en utilisant les ensembles de données traitées montrent très bonne stéréochimie et statistiques appropriés (tableau 4). En outre, toutes les cartes de densité d’électron final étaient de très bonne qualité.
Dans les précédentes approches de cristallographie sur copeaux transparente aux rayons x, l’orientation et l’arrangement des cristaux devaient être délibérément manipulé pour obtenir une répartition aléatoire de cristal orientations40 ou a été obtenue par des mouvements de cristal au sein de la couche liquide21. Pour évaluer l’orientation cristalline dans les chips de microfluidique transparent aux rayons x décrites dans le présent protocole, l’orientation de cellule d’unité de tous les cristaux exposés par rapport au repère de laboratoire a été déterminée. Pour les cristaux de thaumatine bipyramidale, une légère préférence a été observée (Figure 7 a), alors que nous avons obtenu une large distribution des cristaux de glucose isomérase (Figure 7 b). Nous avons pensé que sur l’échelle du nanomètre, la plupart des matériaux pièce rugosité importante. Donc, les cristaux puisse nucléée spontanément sur la surface en nettement moins biaisées orientations spontanément. Tel un noyau petit cristal peut être verrouillé dans une séance d’orientation, tout en continuant de se développer à la taille appropriée sans changement de position par rapport à la normale de la surface. En fait, nucléation de surface cristal médiatisée a longtemps été une nuisance pour les cristallographes essayant un cristal attaché sur la surface de boucle sans endommager le cristal dans le processus. Ici, nous pouvons utiliser directement ces cristaux pour la collecte de données de diffraction. Cependant, les limitations spécifiques du système existent, comme la thiorédoxine a révélé une forte préférence pour certaines orientations dans le xy, xz et yz-planes (Figure 7). Les exemples montrés montrent que la distribution de l’orientation ne dépend pas seulement sur le milieu de croissance, mais aussi sur la forme de cristaux. Les cristaux de thioredoxin allongées des formes qui ont tendance à se développer dans une orientation préférentielle, tandis que les cristaux de thaumatine bipyramide tétragonale ou cristaux orthorhombiques glucose isomérase ne présentent pas ce comportement. Toutefois, dans tous les cas, même avec des orientations préférentielles, que la gamme accessible des rotations de cristal a entraîné suffisamment bonne couverture de l’espace réciproque et donc complet des ensembles de données pour tous enquêté sur les protéines. Ainsi, aucune des mesures supplémentaires ne devaient être prises lors de la sélection des cristaux pour Radiographie du thorax : exposition.

Figure 1 : Régime de microfluidique fabrication de puce aux rayons x. (1) SU-8 est dispensé sur un substrat de silicium et un essorage enduit pour obtenir l’épaisseur désirée. (2) résine photosensible est exposée à la lumière UV à travers un masque. (3) résine photosensible non exposé est ensuite développée de loin en lavant consécutivement avec PGMEA et l’isopropanol, entraînant (4) un maître SU-8 pour effectuer le cast encore pas. (5) PDMS est déversée, et (6) après durcissement du moule PDMS, est épluché du maître SU-8. colle époxy (7 a) est distribue sur le moule PDMS et (7 b) une pellicule polyimide activés est chimiquement lié à la résine époxy. (8) après durcissement, la grille de polyimide avec le film patterned époxy fine est épluchée du moule de PDMS. (9) dans une étape finale, l’appareil est balconnet avec une deuxième feuille de polyimide de céder un clos puce microfluidique faible rayons x fond. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Photo (à gauche) et des images de microscopie de coupes transversales les derniers jetons. Un segment de chaîne représentant (au milieu) et un puits de cristallisation (à droite) de deux puces distinctes sont indiquées. Les flèches indiquent les distances mesurées. Toutes les dimensions sont en µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Schémas de cristallisation conçoit bien avec [un] parallèle ou série mise en page de [B], telle que vue par le haut et par le côté, avec les dimensions indiquées en µm. Hauteur canal typique était : contournement de 50 µm, 50 à 60 µm cristallisation bien, 5-10 µm vanne capillaire, correspondant bien en volumes d’environ 2,5 nL (disposition parallèle) et 8 nL (série mise en page). Représentant bien les comportement de chargement est illustré à l’aide de colorants alimentaires. La puce, on a 12 % en poids de 1H, 1 H, 2H, 2H-perfluoro-1-octanol dans FC-43, avant le colorant alimentaire a été injecté dans les puits de stockage. Flèches blanches indiquent le sens de circulation. Images d’aperçu du spectacle de dispositifs chargé chargés de tous les puits défaut chargement gratuit, illustratrices échantillon robuste. La disposition parallèle est illustrée comme une conception de trois-hauteur, avec puits de cristallisation plus élevés que le bypass, tandis que la mise en série est représenté comme une conception de deux-hauteur avec puits et contourner d’égale hauteur. Les débits typiques ont été environ 150 µL/h pendant le chargement, mais défaut de chargement libre a été observée pour les débits jusqu'à 1 mL/h sur une hauteur de trois-design. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : In situ diffusion dynamique de la lumière d’une cristallisation bien au fil du temps. [A] séries d’images microscopiques de la cristallisation bien. La goutte stockée continue se rétrécit comme vapeur d’eau s’évapore au fil du temps. Première thaumatine microcristaux peut être observés après 4 h. [B] correspondant hydrodynamique rayon distribution des particules thaumatine mesurée par DLS durant le processus de cristallisation même photographié [a]. La formation de la deuxième fraction rayon, indiquant les événements de nucléation initial peuvent être vu après volume représentatif à environ 1-2 h. [C] diminution de deux volumes de gouttelettes de référence en raison de la perte d’eau par évaporation au fil du temps. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : collecte de données in situ diffraction. [A] puces microfluidiques individuels sont montés par un adaptateur imprimé 3D (bleu) sur un goniomètre de plaque. [B] thaumatine cristaux dans la microfluidique puce au cours de l’exposition aux rayons x comme imagée par le microscope en ligne à ligne de faisceaux P14. [C] diffraction des cristaux thaumatine a été enregistrée à une résolution de 2.0 Å, avec une façon négligeable faible bruit de fond. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : Évaluation des données des données de diffraction de la thaumatine cristaux dans la puce microfluidique, enregistrée à la température de la pièce. [A] densité d’électrons du modèle thaumatine raffiné en utilisant le cadre 1-2 dataset uniquement (contours bleus à 1,5 σ). [B] désintégration d’intensité de thaumatine cristaux en fonction de la dose de rayons x. [C] evolution de la valeur de Rmeas sur la dose de rayons x. La boîte des parcelles dans [B] et [C] avec quartiles (valeurs supérieur 75 %, valeurs médianes 50 %, valeurs 25 % inférieure et moyenne) et les moustaches avec 95 % intervalle de confiance représentent la décroissance de l’intensité de diffraction et Rmeas de tous les cristaux exposés (n = 83). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
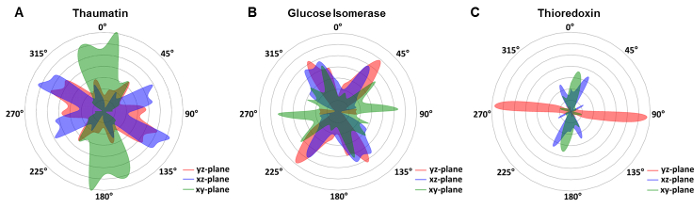
Figure 7 : Distribution des orientations cellule unité en fleuret par puce microfluidique en ce qui concerne le système de coordonnées du laboratoire. [A] les cristaux de thaumatine bipyramidale ont montré une large distribution des orientations portant sur près de 180° dans les xy-(bleu), (vert) le plan xz et plan de yz-(red). [B] glucose isomérase montre également une distribution de grande envergure, tandis que la thiorédoxine [C] a montré une nette préférence pour certaines orientations. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| SU8-couche | Manteau de spin | Précuisson | Exposer | Après cuisson au four |
| [65 / 95 ° C] | [65 / 95 ° C] | |||
| 1 couche dest : Wells | 1000 TR/MIN | 0 / 10 min | 200 mJ/cm2 | 1 / 4 min |
| 15 µm SU8-3010 | ||||
| 2ème couche : Bypass | 2000 TR/MN | 0 / 16 min | 220 mJ / cm2 | 1 / 5 min |
| 35 µm SU8-3025 | ||||
| 3rd couche : vannes | 3000 TR/MIN | 0 / 3 min | 150 mJ / cm2 | 1 / 2 min |
| 5 µm SU8-3005 |
Tableau 1 : exemple de processus SU8 pour la conception de trois-couche parallèle aux rayons x puce. Ce classement de couche permettra un moule PDMS de casting pour la fabrication de puces de rayons x. Pour mouler directement un PDMS lors de prototypage, inverser la couche ordonnant au cours de la fabrication de maître à partir de la 3rd pour en finir avec la 1st couche au lieu de cela.
| Protéine | Concentration de protéines | Mémoire tampon protéique | precipitant | Groupe d’espace, entrée d’APB | Coefficient d’extinction [M-1 cm-1] |
| Thaumatine (Thaumatococcus daniellii) | 40 mg mL-1 | 50 mM Bis-Tris, pH 6,5 | 1.1 tartrate de sodium M, 50 mM Tris, pH 6,8 | I4222, 1LR2 | 29420 |
| Glucose isomérase (Streptomyces rubiginosus) | 25 mg mL-1 | 10 mM HEPES, 1 mM MgCl2, pH 7,0 | 100 mM Bis-Tris, sulfate d’ammonium de 2,7 M, pH 5,7 | I222, 4ZB2 | 46410 |
| Thioredoxin (Wuchereria bancrofti) | mg 34 mL-1 | 20 mM Tris-HCl, 5 mM EDTA, 150 mM NaCl, pH 8,0 | 27,5 % PEG1500, tampon SPG 100 mM, pH 6,3 | P41212, 4FYU | 24075 |
Tableau 2 : Conditions de cristallisation et des groupes d’espace des cristaux de protéines préparé, y compris le code de coefficient et pdb d’extinction.
| Protéine | Nombre de cristaux exposés | Nombre de schéma de diffraction par crystal | Gamme d’oscillation par exposition [°] | Temps d’exposition [ms] | Entrée de l’APB pour Monsieur |
| Thaumatine (Thaumatococcus daniellii) | 103 | 10 | 1 | 40 | 1LR2 |
| Glucose isomérase (Streptomyces rubiginosus) | 69 | 100 | 0,1 | 80 | 4ZB2 |
| Thioredoxin (Wuchereria bancrofti) | 68 | 10 | 1 | 40 | 4FYU |
Tableau 3 : diffraction des rayons x paramètre de collecte des données.
| Données collecte statistiqueun | thaumatine (Cadre 1-20) | glucose isomérase (image 1-100) | thioredoxin (Cadre 1-10) |
| Source de rayonnement | P14 | ||
| Longueur d’onde [Å] | 0.96863 | ||
| Groupe d’espace | P41212 | I222 | P42212 |
| Paramètres de maille d’unité : a = b, c [Å] | 58,62, 151,48 | 93.91, 99,60, 103,04 | 58.45, 151,59 |
| Nombre de cristaux | 101 | 41 | 34 |
| Oscillation totale [°] | 10 | 10 | 10 |
| Résolution [Å] | 30.1.1989 (1,95 – 1,89) | 30.1.1975 (1,80 – 1,75) | 30.3.2000 (3.20 – 3,00) |
| Température [K] | 296 | 296 | 296 |
| R p.i.m.b | 7.5 (25,5) | 8.8 (28,0) | 9.1 (33,2) |
| Réflexions mesurées | 1553200 | 690000 | 1111196 |
| Réflexions uniques | 21850 | 48942 | 44449 |
| Valeur moyenne | 6.07 (1,78) | 5,85 (1,66) | 4.08 (1,47) |
| Mn(I) demi-set corrélation CC(1/2) | 96.2 (72,2) | 95,8 (68,2) | 97,9 (75,3) |
| Exhaustivité [%] | 99,8 (100,0) | 100,0 (99,9) | 99,9 (100,0) |
| Redondance | 71,1 | 14.1 | 25 |
| Statistiques de raffinement | |||
| Plage de résolution [Å] | 30/01/1989 | 30/01/1975 | 30/03/2000 |
| R / Rgratuit [%] | 18.8/23.9 | 18.1/20.5 | 18.9/23.1 |
| Atomes de protéine | 1550 | 3045 | 1129 |
| Molécules d’eau | 51 | 111 | 164 |
| Molécules de ligand | 20 | 0 | 0 |
| Déviation de RMS | |||
| Longueur de la liaison [Å] | 0,02 | 0,026 | 0,01 |
| Angle de liaison [°] | 2.04 | 2.22 | 1.43 |
| Facteur B [Å2] | |||
| Protéine | 22,6 | 20 | 50 |
| Eau | 25.1 | 27.1 | 29,7 |
| Ligand | 20,4 | ||
| Analyse du tracé de richet | |||
| Régions plus favorisées [%] | 97,67 | 95,32 | 96.13 |
| Régions autorisées [%] | 2.44 | 4.16 | 3.64 |
| Généreusement accueilli régions [%] | 0,49 | 0,52 | 0,23 |
| r : les valeurs entre parenthèses sont pour le shell de résolution plus élevé. | |||
b: (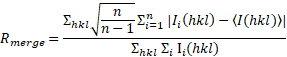 ), où j’ai (hkl) est l’intensité moyenne de la réflexion hkl, Σhkl dépasse la somme de toutes les réflexions et Σi i est la somme des mesures de réflexion hkl. ), où j’ai (hkl) est l’intensité moyenne de la réflexion hkl, Σhkl dépasse la somme de toutes les réflexions et Σi i est la somme des mesures de réflexion hkl. | |||
Tableau 4 : Données statistiques de collection d’ensembles de données de la thaumatine et glucose isomérase de thioredoxin.
Supplementry-fichier 1 : chip_geometry.dwg. CAD-fichier des géométries puce utilisée. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplementry-fichier 2 : goniometer_adapter.stl. STL-fichier en spécifiant l’adaptateur de goniomètre de puce aux rayons x. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplementry-fichier 3 : xds.sh. Bash script pour créer des fichiers d’entrée pour traiter les coins des données de diffraction par XDS. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplementry-fichier 4 : xscale.sh. Bash script pour fusionner les données de diffraction de sous-ensembles et de créer un fichier HKL. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplementry-fichier 5 : ISigma.sh. Bash script pour extraire les valeurs de ISigma de tous les sous-ensembles individuels. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplementry-fichier 6 : Rmeas.sh. Bash script pour extraire les valeurs de Rmeas de tous les sous-ensembles individuels. S’il vous plaît cliquez ici pour télécharger ce fichier.
7 du fichier complémentaire : rotation_matrix.sh. Bash script pour préparer le fichier d’entrée pour Matlab calculer les angles d’Euler de la matrice de rotation. S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Nous fabriquons des dispositifs microfluidiques pour in situ la diffraction des rayons x par la structuration de la résine époxy comme matériau et polyimide aluminium comme matériau de fenêtre de remplissage. Notre procédure optimisée différentes étapes de la fabrication au cours de la précédente aux rayons x puce dessins16,21. Nous avons réduit l’épaisseur de la fenêtre et ainsi l’arrière-plan tout en facilitant également fabrication de diffusion comme moins d’étapes sont nécessaires. in situ la cristallisation en utilisant le protocole décrit a des avantages substantiels. Il permet la collecte de données de diffraction à température ambiante et exclut ainsi la nécessité de la protection de cryo, qui, dans certains cas, contient le risque d’introduire des objets dans la structure des protéines. Par ailleurs, les cristaux ne sont pas soumis à un stress physique, parce que le transfert des cristaux de leur environnement natif peut être évité. Par le biais de cette procédure, les cristaux de maintiennent leur qualité et ne souffrent d’aucun traitement.
Dans notre expérience, les étapes plus critiques au sein du protocole tournent autour de contrôler le processus de cristallisation. Les paramètres afin d’obtenir des cristaux adaptés aux rayons x aux dimensions appropriées doivent être déterminés de façon empirique et ne peuvent être prises directement depuis les expériences de diffusion de vapeur. En utilisant des concentrations de protéines et précipitant identiques n’a pas toujours abouti dans les cristaux dans différentes puces, ou parfois dans les différents puits au sein de la même puce. Ceci indique que tous les facteurs qui influencent la croissance et la nucléation des cristaux devraient être considérés avec précaution, comme la cinétique de composition ou de cristallisation de liqueur mère (à travers la trajectoire de l’évaporation). Comme cristaux plus grands diffracter à une résolution plus élevée, suffisamment gros cristaux est idéalement passées. Le processus de nucléation de cristal et de la croissance peut être suivi avec des mesures de DLS. Focaliser le laser à l’intérieur de la ~ 50 µm compartiments de cristallisation fine de la puce peuvent être difficiles et peuvent nécessiter un alignement manuel soigné. À l’aide de puits plus profonds que 100 µm, laser auto-alignement était faisable et fiable, tel que plusieurs puits pourraient être surveillés par des systèmes automatisés d’acquisition.
Les puces de rayons x de polyimide basé produisent seulement un faible bruit de fond et nous démontrer l’adéquation de ces dispositifs pour la routine de collecte de données de diffraction des rayons x en résolvant les structures de trois protéines de modèle. La meilleure résolution obtenue dans puce différente, comparée à celle des résolutions précédemment obtenues, significativement plus grands cristaux de protéines et de collecte de données de radiographie conventionnelle. Cela pourrait être dû à plusieurs facteurs et optimisation de condition de cristallisation peut améliorer encore davantage la diffraction. Il a été possible de recueillir sur place des données de diffraction jusqu'à une résolution 1,8 Å application crystal avec dimensions inférieure à 30 µm. L’analyse détaillée des données de diffraction thaumatine fourni des renseignements sur les dommages de rayonnement. Pour limiter l’extension des dommages de rayonnement, qu’un seul cristal unique devrait être exposé chaque compartiment dans le dispositif microfluidique, car la diffusion des radicaux à et dans les cristaux voisins peut se produire. Pour améliorer la vitesse de collecte de données, ceci devrait être automatisé à l’avenir.
En raison de la morphologie des cristaux, dans certains cas une orientation préférentielle peut se produire. Par exemple, c’était le cas avec le dataset thiorédoxine, où les cristaux ont une orientation fortement privilégiée par rapport à des fenêtres de la puce. Même ici, nous pourrions recueillir un ensemble de données complet de diffraction. Si les cristaux présentent une orientation préférentielle dans la puce, et en particulier si le groupe d’espace correspondant a aussi une symétrie faible, puis l’intégralité de l’objet dataset doit être surveillée lors de la collecte que soit suffisamment canne de motifs de diffraction recueillies.
Études de résolution temporelle à l’aide de ces puces sont directement possibles quand utilisant la lumière induit des réactions avec une approche de la pompe-sonde. La transmission lumineuse de polyimide clinquant pour le laser de pompe doit être élucidé et alternativement, optiquement clair polyimide ou COC pourrait être utilisé. Les géométries de microfluidique actuelle ne permettent pas de mixage expériences après que les cristaux croissent de substrat. Toutefois, nous espérons que le protocole de fabrication de puce aux rayons x décrit également convenir pour ces dessins pour les deux diffraction des rayons x résolue dans le temps de mélange ainsi que diffusion des approches19.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le Fonds de semence PIER PIF-2015-46, le BMBF accorde 05K16GUA et 05K12GU3 et le cluster d’excellence « Le Centre de Hambourg pour imagerie ultrarapide – Structure, dynamique et contrôle de la matière à l’échelle atomique » de la Deutsche Forschungsgemeinschaft (DFG). Le travail des auteurs affiliés ainsi qu’avec le Centre pour la Science de Laser d’électrons libres a été financé par l’Association Helmholtz, par le biais de fonds destinés aux programmes orientés. Les données de MX de synchrotron ont été collectées au beamline P14 exploité par EMBL Hamburg à l’anneau de stockage de PETRA III (DESY, Hambourg, Allemagne).
matériels
| Name | Company | Catalog Number | Comments |
| SU-8 3000 Series | MicroChem Corp. | SU-8 3000 | Photoresist |
| PGMEA | Sigma-Aldrich | 484431 | Developer |
| Isopropyl alcohol | Solvent | ||
| Ethanol | Solvent | ||
| Epoxy glue | UHU | Plus Schnellfest 5 min | Epoxy glue |
| PDMS | Dow Corning | Sylgard 184 | Silicone |
| Kapton foil | Dupont/ American Durafilm | HN grade, gauge 30 (7.5 μm) | polyimide foil |
| APTS | Sigma-Aldrich | 440140 | Chemical |
| GPTS | Sigma-Aldrich | 440167 | Chemical |
| Cytop CTX-109AE | Asahi Glass Co. Ltd | Cytop CTX-109AE | Cytop fluoropolymer coating |
| CT-Solv 100E | Asahi Glass Co. Ltd | CT-Solv 100E | Cytop fluoro-solvent |
| HFE-7500 | 3M | Novec 7500 | Fluorinated oil |
| AutoCAD | AutoDesk Inc. | AutoCAD | CAD Software |
| Biopsy Punch | Harris | Uni-core 0.75 mm | |
| Photo mask | JD Photo Data | ||
| 3 inch wafer | University Wafer | Silicon wafer | |
| Mask aligner | SÜSS MicroTec | MJB4 | Mask aligner |
| PDMS mixer | Thinky | ARE-250 | |
| Plasma machine | Diener electronic | Zepto | |
| Thaumatin | Sigma Aldrich | T7638 | Protein |
| Glucose Isomerase | Hamton Research | HR7-102 | Protein |
| Bis-Tris | Sigma Aldrich | B9754 | Chemical |
| Sodium Tartrate | Merck | 106664 | Chemical |
| Tris-HCl | Sigma Aldrich | 10812846001 | Chemical |
| HEPES | Carl Roth | 6763.2 | Chemical |
| Magnesium Chloride | Sigma Aldrich | 208337 | Chemical |
| Ammonium Sulfate | Sigma Aldrich | A4418 | Chemical |
| EDTA | Sigma Aldrich | E6758 | Chemical |
| Sodium Chloride | Sigma Aldrich | 1064060250 | Chemical |
| PEG1500 | Molecular Dimensions | MD2-100-6 | Chemical |
| SPG buffer | Jena Bioscience | CSS-389 | Chemical |
| SpectroLight600 | XtalConcepts | DLS Instrument | |
| Nanodrop | Thermo Scientific | Spectrophotometer | |
| Zentrifuge | Eppendorf | ||
| Ultimaker2 | Ultimaker | 3D printer | |
| Form2 | Formlabs | 3D printer | |
| Amicon Filter | Sartorius Stedim | 0.2 µm filter | |
| Tubing | Adtech Polymer Engineering Ltd | Bioblock/05 | PTFE tubing 0.3 mm Inner Diameter x 0.76 mm Outer Diameter |
| Syringes | BD | 309628 | 1ml Luer-Lock Tip |
| Needle | Terumo Agani Needle | AN*2716R1 | 27Gx5/8" |
Références
- Rasmussen, B. F., Stock, A. M., Ringe, D., Petsko, G. A. Crystalline ribonuclease A loses function below the dynamical transition at 220 K. Nature. 357 (6377), 423-424 (1992).
- Tilton, R. F. J. R., Dewan, J. C., Petsko, G. A. Effects of temperature on protein structure and dynamics: X-ray crystallographic studies of the protein ribonuclease-A at nine different temperatures from 98 to 320 K. Biochemistry. 31 (9), 2469-2481 (1992).
- Fraser, J. S., Clarkson, M. W., Degnan, S. C., Erion, R., Kern, D., Alber, T. Hidden alternative structures of proline isomerase essential for catalysis. Nature. 462 (7273), 669-673 (2009).
- Juers, D. H., Matthews, B. W. The role of solvent transport in cryo-annealing of macromolecular crystals. Acta Crystallogr. D. 60 (Pt 3), 412-421 (2004).
- Huang, C. Y., et al. In meso in situ serial X-ray crystallography of soluble and membrane proteins. Acta Crystallogr. D. 71 (Pt 6), 1238-1256 (2015).
- Gati, C., et al. Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser. P. Natl. Acad. Sci. USA. 114 (9), 2247-2252 (2017).
- Gati, C., et al. Serial crystallography on in vivo grown microcrystals using synchrotron radiation. IUCrJ. 1 (Pt 2), 87-94 (2014).
- von Dreele, R. B. Multipattern Rietveld refinement of protein powder data. J. Appl. Crystallogr. 40 (1), 133-143 (2007).
- Cherezov, V. Lipidic cubic phase technologies for membrane protein structural studies. Curr. Opin. Struct. Biol. 21 (4), 559-566 (2011).
- Gati, C. Data processing and analysis in serial crystallography at advanced X-ray sources. , Dissertation, Hamburg (2015).
- Stellato, F., et al. Room-temperature macromolecular serial crystallography using synchrotron radiation. IUCrJ. 1 (Pt 4), 204-212 (2014).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallogr. D. 71 (Pt 2), 387-397 (2015).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (Pt 2), 168-176 (2015).
- Martin-Garcia, J. M., Conrad, C. E., Coe, J., Roy-Chowdhury, S., Fromme, P. Review: Serial femtosecond crystallography: A revolution in structural biology. Arch. Biochem. Biophys. 602, 32-47 (2016).
- White, T. A., et al. CrystFEL: A software suite for snapshot serial crystallography. J Appl Crystallogr. 45 (2), 335-341 (2012).
- Perry, S. L., et al. A microfluidic approach for protein structure determination at room temperature via on-chip anomalous diffraction. Lab Chip. 13 (16), 3183-3187 (2013).
- Schlichting, I. Serial femtosecond crystallography: the first five years. IUCrJ. 2 (Pt 2), 246-255 (2015).
- Sui, S., Perry, S. L. Microfluidics: From crystallization to serial time-resolved crystallography. Struct. Dynam.-US. 4 (3), (2017).
- Ghazal, A., Lafleur, J. P., Mortensen, K., Kutter, J. P., Arleth, L., Jensen, G. V. Recent advances in X-ray compatible microfluidics for applications in soft materials and life sciences. Lab Chip. 16 (22), 4263-4295 (2016).
- Heymann, M., et al. Room-temperature serial crystallography using a kinetically optimized microfluidic device for protein crystallization and on-chip X-ray diffraction. IUCrJ. 1 (Pt 5), 349-360 (2014).
- Schubert, R., et al. A multicrystal diffraction data-collection approach for studying structural dynamics with millisecond temporal resolution. IUCrJ. 3 (Pt 6), 393-401 (2016).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nat. Commun. 5, 3309(2014).
- Conrad, C. E., et al. A novel inert crystal delivery medium for serial femtosecond crystallography. IUCrJ. 2 (Pt 4), 421-430 (2015).
- Cohen, A. E., et al. Goniometer-based femtosecond crystallography with X-ray free electron lasers. P. Natl. Acad. Sci. USA. 111 (48), 17122-17127 (2014).
- Erskine, D., YU, P. Y., Freilich, S. C. High-Pressure Visible Spectroscopy of Polyimide Film. J. Polym. Sci. Pol. Lett. 26 (11), 465-468 (1988).
- Tsai, C. -L., Yen, H. -J., Chen, W. -C., Liou, G. -S. Novel solution-processable optically isotropic colorless polyimidothioethers-TiO2 hybrids with tunable refractive index. J. Mater. Chem. 22 (33), 17236-17244 (2012).
- Destremaut, F., Salmon, J. -B., Qi, L., Chapel, J. -P. Microfluidics with on-line dynamic light scattering for size measurements. Lab Chip. 9 (22), 3289-3296 (2009).
- Chastek, T. Q., Iida, K., Amis, E. J., Fasolka, M. J., Beers, K. L. A microfluidic platform for integrated synthesis and dynamic light scattering measurement of block copolymer micelles. Lab Chip. 8 (6), 950-957 (2008).
- Heymann, M., Fraden, S., Kim, D. Multi-Height Precision Alignment With Selectively Developed Alignment Marks. J. Microelectromech. S. 23 (2), 424-427 (2014).
- Schubert, R., et al. Reliably distinguishing protein nanocrystals from amorphous precipitate by means of depolarized dynamic light scattering. J Appl Crystallogr. 48 (5), 1476-1484 (2015).
- Aghvami, S. A., et al. Rapid prototyping of cyclic olefin copolymer (COC) microfluidic devices. Sensor Actuat. B-Chem. 247, 940-949 (2017).
- Walker, J. M. The Proteomics Protocols Handbook. , Humana Press Inc. Totowa, NJ. (2005).
- Kabsch, W. XDS. Acta Crystallogr D. 66 (Pt 2), 125-132 (2010).
- Vagin, A., Teplyakov, A. Molecular replacement with MOLREP. Acta Crystallogr. D. 66 (Pt 1), 22-25 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallogr. D. 67, 235-242 (2011).
- Murshudov, G. N., et al. REFMAC5 for the refinement of macromolecular crystal structures. Acta Crystallogr. D. 67 (Pt 4), 355-367 (2011).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallogr. D. 66 (Pt 4), 486-501 (2010).
- Owen, R. L., et al. Exploiting fast detectors to enter a new dimension in room-temperature crystallography. Acta Crystallogr. D. 70 (Pt 5), 1248-1256 (2014).
- Kabsch, W. Automatic-Indexing of Rotation Diffraction Patterns. J. Appl. Crystallogr. 21, 67-71 (1988).
- Zarrine-Afsar, A., et al. Crystallography on a chip. Acta Crystallogr. D. 68 (Pt 3), 321-323 (2012).
- Boukellal, H., Selimović, S., Jia, Y., Cristobal, G., Fraden, S. Simple, robust storage of drops and fluids in a microfluidic device. Lab Chip. 9 (2), 331-338 (2009).
- Aghvami, S. A., et al. Rapid prototyping of cyclic olefin copolymer (COC) microfluidic devices. Sens. Actuator B Chem. 247, 940-949 (2017).
- Shemesh, J., et al. Stationary nanoliter droplet array with a substrate of choice for single adherent/nonadherent cell incubation and analysis. Proc. Natl. Acad. Sci. USA. 111 (31), 11293-11298 (2014).
- Sun, M., Bithi, S. S., Vanapalli, S. A. Microfluidic static droplet arrays with tuneable gradients in material composition. Lab Chip. 11 (23), 3949-3952 (2011).
- Shim, J. -U., et al. Control and measurement of the phase behavior of aqueous solutions using microfluidics. J. Am. Chem. Soc. 129 (28), 8825-8835 (2007).
- Schubert, R., Meyer, A., Baitan, D., Dierks, K., Perbandt, M., Betzel, C. Real-Time Observation of Protein Dense Liquid Cluster Evolution during Nucleation in Protein Crystallization. Cryst. Growth Des. 17 (6), 3579(2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon