Method Article
Propriétés électro-Polymer nanoparticules Exposer photothermiques
Dans cet article
Résumé
A protocol is presented for the synthesis and preparation of nanoparticles consisting of electroactive polymers.
Résumé
A method for the synthesis of electroactive polymers is demonstrated, starting with the synthesis of extended conjugation monomers using a three-step process that finishes with Negishi coupling. Negishi coupling is a cross-coupling process in which a chemical precursor is first lithiated, followed by transmetallation with ZnCl2. The resultant organozinc compound can be coupled to a dibrominated aromatic precursor to give the conjugated monomer. Polymer films can be prepared via electropolymerization of the monomer and characterized using cyclic voltammetry and ultraviolet-visible-near infrared (UV-Vis-NIR) spectroscopy. Nanoparticles (NPs) are prepared via emulsion polymerization of the monomer using a two-surfactant system to yield an aqueous dispersion of the polymer NPs. The NPs are characterized using dynamic light scattering, electron microscopy, and UV-Vis-NIR-spectroscopy. Cytocompatibility of NPs is investigated using the cell viability assay. Finally, the NP suspensions are irradiated with a NIR laser to determine their effectiveness as potential materials for photothermal therapy (PTT).
Introduction
Les polymères électroactifs changent leurs propriétés (couleur, conductivité, la réactivité, volume, etc.) en présence d'un champ électrique. Les temps de commutation rapides, accordabilité, la durabilité, et les caractéristiques légers de polymères électroactifs ont conduit à de nombreuses applications proposées, y compris les énergies de remplacement, capteurs, électrochromiques, et dispositifs biomédicaux. Les polymères électroactifs sont potentiellement utiles comme la batterie et le condensateur électrodes souples, légers. 1 Applications de polymères électroactifs dans les dispositifs électrochromes comprennent des systèmes de réduction de l'éblouissement pour les bâtiments et voitures, lunettes de soleil, lunettes de protection, des dispositifs de stockage optiques, et les textiles intelligents. 2-5 Smart fenêtres peuvent réduire les besoins énergétiques en bloquant les longueurs d'onde spécifiques de la lumière à la demande et de protéger les intérieurs des maisons et des voitures. Les textiles intelligents peuvent être utilisés dans les vêtements pour aider à protéger contre les rayons UV. 6 Les polymères électroactifs ont also commencé à être utilisés dans des dispositifs médicaux. Parmi polymères électroactifs utilisés dans des dispositifs biomédicaux, polypyrrole (PPy), polyaniline (PANI) et le poly (3,4-éthylènedioxythiophène) (PEDOT) sont parmi les plus courantes. Par exemple, ces types de polymères sont couramment utilisés comme transducteurs dans les dispositifs de biocapteurs 7 applications dans l'administration thérapeutique ont également montré des résultats prometteurs. études ont démontré la libération de médicaments et de protéines thérapeutiques à partir de dispositifs préparés à partir de polymères électroactifs. 12/08 Plus récemment, des polymères électro-actifs ont été utilisés comme agents thérapeutiques dans la thérapie photothermique. 13-15 Dans la thérapie photothermique, agents photothermiques doivent absorber la lumière dans le proche -Infrarouge (NIR) région (~ 700 à 900 nm), aussi connu sous le nom de la fenêtre thérapeutique, où la lumière a la profondeur maximale de pénétration dans les tissus, typiquement jusqu'à 1 cm. 16,17 Dans cette gamme, des chromophores biologiques tels que l'hémoglobine , l'hémoglobine oxygénée, lipides, et de l'eau ont peu à pasabsorbance, ce qui permet à la lumière de pénétrer facilement. Lorsque les agents photothermiques absorbent la lumière dans la fenêtre thérapeutique, l'énergie lumineuse est convertie en énergie photothermique.
Irvin et ses collaborateurs ont rapporté précédemment bis-EDOT monomères de benzène qui ont été synthétisés en utilisant un couplage de Negishi alcoxy-substitué. 18 couplage de Negishi est un procédé préféré pour la formation de liaisons carbone-carbone. Ce procédé présente de nombreux avantages, y compris l'utilisation d'intermédiaires organiques du zinc, qui sont moins toxiques et ont tendance à avoir une réactivité plus élevée que les autres composés organométalliques utilisés. 19,20 organozinciques sont également compatibles avec un large éventail de groupes fonctionnels sur les organohalogénures. 20 Dans le réaction de couplage de Negishi, un halogénure organique et organométallique sont couplées par l'utilisation d'un catalyseur au palladium (0) comme catalyseur. 20 Dans le travail présenté ici, ce procédé de couplage croisé est utilisé dans la synthèse de 1,4-dialcoxy-2,5-bis ( 3,4-ethylenedioxythienyl) benzemonomères ne (2 BEDOT-B (OR)). Ces monomères peuvent ensuite être facilement polymérisés électrochimiquement ou chimiquement pour produire des polymères qui sont des candidats prometteurs pour une utilisation dans des applications biomédicales.
Les procédés classiques pour la préparation de suspensions colloïdales polymères dans des solutions aqueuses pour des applications biomédicales impliquent typiquement la dissolution de polymères en vrac suivie par des techniques d'évaporation nanoprécipitation ou émulsion solvant. 21,22 Afin de produire les IP de poly (BEDOT-B (OR) 2) , une approche bottom-up est démontré ici, où les infirmières praticiennes sont synthétisés par polymérisation en émulsion in situ. La polymérisation en émulsion est un processus qui est facilement extensible et est une méthode relativement rapide pour la préparation NP. 22 études utilisant polymérisation en émulsion pour produire les IP des autres polymères électroactifs ont été rapportés pour PPy et PEDOT. 15,23,24 PEDOT IP, par exemple, ont été préparés en utilisant pulvérisation émulsion polymerization. 24 Cette méthode est difficile à reproduire, et donne généralement des particules plus grosses, de la taille du micron. Le protocole décrit dans cet article explore l'utilisation d'une méthode goutte-ultrasons pour préparer reproductible IP polymère de 100 nm.
Dans ce protocole, polymères électroactifs adaptés à absorber la lumière dans la région NIR similaire à poly indiqué précédemment (BEDOT-B (OR) 2) sont synthétisés et caractérisés de démontrer leur potentiel dans des dispositifs électrochromes et comme agents des PTT. Tout d'abord, le protocole pour la synthèse des monomères par un couplage de Negishi est décrite. Les monomères sont caractérisés par RMN et la spectroscopie UV-Vis-NIR. La préparation de suspensions colloïdales NP par polymérisation oxydative de l'émulsion dans un milieu aqueux est également décrite. La procédure est basée sur un procédé de polymérisation en émulsion en deux étapes décrit précédemment par Han et al., Qui est appliqué sur les différents monomères. Un système à deux tensio-actif estutilisé pour contrôler la monodispersité NP. Un dosage de la viabilité des cellules est utilisée pour évaluer cytocompatibilité des infirmières praticiennes. Enfin, le potentiel de ces IP pour agir en tant que transducteurs PTT est démontrée par irradiation avec un laser NIR.
Protocole
Attention: S'il vous plaît consulter toutes les fiches de données de sécurité (FDS) pertinentes avant utilisation. Plusieurs des réactifs utilisés dans ces synthèses sont potentiellement dangereux. S'il vous plaît utiliser toutes les pratiques de sécurité appropriées, y compris des équipements de protection individuelle (lunettes de sécurité, gants, blouse de laboratoire, des pantalons longs et des chaussures fermées), et effectuer des synthèses des hottes aspirantes. Lithiation est particulièrement dangereux et ne doit être effectuée par des personnes dûment formées avec supervision.
1. monomère de synthèse
Remarque: La figure 1 montre la voie chimique pour la préparation des précurseurs et des monomères dont la synthèse est décrite dans les sections 1.2 - 1.5.
- Matériaux
- Purifier EDOT comme décrit précédemment. 25
- Recristalliser tétrabutyle perchlorate d'ammonium (PETM) à partir de l'acétate d'éthyle et sèche sous vide pendant 24 h. Titrer n-butyllithium (nBuLi, 2,5 M dans des hexanes) comme décrit par Hoye et al. 26 dans les 48 heures avant son utilisation pour déterminer la concentration réelle.
- Du sulfate de magnésium sec et de carbonate de potassium à 100 ° C pendant 24 heures avant utilisation. Utilisez tous les autres produits chimiques utilisés dans le présent protocole reçu.
- Synthèse de 1,4-dialcoxybenzènes
Remarque: La figure 1A montre la préparation de 1,4-dihexyloxybenzene utilisant du 1-bromohexane.- Équiper un à trois cols ballon à fond rond séché à l'étuve d'un septum, d'un adaptateur d'admission d'argon, et d'un condenseur équipé d'un adaptateur de sortie de gaz reliée à un barboteur. Ajouter une barre d'agitation dans le ballon avant de le sceller.
- Branchez l'adaptateur d'entrée à une ligne de Schlenk en utilisant le poly (chlorure de vinyle) (PVC) tubes et purger le ballon avec de l'argon.
- Ajouter 12,5 g (113,5 mmol) d'hydroquinone dans le ballon à fond rond et le dissoudre dans 20 ml de tétrahydrofuranne (THF) anhydre sous agitation.
- Séparément, on dissout 14 g (250 mmol) de KOH dans 30 ml d'éthanol dans un seul cou-ballon à fond rond et remuer jusqu'à dissolution.
- Une fois dissous, ajouter lentement la solution de KOH à la ballon tricol à fond rond à l'aide d'une seringue. Laisser le mélange en remuant pendant 1 h.
- Après 1 heure, ajouter 250 mmoles de 1-bromoalcane au mélange réactionnel.
- Chauffer le mélange réactionnel à reflux pendant 24 heures tout en agitant sous argon.
- Après 24 heures, laisser le mélange réactionnel refroidir à température ambiante et ajouter 15 ml d'eau DI et 10 ml de dichlorométhane.
- Transférer le mélange dans une ampoule à décanter. Isoler la couche organique et laver trois fois avec 10 ml d'eau DI.
- Sécher la couche organique sur 15 g de MgSO 4 pendant 15 min.
- Retirer le MgSO4 par filtration sous vide à travers un papier filtre.
- Éliminer le solvant de la solution filtrée en utilisant un évaporateur rotatif à 50 ° C et 21 kPa pour donner le 1,4-dialcoxybenzène forme d'un solide blanc brut.
- Recristalliser le produit brut en ajoutant juste assez chaude pour l'éthanoldissoudre le produit. Une fois dissous, placer dans un bain de glace pour provoquer la cristallisation.
- Recueillir les cristaux par filtration sous vide à travers un papier filtre et on lave avec de l'éthanol froid.
- Sécher les cristaux sous vide pendant 24 heures à température ambiante et de les stocker sous argon jusqu'à utilisation ultérieure. Cette procédure donne 1,4-dihexyloxybenzene.
- Caractériser le produit en utilisant le point de fusion et 1 H et 13 spectroscopie RMN C. 27
- Synthèse de 1,4-dialcoxybenzènes contenant des groupements ester
Remarque: La figure 1B montre la voie chimique pour la préparation d'un 1,4-dialcoxybenzène utilisant éthyl-4-bromobutanoate.- Équiper un à trois cols ballon à fond rond séché à l'étuve d'un septum, d'un adaptateur d'entrée d'argon, d'un réfrigérant et muni d'un adaptateur de sortie de verre reliée à un barboteur. Ajouter une barre d'agitation dans le ballon avant de le sceller.
- Branchez l'adaptateur d'entrée à la ligne de Schlenk en utilisant un tube de PVC et purger avec de l'argon.
- Peser 1,88 g (93,5 mmol) de KI et 15,69 g (93,3 mmoles) de K 2 CO 3 et ajouter au flacon à fond rond.
- Ajouter 25 ml d'anhydre N, N-diméthylformamide (DMF) et remuer jusqu'à ce que les sels se dissolvent.
- Une fois dissous, ajouter 2,5 g (18,7 mmol) d'hydroquinone au mélange réactionnel et laisser la réaction se mélanger jusqu'à dissolution.
- Lorsque tous les solides sont dissous, ajouter 46,8 mmol d'alkyle bromoalkanoate; chauffer le mélange réactionnel à reflux pendant 24 heures sous atmosphère d'argon avec agitation continue.
- Retirer le mélange réactionnel de la chaleur et laisser refroidir à température ambiante.
- Transférer le mélange réactionnel dans une ampoule à décanter et ajouter de l'eau (20 ml) et de l'acétate d'éthyle (20 ml) pour extraire la couche organique. Isoler la couche organique et laver trois fois avec de l'eau (20 ml portions).
- Sécher la couche organique sur 15 g de MgSO 4 pendant 15 min. Une fois séché, retirer MgSO 4 à partir du mélange par filtration sous vide à travers filpapier ter.
- On élimine le solvant en utilisant un évaporateur rotatif à 100 ° C et 21 kPa. Sécher le produit brut sous vide à RT O / N.
- On recristallise le produit en ajoutant de l'éthanol juste assez chaude pour dissoudre tout le solide. Une fois dissous, refroidir le ballon dans la glace et permettent la formation de cristaux. Récupérer le produit par filtration sous vide et laver avec de l'éthanol froid.
- Sécher les cristaux sous vide à température ambiante pendant 24 h et stocker sous argon jusqu'à utilisation ultérieure. Cette procédure donne 1,4-bis (butanoyloxy d'éthyle) benzène.
- Caractériser le produit en utilisant le point de fusion et 1 H et 13 spectroscopie RMN C. 28
- Synthèse de 1,4-dialcoxy-2,5-dibromobenzènes
Remarque: La voie chimique pour la préparation de 1,4-dialcoxy-2,5-dibromobenzènes est représentée sur la Figure 1A et 1B.- Monter un, trois cols ballon à fond rond sec avec une entrée d'argon, d'un entonnoir d'addition à pression constante coiffé d'unbouchon en verre ou septum, et une sortie reliée à un tube en matière plastique muni d'un entonnoir en verre inversé suspendue au-dessus d'une solution 1 M de NaOH.
- Dans ce ballon, on dissout 218 mmoles de 1,4-dialcoxybenzène dans du dichlorométhane (15 ml).
- Séparément, on ajoute 12 ml (598 mmol) de Br2 dans une fiole de 250 ml et diluer avec du dichlorométhane (12 ml).
- Transférer la solution Br 2 / dichlorométhane à l'entonnoir d'addition à pression constante. Ajouter la solution goutte à goutte Br 2 dans le ballon à fond rond à trois cols avec agitation sous argon sur une période de 2 h.
- Après addition complète, la réaction permet d'agiter O / N sous un courant d'argon continu.
- Arrêter la réaction en ajoutant de l'eau déminéralisée (20 ml), et verser le mélange dans une ampoule à décanter.
- Isoler la couche organique et laver trois fois à l'eau déminéralisée (20 ml portions). Sécher la couche organique sur 15 g de MgSO 4 pendant 15 min.
- Retirez le MgSO4 parfiltration sous vide à travers un papier filtre, et éliminer le solvant en utilisant un évaporateur rotatif à 75 ° C et 21 kPa.
- Purifier brut 1,4-dialcoxy-2,5-dibromobenzène en ajoutant juste assez d'éthanol chaud pour dissoudre tout le solide. Une fois dissous, refroidir le ballon dans la glace et permettent la formation de cristaux. Récupérer le produit par filtration sous vide et laver avec de l'éthanol froid.
- Sécher le produit purifié sous vide à RT O / N; stocker sous argon.
- Caractériser le produit en utilisant le point de fusion et 1 H et 13 spectroscopie RMN C. 27,28
- Le couplage de Negishi de 3,4-éthylènedioxythiophène avec le 2,5-dialcoxy-1,4 dibromobenzènes (EDOT)
Remarque: La figure 1C montre le couplage de Negishi de 1,4-dialcoxy-2,5-dibromobenzènes avec EDOT pour former des monomères M1 et M2.- Monter un ballon tricol à fond rond propre avec un septum, d'un condenseur équipé d'un adaptateur de commande d'écoulement d'entrée relié à l'argon, et un écoulement con de sortie de gazAdaptateur de commande relié à un barboteur.
- Branchez l'adaptateur d'entrée à la ligne de Schlenk en utilisant un tube en PVC à paroi épaisse. Commencer argon circulant dans le ballon de réaction pendant plusieurs minutes.
- L'utilisation d'un bec Bunsen, la flamme sécher l'appareil sous vide et purge avec de l'argon trois fois, afin d'assurer un environnement sans air.
- Peser 1,07 g (10 mmol) de EDOT purifiée et ajouter à la fiole réactionnelle en utilisant une seringue insérée à travers le septum. Diluer le EDOT avec du THF anhydre (20 ml) et agiter sous atmosphère d'argon.
- Refroidir le flacon contenant la solution EDOT l'aide d'un bain de glace / acétone pendant 15 min à -78 ° C.
- Après 15 min, ajouter lentement 11 mmol nBuLi dans l'hexane goutte à goutte une solution de en maintenant la température à -78 ° C. Agiter le mélange réactionnel à -78 ° C pendant 1 heure.
Note: La concentration exacte de la nBuLi devrait être déterminée par titrage avant de les utiliser conformément à la section 1.1. - Après 1 heure d'agitation, enlever la glace / ba acétonee.
- Immédiatement après le retrait du bain, ajouter 14,13 ml de 1,0 M de ZnCl2 solution goutte à goutte. Laisser la réaction se dérouler pendant 1 heure tout en agitant à température ambiante.
- Après 1 heure d'agitation, ajouter 4 mmoles de 1,4-dialcoxy-2,5-dibromobenzène et 0,08 mmoles de tétrakis (triphénylphosphine) palladium (0) au mélange réactionnel.
- Chauffer le mélange réactionnel à reflux (70 ° C) dans un bain d'huile.
- Suivi de l'avancement de la réaction par chromatographie sur couche mince (CCM): Prenez de petites (0,2 ml) aliquotes du mélange de réaction à l'aide quotidienne d'une seringue et précipiter dans 2 ml 1 M HCl. Extraire avec 2 ml CHCl 3 et repérer l'extrait sur une plaque de CCM de silice aux côtés des taches de solutions de EDOT et l'appropriate1,4-dialcoxy-2,5-dibromobenzène. Eluer avec de l'acétate d'éthyle 60:40: hexane.
- Lorsque la réaction est terminée, laisser le mélange réactionnel refroidir à température ambiante. Arrêter la réaction en ajoutant 10 ml de HCl 1 M, suivi par l'addition de dichlorométhane (20 ml).
- Transfert une ampoule à décanter et d'isoler la couche organique.
- Laver la couche organique avec de l'eau déminéralisée jusqu'à ce que l'eau de lavage est plus acide. Testez l'acidité de l'eau de lavage avec du papier pH.
- Sécher la couche organique de plus de 15 g de MgSO 4, filtre et éliminer le solvant en utilisant un évaporateur rotatif à 50 ° C et 21 kPa pour donner le monomère brut étendue de conjugaison (M1 ou M2) comme un solide jaune-orange.
- On recristallise le produit brut en utilisant une solution chaude de 3: 1 éthanol: solution de benzène M1 ou 7: 2 hexane: benzène pour M2. Ajoutez juste assez de mélange de solvant chaude pour dissoudre le solide. Une fois dissous, refroidir le ballon dans la glace et permettent la formation de cristaux. Récupérer le produit par filtration sous vide et laver avec de l'éthanol froid.
- Sécher le produit sous vide pendant 24 heures à température ambiante. Conserver dans l'obscurité sous atmosphère d'argon.
- Caractériser le produit en utilisant le point de fusion et 1 H et 13 spectroscopie RMN C. 18
2. Électrochimie
- Électropolymérisation
- Dans 50 ml fiole jaugée de préparer un (PETM) solution d'électrolyte 100 mM tétrabutylammonium de perchlorate dans l'acétonitrile anhydre (CH 3 CN).
- Dans une fiole jaugée de 10 ml de préparer un monomère 10 mM (M1 ou M2) en utilisant la solution une solution de 100 mM PETM / CH3CN en tant que diluant.
- Ajouter un fil d'argent (électrode de pseudo-référence) et un indicateur de platine (contre-électrode) d'une cellule électrochimique séché au four.
- Insérer un bouton de platine fraîchement poli (2 mm de diamètre 2) destiné à être utilisé comme l'électrode de travail. Assurez-vous que le fond de l'électrode de platine bouton ne touche pas le fond de la cellule électrochimique.
- Remplir la cellule électrochimique avec suffisamment de solution d'électrolyte monomère faire en sorte que les pointes des trois électrodes sont immergées dans la solution.
- De-aérer la solution pendant 5 min par barbotage d'argon doucement à travers une aiguille immergée dans esolution e.
- Relever l'aiguille 2 mm au-dessus de la solution et continuer flux d'argon pendant toute l'expérience pour maintenir une couverture d'argon au-dessus de la solution.
- Connecter les électrodes au potentiostat et de commencer la polymérisation par le vélo le potentiel appliqué cinq fois à une vitesse de balayage de 100 mV / s et une gamme de potentiel entre -1,5 V et 1,0 V.
- Enregistrez la sortie de courant pendant ce processus pour générer voltammogrammes cycliques.
- Polymer Electrochimie
- Après que le film de polymère est déposée sur l'électrode de travail du bouton de platine, supprimer toutes les électrodes de la solution d'électrolyte monomère et rincer lentement avec une solution d'électrolyte exempte de monomère (3 ml).
- Ajouter les électrodes pour une cellule électrochimique propre et ajouter suffisamment de solution d'électrolyte exempte de monomère de sorte que les pointes des trois électrodes sont immergées dans la solution.
- Connecter les électrodes au potentiostat. Cycle du tw potentiel appliquéo fois à une vitesse de balayage de 50 mV / s et une gamme de potentiel entre -1,5 V et 1,0 V.
- À répéter l'expérience 100, 200, 300 et 400 mV / s. Enregistrez la sortie de courant au cours de chaque expérience pour générer voltammogrammes cycliques.
- Préparation de électropolymérisé Films pour UV-Vis-NIR Spectroscopie et photothermiques études
- Préparer des films polymères tels que décrits dans la section 2.1 ci-dessus, cette fois en utilisant un oxyde d'indium-étain (ITO) de lame de verre revêtu de que l'électrode de travail. Développer les films de polymère de plus de 5 cycles à une vitesse de balayage de 100 mV / sec.
- Après le dépôt de polymère, retirer les électrodes de la solution de monomère et rincer avec de l'acétonitrile (5 ml).
- Stocker le film de polymère dans de l'acétonitrile avant d'études spectroscopiques.
3. Préparation NP
La figure 2 montre un schéma du procédé utilisé pour la préparation NP par polymérisation en émulsion.
- Prepare une solution de 1 ml de 2% (p / v) de poly (acide 4-styrènesulfonique acide-co-maléique) (PSS-co-MA) dans l'eau dans un flacon en verre. Ajouter une petite barre d'agitation magnétique dans le flacon. Ceci est la phase aqueuse.
- Préparer 100 ul de solution de monomère 16 mg / ml dans du chloroforme dans un tube de microcentrifugation.
- Préparation de la solution organique en dissolvant 0,03 g d'acide dodécylbenzènesulfonique (DBSA) dans la solution de monomère de 100 ul. Mélanger la solution organique en utilisant un mélangeur à tourbillon automatique pendant 30-60 minutes afin d'assurer l'homogénéité de la solution.
- Ajouter la phase organique à la phase aqueuse, goutte à goutte de 10 ul en portions, tout en agitant avec un barreau d'agitation magnétique jusqu'à ce que le volume complet de la solution organique est utilisé. Autoriser agitation pendant 60 secondes entre les deux ajouts.
- Ajouter 2 ml d'eau pour diluer le mélange. Retirez la barre d'agitation du flacon.
- Soniquer l'émulsion en utilisant un appareil à ultrasons de la sonde pour un total de 20 sec à 10 sec-intervalles à une amplitude de 30%, tandis que l'immersion de laflacon dans un bain de glace.
- Retirez le flacon d'échantillon du bain de glace, remplacer la barre d'agitation, et continuez de remuer l'émulsion.
- Ajouter 3,8 pi de solution à 100 mg / ml de FeCl 3 dans de l'eau à l'émulsion de monomères. Laisser la polymérisation de se produire pendant 1 heure en remuant continuellement. Cela donne de protocole IP de polymère stabilisées avec PSS-co-MA.
- Retirer la suspension NP de la plaque d'agitation et transférer dans 7 ml tubes de centrifugation. Centrifuger la suspension à 75 600 g pendant 3 min; récupérer le surnageant et jeter culot.
- Dialyser le surnageant pendant 24 heures en utilisant 100 moléculaire tube de dialyse kDa poids coupure (MWCO).
4. films polymères et NP Caractérisation
Remarque: Caractériser les films polymères et les IP par spectroscopie-Vis-NIR UV, et les IP en utilisant la diffusion dynamique de la lumière, l'analyse du potentiel zêta, et la microscopie électronique.
- Détermination de l'absorption dans le polymère UV-Vis-NSpectre IR 29
- Suspensions NP: Transférer la suspension dans une cuve en quartz et d'acquérir un spectre allant de 300 - 1000 nm à un intervalle de balayage de 5 nm.
- Films polymères oxydés: Transférer la lame de verre d'ITO revêtue de polymère à une cuve en quartz et remplir la cuve avec de l'acétonitrile anhydre. Ajouter 2 gouttes d'une solution / ml 100 mg de FeCl 3 dans CHCl 3 à l'acétonitrile et mélanger pour assurer le film de polymère est totalement oxydé. Acquérir un spectre allant de 300 - 1000 nm à un intervalle de balayage de 5 nm.
- Films polymères réduite: Transférer la lame de verre d'ITO revêtue de polymère à une cuvette et remplir la cuve avec de l'acétonitrile anhydre. Ajouter une goutte de l'hydrazine pour mélanger le liquide et pour assurer le film de polymère est complètement réduit. Acquérir un spectre allant de 300 - 1000 nm à un intervalle de balayage de 5 nm.
- Détermination de la taille à l'aide NP de Dynamic Light Scattering (DLS) 30
- Tournez sur l'instrument de DLS et de permettrese réchauffer pendant 15 min.
- Diluer la suspension NP dans l'eau à une concentration de 0,01 mg / ml et placer dans un polystyrène cuvette jetable.
- Placez la cuvette dans le lecteur et commencer la mesure.
- Détermination du potentiel Zeta NP 31
- Tournez sur l'instrument potentiel zeta et lui permettre de se réchauffer pendant 30 min.
- Préparer l'échantillon par dilution de 200 pi de NP suspension dans 800 pi d'une solution 10 mM de KCl.
- Remplir une cuvette jetable en polystyrène avec 700 ul de l'échantillon.
- Insérer la cellule de l'électrode de potentiel zêta dans l'échantillon en assurant qu'aucune bulle ne se trouve entre les électrodes ou dans le trajet de la lumière laser.
- Insérez la cuvette dans l'instrument et de suivre les instructions de logiciels pour l'exécution de la mesure.
- Détermination de la taille à l'aide NP microscopie électronique à balayage (MEB) 32
- Drop-jeté 10 pi des suspensions NP sur des plaquettes de silicium etlaisser sécher.
- Pulvérisation enrober les IP séchées avec 2 nm d'iridium.
- Image les échantillons à une distance de travail de 5 mm et à 5 kV.
5. Enquêter sur la cytocompatibilité de l'IP
Remarque: Toutes les manipulations de cellules devraient être effectuées dans une enceinte de sécurité biologique (écoulement laminaire de la hotte) pour empêcher la contamination des cellules avec les bactéries, les levures, ou les champignons provenant de l'environnement, et à protéger l'utilisateur contre les maladies potentiellement infectieux. Toutes les solutions et les fournitures utilisés avec les cellules doivent être stériles. Utiliser des techniques de culture cellulaire aseptiques appropriées.
- Culture des Skov-3 cellules de cancer ovarien dans des flacons T75 à 37 ° C dans un incubateur à CO2 (5% de CO 2) à l'aide de milieu Eagle modifié Dulbecco (DMEM) supplémenté avec 10% de sérum fœtal bovin en tant que milieu de croissance.
- Cellules de semences à une densité cellulaire de 5000 cellules / puits dans une plaque de 96 puits et incuber pendant 24 heures à 37 ° C dans un CO 2 incubateur.
- Immédiatement avant utilisation, diluer NP suspension dans un milieu de croissance complet à une concentration de 1 mg / ml.
- Filtrer les suspensions NP en passant à travers un filtre de 0,2 um stérile et diluer les concentrations désirées d'exposition (2-500 pg / ml) avec un milieu de croissance complet supplémenté avec 1% de pénicilline / streptomycine.
- Retirez le support de chacun des puits de la plaque de 96 puits par pipetage et les remplacer par 100 pi de suspensions NP aux différentes concentrations d'exposition, ou avec 100 pi de milieu NP-libre pour les deux commandes de cytocompatibilité positifs et négatifs. Utiliser 6 puits réplicats par condition.
- Immédiatement avant l'étape suivante, préparer une solution à 0,5 mg / ml d'acide 3- (4,5-diméthylthiazol-2-yl) -2,5-diphényltétrazolium (MTT) dans du phénol DMEM exempt de rouge. Filtre stérile à la solution de MTT à travers un filtre de 0,2 um stérile.
- Après avoir laissé les infirmières praticiennes à incuber avec les cellules pendant la période de temps désirée (tyPically 24 ou 48 heures), retirez soigneusement suspensions NP par pipetage sur.
- Remplacer immédiatement les médias avec la suivante en fonction de l'état:
- Pour le contrôle de cytocompatibilité négative, ajouter 100 ul de méthanol à chacun des 6 puits et laisser reposer pendant au moins 5 min. Après traitement au méthanol, le méthanol remplacer avec 100 ul de 0,5 mg / ml solution stérilisée par filtration de MTT dans du phénol DMEM exempt de rouge.
- Pour le contrôle positif et les échantillons NP-traités, remplacer le milieu avec 100 pi de 0,5 mg / ml solution stérile filtré MTT dans du phénol DMEM sans rouge.
- Incuber les cellules pendant 2 à 4 heures dans l'incubateur. Après incubation, examiner les cellules sous le microscope pour vérifier la formation de cristaux de formazan.
- Retirez délicatement la solution de MTT par pipetage et le remplacer par 100 pi de diméthylsulfoxyde (DMSO).
- Placer la plaque de 96 puits sur un agitateur et mélanger pendant plusieurs minutes afin d'encourager la dissolution de la pourcristaux Mazan.
- Mesurer l'absorbance de chaque puits à 590 nm (pic d'absorbance produit formazan) et 700 nm (ligne de base).
- Soustraire l'échantillon absorbance à 700 nm (ligne de base) à partir de celle à 590 nm pour chaque puits.
- Normaliser l'absorbance corrigée en le divisant par la moyenne du contrôle positif et de se convertir à un pourcentage en multipliant par 100.
- Déterminer la viabilité pour cent en moyenne et l'écart type pour chaque condition.
6. photothermiques études de transduction
Note:. Dans ce travail, un système laser décrit précédemment par Pattani et Tunell est utilisé 33
- Photothermal transduction du NP Suspensions
- Diluer IP dans de l'eau DI à la concentration d'intérêt.
- Ajouter 100 pi de suspension NP à un puits d'une plaque de 96 puits. Placer la plaque de puits sur une plaque chaude maintenue à 25 ° C.
- Allumez l'alimentation du laser et lui permettre de to réchauffer pendant plusieurs minutes. Dans cette étude, une diode laser 808 nm couplée à la fibre nominale jusqu'à 1 W de puissance est utilisé.
- Acheminer le faisceau laser vers la scène de l'échantillon par l'intermédiaire d'une fibre optique. Utilisez une lentille convexe à diverger le faisceau laser de la taille du point désiré.
- Mesurer la puissance de sortie en utilisant un dispositif de mesure de courant standard et pour ajuster une puissance de 1 W / cm 2.
- Tournez sur la caméra IR (InSb caméra infrarouge (FLIR Systems SC4000)) et définir la région d'intérêt (ROI) endroit pour lire la température du point de 6 mm où le laser est focalisé.
- Placez le bien de l'intérêt au point de focalisation du faisceau laser. Enregistrer la température de référence de l'échantillon. Allumez le laser et irradier le bien continu pendant 5 min pendant l'enregistrement de la température.
- Après 5 min, éteignez le laser et continuer à enregistrer la température du puits jusqu'à ce qu'elle se refroidit à la température de base de départ.
Remarque: La chaleur et refroidir chaque suspension trois fois et calculer lale changement de la température moyenne au cours du temps. Utilisez de l'eau DI à 25 ° C au lieu d'une suspension NP comme contrôle négatif pour la conversion photothermique.
- Photothermal transduction des films polymères
- Transférer la lame de verre ITO revêtu de polymère sur une plaque chaude maintenue à 25 ° C.
- Tournez sur l'alimentation au laser et le laisser chauffer pendant plusieurs minutes. Dans cette étude, une diode laser 808 nm couplée à la fibre nominale jusqu'à 1 W de puissance est utilisé.
- Acheminer le faisceau laser vers la scène de l'échantillon par l'intermédiaire d'une fibre optique. Utilisez une lentille convexe à diverger le faisceau laser de la taille du point désiré.
- Mesurer la puissance de sortie en utilisant un dispositif de mesure de courant standard et pour ajuster une puissance de 1 W / cm 2.
- Tournez sur la caméra IR (InSb caméra infrarouge (FLIR Systems SC4000)) et définir la région d'intérêt (ROI) endroit pour lire la température du point de 6 mm où le laser est focalisé.
- Placez le film au point de focalisation du faisceau laser. Enregistrez le bASE température de l'échantillon. Allumez le laser et irradier l'échantillon en continu pendant 5 min pendant l'enregistrement de la température.
- Après 5 min, éteignez le laser et continuer à enregistrer la température de l'échantillon jusqu'à ce qu'elle se refroidit à la température de base de départ.
Remarque: La chaleur et refroidir chaque film trois fois et calculer la variation moyenne de la température au cours du temps. Utilisez une lame de ITO nue à 25 ° C comme contrôle négatif pour la conversion photothermique.
Résultats
Le protocole de réaction donnant M1 et M2 est illustrée à la figure 1. Les monomères peuvent être caractérisées par 1 H et 13 spectroscopie RMN C, point de fusion et analyse élémentaire. Le spectre RMN 1 H présente des informations concernant la connectivité des atomes et leur environnement électronique; Ainsi, il est couramment utilisée pour vérifier que les réactions ont été accomplies avec succès. Réactions de couplage de Negishi couplage comportent le noyau phényle de l'EDOT, ce qui provoque le proton phényle pic à 7,1 ppm de décaler à 7,8 ppm. Le proton thiényle sera également passer à travers le terrain à 6,5 ppm. Les quatre protons sur les atomes de carbone du pont éthylènedioxy se diviseront en deux ensembles de multiplets à 4,3 ppm. Protons sur des carbones aliphatiques ne changeront pas de manière significative. Le spectre RMN 13 C présentera des pics à 170, 145, 140, et 113 pour les atomes de carbone du groupe thiényle, et 150, 120 et 112 pour les atomes de carbone phénylène. Positions des alicarbones phatique ne changeront pas de manière significative. La structure chimique, RMN 1 H et RMN 13 C de M2 sont représentés sur la figure 3.
Électropolymérisation du polymère donnant M2 (P2) et voltamétrie cyclique de P2 sont illustrés sur la figure 4 A la figure 4A, au départ, il n'y a pas de réponse courant. que les augmentations potentielles, le début de l'oxydation du monomère M1 (E sur, m) peut être vu à + 0,25 V, avec l'oxydation de pointe du monomère (E p, m) à + 0,61 V. Au cours de la première analyse, le pic initial observé est indicatif de l'oxydation du monomère irréversible, entraînant la formation P2 sur la surface de l'électrode de travail. Pendant le deuxième balayage deux procédés d'oxydation sont observés: oxydation de monomères est encore observée à 0,25 V, et l'oxydation du polymère est vu à 0 V. voltamétrie cyclique de P2 (figure 4B) a été réalisée à des vitesses de balayage comprises entre 50 et quatre00 mV / sec. Le film de polymère est bleu foncé à l'état oxydé et rouge à l'état neutre. Vélo le polymère à une variété de vitesses de balayage révèle une relation linéaire entre la vitesse de balayage et le courant de pic, ce qui indique que le polymère est électroactif et adhère à l'électrode. 18 d'oxydation polymère (E a, p) est observée à -0,02 V pour P2, et la réduction de polymère (E c, p) est observée à -0,3 V lors du passage à 100 mV / sec.
Les IP ont été synthétisés comme montré sur la figure 2 et caractérisé par spectroscopie UV-Vis-NIR, la microscopie électronique, et DLS. L'UV-Vis-NIR spectres de oxydées et réduites films P2 et P2 de oxydé IP, sont présentés dans la figure 5. Les films polymères oxydés et les IP présentent un pic d'absorption λ max 1,56 eV (795 nm). Lorsque réduite dans de l'hydrazine, l'absorbance film de pic se déplace à une λ max de 2,3 eV (540 nm). La bande de polymère gap (E g) est déterminée à partir de l'apparition de la transition π- π * dans le polymère neutre, comme indiqué par la flèche noire sur la figure 5.
L'image MEB d'IP P2 sur la figure 6A montre que les IP sont sphériques et sub-100 nm de diamètre. Données DLS sur la figure 6B montre une moyenne Z des suspensions soit 104 nm de diamètre avec un indice de polydispersité (PDI) de 0,13, ce qui indique que l'échantillon est modérément monodispersées. Le potentiel zêta de la P2 IP a été jugée -30,5 mV. Changement de température lorsque les IP sont exposés à un rayonnement NIR démontre conversion photothermique. Par rapport aux contrôles d'eau, qui subissent moins d'un C augmentation de 1 ° de la température, de suspensions NP dans l'eau sont capables de convertir l'énergie laser absorbée en chaleur tel que démontré par l'augmentation de 30 ° C à la température de la suspension NP (Figure6C). Une augmentation de température similaire (28 ° C) est observée lorsque des films de polymère sur le verre ITO sont irradiés à 808 nm (Figure 6C).
Le cytocompatibilité des IP polymères est déterminée en utilisant des tests de viabilité cellulaire au MTT. Les résultats des études de cytocompatibilité pour PEDOT:. PSS-co-MA IP sont représentées sur la figure 7 Comme le montre, dans la gamme de concentration NP de 0,23 à 56 pg / ml, le NPS ne diminuent pas la viabilité des cellules à moins de 90% de la commande. Typiquement, une réduction de la viabilité des cellules de moins de 20% (par exemple, jusqu'à 80% de viabilité) est considéré comme acceptable pour la détermination de cytocompatibilité NP.

Figure 1. Synthèse de monomères général à partir de la synthèse des précurseurs. (A) Synthèse du 1,4-dialcoxy-2,5-dibromobenzène. (B) Synthèse du 1,4-dialcoxy-2,5-dibromobenzène contenant groupement ester. (C) réaction de couplage croisé de 1,4-dialcoxy-2,5-dibromobenzène avec EDOT, cédant monomères M1 et M2. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Procédé de polymérisation dans lequel la solution organique est ajouté goutte à goutte à une solution aqueuse créant une émulsion. Le monomère et le solvant organique peut varier. Polymérisation oxydative se produit lorsque FeCl 3 est ajouté à l'émulsion. Après purification de la suspension colloïdale, les infirmières praticiennes sont en suspension dans le milieu aqueux. S'il vous plaît cliquer ici pour voir une version plus grande de cettefigure.
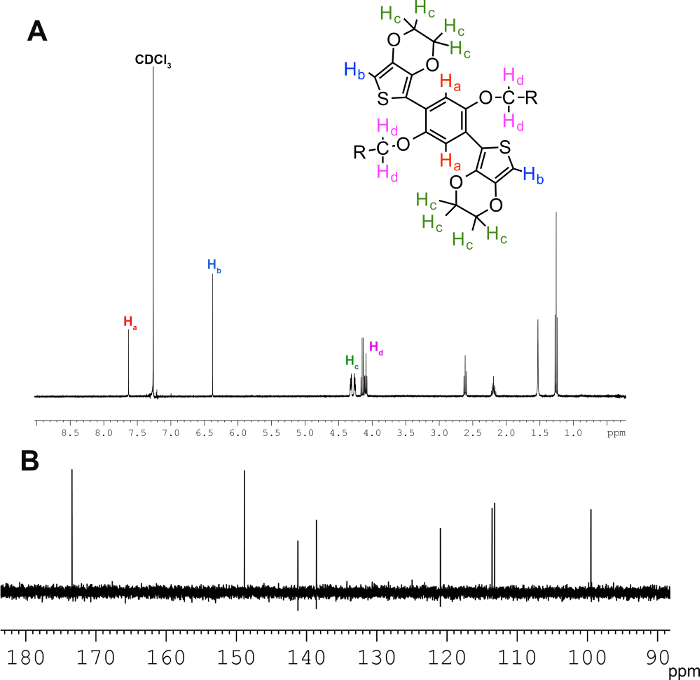
Figure 3. Les spectres de RMN du monomère M2. (A) 1 H-RMN spectroscopie de M2, où le fractionnement des protons éthylènedioxy à 4,32 ppm, le passage à travers le terrain des protons thiényle, et le passage à travers le terrain des protons phényliques sont indicatives d'un couplage réussi . (B) 13 C spectroscopie RMN de M2 montrant les thiényle et phényle carbone pics. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
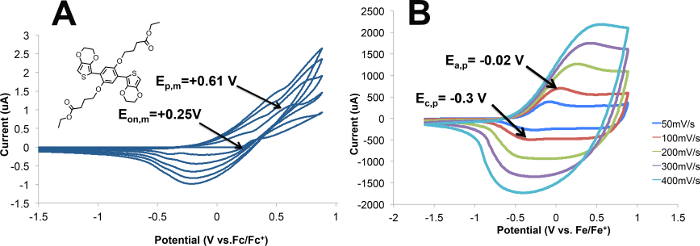
Figure 4. (A) de polymérisation électrochimique de M2 à P2; cinq cycles à 100 mV / sec de 0,01 M M2 à 0,1 M TBAP / CH3CN. (B) de voltampérométrie cyclique du film de polymère dans 0,1 M PETM / CH 3 CN pédalé à 50, 100, 200, 300, et 400 mV / sec. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5.-Vis-NIR spectres UV de P2 à la fois comme un film et comme une suspension des IP. Le spectre du film oxydé est représenté en bleu, le spectre du film réduite est affichée en rouge, et le spectre de la oxydé NP suspension est représenté en vert. La flèche noire correspond à la ligne tangente utilisée pour la détermination de la largeur de bande interdite du polymère. Longueurs d'onde d'absorption de pic pour les polymères sont fournis. S'il vous plaît cliquer ici pour voir une version plus grande de cettefigure.
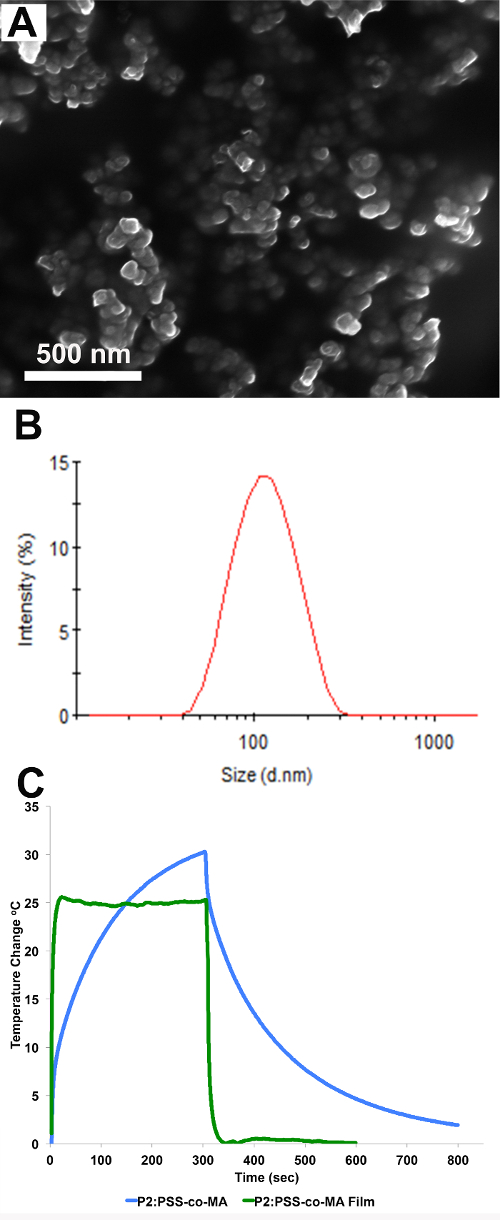
Figure 6. l'image (A) SEM montrant la morphologie et la taille des P2 IP. (B) la distribution des tailles de P2: PSS-co-MA NP suspension où la valeur moyenne Z est de 104 nm et le PDI est de 0,13. (C) de changement de température d'un P2:. PSS-co-MA NP suspension à 1 mg / ml (bleu) et le film (vert) lorsque irradié avec une lumière proche infrarouge pour 300 secondes, suivi d'un refroidissement passif à la fin de l'irradiation laser S'il vous plaît cliquer sur ici pour voir une version plus grande de cette figure.
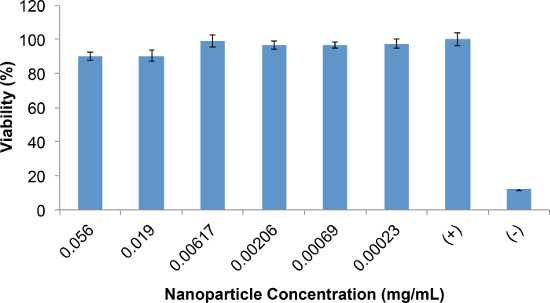
Figure 7. cytocompatibilité de PEDOT: PSS suspensions-co-MA NP tel que déterminé par le test de viabilité de MTT est.représenté pour les cellules exposées à des concentrations de NP variant le pourcentage moyen par rapport à celle de cellules incubées avec des milieux NP-libre (témoin positif). Contrôle négatif constitué de cellules tuées par exposition à du methanol avant le test MTT. Les barres d'erreur représentent l'écart entre les répétitions (n = 6). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Dans ce travail, les IP polymères électroactifs ont été synthétisés comme agents potentiels PTT pour le traitement du cancer. La préparation de PN est décrite, en commençant par la synthèse des monomères suivie d'une polymérisation en émulsion. Alors que la préparation des IP en utilisant polymères électroactifs tels que EDOT et pyrrole a été décrit précédemment, ce document décrit la préparation de polymères IP commençant par monomères de conjugaison de longues uniques, ce qui démontre que ce processus peut être étendu à de plus grandes monomères, plus complexes.
Deux itinéraires différents sont nécessaires pour synthétiser les monomères dialcoxybenzène. Bien que le 1,4-dihexyloxybenzene peut être synthétisé en utilisant KOH / EtOH, cette approche ne réussit pas à la synthèse de 1,4-bis (butanoyloxy d'éthyle) benzène, probablement en raison de l'hydrolyse de l'ester favorisée par une base. Quand un KI / K 2 CO 3 mélange est utilisé, l'hydrolyse est évité, et le produit est obtenu avec succès. Bromation du botdialcoxybenzènes h est accompli en utilisant Br 2. Il est nécessaire de réaliser cette expérience sous courant d'argon à déplacer HBr formé pendant la réaction. La sortie de gaz devrait évacuer sur une solution de NaOH de neutralisation pour éviter HBr de corroder les appareils de la hotte; noter que HBr peut causer des tubes en plastique de durcir au fil du temps.
BEDOT-B (OR) 2 monomères M1 et M2 ont été synthétisés en utilisant un couplage de Negishi. Ceci est une méthode efficace pour le couplage carbone-carbone avec de EDOT 1,4-dialcoxy-2,5-dibromobenzènes pour donner BEDOT-B (OR) 2 monomères. Il est essentiel de refroidir le EDOT à -78 ° C avant l'addition de nBuLi, de manière à minimiser des réactions secondaires indésirables. Lorsque tout le 1,4-dialcoxy-2,5-dibromobenzène est épuisé à partir du mélange réactionnel (déterminé par CCM, ce qui prend généralement 3-5 jours), la réaction est terminée. La réaction est extrêmement sensible à l'air, et de toute exposition à l'air aura une incidence sur le rendement de la réaction. Ainsi, lorsque introducing composés solides (tels que le catalyseur) dans le flacon scellé, exposition à l'air doit être minimisé en augmentant le flux d'argon.
Des monomères et des polymères électroactifs sont caractérisées en routine en utilisant la voltamétrie cyclique à déterminer monomères et d'oxydation du polymère potentiel et les potentiels de réduction du polymère, et les films préparés par polymérisation électrochimique sont utilisés pour déterminer l'absorption du polymère dans le spectre UV-Vis-NIR à la fois les états oxydé et réduit. Dans ce travail, les films polymères ont été déposés à la fois sur un bouton de platine et ITO verre revêtu par électropolymérisation. Certains des avantages de l'électropolymérisation sont la reproductibilité et la possibilité de contrôler l'épaisseur du film en contrôlant le courant de la couche polymérisée et l'arrêt de l'électropolymérisation quand une réponse spécifique est réalisé 34 expériences électrochimiques doivent être conduites sous une atmosphère inerte telle que l'argon. le flux d'argon devrait être si lent pour ne pas déplacer la surface de la solution afin d'assurer un processus de diffusion contrôlée. Alternativement, les expériences électrochimiques peuvent être effectuées dans une boîte sèche d'atmosphère inerte équipé traversées électrochimiques. Il est important qu'aucune des trois électrodes se touchent les uns les autres au cours de l'électropolymérisation. Avant en polymère études de voltampérométrie cyclique, les films polymères déposés doivent être lavées avec une solution électrolytique exempte de monomère pour éliminer tout monomère qui n'a pas réagi à partir des films. Pour toutes les études électrochimiques le domaine de potentiel nécessaire dépendra de la structure du monomère / polymère; si cette plage peut varier avec des monomères et polymères alternatifs. Selon la structure des substituants alcoxy, le solvant utilisé pour préparer les solutions d'électrolyte monomère peut également dissoudre le polymère. Dans ce cas, le dépôt de polymère sur l'électrode pendant l'électropolymérisation sera lente, voire inexistante, et le solvant utilisé pour la polymérisation doit être changé.
e_content "> La polymérisation en émulsion pour la préparation des IP composée de polymères électroactifs est une méthode efficace qui donne IP avec une morphologie uniforme Dans ce travail, le processus de polymérisation en émulsion utilise le même mécanisme de polymérisation oxydante utilisé lors de la polymérisation électrochimique;. la différence majeure est que un oxydant chimique (chlorure ferrique) est utilisé au lieu d'un potentiel électrochimique appliquée. Cette polymérisation en emulsion, par conséquent, produit IP identiques en composition chimique des films préparés par polymérisation électrochimique. Bien que la polymérisation électrochimique fournit un moyen facile de caractériser les propriétés d'oxydo-réduction de la des monomères et des polymères, la polymérisation en emulsion est un procédé rapide, peu coûteuse et reproductible, facilement adaptable et peut potentiellement être utilisé avec un certain nombre de différents polymères électroactifs. La polymérisation en emulsion permet également la préparation des IP à partir de polymères qui ont une faible solubilité dans organiqueet des solutions aqueuses qui ne pouvaient être émulsionnés efficace de l'état polymère. Dans nos polymérisations en emulsion, la phase organique est constituée d'un monomère, un solvant organique (hexane) et de l'acide dodécylbenzène sulfonique (tensio-actif). La phase aqueuse est constituée d'eau, le chlorure ferrique (oxydant), et PSS-co-MA (tensio-actif). Le procédé de polymérisation en émulsion est précédée d'une étape de sonication pour assurer la phase organique est bien dispersée dans la phase aqueuse. Durant la sonication, il est nécessaire de plonger l'émulsion dans un bain de glace pour éviter un échauffement vrac. Les tensioactifs PSS-co-MA et la DBSA permettent la dispersion de l'IP synthétisé dans des solutions aqueuses par inter-particules électrostatiques forces répulsives. Ces tensioactifs agissent également dopants équilibrant la charge que d'autres et ont été montrés pour produire la géométrie NP sphérique 24 Les infirmières praticiennes polymères restent à l'état oxydé, (comme en témoigne le pic d'absorption à 795 nm; Figure 4)., Ce qui est critiqueal pour des applications biomédicales dans lequel absorption dans la gamme NIR est nécessaire. 24Analyse du potentiel Zeta est généralement effectuée pour évaluer la stabilité des suspensions NP. Potentiel Zeta est le potentiel à la limite entre la couche de Stern où les ions sont fortement associées à la surface NP, et la couche diffuse où les ions interagissent plus avec la surface NP. 31 Zeta mesures potentiels comptent sur le mouvement des infirmières praticiennes chargées lorsqu'un électrique champ est appliqué à la suspension. Plus précisément, les IP chargés négativement sont attirés vers l'électrode positive, et vice versa. Suspensions colloïdales peuvent être stabilisées par l'intermédiaire de répulsions électrostatiques. Plus précisément, les suspensions sont considérées comme stables lorsque leur potentiel zêta est supérieure à +/- 30 mV. Dans les formules de nos NP, la présence de groupes sulfonate et carboxylate de DBSA et PSS-co-MA fournit une charge de surface négative sur les infirmières praticiennes.
Purification de the IP est une étape cruciale afin d'éliminer tout tensioactif excédentaire et tout matériau de départ qui n'a pas réagi avant les études in vitro de cellules. Élimination inefficace de tensioactif peut conduire à la mort cellulaire significative. Comme pour toute autre dans le dosage de cellules in vitro, il est essentiel de travailler dans une hotte à flux laminaire et de travailler dans des conditions stériles. IP doit également être stérilisé avant utilisation par passage de la suspension à travers un filtre de 0,2 um stérile. Il est également important de vérifier la concentration des suspensions NP après filtration stérile. A cet effet, une fraction de la suspension filtrée NP de volume connu peut être lyophilisée pour obtenir la masse sèche. Le test de viabilité cellulaire MTT est généralement utilisée pour étudier l'effet des biomatériaux, notamment IP, sur des cellules en culture. Ce test simple peut être adaptée à l'enquête de l'cytocompatibilité de suspensions NP avec une ligne de cellules de mammifères. Le test colorimétrique MTT est basée sur la conversion d'un colorant jaune de tétrazolium en violet, INSOLcristaux de formazan üble qui peut ensuite être dissous dans du DMSO ou des solutions alcooliques acides. 35,36 Lors de l'exécution dans des dosages cellulaires in vitro, tels que la viabilité de la cellule test MTT dans des plaques multi-puits, de la cohérence dans l'ensemencement des cellules et la manipulation est critique pour atteindre des différences minimes entre répliquer des échantillons. Avant et pendant l'expérience, les cellules ensemencées devraient être examinés sous un microscope pour assurer l'ensemencement et la croissance constante, et aussi à exclure toute contamination. Enfin, la microscopie peut également être utilisé pour confirmer la dissolution complète des cristaux de formazan après addition de DMSO.
Études photothermiques ont été réalisées avec un laser continu à 808 nm. L'utilisation de lasers pulsés vs. peut chauffer en continu les matériaux différemment. Des études antérieures ont comparé conversion photothermique et photothermique ablation des nanostructures d'or que les agents des PTT, 37 mais d'autres recherches sont nécessaires pour étudier conversion photothermique de polymeric IP comme ceux décrits ici. Dans ce travail, le laser a été divergé en une lentille convexe et focalisée à une taille de spot de 6 mm. Il est important de veiller à ne pas perturber le système optique lors de l'exécution des expériences pour éviter toute modification accidentelle dans le plan focal qui pourraient causer des différences dans les résultats de conversion photothermique. Une plaque chaude a été utilisée pour chauffer et maintenir une température constante de référence pour l'étude.
En conclusion, un protocole pour le NP de préparation de polymères électroactifs en suspension dans un milieu aqueux est décrit. Couplage de Negishi est une méthode efficace pour coupler le 1,4-dialcoxy-2,5-dibromobenzènes 3,4-éthylènedioxythiophène avec (EDOT). Électropolymérisation des monomères est détaillée dans ce protocole. Cela prouve être un moyen efficace de produire rapidement des films de polymère et d'étudier leurs propriétés électroniques. Les films polymères sont en outre caractérisés par spectroscopie NIR-Vis-UV pour déterminer les largeurs de bande interdite des polymères neutres. Electrochemical rendements de polymérisation en émulsion sous-IP de 100 nm avec des morphologies sphériques uniformes. En plus de la thérapie d'ablation photothermique, ces IP ont de nombreuses applications potentielles dans des dispositifs électroactifs, y compris le stockage et des capteurs d'énergie. Les études thermiques et cytocompatibilité effectuées indiquent que ces infirmières praticiennes pourraient être des candidats potentiels dans les applications biomédicales comme agents photothermiques.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Ce travail a été financé en partie par le Fonds Texas Emerging Technology (démarrage à la tuberculose), le Programme d'amélioration de Texas State University Research, le Texas State University Bourse de recherche postdoctorale (TC), le Partenariat NSF pour la recherche et l'éducation dans les Matériaux (PREM, DMR-1205670), La Fondation Welch (AI-0045), et National Institutes of Health (R01CA032132).
matériels
| Name | Company | Catalog Number | Comments |
| 2 mm diameter platinum working electrode | CH Instruments | CH102 | Polished using very fine sandpaper |
| 3,4-ethylenedioxythiophene | Sigma-Aldrich | 483028 | Purified by vacuum distillation |
| 3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide (MTT) 98% | Alfa Aesar | L11939 | |
| 505 Sonic Dismembrator | Fisher Scientific™ | FB505110 | 1/8“ tip and rated at 500 watts |
| 808 nm laser diode | ThorLabs | L808P1WJ | Rated at 1 W |
| Acetonitrile anhydrous 99% | Acros | 61022-0010 | |
| Avanti J-26 XPI | Beckman Coulter | 393127 | |
| Bromohexane 98% | MP Biomedicals | 202323 | |
| Dialysis (100,000) MWCO | SpectrumLabs | G235071 | |
| Dimethyl sulfoxide 99% (DMSO) | BDH | BDH1115 | |
| Dimethylformamide anhydrous (DMF) 99% | Acros | 326870010 | |
| Dodecyl benzenesulfonate (DBSA) | TCI | D0989 | |
| Dulbecco’s modified eagle medium (DMEM) | Corning | 10-013 CV | |
| EMS 150 TES sputter coater | Electron Microscopy Sciences | ||
| Ethanol (EtOH) 100% | BDH | BDH1156 | |
| ethyl 4-bromobutyrate (98%) | Acros | 173551000 | |
| Ethyl acetate 99% | Fisher | UN1173 | |
| Fetal bovine serum (FBS) | Corning | 35-010-CV | |
| Helios NanoLab 400 | FEI | ||
| Hexane | Fisher | H306-4 | |
| Hydrochloric acid (HCl) | Fisher | A142-212 | |
| Hydroquinone 99.5% | Acros | 120915000 | |
| Hydrozine anhydrous 98% | Sigma-Aldrich | 215155 | |
| Indium tin oxide (ITO) coated galss | Delta Technologies | CG-41IN-CUV | 4-8 Ω/sq |
| Iron chloride 97% FeCl3 | Sigma-Aldrich | 157740 | |
| Magnesium sulfate (MgSO4) | Fisher | 593295 | Dried at 100 °C |
| SKOV-3 | ATCC | HTB-26 | |
| Methanol | BDH | BHD1135 | |
| n-Butlithium (2.5 M) | Sigma-Aldrich | 230707 | Pyrophoric |
| Poly(styrenesulfonate-co-malic acid) (PSS-co-MA) 20,000 MW | Sigma-Aldrich | 434566 | |
| Potassium carbonate | Sigma-Aldrich | 209619 | Dried at 100 °C |
| Potassium hydroxide | Alfa Aesar | A18854 | |
| Potassium iodide | Fisher | P410-100 | |
| RO-5 stirplate | IKA-Werke | ||
| SC4000 IR camera | FLIR | ||
| Synergy H4 Hybrid Reader | Biotek | ||
| Tetrabutylammonium perchlorate (TBAP) 99% | Sigma-Aldrich | 3579274 | Purified by recrystallization in ethyl acetate |
| Tetrahydrofuran anhydrous (THF) 99% | Sigma-Aldrich | 401757 | |
| tetrakis(triphenylphosphine) palladium(0) | Sigma-Aldrich | 216666 | Moisture sensitive |
| Thermomixer | Eppendorf | ||
| USB potentiostat/galvanostat | WaveNow | AFTP1 | |
| Zetasizer Nano Zs | Malvern | Optical Arrangment 175° | |
| Zinc chloride (1 M) ZnCl2 | Acros | 370057000 |
Références
- Irvin, J., Irvin, D., Stenger-Smith, J. Electrically active polymers for use in batteries and supercapacitors. Handbook of Conducting Polymers. , (2007).
- Amb, C. M., Dyer, A. L., Reynolds, J. R. Navigating the color palette of solution-processable electrochromic polymers. Chemistry of Materials. 23 (3), 397-415 (2011).
- Beaujuge, P. M., Reynolds, J. R. Color control in pi-conjugated organic polymers for use in electrochromic devices. Chemical Reviews. 110 (1), 268-320 (2010).
- Ananthakrishnan, N., Padmanaban, G., Ramakrishnan, S., Reynolds, J. R. Tuning polymer light-emitting device emission colors in ternary blends composed of conjugated and nonconjugated polymers. Macromolecules. 38 (18), 7660-7669 (2005).
- Zhu, Y., Otley, M. T., et al. Neutral color tuning of polymer electrochromic devices using an organic dye. Chemical Communications, Cambridge, England. 50 (60), 8167-8170 (2014).
- Kline, W. M., Lorenzini, R. G., Sotzing, G. A. A review of organic electrochromic fabric devices. Coloration Technology. 130 (2), 73-80 (2014).
- Gerard, M., Chaubey, A., Malhotra, B. D. Application of conducting polymer to biosensors. Biosensors & Bioeletronics. 17, 345-359 (2002).
- Abidian, M. R., Kim, D. -H., Martin, D. C. Conducting-polymer nanotubes for controlled drug release. Advanced materials. 18 (4), 405-409 (2006).
- Ge, D., Qi, R., et al. A self-powered and thermally-responsive drug delivery system based on conducting polymers. Electrochemistry Communications. 12 (8), 1087-1090 (2010).
- George, P. M., LaVan, D. A., Burdick, J. A., Chen, C. -Y., Liang, E., Langer, R. Electrically controlled drug delivery from biotin-doped conductive polypyrrole. Advanced Materials. 18 (5), 577-581 (2006).
- Li, Y., Neoh, K. G., Kang, E. T. Controlled release of heparin from polypyrrole-poly(vinyl alcohol) assembly by electrical stimulation. Journal of biomedical materials research. Part A. 73 (2), 171-181 (2005).
- Svirskis, D., Travas-Sejdic, J., Rodgers, A., Garg, S. Electrochemically controlled drug delivery based on intrinsically conducting polymers. Journal of controlled release: official journal of the Controlled Release Society. 146 (1), 6-15 (2010).
- Cheng, L., Yang, K., Chen, Q., Liu, Z. Organic stealth nanoparticles for highly effective in vivo near-infrared photothermal therapy of cancer. ACS Nano. 6 (6), 5605-5613 (2012).
- Chougule, M. A. Synthesis and characterization of polypyrrole (PPy) thin films. Soft Nanoscience Letters. 01 (01), 6-10 (2011).
- Yang, K., Xu, H., Cheng, L., Sun, C., Wang, J., Liu, Z. In vitro and in vivo near-infrared photothermal therapy of cancer using polypyrrole organic nanoparticles. Advanced materials. 24 (41), 5586-5592 (2012).
- Diniz, S. N., Sosnik, A., Mu, H., Valduga, C. J. Nanobiotechnology. BioMed research international. 2013, (2013).
- Weissleder, R. A Clearer Vision for in vivo Imaging. Nature Biotechnology. , (2001).
- Irvin, J., Reynolds, J. Low-oxidation-potential conducting polymer: alternating substituted para-phenylene and 3,4-ethylenedioxythiophene repeat units. Polymer. 39 (11), 2339-2347 (1998).
- Yang, Y., Oldenhius, N., Buchwald, S. Mild and general condition for Negishi cross-coupling enabled by the use of palladacycle percatalysts. Angew Chem. 29 (6), 997-1003 (2012).
- Negishi, E., Hu, Q., Huang, Z., Qian, M., Wang, G. The Negishi Coupling: an update: Enantiopure sulfoxides and sulfinamides. New products from Aldrich R & D. Aldrichchimica Acta. 38 (3), (2005).
- Bilati, U., Allémann, E., Doelker, E. Development of a nanoprecipitation method intended for the entrapment of hydrophilic drugs into nanoparticles. European Journal of Pharmaceutical Sciences. 24 (1), 67-75 (2005).
- Nagavarma, B. V. N., Yadav, H. K. S., Ayaz, A., Vasudha, L. S., Shivakumar, H. G. Different techniques for preparation of polymeric nanopaticles-A review. Asian Journal of Pharaceutical and Clinical Research. 5 (3), 16-23 (2012).
- Vaitkuviene, A., Kaseta, V., et al. Evaluation of cytotoxicity of polypyrrole nanoparticles synthesized by oxidative polymerization. Journal of Hazardous Materials. 250-251, 167-174 (2013).
- Han, Y. K., Yih, J. N., et al. Facile synthesis of aqueous-dispersible nano-PEDOT:PSS-co-MA core/shell colloids through spray emulsion polymerization. Macromolecular Chemistry and Physics. 212 (4), 361-366 (2011).
- Winkel, K. L., Carberry, J. R., Irvin, J. A. Synthesis and electropolymerization of 3,5-bis-(3,4-ethylenedioxythien-2-yl)-4,4-dimethyl isopyrazole: A donor-acceptor-donor monomer. Journal of the Electrochemical Society. 160 (8), G111-G116 (2013).
- Hoye, T., Eklov, B., Voloshin, M. No-D NMR spectroscopy as a convenient method for titering. Organic Letters. 6 (15), 2567-2570 (2004).
- Umezawa, K., Oshima, T., Yoshizawa-Fujita, M., Takeoka, Y., Rikukawa, M. Synthesis of hydrophilic-hydrophobic block copolymer ionomers based on polyphenylenes. ACS Macro Letters. 1 (8), 969-972 (2012).
- Tao, Z., Fan, H., Zhou, J., Jin, Q. Conjugated polyelectrolyte with pendant caboxylate groups: synthesis, photophysics, and pH responses in the presence of surfactants. Journal of Polymer Science Part A-Polymer Chemistry. 46 (3), 830-843 (2008).
- Winkel, K. L., Carberry, J. R., et al. Donor-acceptor-donor polymers utilizing pyrimidine-based acceptors. Reactive & Functional Polymers. 83, 113-122 (2014).
- Kròl, E., Scheffers, D. -J. FtsZ polymerization assays: simple protocols and considerations. Journal of Visualized Experiments : JoVE. (81), e50844(2013).
- Zolnik, B., Potter, T. M., Stern, S. T. Zeta potential measurement. Methods in Molecular Biology. 697, 173-179 (2011).
- Nogi, K., Naito, M., Yokoyama, T. Nanoparticle technology handbook. , Elsevier. (2012).
- Pattani, V. P., Tunnell, J. W. Nanoparticle-mediated photothermal therapy: A comparative study of heating for different particle types. Lasers in Surgery and Medicine. 44 (8), 675-684 (2012).
- Subianto, S., Will, G. D., Kokot, S. Templated electropolymerization of pyrrole in a capillary. Journal of Polymer Science, Part A: Polymer Chemistry. 41 (12), 1867-1869 (2003).
- Sgouras, D., Duncan, R. Methods for the evaluation of biocompatibility of soluble synthetic polymers which have potential for biomedical use: use of the tetrazolium-based colorimetric assay (MTT) as a preliminary screen for evaluation of in vitro cytotoxicity. Journal of Materials Science: Materials in Medicine. 1 (2), 61-68 (1990).
- Ahmadian, S., Barar, J., Saei, A. A., Fakhree, M. A. A., Omidi, Y. Cellular toxicity of nanogenomedicine in MCF-7 cell line: MTT assay. Journal of Visualized Experiments : JoVE. (26), (2009).
- Huang, X., Kang, B., et al. Comparative study of photothermolysis of cancer cells with nuclear-targeted or cytoplasm-targeted gold nanospheres: continuous wave or pulsed lasers. Journal of Biomedical Optics. 15 (5), 058002(2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon