Method Article
Épithéliale repeuplement cellulaire et préparation des rongeurs matrice extracellulaire échafaudages pour le développement de tissu rénal
Dans cet article
Erratum Notice
Résumé
This protocol describes decellularization of Sprague Dawley rat kidneys by antegrade perfusion of detergents through the vasculature, producing acellular renal extracellular matrices that serve as templates for repopulation with human renal epithelial cells. Recellularization and use of the resazurin perfusion assay to monitor growth is performed within specially-designed perfusion bioreactors.
Résumé
Ce protocole détaille la génération de acellulaire, encore, des échafaudages biofonctionnels rénales matrice extracellulaire (MEC) qui sont utiles comme substrats modèles à petite échelle pour le développement du tissu organe échelle. Reins de rats Sprague Dawley sont canulées par l'insertion d'un cathéter dans l'artère rénale et perfuses avec une série de détergents à faible concentration (Triton X-100 et du dodécylsulfate de sodium (SDS)) de plus de 26 heures pour obtenir intactes, des échafaudages entier rénaux avec intact vascularisation perfusable, glomérules et les tubules rénaux. À la suite de la décellularisation, l'échafaudage rénale est placé dans un récipient bioréacteur à perfusion conçu sur mesure, et cathétérisé l'artère rénale est connecté à un circuit de perfusion comprenant: une pompe péristaltique; tube; et en option des sondes pour le pH, l'oxygène dissous et la pression. Après stérilisation du échafaud avec de l'acide peracétique et d'éthanol, et en équilibrant le pH (7,4), l'échafaudage de rein est préparée pour l'ensemencement par perfusion de milieu de culture dans un large-capacité incubateur maintenu à 37 ° C et 5% de CO 2. Quarante millions épithéliales tubulaire cortical (RCTE) les cellules rénales sont injectés dans l'artère rénale, rapidement et perfuses à travers l'échafaudage sous fort débit (25 ml / min) et la pression (~ 230 mmHg) pendant 15 min avant de réduire le débit à un taux physiologique (4 ml / min). Cellules RCTE peuplent principalement le créneau ECM tubulaire dans le cortex rénal, prolifèrent, et forment des structures épithéliales tubulaires plus de sept jours de culture de perfusion. Une solution de résazurine 44 pM dans du milieu de culture est perfusé à travers le rein pendant 1 heure au cours d'échanges moyen pour fournir une évaluation sur la base du métabolisme redox fluorométrique de la viabilité cellulaire et la prolifération pendant tubulogenèse. Le bioréacteur de perfusion rénale permet échantillonnage non invasive pour l'évaluation de milieu biochimique, et de multiples orifices d'entrée permet l'ensemencement rétrograde alternatif à travers la veine rénale ou de l'uretère. Ces protocoles peuvent être utilisés pour recellularize échafaudages de rein avec unegrande variété de types cellulaires, y compris l'endothélium vasculaire, l'épithélium tubulaire, et les fibroblastes du stroma, pour une évaluation rapide au sein de ce système.
Introduction
Comme le nombre de patients souffrant d'insuffisance rénale terminale continue d'augmenter, il ya une pénurie grave et croissante du nombre de reins de donneurs disponibles pour la transplantation. L'incapacité à répondre à la demande d'un nombre croissant continuellement des candidats en liste d'attente pour une transplantation rénale a incité la recherche en ingénierie d'organe de rein avec le but ultime de développement personnalisé, des greffes de rein implantables sur demande 1,2. Fonctionnement tissu rénal partir des propres cellules d'un patient de construction permettrait d'éliminer la nécessité d'immunosuppression à vie, diminuer la quantité de temps que les patients passent à la dialyse en attente d'une greffe de rein, et d'étendre la transplantation de sauver la vie à plus de patients atteints de maladie rénale chronique.
La première étape vers la bioingénierie un tissu de rein en utilisant des cellules provenant de patients est de développer un échafaudage qui sert de substrat favorable pour parenchyme rénal (par exemple épithélium tubulaireLiAl), des fibroblastes du stroma, et la croissance des cellules vasculaires. Échafaudages de biomatériaux dérivés de orgue naturelle matrices extracellulaires (ECM) ont plusieurs caractéristiques qui les rendent souhaitables pour une utilisation dans l'ingénierie tissulaire, y compris leur composition biologique naturelle; macro et microstructure appropriée pour doter la fonction physiologique; et la biocompatibilité cellulaire, favoriser l'adhésion cellulaire, la migration, et le tissu constructive remodelage 3. Une méthode prometteuse pour produire des échafaudages pour la régénération tissulaire rénale est par décellularisation de allogéniques ou xénogéniques reins qui préservent une grande partie de la composition de protéine naturelle complexe du rein ECM 4, conserver la complexité architecturale inhérente de l'organe, et de surmonter la difficulté associée à ascendante jusqu'à l'ingénierie des tissus épais cellularisées en fournissant un apport vasculaire de cellules en développement après échafaudage recellularization 5.
Perfusion décellularisation est un processus dansces détergents, des enzymes, ou d'autres solutions perturber cellules sont uniformément livrés à travers le réseau vasculaire de l'organe 6. Cette stratégie a été établie comme un processus efficace pour dériver acellulaire échafaudages ECM basé organes, comme en trois dimensions (3D), modèles biologiques pour l'ingénierie entier organe 6-8, comme en témoigne le développement de modèles rénales acellulaire à partir de reins humains jetés 9 et les reins xénogéniques obtenus à partir de grand animal (par exemple 10 cochon, la chèvre 11) et sources de rongeurs 12. En particulier, l'utilisation de petits modèles animaux comme les rongeurs nécessite moins de cellules et les milieux de culture, ce qui est particulièrement utile pour les études de recellularization de l'organe dans lequel le nombre de cellules sont habituellement limitées, comme cela est le cas avec les tissus dérivés de cellules souches. Le but du protocole de décellularisation est décrit pour produire un ECM rénale acellulaire qui peut être utilisé comme un système d'échafaudage 3D pour la régénération du rein structures, y compris les tubules du néphron qui sont repeuplé dans le présent exemple avec épithéliales tubulaire du cortex rénal humain (RCTE) cellules. Nous avons décrit précédemment notre évaluation rigoureuse d'un optimale, à base de détergent protocole de rein de rat de décellularisation 7, ce qui est plus rapide (environ un jour) que les autres méthodes précédemment rapportés (Ross et al .- 5 jours 12, Song et al .- 4,5 jours 13), et expose l'organe à une concentration beaucoup plus faible (0,1%), du sulfate de dodécyle de sodium dénaturant (SDS) au cours de la décellularisation de rapports antérieurs 12-15.
Un nombre limité d'études ont décrit l'utilisation de reins de rongeurs pour décellularisation et l'utilisation ultérieure comme un échafaudage 3D pour le repeuplement cellulaire (revue ailleurs 1) 12-16. Dans ce protocole, nous fournissons une description détaillée de notre établi précédemment, la stratégie de décellularisation optimale pour produire des échafaudages rénaux acellulairede Sprague-Dawley reins de rats 7. Utilisation de bioréacteurs de perfusion conçu sur mesure capables de double ensemencement et la maintenance perfusion culture 17, nous recellularize les échafaudages rénaux acellulaires avec des cellules de RCTE humaines, qui repeupler toujours l'élément tubulaire dans ces matrices décellularisés, prolifèrent, et survivent dans la culture de perfusion pendant une semaine. Nous démontrons en outre notre utilisation de la résazurine dosage de perfusion - une, non cytotoxiques peu coûteux, et l'évaluation non invasive métabolique précédemment utilisé pour la cytotoxicité étudie 17 - pour fournir une indication de la viabilité cellulaire et de prolifération dans les reins au cours du temps recellularized 7.
Protocole
ÉTHIQUE DECLARATION: Toutes les procédures impliquant des animaux ont été effectuées conformément aux lignes directrices approuvées par le soin et l'utilisation des animaux Commission institutionnelle de la Northwestern University.
1. Rein Décellularisation
- Préparer des solutions de décellularisation. Préparer les volumes de réactifs suivants pour chaque rein décellularisé à, et un volume supplémentaire (par exemple, pour quatre reins, préparer 5000 ml de Triton X-100 à l'étape 1.1.3.):
- Préparer 500 ml eau par osmose inverse (ROH 2 O). Remarque: Sinon, l'eau déminéralisée peut être utilisé dans les étapes où ROH 2 O est indiqué.
- Préparer 1,000 ml de Triton X-100, 1% (v / v) dans ROH 2 O. Lentement, ajouter 10 ml de Triton X-100 à 990 ml d'eau dans un grand récipient sous agitation rapide sur une plaque d'agitation. Laisser le réactif pour dissoudre complètement avant l'utilisation (au moins 10 min).
- Préparer 1,000 ml de Triton X-100, 1% (v / v) dans 2 ROH O (septembrevolume de arate).
- Préparer 1000 ml de dodécylsulfate de sodium (SDS), 0,1% (v / v) dans ROH 2 O. Lentement, ajouter 5 ml de SDS (20% de la solution d'achat d'actions) à 995 ml d'eau dans un grand bécher, sous agitation rapide sur une plaque d'agitation. Laisser le réactif de mélanger de manière uniforme avant l'utilisation (au moins 10 min).
- Préparer 500 ml ROH 2 O (volume séparé).
- Préparer reins pour décellularisation.
- Récupérer un rein provenant d'un rat mâle Sprague Dawley (250-300 g) comme décrit précédemment 7.
- Anesthésier le rat par injection intrapéritonéale de pentobarbital (50 mg / kg de poids corporel). Foire examiner la profondeur de l'anesthésie (toutes les 10-15 min) par la surveillance de la fonction respiratoire, le rythme cardiaque, et la réponse orteil de pincement pendant la chirurgie. Si l'animal a un taux de respiration élevée ou réflexe de pédale positif, administrer une dose supplémentaire (avec 1/3 à 1/4 de la dose initiale) de pentobarbital.
- Effectuez une ligne médiane longitudinale abdominal incision pour exposer le rein, l'aorte abdominale et la veine cave inférieure.
- Injecter 2000 unités d'héparine USP / kg de poids corporel dans la veine du pénis.
- Mobiliser les deux reins par dissection douce. Soigneusement séparer le rein de la graisse péri-rénale, tout en gardant la capsule rénale entourant le rein intact. Perfuser les reins avec une solution saline froide (10 ml) par infra-rénale de l'aorte abdominale.
- Insérer un cathéter de calibre 24 dans l'artère rénale, ligaturer fermement le cathéter de l'artère, et (à l'aide d'une seringue) perfuser doucement le rein avec 10 ml de solution saline tamponnée au phosphate froide (PBS) pour dégager complètement le organe de sang.
- Plongez rénale dans 25 ml de PBS dans une boîte de Pétri et placer dans un congélateur C -20 ° à geler progressivement l'organe (induisant ainsi une lyse cellulaire) pour le stockage jusqu'à décellularisation.
Remarque: si on le souhaite, l'uretère et / ou rénale, la veine peut également être pourvue d'une canule pour l'ensemencement rétrograde, bien que non décrit dans this protocole. - Dégeler complètement le rein congelés (equilibriate à la température ambiante (RT)), et de perfuser doucement avec 10 ml de PBS pour vérifier l'artère rénale ligaturé pour les fuites. En cas de fuite ou de résistance significative sont observées, re-sonder l'artère rénale.
- Récupérer un rein provenant d'un rat mâle Sprague Dawley (250-300 g) comme décrit précédemment 7.
- Préparer l'équipement pour décellularisation. Assembler le système de perfusion de décellularisation comme représenté sur la figure 1B.
- Branchez une 8 "longueur du tuyau de la pompe péristaltique (figure 1D, f) à deux longueurs suffisantes (> 36" recommandé) de 1/16 "de diamètre (ID) tube interne de caoutchouc de silicone (figure 1D, h). Utilisez deux verrouillage Luer mâle à 1/8 "adaptateurs barbelés rejoints par un luer femelle x adaptateur luer femelle pour rejoindre des segments de tuyau (figure 1D, j). Insérer un verrou Luer mâle complémentaire à 1/8 "adaptateur cannelé (figure 1D, c) dans l'extrémité aval de la ligne de perfusion destiné à être fixé à la rénalCathéter d'artère.
- Connectez chaque segment de tuyau de la pompe péristaltique à la tête de la pompe à 4 galets en utilisant une grande cartouche de la pompe.
- Après avoir placé l'extrémité amont du tube de caoutchouc de silicone dans le premier réservoir de solution (ROH 2 O), maintenez le bouton "Premier" pleinement chaque premier circuit de perfusion avec une solution. CRITIQUE: Vérifier qu'aucune bulle restent piégés dans le tube, et en ce que l'extrémité amont (à gauche ouvert pour aspirer le fluide) du tube de caoutchouc de silicone est fixé au-dessous de l'interface liquide-air du réservoir de réactif, comme cela est représenté sur la figure 1B.
- Effectuer le protocole de décellularisation à RT 7.
- Connecter le cathéter de l'artère rénale de chaque rein décongelé à la fin du circuit tubulure de perfusion en aval de la pompe, en sorte que les bulles d'air sont piégées dans le cathéter. Autoriser rein à être suspendue le long de la paroi intérieure d'un 5 bêcher (réservoir de collecte de perfusion vide, voir Figure 1B) de sorte que l'artère rénale ne soit pas plié ou enroulé.
- Réglez la commande de la pompe à 5 ml / min, et appuyez sur le bouton "Démarrer". Vérifiez que chaque rein est perfusion en observant solutions goutte à goutte à partir du bas de l'organe.
- Perfuser chaque rein avec les réactifs suivants, comme décrit sur la figure 1A
- Perfuser avec 500 ml ROH O 2 à 5 ml / min pendant 1 h, 40 min.
- Perfuser 1000 ml avec 1% de Triton X-100 à 5 ml / min pendant 3 h, 20 min.
- Perfuser 1000 ml avec 1% de Triton X-100 à 1 ml / min pendant 16 h, 40 min.
- Perfuser avec 1,000 ml 0,1% de SDS à 5 ml / min pendant 3 h, 20 min.
- Perfuser avec 500 ml ROH O 2 à 5 ml / min pendant 1 h, 40 min.
Note: Chaque rein décellularisé peut être stocké dans du PBS (sans additifs) dans un tube conique de 50 ml à 4 ° C pendant un maximum de deux semaines avant utilisation.
2. Parfusion Assemblée bioréacteur, Reins stérilisation, et préparation pour Recellularization
- Préparer les navires de bioréacteur.
- Laver les réservoirs de bioréacteurs en verre (composante du corps) et les chefs de bioréacteurs à chaud, diluer des solutions détergentes plat (ex. De solution à 1% plat de détergent dans l'eau du robinet) et rincer abondamment avec de l'eau du robinet, puis ROH 2 O. Autoriser les composants sécher complètement.
- Application d'un petit volume (~ 5 ml) de siliciuration réactif à la partie inférieure de chaque réservoir. Veiller à ce que réactif mouille la surface inférieure entière pendant plusieurs secondes, puis les égoutter l'excès de liquide.
- Laisser les réservoirs à sécher dans une hotte à RT O / N. En variante, les réservoirs peuvent être séchées dans un four à 100 ° C pendant 30 min afin d'accélérer le séchage et améliorer la durabilité du revêtement, qui est destinée à empêcher la fixation des cellules au fond du réservoir de bioréacteur en verre.
- Préparation des composants de circuit de perfusion pour la stérilisation (Figure1D).
- Couper les longueurs suivantes de tubes (pour chaque bioréacteur):
- Coupez deux longueurs de 25 "1/16" tube de caoutchouc de silicone ID (figure 1D, h).
- Coupez un 8 "longueur du tuyau de la pompe péristaltique (figure 1D, f).
- Coupez un 4.25 "longueur de 1/16" tube de caoutchouc de silicone de ID.
- Coupez deux longueurs de 1 "1/16 à paroi épaisse" tube de caoutchouc de silicone de ID (figure 1D, g).
- Coupez un 2 "longueur de 1/4 'ID x 0,5" de diamètre (OD) d'un tube de caoutchouc de silicone extérieure (figure 1D, e).
- Préparer les adaptateurs Luer suivants (pour chaque bioréacteur):
- Préparer 10 Luer Lock mâle à 1/8 adaptateurs barbelés »(figure 1D, c)
- Préparez 2 luer mâle branche (figure 1D, a)
- Préparez 2 caps luer femelle (figure 1D, b)
- Préparer 5 luer femellex adaptateurs luer femelle (x5; Figure 1D, d)
- Lavez tous les adaptateurs de tubes et Luer avec chaud, des solutions diluées de détergent pour lave, rincer abondamment à l'eau du robinet, puis ROH 2 O, et laissez-les sécher.
- Couper les longueurs suivantes de tubes (pour chaque bioréacteur):
- Assemblez circuits de perfusion.
- Slip 1 "longueur de 1/16 'ID tube de caoutchouc de silicone à paroi épaisse sur entrée accepteur Luer attaché à la tête du bioréacteur. Placez Luer Lock mâle à 1/8 "adaptateur barbe de ID dans l'extrémité ouverte du tube. Répétez l'opération pour l'autre accepteur Luer entrée, et de connecter un bouchon luer femelle pour obturer le port (destinés à l'uretère ou veineux techniques de semis ne sont pas décrites dans ce protocole).
- Connectez chaque «segment de 1/16" 25 ID tube de caoutchouc de silicone à la "segment 8 des tubes de pompe péristaltique utilisant verrouillage Luer mâle à 1/8" barbe d'identité et luer femelle x femelle adaptateurs Luer (figure 1D, j).
- Branchez une extrémité ouverte de caoutchouc de silicone Tubing à la sortie du perfusat de médias à l'extérieur de la tête du bioréacteur. Connectez le "longueur de 1/16" 4,25 tube ID sur le côté opposé (intérieure) de la sortie de liquide de perfusion de médias à l'intérieur de la tête de bioréacteur.
- Se connecter un verrou Luer mâle à 1/8 'adaptateur cannelé ID à l'extrémité ouverte restante du tube en circuit de perfusion. Connectez un luer femelle x adaptateur Luer femelle à la serrure Luer mâle. Connectez le luer femelle x adaptateur luer femelle au mâle Luer cadenas ouvert menant à l'entrée Luer accepteur sur le bioréacteur. Cela servira de l'entrée de liquide de perfusion médiatique menant directement dans l'artère rénale cathétérisé.
- Assurez-vous que pas de ports sur le couvercle du bioréacteur sont laissés ouverts ou exposés. Bien refermer la soupape de vide sur le corps de bioréacteur.
- Monter la tête de bioréacteur sur le corps du réservoir, avec un joint torique en sandwich entre les rainures identiques bordant chaque composant. Placer une pince métallique au-dessus de l'interface pour maintenir les deux éléments ensemble.
- Monter l'orifice d'évent sur la tête du bioréacteur avec un filtre de 0,2 micron évent, reliant les deux composants à l'aide d'un "quart de longueur 2" ID x 0,5 'de tube de caoutchouc de silicone de la DO (figure 1D, e). Ouvrez la vanne de purge.
- Desserrer légèrement le bouchon à vis rouge sur la tête de bioréacteur.
- Placez les adaptateurs Luer restants et 6 "dentelées spécimens forceps dans un sachet autoclavable et le joint.
- Autoclaver les bioréacteurs assemblés et fiches mâles Luer.
- Préparer les réactifs suivants pour échafaudage stérilisation et perfusion du milieu avant de semer (volumes sont répertoriés par le rein décellularisé):
- Dans une hotte, préparer un acide peracétique 50 ml de 0,1%, solution d'éthanol de 4% en ajoutant 2,56 ml de solution d'acide peracétique (39% de concentration en stock) et 40 ml 200 éthanol preuve ~ 957 ml ROH 2 O dans une bouteille de 1 L. Mélanger soigneusement par bouteille retournant plusieurs fois, et le placer dans l'armoire de sécurité biologique.
- Préparerun 150 ml solution de PBS 1x, pré-stérilisés par autoclavage.
- Préparer 50 ml de DMEM / F12 supplémenté avec du sérum de 10% de fœtus bovin (FBS) et 1% de pénicilline-streptomycine (Pen-Strep).
- Recueillir les éléments restants pour l'assemblage de bioréacteur à perfusion. Placez tous les éléments dans une enceinte de sécurité biologique. CRITIQUE: Assurez-vous que l'enceinte de sécurité biologique est équipé de prises électriques de travail pour alimenter le moteur de la pompe numérique. Sinon, utilisez une rallonge pour connecter le lecteur de la pompe à des prises électriques externes extérieur de l'armoire.
- Recueillir reins décellularisés.
- Recueillir bioréacteurs autoclaves avec des circuits de perfusion attachés.
- Recueillir sachet autoclave contenant adaptateurs Luer et des pinces.
- Recueillir entraînement de la pompe attachée numérique avec la tête à 4 galets, et de grandes cartouches de pompe (1 par circuit de perfusion).
- Remplissez le circuit de perfusion tel que décrit à la figure 1C sous c stérileonditions au sein d'une enceinte de sécurité biologique.
- Connectez un robinet à 3 voies (figure 1D, i) entre le luer lock mâle à 1/8 'adaptateur barbe d'identité près de l'entrée de liquide de perfusion des médias et de l'adaptateur luer femelle la femelle Luer x. Laissez tous les trois ports sur le robinet ouvert.
- Retirez le bouchon à vis rouge sur la tête de bioréacteur et la pipette 50 ml de l'acide peracétique à 0,1%, solution d'éthanol de 4% dans le réservoir de fluide à travers l'ouverture.
- Connectez le segment de tuyau de la pompe péristaltique à la tête de la pompe en utilisant une grande cartouche de la pompe. Réglez le débit à 5 ml / min, appuyez sur "Démarrer", et permettre au circuit pour amorcer.
- Lorsque le liquide remplit la ligne de perfusion et atteint le port ouvert restante du robinet à trois voies, branchez le port à l'aide d'une fiche mâle Luer (figure 1D, a).
- À permettre au circuit principal jusqu'à ce que tout l'air ne soit observée dans le tube de circuit de perfusion ou à l'intérieur de l'orifice d'entrée Luer accepteur. Si nécesry, augmenter le débit temporairement pour expulser des bulles de la ligne de perfusion. Lorsque amorcé complètement, arrêter l'entraînement de la pompe.
- Brancher avec précaution l'extrémité luer femelle du cathéter de l'artère rénale dans l'entrée accepteur luer mâle sur la surface intérieure de la tête de bioréacteur en utilisant les 6 "pinces stérilisées. Assurez-vous que la connexion est serré et que l'air ne reste dans le cathéter. Laisser le rein pour accrocher doucement de cathéter de l'artère rénale, de sorte que l'artère rénale n'a pas tordre ou kink.
- Serrer le collier métallique maintenir ensemble la tête du bioréacteur et le corps de sorte que le réservoir de bioréacteur est hermétiquement fermés. Fermez le bouchon à vis rouge sur la tête de bioréacteur.
- Stériliser les reins à la température ambiante par perfusion avec 0,1% peracétique, solution d'éthanol à 4% à 5 ml / min pendant 1 heure, puis trois perfusions séquentielles 1 heure à température ambiante avec 50 ml de PBS à 5 ml / min.
- Modification de solutions:
- Après 1 heure, arrêter la pompe et ouvrir bouchon à vis rouge. Utilisation d'un sterile (autoclave) pipette Pasteur, aspirer soigneusement la totalité de la solution du réservoir de bioréacteur. Laissez le circuit de perfusion amorcé complètement.
- Pipette 50 ml de solution fraîche dans le réservoir de bioréacteur, fermer le bouchon à vis, et démarrer la pompe.
- Modification de solutions:
- Après le rinçage finale du PBS, PBS aspiré depuis le réservoir et la pipette dans 50 ml de DMEM / F12 supplémenté avec 10% de FBS et 1% de Pen-Strep. Fermer le bouchon fileté et transférer le bioréacteur avec le circuit de perfusion fixé à une grande capacité incubateur maintenu à 37 ° C et 5% de CO 2.
- Si nécessaire, transférer la commande de la pompe à l'incubateur. Connectez circuit de perfusion de bioréacteur à la pompe, et perfuser les reins à 4 ml / min pendant au moins 1 h avant l'ensemencement.
3. Rein Recellularization avec des cellules épithéliales du cortex rénal tubulaire
- Des volumes suffisants chaudes de DMEM / F12 (complétés avec 10% de FBS et 1% Pen-Strep) et cell dissocier l'enzyme pour le levage de la cellule à 37 ° C. Volumes proposés sont énumérés ci-dessous:
- Préparer 10 ml cellule dissocier enzyme et 10 ml de DMEM / F12 par 175 cm 2 flacon de culture pour le levage.
- Préparer 5-10 ml de DMEM / F12 par rein à être ensemencé.
- Prélever un nombre suffisant de flacons de culture pour la concentration d'ensemencement souhaitée (4 x 10 7 cellules immortalisées de RCTE droits de 18 pour les résultats de la prise de greffe de rein dans maximal de cellules RCTE utilisant cette stratégie de semis).
- cellules de levage dans les fioles à l'aide de dissociation cellulaire enzyme. Aspirer milieu du flacon, puis pipette de 10 ml dissocier cellule enzyme dans le flacon. Lieu flacon dans 37 ° C incubateur pour accélérer la dissociation.
- Vérifier la fiole sur un microscope à contraste de phase toutes les 2 min jusqu'à ce que la dissociation complète de cellules de surface du ballon est observée. Remarque: Le temps d'incubation varie en fonction du niveau de confluence des cellules, mais les cellules r RCTE volontéequire environ 15 min pour se dissocient complètement.
- Prélever un échantillon de suspension cellulaire dissociée pour compter avant la granulation. Diluer la suspension cellulaire avec un volume égal de milieu préchauffé DMEM / F12, et centrifuger à 232 xg force centrifuge relative (RCF) pendant 5 min.
- Compter les cellules pendant la centrifugation. Diluer l'échantillon obtenu avec un volume égal de bleu Trypan, et la pipette 10 ul dans chaque extrémité d'un hématimètre pour le comptage. Calculer le volume nécessaire culot de dilution pour obtenir la concentration souhaitée d'ensemencement (2 x 10 7 cellules / ml).
- Après centrifugation, diluer le culot avec un volume approprié de milieu de culture pour obtenir une concentration finale de 2 x 10 7 cellules / ml. Aspirer 2 ml de la suspension d'ensemencement dans un 5 ml seringue stérile.
- Transférer le bioréacteur de perfusion à une enceinte de sécurité biologique. Tournez le robinet d'arrêt pour fermer l'écoulement vers le port d'ensemencement. Retirez le bouchon de glissement Luer mâle dele robinet, et connectez la seringue chargée avec la suspension d'ensemencement.
- Transférer rapidement le circuit de perfusion retour à l'incubateur, et utiliser la grande cartouche de la pompe pour assurer le segment péristaltique de tuyau de la pompe à la tête de la pompe.
- Cellule ensemencement: Fermez le port de robinet d'arrêt dirigée vers la pompe. Injecter lentement la suspension cellulaire dans les reins, veillant à ce que la totalité de la suspension est transférée à partir de la seringue dans la ligne de perfusion et robinet d'arrêt. Tournez le robinet d'arrêt pour fermer l'écoulement de la seringue, et commencer à la pompe à 25 ml / min pendant 15 min.
- Après 15 minutes, réduire le taux de débit de la pompe à 4 ml / min. moyen d'échange (volume de 100 ml pour les modifications ultérieures) le lendemain et ensuite tous les deux jours.
4. L'évaluation de la viabilité cellulaire et de prolifération utilisant Résazurine Perfusion Assay
- Préparer le réactif résazurine. Dissoudre le sel de sodium résazurine 110,5 mg dans 100 ml de PBS sous agitation, et on dilue par addition de 5 01 heures 10 ml de lasolution résultante à 45 ml PBS frais pour créer un résazurine solution stock de 440 uM. Filtre-stériliser (en utilisant un filtre de 0,2 um de la seringue), et de stocker la solution mère dans un tube conique de 50 ml abri de la lumière à 4 ° C.
- Préparer des témoins des médias résazurine-complété. Préparer une solution à 10% de réactif de résazurine en milieu de culture (p. 5 ml Résazurine solution stock + 45 ml de milieu de culture) pour créer résazurine solution de travail. Autoclave un volume de 10 ml de la solution de travail de la résazurine dans un récipient protégé contre la lumière. Remarque: Ce sera complètement réduire le composé de résazurine à résorufine, et servira comme un contrôle positif pour le calcul de la réduction de la résazurine pour cent.
- Aliquote de 1 ml de solution de travail chaque REMA (oxydé), autoclave résazurine solution (réduit), et milieu de culture de travailler seul (blanc) dans 1,5 ml tubes de collecte sélective. Placer les tubes ouverts dans le même incubateur que les bioréacteurs de perfusion.
- Transférer la perfusion rénalecircuit de l'incubateur à une enceinte de sécurité biologique. Retirez le bouchon à vis de la tête de bioréacteur, et milieu de culture d'aspiration du réservoir de bioréacteur aide d'une pipette Pasteur.
- Pipette de 10 ml de résazurine solution dans le réservoir, fermer le bouchon à vis de travail, et transférer le circuit de perfusion rénale retour à l'incubateur.
- Démarrer la pompe à 4 ml / min et permet réactif pour perfuser à travers les reins pendant exactement 1 h.
- Après 1 heure, arrêter la pompe, et de transférer le circuit de perfusion rénale à l'enceinte de sécurité biologique.
- Récupérer le conditionné (partiellement réduit) solution de résazurine, et ajouter 100 ml de milieu de culture vers le réservoir de bioréacteur. circuit de perfusion de transfert d'incubateur, et reprendre flux (4 ml / min).
- Pipette 100 pi (x 3 répétitions) conditionnée résazurine solution, résazurine solution de travail, autoclave solution de travail, et vierge de milieux de culture dans un noir (opaque) plaque de 96 puits dosage. Lire l'intensité de fluorescence (excitation: 540/35; émission: 590/20) à l'aide d'un spectrophotomètre.
- Calculer la réduction de pour cent sous forme de rapport d'intensités de fluorescence normalisée par l'intensité de fluorescence (FI) générés par le moyen de résazurine oxydé (ORM, ou la résazurine solution de travail non exposé à des cellules) ou la réduit résazurine moyen (MRR, ou à l'autoclave la solution de travail):% réduction = 100 x {[FI (solution de résazurine conditionné) - FI (ORM)] / [FI (RRM) - FI (ORM)]}. Pour normaliser les résultats, multiplier% de réduction en faisant circuler volume (10 ml) et diviser par temps d'incubation (1 h).
Résultats
Reins séquentiellement perfusés avec de l'eau et des solutions diluées de détergent (1% de Triton X-100, 0,1% de SDS) selon un protocole de décellularisation optimale précédemment établie (voir Figure 1A, B) 7, deviennent progressivement plus transparente sur une période de 26 heures, comme représenté sur la figure 2A. Le rein échafaudage acellulaire résultante est dépourvue de cellules et conserve une ECM rénale cohérent soutenu par une capsule rénale est intacte, ce qui est en bon état en suivant le protocole de perfusion. Par le détergent finale perfusion (SDS), le réseau vasculaire du rein, et en particulier les vaisseaux interlobaires, sont mis en évidence dans l'échafaudage décellularisé, en raison de la plus grande épaisseur de ces vaisseaux sanguins par rapport à la membrane basale relativement mince des tubules du néphron ( voir la figure 2A, B). L'organe entier est effacé des cellules natives, laissant derrière intact réseau de la membrane basale des glomérules, tubules et collecte conduits, et l'ECM des vaisseaux sanguins décellularisés, y compris lames élastiques interne et externe des artères interlobulaires corticales (voir Figure 2B, C). En plus des grands navires, les membranes microvasculaire du sous-sol dans les glomérules conservent également l'intégrité structurelle (voir Figure 2B, C).
Décellularisé reins sont stockés dans du PBS à 4 ° C pour limiter la dégradation hydrolytique de la MEC naturel rénale, et doivent être utilisés dans les 2 semaines de décellularisation. Nous avons déjà décrit en détail la conception d'un bioréacteur à base de perfusion rénale personnalisé qui est utilisé pour les deux semis décellularisé échafaudages rongeurs rénaux, et de la culture à long terme des organes recellularized sous flux 17. Pour recellularization, un circuit de perfusion composé de caoutchouc de silicone de faible diamètre et le tube de la pompe à PharMed résistante à l'usure est utilisé dans un milieu de culture de l'itinéraire à partir du réservoir de bioréacteur, à une pompe péristaltique, etRetour à l'entrée Luer accepteur à laquelle l'artère rénale cathétérisé est relié à la face interne de la tête de bioréacteur (voir figure 1C). Après stérilisation du rein décellularisé par perfusion avec un mélange acide / éthanol peracétique, le système de perfusion est préparée pour l'ensemencement en faisant circuler un milieu de culture standard (contenant 10% de FBS à améliorer l'adhérence cellule-ECM) à travers l'échafaudage à l'intérieur de l'incubateur.
Les reins décellularisés peuvent maintenant servir de modèles ECM comme acellulaire pour recellularization, dont nous avons déjà effectuées en utilisant des cellules dérivées de cellules souches pluripotentes induites endothéliales de revascularisation 7. Ici, nous démontrons l'utilité de ce système de bioréacteur échafaudage et la perfusion pour tubulogenèse utilisant épithéliales tubulaire (RCTE) cellules corticales rénales d'origine humaine. RCTE cellules sont ensemencées dans des échafaudages de rein à travers l'artère rénale sous un protocole de perfusion à haute pression qui a été décrit précédemment 7, 17 .RCTE cellules infusées de cette manière domicile principalement dans les régions du cortex du rein, où l'on repeupler préférentiellement les tubules périglomérulaire (voir la figure 3A). Peu de cellules intégrer au sein de glomérules au jour 1 post-semis, et le jour 7, les glomérules sont pratiquement dépourvu de cellules. Au cours de la culture de perfusion, milieu est changé tous les 2 jours, à quel point le test de perfusion de résazurine est effectuée simultanément pour fournir des évaluations comparatives de la viabilité des cellules au cours du temps (voir la figure 3B). Comme soutenu par les résultats de réduction de la résazurine, cellules RCTE prolifèrent dans le ECM 3D, formant bien organisés, des structures tubulaires de brevet par jour 7. Alors que la majorité de ces cellules occupent les régions corticales de l'ECM rénale, après 7 jours de culture antérograde de perfusion de nombreux tubules RCTE bordée sont présents dans la médullaire externe et tubules papillaires et canaux collecteurs (voir Figure 4). Après le repeuplement avec des cellules RCTE et une semaine de parla culture de la fusion, la transparence observée après décellularisation est perdue, et le rein recellularized apparaît opaque et plus proche en apparence à son état natif (voir Figure 4).

Figure 1:. Rein Système Décellularisation et du Protocole et Recellularization Perfusion Circuit (A) Perfusion calendrier des réactifs pour décellularisation de reins de rongeurs. Les réactifs utilisés pour la décellularisation, le débit volumétrique, et la durée de chaque étape sont présentés. (B) perfusion décellularisation set-up. Les solutions sont pompées de manière unidirectionnelle à partir d'un réservoir de réactif dans un récipient de collecte de perfusion à travers les conduites d'écoulement individuelles pour chaque rein subissant décellularisation. Jusqu'à quatre reins peuvent être décellularisé par pompe péristaltique. Circuit (C) Perfusion for ensemencement et la culture des échafaudages rénaux recellularized. Les cellules sont chargées par l'intermédiaire d'une seringue connectée directement en amont de l'entrée accepteur Luer. Capteurs en ligne en option pour contrôler la pression, oxygène dissous (OD 2), et le pH peuvent être placés en amont du bioréacteur. La pompe péristaltique numérique peut être contrôlée par ordinateur, et la pression négative (vide partiel) peut être appliqué pour faciliter l'ensemencement urétérale. (D) Les composants utilisés pour créer des lignes de perfusion de décellularisation (B) et recellularization (C). (A) fiche mâle Luer, (b) bouchon luer femelle, (c) verrouillage Luer mâle à 1/8 "adaptateur cannelé, (d) luer femelle à l'adaptateur luer femelle, (e) ¼" tuyau ID de silicone, (f) les tubes de pompe péristaltique, g: à paroi épaisse 1/16 "ID tube en caoutchouc de silicone, (h) 1/16" ID tube en caoutchouc de silicone, (i) robinet à trois voies, (j) de couplage utilisé pour connecter les segments de tubes en combinant deux 1/8 "barbe à des adaptateurs de luer mâle (c) en utilisant unluer femelle pour coupleur luer femelle (d). S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.

Figure 2:. Les résultats représentatifs de rein Décellularisation brute représentant et images microscopiques sont présentés des reins avant et après décellularisation. (A) des séries chronologiques de déchéance d'un rein subir décellularisation. Les images sont portées immédiatement après perfusion avec chaque réactif spécifié. Suite à la perfusion de 0,1% de SDS (dodécylsulfate de sodium), le réseau vasculaire est conservé visible. (B) des images représentatives de rein natif ou décellularisées sectionnés et colorés avec de l'hématoxyline et de l'éosine (H & E). L'architecture ECM de fonctions, y compris la microstructure glomérules, les canaux collecteurs, Et les vaisseaux sanguins, est bien conservé suivante décellularisation. Les photographies (C) d'électrons Numérisation comparant les glomérules et les tubules en natif (rangée du haut) et décellularisée (rangée du bas) reins. Après l'élimination de la cellule, tubules ouverts sont répandus dans le rein. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3: Résultats. Représentant de Human cortex rénal tubulaire épithéliale Recellularization de décellularisée Rat Reins Les reins sont recellularized travers un antérograde artérielle technique de perfusion à haute pression qui se traduit par l'adhésion cellulaire RCTE principalement pour les tubules rénaux du cortex. (A) représentatifs des images à fort grossissement (20x) de l'hématoxyline et de l'éosine histo-tachésections giques d'échafaudages recellularized 1, 3 ou 7 jours après l'ensemencement. Rangée du haut montre que les cellules occupent l'espace tubulaire periglomerular en dépit d'être injecté dans le système vasculaire artériel, indiquant leur préférence pour la première niche ECM rénale. Flèche pointe jaunes à une artériole afférente avec une lumière qui est dépourvu de cellules. Rangée du bas montre tubules corticaux où les cellules prolifèrent RCTE, avec l'augmentation de la densité des cellules sur une semaine, et forment des structures épithéliales tubulaires serrées. (B) Une petite (10 ml) volume de milieu de culture résazurine-complété est remis en circulation par les reins au moment des changements de médias. Au cours de 60 min de perfusion, les cellules à réduire le composé oxydé de la résazurine (bleu) de résorufine (rouge), qui produit un signal très fluorescent proportionnellement au nombre de cellules dans le rein. Conformément à l'augmentation observée de la densité cellulaire vu dans les images histologiques, la réduction de la résazurine pour cent de culture augmente avec time avec la croissance de la cellule, fournissant une indication de non-invasive la fois la viabilité et la prolifération cellulaire au cours de la culture de la maintenance. Les résultats sont présentés en moyenne ± écart type (n = 4 reins recellularized). S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
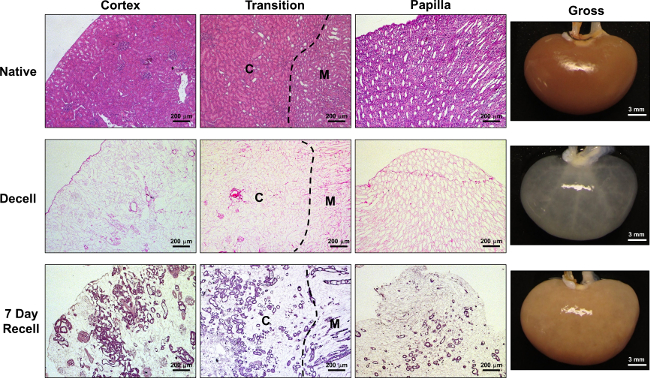
. Figure 4: Les résultats représentatifs: Comparaison de Native, décellularisée et Recellularized reins faible grossissement des images histologiques montrent le cortex rénal, zone de transition entre le cortex et médullaire externe, et les régions de la papille médullaires dans les reins natifs (rangée du haut), décellularisé (Decell; rangée du milieu), et 7 jours CRTE-recellularized (7 jours Recell; bas rangée) échafaudages. La ligne pointillée indique la limite approximative entre le cortex rénal (C) et médullaire externe (M). Images brutes montrent un rein dans son état natif après l'obtention, après décellularisation, et 7 jours après l'ensemencement des cellules RCTE à travers l'artère rénale. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Le protocole de décellularisation décrit un produit toujours ECM rénale complètement acellulaire qui sert de modèle 3D pour la culture de cellules humaines épithéliales tubulaires rénales corticales (à la fois proximale et distale tubules dérivés), en plus des cellules endotheliales vasculaires 7,17. Le système vasculaire rénale canule sert l'élément clé pour la livraison uniforme des réactifs et des cellules à travers l'échafaud dans un bioréacteur mis en place, permettant ainsi aux perfusion décellularisation, ensemencement cellulaire, culture de perfusion à long terme, et de la résazurine protocoles de perfusion. En tant que tel, approprié canulation de l'artère rénale avant la perfusion des organes est critique, et des précautions particulières doivent être prises pour assurer que l'artère rénale soit pas obstrué ou endommagé, et en ce que le cathéter est fixé. Les rats Sprague-Dawley à partir de laquelle les reins sont récupérés doivent être systémique héparinés pour éviter la coagulation dans le système vasculaire pendant le prélèvement d'organes, comme des caillots intravasculaires peuvent pas be retirée, et peut inhiber la décellularisation complet du rein.
Le bioréacteur de perfusion utilisé pour l'ensemencement et la perfusion culture de reins recellularized est conçu pour permettre de multiples méthodes d'ensemencement in situ 17. En plus de la technique d'injection artérielle décrit ici, les cellules peuvent être injectées rétrograde à travers l'uretère ou cathétérisé la veine rénale. En outre, le corps du bioréacteur est équipé d'une soupape qui permet l'application d'une pression négative (vide partiel; voir la figure 1C), pour urétéral ensemencement. Quelle que soit la stratégie d'ensemencement utilisée, la perfusion de milieu de culture antérograde dans l'artère rénale est critique pour nutritif adéquat (par exemple l'oxygène, le glucose) suivant de cellules ensemencées.
Le protocole décrit recellularization démontre notre utilisation de matrices rénales décellularisés pour servir comme modèles spécifiquement pour tubulogenèse épithéliale. Cependant, nous avons déjà shpropre que la matrice rénale supporte également re-endothélialisation du réseau vasculaire retenu et peut être revêtu avec des cellules dérivées de cellules souches pluripotentes humaines induites endotheliales, ce qui est une observation importante pour une éventuelle transplantation à long terme des reins recellularized dans des modèles animaux en empêchant thrombotique occlusion du système vasculaire rénal 7. Un obstacle courant à l'éventuelle mise à l'échelle de protocoles de recellularization rénaux pour échafaudages rénaux grande animales est sensiblement le plus grand nombre de cellules nécessaires pour repeupler échafaudages de rein humain de taille. Stratégies efficaces de semis, telles que la technique d'injection artérielle à haute pression décrit ci-dessus, sont absolument nécessaires pour maximiser le nombre de cellules qui se greffer à l'intérieur de l'ECM décellularisé. Compte tenu de la composition cellulaire hétérogène du rein natif, de multiples méthodes de semis peuvent finalement être nécessaires pour repeupler efficacement les diverses niches rénales extracellulaires avec divers types de cellules qui Collecment exécuter les nombreuses fonctions du rein, y compris la filtration, la résorption, la concentration de l'urine, et la synthèse de l'hormone.
Enfin, le dosage résazurine de perfusion démontré dans cet article fournit une évaluation non invasive, non-toxique de la viabilité et la prolifération cellulaire pendant la culture à long terme 7,17,18. Le test fournit une rétroaction instantanée sur l'état métabolique des cellules en croissance dans les échafaudages de rein, et quand régulièrement effectué entre les échanges périodiques moyennes, peut être utilisée pour caractériser la prolifération cellulaire dans le temps. Le réactif de résazurine est peu coûteux, le dosage nécessite peu de temps pour effectuer (1 h), et il est une méthode d'analyse plus conservatrice pour caractériser la prolifération cellulaire ou du métabolisme des tendances par rapport à une évaluation histologique, ce qui nécessite sacrifice borne de l'échafaudage recellularized. Le dosage de la résazurine perfusion peut également être adapté pour l'évaluation des populations de cellules en cours de croissance à l'intérieur de l'autre receorganes ou tissus llularized.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The authors thank the support of the Zell Family Foundation. We recognize support from the Northwestern Memorial Foundation Dixon Translational Research Grants Initiative, the American Society of Transplant Surgeon’s Faculty Development Grant, and a Research Grant for the Young Investigator from the National Kidney Foundation of Illinois. We acknowledge support from the Robert R. McCormick Foundation. This work was also supported by NIDDK K08 DK10175 to J.A.W. Imaging and histology cores used for this research is supported by the Mouse Histology and Phenotyping Laboratory, Electron Probe Instrumentation Center (EPIC), and Simpson Querrey Institute Equipment Core at Northwestern University, and a Cancer Center Support Grant (NCI CA060553). The authors would like to acknowledge the Northwestern University Microsurgery Core for rodent kidney procurements. Evaluation of renal tubular epithelia morphology following recellularization conducted in the Fluorescence Microscopy Shared Resource supported by P30 CA118100.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| TRITON X-100, Proteomics Grade, AMRESCO | VWR | M143-4L | |
| Sodium dodecyl sulfate solution, BioUltra, for molecular biology, 20% in H2O | Sigma-Aldrich | 05030 | |
| Peracetic acid solution, purum, ~ 39% in acetic acid (RT) | Sigma-Aldrich | 77240 | Peracetic is flammable and corrosive. Prepare within a fume hood using appropriate personal protective equipment (e.g. gloves, goggles). |
| 200 proof ethanol | VWR | V1001TP | |
| Sigmacote, siliconizing reagent for glass and other surfaces | Sigma-Aldrich | SL2 | For treatment of bioreactor reservoirs. Referred to in text as siliconizing reagent. |
| DMEM/F12 media | Life Technologies | 11320-033 | |
| Corning cellgro Fetal Bovine Serum Premium, Mediatech | Corning | 35-010-CV | |
| Penicillin-Streptomycin Solution, 100X 10,000 I.U. Penicillin 10,000 µg/mL Streptomycin | Corning | 30-002-CI | |
| TrypLE Express (1X), Phenol Red | Life Technologies | 12605-028 | Referred to in text as cell dissociating enzyme. |
| Trypan Blue Stain (0.4%) | Life Technologies | 15250-061 | |
| Resazurin sodium salt | Sigma-Aldrich | R7017 | |
| Equipment: | |||
| Masterflex L/S Digital Drive, 600 RPM, 115/230 VAC | Cole-Parmer | EW-07522-20 | |
| Masterflex L/S large cartridges for 07519-05 and -06 pump heads. | Cole-Parmer | EW-07519-70 | Referred to in text as large pump cartridge. |
| Masterflex L/S 8-channel, 4-roller cartridge pump head. | Cole-Parmer | EW-07519-06 | |
| Straight 6" specimen forceps, serrated | VWR | 82027-438 | |
| *Kidney perfusion bioreactor | WilMad Labglass | *Custom designs | Bioreactors are produced as described by WilMad Labglass. The designs have been described in depth in a previous publication. |
| Perfusion Circuit Components | |||
| 24 G x 0.75 in. BD Insyte Autoguard shielded IV catheter (0.7 mm x 19 mm) made of BD Vialon biomaterial. Has notched needle. (50/sp, 200/ca) | BD Biosciences | 381412 | Referred to in text as 24 gauge catheter. |
| Masterflex PharMed BPT Tubing, L/S #14, 25' | Cole-Parmer | HV-06508-14 | Referred to in text as peristaltic pump tubing. |
| Peroxide-Cured Silicone Tubing, 1/16" ID X 1/8" OD, 25 ft/pack | Cole-Parmer | HV-06411-62 | Referred to in text as 1/16" ID silicone rubber tubing. |
| Masterflex platinum-cured silicone tubing, L/S 14, 25 ft. | Cole-Parmer | HV-96410-14 | Referred to in text as thick-walled 1/16" ID silicone rubber tubing. |
| VWR Silicone Tubing, 1/4" ID x 0.5" OD | VWR | 89068-484 | |
| Acro 50 Vent Filters, Pall Life Sciences | VWR | 28143-558 | Referred to in text as 0.2 micron vent filter. |
| Cole-Parmer Luer Adapters, Male Luer Lock to 1/8" ID, Nylon, 25/pk | Cole-Parmer | T-45505-11 | Referred to in text as male Luer lock to 1/8" barbed adapter. |
| Cole-Parmer Luer Accessory, Male Luer Plug, Nylon, 25/pk | Cole-Parmer | EW-45505-58 | |
| Female luer x female luer adapter, Nylon, 25/pk | Cole-Parmer | EW-45502-22 | Referred to in text as female Luer x female Luer adapter. |
| Cole-Parmer Luer Accessory, Female Luer Cap, Nylon, 25/pk | Cole-Parmer | EW-45502-28 | |
| Smiths Medical Large Bore Hi-Flo Stopcocks # MX4311L - 3-Way Hi-Flo Stopcock with Extended Male Luer Lock, Non-DEHP Formulation, Latex Free (LF), Lipid Resistant, Non-PVD, 50/cs | Careforde Healthcare | 10254821 | Smiths Medical (vendor) catalogue number is #MX4311L. |
| Other Components | |||
| 5 ml BD Luer-Lok disposable syringe with BD Luer-Lok™ tip. | BD Biosciences | 309646 | |
| 35 mm x 10 mm Easy Grip Culture Dish | BD Biosciences | 353001 | Used to draw cell suspension into syringe for cell seeding. |
Références
- Uzarski, J. S., Xia, Y., Belmonte, J. C., Wertheim, J. A. New strategies in kidney regeneration and tissue engineering. Current opinion in nephrology and hypertension. 23, 399-405 (2014).
- Soto-Gutierrez, A., Wertheim, J. A., Ott, H. C., Gilbert, T. W. Perspectives on whole-organ assembly: moving toward transplantation on demand. J Clin Invest. 122, 3817-3823 (2012).
- Badylak, S. F. Decellularized allogeneic and xenogeneic tissue as a bioscaffold for regenerative medicine: factors that influence the host response. Ann Biomed Eng. 42, 1517-1527 (2014).
- Miner, J. H. Renal basement membrane components. Kidney Int. 56, 2016-2024 (1999).
- Nichol, J. W., Khademhosseini, A. Modular Tissue Engineering: Engineering Biological Tissues from the Bottom Up. Soft matter. 5, 1312-1319 (2009).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nat Med. 14, 213-221 (2008).
- Caralt, M., et al. Optimization and critical evaluation of decellularization strategies to develop renal extracellular matrix scaffolds as biological templates for organ engineering and transplantation. American Journal of Transplantation. 15, 64-75 (2015).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: decellularization and recellularization of three-dimensional matrix scaffolds. Annu Rev Biomed Eng. 13, 27-53 (2011).
- Orlando, G., et al. Discarded human kidneys as a source of ECM scaffold for kidney regeneration technologies. Biomaterials. 34, 5915-5925 (2013).
- Sullivan, D. C., et al. Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials. 33, 7756-7764 (2012).
- Vishwakarma, S. K., et al. Preparation of natural three-dimensional goat kidney scaffold for the development of bioartificial organ. Indian journal of nephrology. 24, 372-375 (2014).
- Ross, E. A., et al. Embryonic stem cells proliferate and differentiate when seeded into kidney scaffolds. J Am Soc Nephrol. 20, 2338-2347 (2009).
- Song, J. J., et al. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nat Med. 19, 646-651 (2013).
- Bonandrini, B., et al. Recellularization of well-preserved acellular kidney scaffold using embryonic stem cells. Tissue Eng Part A. 20, 1486-1498 (2014).
- Burgkart, R., et al. Decellularized kidney matrix for perfused bone engineering. Tissue Eng Part C Methods.2. 20, 553-561 (2014).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8, 49-55 (2012).
- Uzarski, J. S., et al. Dual-purpose bioreactors to monitor non-invasive physical and biochemical markers of kidney and liver scaffold recellularization. Tissue Eng Part C Methods. , (2015).
- Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European journal of biochemistry / FEBS. 267, 5421-5426 (2000).
- Loghman-Adham, M., Nauli, S. M., Soto, C. E., Kariuki, B., Zhou, J. Immortalized epithelial cells from human autosomal dominant polycystic kidney cysts. American journal of physiology. Renal physiology. 285, F397-F412 (2003).
Erratum
Formal Correction: Erratum: Epithelial Cell Repopulation and Preparation of Rodent Extracellular Matrix Scaffolds for Renal Tissue Development
Posted by JoVE Editors on 3/03/2017. Citeable Link.
An erratum was issued for Epithelial Cell Repopulation and Preparation of Rodent Extracellular Matrix Scaffolds for Renal Tissue Development.
The human RCTEC/RCTE cell stocks used here and in Caralt et al., 2015, Uzarski et al., 2015 were originally provided by Dr. Loghman-Adham (then at St. Louis University) to co-author Dr. Wandinger-Ness (University of New Mexico) through an MTA in 2001. The SV40 immortalized human RCTEC/RCTE cells were characterized as being of distal tubule cell line as detailed in Loghman-Adham et al., 2003. On the basis of recent short tandem repeat (STR) DNA sequencing (Performed by IDEXX BioResearch) of the earliest passages of the RCTEC/RCTE cell stocks it became evident the cells were of mixed lineage. Further analyses of PCR products using QIAxcel capillary electrophoresis demonstrated the presence of a canine product. The product was sequenced and established to be of canine origin. A set of canine specific STR markers were compared to the sample and showed that the sample had a genetic profile with 92% identity to the MDCK cell line. Later cell stocks that were used in the present publication were STR profiled and showed drift to 100% MDCK lineage. Despite being of canine origin, rather than human as was previously thought, MDCK is similarly a distal tubule epithelial cell line. For this reason, previous interpretation and conclusions drawn using these cells here and in Caralt et al., 2015, Uzarski et al., 2015 remain sound, but for purposes of rigor, reproducibility and experimental validation by others we report on this misidentification. This information will also be reported for listing on the International Cell Line Authentication Committee (ICLAC) database (http://iclac.org).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon