Method Article
Surveillance en temps réel des interactions ligand-récepteur avec Fluorescence Resonance Energy Transfer
Dans cet article
Résumé
On démontre FRET entre le polymère conjugué polydiacétylène (PDA) et un fluorophore attaché à la surface des liposomes PDA pour la détection de biomolécules. Liposomes PDA contient également des molécules réceptrices sur leurs surfaces de biomolécules à être utilisées en tant que sondes. Interactions ligand-récepteur entraîner des changements dans l'efficacité de FRET entre le fluorophore et PDA qui est la base du mécanisme de détection.
Résumé
FRET est un processus par lequel l'énergie est non-radiative transféré d'une molécule donneur excité à une molécule accepteur de l'état fondamental par le biais longue portée interactions dipôle-dipôle 1. Dans le présent essai de détection, nous utilisons une propriété intéressante de PDA: bleu-décalage du spectre d'absorption UV-Vis électronique de PDA (figure 1) après un analyte interagit avec les récepteurs attachés aux PDA 2,3,4,7. Ce changement dans le spectre d'absorption PDA prévoit des changements dans le recouvrement spectral (J) entre PDA (accepteur) et la rhodamine (bailleurs de fonds) qui conduit à des changements dans l'efficacité de FRET. Ainsi, les interactions entre l'analyte (ligand) et les récepteurs sont détectés par FRET entre fluorophores donneurs et les PDA. En particulier, nous montrons la détection d'une molécule de streptavidine protéine modèle. Nous démontrons également la liaison covalente d'albumine sérique bovine (BSA) à la surface du liposome avec mécanisme de FRET. Ces interactions entre til liposomes bicouches et des molécules protéiques peuvent être détectés en temps réel. La méthode proposée est une méthode générale de détection chimique petites et grandes molécules biochimiques. Depuis la fluorescence est intrinsèquement plus sensibles que la colorimétrie, la limite de détection du test peut être en Afrique sub-nanomolaire plage ou moins 8. En outre, un PDA peut agir comme un accepteur de FRET universel, ce qui signifie que plusieurs capteurs peuvent être mis au point avec un PDA (accepteur) fonctionnalisé avec donneurs et des récepteurs différents attachés à la surface des liposomes PDA.
Protocole
A. Synthèse et caractérisation de liposomes PDA 4,5,6
Note 1: Protéger la solution PDA de la lumière à l'aide d'emballage papier d'aluminium sur chaque conteneur à travers toutes les étapes expérimentales.
Note 2: Deux ensembles différents de solution de liposomes (B et C) ont été préparés suivant la procédure A (Synthèse et caractérisation de liposomes PDA).
1. Synthèse de N-hydroxysuccinimide Diacteylene (NHS PCDA)
- Pour préparer des liposomes, un ingrédient essentiel PCDA-NHS est nécessaire. Nous avons synthétisé PCDA-NHS en utilisant la procédure suivante:
- Ajouter l'acide 10,12-pentacosadiynoic (PCDA) (0,267 g, 0,713 mmol), de N-hydroxysuccinimide (0.0914 g, 0,786 mmol) et de 1 - (3 - (diméthylamino) propyl)-3-éthylcarbodiimide (0,144 g, 0,713 mmol ) dans un endroit sec CH 2 Cl 2 (20 ml).
- Agiter la solution à la température ambiante pendant 2 heures.
- Retirez délicatement le solvant à l'aide de révaporateur otarie pour obtenir un film sec mince.
- Utilisez ampoule à décanter pour en extraire le résidu avec de l'éther diéthylique (25 ml) et d'eau (25 ml) trois fois.
- Sécher la couche organique sur MgSO 4 (1,0 g) pendant une demi-heure. Filtrer et éliminer le solvant par évaporation rotative pour obtenir une poudre solide blanc (0,24 g,> 90%).
- Analyser composé final sous la Résonance Magnétique Nucléaire (RMN).
- RMN 1 H (300 MHz, DMSO), δ (ppm): 0.893 (t, 3H), 1,268 (m, 26H), 1,512 (m, 4H), 1,754 (m, 2H), 2,252 (t, 4H), 2,365 (m, 1H), 2,610 (m, 1H), 2,842 (s, 2H).
2. Préparation de liposomes 5,6,7
- Dissoudre PCDA: PCDA-NHS: 1,2-dimyristoyl-sn-glycéro-3-phosphocholine (DMPC) :: 8: 1: 1 dans 20 ml de dichlorométhane.
- Filtrer la solution avec un papier filtre pour éliminer les agrégats.
- Évaporer complètement le solvant pour obtenir un film mince de monomères.
- Sécher la couche mince pendant la nuit sous vacuum.
- Hydrater le film avec de l'eau déminéralisée (50 ml) pour obtenir une solution de liposome de concentration souhaitée (de 0,65 à 1 mM).
- Sonication de la suspension résultante avec un sonicateur à sonde 76 ° C pendant ~ 18 min.
- Soigneusement passer la solution à travers un filtre en papier pour enlever les agrégats lipidiques
- Refroidir la solution à 4 ° C pendant la nuit afin de promouvoir l'auto-assemblage des monomères. La solution finale doit être optiquement clair.
- Polymériser les monomères de diacétylène auto-assemblées (liposomes) par irradiation avec de 254 nm du rayonnement UV pour ~ 2 min à l'aide d'une source UV Pen Ray (4,5 mW / cm 2) dans l'air.
- La solution de liposome est stable à température ambiante pendant au moins deux semaines. La solution était plus stable au réfrigérateur.
B. Préparation de la rhodamine taggés albumine sérique bovine (BSA-Rh) du PCDA liposomes modifiés
1. Liaison de BSA-Rh à la surface des liposomes
- Dissoudre BSA dans du PBS-Rh buffer (concentration ionique est 0,01 M, pH 7,2) pour obtenir une concentration finale de 1,2 uM de BSA-Rhodamine solution.
- Ajouter 2 ml (1,2 M) de BSA-Rhodamine à 10 ml de solution de liposomes préparée à l'étape A.2. (Voir ci-dessus) à la température ambiante.
- Réaction classique pour la fixation de groupes d'amines à partir du résidu lysine des protéines à l'acide carboxylique activé par NHS groupe a été suivie (schéma réactionnel de la figure 2). NHS-PCDA a été conçu (figure 2, étape 1) pour covalente des molécules de liaison aux protéines avec des liposomes en utilisant NHS-amine réactions (figure 2, étape 2). NHS est un excellent agent qui entraîne en laissant la réaction de l'acide aminé-carboxylique dans la direction vers l'avant. Le rendement de cette réaction dans les conditions appropriées doivent être quantitatives.
- Suppression des BSA libre-Rh: Imbiber un Spectra / Por Biotech Ester de cellulose (CE) membrane (MW C O: 100.000) en désionisée water pendant 15 min. Cette membrane est utilisée pour la dialyse de BSA-Rhodamine n'ayant pas réagi (poids moléculaire ~ 66000 Da) dans de l'eau désionisée.
- Transférer délicatement la solution dans la membrane de dialyse.
- Changez l'eau à 2 h, 8 h, 14 h, 24 h et 36 h pendant la dialyse.
- Recueillir la solution finale dans un flacon recouvert d'une feuille d'aluminium.
C. Préparation de SR-diamine et la biotine marquée liposomes
1. Au lieu d'utiliser DMPC à l'étape 2.1, nous allons utiliser la biotine marqué-(1,2-dioléoyl-sn-glycéro-3-phosphoéthanolamine-N-(biotinyle) (biotine-DOPE).
- Suivez toutes les étapes par 2,2 à 2,9.
- Au lieu de BSA-Rh dans l'étape B, utilisez Diamine Sulphorhodamine marqué (SR-diamine).
- Suivez toutes les étapes ultérieures de B.
- Des liposomes dans cette préparation contient de la biotine et SR-diamine sur leurs surfaces. Les étapes suivantes sont similaires à A et B (voir ci-dessus) à une exception près: la streptavidine a été ajouté à la solutià enquêter sur les interactions biotine-streptavidine par des changements dans le FRET efficacité.
D. Représentant Résultats
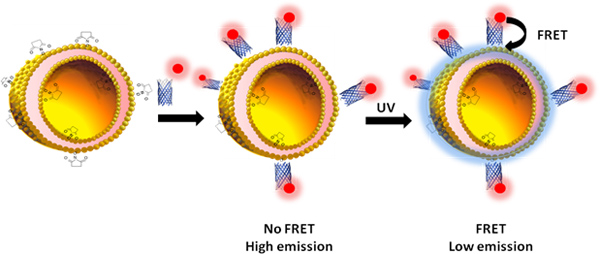
Figure titre. Une bande dessinée expliquant la réaction et FRET processus se produisant à la surface du liposome (préparé en suivant l'étape B).
A. Surveillance de l'attachement des protéines à des liposomes en utilisant une FRET
Suivi de FRET entre la rhodamine et des liposomes PDA préparées à l'étape B.
Spectres d'excitation et d'émission de BSA-Rh et spectre d'absorption de PDA sont prises (figure 3A). Nous pouvons clairement voir que le spectre d'émission de BSA-Rh chevauche le spectre d'absorption de PDA. Ce satisfait à l'exigence de résonance pour le mécanisme de FRET. BSA-rhodamine liposomes marqués avant et après polymérisation ont été analysées avec UV-Vet est la spectroscopie de fluorescence. Pour le donneur et l'accepteur d'isolement, le FRET efficacité dépend fortement donneur-accepteur distance (r) et J 1 (j-value). La trempe à l'émission est observé (figure 3B) du fait de FRET entre la rhodamine et PDA due à l'apparition du spectre d'absorption électronique de PDA bleue après photopolymérisation. Dans notre cas, l'efficacité de FRET est égal à zéro pour les liposomes non polymérisées et Rhodamine parce que J = 0 pour les liposomes polymérisés dans la région visible.
Nous avons effectué des expériences similaires avec seulement liposomes PDA qui ne contiennent pas de NHS sur leur surface. Dans ces cas, BSA-Rh n'a pas été marqué à la surface des liposomes. Dans ce cas, la distance moyenne entre la rhodamine et PDA (r moyenne) était beaucoup plus grande que le rayon Forster (R 0 = 2,8 nm). Ainsi, nous n'avons pas observé une diminution importante de l'intensité de fluorescence. Cette observation also suggère que l'extinction de la fluorescence est dominante lorsque R <2,8 nm.
J et R 0 valeurs ont été calculées à l'aide des formules suivantes: [1]
J (λ) = ∫ F D (λ) ε A (λ) dλ λ 4
R 0 = 0,211 [k 2 n -4 J Q D (λ)] 1/6
Le coefficient d'extinction (ε) de bleu-PDA est dans la gamme de 2000-10000 ~ M -1 cm -1, avant l'addition de la streptavidine. Le coefficient d'extinction du bleu-PDA dépend de l'état photo-polymérisation. [2] Par exemple, les valeurs e sera plus importante pour une solution qui a été polymérisé un temps plus long. En outre, l'auto-assemblage des monomères de diacétylène peut également affecter les valeurs de e. Le calcul Jtions tenir compte de ces changements, et ils reflètent les changements dans les coefficients d'extinction PDA en raison de la biotine-streptavidine interactions moléculaires. valeurs de J sont calculées en utilisant l'absorption PDA expérimentale et RS-101 données sur les émissions. Les changements dans les valeurs de J sont dus à passer dans le spectre d'absorption électronique de PDA suite à l'ajout de la streptavidine à la solution (figure 4C). L'unité de valeurs de J est M -1 cm -1 nm 4.
B. Suivi de FRET avec addition de streptavidine à la biotine marqué avec solution de liposomes
Note 1: Suivi de FRET entre la rhodamine et des liposomes préparés PDA à l'étape C ci-dessus.
Spectres d'excitation et d'émission de Sulphorhodamine-étiqueté diamine (SR-diamine) et spectre d'absorption de PDA sont prises (figure 4A). Liposomes non polymérisées et polymérisé biotine marqués ont été analysées à l'aide UV-Viset la spectroscopie de fluorescence. L'émission de la rhodamine (SR-101) est diminuée d'environ 45% après polymérisation (figure 4B), suggérant une trempe d'émission en raison de FRET. Ajouter 40 aliquotes (1 uM) de solution de streptavidine à 2 ml de solution de liposomes. Avec l'addition de streptavidine à la solution, les variations de valeur de J est observé (figure 4C). Que la biotine se lie à la streptavidine, l'intensité du pic de bleu PDA liposome (centré à ~ 645 nm sur la figure 1) est diminuée tandis que l'augmentation du pic d'absorption à 540 nm est observée (F igure 1S). Figure 4D montre les changements du FRET efficacité. L'efficacité de FRET diminué avec l'augmentation de la concentration de streptavidine est également compatible avec notre prédiction.
Enregistrer l'émission SR après chaque aliquote outre, 40 ul de streptavidine. Nous avons observé une augmentation constante de l'émission de rhodamine après l'ajout de streptavidine (Figure 5). Cette augmentation de l'émission de rhodamine est dû à une diminution de la valeur de J pour le spectre d'émission et de sulforhodamine spectre d'absorbance après PDA biotine-streptavidine interactions. Au niveau moléculaire, les interactions biotine-streptavidine conduire à de subtils changements dans la longueur de conjugaison efficace de l'ANP qui se traduit par une diminution de la forme bleu-PDA à un plus stable thermodynamiquement rouge-PDA forme 2. C'est la base de l'évolution des valeurs de J. Fait intéressant, les différences subtiles dans les interactions moléculaires pour la biotine liée de façon covalente ou non covalente à des liposomes PDA peuvent être sondés à l'aide de notre test de détection 4.
Nous avons également réalisé des expériences de contrôle et de surveillance ont l'émission des échantillons de contrôle dans les mêmes conditions expérimentales que celles pour la streptavidine-biotine système. Les expériences de contrôle se composent de: (1) des solutions de liposomes qui contiennent la biotine sur leursurface a été ajoutée une solution tampon de même volume et de concentration, et (2) sans solution de liposomes récepteurs de biotine à leur surface ont été ajoutés streptavidine de même volume et de concentration. L'intensité de la solution de biotine-liposome marqué après l'addition de streptavidine a montré l'intensité accrue, mais l'intensité de la solution de liposomes des expériences de contrôle (par exemple, s'il vous plaît voir Figure 2S), d'autre part, a montré une diminution de l'intensité des émissions. Ceci est attribué à la dilution de la solution. Ces expériences indiquent clairement que l'émission accrue de la solution est due à des interactions spécifiques moléculaires.
Forster rayon (R 0) de la paire rhodamine et PDA est calculée (équation 2) pour ~ 2,80 nm. Cela signifie que, pour isolés PDA-rhodamine paires, 50% des molécules excitées rhodamine état auront leur énergie transféré au PDA lorsque r est égal à 2,80 nm.
Nous obs erved que lorsque la biotine est liée de manière covalente au squelette de PDA, l'augmentation des émissions est 2-3 fois supérieure à celle des non-covalente biotine lié à des liposomes. 4 Ces résultats suggèrent fortement que notre système proposé est sensible à distinguer les différences subtiles dans les interactions au niveau du transducteur (liaison entre la biotine et bicouche du liposome) en raison de façon covalente et non covalente récepteurs liés attachés à des liposomes. Selon les capacités d'acquisition de numérisation et de données du spectrophotomètre, suivi en temps réel (en milliseconde deuxième échelle de temps) des interactions protéiques (dans la spectroscopie UV-Vis) sont possibles avec ce système de détection.
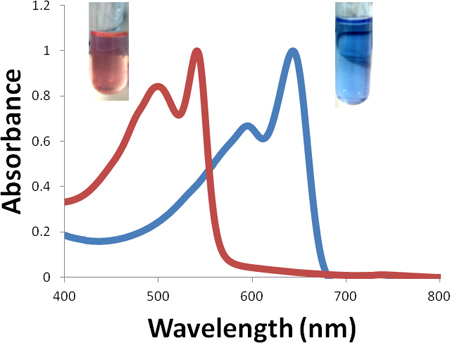
Les spectres d'absorption Figure 1. D'bleues et rouges solutions pour PDA. (Encadré) micrographies optiques prises avec un appareil photo numérique.
g "/>
Figure 2. Schéma réactionnel pour la synthèse PCDA-NHS (étape 1). Réaction du PCDA-NHS au substituant amine des protéines (étape 2). L'étape 2 est la base de la liaison du résidu lysine des protéines à l'acide carboxylique monomère du PCDA. Cliquez ici pour agrandir la figure .

La figure 3A. Changement dans l'efficacité de FRET observée est due aux changements dans le spectre d'absorption du PDA. Avant de polymérisation n'y a pas de chevauchement entre les BSA-Rh émission et d'absorption PDA mais après polymérisation chevauchements d'absorption PDA avec BSA-Rh émission qui est l'exigence de FRET. Rhodamine est un donateur (rouge) et des liposomes polymérisés PDA agir comme accepteur (bleu).

Figure3B. Spectres de fluorescence de BSA-Rh liposomes marqués avant (bleu) et après polymérisation PCDA (rouge). Une forte diminution de l'émission de la rhodamine a été observée en raison de FRET entre la rhodamine et PDA.

.. Figure 4A chevauchement spectral (J) de changement de spectre d'absorption PDA (bleu ou rouge) et spectre d'émission Sulphorhodamine (orange) Figure 4A est le spectre représentatif de conditions extrêmes, c'est-à-dire lorsque un excès de streptavidine a été ajouté à la solution. La figure 4A montre une quasi-bleu-rouge à la suite de la transformation PDA addition d'un excès de streptavidine. On voit clairement que J (chevauchement spectral) augmente avec le bleu-décalage du spectre d'absorption PDA

La figure 4B. Spectres de fluorescence avant (bleu) et après (red) polymérisation liposome.

Etat de la figure 4C pour FRET: J. Changement entre le donneur (sulforhodamine) et accepteur (PDA) avec l'addition de streptavidine à la solution de liposomes.
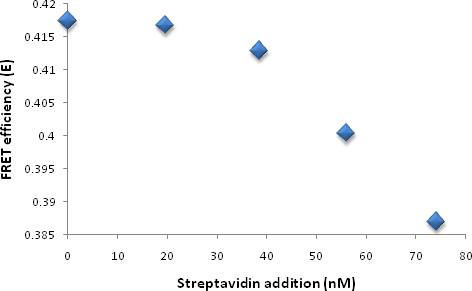
La figure 4D. FRET changement d'efficacité entre le donneur (sulforhodamine) et accepteur (PDA) avec l'addition de streptavidine à la solution de liposomes.

Figure 5. Rhodamine spectre d'émission après l'addition de streptavidine aliquotes de la solution de liposome PDA. Encart montre une vue agrandie de l'évolution des émissions dans les spectres SR-101.
Discussion
Nous avons effectué la liaison sélective des résidus lysine de la protéine à la surface des liposomes en utilisant NHS-amine réaction. Cette méthode basée sur FRET est capable de faire le suivi en temps réel de la biotine-streptavidine et de protéines (BSA) se liant à la surface du liposome. Procédure similaire peut être appliquée à l'étude de la dynamique de liaison des interactions entre protéines différentes avec leurs récepteurs sélectifs. Il est souplesse dans le choix des fluorophores qui fourniront des changements dans les valeurs de J en fonction des caractéristiques spectrales des fluorophores. PDA est un accepteur universel. Ainsi, l'utilisation de PDA (accepteur), ainsi que plusieurs fluorophores et des récepteurs soulève la possibilité de nous fournir de multiples capteurs. La sensibilité de nos capteurs est sous-nanomolaire et à l'optimisation, il peut encore être améliorée. La spécificité des sondes est réglé par l'utilisation d'interactions moléculaires entre des récepteurs et des ligands. Ces capteurs peuvent aussi être utilisés pour des particules plus grosses sne telle que les virus et les bactéries.
Nous avons également été en mesure de recueillir des informations précieuses comme la distance entre le donneur-accepteur, FRET efficacité et J-valeur, etc La distance entre le donneur et l'accepteur est calculée à 2,8 nm. Cela était conforme à nos prévisions. Comme il ya un grand besoin de la surveillance des virus insidieux, les bactéries et autres micro-organismes nuisibles, nous souhaitons fabriquer un dispositif portatif qui peut effectuer en temps réel de détection de biomolécules dangereux.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Le soutien financier pour ce travail a été fournie par la National Science Foundation, le National Institute of Health (NIH), la technologie des matériaux Center (MTC) et l'ORDA à SIUC. Nous remercions la NSF pour une subvention (CHE-0959568) pour l'achat d'un FE-SEM. Nous tenons à remercier le professeur Matthew McCarroll pour des discussions utiles. Julia Reyes tiens à remercier COLCIENCIAS, Agence colombienne et l'Universidad Pedagogica y Tecnológica de la Colombie pour son érudition et de soutien financier.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| 10,12-pentacosadiynoic acide (PCDA) | Produits chimiques GFS | 3261 | Sensible à la lumière |
| N-hydroxysuccinimide (NHS) | Acros Organics | 157270250 | Sensible à l'humidité |
| 1 - (3 - (diméthylamino) propyl)-3-éthylcarbodiimide (EDC) | Chem-Impex International | 00050 | |
| 1,2-dimyristoyl-sn-glycéro-3-phosphocholine (DMPC) | Lipides Avanti Polar | 850345P | |
| Rhodamine-étiqueté Ser bovineeuh albumine (BSA-Rh) | Sigma Aldrich | A4537 | |
| (1,2-dioléoyl-sn-glycéro-3-phosphoéthanolamine-N-(biotinyl) (biotine-DOPE) | Lipides Avanti Polar | 870282 |
Références
- Lakowicz, J. R. . Principles of Fluorescence Spectroscopy. , (1999).
- Charych, D. H., Nagy, J. O., Spevak, W., Bednarski, M. D. Direct Colorimetric Detection of a Receptor-Ligand Interaction by a Polymerized Bilayer Assembly. Science. 261, 585-588 (1993).
- Yoon, B., Lee, S., Kim, J. -. M. Recent Conceptual and Technological Advances in Polydiacetylene-based Supramolecular Chemosensors. Chem. Soc. Rev. 38, 1958-1968 (2009).
- Xuelian, L. i., Kohli, P. u. n. i. t. Investigating Molecular Interactions in Biosensors Based on Fluorescence Resonance Energy Transfer. J. Phys. Chem. C. 114, 6255-6264 (2010).
- Li, X., Matthews, S., Kohli, P. Fluorescence Resonance Energy Transfer in Polydiacetylene Liposomes. J. Phys. Chem. B. 112, 13263-13272 (2008).
- Li, X., McCarroll, M., Kohli, P. Modulating Fluorescence Resonance Energy Transfer in Conjugated Liposomes. Langmuir. 22, (2006).
- New, R. R. C., New, R. R. C. . Liposomes: A Practical Approach. , 33-104 (1990).
- Chen, X., Lee, J., Jou, M. J., Kim, J. -. M., Yoon, J. Colorimetric and Fluorometric Detection of Cationic Surfactants Based on Conjugated Polydiacetylene Supramolecules. Chem. Commun. , 3434-3436 (2009).
- Yarimaga, O., Im, M., Choi, Y. -. K., Kim, T. W., Jung, Y. K., Park, H. G., Lee, S., Kim, J. -. M. A Color Display System Based on Thermochromic Conjugated Polydiacetylene. Macromolecular Research. 18, 404-407 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon