Method Article
Synthèse Submonomer en phase solide de polymères et de leurs peptoïde auto-assemblage dans le hautement ordonné nanofeuillets
Dans cet article
Résumé
Un simple et générale méthode manuelle synthèse peptoïde impliquant l'équipement de base et de réactifs disponibles dans le commerce est présenté, permettant peptoïdes pour être facilement synthétisée dans la plupart des laboratoires. La synthèse, la purification et la caractérisation d'une 36mer peptoïde amphiphile est décrite, ainsi que son auto-assemblage en très ordonnée nanofeuillets.
Résumé
Peptoïdes sont une nouvelle classe de biomimétiques, non naturelles, des séquences spécifiques qui résistent à la protéolyse hétéropolymères, présentent une puissante activité biologique, et incorporer des nanostructures d'ordre supérieur. Structurellement similaires aux peptides, peptoïdes sont des poly N-substitué glycines, où les chaînes latérales sont attachés à l'azote plutôt que l'alpha-carbone. Leur facilité de synthèse et de la diversité structurelle permet de tester des principes de conception de base pour conduire de novo design et l'ingénierie de nouveaux matériaux biologiquement actifs et nanostructurés.
Ici, un protocole simple manuel peptoïde synthèse est présentée qui permet la synthèse de la longue chaîne polypeptoids (jusqu'à 50mers) avec d'excellents rendements. Seuls les équipements de base, des techniques simples (par exemple le transfert de liquide, filtration), et des réactifs disponibles dans le commerce sont tenus, faisant un ajout peptoïdes accessible à outils de nombreux chercheurs. L'épine dorsale peptoïde est cultivé un monomère à un temps de vIA la méthode submonomer qui consiste en une à deux étapes du cycle d'addition du monomère: acylation et de déplacement. Tout d'abord, l'acide bromoacétique activé in situ avec le N, N'-diisopropylcarbodiimide acylates une résine assortis amine secondaire. Deuxièmement, le déplacement nucléophile du bromure par une amine primaire suit pour introduire la chaîne latérale. Le cycle à deux étapes est itérée jusqu'à ce que la longueur de la chaîne désirée est atteinte. L'efficacité du couplage de ce cycle en deux étapes dépasse régulièrement 98% et permet la synthèse de peptoïdes aussi longtemps que 50 résidus. Très configurable, précis et chimiquement séquences diverses sont réalisables avec la méthode submonomer que des centaines de disponibles amines primaires peuvent être directement intégrées.
Peptoïdes sont en train de devenir un matériau polyvalent biomimétiques pour la recherche Nanobioscience en raison de leur flexibilité, la robustesse de synthèse, et ordonnant à l'échelle atomique. Le repliement d'une chaîne unique, amphiphiles, de l'informationtion riche en polypeptoid dans un nanosheet hautement ordonné a été récemment démontré. Cette peptoïde est un 36-mer qui se compose de seulement trois différents monomères disponibles dans le commerce: hydrophobe, cationiques et anioniques. Les chaînes hydrophobes latérales phényléthyle sont enterrés dans le cœur nanosheet alors l'amine ioniques et des chaînes latérales carboxyle s'aligner sur les visages hydrophile. Le nanofeuillets peptoïde servir de plateforme pour les potentiels de membrane mimétiques, mimétiques de protéines, fabrication de dispositifs, et des capteurs. Méthodes de synthèse peptoïde, formation de la feuille, et l'imagerie par microscopie sont décrites et fournir une méthode simple pour permettre aux futurs designs nanosheet peptoïde.
Protocole
1. Synthèse Submonomer en phase solide de Polypeptoids
Synthèse en phase solide (SPS) est une technique courante utilisée pour synthétiser des séquences spécifiques de biopolymères par étapes, directement sur une solide inerte de soutien comme une résine polymère perles. Haute rendements de couplage et de facilité de retrait excès de réactif sont des atouts majeurs de la SPS. Après une réaction de couplage à la résine, excès de réactifs sont simplement égouttés et les billes sont lavées pour être prêt pour l'étape de réaction suivante. Après la réaction de synthèse final, les oligomères pleine longueur sont clivés de la résine et le matériau de phase solution peut être étudiée davantage. Ici, nous nous adaptons la procédure SPS pour générer des polymères séquences spécifiques peptoïde.
- Configuration: Toutes les étapes de la synthèse peptoïde manuelle peut être effectuée dans un jetable, polypropylène (PP) cartouche fritté ou un récipient en verre fritté de réaction équipé d'un robinet à 3 voies. Effectuer toutes les opérations dans une hotte. Pour les incubations dans la glass navire ou d'une cartouche en plastique, connectez un bras à un apport d'azote en douceur la bulle de la solution pour un bon mélange. Sinon, pour les incubations de réaction dans la cartouche jetable, joint les deux extrémités de la cartouche avec capuchons et les placer sur un agitateur rotatif. Pour drainer les mélanges de réaction ou les lavages, se connecter à la maison vide par l'intermédiaire d'un piège de déchets. Le navire devrait être fritté avec une fritte grossière. Siliconize la cuve de réaction en verre pour éviter de perles de coller à la parois du récipient en verre. Préparer une solution de 5% en dichlorodiméthylsilane dichloroéthane (v / v). Remplir une cuve de réaction propre et sec vers le haut avec une solution de siliconage, laisser reposer pendant 30 minutes, puis égoutter. Lavez le récipient une fois avec DCE et puis une fois avec du méthanol. La solution siliconage peut être réutilisé, il doit donc être sauvé. Soit l'air sec ou secouer tout excès de solution et faire cuire de la verrerie à sec après avoir enlevé le robinet. Cuve de réaction refroidir avant d'ajouter de la résine.
- Ajouter 100 mg (0,06 mmol) de re Rink amidele péché d'une cuve de réaction fritté. Gonfler la résine en ajoutant 2 ml de diméthylformamide (DMF). Agiter en secouant ou en bouillonnement pendant 10 minutes. Égoutter la solution par le vide pour isoler la résine gonflé.
- Ajouter 1 mL de 20% 4-méthylpipéridine dans le DMF (v / v) à déprotéger le groupe Fmoc. Agiter pendant 2 minutes et égoutter. Répéter l'opération avec une incubation de 12 minutes.
- Rincer la résine en ajoutant 2 mL de DMF, en agitant pendant 15 secondes, et le drainage. Répétez 3 fois.
- Bromoacetylation: Ajouter 1 mL de 0,6 M d'acide bromoacétique (0,6 mmol) dans du DMF et 86 uL de N, N'-diisopropylcarbodiimide (0,93 équivalent, 0,56 mmol). Incuber avec bullage doux pendant 30 minutes, puis égoutter et rincer avec 2 ml de DMF (répéter 4x).
- Déplacement: Ajouter 1 mL de 1-2 M amine dans la N-méthylpyrrolidinone. Incuber avec un barbotage d'30-120 minutes, puis égoutter et rincer avec du DMF (4x 2 ml).
- Continuer à pousser la chaîne peptoïde en répétant le cycle submonomer, des mesures 1.5 (bromoacetylation) et 1,6 (displacement).
- Après le déplacement final est terminé, rincez avec 2 ml de DMF (répéter 4x), puis 2 mL de dichlorométhane (Repeat 3x). Cap et de stocker la cuve de réaction jusqu'à ce clivage.
- Pause dans la synthèse (en option): Pour faire une pause pendant une synthèse peptoïde, terminer la réaction de déplacement et de continuer à l'étape 1.8. Pour poursuivre sa croissance la chaîne peptoïde, redémarrez la synthèse par re-gonflement de la résine séchée (étape 1.2) et en répétant le cycle submonomer (étape 1.5 et 1.6). La résine peut être séché et stocké après tout déplacement, sauf le déplacement parce que le deuxième conjugué de résine peptoïde peut former un produit cyclique dicétopipérazine côté.
- Pour de multiples synthèses simultanées, un collecteur d'extraction en phase solide sous vide est recommandé afin de maximiser l'efficacité. Synthèse peptoïde peut également être automatisé par bien méthodes de programmation dans les synthétiseurs peptidiques commercialement disponibles, comme l'Apex Aapptec 396, synthétiseur à micro-ondes CEM Liberté et Techno protéinessynthétiseur Logies Prélude inc.
2. Clivage et Side-Chain Déprotection
- Transférer la totalité de la résine séchée pour un flacon de 20 mL en verre à scintillation.
- Travaillant à l'intérieur d'une hotte et d'utiliser un équipement de protection personnelle, ajouter 4 ml d'acide trifluoroacétique (TFA) 1 cocktail de clivage (par exemple 95% aq. TFA, voir la discussion) dans le flacon en verre à scintillation et bouchon. Agiter pendant 10 minutes à 2 heures à température ambiante (voir la discussion).
- Recueillir la solution de clivage TFA par filtration de la résine à travers un jetables, cartouches PP fritté dans une nouvelle pré-pesées 20 ml flacon en verre à scintillation. Un jetables, PP pipette est pratique pour transférer des solutions cocktails clivage.
- Ajouter 1 ml de cocktail de clivage fraîche pour rincer la résine et de recueillir toute peptoïde résiduelle. Répéter 2x.
- Evaporer TFA en soufflant un léger courant d'azote ou en utilisant un Biotage V10 évaporateur.
- Redissoudre le pétrole brut dans 6 mLd'acétonitrile / eau 1:1 (v / v) pour HPLC. Freeze et lyophiliser. Répéter.
- Noter le poids du produit brut. Magasin sous forme de poudre sèche à -20 ° C
- Clivage d'essai (en option): Un clivage test sur 0,5% de la résine peut être effectuée pour déterminer rapidement la pureté et la masse de la peptoïde synthétisés et si les conditions de clivage correctes ont été choisis. Clivages test sont particulièrement utiles pour suivre les progrès de la synthèse.
3. Caractérisation et de purification de l'Polypeptoid
- Grâce à une combinaison d'analyse HPLC, electrospray LC-MS, et / ou MALDI-TOF, déterminer la pureté du produit brut et si le poids moléculaire désiré est présent.
- Préparer un ~ 5-10 mg / ml solution de la poudre sèche peptoïde dans l'eau avec acétonitrile minimale nécessaire pour que la solubilité. Filtre solution claire du produit brut avec 0,45 peptoïde filtre seringue um pour enlever la poussière et les particules.
- Analytique HPLC et electrospray LC-MS: Préparer un ~ 20 mg / ml solution peptoïde brut. Filtre 200 uL avec un filtre de 0,45 um et injecter 20 pl.
- MALDI: Mélanger 1 ul de ~ 20 mg / mL peptoïde avec 1 matrice ul. Spot 1 uL sur la plaque MALDI et laisser sécher à l'air. Matrix et le mode d'acquisition dépend de l'échantillon (Fig. 5).
- Purifier le mélange brut peptoïde avec inversion de phase de préparation HPLC. Choisissez le gradient et la colonne (C4 ou C18) basé sur l'hydrophobie de polypeptoid. Combinez fractions purifiées, geler et lyophiliser, résultant en une poudre blanche duveteuse. Noter le poids du produit final.
- Formation de HCl sel (facultatif): Redissoudre la poudre lyophilisée dans 100 mM HCl (aq) avec de l'acétonitrile minime. Transfert à pré-pesées flacon en verre. Freeze et re-lyophiliser. Répéter 2x. Peser de nouveau pour déterminer la masse de poudre peptoïde.
4. Formation Nanosheet peptoïde
Cette section describes le protocole pour former des feuilles d'une chaîne unique, séquence spécifique, amphiphiles 36-mer peptoïde (Fig. 1). Après le brin peptoïde est synthétisé, purifié, et lyophilisée comme décrit ci-dessus, la poudre blanche obtenue est dissoute dans du DMSO pour faire une solution à 2 mM.
- Préparer 500 pi de solution à 20 uM dans un tampon de peptoïde formation de la feuille (10 mM Tris-HCl, NaCl 100 mM, pH 8,0 dans l'eau) dans un flacon en verre 1 drachme. D'abord, ajouter 445 ul d'eau Milli-Q, 50 ul de tampon feuille de formation de 10x, et le vortex pour mélanger. Ensuite, ajoutez 5 pi de solution à 2 mm Stock peptoïde et la solution agiter doucement. Boucher le flacon en verre.
- Les feuilles sont formées par l'agitation douce de la solution aqueuse diluée peptoïde. Lentement inclinant le flacon en verre de la position horizontale à la position verticale des résultats dans les fiches. Agitant doucement rendements aussi des fiches, mais les feuilles ont tendance à être plus petits et avec moins de lignes droites. Une analyse plus approfondie du mécanisme de formation de la feuille est ReporteD séparément. 2
- Pour de nombreuses feuilles de haute qualité, faire pivoter les flacons de verre à l'axe horizontal lentement (<1 RPM) pour un à trois jours. Un ressources techniques appropriées RKVSD rotateurs tubes Rotamix ou un rocker personnalisés peuvent effectuer cette permanence.
- Dialyse des nanofeuillets (facultatif): Dans certaines applications, il peut être nécessaire pour enlever toutes les chaînes gratuitement peptoïde ou des tampons / sels. Imbiber un flotteur-a-Lyzer 100 kD la membrane dans le tampon désiré pendant 15 minutes. Charge 500 uL solution de tôle peptoïde dans la chambre de l'échantillon. Faire tremper dans 500 ml de tampon désirée, en remuant avec un agitateur magnétique à 60 rpm. Autoriser la dialyse de feuilles se dérouler pendant 4 heures. Chaque heure, l'échange avec une souche nouvelle de solution tampon.
5. Microscopie à fluorescence d'nanofeuillets
- Images de fluorescence de l'nanofeuillets ont été imagées avec Nile Red, un colorant sensible à l'environnement dont la fluorescence d'intensité augmente quand il est localisé dans hydrenvironnements ophobic (Fig. 2).
- Ajouter 1 ul de 100 uM du Nil Rouge à 100 ul de la solution nanosheet pour obtenir une concentration finale de 1 uM du Nil Rouge.
- Préparer une solution d'agarose 1% dans l'eau chaude et versez dans un plat en plastique de Petri. S'assurer que la solution d'agarose est d'environ 1 / 8 pouce d'épaisseur et laisser la solution refroidir tranquille sur une surface plane. Après les jeux d'agarose, utiliser une spatule pour couper et de transfert de 1 cm x 1 cm carrés à une lame de verre.
- Pour recueillir les feuilles dans le même plan, la tache 1 microlitre de solution sur la feuille de morceau d'agarose. Laisser l'agarose pour absorber la mémoire tampon de 2 minutes, en laissant les feuilles à la surface. Image dans les 15 minutes, sinon l'agarose commence à se déformer à cause de la déshydratation.
- Pour l'image des feuilles dans la solution, la charge 15 uL l'intérieur d'un joint mm de diamètre 20 mm 0.12 sur une lame de verre. Couvrir avec une lamelle. Si les feuilles sont simplement pris en sandwich entre une lame de verre et de la lamelle sans joint, de nombreuses feuilles wicisaillement ll et l'évaporation apparemment mineures fera les feuilles à se déplacer constamment.
- Feuilles d'images sous un éclairage à épifluorescence (par exemple, un Olympus IX81 microscope inversé équipé d'une iXonEM Andor spectres + EMCCD avec un filtre rouge Texas).
6. Microscopie électronique à balayage (MEB) de nanofeuillets
- Gravure de substrat de silicone (en option) Plasma: Les puces de silicium sont gravés le plasma à l'aide de l'adsorption des feuilles. Placer les puces de silicium dans la chambre à vide d'un nettoyeur de plasma (par exemple Harrick Plasma Cleaner / Stérilisateur PDC-32G). Pompe jusqu'à 200 mTorr et mettre la bobine RF pour 18W (réglage élevé pour PDC-32G). Etch pendant 2 minutes.
- Baisse de 20 uL d'une solution de tôle peptoïde sur un substrat de silicium traité au plasma. Laisser reposer pendant 3 minutes. Retirer l'excédent de solution avec le bout de Kim-wipe. Pipeter 20 uL d'eau sur la surface et enlever l'excès de solution de nouveau pour enlever tampons et des sels. Répéter 4x.
- Alternativement, composezYZE les solutions contre la feuille de peptoïde eau pour éliminer le tampon et le sel. Baisse de 20 uL d'une solution de feuille de dialyse sur des substrats de silicium traité au plasma. Sécher à l'air de l'échantillon.
- Image avec des feuilles SEM (par exemple Zeiss Gemini Ultra-55 Microscope Electronique à Balayage analytique) avec un détecteur intégré à l'objectif et à des énergies de faisceau entre 1 kV et 5 kV (Fig. 3).
7. Consignes de sécurité:
- Diméthylformamide et le dichlorométhane sont raisonnablement soupçonnés cancérigènes.
- N, N'-diisopropylcarbodiimide, 4-methylpiperdine et de l'acide bromoacétique sont dangereux pour la peau, des yeux et des voies respiratoires. Ils doivent être utilisés dans la hotte avec soin. Il peut être toxique s'il est inhalé ou absorbé par la peau, et l'exposition peut entraîner une sensibilisation. Les conteneurs vides retiennent les résidus (liquide / vapeur) et doit être soigneusement rincé avant de les retirer de la hotte.
- TFA est un acide fort, et est extrêmement destructeur pour les voies respiratoires supérieures, des yeux etpeau. TFA est aussi volatile conserver les solutions concentrées de TFA dans la hotte, en tout temps pour éviter les dommages respiratoires. Utilisez EPI approprié, et la prudence lors de la manipulation des solutions de TFA. Changer les gants rapidement si elles entrent en contact avec du TFA, et immédiatement nettoyer tout déversement.
8. Les résultats représentatifs:
Cette section décrit la synthèse, la caractérisation et la purification d'une séquence-spécifique de la chaîne 36-mer peptoïde qui se plie en un très ordonné nanosheet 3 (Fig. 1).
Le bloc-charge peptoïde H-[Nae-NPE] 9 - [RCE-NPE] 9-NH 2 a été synthétisé sur 100 mg de résine Rink amide. A 2 M d'amine solution a été utilisée pour toutes les réactions de déplacement, qui ont été effectués pendant 60 minutes pour les résidus 1-18 et 120 minutes pour les résidus 19-36. t-butyle bêta-alanine HCl a été converti en base libre (voir la discussion) alors phénéthylamine et BOC-éthylènediamine ont tous deux été utilisés directly. La résine a été coupé avec 95% de TFA, triispropylsilane 2,5%, 2,5% d'eau pendant 2 heures. TFA est évaporé et l'huile visqueuse résultant (~ 180 mg) a été re-dissous dans 6 ml d'acétonitrile: eau 1:1 (v / v). La pureté du produit (fig. 4) et la présence de la masse du produit a été confirmé par des RP-HPLC analytique (30-80% d'acétonitrile dans l'eau de gradient, à la fois contenant 0,1% (v / v) TFA, à 1 mL / min pendant 30 minutes à 60 ° C avec une C18, 5 um, colonne 50 x 2 mm) et MALDI (fig. 5).
Purification avec CLHP en phase inverse sur une colonne Vydac C18 (10 um, 22 mm x 250 mm) a procédé, en utilisant un gradient d'acétonitrile 30-60% dans l'eau avec 0,1% de TFA de plus de 60 minutes à 10 mL / min. La colonne a été chargé avec 60 mg de produit brut pour chaque exécution chromatographique. Les fractions purifiées ont été combinés basés sur la pureté du RP-HPLC analytique (Fig. 4) et lyophilisé pour donner ~ 80 mg d'une poudre blanche duveteuse.
Purifié par blocs de charge peptoïde moléculairespoids a été confirmée par MALDI. 1 pl de 100 M purifiée peptoïde dans l'acétonitrile: eau 1:1 (v / v) a été mélangé avec 1 pl de la matrice (5 mg / mL α-cyano-4-hydroxycinnamique dans l'acétonitrile: eau 01:01 v / v et 0,1% de TFA) et 1 ul a été repéré sur la plaque MALDI. Après l'échantillon séché à l'air, il a été placé dans le Applied Biosystem / MDS SCIEX 4800 MALDI TOF / TOF Analyzer. Les modes d'acquisition et de traitement étaient linéaires de faible masse. Le poids calculé a été inscrit dans la masse ciblée pour ajuster automatiquement le temps de retard. L'intensité du laser a été fixé à 3400. La masse observée, 4981,2, correspond étroitement à la masse calculée de 4981,74.
La poudre lyophilisée purifiée a été dissous dans du DMSO pour faire une solution à 2 mM, qui peuvent être conservés à 4 ° C. Les draps étaient préparés par le protocole ci-dessus et imagées par microscopie optique de fluorescence et SEM (Fig. 2 et 3). Une variété de formes avec des tailles de fonction allant jusqu'à 300 um sont observées, et notabLy, arêtes droites sont proéminentes.

Figure 1 Séquence du bloc de charge peptoïde H-[Nae-NPE] 9 -. [RCE-NPE] 9-NH 2. Une chaîne unique, responsable de bloc, polypeptoid amphiphiles 36-mer s'auto-assemble en très ordonnée, en deux dimensions nanofeuillets 3. Le poids moléculaire calculé est 4981,74.

Figure 2. Images de microscopie de fluorescence de nanofeuillets peptoïde. Les draps étaient formées d'une solution à 20 uM peptoïde dans 10 mM Tris, 100 mM NaCl, pH 8,0. Les feuilles ont été imagées sur agarose à 1 uM du Nil Rouge. Barres d'échelle sont à 100 um.

Figure 3. Numérisation d'images de microscopie électroniquedes nanofeuillets peptoïde. Les draps étaient formées d'une solution à 20 uM peptoïde dans 10 mM Tris, 100 mM NaCl, pH 8,0. Barres d'échelle sont à 5 um.
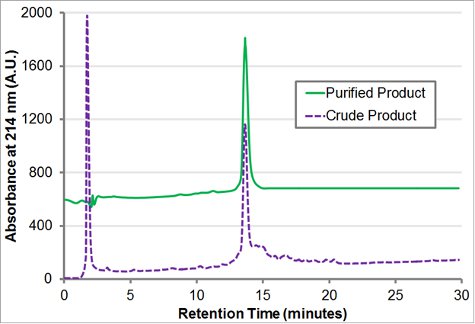
Figure 4 analyse HPLC en phase inverse trace de H-[Nae-NPE] 9 -. [RCE-NPE] 9-NH 2. Le brut et purifié HPLC analytique de traces (30-80% d'inclinaison à 1 mL / min pendant 30 minutes à 60 ° C avec une C18, 5 um, colonne 50 x 2 mm) du brut et purifié par blocs de charge peptoïde H-[ Nae-NPE] 9 - [RCE-NPE] 9-NH 2 est représenté.
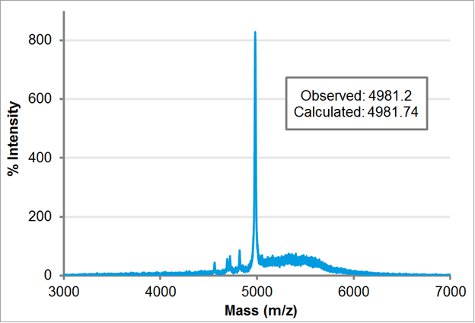
Figure 5 masse MALDI-TOF spectroscopie de traces de H-[Nae-NPE] 9 -. [RCE-NPE] 9-NH 2. La masse observée, 4981.2, est en accord proche de la masse calculée, 4981,74.
Discussion
Applications et importance
Ce protocole décrit une méthode simple et efficace de synthèse peptoïde et la phase aqueuse auto-assemblage de l'peptoïdes en nanofeuillets. La plupart des laboratoires sont facilement capables de synthétiser des matériaux peu coûteux, car peptoïdes, d'expertise et techniques de base simples sont utilisés 4. De même, l'auto-assemblage de l'ultra-mince, très ordonnée nanofeuillets nécessite simplement répété inclinant un flacon d'une solution aqueuse diluée peptoïde 2. Peptoïdes sont prometteurs des matériaux pour la recherche biomédicale et de la nanoscience, car ils sont robustes et flexibles mais synthétiquement séquence-spécifique et hautement accordables 5. Peptoïdes ont démontré une activité biologique (6,7 thérapeutiques, diagnostiques 8, délivrance intracellulaire 9-10) et le pliage en nanostructures hiérarchique 3, 11-14. En raison de leur synthèse modulaire, combinatoire peptoïde librArles 15-19 peuvent être facilement synthétisés et tamisés pour une série d'activités ou propriétés. En particulier, le nanofeuillets servir de plate-forme potentielle pour les échafaudages d'affichage en deux dimensions, mimétiques membrane, capteurs biologiques, protéines et mimétiques fabrication du dispositif. Avec les séquences pratiquement inépuisable différents possible, le domaine de la recherche peptoïde s'étend rapidement.
Variables dans la synthèse en phase solide submonomer des polypeptoids
En raison de la possibilité de choisir parmi un alphabet incroyablement vaste et diversifié de monomères 20, la méthode submonomer besoins modifications occasionnelles pour les cas où l'augmentation de l'efficacité du couplage de chaque étape sera d'améliorer le rendement global du produit. Incorporation de chaînes latérales non protégées hétérocycliques nécessite l'utilisation de l'acide chloracétique lieu de l'acide bromoacétique 21. Fois le déplacement prolongé et plusLes concentrations d'amine sont généralement employés après environ 20 raccords pour de longues séquences peptoïde ou amines moins nucléophiles. Le chauffage de la cuve de réaction à 35 ° C, en utilisant un réacteur à chemise d'eau, aide à conduire la réaction. Pour hautement volatile amines telles que l'isopropylamine, des précautions doivent être prises pour éviter l'évaporation.
Amines sous la forme d'un sel HCl, tels que des t-butyl-bêta-alanine HCl, doivent être libres à base avant d'être introduit dans la réaction de déplacement. Ceci peut être réalisé par dissolution ou suspension de l'amine dans le DCM (~ 5g amine/25 ml de DCM), et de neutralisation avec une solution équimolaire d'hydroxyde de sodium aqueux dans une ampoule à décanter. La couche de DCM est recueilli et la couche aqueuse est lavée avec du DCM supplémentaire. Les couches DCM combinées sont séchées sur sulfate de sodium et filtrée dans un ballon à fond rond pré-pesées. Éliminer le solvant par évaporation rotative pour donner une huile, et noter le poids du produit.
During l'étape de clivage, cocktail clivage TFA et le temps de clivage est dépendant du nombre et la variété de groupes de protection utilisés. Directives pour les cocktails de clivage sont similaires à des clivages traditionnels déprotection peptide 1. Généralement, 10 incubations minute sont nécessaires pour des séquences sans la protection des groupes ou des séquences avec quelques très acides labiles groupes de protection (par exemple BOC, trityle). Deux heures d'incubation sont recommandées pour des séquences plus difficiles groupes de protection (par exemple t-butyle, Mtr, PBF) ou des séquences avec de nombreux groupes de protection pour assurer une déprotection totale de chaque chaîne. Brut produits peptoïde sera généralement se dissoudre dans l'acétonitrile: eau 1:1 (v / v), mais les proportions d'acétonitrile supérieur sont communs avec des chaînes latérales avec une hydrophobicité globale élevée.
Déclarations de divulgation
Nous n'avons rien à révéler.
Remerciements
Les auteurs tiennent à remercier Byoung-Chul Lee, Philip Choi et Samuel Ho pour une aide précieuse. Ce travail a été réalisée à la Fonderie Moléculaire au Lawrence Berkeley National Laboratory, qui est soutenu par le Bureau de la science, Bureau des sciences fondamentales de l'énergie, du Département américain de l'Énergie en vertu du contrat n ° DE-AC02-05CH11231 et la réduction de la menace de la Défense Agence sous le n ° du contrat: IACRO-B0845281.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
| Diméthylformamide | EMD | EM-DX1726P-1 | 99% + |
| N-méthylpyrrolidinone | BDH | BDH1141-4LP | 99% |
| Acide bromoacétique | Acros Organics | 200000-106 | 99% |
| 4-méthylpipéridine | Sigma-Aldrich | M73206 | 96% |
| N, N'-diisopropylcarbodiimide | Chem-Impex | 001100 | 99,5% |
| Dichlorométhane | EMD | EMD-DX0835 | Qualité ACS |
| Acétonitrile | EMD | EM-AX0145P-1 | 99,8% |
| L'acide trifluoroacétique | Sigma-Aldrich | T6508 | 99% |
| Triisopropylsilane | Sigma-Aldrich | 233781 -10G | Pour le clivage TFA |
| 1,2-dichloroéthane | JT Baker | JTH076-33 | Pour siliconise de navires de réaction en verre |
| Phenethylamine | Sigma-Aldrich | 407 267-100ml | > Hydrophobes 99,5% de la chaîne latérale amine |
| Boc-éthylènediamine | Technologies de CNH | C-1112 | Cationiques chaîne latérale amine |
| t-butyle bêta-alanine HCl | Chem-Impex international | 04407 | Anioniques chaîne latérale amine |
| α-cyano-4-hydroxycinnamique | Sigma-Aldrich | C8982-10X10MG | Pour la matrice MALDI |
| Nil-Rouge | Sigma-Aldrich | 19123-10MG | Pour l'imagerie de fluorescence |
| Dichlorodiméthylsilane | Sigma-Aldrich | 80430-500G-F | Pour siliconise de navires de réaction en verre |
| Jetables PP panier frittéRidge | Séparations appliquée | 2416 | 6 ml en polypropylène cartouche avec 20 mm PE fritte |
| Jetables à 3 voies Luer Adaptateur | Cole Parmer | 31200-80 | Robinet pour cuve de réaction manuelle jetables synthèse |
| Luer Lock anneau | Cole Parmer | 45503-19 | ¼ "convenable pour jetables récipient de synthèse de réaction manuelle |
| Raccords Luer | Cole Parmer | 45500-20 | ¼ "convenable pour jetables récipient de synthèse de réaction manuelle |
| Pipettes jetables PP | VWR | 16001-194 | Pour les transferts TFA |
| Seringue Luer en plastique de verrouillage | Scientifique national | S7515-5 | 6 seringues ml |
| 1 flacon en verre de DRAM | VWR | 66011-041 | Avec phénoliques moulées bouchon à vis avec polyvinyle face revêtement de pâte |
| 20 ml SCINflacon tillation | VWR | 66022-060 | Avec bouchon en PP-joint et revêtement feuille de pâte |
| Entretoise adhésif Secure-Seal | Invitrogen | S-24736 | Pour l'imagerie de fluorescence |
| Lames de verre | Sciences Electron Microscopy | 63411 | Pour l'imagerie de fluorescence |
| Lamelle | VWR | 48366-067 | Pour l'imagerie de fluorescence |
| 4 tranches de silicium " | Ted Pella | 16007 | Pré-dés en jetons mm 5x7 |
| Filtre de 0,45 | VWR, Acrodisc | 28143-924 | Pour HPLC. Membrane PTFE |
| Agarose | BD | 212272 | Pour l'imagerie de fluorescence |
| Collecteur à vide SPE | Sigma-Aldrich | 57044 | Exemple de collecteur à vide SPE |
| Récipient en verre fritté | Ace de verre | 6402-12 | Porosité Cfritte |
| Plasma Cleaner / stérilisateur | Harrick Plasma | PDC-32G | Exemple de produit de nettoyage du plasma pour préparer des puces de silicium pour les SEM |
Références
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Pro. Res. 36, 255-266 (1990).
- Sanii, B., Kudirka, R., Cho, A., Venkateswaran, N., Oliver, G. K., Olson, A. M., Tran, H., Harada, R. M., Tan, L., Zuckermann, R. N. Shaken, not stirred: Collapsing a peptoid monolayer to produce free-floating, stable nanosheets. J. Am. Chem. Soc. , (2011).
- Kudirka, R., Tran, H., Sanii, B., Nam, K. T., Choi, P. H., Venkateswaran, N., Chen, R., Whitelam, S., Zuckermann, R. N. Folding of a single-chain, information-rich polypeptoid sequence into a highly-ordered nanosheet. Bioploymers: Peptide Science. 96, 586-595 (2011).
- Utku, Y., Rohatgi, A., Yoo, B., Zuckermann, R., Pohl, N., Kirshenbaum, K. Rapid multistep synthesis of a bioactive peptidomimetic oligomer for the undergraduate laboratory. J. Chem. Ed. 87, 637-639 (2010).
- Fowler, S. A., Blackwell, H. E. Structure-function relationships in peptoids: Recent advances toward deciphering the structural requirements for biological function. Org. Biomol. Chem. 7, 1508-1524 (2009).
- Zuckermann, R. N., Kodadek, T. Peptoids as potential therapeutics. Curr. Op. Mol. Ther. 11, 299-307 (2009).
- Chongsiriwatana, N. P., Patch, J. A., Czyzewski, A. M., Dohm, M. T., Ivankin, A., Gidalevitz, D., Zuckermann, R. N., Barron, A. E. Peptoids that mimic the structure, function and mechanism of helical antimicrobial peptides. , 105-2794 (2008).
- Yam, A. Y., Wang, X., Gao, C., Connolly, M. D., Zuckermann, R. N., Bleua, T., Halla, J., Fedynyshyn, J., Allauzen, S., Peretz, D., Salisbury, C. M. A Universal method for detection of amyloidogenic misfolded proteins. Biochem. 50, 4322-4329 (2011).
- Huang, C. -. Y., Uno, T., Murphy, J. E., Lee, S., Hamer, J. D., Escobedo, J. A., Cohen, F. E., Radhakrishnan, R., Dwarki, V., Zuckermann, R. N. Lipitoids - novel cationic lipids for cellular delivery of plasmid DNA in vitro. Chem. Biol. 5, 345-354 (1998).
- Schroeder, T., Niemeier, N., Afonin, S., Ulrich, A. S., Krug, H. F., Bräse, S. Peptoidic amino- and guanidinium-carrier systems: Targeted drug delivery into the cell cytosol or the nucleus. J. Med. Chem. 51, 376-379 (2008).
- Murnen, H. K., Rosales, A. M., Jaworski, J. N., Segalman, R. A., Zuckermann, R. N. Hierarchical self-assembly of a biomimetic diblock copolypeptoid into homochiral super helices. J. Am. Chem. Soc. 132, 16112-16119 (2010).
- Nam, K. T., Shelby, S. A., Marciel, A. B., Choi, P. H., Chen, R., Tan, L., Chu, T. K. Free-floating ultra-thin two-dimensional crystals from sequence-specific peptoid polymers. Nature. Mater. 9, 454-460 (2010).
- Burkoth, T. S., Beausoleil, E., Kaur, S., Tang, D., Cohen, F. E., Zuckermann, R. N. Toward the synthesis of artificial proteins: The Discovery of an amphiphilic helical peptoid assembly. Chemistry & Biology. 9, 647-654 (2002).
- Murphy, J. E., Uno, T., Hamer, J. D., Cohen, F. E., Dwarki, V., Zuckermann, R. N. A Combinatorial approach to the discovery of efficient cationic peptoid reagents for gene delivery. Proc. Natl. Acad. Sci. U. S. A. 95, 1517-1522 (1998).
- Mora, P. u. i. g., Masip, I. s. a. b. e. l., Cortés, N. u. r. i. a., Marquina, R. e. g. i. n. a., Merino, R. a. m. &. #. 2. 4. 3. ;. n., Merino, J. e. s. &. #. 2. 5. 0. ;. s., Carbonell, T. e. r. e. s. a., Mingarro, I. s. m. a. e. l., Messeguer, A. n. g. e. l., Pérez-Payá, E. n. r. i. q. u. e. Identification from a positional scanning peptoid library of in vivo active compounds that neutralize bacterial endotoxins. J. Med. Chem. 48, 1265-1268 (2005).
- Zuckermann, R. N. Discovery of nanomolar ligands for 7-transmembrane G-protein coupled receptors from a diverse (N-substituted)glycine peptoid Library. J. Med. Chem. 37, 2678-2685 (1994).
- Alluri, P., Liu, B., Yu, P., Xiao, X., Kodadek, T. Isolation and characterization of coactivator-binding peptoids from a combinatorial library. Moleular Biosystems. 2, 568-579 (2006).
- Figliozzi, G. M., Goldsmith, R., Ng, S., Banville, S. C., Zuckermann, R. N. Synthesis of N-(substituted)glycine peptoid libraries. Methods Enzymol. 267, 437-447 (1996).
- Culf, A. S., Ouellette, R. J. Solid-phase synthesis of N-substituted glycine oligomers (α peptoids) and derivatives. Molecules. 15, 5282-5335 (2010).
- Burkoth, T. S., Fafarman, A. T., Charych, D. H., Connolly, M. D., Zuckermann, R. N. Incorporation of unprotected heterocyclic side chains into peptoid oligomers via solid-phase submonomer synthesis. J. Am. Chem. Soc. 125, 8841-8845 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon