Method Article
Suivi de l'activité ubiquitine-protéasome dans les cellules vivantes aide d'un Degron (dgn)-déstabilisé Green Fluorescent Protein Reporter Protéines (GFP) à base de
Dans cet article
Résumé
Procédé pour surveiller l'activité ubiquitine-protéasome dans les cellules vivantes est décrit. Un degron-GFP déstabilisée-(GFP-dgn) et une protéine de fusion GFP-stable dgnFS sont générés et transduites dans la cellule en utilisant un vecteur d'expression lentiviral. Cette technique permet de générer une lignée stable de cellules exprimant GFP-dgn/GFP-dgnFS dans lequel l'activité ubiquitine-protéasome peut être facilement évaluée en utilisant épifluorescence ou la cytométrie en flux.
Résumé
Protéasome est la principale organite intracellulaire impliquée dans la dégradation protéolytique de la anormaux, mal repliées, les protéines endommagées ou oxydées 1, 2. Maintien de l'activité du protéasome est impliqué dans de nombreux processus cellulaires clés, comme la réponse au stress cellulaire 3, la régulation du cycle cellulaire et de la différenciation cellulaire 4 ou en réponse du système immunitaire 5. Le dysfonctionnement du système ubiquitine-protéasome a été associée à l'apparition de tumeurs et de maladies neurodégénératives 4, 6. En outre, une diminution de l'activité du protéasome a été trouvé comme une caractéristique de la sénescence cellulaire et organismique vieillissement 7, 8, 9, 10. Ici, nous présentons une méthode pour mesurer l'activité ubiquitine-protéasome dans les cellules vivantes en utilisant une protéine de fusion GFP-dgn. Pour être en mesure de surveiller l'activité ubiquitine-protéasome dans les cellules vivantes primaires, construit d'ADN complémentaire codant pour une protéine fluorescente verte (GFP)-dgn protéine de fusion (GFP-dgn, instable) et une variante portant une mutation du cadre de lecture (GFP-dgnFS, stable 11) sont insérés dans des vecteurs d'expression lentiviral. Nous préférons cette technique par rapport aux techniques de transfection traditionnels, car il garantit une efficacité de transfection très élevée indépendamment du type de cellule ou de l'âge du donateur. La différence entre la fluorescence émise par la GFP-dgnFS (stable) et la protéine déstabilisé (GFP-dgn) en l'absence ou en présence de l'inhibiteur de protéasome peuvent être utilisées pour estimer l'activité ubiquitine-protéasome dans chaque souche cellulaire particulier. Ces différences peuvent être surveillés par microscopie à épifluorescence ou peut être mesurée par cytométrie en flux.
Protocole
1. Construction des plasmides
- Afin personnalisé oligo-nucléotides codant pour dgn (ACKNWFSSLSHFVIHL 11) et pour dgnFS (HARTGSLACPTSSSICE) et le ligaturer dans le vecteur pEGFP-C1 afin d'obtenir la fusion de la GFP avec dgn / dgnFS (figure 1).
- Amplifier la séquence codant pour la GFP-dgn et GFP-dgnFS par PCR selon le protocole du kit de clonage TOPO directionnel pENTR et continuer avec le kit TOPO directionnel pLenti6/V5 clonage (figure 6).
2. Production de virus
- Le jour avant la transfection (Jour 1) de graines sur les cellules HEK 293FT dans un des flacons T75 de sorte qu'ils seront confluentes à 90-95% le jour de la transfection.
- Le jour de la transfection diluer 36 ul de lipofectamine 2000 réactif dans 1,5 ml de DMEM sans sérum et d'antibiotiques dans un falcon de 15 ml. Utilisez un autre Falcon de 15 ml et diluer 3 pg pLenti6/V5 portant l'ADN complémentaire de construire soit pour la GFP -Dgn ou GFP-dgnFS, 2,5 mg pMD2.G encodage plasmide d'enveloppe et de 7,5 mg psPAX2 squelette du vecteur dans 1,5 ml de DMEM sans sérum et d'antibiotiques. Après 5 min de l'ADN dilué est combiné avec le réactif dilué lipofectamine 2000.
- Incuber le mélange pendant 20 min à température ambiante pour permettre les complexes ADN-lipofectamine à la forme.
- Retirez le support de cellules HEK 293FT, remplacez-le avec soin par 7 ml de milieu (sans antibiotiques) et ajouter le mélange d'ADN-lipofectamine dans le ballon et it rock d'avant en arrière pour le mélange (Jour 2). Incuber le ballon pendant une nuit à 37 ° C dans une atmosphère humidifiée à 5% de CO 2 incubateur.
- Changer le milieu le lendemain (10 ml de milieu sans antibiotiques; Jour 3).
- Après 48 heures (jour 5) surnageant récolte, centrifuger à 300 xg pendant 5 min à température ambiante et filtrer le surnageant à travers un filtre de 0,45 um PVDF.
Milieu de culture - DMEM (HEK 293FT)
tente "> DMEMFBS 10%
0,1 mM MEM NEAA
6 mM de L-glutamine
Pyruvate de sodium 1 mM MEM
1% Pen-Strep (facultatif)
500 pg / ml de généticine (facultatif)
3. Concentration du virus par le polyéthylène glycol (PEG) Précipitations
- Ajoutez une solution de glycol polyéthylène de volume (50 Polyéthylène glycol mM, 41 mM de NaCl, autoclave, pH = 7,2; PEG) à quatre volumes de surnageant et laisser incuber pendant 2 heures à 4 ° C. Mélanger soigneusement à chaque 20-30 minutes en retournant.
- Centrifuger à 1500 xg pendant 30 min à 4 ° C. Une pastille blanche doit être visible.
- Aspirer le surnageant et centrifuger à nouveau à 1500 xg pendant 5 min à 4 ° C. Aspirer la solution de PEG restant.
- Remettre en suspension le culot dans du milieu ou tampon phosphate salin (PBS) par pipetage de haut en bas et vigoureusement au vortex pendant 20 à 30 secondes. A titre indicatif utiliser 500 ul pour un flacon T75 et il aliquote de 100 ul. Stocker le virus à -80 ° C.
4. Titrage des virus
- Graines à 5 × 10 4 cellules U2-OS à chaque puits d'une plaque à 6 puits le jour avant la transfection.
- Le jour de la transfection enlever le milieu de culture et le remplacer par 1 ml de DMEM contenant 8 pg / ml de polybrène (hexadiméthrine bromure). Diluer le concentré de virus surnageant 1:10 et 1:100 et ajouter 1 ul de chacune à un puits. Pour des concentrations plus élevées de virus utilisent 1 pi, 5 pi et 10 pi de surnageant de virus concentré pour les puits restants. Un puits est laissé comme témoin positif.
- Le jour suivant, remplacer le milieu par 2 ml de DMEM.
- Début de la sélection le lendemain. Appliquer 10 pg / ml blasticidine sur chaque puits. Remplacez le support antibiotique contenant tous les deux jours.
- Environ 6-7 jours après le début de la sélection des cellules untransduced sont morts. Pour la coloration des cellules laver trois fois avec du PBS et les cellules couvrir au cristal violet (10 mg / l de cristal violet dedans de l'éthanol 20%) et incuber pendant 5-10 min à température ambiante. Aspirer cristal violet (peut être réutilisé plusieurs fois) et rincer les puits deux fois avec ddH 2 O et sécher la plaque.
- Compter les colonies et se multiplient à 1000 et la dilution correspondante (figure 7). Cette procédure permet de calculer les unités de transfection (TU) du virus / ml.
Milieu de culture - DMEM (HFF-2/U2-OS)
DMEM
FBS 10%
6 mM de L-glutamine
1% Pen-Strep
5. La transduction des fibroblastes diploïdes humains (Cette procédure peut être utilisée pour n'importe quel type de cellule.)
- Graines à 5 × 10 4 fibroblastes diploïdes humains (HDFS) à des plaques 6 puits la veille de transduction.
- Utiliser une multiplicité d'infection de deux avec 8 ug / ml de polybrène en tant que renforçateur de transduction dans un total de un millilitre.
- Changer le milieu de la journée suivante.
- Quandles cellules sont à 70-80% de confluence début de la sélection avec 10 ug / ml blasticidine. Une fois la sélection terminée (pas de cellules non transfectées meurent plus) l'expansion des cellules peut commencer et les cellules sont prêtes pour des expériences. Sélection chronique avec blasticidine permet de générer une lignée cellulaire stable surexprimant GFP-dgn ou protéines de fusion GFP-dgnFS, prêt à mesurer l'activité du protéasome. Ce procédé garantit une efficacité de transfection très élevée indépendante du type cellulaire.
6. Mesure par cytométrie en flux
- Graines à 1 × 10 5 cellules (portant soit GFP-dgn ou GFP-dgnFS) le jour avant l'expérience.
- Traiter les cellules de contrôle 3 heures avant la mesure avec l'inhibiteur de protéasome, par exemple 100 pg / ml LLnL.
- Laver deux fois avec du PBS et récolter les cellules en utilisant 0,5 ml de trypsine. Pour arrêter la trypsinisation utiliser 4,5 ml de milieu de culture et de transférer les cellules à un faucon 15 ml.
- Spin til cellules à 300 xg pendant 5 min à température ambiante.
- Aspirer le milieu, remettre en suspension les cellules dans du PBS et centrifuger à nouveau à 300 xg pendant 5 minutes à 37 ° C.
- Aspirer le PBS, remettre en suspension dans 400 ul de tampon FACS (HEPES 10 mM, NaCl 140 mM, 2,5 mM de CaCl2, pH = 7,4) et de transférer les cellules dans des tubes FACS.
- Gardez les cellules sur des échantillons de glace et de mesure par cytométrie en flux. Les cellules ne doivent pas être stockés plus de 30 min à 4 ° C.
7. Les résultats représentatifs
La protéine de fusion GFP-dgn porte une séquence qui est destiné à le protéasome et donc la protéine est immédiatement dégradée, elle correspond à la diminution de la fluorescence de la GFP signal. Le cadre de lecture (GFP-dgnFS) mutant porteur d'une version mutée de cette séquence et n'est pas dégradé par le protéasome, elle conduit à l'augmentation de fluorescence verte. Pour ces raisons, le jeune HDFS les contraintes auxquelles s'attend l'activité du protéasome élevé et transduites avec GFP-dgn montrent une faible (6% de cellules positives) signal de fluorescence à la fois la mesure par cytométrie en flux et en épifluorescence (figure 2A et B, Figure 3). Le même HDFS transduites avec GFP-dgnFS afficher 39,7% de cellules positives. Le traitement des cellules avec un inhibiteur de protéasome LLnL (N-acétyl-L-leucyl-L-leucyl-L-norleucinal) a soulevé le signal à concurrence de 62,9% dans les deux, la GFP et GFP-dgn dgnFS cellules (figure 2A et B ).
Pour déterminer éventuelle baisse de l'activité du protéasome dans vieillards échantillons de peau humaine, des fibroblastes dermiques isolés à partir de donneurs jeunes, d'âge moyen et vieux ont été infectées par le GFP-dgn et GFP-dgnFS, tel que décrit ci-dessus et cultivées pour le nombre de passages même avant l'analyse par les flux de cytométrie. Dans ces expériences, une augmentation nette du signal GFP entre les individus jeunes (11,2 ± 0,88% des cellules GFP-positives) et d'âge moyen 20,4 ± bailleurs de fonds (2,27% cellules GFP-positives, p = 0,003) a été observée, ce qui indique une diminution de la proteasome activité dans des échantillons provenant de donneurs âgés de 7 (figure 4). Aucune nouvelle baisse de l'activité du protéasome a été observée dans les fibroblastes isolés à partir de vieux individus (figure 4). L'intensité de fluorescence de la GFP-dgnFS était dans tous les cas à 90% (données non présentées) qui indique une efficacité de transfection élevée pour les trois groupes d'âge différents.

Figure 1. La séquence de la GFP-dgn et GFP-dgnFS. Affichée est l'extrémité 3 'de la GFP (green) le site de clonage multiple du vecteur pEGFP-CL1 (gris) et la séquence dgn / dgnFS (rouge).
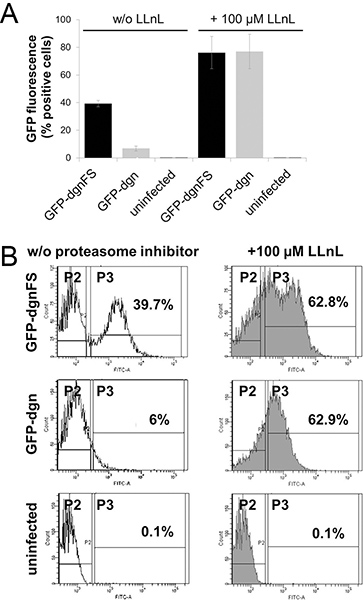
Figure 2. Cytométrie en flux de la GFP-dgn et GFP-dgnFS fibroblastes diploïdes humains. A. fibroblastes jeunes prépuce humain (HFF-2) ont été infectées avec les vecteurs lentiviraux porteurs d'une protéine fluorescente verte (GFP)-dgn gène ou d'un GFP-dgnFS (cadre de lecture) construire, comme il est indiqué et analysé pour fluorescence de la GFP en utilisant la cytométrie de flux (FACS Canto II, Becton Dickinson). Spécification, les cellules ont été traitées pendant 3 heures également avec inhibiteur de protéasome N-acétyl-L-leucyl-L-leucyl-L-norleucinal (LLNL). Les cellules non infectées ont été utilisées comme contrôle. Des expériences ont été réalisées en triple. B. Données sont représentatifs de trois expériences indépendantes. Ces chiffres reflètent la quantité de cellules GFP-positives. Cliquez ici pour agrandir la figure .
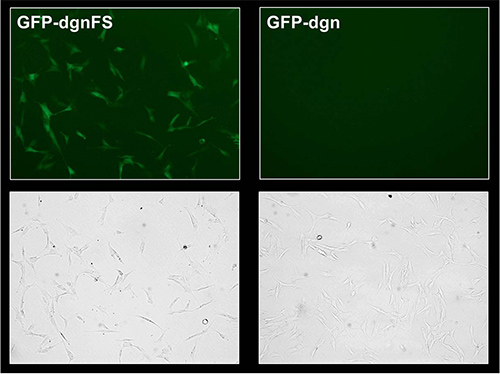
Figure 3. Analyse microscopie à fluorescence de la GFP-dgn et GFP-dgnFS HFF-2 cellules. Jeune HFF-2 ont été traités comme dans la figure 2. À 9 jours après l'infection, les cellules sont visualized par fluorescence et par microscopie à contraste de phase.
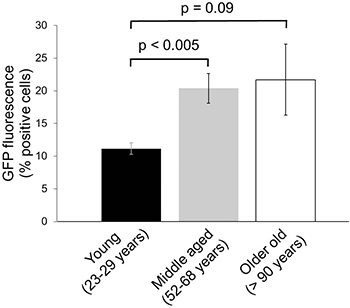
Figure 4. Les changements dans l'activité du protéasome dans le vieillissement cutané humain. Les fibroblastes de prépuce humain de neuf différents bailleurs de fonds dans les groupes d'âge indiquées ont été peu développées et infectées avec des constructions lentiviraux codant pour la GFP-dgn. À 9 jours après l'infection, les cellules ont été analysées par cytométrie en flux. Les données ont été obtenues sur trois échantillons par groupe d'âge en doublons (± SE).
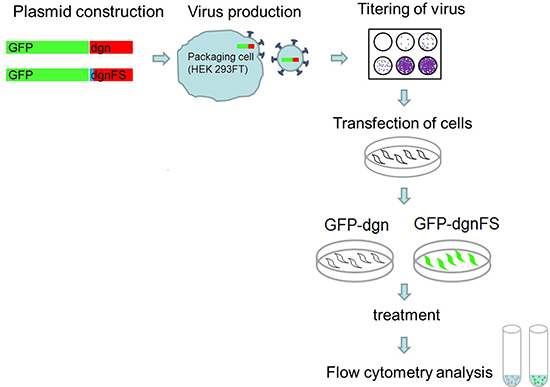
Figure 5. Approche expérimentale. Custom-oligo nucléotides pour dgn et dgnFS sont clonées dans le vecteur pEGFP-C1 et les virus sont produits pour chaque construction en utilisant des cellules HEK 293FT. Le titre du virus est déterminé. Les cellules sont transduites avec le virus et élargi. Après le traitement favorable les cellules sont analyséespour le signal de fluorescence par cytométrie de flux.
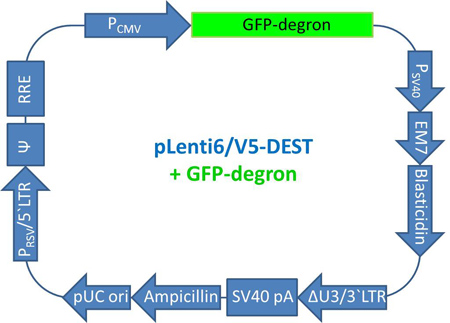
Figure 6. Carte de Plenti GFP-dgn. La carte du pLenti6/V5-DEST vecteur comprenant la séquence GFP-dgn est affiché. Abréviations: pCMV (promoteur CMV), GFP-dgn (séquence de la GFP-dgn), P SV40 (SV40 promoteur précoce), EM7 (EM7 promoteur), blasticidine (gène de résistance à blasticidine), ΔU3 / 3'LTR (3'LTR avec supprimé région U3), SV40 pA (signal de polyadénylation de SV40), ampicilline (gène de résistance à l'ampicilline), pUC ori (origine pUC), PRSV / LTR 5 '(RSV / 5'LTR promoteur hybride), Ψ (VIH-1 signal d'encapsidation Ψ ), RRE (VIH-1 élément de réponse Rev).
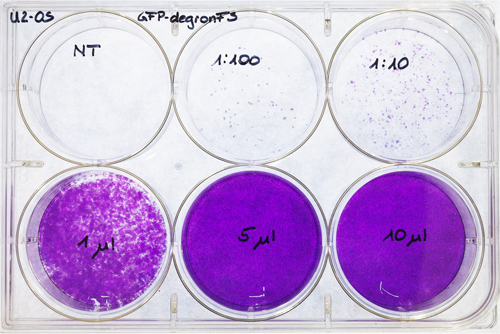
Figure 7. Plaque de titrage U2-OS. U2-OS ont été ensemencées sur une plaque à 6 puits et transfectées avec différentes concentrations de virus (dilution de 1/100 et 1/10, 1, 5 et 10 pi de coopérationncentrated surnageant viral). Un puits a été utilisé comme contrôle non transfectées (NT). Après 6-7 jours, les cellules ont été colorées au cristal violet et séché à l'air.
Discussion
La première publication en utilisant la protéine fluorescente verte (GFP) comme substrat reporter pour l'activité ubiquitine-protéasome a été publié en 2000 12. Depuis lors, la GFP est devenu un outil commun de visualiser les activités cellulaires, en particulier le processus ubiquitine-protéasome. Pour surveiller l'activité ubiquitine-protéasome in vivo d'un modèle de souris transgénique avec un rapporteur GFP basée a été mis en place 13. Autres recherches in vivo a établi un autre modèle de souris transgénique avec un semblable degron-déstabilisé rapporteur GFP tel qu'il est utilisé dans la présente publication 14.
Malheureusement, la GFP en tant que journaliste a quelque imperfection qui a été montré par Dantuma et al. Et Bowman et al. 12,15. Tout d'abord, déstabilisée GFP peuvent s'accumuler sans l'inhibition du protéasome pour des raisons inconnues. Comme les machines ubiquitine-protéasome est un système dont la fonctionnalité dépend de plusieurs étapes, annonceisturbance avant la dégradation peut conduire à l'accumulation du substrat reporter et entraîner des effets faux positifs 12. Deuxièmement, les substrats à base de reporter GFP sont en raison de leur demi-vie courte sensible aux variations de la transcription et de la traduction. Toute modification de fluorescence de la GFP peut donc être le résultat de la synthèse diminuée ou augmentée et la traduction 15. Ces problèmes ont été abordés dans d'autres études par des modifications de la GFP comme suit:
L'activité du protéasome a été trouvé à être réduite dans la sénescence cellulaire et organismique vieillissement 7, 8, 9, 10. Dans le domaine de la recherche sur le vieillissement, l'accent est mis principalement sur l'élimination des protéines oxydées où le protéasome joue un rôle clé, et il n'y a aucune preuve concluante que l'ubiquitination de protéines précède la dégradation dans ce cas 2. Des travaux antérieurs ont également montré que l'utilisation de la GFP avec un fragment muté ubiquitine uncleavable convient d'étudier le processus complexe de pdégradation rotein 16. Cette construction GFP-donne la possibilité de contrôler l'activité du protéasome sans l'influence potentielle de son activité par l'intermédiaire des perturbations dans les machines ubiquitine.
Dans ce travail, nous avons utilisé une protéine degron-déstabilisé rapporteur GFP basée sur (GFP-dgn) pour surveiller l'activité ubiquitine-protéasome dans la vie des fibroblastes diploïdes humains. Pour avoir un aperçu de l'efficacité de la transfection, les fonctionnalités et les niveaux de transcription / traduction du rapporteur GFP-dgn, plusieurs contrôles appropriés ont été inclus. Nous avons utilisé jeunes non traités GFP-dgn fibroblastes transfectés pour montrer qu'il n'y a presque pas de vert fonction de fluorescence visible et protéasome n'est pas affectée. Pour valider que le signal augmente avec l'inhibition du protéasome, nous avons traité la GFP-dgn fibroblastes transfectés avec un inhibiteur de protéasome pour visualiser l'accumulation de GPF après inhibition. Comme un troisième contrôle, nous avons utilisé GFP-dgnFS. Avec cette construction, nous pouvons montrer l'overall efficacité de transfection qui peut différer de la souche de cellules de la souche de cellules et à tous les trois contrôles sans avoir une vue d'ensemble sur le taux de synthèse des constructions à l'intérieur de la cellule.
La méthode présentée ici permet à l'utilisateur de mesurer facilement et rapidement l'activité ubiquitine-protéasome dans les cellules vivantes. Une surexpression stable du substrat rapporteur GFP peut être réalisée par différentes techniques 17. Dans cette publication, la transfection de l'ADNc de GFP dans les cellules dgn est réalisée par le système lentiviral qui fournit une expression stable. En outre, l'utilisation de ce système permet une efficacité de transfection élevée indépendante du type de cellule, maladie métabolique cellulaire ou 7 l'âge du donneur. Nous avons utilisé avec succès ce protocole pour introduire de l'ADN dans les cellules endothéliales dans lesquels d'autres méthodes de transfection a échoué 18. Néanmoins, les expériences précédentes ont montré que les cellules qui sont développées plus dans la culture d'afficher une faible fluorescencesignal que les cellules transfectées fraîchement probablement en raison de la pression plus de sélection.
La précipitation au PEG est utilisé pour augmenter le titre de l'unité de transformation par ml (TU / ml). Si de bons titres sont atteints (plus de 5 × 10 5 TU / ml), la précipitation au PEG peut être omis. Une étape importante au cours de précipitation au PEG est d'éviter la suspension de pipetage vigoureux ou qui génère des bulles d'air. Il peut inactiver les particules de virus et de réduire sensiblement l'efficacité de la transfection.
Lors de l'utilisation des inhibiteurs du protéasome quelques expériences priori doit être effectuée. La concentration finale utilisée et le temps d'incubation sont de type cellulaire dépendante et doivent être déterminées expérimentalement. Observations antérieures sur HFF-2 a révélé que les cellules d'incubation 3h avec LLnL ne doit pas être dépassée en raison de 1) les effets toxiques de l'inhibiteur 2) de signaux GFP trop élevée qui peut être atteint, ou 3) les effets secondaires de l'inhibition du protéasome plus longtemps timpériodes électroniques.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Cette étude a été financée par le Réseau national de recherche sur le vieillissement (PNN S93) par le scientifique autrichien Foundation (FWF), la Commission européenne des projets intégrés et MiMAGE PROTEOMAGE, Pays-Bas Genomics Initiative / Organisation néerlandaise pour la recherche scientifique (NGI / NWO, 05040202 et 050 - 060-810 LPN), financé par l'UE réseau d'excellence Durée de vie (FP6 036894) et le Programme de recherche et d'innovation orientée sur la génomique (SenterNovem; IGE01014 et IGE5007).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| pEGFP-C1 Vecteur | BD Bioscience Clontech | 6084-1 | |
| pENTR Directional TOPO Cloning Kit | Invitrogen | K2400-20 | |
| pLenti6/V5 Directional TOPO Cloning Kit | Invitrogen | V496-10 | |
| Lipofectamine 2000 réactif | Invitrogen | 11668019 | |
| DMEM | Sigma | D5546 | |
| Filtre PVDF (Rotilabo-Spritzenfilter) | Roth | P667.1 | |
| Polyéthylène glycol | Sigma | P2139 | |
| NaCl | Merck | 1.06404.1000 | |
| Phosphate de Dulbecco tamponnée Saline 1x (PBS) | Invitrogen | 14190 | |
| hexadiméthrine bromure de | Sigma | 10,768-9 | |
| Blasticidine | Invitrogen | R21001 | |
| Cristal violet | Sigma | C3886 | |
| FACS tubes | BD Biosciences | ||
| La streptomycine Pénicilline (Pen-Strep) | Invitrogen | 15140130 | |
| L-glutamine 200 mM | Invitrogen | 25030024 | |
| Sérum foetal bovin (FBS) | Biochrom AG | S0115 | |
| MEM non-acides aminés essentiels (AANE) 100x | Invitrogen | 11140035 | |
| Pyruvate de sodium 100 mM MEM | Invitrogen | 11360039 | |
| D-(+)-glucose (45%) | Sigma | G8769 | |
| Généticine | Invitrogen | 11811023 | |
| CaCl2 | Merck | C5080 | |
| Hepes | Sigma | H3375 | |
| Trypsine-EDTA (0,05%) | Invitrogen | 25300054 |
Références
- Coux, O., Tanaka, K., Goldberg, A. L. Structure and functions of the 20S and 26S proteasomes. Annu. Rev. Biochem. 65, 801-847 (1996).
- Davies, K. J. Degradation of oxidized proteins by the 20S proteasome. Biochimi. 83, 301-310 (2001).
- Stangl, K., Stangl, V. The ubiquitin-proteasome pathway and endothelial (dys)function. Cardiovasc. Res. 85, 281-290 (2009).
- Tuoc, T. C., Stoykova, A. Roles of the ubiquitin-proteosome system in neurogenesis. Cell Cycle. 9, 3174-3180 (2010).
- Rock, K. L., et al. Inhibitors of the proteasome block the degradation of most cell proteins and the generation of peptides presented on MHC class I molecules. Cell. 78, 761-771 (1994).
- Lehman, N. L. The ubiquitin proteasome system in neuropathology. Acta Neuropathol. 118, 329-347 (2009).
- Koziel, R., Greussing, R., Maier, A. B., Declercq, L., Jansen-Durr, P. Functional Interplay between mitochondrial and proteasome activity in skin aging. J. Invest. Dermatol. 131, 594-603 (2010).
- Grillari, J., Grillari-Voglauer, R., Jansen-Durr, P. Post-translational modification of cellular proteins by ubiquitin and ubiquitin-like molecules: role in cellular senescence and aging. Adv. Exp. Med. Biol. 694, 172-196 (2010).
- Bulteau, A. L., Szweda, L. I., Friguet, B. Age-dependent declines in proteasome activity in the heart. Arch. Biochem. Biophys. 397, 298-304 (2002).
- Strucksberg, K. H., Tangavelou, K., Schroder, R., Clemen, C. S. Proteasomal activity in skeletal muscle: A matter of assay design, muscle type, and age. Anal. Biochem. , (2009).
- Bence, N. F., Sampat, R. M., Kopito, R. R. Impairment of the ubiquitin-proteasome system by protein aggregation. Science. 292, 1552-1555 (2001).
- Dantuma, N. P., Lindsten, K., Glas, R., Jellne, M., Masucci, M. G. Short-lived green fluorescent proteins for quantifying ubiquitin/proteasome-dependent proteolysis in living cells. Nat. Biotechnol. 18, 538-543 (2000).
- Lindsten, K., Menendez-Benito, V., Masucci, M. G., Dantuma, N. P. A transgenic mouse model of the ubiquitin/proteasome system. Nat. Biotechnol. 21, 897-902 (2003).
- Liu, J., et al. Impairment of the ubiquitin-proteasome system in desminopathy mouse hearts. FASEB J. 20, 362-364 (2006).
- Bowman, A. B., Yoo, S. Y., Dantuma, N. P., Zoghbi, H. Y. Neuronal dysfunction in a polyglutamine disease model occurs in the absence of ubiquitin-proteasome system impairment and inversely correlates with the degree of nuclear inclusion formation. Hum. Mol. Genet. 14, 679-691 (2005).
- Myung, J., Kim, K. B., Lindsten, K., Dantuma, N. P., Crews, C. M. Lack of proteasome active site allostery as revealed by subunit-specific inhibitors. Mol. Cell. 7, 411-420 (2001).
- Menendez-Benito, V., Heessen, S., Dantuma, N. P. Monitoring of ubiquitin-dependent proteolysis with green fluorescent protein substrates. Methods Enzymol. 399, 490-511 (2005).
- Lener, B., et al. The NADPH oxidase Nox4 restricts the replicative lifespan of human endothelial cells. Biochem. J. 423, 363-374 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon