Method Article
Control de la ubiquitina-proteasoma actividad en las células vivas utilizando un degron (dgn)-desestabilizado la proteína verde fluorescente (GFP)-basada en proteína indicadora
En este artículo
Resumen
Un método para supervisar la actividad de ubiquitina-proteasoma en células vivas se describe. Un degron-GFP desestabilizado-(GFP-dgn) y una estable GFP-dgnFS proteína de fusión se generan y se transduce en la célula usando un vector de expresión lentiviral. Esta técnica permite generar un GFP-dgn/GFP-dgnFS estable línea celular que expresa en la que se puede ubiquitina-proteasoma actividad fácilmente evaluada utilizando epifluorescencia o citometría de flujo.
Resumen
Proteasoma es el principal organelo intracelular implicada en la degradación proteolítica de proteínas anormales, mal dobladas, dañadas u oxidadas 1, 2. El mantenimiento de la actividad del proteasoma fue implicado en muchos procesos celulares clave, como respuesta al estrés celular 3, la regulación del ciclo celular y la diferenciación celular 4 o en la respuesta del sistema inmune 5. La disfunción del sistema ubiquitina-proteasoma se ha relacionado con el desarrollo de tumores y enfermedades neurodegenerativas 4, 6. Además, una disminución en la actividad del proteasoma se encontró como una característica de la senescencia celular y el envejecimiento organismal 7, 8, 9, 10. A continuación, se presenta un método para medir la actividad ubiquitina-proteasoma en células vivas utilizando una proteína de fusión GFP-dgn. Para ser capaz de controlar la actividad de la ubiquitina-proteasoma en células vivas primarias, ADN complementario construye codifica para una proteína fluorescente verde (GFP)-dgn proteína de fusión (GFP-dgn, inestable) y una variante con una mutación de desplazamiento de marco (GFP-dgnFS, estable 11) se insertan en vectores de expresión lentiviral. Se prefiere esta técnica sobre técnicas de transfección tradicionales, ya que garantiza una eficacia de transfección muy alta independiente del tipo de célula o de la edad del donante. La diferencia entre la fluorescencia mostrada por el GFP-dgnFS (estable) de proteína y la proteína de desestabilizado (GFP-dgn) en ausencia o presencia de inhibidor del proteasoma puede ser utilizado para estimar la ubiquitina-proteasoma actividad en cada cepa de célula particular. Estas diferencias pueden ser supervisado por microscopía de epifluorescencia o puede ser medido por citometría de flujo.
Protocolo
1. Construcción de plásmidos
- Orden de ratón oligo-nucleótidos que codifica para dgn (ACKNWFSSLSHFVIHL 11) y para dgnFS (HARTGSLACPTSSSICE) y ligarlo en el vector pEGFP-C1 para obtener la fusión de la GFP con dgn / dgnFS (Figura 1).
- Amplificar la secuencia codificante de GFP y GFP-dgn dgnFS-por PCR de acuerdo con el protocolo del kit de clonación pENTR Directional TOPO y continuar con la pLenti6/V5 direccional TOPO Cloning Kit (Figura 6).
2. Virus Producción
- El día antes de la transfección (Día 1) semilla fuera HEK 293FT células en unos frascos T75 para que puedan ser 90-95% de confluencia en el día de la transfección.
- En el día de la transfección diluir 36 l de Lipofectamine 2000 reactivo en 1,5 ml de DMEM sin suero y antibióticos en un falcon de 15 ml. Utilice otro Falcon de 15 ml y diluir 3 mg pLenti6/V5 que lleva el ADN complementario, ya sea para la construcción de buenas prácticas agrarias -Dgn o GFP-dgnFS, 2,5 g envolvente pMD2.G plásmido que codifica y 7,5 g psPAX2 esqueleto del vector en 1,5 ml de DMEM sin suero y antibióticos. Después de 5 min el ADN diluido se combina con la solución diluida de reactivos Lipofectamine 2000.
- Incubar la mezcla durante 20 min a temperatura ambiente para permitir que los complejos de ADN-lipofectamina a forma.
- Retire el medio de las células HEK 293FT, reemplácelo con cuidado por 7 ml de medio (sin antibióticos) y se añade la mezcla de ADN-lipofectamina al matraz y roca hacia adelante y atrás para mezclar (Día 2). Incubar el frasco durante la noche a 37 ° C en un humidificado 5% de CO 2 incubadora.
- Cambio de medio el día siguiente (10 ml de medio sin antibióticos; Día 3).
- Después de 48 horas (día 5) cosecha sobrenadante, centrifugar a 300 xg durante 5 min a temperatura ambiente y se filtra el sobrenadante a través de un filtro de 0,45 micras PVDF.
Medio de cultivo - DMEM (HEK 293FT)
tienda de campaña "> DMEMFBS 10%
0,1 mM MEM NEAA
6 mM de L-glutamina
1 mM de piruvato sódico MEM
1% de Pen-Strep (opcional)
500 g / ml de geneticina (opcional)
3. Virus Concentración por polietilenglicol (PEG) Precipitación
- Añadir una solución de glicol de polietileno volumen (50 Polietilenglicol mM, 41 mM NaCl, autoclave, pH = 7,2; PEG) a cuatro volúmenes de sobrenadante y se incuba durante 2 horas a 4 ° C. Con cuidado, se mezcla cada 20-30 minutos por inversión.
- Centrifugue a 1500 xg durante 30 min a 4 ° C. Una bola blanca debe ser visible.
- Aspirar el sobrenadante y se centrifuga de nuevo a 1500 xg durante 5 min a 4 ° C. Aspirar la solución de PEG restante.
- Resuspender el sedimento en medio o tampón fosfato salino (PBS) pipeteando arriba y abajo y vigorosamente vórtice durante 20 a 30 segundos. Como una guía para utilizar 500 l un matraz T75 y alícuota a 100 l. Almacenar el virus a -80 ° C.
4. Titulación de Virus
- Semilla fuera 5 × 10 4 U2-OS células a cada pocillo de una placa de 6-y el día antes de la transfección.
- En el día de la transfección eliminar el medio de cultivo y sustituirla por 1 ml de DMEM que contenía 8 g / ml de polibreno (bromuro de hexadimetrina). Diluir el virus concentrado sobrenadante 1:10 y 1:100 y añadir 1 l cada uno a un pocillo. Para concentraciones más altas de virus usan 1 l, l 5 y 10 l de sobrenadante de virus concentrada para los pocillos restantes. Uno bien se deja como un control positivo.
- El día siguiente sustituir el medio por 2 ml de DMEM.
- Comienza con la selección del día siguiente. Aplicar 10 g / ml blasticidina en cada pocillo. Sustituya el medio que contiene antibiótico cada dos días.
- Aproximadamente 6-7 días después de comenzar la selección de las células no transducidas están muertos. Para la tinción de lavar las células tres veces con PBS y se cubren las células con violeta cristal (10 mg / l de violeta cristalen 20% de etanol) y se incuba durante 5-10 min a temperatura ambiente. Aspirado de cristal violeta (puede ser reutilizado varias veces) y enjuagar los pocillos dos veces con ddH 2 O y secar la placa.
- Contar las colonias y se multiplican con 1.000 y la dilución correspondiente (Figura 7). Este procedimiento permite calcular las unidades de transfección (TU) del virus / ml.
Medio de cultivo - DMEM (HFF-2/U2-OS)
DMEM
FBS 10%
6 mM L-glutamina
1% de Pen-Strep
5. Transducción de fibroblastos diploides humanos (Este procedimiento puede ser utilizado para cualquier tipo de célula.)
- Semilla fuera 5 × 10 4 fibroblastos diploides humanas (HDF) a 6-y las placas el día antes de la transducción.
- Utilice una multiplicidad de infección de dos junto con 8 mg / ml de polibreno como potenciador de la transducción en un total de un mililitro.
- Cambio de medio al día siguiente.
- ¿Cuándolas células están en un 70-80% de confluencia comienzo de la selección con 10 mg / ml de blasticidina. Después de completada la selección (sin células no transfectadas mueren más) la expansión de las células puede iniciar y las células están listas para experimentos. Selección crónica con blasticidina permite generar una línea celular estable que sobreexpresan GFP-dgn o GFP-dgnFS proteínas de fusión, listos para medir la actividad del proteasoma. Este procedimiento garantiza una eficacia de transfección muy alta independiente del tipo de células.
6. Medición por citometría de flujo
- Semilla out 1 × 10 5 células (ya sea en libros o GFP-dgn dgnFS GFP-) el día antes del experimento.
- Tratar las células de control de 3 horas antes de la medición con el inhibidor del proteasoma, por ejemplo, 100 mg / ml LLnL.
- Lavar dos veces con PBS y se cosechan las células usando 0,5 ml de tripsina. Para detener la tripsinización utilizar 4,5 ml de medio de cultivo y transferir las células a un Falcon de 15 ml.
- Girar tél las células a 300 xg durante 5 min a temperatura ambiente.
- Aspirar el medio, resuspender las células en PBS y centrifugar de nuevo a 300 xg durante 5 min a 37 ° C.
- Aspirar el PBS, resuspender en 400 l de tampón FACS (10 mM Hepes, 140 mM NaCl, 2,5 mM CaCl 2, pH = 7,4) y transferir las células a tubos de FACS.
- Mantener las células en muestras de hielo y medida por citometría de flujo. Las células no se deben almacenar más de 30 min a 4 ° C.
7. Los resultados representativos
La proteína de fusión GFP-dgn lleva una secuencia que se dirige al proteosoma y por lo tanto la proteína es degradada inmediatamente, sino que corresponde a la disminución de la señal de fluorescencia GFP. El mutante de desplazamiento de marco (GFP-dgnFS) lleva una versión mutada de esta secuencia y no es degradado por la proteasoma, sino que conduce a la mayor fluorescencia verde. Por estas razones, joven HDF con la actividad del proteasoma espera alta y transducidas con GFP-dgn muestran una baja (6% de células positivas) señal de fluorescencia en tanto la medición de citometría de flujo y en epifluorescencia (Figura 2A y B, Figura 3). Lo mismo HDF transduced con las buenas prácticas agrarias-dgnFS mostrar el 39,7% de las células positivas. El tratamiento de las células con inhibidor del proteasoma LLnL (N-acetil-L-leucil-L-leucil-L-norleucinal) planteó la señal hasta un máximo de 62,9% en ambos, GFP-dgn y GFP-dgnFS células (Figura 2A y B ).
Para determinar la posible disminución de la actividad del proteasoma en edades comprendidas entre muestras de piel humana, los fibroblastos dérmicos aislados de donantes jóvenes, de mediana edad y ancianos fueron infectadas con GFP y GFP-dgn dgnFS, como se ha descrito anteriormente y se cultiva en el número mismo pasaje antes del análisis por flujo citometría. En estos experimentos, un aumento claro en la señal de GFP entre individuos jóvenes (11,2 ± 0,88% células GFP-positivas) y de mediana edad donantes (20,4 ± 2,27% de opiniones positivas GFP-células, p = 0,003) se ha observado, lo que indica una disminuir en proteasome actividad en las muestras obtenidas de donantes de edad 7 (Figura 4). No mayor disminución en la actividad del proteasoma se observó en fibroblastos aislados de individuos de más edad (Figura 4). La intensidad de fluorescencia de GFP-dgnFS era en todos los casos ~ 90% (datos no mostrados) lo que indica una alta eficiencia de transfección de los tres diferentes grupos de edad.

Figura 1. La secuencia GFP y GFP-dgn dgnFS-. Muestra es el extremo 3 'de GFP (verde) el sitio de clonación múltiple del vector pEGFP-CL1 (gris) y la secuencia de dgn / dgnFS (rojo).
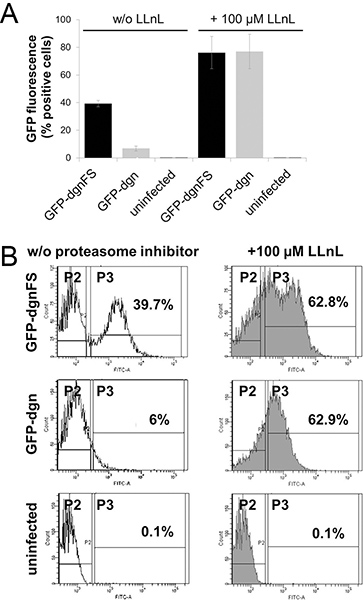
Figura 2. Análisis de citometría de flujo de las buenas prácticas agrarias y las buenas prácticas agrarias-dgn dgnFS fibroblastos diploides humanos. A. fibroblastos jóvenes de prepucio humano (HFF-2) fueron infectadas con vectores lentivirales que transportan una proteína fluorescente verde (GFP)-dgn gen o un dgnFS GFP-(frameshift) construir, como se indica y se analizaron para la fluorescencia de GFP mediante citometría de flujo (FACS Canto II, Becton Dickinson). Donde se indique, las células se trataron también durante 3 h con inhibidor del proteasoma N-acetil-L-leucil-L-leucil-L-norleucinal (LLNL). Las células no infectadas se utilizaron como control. Los experimentos se realizaron por triplicado. B. Los datos son representativos de tres experimentos independientes. Los números reflejan la cantidad de células GFP positivas. Haga clic aquí para ampliar la cifra .
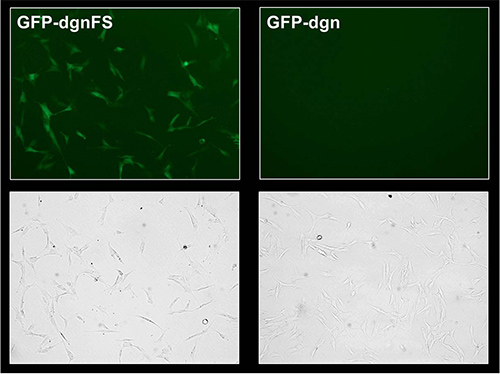
Figura 3. Análisis de microscopía de fluorescencia de GFP y GFP-dgn-dgnFS células HFF-2. Joven HFF-2 fueron tratados como en la Figura 2. A los 9 días después de la infección, las células fueron visualized por fluorescencia y microscopía de contraste de fase.
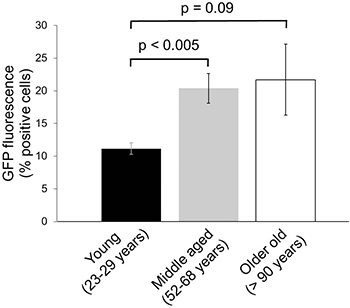
Figura 4. Los cambios en la actividad del proteasoma en el envejecimiento de la piel humana. Los fibroblastos de prepucio humano de nueve donantes diferentes en los grupos de edad indicados se expandieron mínimamente y se infectaron con constructos de lentivirus que codifican para GFP-DGN. A los 9 días después de la infección, las células fueron analizadas por citometría de flujo. Los datos se obtuvieron en tres muestras por grupo de edad por duplicado (± SE).
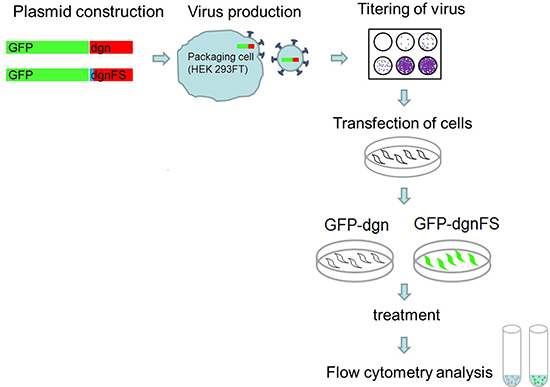
Figura 5. Enfoque experimental. Custom-oligo nucleótidos para dgn y dgnFS se clonan en el vector pEGFP-C1 y los virus se producen para cada constructo utilizando células HEK 293FT. El título de los virus se determina. Las células son transducidas con el virus y expandido. Después de que el trato de favor que las células se analizanpara la señal de fluorescencia por citometría de flujo.
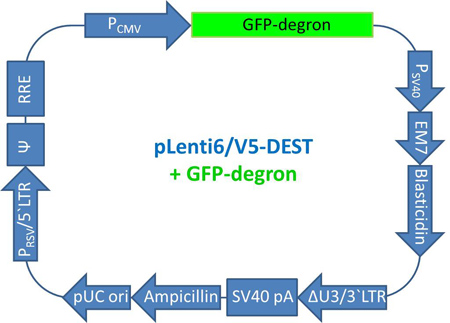
Figura 6. Mapa de Plenti GFP-dgn. El mapa del pLenti6/V5-DEST vector que incluye la secuencia de GFP-dgn se muestra. Abreviaturas: pCMV (promotor CMV), GFP-dgn (secuencia de GFP-dgn), P SV40 (SV40 promotor temprano), EM7 (EM7 promotor), blasticidina (gen blasticidina resistencia), ΔU3 / LTR 3 '(3' LTR con eliminada región U3), pA SV40 (SV40 señal de poliadenilación), ampicilina (gen de resistencia a ampicilina), pUC ori (origen de pUC), PRSV / LTR en 5 '(RSV / LTR 5' promotor híbrido), Ψ (VIH-1 señal de empaquetamiento Ψ ), RRE (VIH-1 elemento de respuesta a Rev).
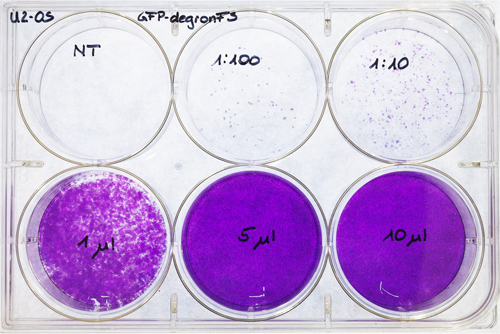
Figura 7. U2-OS placa de titulación. U2-OS se sembraron sobre una placa de 6 pocillos y se transfectaron con diferentes concentraciones de virus (dilución de 1/100 y 1/10, 1, 5 y 10 l de concentrated sobrenadante viral). Un pozo se utilizó como control no transfectadas (NT). Después de 6-7 días, las células se tiñeron con cristal violeta y se secaron al aire.
Discusión
La primera publicación utilizando la proteína fluorescente verde (GFP) como sustrato reportero de ubiquitina-proteasoma actividad se publicó en 2000 12. Desde entonces, GFP se ha convertido en una herramienta común para visualizar las actividades celulares, especialmente el proceso de ubiquitina-proteasoma. Para supervisar la ubiquitina-proteasoma actividad in vivo de un modelo de ratón transgénico con un reportero GFP basada ha introducido 13. Adicional a la investigación in vivo establecido otro modelo de ratón transgénico con una similar degron-desestabilizado reportero GFP como se utiliza en esta publicación 14.
Desafortunadamente, GFP como reportero tiene alguna imperfección que se ha demostrado por Dantuma et al., Y Bowman et al. 12,15. En primer lugar, desestabilizado GFP se puede acumular sin la inhibición del proteasoma por razones desconocidas. Como la maquinaria de ubiquitina-proteasoma es un sistema cuya funcionalidad depende de múltiples pasos, adisturbance antes de la degradación puede conducir a la acumulación del sustrato reportero y resultar en falsos positivos efectos 12. En segundo lugar, los sustratos basados en GFP reportero son debido a su vida media corta sensible a cambios en la transcripción y la traducción. Cualquier cambio en la fluorescencia de GFP por lo tanto, puede ser un resultado de la síntesis reducida o aumentada y traducción 15. Estos problemas han sido abordados en otros estudios por las modificaciones de GFP como sigue:
La actividad del proteasoma se encuentra disminuida en la senescencia celular y el envejecimiento organismal 7, 8, 9, 10. En el campo de la investigación del envejecimiento, la atención se centra principalmente en la eliminación de proteínas oxidadas en el proteasoma desempeña un papel clave, y no hay evidencia concluyente de que la ubiquitinación de proteínas precede a la degradación en este caso 2. El trabajo previo ha demostrado también que el uso de GFP con un resto de ubiquitina mutada uncleavable es adecuado para estudiar el proceso complejo de protein degradación 16. Este constructo GFP-ofrece la posibilidad de monitorear la actividad del proteasoma sin la influencia potencial de su actividad a través de alteraciones en la maquinaria de la ubiquitina.
En este trabajo, se utilizó un degron-GFP desestabilizado a base de proteínas reportero (GFP-dgn) para supervisar la actividad de la ubiquitina-proteasoma en vivir fibroblastos humanos diploides. Para tener una visión general de la eficacia de la transfección, la funcionalidad y los niveles de transcripción / traducción del reportero GFP-dgn, varios controles apropiados se incluyeron. Utilizamos jóvenes no tratados dgn GFP-fibroblastos transfectados para demostrar que no hay casi ninguna función fluorescencia verde visible y el proteasoma no se ve afectada. Para validar que la señal aumenta con la inhibición de la proteasoma, se trataron GFP-dgn fibroblastos transfectados con un inhibidor del proteasoma para ver la acumulación de GPF después de la inhibición. Como tercer control se utilizó GFP-dgnFS. Con esta construcción se puede mostrar la overala eficiencia de transfección ll que puede diferir de cepa de células de cepa de células y con los tres controles que tenemos una visión general sobre la tasa de síntesis de las construcciones dentro de la célula.
El método presentado aquí permite al usuario medir fácil y rápidamente la actividad de la ubiquitina-proteasoma en células vivas. Una sobreexpresión estable del sustrato reportero GFP se puede lograr con diferentes técnicas 17. En esta publicación, la transfección del ADNc de GFP-dgn en las células se consigue mediante el sistema lentiviral que proporciona una expresión estable. Además, el uso de este sistema permite alta eficiencia de transfección independientes del tipo de célula, afección metabólica celular o la edad del donante 7. Hemos utilizado con éxito este protocolo para introducir ADN a las células endoteliales en las que otros métodos de transfección fallidos 18. Sin embargo, los experimentos anteriores demostraron que las células que se expanden más en la cultura de mostrar una fluorescencia más bajoseñal de que las células recién transfectadas posiblemente debido a la presión de selección más tiempo.
La precipitación con PEG se utiliza para aumentar el título de las unidades de transformación por ml (TU / ml). Si se alcanzan buenos títulos (por encima de 5 x 10 5 TU / ml), la precipitación con PEG se puede omitir. Un paso importante durante la precipitación con PEG es para evitar la suspensión de pipeteo vigoroso o que genera burbujas de aire. Se pueden inactivar las partículas de virus y disminuyen significativamente la eficiencia de la transfección.
Cuando se utilizan los inhibidores del proteasoma una experimentos priori debe ser realizada. La concentración final utilizado y el tiempo de incubación son de tipo celular dependiente y tiene que determinarse experimentalmente. Las observaciones anteriores sobre HFF-2 células reveló que la incubación con 3h LLnL no debe superarse porque: 1) los efectos tóxicos del inhibidor 2) Señal de GFP muy alto que se puede alcanzar, o 3) los efectos secundarios de la inhibición del proteasoma más largo timperíodos e.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este estudio fue financiado por: Red Nacional de Investigación sobre el Envejecimiento (NFN S93) por la Fundación de Ciencias de Austria (FMF), Comisión Europea Integrada de Proyectos y MiMAGE PROTEOMAGE, Países Bajos Genómica Iniciativa / Organización Neerlandesa para la Investigación Científica (IGN / NWO, 05040202 y 050 - 060-810 NCHA), financiado por la UE Red de Excelencia Duración (6 º PM 036.894) y el Programa de Innovación Tecnológica Orientada sobre Genómica (SenterNovem; IGE01014 y IGE5007).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| pEGFP-C1 Vector | BD Bioscience Clontech | 6084-1 | |
| pENTR Directional TOPO Cloning Kit | Invitrogen | K2400-20 | |
| pLenti6/V5 direccional TOPO Cloning Kit | Invitrogen | V496-10 | |
| Lipofectamine 2000 Reactivo | Invitrogen | 11668019 | |
| DMEM | Sigma | D5546 | |
| PVDF filtro (Rotilabo-Spritzenfilter) | Roth | P667.1 | |
| Polietileno glicol | Sigma | P2139 | |
| NaCl | Merck | 1.06404.1000 | |
| Fosfato de Dulbecco tamponada Saline 1x (PBS) | Invitrogen | 14190 | |
| hexadimetrina bromuro | Sigma | 10,768-9 | |
| Blasticidina | Invitrogen | R21001 | |
| El cristal violeta | Sigma | C3886 | |
| FACS tubos | BD Biosciences | ||
| La penicilina estreptomicina (Pen-Strep) | Invitrogen | 15140130 | |
| L-glutamina 200 mM | Invitrogen | 25030024 | |
| Suero bovino fetal (FBS) | Biochrom AG | S0115 | |
| MEM no aminoácidos esenciales (AANE) 100x | Invitrogen | 11140035 | |
| MEM piruvato sódico 100 mM | Invitrogen | 11360039 | |
| D-(+)-glucosa (45%) | Sigma | G8769 | |
| Geneticina | Invitrogen | 11811023 | |
| CaCl2 | Merck | C5080 | |
| Hepes | Sigma | H3375 | |
| Tripsina-EDTA (0,05%) | Invitrogen | 25300054 |
Referencias
- Coux, O., Tanaka, K., Goldberg, A. L. Structure and functions of the 20S and 26S proteasomes. Annu. Rev. Biochem. 65, 801-847 (1996).
- Davies, K. J. Degradation of oxidized proteins by the 20S proteasome. Biochimi. 83, 301-310 (2001).
- Stangl, K., Stangl, V. The ubiquitin-proteasome pathway and endothelial (dys)function. Cardiovasc. Res. 85, 281-290 (2009).
- Tuoc, T. C., Stoykova, A. Roles of the ubiquitin-proteosome system in neurogenesis. Cell Cycle. 9, 3174-3180 (2010).
- Rock, K. L., et al. Inhibitors of the proteasome block the degradation of most cell proteins and the generation of peptides presented on MHC class I molecules. Cell. 78, 761-771 (1994).
- Lehman, N. L. The ubiquitin proteasome system in neuropathology. Acta Neuropathol. 118, 329-347 (2009).
- Koziel, R., Greussing, R., Maier, A. B., Declercq, L., Jansen-Durr, P. Functional Interplay between mitochondrial and proteasome activity in skin aging. J. Invest. Dermatol. 131, 594-603 (2010).
- Grillari, J., Grillari-Voglauer, R., Jansen-Durr, P. Post-translational modification of cellular proteins by ubiquitin and ubiquitin-like molecules: role in cellular senescence and aging. Adv. Exp. Med. Biol. 694, 172-196 (2010).
- Bulteau, A. L., Szweda, L. I., Friguet, B. Age-dependent declines in proteasome activity in the heart. Arch. Biochem. Biophys. 397, 298-304 (2002).
- Strucksberg, K. H., Tangavelou, K., Schroder, R., Clemen, C. S. Proteasomal activity in skeletal muscle: A matter of assay design, muscle type, and age. Anal. Biochem. , (2009).
- Bence, N. F., Sampat, R. M., Kopito, R. R. Impairment of the ubiquitin-proteasome system by protein aggregation. Science. 292, 1552-1555 (2001).
- Dantuma, N. P., Lindsten, K., Glas, R., Jellne, M., Masucci, M. G. Short-lived green fluorescent proteins for quantifying ubiquitin/proteasome-dependent proteolysis in living cells. Nat. Biotechnol. 18, 538-543 (2000).
- Lindsten, K., Menendez-Benito, V., Masucci, M. G., Dantuma, N. P. A transgenic mouse model of the ubiquitin/proteasome system. Nat. Biotechnol. 21, 897-902 (2003).
- Liu, J., et al. Impairment of the ubiquitin-proteasome system in desminopathy mouse hearts. FASEB J. 20, 362-364 (2006).
- Bowman, A. B., Yoo, S. Y., Dantuma, N. P., Zoghbi, H. Y. Neuronal dysfunction in a polyglutamine disease model occurs in the absence of ubiquitin-proteasome system impairment and inversely correlates with the degree of nuclear inclusion formation. Hum. Mol. Genet. 14, 679-691 (2005).
- Myung, J., Kim, K. B., Lindsten, K., Dantuma, N. P., Crews, C. M. Lack of proteasome active site allostery as revealed by subunit-specific inhibitors. Mol. Cell. 7, 411-420 (2001).
- Menendez-Benito, V., Heessen, S., Dantuma, N. P. Monitoring of ubiquitin-dependent proteolysis with green fluorescent protein substrates. Methods Enzymol. 399, 490-511 (2005).
- Lener, B., et al. The NADPH oxidase Nox4 restricts the replicative lifespan of human endothelial cells. Biochem. J. 423, 363-374 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados