Síntesis de un complejo de cobalto (II) que transporta oxígeno
Visión general
Fuente: Deepika Das, Tamara M. Powers, Departamento de química, Texas A & M University
Química de Bioinorganic es el campo de estudio que investiga el papel que juegan los metales en la biología. Aproximadamente la mitad de todas las proteínas contienen metales y se estima que hasta un tercio de todas las proteínas dependen de metal-que contienen sitios activos para funcionar. Proteínas que presentan los metales, llamados metaloproteinas, juegan un papel vital en una variedad de funciones de las células que son necesarias para la vida. Metaloproteinas han intrigado e inspirado a químicos inorgánicos sintéticos durante décadas, y muchos grupos de investigación han dedicado sus programas para modelado de la química del metal que contienen sitios activos en proteínas a través del estudio de compuestos de coordinación.
El transporte de O2 es un proceso vital para los organismos vivos. O2-metaloproteinas de transporte son responsables de enlace, transporte, y liberando oxígeno, que puede utilizarse para procesos vitales como la respiración. El complejo de coordinación de cobalto de transportadora de oxígeno, [N,N'-bis(salicylaldehyde)ethylenediimino]cobalt(II) [Co(salen)]2 se ha estudiado extensivamente para entender sobre cómo metales complejos unen reversiblemente O2 . 1
En este experimento, vamos a sintetizar [Co(salen)]2 y estudiar su reacción reversible con O2 en presencia de dimetilsulfóxido (DMSO). En primer lugar, a cuantificar la cantidad de O2 consumido con la exposición de [Co(salen)]2 al DMSO. Luego visualmente observamos la liberación de O2 de la [Co(salen)]2- O2 aducción exponiendo el sólido CHCl3.
Principios
Hay dos organismos polimorfos sólidos de [Co(salen)]2 (activos e inactivos), que puede ser aislado de las condiciones de reacción diferentes. Activos e inactivos [Co(salen)]2 varían en su color (marrón y rojo, respectivamente), estructura y reactividad. Ambos polimorfos consisten en unidades dimérica. En el caso de activos [Co(salen)]2, los centros de cooperación en cada uno de los dos Co(salen)2 moléculas están en proximidad cercana, formando un muy débil van der Waals interacción entre el metal centros (figura 1). Mientras que la forma activa exhiben una débil interacción Co-Co, la separación entre las unidades dimérica proporciona espacio para el O2 reacciona con los centros de Co; como resultado, la forma activa de [Co(salen)]2 reacciona con O2 en el de estado sólido.
En la forma inactiva llamada de [Co(salen)]2, hay una interacción dativo entre el centro de Co de una molécula y un átomo de oxígeno de la otra (figura 1). Las dos Co(salen)2 unidades están más cercanos juntos en comparación con la forma activa y, en consecuencia, la forma inactiva es estable en el aire en el estado sólido y sólo reacciona con O2 en presencia de un disolvente coordinación (como el DMSO), que interrumpe la unidad dimérica y estabiliza la [Co(salen)]2- O2 aducción. Inactivas [Co(salen)]2 es más fácil de manejar y estudiar, ya que el sólido se puede aislar sin utilizar técnicas de aire libre. Por lo tanto, en este experimento se sintetizan inactivo [Co(salen)]2 y estudiar su reacción con el O2 en presencia de DMSO.
Hay varias maneras que puede coordinar O2, una molécula diatómica, a centros metálicos (figura 2). Final en enlace produce un enlace metal-oxígeno a uno de los átomos de oxígeno O2. De lado-en encuadernación, ambos átomos de oxígeno formar enlaces al centro metálico. En algunos casos, la unidad de2 O puentes dos complejos metálicos donde también se observan enlace extremo y lateral.
[Co(salen)]2 formas inactivas un cobalto de 2:1 O2 aducción en presencia del coordinación disolvente DMSO. Los centros O2 unidad puentes los dos cobalto de final en puente forma (figura 3) y moléculas de DMSO coordinadas completan la esfera de coordinación octaédrica de cada uno de los centros de Co. Si tenemos en cuenta el diagrama de MO de O2 y d-orbital partir diagrama para [Co(salen)]2, podemos entender porqué el 2:1 O2 aducción es favorecido (figura 4). O2 muestra un estado triplete con dos electrones no apareados en el π * MOS [Co(salen)]2 es paramagnético, con un electrón desapareado en su σ * dz2 MO (suponiendo cuadrada planar (Dh 4), Co 2 +, 7 de–). La Unión de O2 a [Co(salen)]2 es una reacción redox, donde Co(salen) dos moléculas se oxidan por 1 e– cada uno a un estado de oxidación final de + 3 en cobalto y la molécula de O2 se reduce en 2 e - ,dando por resultado la formación de peróxido de (O2-2). El aducto 1:1 no es favorecido en este caso porque Co(III) es d6 y, por lo tanto, no quiere renunciar a otro electrón (para una revisión sobre la teoría de MO /d-orbital partir, ver el video en teoría de grupos y teoría de la transición de MO Complejos metálicos).
En este video, determinaremos la proporción de2 Co:O con reacción de inactivo [Co(salen)]2 O2 en presencia de DMSO experimentalmente midiendo el volumen de O2 en un sistema cerrado. Podemos utilizar la ley de gas ideal (ecuación 1) para calcular el número de moles de O2 consumido.
PV = nRT (ecuación 1)
P = presión = 1 atm
V = volumen (L)
R = 0,082 L atm mol-1 K-1
T = temperatura (K)
n = moles
Luego estudiaremos la reversibilidad de la Unión de2 O al exponer la resultante sólido [Co(salen)]2- O2-(DMSO)2 cloroformo (CHCl3). Además de CHCl3 (aducción de un solvente no coordinar que no se puede estabilizar la [Co(salen)]2- O2 ) conduce a una disminución en la concentración de DMSO. Principio de le Châtelier puede explicar que a una disminución en la concentración de DMSO, el equilibrio que se muestra en la figura 3 se desplazará hacia los reactantes, lo que resulta en la liberación de gas de2 O.
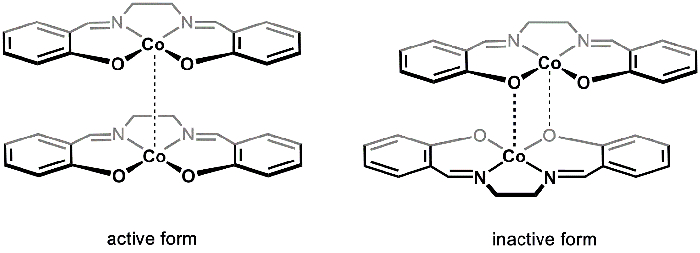
Figura 1. Formas activas e inactivas de [Co(salen)]2.
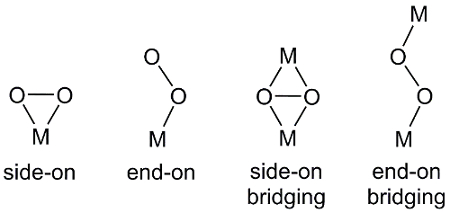
Figura 2. Modos de coordinación de O2 al centro metálico, M.
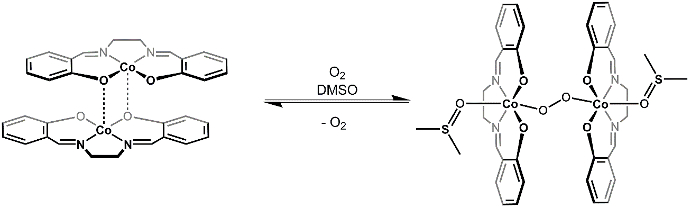
Figura 3. Reacción reversible de O2 con [Co(salen)]2.

Figura 4. Diagrama de MO de O2 y d-orbital partir de diagrama de Co(salen) (derivado de teoría del grupo, asumiendo una geometría cuadrado planar).
Procedimiento
1. síntesis de inactivo [Co(salen)]2
- Un matraz de fondo redondo de 250 mL 3-cuello de carga con 120 mL de 95% EtOH y 2,20 g (0,192 mL, 0.018 mol) de salicylaldehyde.
- Ajuste el cuello de centro con un condensador conectado a N2. Colocar los otros dos cuellos con una membrana de goma y un embudo de adición con una membrana de goma.
- Remover la reacción en un baño de agua y calentar la solución al reflujo (80 ° C).
- Agregar diamina del etileno (0,52 g, 0,58 mL, mol 0.0087) vía jeringa a través del tabique de matraz de fondo redondo.
- En un matraz de fondo redondo de 50 mL, prepare una solución de Co(OAc)2·4H2O (2,17 g, mol 0.0087) en 15 mL de agua destilada. Calentar la solución en el mismo baño de agua que contiene el matraz de cuello de 3 para que todo el acetato de cobalto se disuelva.
- Añadir la solución de acetato de cobalto en el embudo de adición.
- Desgasificar la solución de acetato de cobalto por burbujas de N2 a través del líquido en el embudo de adición durante 10 minutos (ver vídeo de la "Síntesis de un Ti(III) metaloceno usando Schlenk Line técnica" para un procedimiento más detallado en purga de líquidos). El adaptador de2 condensador N deba ser cerrada para permitir que el N2 a burbujear a través de la solución de acetato de cobalto.
Nota: Nunca caliente un sistema cerrado. Asegúrese de que el sistema de ventilación durante la desgasificación. - Añadir lentamente la solución de acetato de cobalto (II) (~ 1 gota/s), agitando vigorosamente la mezcla de etanol. Sin agitación suficiente, formará un precipitado grueso que puede atascarse en la barra de agitación.
- Una vez agregado todo el acetato de cobalto, revuelva la reacción a reflujo durante 1 h.
- Apague la placa caliente y retire el matraz de fondo redondo 3-cuello del baño.
- Retire el embudo condensador y además del frasco. Sumergir el matraz en un baño de hielo para facilitar la precipitación de los [Co(salen)]2.
- Filtrar la solución bajo vacío para aislar el sólido y lavar el sólido resultante rojo con etanol frío.
- Aislar el sólido. Calcular el rendimiento de la reacción y recoger un IR de [Co(salen)]2. Asegúrese de que el [Co(salen)]2 esté seco antes de usarlo en la reacción de absorción de O2 .
2. aparato configuración para O2 absorción (figura 5)1
Nota: Es muy importante que el sistema no gotea. Una fuga en el sistema llevará a una menor de la esperada relación de Co:O2 .
- Conecte una aguja a un cilindro de gas O2 (ultra alta pureza) con tubería de Tygon. Suavemente de la burbuja O2 a 5 mL de DMSO para por lo menos 10 minutos.
- Mientras que el DMSO está siendo saturada con O2, coloque los dos extremos de una pipeta de vidrio graduada de 10 mL con (cada 1,5 pies de longitud) de la tubería de Tygon.
- Coloque un embudo de cristal en una de las piezas de la tubería de Tygon.
- Sujetar la pipeta de vidrio y el embudo en un soporte de anillo para que el embudo esté mirando hacia arriba y el tubo en forma de U ( figura 5).
- Llenar la pipeta y embudo con aceite mineral. Agregue el aceite a través del embudo, asegurándose de que el aceite también llena el tubo conectado a la pipeta. Continuar añadiendo el aceite hasta que el embudo se llena a medio camino encima del embudo. No deje que el aceite de acercarse demasiado a la parte superior del embudo, como el O2 que burbujea a través del embudo puede causar salpicaduras si el embudo es demasiado completo.
- En el extremo abierto del tubo, coloque un tubo de ensayo de brazo lateral (tubo prueba).
- Añadir 50 mg (0.077 mmol) de los inactivos [Co(salen)]2 al tubo de ensayo de brazo lateral un comunicado con la pipeta de cristal.
- Añadir 2 mL de DMSO saturada de O2 a un tubo de ensayo 3 mL (tubo de ensayo B).
- Utilice un par de pinzas para tubo de ensayo suavemente más bajo B en tubo de ensayo A, teniendo cuidado de no derramar alguna del DMSO. Es importante no exponer la [Co(salen)]2 el DMSO en este punto.
- Prueba de tubo con una membrana de goma del sello. Alambre el tabique para evitar fugas.
- Inserte la aguja conectada al tanque de gas de2 O en el tabique y purgar el sistema con O2 durante 10 minutos.
- Retire la aguja de2 O y la parte superior de la membrana de goma para evitar fugas de grasa.
- La presión dentro de la configuración deba ser lanzado para conseguir el aceite con la pipeta de cristal. Para hacer esto, inserte una aguja libre en la membrana de goma en el tubo de ensayo A. tapa la abertura con un dedo y suelte lentamente la presión dentro de la configuración. No se olvide de cubrir el agujero nuevo con grasa para evitar fugas.
- Mueva la pipeta de vidrio y embudo de manera que los niveles de aceite alinean en ambas piezas de la cristalería.
- Registrar el nivel de volumen del aceite dentro de la pipeta de cristal.

Figura 5. O instalación de aparatos de captación de2 .
3. reacción de absorción de2 O
- Agregue el DMSO al sólido [Co(salen)]2 inclinando suavemente los tubos de prueba, asegurándose de que ninguno de la solución entra en el brazo lateral del tubo de ensayo A.
- Una vez agregado todo el DMSO, sostenga la parte superior del tubo de ensayo y mezclar suavemente la solución agitando el tubo de ensayo hacia adelante y hacia atrás.
Nota: No utilice un arriba y abajo sacudiendo movimiento. Golpeen demasiado violentamente los dos tubos de prueba puede conducir a la ruptura del tubo de ensayo A. - Continúan sacuda suavemente los tubos de ensayo con la mano hasta el nivel de aceite en la pipeta de levantamiento (15-20 min.).
- Una vez que cesa el consumo de O2 , mueva la pipeta y el embudo para que el aceite sube de nivel línea.
- Anotar el nuevo nivel de volumen del aceite en la pipeta de cristal. La diferencia de volumen es el volumen de O2 consumido durante la reacción en la atmósfera (1 atm) presión.
- Registrar la temperatura de la habitación.
4. O2 liberación de [Co(salen)]2 - O2 aducción
- Transferir la solución de DMSO resultante del paso 3 para un tubo de centrífuga de 15 mL.
- Llenar un segundo tubo de ensayo con una cantidad equivalente de agua.
- Inserte los tubos de prueba frente a la unos a otros en una centrifugadora.
- Centrifugar la muestra durante al menos 15 minutos. La calidad del pellet sólido resultante mejora con el aumento de tiempo de la centrifugadora.
- Retire suavemente el tubo de ensayo con el [Co(salen)]2- O2 aducción muestra, para no perturbar el sedimento.
- Decantar con cuidado la solución de DMSO sobre el sedimento.
- Sostiene el tubo de centrífuga en un ángulo de 45 ° con el diábolo hacia arriba, lentamente agregar 1 mL de CHCl3 con una pipeta, permitiendo que la solución gotee abajo al lado del tubo de centrífuga.
Resultados
Caracterización de inactivo [Co(salen)]2:

IR (cm-1) recogidos en accesorio de ATR: 2357 (w), 1626 1602 (w), (m), 1528 (w), 1542 (m), 1448 (w), 1454 (m), 1429 (m), 1348 (w), 1327 1323 (w), (m), 1288 (m), 1248 (w), 1236 1197 (w), (m), 1140 (m), 1124 (m), 1089 1053 (w), (m), 1026 (w) , 970 (w), 952 (w), 947 (w), 902 (m), 878 (w), 845 (w), 813 (w), 794 (w), 750 (s), 730 (s).
O2 la absorción:
59,2 mg (0.090 mmol) de [Co(salen)]2 consume 0,002 L de O2. Usando el estándar de la presión y la temperatura registrada en el paso 3.6, el número de moles de O2 consumido fue:

El calculado moles de Co en 0.090 mmol de [Co(salen)]2:

Por lo tanto el cociente de2 Co:O era:
0.180 mmol Co: 0.082 mmol O2
que es equivalente a un cociente de la 2:0.91 de Co O2.
Además de CHCl3 a [Co(salen)]2– O2 aducto:
Además de CHCl3, la CHCl3 solución se puso roja y una corriente de burbujas fue liberada de los sólidos, que indica liberación de gas de2 O y formación de inactivo [Co(salen)]2.
Aplicación y resumen
En este video explicamos las diferentes maneras en que el oxígeno diatómico puede coordinar a centros metálicos. Sintetiza el oxígeno-llevar cobalto complejos [Co(salen)]2 y estudió su unión reversible con O2. Experimentalmente demostró que inactivo [Co(salen)]2 se une reversiblemente O2 y formas un 2:1 Co:O2 aducción en presencia de DMSO.
Todos los vertebrados dependen de la hemoglobina, un metalloprotein encontrado en glóbulos rojos, para el transporte de oxígeno a los órganos respiratorios así como otros tejidos. En hemoglobina, oxígeno reversible une a un grupo hemo que ofrece un centro único de Fe coordinado a un anillo heterocíclico llamado una porfirina (Figura 6a). La hemoglobina no es el único metalloprotein oxígeno-transporte y almacenamiento. Por ejemplo, los moluscos poseen una proteína llamada hemocianina, que cuenta con un sitio activo de dicobre que es responsable del transporte de oxígeno (figura 6b).
Utilizando especies moleculares sintéticas a sitios activos de modelo en metaloproteínas es difícil debido a las diferencias distintas en la estructura electrónica de un compuesto de coordinación simple comparada con la de un metal rodeado por una superestructura de proteína. Como resultado, a menudo es difícil reproducir exactamente la estructura del sitio activo en metaloproteínas. Si bien hay ejemplos de complejos de modelo que imitan estructuralmente metal sitios activos, hay menos ejemplos de complejos de modelo estructural similar que presentan reactividad inherente a la metaloenzima nativo.

Figura 6. (a) la Fe centro de hemoglobina se une al O2 de una manera en extremo, mientras que (b) el sitio de activo que contiene cobre en hemocianina se une al O2 en una puente lateral sobre orientación.
Referencias
- Niederhoffer, E. C., Timmons, J. H., Martell, A. E. Thermodynamics of Oxygen Binding in Natural and Synthetic Dioxygen Complexes. Chem Rev. 84, 137-203 (1984).
- Appleton, T. G. Oxygen uptake by cobalt(II) complex. An undergraduate experiment. J Chem Educ. 54 (7), 443 (1977).
- Ueno, K., Martell, A. E. Infrared Studies on Synthetic Oxygen Carriers. J Phys Chem.60, 1270–1275 (1956).
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Síntesis de un complejo de cobalto (II) que transporta oxígeno
Inorganic Chemistry
51.6K Vistas

Síntesis de un metaloceno Ti(III) utilizando la técnica de línea de Schlenk
Inorganic Chemistry
31.6K Vistas

Guantera y sensores de impureza
Inorganic Chemistry
18.6K Vistas

Purificación de ferroceno por sublimación
Inorganic Chemistry
54.5K Vistas

El método de Evans
Inorganic Chemistry
68.3K Vistas

Difracción de rayos X de monocristal y de polvos
Inorganic Chemistry
104.3K Vistas

Espectroscopía de resonancia paramagnética electrónica (EPR)
Inorganic Chemistry
25.4K Vistas

Espectroscopía de Mössbauer
Inorganic Chemistry
22.0K Vistas

Interacción ácido-base de Lewis en Ph3P-BH3
Inorganic Chemistry
38.8K Vistas

Estructura del ferroceno
Inorganic Chemistry
79.4K Vistas

Aplicación de la teoría de grupos a la espectroscopía infrarroja
Inorganic Chemistry
45.1K Vistas

Teoría del orbital molecular (MO)
Inorganic Chemistry
35.3K Vistas

Enlance cuadruple de metal a metal en complejos de tipo rueda de paletas
Inorganic Chemistry
15.3K Vistas

Celdas solares teñidas con colorante
Inorganic Chemistry
15.8K Vistas

Iniciación fotoquímica de reacciones de polimerización por radicales libres
Inorganic Chemistry
16.7K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados