Synthese eines Sauerstoff-transportierenden Cobalt(II) - Komplex
Überblick
Quelle: Tamara M. Powers, Department of Chemistry, Deepika Das, Texas A & M Universität
Bioanorganische Chemie ist die Studie, die die Rolle untersucht, die Metalle in der Biologie spielen. Etwa die Hälfte aller Proteine Metalle enthalten, und es wird geschätzt, dass bis zu einem Drittel aller Proteine auf metallhaltigen aktive Websites funktionieren verlassen. Proteine, die verfügen über Metalle, genannt Metalloproteine, spielen eine wichtige Rolle in einer Vielzahl von Zellfunktionen, die für das Leben notwendig sind. Metalloproteine haben fasziniert und inspiriert von anorganischen Synthesechemiker seit Jahrzehnten, und viele Forschungsgruppen haben ihre Programme zur Modellierung der Chemie des metallhaltigen active-Standorte in Proteine durch die Untersuchung der Koordination Verbindungen gewidmet.
Der Transport von O2 ist ein wichtiger Prozess für lebende Organismen. O2-Transport Metalloproteine sind verantwortlich für die Bindung, den Transport, und Sauerstoff freigeben, die dann für Lebensvorgänge wie Atmung genutzt werden können. Der Sauerstoff transportierenden Kobalt Koordination Komplex [N,N'-bis(salicylaldehyde)ethylenediimino]cobalt(II) [Co(salen)]2 ist ausgiebig untersucht worden, um zu verstehen über wie Metallkomplexe reversibel binden O2 . 1
In diesem Experiment werden wir synthetisieren [Co(salen)]2 und seine reversible Reaktion mit O2 in Anwesenheit von Dimethylsulfoxide (DMSO) zu studieren. Zuerst werden wir den Betrag von O2 verbraucht unter Einwirkung von [Co(salen)]2 , DMSO quantifizieren. Wir werden dann die Freisetzung von O2 aus [Co(salen)]2- O2 Addukt durch die Aufdeckung des Volumenkörpers auf KCHL3visuell beobachten.
Grundsätze
Gibt es zwei feste polymorphe [Co(salen)]2 (aktive und inaktive), die von verschiedenen Reaktionsbedingungen isoliert werden können. Aktive und inaktive [Co(salen)]2 variieren in ihrer Farbe (braun und rot, beziehungsweise), Struktur und Reaktivität. Beide polymorphe bestehen aus dimeres Einheiten. Im Falle von aktiven [Co(salen)]2, Co Zentren in jedem der zwei Co(salen)2 Moleküle sind in unmittelbarer Nähe, bilden einen sehr schwachen van der Waals Interaktion zwischen dem Metall Zentren (Abbildung 1). Während die Wirkform eine schwache Co-Co-Interaktion aufweist, bietet die Trennung zwischen den dimeres Einheiten Platz für O2 , Co-Zentren zu reagieren; Infolgedessen reagiert das aktive Formular [Co(salen)]2 mit O2 im festen Zustand.
In die so genannte inaktive Form der [Co(salen)]2ist eine Dativ Interaktion zwischen dem Co-Center von einem Molekül und ein Sauerstoffatom aus (Abbildung 1). Die beiden Co(salen)2 Einheiten liegen näher beieinander im Vergleich auf das aktive Formular, und infolgedessen ist die inaktive Form stabil in der Luft in den festen Zustand und nur reagiert mit O2 in der Gegenwart eine koordinierende Lösungsmittel (z. B. DMSO), die stört die dimeres Einheit und die [Co(salen)]2- O2 Addukt stabilisiert. Inaktive [Co(salen)]2 ist einfacher zu handhaben und zu studieren, da der Volumenkörper isoliert werden kann, ohne mit Luft-freie Techniken. Daher in diesem Experiment werden wir synthetisieren inaktiv [Co(salen)]2 und seine Reaktion mit O2 in Anwesenheit von DMSO zu studieren.
Es gibt mehrere Möglichkeiten, die O2, ein zweiatomiges Molekül zu Metall auszusuchen (Abbildung 2) koordinieren können. Ende-auf Bindung resultiert in einer Metall-Sauerstoff-Bindung zu einem der Sauerstoffatome in O2. In seitlich binden, beide Sauerstoff Atome Form Anleihen an das Metallzentrum. In einigen Fällen überbrückt die O2 -Einheit zwei Metallkomplexe, wo Ende auf und seitlich Bindung auch eingehalten werden.
Inaktive [Co(salen)]2 Formen ein 2:1-Kobalt, O2 Addukt im Beisein der koordinierende Lösungsmittel DMSO. O2 Einheit Brücken die beiden Kobalt Zentren in einer Ende-auf bridging Mode (Abbildung 3) und koordinierte DMSO Moleküle vervollständigen die oktaedrischen Koordinationssphäre aller Co-Zentren. Wenn man das MO-Diagramm der O2 und d bedenkt-Orbital Aufteilung Diagramm für [Co(salen)]2, können wir verstehen, warum das 2:1 O2 Addukt begünstigt ist (Abbildung 4). O2 zeigt ein Triplett-Grundzustand mit zwei ungepaarten Elektronen im month [Co(salen)] π *2 ist paramagnetisch, mit einem ungepaarten Elektron in seiner σ * dZ2 MO (vorausgesetzt, quadratisch planar (D4 h), Co 2 +7 de–). Die Bindung von O2 [Co(salen)]2 ist eine Redoxreaktion, wobei zwei Moleküle von 1 e– jeder zu einer endgültigen Oxidationsstufe + 3 bei Kobalt und O2 Molekül oxidiert sind Co(salen) von 2 e reduziert - ,was die Bildung von Wasserstoffperoxid (O22 -). 1:1 Addukt ist nicht in diesem Fall bevorzugt, weil Co(III) d6 ist und daher nicht auf ein anderes Elektron verzichten möchten (für eine Überprüfung auf MO-Theorie /d-Orbital teilen, sehen Sie das Video über Gruppentheorie und MO Theory of Transition Metallkomplexe).
In diesem Video bestimmen wir experimentell Co:O2 Verhältnis bei der Reaktion von inaktiven [Co(salen)]2 mit O2 in Anwesenheit von DMSO durch Messung des Volumens von O2 verloren in einem geschlossenen System. Das ideale Gasgesetz (Gleichung 1) können wir die Anzahl der Muttermale O2 verbraucht berechnen.
PV = nRT (Gleichung 1)
P = Druck = 1 atm
V = Volumen (L)
R = 0,082 L atm Mol-1 K-1
T = Temperatur (K)
n = Muttermale
Wir werden dann die Reversibilität der O2 Bindung prüfen, indem man die resultierende solid [Co(salen)]2- O2-(DMSO)2 um chloroform (KCHL3). Zusatz von KCHL3 (nicht-Koordinierung von Lösungsmittel, die [Co(salen)]2- O2 stabilisieren kann nicht Addukt) führt zu einer Abnahme der Konzentration von DMSO. Le Châtelier-Prinzip kann erklären, dass auf eine Abnahme der Konzentration von DMSO, das in Abbildung 3 gezeigte Gleichgewicht in Richtung der Edukte, was Befreiung von O2 Gas verlagern wird.
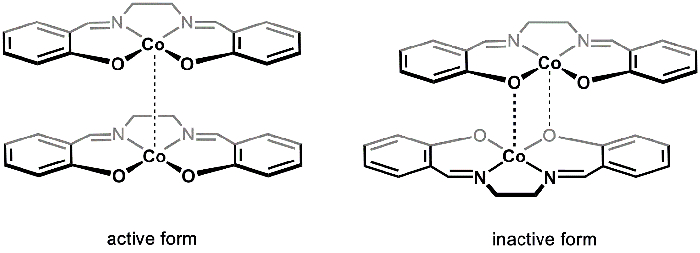
Abbildung 1. Aktive und inaktive Formen von [Co(salen)]2.
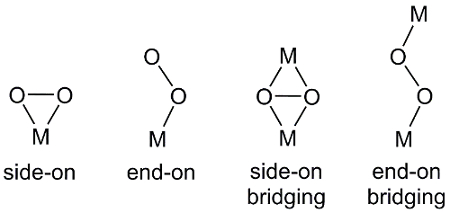
Abbildung 2. Koordination-Modi von O2 Metallzentrum, M.
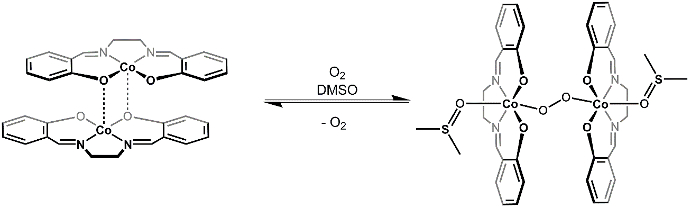
Abbildung 3. Reversible Reaktion von O2 mit [Co(salen)]2.

Abbildung 4. MO-Diagramm der O2 und d-Orbital-Aufspaltung Diagramm des Co(salen) (abgeleitet von Gruppentheorie, quadratisch planare Geometrie vorausgesetzt).
Verfahren
1. Synthese von inaktiven [Co(salen)]2
- Laden Sie eine 250 mL 3-Hals Rundboden Flasche mit 120 mL von 95 % EtOH und 2,20 g (0,192 mL, 0,018 Mol) des Salicylaldehyds.
- Passen Sie die Mitte Hals mit einem Kondensator mit N2verbunden. Passen Sie die anderen beiden Hälse mit ein Gummiseptum und eine Zusatz-Trichter mit einem Gummiseptum ausgestattet.
- Rühren Sie die Reaktion in einem Wasserbad und erhitzen Sie die Lösung zu Reflux (80 ° C).
- Fügen Sie Ethylen-Diamin (0,52 g, 0,58 mL, 0.0087 Mol) per Spritze durch das Septum Rundboden-Kolben.
- Bereiten Sie in einem 50 mL Rundboden Kolben eine Lösung von Co(OAc)2·4H2O (2,17 g, 0.0087 Mol) in 15 mL destilliertem Wasser. Erhitzen Sie die Lösung in der gleichen Wasserbad mit der 3-Hals-Kolben um sicherzustellen, dass alle das Kobalt-Acetat löst sich.
- Fügen Sie die Kobalt-Acetat-Lösung an den Zusatz-Trichter.
- Entgasen von Kobalt-Acetat-Lösung von sprudelnden N2 durch die Flüssigkeit in den Trichter Ergänzung für 10 min (siehe "Synthese von ein Ti(III) Metallocen-Katalysatoren Verwendung Schlenk Linie Technik" Video für eine detailliertere Verfahren auf Spülung Flüssigkeiten). Der Kondensator N-2 -Adapter müssen geschlossen sein, damit um der N2 Blase durch die Kobalt-Acetat-Lösung zu ermöglichen.
Hinweis: Erhitzen Sie nie ein geschlossenes System! Achten Sie darauf, das System während der Entgasung zu entlüften. - Fügen Sie langsam die cobalt(II)-Acetat-Lösung (~ 1 Tropfen/s), die Ethanol-Gemisch kräftig rühren. Ohne ausreichende Rühren ein klobiger Niederschlag bilden, können die Stir Bar Marmelade.
- Sobald alle Kobalt-Acetat hinzugefügt wurden, rühren Sie die Reaktion am Rückfluß 1 h.
- Schalten Sie die Heizplatte und entfernen Sie die 3-Hals-Rundboden-Flasche aus dem Wasserbad.
- Entfernen Sie den Kondensator und Zusatz-Trichter aus der Flasche. Tauchen Sie die Flasche in ein Eisbad, Ausfällung von [Co(salen)]2zu erleichtern.
- Filtern Sie die Lösung unter Vakuum zu isolieren die Solid und der daraus resultierenden roten Feststoffs mit kaltem Ethanol zu waschen.
- Isolieren Sie der Feststoff. Berechnen Sie die Ausbeute der Reaktion und sammeln Sie eine IR [Co(salen)]2zu. Stellen Sie sicher, dass die [Co(salen)]2 trocken ist, bevor Sie es in der O2 Aufnahme Reaktion verwenden.
2. Geräte-Setup für O2 Aufnahme (Abbildung 5)1
Hinweis: Es ist sehr wichtig, dass das System nicht entweicht. Ein Leck im System führt zu einer niedrigeren als erwartet Co:O2 Verhältnis.
- Verbinden Sie eine Nadel mit einem O2 (ultrahohe Reinheit) Gasflasche mit Tygon Schlauch. O2 bis 5 mL DMSO für mindestens 10 min sanft-Blase.
- Während die DMSO mit O2gesättigt wird, passen Sie die beiden Enden einer abgestuften 10 mL Glaspipette mit Tygon Schlauch (jeweils 1,5 ft Länge).
- Legen Sie ein Glastrichter auf eines der Tygon-Schlauch-Stücke.
- Klemme die Glaspipette und den Trichter zu einem Ring zu stehen, so dass der Trichter nach oben zeigt und das Rohr bildet eine U-Form ( Abbildung 5).
- Füllen Sie die Pipette und Trichter mit Mineralöl. Fügen Sie das Öl durch den Trichter, um sicherzustellen, dass das Öl auch die Schläuche mit der Pipette verbunden füllt. Weiterhin das Öl hinzufügen, bis der Trichter etwa auf halber Höhe den Trichter gefüllt ist. Lassen Sie sich nicht das Öl zu nahe an die Spitze des Trichters, als O-2 sprudeln durch den Trichter kann dazu führen, dass Spritzen, wenn der Trichter zu voll ist.
- Zum offenen Ende des Schlauches legen Sie ein Seitenarm Reagenzglas (Test Rohr A).
- Der Seitenarm Reagenzglas einen mit der Glaspipette verbundenen 50 mg (0.077 Mmol) der inaktiven [Co(salen)]2 hinzufügen.
- Hinzugeben Sie 2 mL der DMSO gesättigt mit O2 bis 3 mL Reagenzglas (Reagenzglas B).
- Verwenden der Pinzette, sanft niedriger Reagenzglas B in Reagenzglas A, wobei Sie darauf achten, nicht zu verschütten eines der DMSO. Es ist wichtig, nicht die [Co(salen)]2 , die DMSO an dieser Stelle verfügbar zu machen.
- Test-Rohr A mit ein Gummiseptum zu versiegeln. Verdrahten Sie das Septum um Leckagen zu vermeiden.
- Stechen Sie die Nadel an der O2 -Gas-Tank in das Septum angeschlossen und Säuberung des Systems mit O2 für 10 Minuten.
- Entfernen Sie die O-2 -Nadel und Fett oben auf das Gummiseptum um Leckagen zu vermeiden.
- Einen Teil des Drucks innerhalb der Einrichtung müssen freigegeben werden, um Öl in die Glaspipette. Zu diesem Zweck freien Nadel in die Gummiseptum am Reagenzglas A. Abdeckung der Öffnung mit einem Finger und lassen Sie langsam den Druck innerhalb der Einrichtung. Vergessen Sie nicht, das neue Loch abdecken mit Fett um Leckagen zu vermeiden.
- Bewegen Sie die Glaspipette und Trichter, so dass die Ölstände in beide Stücke Glaswaren aufstellen.
- Die Lautstärke des Öls in die Glaspipette aufnehmen.

Abbildung 5. O2 Aufnahme Gerät einrichten.
3. O2 Aufnahme Reaktion
- Fügen Sie die solide [Co(salen)]2 die DMSO hinzu, indem sanft kippen die Reagenzgläser, um sicherzustellen, dass keiner die Lösung den Seitenarmen des Reagenzglas A. tritt
- Sobald alle die DMSO hinzugefügt wurden, halten Sie die Spitze des Reagenzglases und vorsichtig mischen der Lösung durch Schütteln das Reagenzglas hin und her.
Hinweis: Nicht verwenden Sie eine oben und nach unten Sie schütteln Bewegung. Zwei Reagenzgläser zu heftig zusammen Hämmern kann zum Bruch der Reagenzglas A. führen - Die Reagenzgläser von hand schütteln bis der Ölstand in der Pipette steigende (ca. 15-20 min) nicht mehr weiter.
- Sobald O2 Konsum aufhört, verschieben Sie Pipette und Trichter, sodass das Öl Linie bei einem erhöhen Stufenaufstieg.
- Notieren Sie die neue Lautstärke des Öls in die Glaspipette. Die Volumendifferenz ist das Volumen der O2 verbraucht während der Reaktion bei atmosphärischen (1 atm) Druck.
- Notieren Sie die Temperatur des Raumes.
4. O2 Befreiung von [Co(salen)]2 - O2 Addukt
- Übertragen Sie die resultierende DMSO-Lösung von Schritt 3 auf eine 15 mL Zentrifugenröhrchen.
- Eine entsprechende Menge an Wasser ein zweites Reagenzglas einfüllen.
- Legen Sie die Reagenzgläser einander gegenüber in einer Zentrifuge.
- Zentrifugieren Sie die Probe mindestens 15 min lang. Die daraus resultierende feste Pelletqualität verbessert mit zunehmender Zeit der Zentrifuge.
- Entfernen Sie vorsichtig das Reagenzglas mit dem [Co(salen)]-2- O2 Addukt Probe, um nicht zu stören, das Pellet.
- Dekantieren Sie sorgfältig die DMSO-Lösung über das Pellet.
- Fügen Sie die Zentrifugenröhrchen in einem 45 °-Winkel mit der Kugel nach oben halten, langsam 1 mL KCHL3 mit einer Pipette dadurch, dass die Lösung für die Schattenseite der Zentrifugenröhrchen tropft.
Ergebnisse
Charakterisierung von inaktiven [Co(salen)]2:

IR (cm-1) auf ATR Anlage gesammelt: 2357 (w), 1626 (w), 1602 (m), 1542 (w), 1528 (m), 1454 (w), 1448 (m), 1429 (m), 1348 (w), 1327 (w), 1323 (m), 1288 (m), 1248 (w), 1236 (w), 1197 (m), 1140 (m), 1124 (m), 1089 (w), 1053 (m), 1026 (w) , 970 (w), 952 (w), 947 (w), 902 (m), 878 (w), 845 (w), 813 (w), 794 (w), 750 (s), 730 (s).
O2 Aufnahme:
59,2 mg (0,090 Mmol) [Co(salen)]2 verbraucht 0,002 L O2. Mit standard Druck und die Temperatur im Schritt 3.6 aufgezeichnet, wurde die Anzahl der Muttermale O2 verbraucht:

Die berechneten Maulwürfe Co in 0,090 Mmol [Co(salen)]2:

Daher wurde das Co:O-2 -Verhältnis:
0.180 Mmol Co: 0.082 Mmol O2
Das entspricht einem 2:0.91 Verhältnis von Co, O2.
Zusatz von KCHL3 [Co(salen)]2– O2 Addukt:
Nach Zugabe von KCHL3KCHL3 Lösung wurde rot und ein Strom von Luftblasen aus dem vollen, Angabe Freisetzung von O2 Gas und Bildung von inaktiven [Co(salen)]2befreit wurde.
Anwendung und Zusammenfassung
In diesem Video erklärt wir die verschiedenen Möglichkeiten, dass zweiatomiges Sauerstoff zu Metall Zentralbereich koordinieren kann. Wir den Sauerstoff transportierenden Kobalt komplexe [Co(salen)]2 synthetisiert und studierte die reversible Bindung mit O2. Experimentell haben wir bewiesen, dass inaktive [Co(salen)]2 bindet reversibel O2 und Formen einen 2:1 Co:O2 Addukt in Anwesenheit von DMSO.
Alle Wirbeltiere hängen Hämoglobin, ein Metalloprotein gefunden in den Erythrozyten, um Sauerstoff zu Atmungsorgane sowie anderer Gewebe zu transportieren. Im Hämoglobin bindet Sauerstoff reversibel an eine Häm-Gruppe, bietet ein einziges Fe-Zentrum zu einem heterozyklische Ring genannt ein Porphyrin (Abbildung 6a) koordiniert. Hämoglobin ist nicht die einzige Sauerstoff transportierenden und Lagerung Metalloprotein. Mollusken besitzen beispielsweise ein Protein namens Hemocyanin, die eine Dicopper aktive Situationsmerkmale, die für den Sauerstofftransport (Abbildung 6 b) verantwortlich ist.
Mit synthetischen Molekülsorten, Modell aktiven Zentren in Metalloproteine ist schwierig wegen der deutliche Unterschiede im elektronischen Struktur einer einfachen Koordination Verbindung im Vergleich zu der eines Metalls, umgeben von einem Protein-Überbau. Infolgedessen ist es oft schwierig, genau die Struktur der aktiven Seite in Metalloproteine zu replizieren. Zwar gibt es Beispiele für Modell-komplexe, die strukturell Metall aktiven Websites imitieren, gibt es weniger Beispiele von strukturell ähnlichen Modell-komplexe, die inhärent native Metalloenzyme Reaktivität aufweisen.

Abbildung 6. (ein) die Fe-Center im Hämoglobin bindet an O2 an einem Ende am Wohnort, während (b) Kupfer enthaltenden aktiven Seite in Hemocyanin an O2 in einer überbrückenden seitlich Ausrichtung bindet.
Referenzen
- Niederhoffer, E. C., Timmons, J. H., Martell, A. E. Thermodynamics of Oxygen Binding in Natural and Synthetic Dioxygen Complexes. Chem Rev. 84, 137-203 (1984).
- Appleton, T. G. Oxygen uptake by cobalt(II) complex. An undergraduate experiment. J Chem Educ. 54 (7), 443 (1977).
- Ueno, K., Martell, A. E. Infrared Studies on Synthetic Oxygen Carriers. J Phys Chem.60, 1270–1275 (1956).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Synthese eines Sauerstoff-transportierenden Cobalt(II) - Komplex
Inorganic Chemistry
51.6K Ansichten

Synthese eines Ti(III)-Metallocen-Katalysators mittels Schlenk-Technik
Inorganic Chemistry
31.6K Ansichten

Handschuhbox und Verunreinigungssensoren
Inorganic Chemistry
18.6K Ansichten

Reinigung von Ferrocen durch Sublimation
Inorganic Chemistry
54.5K Ansichten

Die Evans-Methode
Inorganic Chemistry
68.3K Ansichten

Einkristall- und Pulverröntgendiffraktometrie
Inorganic Chemistry
104.3K Ansichten

Elektronenparamagnetische Rezonanzspektroskopie (EPR-Spektroskopie)
Inorganic Chemistry
25.4K Ansichten

Mößbauerspektroskopie
Inorganic Chemistry
22.0K Ansichten

Lewis-Säure-Base-Wechselwirkungen in Ph3P-BH3
Inorganic Chemistry
38.8K Ansichten

Struktur von Ferrocen
Inorganic Chemistry
79.3K Ansichten

Anwendung der Gruppentheorie auf die IR-Spektroskopie
Inorganic Chemistry
45.1K Ansichten

Molekülorbital (MO)-Theorie
Inorganic Chemistry
35.3K Ansichten

Vierfach-metallgeklebte Schaufelräder
Inorganic Chemistry
15.3K Ansichten

Farbstoffsensibilisierte Solarzellen
Inorganic Chemistry
15.7K Ansichten

Photochemische Initiierung von radikalischen Polymerisationsreaktionen
Inorganic Chemistry
16.7K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten