Method Article
Un modelo basado en la línea celular murina de la inhibición crónica de CDK9 para estudiar defectos de alargamiento transcripcional no genéticos generalizados (TEdefinitivamente)en cánceres
En este artículo
Resumen
El protocolo detalla un modelo de carcinoma murino in vitro de alargamiento de transcripción defectuosa no genética. Aquí, la inhibición crónica de CDK9 se utiliza para reprimir el alargamiento productivo del ARN Pol II a lo largo de genes de respuesta proinflamatoria para imitar y estudiar el fenómeno te definitivamente clínicamente sobrecumplido, presente enaproximadamente el 20% de todos los tipos de cáncer.
Resumen
Hemos informado previamente que un subconjunto de cánceres se define por la desregulación transcripcional global con deficiencias generalizadas en el alargamiento de transcripción de ARNm (TE), llamamos cánceres como TEdefinitivamente. En particular, los cánceres TEdefinitivamente se caracterizan por la transcripción espuria y el procesamiento defectuoso de ARNm en un gran conjunto de genes, como las vías de interferón/JAK/STAT y TNF/NF-B, lo que conduce a su supresión. El TEdefinitivamente subtipo de tumores en pacientes con carcinoma de células renales y melanoma metastásico se correlaciona significativamente con una respuesta y un resultado deficientes eninmunoterapia. Dada la importancia de investigar los cánceresDE, ya que augura un obstáculo significativo contra la inmunoterapia, el objetivo de este protocolo es establecer un modelo in vitro de ratón TEpara estudiar estos modelos generalizados y no genéticos anormalidades transcripcionales en los cánceres y obtener nuevos conocimientos, nuevos usos de medicamentos existentes, o encontrar nuevas estrategias contra tales cánceres. Detallamos el uso de la inhibición crónica mediada por flavopiridol CDK9 para abrogar la fosforilación de residuos de serina 2 en el dominio de repetición C-terminal (CTD) de ARN polimerasa II (RNA Pol II), suprimiendo la liberación de ARN Pol II en transcripción productiva Alargamiento. Dado que los cánceres TEdefinitivamente no están clasificados bajo ninguna mutación somática específica, un modelo farmacológico es ventajoso, y mejor imita los defectos transcripcionales y epigenéticos generalizados observados en ellos. El uso de una dosis subletal optimizada de flavopiridol es la única estrategia eficaz para crear un modelo generalizable de alteración generalizada no genética en defectos de elongación de transcripción y procesamiento de ARNm, imitando estrechamente el TE clínicamente observado características definitivamente. Por lo tanto, este modelo de TEdefinitivamente se puede aprovechar para diseccionar, factores autónomos celulares que les permiten resistir el ataque celular mediado inmune.
Introducción
Un paso clave que limita la tasa en la expresión de casi todos los genes activos es la transición del ARN polimerasa II (RNA Pol II) de la pausa promotor-proximal a la elongación productiva1,2. Dado que la desregulación epigenética de la elongación transcripcional ayuda en la progresión de múltiples neoplasias malignas humanas definidas como TEdefinitivamente,lo que conduce a una señalización subóptima en las vías de respuesta proinflamatoria que equivalen a una respuesta deficiente y el resultado de la inmunoterapia3, el objetivo general de este protocolo es establecer un modelo in vitro útil para estudiar estas anomalías transcripcionales no genéticas generalizadas en los cánceres. En este sentido, el uso de la inhibición farmacológica crónica de CDK9 es una estrategia eficaz para crear un modelo generalizable de interrupción generalizada no genética en el alargamiento de transcripción y defectos de procesamiento de ARNm. La razón de ser detrás del uso de la inhibición crónica de CDK9 es que abroga la fosforilación de los residuos de serina 2 en el dominio de repetición C-terminal (CTD) del ARN Pol II, reprimiendo así la liberación de ARN Pol II en el alargamiento de transcripción productiva. Además, los cánceres TEdefinitivamente, descritos previamente por nuestro grupo3,no están clasificados bajo ninguna mutación somática específica. Por lo tanto, un modelo no genético (farmacológico) es ventajoso y mejor imita los defectos transcripcionales y epigenéticos generalizados observados en ellos. El método aquí en aquí detalla la generación y caracterización del modelo de tratamiento crónico de flavopiridol de las células cancerosas murinas. Este método interrumpe de manera demostrable el alargamiento de la transcripción a lo largo de genes caracterizados por longitudes genómicas más largas, con promotores preparados y expresiones inducibles como TNF/NF--B e señalización de interferón/STAT, profundamente controlados a nivel de alargamiento de transcripción3,4,5. En general, este modelo optimizado de la línea celular murina de defectos de alargamiento transcripcional, el único modelo de nuestro conocimiento para estudiar los tumores TEdefinitivamente recién descritos, impulsa la resistencia al ataque inmune antitumoral, haciendo un sistema útil para explotar y explotar y examinar las vulnerabilidades de los defectos no genéticos en la maquinaria de transcripción de núcleos en cánceres frente al ataque celular mediado por el sistema inmunitario.
Protocolo
El Comité Institucional de Cuidado y Uso de Animales y el Comité Institucional de Bioseguridad de la Fundación de Investigación Infantil de Cincinnati aprobaron todos los procedimientos experimentales de animales (protocolo #2017-0061 del IBC y protocolo IBC #IBC2016-0016), y estos Los experimentos se llevaron a cabo de acuerdo con las normas descritas en la Guía de los NIH para el Cuidado y Uso de Animales de Laboratorio.
1. Inhibición crónica del ARN Pol II por tratamiento con flavopiridol— estrategia básica
- Células de melanoma de ratón serie B16/F10 en baja densidad (0,2 x 106) en una placa de cultivo de 10 cm en su medio correspondiente (medio de águila modificado de Dulbecco [DMEM], 10% de suero bovino fetal [FBS], 1% penicilina y estreptomicina [Pen/Strep]) e incubar durante la noche en una incubadora humidificada de 37oC, 5%CO2.
- Al día siguiente, lave las células con 1 solución salina tamponada con fosfato (PBS) y agregue un nuevo lote de medios de cultivo con una dosis subletal (estimada como 25 nM) de flavopiridol, un inhibidor del factor de alargamiento RNA Pol II p-TEFb (ciclina T/CDK9)— durante una semana sin más sub-cultivo.
- Después de una semana de tratamiento con flavopiridol, realice ensayos confirmatorios para evaluar la capacidad del modelo para recapitular varios atributos de defectos de alargamiento transcripcional vistos en los cánceres TEdefinitivamente.
2. Ensayo de inmunoblot confirmatorio para evaluar la función de ARN Pol II defectuosa y el deterioro de la vía de interferón (IFN) y la señalización del factor de necrosis tumoral (TNF) en el modelo de ratón generado TEdefinitivamente
- Cultivo igual número (105) de células de melanoma de ratón B16/F10 tratadas con flavopiridol y células parentales de melanoma de ratón B16/F10 en dos conjuntos diferentes de 12 placas de pozo (un conjunto para la caracterización funcional del ARN Pol II y el otro conjunto para la citoquina estimulación) a 37 oC en una incubadora humidificada de CO2 al 5% durante la noche.
- Al día siguiente, trate las células en el conjunto de estimulación de citoquinas con el ratón IFN-o, IFN-o (5 ng/ml) o TNF-o (5 ng/ml) durante 45 min a 37 oC.
- Ahora, extraiga la proteína de las células en los conjuntos de caracterización funcional de citoquinas y ARN Pol II utilizando un tampón de lisis de radioinmunoprecipitación (RIPA) de la siguiente manera:
- Lave las células con 1x PBS y lise con 50 éL del tampón de lisis por poca. Raspa, y luego peletlas las células lysed a 4 oC, 21,130 x g.
- Mida la proteína en los sobrenatantes de lisado celular utilizando un ensayo colorimétrico estándar para la concentración de proteínas después de la solubilización detergente (Bradford o un ensayo similar).
- Cargue la misma cantidad de proteína medida (15 g) de cada muestra para funcionar en un gel de poliacrilamida de dodecilo sódico (SDS) de 4%-18%, y transfiéralos a membranas de difluoruro de polivinilideno (PVDF).
- Bloquear las membranas PVDF en leche seca al 5% en solución salina-polisorbato 20 (TBST) tris tamponado (TBST) durante 1 h seguida de una incubación durante la noche a 4oC con anticuerpos primarios (RNA Pol II 1:1000; p-SER2 RNA Pol II 1:1000; p-SER5 RNA Pol II 1:1000; H3K36me3 1:2000; total H3 1:2000; STAT1 1:1000; p-STAT1 1:1000; NF-B 1:1000; p-NF-B 1:1000; 1:5000) en albúmina sérica bovina al 5%.
- Al día siguiente, lave las membranas PVDF con 1 x TBST durante 15 minutos a temperatura ambiente (RT) e incubarlas con anticuerpos secundarios apropiados (antirrat [1:5000] para RNA Pol II, p-SER2 RNA Pol II y p-SER5 RNA Pol II; anticonejo (1:5000) para H3K36me3, Total H3, STAT1, p-STAT1, NF-B y p-N-B) durante 50 min en RT. Detectar las señales proteicas utilizando sustrato de peroxidasa de rábano picante (HRP) disponible comercialmente con quimioluminiscencia mejorada.
NOTA: El primario de Actin utilizado es conjugado por HRP, por lo tanto, se puede desarrollar sin una secundaria.
3. Ensayo confirmatorio para evaluar defectos de procesamiento de ARNm en el modelo de ratón generado TEdefinitivamente
- Número igual de semillas (0,2 x 106) de células de melanoma de ratón B16/F10 tratadas con flavopiridol y células de melanoma de ratón parentales B16/F10 en placas de 6 pocillos a 37 oC en una incubadora humidificada de CO2 al 5% durante la noche.
- Extraiga el ARN total de las células cultivadas al 60% de confluencia utilizando un reactivo o kit de extracción de ARN(Tabla de materiales).
- Agotar el ARNR del ARN total extraído de la siguiente manera:
NOTA: Se ha cooptado un protocolo de entrada baja de un kit disponible comercialmente para agotar el ARNm- Establezca un baño de agua o un bloque de calor a 70 oC y otro baño de agua o bloque de calor a 37 oC.
- Añadir el ARN total (100 a 500 ng en 2 l de agua libre de nucleasas) con 1 l de sonda de agotamiento de rRNA selectiva y 30 l de tampón de hibridación en un tubo de microcentrífuga, mezclar suavemente por vórtice e incubarlo a 70 oC durante 5 minutos.
- Ahora, transfiera los tubos a un bloque de calor/baño de agua de 37 oC, y permita que la muestra se enfríe a 37 oC durante un período de 30 minutos.
- Resuspenda las perlas magnéticas de la sonda de agotamiento de rRNA selectiva por vórtice y la alícuota de 75 ml de perlas en un tubo de microcentrífuga libre de RNase de 1,5 ml.
- Coloque la suspensión del cordón en un separador magnético durante 1 min. Aspirar suavemente y desechar el sobrenadante. Repita el lavado de las perlas una vez más añadiendo 75 ml de agua libre de nucleasas y desechando el sobrenadante después de la separación magnética.
- Resuspender las perlas lavadas en 75 oC de tampón de hibridación, y la alícuota de 25 oL de él a otro tubo y mantenerlas a 37 oC para su uso posterior.
- Coloque las perlas restantes de 50 l en un separador magnético durante 1 min y deseche el sobrenadante. Resuspenda las perlas en 20 s de búfer de hibridación y manténgalos a 37 oC para su uso posterior.
- Después de la refrigeración de la mezcla de la sonda de agotamiento de ARN/RRNA selectivo a 37 oC durante 30 minutos, centrifugar brevemente el tubo para recoger la muestra en la parte inferior del tubo.
- Transfiera 33 oL de la mezcla de la sonda de agotamiento de ARN/ARNm selectivo a las perlas magnéticas preparadas desde el paso 3.3.7. Mezclar por vórtice a baja velocidad.
- Incubar el tubo a 37oC durante 15 min. Durante la incubación, mezcle suavemente el contenido ocasionalmente. Seguido de una breve centrifugación para recoger la muestra en la parte inferior del tubo.
- Coloque el tubo en un separador magnético durante 1 min para peletizar el complejo de sonda rRNA. Esta vez no descartes el sobrenadante. El sobrenadante contiene ARN agotado por rRNA.
- Coloque el tubo de 25 s de perlas del paso 3.3.6 en un separador magnético durante 1 min. Añade el sobrenadante del paso 3.3.11 al nuevo tubo de cuentas. Mezclar por vórtice a baja velocidad.
- Incubar el tubo a 37oC durante 15 min. Durante la incubación, mezcle suavemente el contenido ocasionalmente. Centrifugar brevemente el tubo para recoger la muestra en la parte inferior del tubo.
- Coloque el tubo en un separador magnético durante 1 min para peletizar el complejo de sonda rRNA. No deseche el sobrenadante. Transfiera el sobrenadante (alrededor de 53 ol) que contiene ARN agotado por rRNA a un tubo nuevo.
- Mida la concentración del rendimiento del ARN mediante un espectrofotómetro.
- Utilice la mitad de las muestras agotadas por rRNA como entrada a perlas magnéticas que contienen oligo (dT)25 para extraer poliA+ ARN de la siguiente manera:
NOTA: Este protocolo de aislar el ARN mensajero de cola poliA utilizando secuencias de dT oligo enlazadas a la superficie de las perlas magnéticas ha sido cooptado desde un kit disponible comercialmente(Tabla de materiales).- Resuspenda las perlas de oligo dT en el vial vórtinas brevemente para >30 s y transfiera 200 s de perlas de dT de oligo a un tubo. Agregue el mismo volumen (200 l) del búfer de enlace y vuelva a suspender.
- Coloque el tubo en un imán durante 1 min y deseche el sobrenadante. Ahora, retire el tubo del imán y vuelva a suspender las perlas de dT de oligo lavadas en 100 s de tampón de unión.
- Ajuste el volumen de la muestra de ARN total agotada por rRNA de entrada a 100 ml con 10 mM Tris-HCl pH 7.5. Ahora, agregue 100 s l de búfer de enlace.
- Caliente a 65 oC durante 2 min para interrumpir las estructuras secundarias de ARN. Ahora, inmediatamente colóquelo en hielo.
- Añadir los 200 ml de ARN total a las cuentas lavadas de 100 l. Mezcle bien y permita la unión girando continuamente en un rotor durante 5 minutos a RT.
- Coloque el tubo en el imán durante 1-2 minutos y retire cuidadosamente todo el sobrenadante y retire cuidadosamente todo el sobrenadante.
- Retire el tubo del imán y agregue 200 ml de búfer de lavado.
- Mida la pureza y concentración del poliA+ ARN extraído mediante un espectrofotómetro.
NOTA: Se considera aceptable una relación de 260/280 de 1,90 a 2,00 y una relación de 260/230 de 2,00 a 2,20 para todas las muestras de ARN. - Utilice la mitad restante de las muestras agotadas por rRNA de la sección 3.3 como entrada a las columnas de proteína A (proporcionadas en el kit de inmunoprecipitación [RIP], Tabla de materiales)para inmunopreciar los ARN tapados de cinco primas utilizando ARN monoclonal7-metilguanosina anticuerpos de la siguiente manera:
NOTA: Este protocolo de ARN mensajero con tapa m7G de aislación utilizando un kit de inmunoprecipitación de ARN disponible comercialmente ha sido cooptado y modificado aún más.- Lavar las perlas magnéticas de proteína A obtenidas del kit RIP de acuerdo con el protocolo del fabricante para pre-unir el anticuerpo a las perlas.
- Transferir 3 g de anticuerpo de 7-metilguanosina (el IgG de conejo proporcionado en el kit se puede utilizar el control negativo) a las perlas en un tubo de microcentrífuga suspendido en tampón de lavado de 100 l del kit.
- Incubar con rotación a baja velocidad durante 30 minutos en RT. Centrifugar tubos brevemente y luego colocar los tubos en un separador magnético, quitar y desechar el sobrenadante.
- Retire brevemente los tubos y añada 500 ml de tampón de lavado del kit y del vórtice. Centrifugar los tubos brevemente seguido sin una vez más, retirar y desechar el sobrenadante.
- Repita el paso 3.6.4 una vez más.
- Añadir alrededor de 120 ng de ARNm agotado (de la sección 3.3) a los perlas enlazadas a anticuerpos de 7-metilguanosina prelavadas. Añadir 1 l de inhibidor de la rnalosa. Incubar a RT durante 1 x 1,5 h con agitación leve.
- Gire las perlas a 300 x g durante 10 s y retire el mRNA sin tapar (no 7-metilguanosina) a un nuevo tubo de microcentrífuga.
- Añadir 100 l de tampón de lavado y lavarlo dos veces más de forma similar. Aunar el sobrenadante recogido en el mismo tubo de microcentrífuga etiquetado sin tapar (no 7-metilguanosina) ARNm. Almacenar en hielo.
- Eluir el ARNm tapado (7-metilguanosina) de las perlas con 300 l de tampón de lisis de urea (ULB) que contiene 7 M de urea, 2% SDS, 0,35 M NaCl, 10 mM EDTA y Tris de 10 mM, pH 7,5 calentando las perlas a 65 oC durante 2 x 3 minutos.
- Mezclar 300 l de las muestras elutadas (arNM tapado y sin tapar) con 300 l de fenol:cloroformo:alcohol isoamilo (25:24:1; disponible comercialmente) (almacenado a 4 oC). Mezclar bien invirtiendo y dejar durante unos 10 minutos y luego mezclar de nuevo suavemente.
- Centrifugar a 18.928 x g durante 2 min y pipetear cuidadosamente la capa superior a un tubo fresco y deseche la capa inferior.
- Añadir 300 oC de fenol:cloroformo:alcohol isoamilo (25:24:1; almacenado a 4 oC) a las muestras. Mezclar bien invirtiendo y luego centrifugar a 18.928 x g durante 1 min. Cuidadosamente, pipetee la capa superior a un tubo nuevo y deseche la capa inferior.
- Añadir 300 s de 2-porpanol y 30 l de acetato de sodio de 3 M (pH 5.2) al ARN tapado y sin tapar. Invierta la muestra unas cuantas veces y colóquela a -20 oC durante 20 h.
- Ahora, centrifugar las muestras a 18.928 x g durante 10 min a 4oC. Retire con cuidado el sobrenadante y agregue 500 s de etanol al 70%.
- Centrífuga de nuevo a 18.928 x g durante 10 min a 4oC. Deseche cuidadosamente el sobrenadante y seque el pellet en RT durante menos de 5 minutos.
- Mida la pureza y concentración del rendimiento del ARN mediante un espectrofotómetro. La relación 260/280 debe estar en el rango de 1,90 a 2,00, y la relación 260/230 en el rango de 2,00 a 2,20 para todas las muestras de ARN.
4. Ensayo confirmatorio para evaluar la respuesta del modelo de ratón TEdefinitivamente a la muerte celular mediada por FasL
- Número igual de semillas (30.000 células) de células de melanoma de ratón B16/F10 tratadas con flavopiridol y células de melanoma de ratón parentales B16/F10 en una placa de cultivo de 96 pocillos en su medio correspondiente (DMEM), e incubar durante la noche en un 37 oC, 5% COhumidificado Incubadora.
- Tratar las células en una campana de cultivo con diferentes concentraciones de hsu6FasL (0,1 x 1000 ng/ml) en presencia de 10 g/ml de anticuerpo s/su anticuerpo e incubar durante 24 h a 37 oC, una incubadora humidificada de CO 2 al 5% deCO2.
- Retire las células muertas lavándolo con 1 búfer PBS. Fijar las células adjuntas en 4% paraformaldehído durante 20 minutos en RT. Deseche el 4% paraformaldehído (sin necesidad de lavar), y manchar con solución violeta cristalina (20% metanol, 0.5% violeta de cristal en 1x PBS) durante 30 min.
- Retire el exceso de manchas encerrando suavemente las placas en el agua del grifo. Mantenga las placas para que se sequen en RT.
- Vuelva a disolver el cristal violeta en 100 ml de 1 tensioactivo no iónico disuelto en 1x PBS, y mida la densidad celular midiendo la absorbancia a 570 nm en un lector de microplacas.
5. Ensayo exploratorio para evaluar la respuesta del ratón TEdefinitivamente modelo al ataque de células T citotóxica específico antígeno
- Aislamiento y activación del ataque de células T citotóxicas OT-I CD8+ (CTL)
- Purifique las células CD8+ de los bazos de los ratones OT-I TCR Tg RAG-1/o mediante la separación de células magnéticas utilizando un kit de aislamiento de células T CD8 de ratón de la siguiente manera:
- Cosecha dos bazos de dos ratones OT-I TCR Tg RAG-1o/o en medios RPMI completos.
- Machacar los bazos en un filtro de 70 m mantenido en un tubo de 50 ml lleno de 20 ml de RPMI, utilizando la parte posterior de una jeringa hasta que sólo se deje grasa en el filtro.
- Centrifugar el flujo a 220 x g durante 5 min a 4 oC. Descarta el sobrenadante.
- Añadir 1 ml de tampón de lisis de glóbulos rojos (RBC) al pellet de bazo del paso de centrifugación anterior y pipetear la mezcla durante 1 min.
- Neutralice la solución sumando hasta 10 ml de RPMI.
- Centrífuga a 220 x g durante 5 min a 4oC. Deseche el sobrenadante y resuspenda en 10 ml de RPMI.
- Toma una pequeña alícuota para contar. Centrifugar el resto a 220 x g durante 5 min a 4oC.
- Por cada millón de células contadas, resuspende el pellet en 1 ml de búfer del sistema de separación magnética disponible comercialmente (buffer de Mojo o un búfer similar).
- Preparar un cóctel de anticuerpos de volumen de 100 ml por cada 1 ml de células peletadas en el paso 5.1.1.8. El cóctel de anticuerpos incluye: biotina anti-CD4, CD105, CD45R/B220, CD11c, CD49b, TER-119, CD19, CD11b, TCR á/o y CD44.
- Añadir este cóctel a las células peletadas de 1 ml y mantener en hielo durante 15 minutos.
- Añadir 100 l de perlas magnéticas (streptavidin) a cada 100 ol del cóctel de anticuerpos añadido a las células de bazo peletizado resuspendidas de 1 ml. Mantener en hielo durante 15 minutos.
- Añadir 7 ml de búfer de sistema de separación magnética disponible comercialmente. Ahora, alícuota de unos 3 x 4 ml de la mezcla a un tubo nuevo. Mezcle bien y fijarlo al imán durante 5 min.
- Decantar el líquido (contiene células CD8+) a un tubo fresco en el hielo. Ahora, alícela los 3 x 4 ml restantes de la mezcla desde el paso 5.1.1.12 hasta el tubo y fijelo al imán durante 5 minutos. Decant el líquido (segundo lote de células CD8+ aisladas) al mismo tubo que contiene el primer lote de células CD8+ mantenidas en hielo.
- Semilla sin diseño de fibroblastoadherente APC-(MEC. B7. SigOVA) para expresar una línea específica de ovalbumina (OVA) derivada de H-2Kb, epítopo de péptido restringido Por H-2Kb OVA257-264 (SIINFEKL), junto con la molécula coestimulante B7.1, a 75.000 células por pozo en placas de 24 pocillos, a 37 oC, 5% co2 incubadora humidificada.
NOTA: El fibroblasto adherente utilizado es un regalo del laboratorio de la Dra. Edith Janssen en CCHMC. La línea fue creada originalmente en el laboratorio del Dr. Stephen P. Schoenberger en el Instituto La Jolla para la Alergia e Inmunología6. - Después de 24 h, lave la monocapa de APC una vez con el medio modificado de Dulbecco (IMDM) de Iscove disponible comercialmente con tampón HEPES, piruvato sódico, L-glutamina y glucosa alta), y agregue 0.5 x 106 células de OT-I CD8+ ingenuas (del paso 5.1.1.13) en 2 ml de IMDM complementado con 50 mM-ME, 2 mL EDTA, 4 mM L-glutamina y HEPES y 10% FBS.
- Después de 20 h, cosechar suavemente las células OT-I no adherentes (mediante la recolección de los medios en el plato de cultivo con células OT-I flotantes y peletizar las células a 191 x g durante 2 min; contar las células OT-I viables) y transferirlas para el cocultivo.
- Purifique las células CD8+ de los bazos de los ratones OT-I TCR Tg RAG-1/o mediante la separación de células magnéticas utilizando un kit de aislamiento de células T CD8 de ratón de la siguiente manera:
- Cocultivo de células CD8+ con células B16/F10-OVA
- Células CD8+ derivadas de OT-I de semilla en una proporción de 1:1 (300.000 células cada una) en un cocultivo con B16/F10 (que carece del antígeno ovalbumin), células B16/F10-OVA no tratadas y células B16/F10-OVA pretratadas con flavopiridol (25 nM) durante 1 semana, en 6 pozos con DME completos con DME medios durante 20 h a 37oC en una incubadora humidificada deCO2 al 5%.
- Después de 20 h, retire las células CD8+ derivadas de OT-I (mediante la recopilación de los medios en la bandeja de cultivo con celdas CD8+ derivadas de OT-I flotantes). Lave las células B16/F10-OVA adherentes en 1x PBS.
- Pruebe los tres grupos de células B16/F10-OVA conectadas en 0.05% EDTA que contienen trippsina durante 5 min. Pelet las células trippsinizadas a 191 x g durante 5 min.
- Manchar las células b16/F10-OVA cosechadas incubando en PBS frío (que contiene 0,5% FBS y 0,05% azida sódica) con tinte de viabilidad y anticuerpos etiquetados relevantes (teñido de tinción de viabilidad fijable e780, ratón conjugado AF647 CD8 y ratón conjugado BV421 CD45 ).
- Analice la viabilidad de los tres grupos de células B16/F10-OVA por citometría de flujo.
Resultados
Aquí, proporcionamos un esquema detallado (Figura 1) para establecer un modelo de células TEdefinitivamente obtenido por tratamiento crónico subletal(Figura 2) con flavopiridol a 25 nM. En la Figura 3, en 3 días de tratamiento con flavopiridol, las células OVA B16 muestran características parciales de TEdefinitivamente, pero después de una semana de tratamiento, las células OVA B16/F10 muestran una pérdida profunda de fosforilación en la posición de la serina 2 en el CTD de ARN Pol II a lo largo de con una disminución significativa de H3K36me3, una modificación de la histona implicada en la definición de los límites de exón y un inhibidor de transcripciones crípticas desbocadas. Como consecuencia, el modelo de célulasin TE muestra defectos críticos de procesamiento de ARNm con proporciones manifiestamente mayores de ARNm mal tapados y no adenilados(Figura 4A,B). Además, la represión específica de los genes clave de la vía de respuesta inflamatoria y la vía de muerte celular mediada por FasL se ven en la Figura 5 y la Figura 6. La resistencia impuesta al interferón (IFN--, IFN) y el TNF-o estimularon la fosforilación de STAT1 y NF-B, y la resistencia a la muerte celular por el ligando del receptor de la muerte Y FasL reduce drásticamente la citotoxicidad de un ataque de células inmunitarias contra TEdefinitivamente Tumores. Estas técnicas de confirmación están diseñadas para probar el grado de influencia que la perturbación crónica de la elongación de transcripción tiene en una amplia gama de genes sensibles al estímulo, y si tal perturbación en un modelo de línea celular de ratón dado es lo suficientemente adecuada para provocar una escasez aguda de ARNm funcional en los genes de señalización de respuesta inflamatoria, imitando las características básicas de los cánceres de TEdefinitivamente clínicamente. Basándonos en nuestro estudio del tratamiento con flavopiridol, la supresión de la fosforilación en el segundo residuo de serina (pSER2) de ARN Pol II CTD es crítica, ya que marca el alargamiento de la transcripción. Una dosis subletal para cualquier línea celular de carcinoma de ratón determinada debe lograr una reducción en los niveles de pSER2 además de tener un efecto insignificante en la tasa de crecimiento y viabilidad de la línea celular. Aunque vemos consistentemente una reducción en los niveles de pSER2 y H3K36me3 en los tratamientos de flavopiridol de 25 nM, no garantiza una represión de los niveles de pSTAT1 y pNF-B (en las estimulaciones IFN-, IFN y TNF, respectivamente). Cada línea celular de carcinoma de ratón es única (células B16/F10 OVA o CT26 cultivadas en diferentes laboratorios durante un período de tiempo pueden tener efectos ligeramente alterados) y pueden tener JAK1 o CCNT1 parcialmente rescatando los efectos del flavopiridol en la supresión de la genes de la vía de respuesta inflamatoria. En tales casos, es posible que sea necesario comprobar la cinética de los niveles de pSTAT1 y pNF-B en diferentes puntos de tiempo (5-70 min) para comprender la temporalidad de los efectos mediados por flavopiridol y su rescate por JAK1 o CCNT1. En consecuencia, es posible que sea necesario derribar JAK1 y/o CCNT1 para establecer este modelo.
Una vez establecido y caracterizado el modelo flavopiridol utilizando los ensayos antes mencionados, proporcionamos un ensayo exploratorio para comprobar si el modeloTE definitivamente celular confiere resistencia al ataque citotóxico de células T (CTL). Basado en nuestro protocolo optimizado, las células B16/F10 tratadas con flavopiridol que presumian de forma estable el gen OVA (B16 OVA) coincubado con los CTL CD8+ activados (específicos para el epítopo OVA257-264) que tienen toxicidad selectiva para las células que expresan los óvulos (un regalo del Dr. El laboratorio6de Stephen P. Schoenberger no era susceptible a la lisis tumoral mediada por el CTL OT-I. Las células OVA B16/F10 (no pretratadas con flavopiridol) fueron sometidas a una muerte celular masiva en este sistema, mientras que las células parentales B16/F10 sobrevivieron, ya que no expresan antígeno OVA(Figura 7). Del resultado del ensayo exploratorio sugerido se desprende claramente que la TE crónica inducida por flavopiridoldefinitivamente puede otorgar un medio para escapar del ataque inmune antitumoral incluso in vivo. Esto se puede probar aún más en modelos de tumores in vivo para comprobar la propensión de los modelos TEdefinitivamente para escapar de las respuestas inmunitarias antitumorales innatas y adaptativas. Los tratamientos antiasiáticos podrían utilizarse para regular la actividad de las células NK in vivo en ratones con tumores. Además, la terapia de punto de control inmune (anti-CTLA4 y anti-PD1) se puede administrar a ratones tedefinitivamente portadores de tumores.
En su totalidad, los ensayos confirmatorios deTE, junto con el ensayo exploratorio sugerido en conjunto, demuestran la utilidad de incorporar este modelode células TE definitivamente en una serie de otras condiciones de prueba tumoral-inmune. Este modelo puede ayudar a analizar los detalles moleculares resultantes de un alargamiento transcripcional defectuoso en las células tumorales y su respuesta a las interacciones de las células inmunitarias.

Figura 1: Representación esquemática del flujo de trabajo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Características de crecimiento celular de las células de OVA B16 tratadas crónicamente con flavopiridol en dosis bajas: Viabilidad (medida por reactivo de viabilidad) de las células de control y tratadas con flavopiridol B16 OVA a los días indicados después del tratamiento. Esta cifra ha sido modificada de Modur et al.3. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ensayo confirmatorio para evaluar el ARN Pol II y el perfil de histona: Inmunoblots de marcas de histona indicadas y ARN Pol II en células OVA B16 tratadas con flavopiridol durante 72 h o 1 semana. Esta cifra ha sido modificada de Modur et al.3. Haga clic aquí para ver una versión más grande de esta figura.
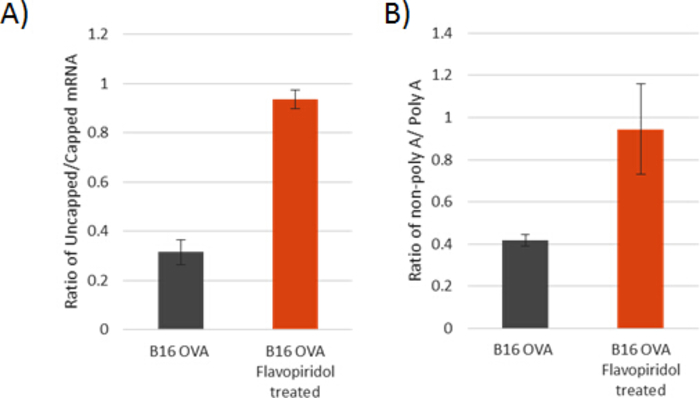
Figura 4: Ensayo confirmatorio para evaluar defectos graves en el procesamiento de ARNm. Ratios de 5o sin límite a 5o(A) y concentraciones de ARNm de 3o no poliadeniladas a 3o poliadeniladas(B)después del agotamiento del ARNR en las líneas celulares indicadas. Las barras de error representan una desviación estándar basada en tres réplicas técnicas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Ensayo confirmatorio para evaluar el perfil de estimulación de la citoquina. Inmunoblots de células OVA B16, IF1, NF-B y p NF-B en control y flavopiridol pretratadas b16 estimuladas con IFN-, IF-N o TNF-, durante 30 minutos a 5 ng/ml). Esta cifra ha sido modificada de Modur et al.3. Haga clic aquí para ver una versión más grande de esta figura.
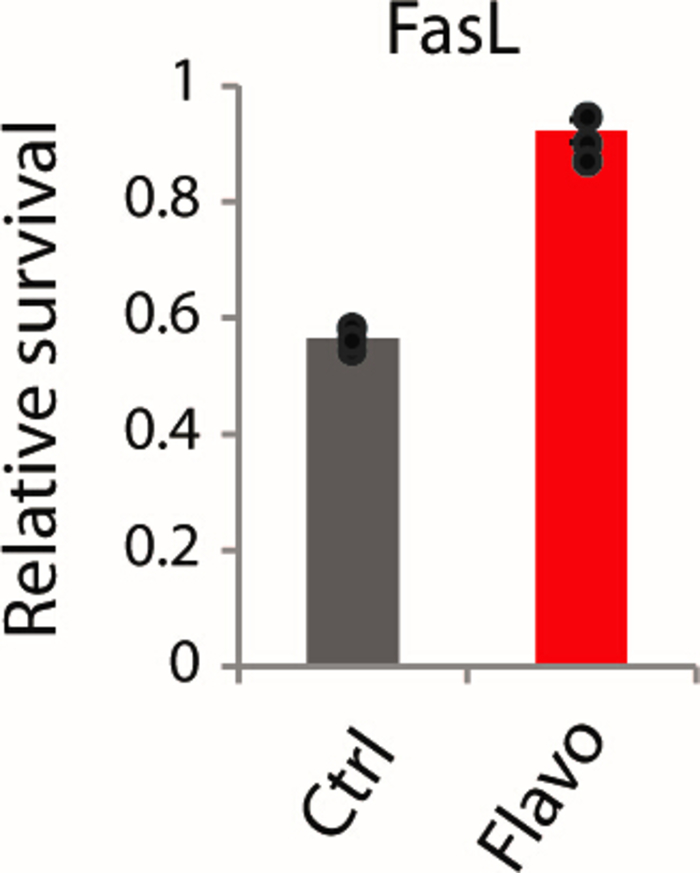
Figura 6: Ensayo confirmatorio para evaluar la resistencia a la muerte celular mediada por FasL in vitro. Control y flavopiridol pre-tratado b16 CÉLULAs OVA tratadas con FasL para 24 h de lectura medida por ensayo de viabilidad. Esta cifra ha sido modificada de Modur et al.3. Haga clic aquí para ver una versión más grande de esta figura.
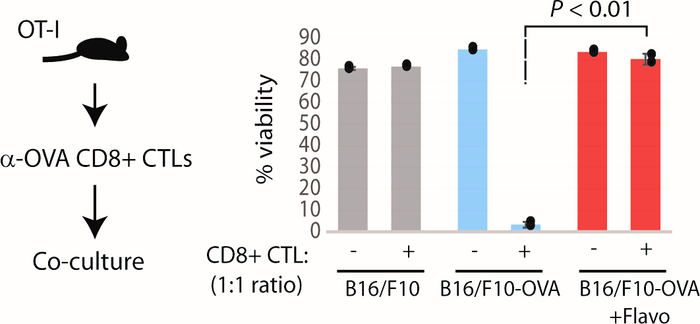
Figura 7: Ensayo exploratorio para evaluar la resistencia de TEdefinitivamente modelo a antigen-restringido citotóxico t cell mediado ataque in vitro. Izquierda: esquema esquemático del ensayo exploratorio. Derecha: viabilidad relativa de las células B16/F10-OVA co-cultivadas con CD8 + CTL activados (1:1 relación) aisladas del bazo de ratones OT-I. P: Prueba tde dos muestras. Esta cifra ha sido modificada de Modur et al.3. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El control de alargamiento del ARN Pol II ha surgido como una palanca decisiva para regular la expresión génica sensible al estímulo en beneficio de las células malignas5,7,8. La superación de la pausa promotor-proximal al alargamiento y posterior producción de ARNm requiere la actividad quinasa de P-TEFb9,10,11. Nuestro modelo utiliza flavopiridol (25 nM), un inhibidor de la quinasa esencial dependiente de la ciclina CDK9, para imitar los defectos observados durante el alargamiento de Pol II en cánceres TEdefinitivamente, un fenotipo previamente desconocido en cánceres descubiertos por nuestro grupo anteriormente3.
Durante mucho tiempo se ha sabido que la actividad de la quinasa CDK9 es esencial para la fosforilación de los residuos de serina 2 en el CTD de la gran subunidad de Pol II. Críticamente, hemos logrado optimizar la inhibición crónica tratada con flavopiridol de CDK9 (25 nM durante 1 semana) en B16/F10 OVA de tal manera que, además de inhibir la fosforilación CTD, el tratamiento con flavopiridol de 25 nM durante 1 semana previene la correcta post-transcripción las modificaciones del ARNm de manera imprevista y abroga eficazmente el alargamiento productivo dependiente de p-TEFb a lo largo de genes largos como genes de señalización de respuesta proinflamatoria, alterando significativamente sus patrones de expresión tanto en el ARNm como en el ARNm y niveles de proteínas. Hasta donde sabemos, no hay otro modelo descrito en la literatura que logre efectivamente lo mismo.
Por lo tanto, este modelo de TE, fácil de establecer y generalizable,definitivamente se puede aprovechar para diseccionar, tanto modificaciones transcripcionales como epigenéticas que permiten a los cánceres de TEadaptarse definitivamente al ataque celular mediado por el sistema inmunitario. Además, este modelo murino conservadefinitivamentesu TE -como la reducción de los niveles totales y fosfo- RNA Pol II 21 días después de la liberación de flavopiridol in vivo el ensayo de crecimiento3 (no mencionado en el protocolo aquí), sugiriendo el grado de estabilidad de este modelo no genético para la experimentación in vivo. Sin embargo, se debe tener cuidado para optimizar la dosis subletal exacta de flavopiridol para otras líneas murinas (por ejemplo, alrededor de 20 nM tratamiento con flavopiridol durante 1 semana es la dosis subletal para la línea de carcinoma murino MC38; no se utiliza en este protocolo), el impacto de la variación en la variación celular La densidad de chapado, las condiciones de cultivo y las condiciones de estimulación de la citoquina pueden variar para diferentes líneas murinas. El protocolo descrito aquí proporciona un marco básico para minimizar las variables que se sabe que son críticas para la generación de características de TEdefinitivamente-como por inhibición crónica de CDK9. Además, las líneas celulares de carcinoma humano, como T47D y CAL51, se han probado con tratamientos de flavopiridol a corto plazo (3 días) que dieron lugar a perfiles similares de TE definitivamente -como RNA Pol II, lo que indica la utilidad de la inhibición crónica basada en flavopiridol que da lugar a perfiles similares de TEdefinitivamente-como RNA Pol II, lo que indica la utilidad de la inhibición crónica basada en flavopiridol de CDK9 mediada elongación transcripción en la creación de incluso líneas humanas modelo para estudiar TEdefinitivamente.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado en parte por los premios NCI (CA193549) y CCHMC Research Innovation Pilot a Kakajan Komurov, y el premio del Departamento de Defensa (BC150484) a Navneet Singh. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente las opiniones oficiales del Instituto Nacional del Cáncer o del Departamento de Defensa. Los fórhechos no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| hhis6FasL | Cell Signaling | 5452 | |
| 10X TBS | Bio-Rad | 170-6435 | |
| 12 well plates | Falcon | 353043 | |
| 20% methanol | Fisher Chemical | A412-4 | |
| 24-well plates | Falcon | 351147 | |
| 4–18% SDS polyacrylamide gel | Bio-Rad | 4561086 | |
| 4% Paraformaldehyde | Thermo Fisher Scientific | AAJ19943K2 | |
| 5% dry milk | Bio-Rad | 170-6404 | |
| 7-Methylguanosine antibody | BioVision | 6655-30T | |
| 96-well plates | Cellstar | 655180 | |
| AF647-conjugated mouse CD8 | Biolegend | 100727 | |
| antibiotic and antimycotic | Gibco | 15240-062 | |
| anti-His antibody | Cell Signaling | 2366 P | |
| Anti-Rabit | Cell Signaling | 7074 | Dilution 1:5000 |
| Anti-Rat | Cell Signaling | 7077S | Dilution 1:5000 |
| Bradford assay Kit | Bio-Rad | 5000121 | |
| BSA | ACROS Organics | 24040-0100 | |
| BV421-conjugated mouse CD45 | Biolegend | 109831 | |
| crystal violet | Sigma | C3886-100G | |
| DMEM | Gibco | 11965-092 | |
| Dynabeads Oligo (dT)25 | Ambion | 61002 | |
| FBS | Gibco | 45015 | |
| Fixable Live/Dead staining dye e780 | eBioscience | 65-0865-14 | |
| Flavopiridol | Selleckchem | S1230 | |
| H3k36me3 | Abcam | ab9050 | Dilution 1:2000 |
| IFN-α | R&D systems | 12100-1 | |
| IFN-γ | R&D systems | 485-MI-100 | |
| IMDM | Gibco | 12440053 | |
| Immobilon Western Chemiluminescent HRP Substrate | Millipore | WBKLS0500 | |
| MojoSort Mouse CD8 T Cell Isolation Kit | Biolegend | 480007 | |
| NF-κB | Cell Signaling | 8242s | Dilution 1:1000 |
| PBS | Gibco | 14190-144 | |
| p-NF-κB | Cell Signaling | 3033s | Dilution 1:1000 |
| p-Ser2-RNAPII | Active Motif | 61083 | Dilution 1:500 |
| p-Ser5-RNAPII | Active Motif | 61085 | Dilution 1:1000 |
| p-STAT1 | Cell Signaling | 7649s | Dilution 1:1000 |
| RiboMinu Eukaryote Kit | Ambion | A10837-08 | |
| RIPA buffer | Santa Cruz Biotechnology | sc-24948 | |
| RNAPII | Active Motif | 61667 | Dilution 1:1000 |
| STAT1 | Cell Signaling | 9175s | Dilution 1:1000 |
| TNF-α | R&D systems | 410-MT-010 | |
| total H3 | Cell Signaling | 4499 | Dilution 1:2000 |
| Tri reagent | Sigma | T9424 | |
| Triton | Sigma | T8787-50ML | |
| Tween 20 | AA Hoefer | 9005-64-5 | |
| β-Actin | Cell Signaling | 12620S | Dilution 1:5000 |
| β-ME | G Biosciences | BC98 |
Referencias
- Adelman, K., Lis, J. T. Promoter-proximal pausing of RNA polymerase II: emerging roles in metazoans. Nature Reviews Genetics. 13 (10), (2012).
- Margaritis, T., Holstege, F. C. Poised RNA polymerase II gives pause for thought. Cell. 133 (4), 581-584 (2008).
- Modur, V., et al. Defective transcription elongation in a subset of cancers confers immunotherapy resistance. Nature Communications. 9 (1), 4410 (2018).
- Hargreaves, D. C., Horng, T., Medzhitov, R. Control of inducible gene expression by signal-dependent transcriptional elongation. Cell. 138 (1), 129-145 (2009).
- Adelman, K., et al. Immediate mediators of the inflammatory response are poised for gene activation through RNA polymerase II stalling. Proceedings of the National Academy of Sciences of the United States of America. 106 (43), 18207-18212 (2009).
- van Stipdonk, M. J., Lemmens, E. E., Schoenberger, S. P. Naïve CTLs Require a Single Brief Period of Antigenic Stimulation for Clonal Expansion and Differentiation. Nature Immunology. 2 (5), 423-429 (2001).
- Gilchrist, D. A., et al. Regulating the regulators: the pervasive effects of Pol II pausing on stimulus-responsive gene networks. Genes & Development. 26 (9), 933-944 (2012).
- Danko, C. G., et al. Signaling pathways differentially affect RNA polymerase II initiation, pausing, and elongation rate in cells. Molecular Cell. 50 (2), 212-222 (2013).
- Nechaev, S., Adelman, K. Pol II waiting in the starting gates: Regulating the transition from transcription initiation into productive elongation. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms. 1809 (1), 34-45 (2011).
- Zhou, M., et al. Tat modifies the activity of CDK9 to phosphorylate serine 5 of the RNA polymerase II carboxyl-terminal domain during human immunodeficiency virus type 1 transcription. Molecular and Cellular Biology. 20 (14), 5077-5086 (2000).
- Palancade, B., Bensaude, O. Investigating RNA polymerase II carboxyl‐terminal domain (CTD) phosphorylation. European Journal of Biochemistry. 270 (19), 3859-3870 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados