Method Article
A Murine Cell Line Based Model of Chronic CDK9 Inhibition to Study Widespread Non-Genetic Transcriptional Elongation Defects (TEdefinitely) in Cancers
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt ein in vitro muriner Karzinommodell der nicht-genetischen defekten Transkriptionsdehnung. Hier wird die chronische Hemmung von CDK9 verwendet, um die produktive Dehnung von RNA Pol II entlang der pro-entzündlichen Reaktionsgene zu unterdrücken, um das klinisch überversorgteTE-Phänomen, das bei etwa 20% aller Krebsarten vorhanden ist, zu imitieren und zu untersuchen.
Zusammenfassung
Wir haben bereits berichtet, dass eine Teilmenge von Krebsdurchurteilen durch globale transkriptionelle Deregulierungen mit weit verbreiteten Mängeln in der mRNA-Transkriptionsdehnung (TE) definiert wird – wir nennen solche Krebsartendefinitivals TE . Insbesondere sind TEdefinitiv Krebserkrankungen durch falsche Transkription und fehlerhafte mRNA-Verarbeitung in einer großen Reihe von Genen gekennzeichnet, wie Interferon/JAK/STAT und TNF/NF-B-Wege, die zu ihrer Unterdrückung führen. DerTE-Subtyp von Tumoren bei Nierenzellkarzinom und metastasierendem Melanom korreliert signifikant mit einem schlechten Ansprechen und Ergebnis in der Immuntherapie. Angesichts der Bedeutung der Untersuchung von TEdefinitiv Krebserkrankungen – da es eine signifikante Hürde gegen Die Immuntherapie darstellt – ist das Ziel dieses Protokolls, ein In-vitro-TE-Modell zu etablieren, um diese weit verbreiteten, nicht-genetischen Transkriptionsanomalien bei Krebserkrankungen und gewinnen neue Erkenntnisse, neuartige Verwendungen für bestehende Medikamente oder neue Strategien gegen solche Krebsarten zu finden. Wir beschreiben die Verwendung von chronischer Flavopiridol-vermittelter CDK9-Hemmung zur Aufhebung der Phosphorylierung von Serin-2-Rückständen auf der C-Terminal-Repeat-Domäne (CTD) der RNA-Polymerase II (RNA Pol II), wodurch die Freisetzung von RNA Pol II in die produktive Transkription unterdrückt wird. Dehnung. Da TEdefinitiv krebsern ist, ist ein pharmakologisches Modell vorteilhaft und imitiert am besten die weit verbreiteten transkriptionellen und epigenetischen Defekte, die in ihnen beobachtet werden. Die Verwendung einer optimierten subletalen Dosis von Flavopiridol ist die einzige wirksame Strategie bei der Schaffung eines verallgemeinerbaren Modells nicht genetisch erweiterbarer Störungen bei der Transkriptionsdehnung und mRNA-Verarbeitungsfehlern, die die klinisch beobachteten TE genau nachahmen. auf jeden Fall Eigenschaften. Daher kann dieses Modell von TEdefinitiv genutzt werden, um zellautonome Faktoren zu sezieren, die es ihnen ermöglichen, immunvermittelten Zellangriffen zu widerstehen.
Einleitung
Ein wichtiger schritt zur Begrenzung der Rate bei der Expression fast aller aktiven Gene ist der Übergang der RNA-Polymerase II (RNA Pol II) von der Promotor-proximale Pausierung zur produktiven Dehnung1,2. Angesichts der Tatsache, dass epigenetische Dysregulation der Transkriptionsdehnung hilft bei der Progression von mehreren menschlichen Malignitäten definiert als TEdefinitiv, was zu suboptimalen Signalisierung in den pro-flamme Reaktionsbahnen in Höhe einer schlechten Reaktion und Ergebnis der Immuntherapie3ist das übergeordnete Ziel dieses Protokolls, ein nützliches In-vitro-Modell zu etablieren, um diese weit verbreiteten nicht-genetischen Transkriptionsanomalien bei Krebserkrankungen zu untersuchen. Vor diesem Hintergrund ist die Anwendung der chronischen pharmakologischen Hemmung von CDK9 eine wirksame Strategie zur Schaffung eines verallgemeinerbaren Modells nicht-genetisch erweiterbarer Störungen bei der Transkriptionsdehnung und mRNA-Verarbeitungsfehlern. Der Grund für die Verwendung der chronischen CDK9-Hemmung ist, dass es die Phosphorylierung von Serin-2-Rückständen auf der C-Terminal-Repeat-Domäne (CTD) von RNA Pol II aufhebt und so die Freisetzung von RNA Pol II in produktive Transkriptiondehnung unterdrückt. Auch TEdefinitiv Krebserkrankungen, die zuvor von unserer Gruppe3beschrieben wurden, werden nicht unter eine spezifische somatische Mutation eingestuft. Daher ist ein nicht-genetisches (pharmakologisches) Modell vorteilhaft und imitiert am besten die weit verbreiteten transkriptionellen und epigenetischen Defekte, die in ihnen beobachtet wurden. Die hierin enthaltene Methode beschreibt die Generierung und Charakterisierung des chronischen Flavopiridol-Behandlungsmodells von murinen Krebszellen. Diese Methode stört nachweislich die Transkriptionsdehnung entlang von Genen, die durch längere genomische Längen gekennzeichnet sind, mit aufgesetzten Promotoren und induzierbaren Ausdrücken wie TNF/NF-B und Interferon/STAT-Signalisierung, die auf der Ebene der Transkriptionsdehnung 3,4,5. Insgesamt treibt dieses optimierte modellhafte Zelllinienmodell von Transkriptionsdehnungsdefekten – das einzige Modell, das nach unserem Wissen die neu beschriebenenTE-Tumoren untersucht – die Resistenz gegen Anti-Tumor-Immunangriffe und macht ein nützliches System zur Ausnutzung und untersuchen Sie die Schwachstellen nichtgenetischer Defekte in Kerntranskriptionsmaschinen bei Krebserkrankungen gegenüber immunvermitteltem Zellangriff.
Protokoll
Der Institutional Animal Care and Use Committee und der Institutional Biosafety Committee der Cincinnati Children es Research Foundation genehmigten alle tierexperimentellen Verfahren (IACUC-Protokoll #2017-0061 und IBC-Protokoll #IBC2016-0016), und diese Die Versuche wurden in Übereinstimmung mit den ImnI-Leitfaden für die Pflege und Verwendung von Labortieren beschriebenen Standards durchgeführt.
1. Chronische Hemmung von RNA Pol II durch Flavopiridol-Behandlung – Basisstrategie
- Samen B16/F10 Mausmelanom-Zellen in geringer Dichte (0,2 x 106) in einer 10 cm Kulturplatte in ihrem entsprechenden Medium (Dulbecco es Modified Eagle Medium [DMEM], 10% fetales Rinderserum [FBS], 1% Penicillin und Streptomycin [Pen/Strep]) und über Nacht inkubieren in einem 37 °C, 5%CO2 befeuchteten Inkubator.
- Waschen Sie die Zellen im folgenden Tag mit 1x phosphatgepufferter Salin (PBS) und fügen Sie eine neue Charge Kulturmedien mit einer subletalen Dosis (geschätzt 25 nM) Flavopiridol hinzu – einem Inhibitor des RNA Pol II Dehnungsfaktors p-TEFb (Cyclin T/CDK9) – für eine Woche ohne weitere Unterkultivierung.
- Führen Sie nach einer Woche der Flavopiridol-Behandlung bestätigende Tests durch, um die Fähigkeit des Modells zu bewerten, verschiedene Attribute von Transkriptionsdehnungsfehlern zu rekapitulieren, die bei TEdefinitiv Krebserkrankungen beobachtet werden.
2. Bestätigender Immunoblot-Test zur Beurteilung der defekten RNA Pol II-Funktion und Beeinträchtigung des Interferon- (IFN)-Signalwegs und tumor-nekrosefaktors (TNF)
- Kultur gleiche Anzahl (105) von Flavopiridol behandelt B16/F10 Maus MelanomZellen und elternbeinen B16/F10 Maus Melanomzellen in zwei verschiedenen Sätzen von 12 Brunnenplatten (ein Satz für RNA Pol II funktionelle Charakterisierung und der andere Satz für Zytokin Stimulation) bei 37 °C in einem 5%CO2 befeuchteten Inkubator über Nacht.
- Behandeln Sie am nächsten Tag die Zellen in der Zytokinstimulationsmenge mit der Maus IFN-, IFN-A (5 ng/ml) oder TNF-A (5 ng/ml) 45 min bei 37 °C.
- Extrahieren Sie nun Proteine aus Zellen in Zytokin- und RNA-Pol-II-Funktionscharakterisierungssätzen mit einem Radioimmunozipier-Assay-Lysepuffer (RIPA) auf folgende Weise:
- Waschen Sie Zellen mit 1x PBS und lysen Sie sie mit 50 l des Lysepuffers pro Brunnen. Schrott, und dann pellet die lysierten Zellen bei 4 °C, 21.130 x g.
- Messen Sie das Protein in Zelllysatüberwachungsmitteln mit einem standard kolorimetrischen Test für die Proteinkonzentration nach Waschmittellöslichkeit (Bradford oder ein ähnlicher Assay).
- Laden Sie die gleiche Menge des gemessenen Proteins (15 g) aus jeder Probe, um in einem 4%-18%-Natriumdodecium (SDS) Polyacrylamid-Gel zu laufen, und übertragen Sie sie auf Polyvinylidendifluorid -Membranen (PVDF).
- Blockieren Sie die PVDF-Membranen in 5% Trockenmilch in tris-gepufferter Kochsaline-Polysorbat 20 (TBST) für 1 h, gefolgt von einer nächtlichen Inkubation bei 4 °C mit primären Antikörpern (RNA Pol II 1:1000; p-SER2 RNA Pol II 1:1000; p-SER5 RNA Pol II 1:1000; H3K36me3 1:2000; insgesamt H3 1:2000; STAT1 1:1000; p-STAT1 1:1000; NF-B 1:1000; p-NF-B 1:1000; -Actin 1:5000) in 5% Rinderserumalbumin.
- Danach die PVDF-Membranen mit 1x TBST 15 min bei Raumtemperatur (RT) waschen und mit geeigneten sekundären Antikörpern (Antiratte [1:5000] für RNA Pol II, p-SER2 RNA Pol II und p-SER5 RNA Pol II; Antikaninchen (1:5000) für H3K36me3, insgesamt H3, STAT1, p-STAT1, NF-B und p-NF-B) für 50 min bei RT. Erkennen Sie die Proteinsignale mit handelsüblichem Meerrettichperoxidase (HRP)-Substrat mit verbesserter Chemilumineszenz.
ANMERKUNG: Die primäre Verwendung von -Actin ist HRP-konjugiert, daher kann sie ohne Sekundärentwicklung entwickelt werden.
3. Bestätigender Assay zur Beurteilung von mRNA-Verarbeitungsfehlern in der generierten Maus TEdefinitiv Modell
- Samen gleiche Anzahl (0,2 x 106) von Flavopiridol behandelt B16/F10 Maus MelanomZellen und elternbäuerliche B16/F10 Maus Melanomzellen in 6-Well-Platten bei 37 °C in einem 5%CO2 befeuchteten Inkubator über Nacht.
- Extrahieren Sie die gesamte RNA aus den kultivierten Zellen bei 60% Konfluenz mit einem RNA-Extraktionsreagenz oder -kit (Table of Materials).
- Deplete rRNA aus der gesamten extrahierten RNA auf folgende Weise:
ANMERKUNG: Ein Protokoll mit niedrigem Input wurde von einem kommerziell erhältlichen Kit kooptiert, um rRNA zu erschöpfen- Stellen Sie ein Wasserbad oder einen Wärmeblock auf 70 bis 75 °C und ein weiteres Wasserbad oder einen Wärmeblock bei 37 °C ein.
- Fügen Sie die gesamte RNA (100-500 ng in 2 l nukleasefreies Wasser) mit 1 l selektiver rRNA-Erschöpfungssonde und 30 l Hybridisierungspuffer in einem Mikrozentrifugenrohr hinzu, mischen Sie sie vorsichtig durch Wirbeln und inkubieren Sie sie bei 70 x 75 °C für 5 min.
- Übertragen Sie nun die Rohre in ein 37 °C Wasserbad/Wärmeblock und lassen Sie die Probe über einen Zeitraum von 30 min auf 37 °C abkühlen.
- Setzen Sie die selektive rRNA-Erschöpfungssonde magnetische Perlen durch Wirbeln und aliquot 75 l Perlen in einem 1,5 ml RNase-freien Mikrozentrifugenrohr aus.
- Legen Sie die Perlenaufhängung für 1 min auf einen Magnetischen Separator. Lassen Sie die Perlen sich absetzen. Den Überstand vorsichtig ansaugen und entsorgen. Waschen Sie die Perlen noch einmal, indem Sie 75 L nukleasefreies Wasser hinzufügen und den Überstand nach magnetischer Trennung entsorgen.
- Setzen Sie die gewaschenen Perlen in 75 L Hybridisierungspuffer aus, und aliquot 25 l davon in ein anderes Rohr und halten Sie sie bei 37 °C für die spätere Verwendung.
- Legen Sie die restlichen 50 L-Perlen für 1 min auf einen magnetischen Separator und entsorgen Sie den Überstand. Setzen Sie die Perlen in 20 L Hybridisierungspuffer aus und halten Sie sie bei 37 °C für die spätere Verwendung.
- Nach der Abkühlung des RNA/selektiven rRNA-Erschöpfungssondengemisches auf 37 °C für 30 min zentrieren Sie das Rohr kurz, um die Probe an den Boden des Rohres zu sammeln.
- Übertragen Sie 33 l des RNA/selektiven rRNA-Erschöpfungssondengemisches auf die vorbereiteten Magnetperlen ab Schritt 3.3.7. Mischen Sie durch Low-Speed-Wirbel.
- Inkubieren Sie das Rohr bei 37 °C für 15 min. Während der Inkubation den Inhalt gelegentlich vorsichtig mischen. Gefolgt von einer kurzen Zentrifugation, um die Probe an der Unterseite des Rohres zu sammeln.
- Legen Sie das Rohr 1 min auf einen Magnetischen Separator, um den rRNA-Sondenkomplex zu pelleten. Diesmal den Überstand nicht verwerfen. Der Überstand enthält rRNA-erschöpfte RNA.
- Legen Sie das Rohr von 25 L Perlen ab Schritt 3.3.6 auf einen magnetischen Separator für 1 min. Aspirieren und entsorgen Sie den Überstand. Fügen Sie den Überstand von Schritt 3.3.11 in die neue Röhre der Perlen. Mischen Sie durch Low-Speed-Wirbel.
- Inkubieren Sie das Rohr bei 37 °C für 15 min. Während der Inkubation den Inhalt gelegentlich vorsichtig mischen. Zentrifugieren Sie das Rohr kurz, um die Probe an der Unterseite des Rohres zu sammeln.
- Legen Sie das Rohr 1 min auf einen Magnetischen Separator, um den rRNA-Sondenkomplex zu pelleten. Verwerfen Sie den Überstand nicht. Übertragen Sie den Überstand (ca. 53 l), der rRNA-erschöpfte RNA enthält, in eine neue Röhre.
- Messen Sie die Konzentration der RNA-Ausbeute durch ein Spektralphotometer.
- Verwenden Sie die Hälfte der rRNA-erschöpften Proben als Input für magnetische Perlen, die Oligo (dT)25 enthalten, um PolyA+ RNA auf folgende Weise zu extrahieren:
HINWEIS: Dieses Protokoll der Isolierung von PolyA Schwanz Boten-RNA mit Oligo dT-Sequenzen an die Oberfläche von magnetischen Perlen gebunden wurde von einem kommerziell erhältlichen Kit (Tabelle der Materialien) kooptiert.- Setzen Sie die Oligo-dT-Perlen in der Durchstechflasche wieder auf, indem Sie kurz für >30 s wirbeln und 200 l Oligo-dT-Perlen in ein Rohr übertragen. Fügen Sie das gleiche Volumen (200 L) des Bindungspuffers hinzu, und setzen Sie es erneut aus.
- Legen Sie das Rohr in einen Magneten für 1 min und entsorgen Sie den Überstand. Entfernen Sie nun das Rohr vom Magneten und setzen Sie die gewaschenen Oligo-dT-Perlen in 100 l Bindungspuffer wieder auf.
- Passen Sie das Volumen der eingabegebundenen rRNA-erschöpften Gesamt-RNA-Probe auf 100 l bei 10 mM Tris-HCl pH 7.5 an. Fügen Sie nun 100 L Bindungspuffer hinzu.
- Hitze auf 65 °C für 2 min, um sekundäre RNA-Strukturen zu stören. Jetzt sofort auf Eis legen.
- Fügen Sie die 200 L der gesamten RNA zu den 100 l gewaschenen Perlen hinzu. Mischen Sie gründlich und ermöglichen Bindung durch kontinuierlicheS Drehen auf einem Rotor für 5 min bei RT.
- Legen Sie das Rohr auf den Magneten für 1-2 min und entfernen Sie sorgfältig alle Überstand und sorgfältig entfernen Sie alle Überstand.
- Entfernen Sie das Rohr vom Magneten und fügen Sie 200 L Waschpuffer hinzu.
- Messen Sie die Reinheit und Konzentration der extrahierten PolyA+ RNA mit einem Spektralphotometer.
HINWEIS: Ein Verhältnis von 260/280 von 1,90 x 2,00 und ein Verhältnis von 260/230 von 2,00 bis 2,20 für alle RNA-Proben gelten als akzeptabel. - Verwenden Sie die restliche Hälfte der rRNA-erschöpften Proben aus Abschnitt 3.3 als Input für Protein-A-Säulen (im RNA-Immunpräzipitationskit [RIP]-Kit, Tabelle der Materialien)zur Immunpräzipierung von fünf-prime-capped RNAs mit monoklonalen 7-Methylguanosin Antikörper in folgender Weise:
HINWEIS: Dieses Protokoll zur Isolierung von m7G-capped Messenger RNA mit einem kommerziell erhältlichen RNA-Immunpräzipitationskit wurde kooptiert und weiter modifiziert.- Waschen Sie das Protein A magnetische Perlen aus dem RIP-Kit nach herstellerspezifischem Protokoll erhalten, um den Antikörper an die Perlen vorzubinden.
- Übertragen Sie 3 g 7-Methylguanosin-Antikörper (Kaninchen IgG im Kit ist die Negativkontrolle verwendet werden) auf die Perlen in einem Mikrozentrifugenrohr, das in einem 100-L-Waschpuffer aus dem Kit aufgehängt ist.
- Inkubieren Sie mit niedriger Drehzahl drehung für 30 min bei RT. Zentrifugenrohre kurz und legen Sie dann die Rohre auf einen magnetischen Separator, entfernen und entsorgen Sie den Überstand.
- Entfernen Sie die Rohre und fügen Sie 500 L Waschpuffer aus dem Kit und Wirbel kurz hinzu. Zentrifugieren Sie die Rohre kurz gefolgt von magnetischer Trennung, entfernen und entsorgen Sie den Überstand.
- Wiederholen Sie Schritt 3.6.4 noch einmal.
- Fügen Sie etwa 120 ng rRNA erschöpft (ab Abschnitt 3.3) zu den vorgewaschenen 7-Methylguanosin-Antikörper gebundenen Perlen hinzu. Fügen Sie 1 L RNase-Inhibitor hinzu. Bei RT für 1 x 1,5 h mit leichter Rührung inkubieren.
- Drehen Sie die Perlen bei 300 x g für 10 s und entfernen Sie den Überstand, der ungekapselte (nicht-7-methylguanosine) mRNA enthält, in ein neues Mikrozentrifugenrohr.
- Fügen Sie 100 L Waschpuffer hinzu und waschen Sie ihn zwei weitere Male ähnlich. Bündeln Sie den gesammelten Überstand in demselben Mikrozentrifugenrohr, das mit unbedeckter (nicht-7-methylguanosin) mRNA gekennzeichnet ist. Auf Eis aufbewahren.
- Elute die gekapselte (7-Methylguanosin) mRNA aus den Perlen mit 300 L Harnstofflysepuffer (ULB) mit 7 M Harnstoff, 2% SDS, 0,35 M NaCl, 10 mM EDTA und 10 mM Tris, pH 7,5 durch Erhitzen der Perlen bei 65 °C für 2 x 3 min.
- Mischen Sie 300 l der eluierten Proben (gekappt und ungekapselt mRNA) mit 300 l Phenol:Chloroform:Isoamylalkohol (25:24:1; kommerziell erhältlich) (bei 4 °C gelagert). Gut mischen, indem Sie umkehren und ca. 10 min lassen, dann wieder sanft mischen.
- Zentrifugieren Sie bei 18.928 x g für 2 min und pipette die obere Schicht sorgfältig zu frischem Rohr und entsorgen Bodenschicht.
- Fügen Sie den Proben 300 l Phenol:Chlorform:Isoamylalkohol (25:24:1; bei 4 °C gelagert) hinzu. Mischen Sie gut durch Invertieren und zentrifugieren Sie dann bei 18.928 x g für 1 min. Sorgfältig die obere Schicht zu einem frischen Rohr pipette und entsorgen Bodenschicht.
- Fügen Sie der gekappten und ungekapselten RNA 300 l 2-Porpanol und 30 l 3 M Natriumacetat (pH 5,2) hinzu. Die Probe einige Male umkehren und 20 h bei -20 °C stellen.
- Zentrifugieren Sie nun die Proben bei 18.928 x g für 10 min bei 4 °C. Entfernen Sie den Überstand vorsichtig und fügen Sie 500 l 70% Ethanol hinzu.
- Zentrifugieren Sie wieder bei 18.928 x g für 10 min bei 4 °C. Den Überstand vorsichtig entsorgen und das Pellet bei RT weniger als 5 min trocknen. Das Pellet in nukleasefreiem Wasser auflösen.
- Messen Sie die Reinheit und Konzentration der RNA-Ausbeute durch ein Spektralphotometer. Das Verhältnis 260/280 sollte im Bereich von 1,90 bis 2,00 liegen, das Verhältnis 260/230 im Bereich von 2,00 bis 2,20 für alle RNA-Proben.
4. Bestätigender Assay zur Beurteilung der Reaktion der Maus TEdefinitiv Modell auf FasL vermittelten Zelltod
- Samen gleiche Anzahl (30.000 Zellen) von Flavopiridol behandelt B16/F10 Maus Melanomzellen und elternbäuerliche B16/F10 Maus Melanomzellen in einem 96-Well-Kulturplatte in ihrem entsprechenden Medium (DMEM), und über Nacht in einem 37 °C, 5%CO2 befeuchtet brutkasten.
- Behandeln Sie die Zellen in einer Kulturhaube mit unterschiedlichen Konzentrationen von hseinem6FasL (0,1,1000 ng/ml) in Gegenwart von 10 g/ml Anti-His-Antikörper und inkubieren Sie für 24 h bei 37 °C, 5%CO2 befeuchteter Inkubator.
- Entfernen Sie abgestorbene Zellen, indem Sie mit 1x PBS-Puffer waschen. Fixieren Sie die angeschlossenen Zellen in 4% Paraformaldehyd für 20 min bei RT. Entsorgen Sie das 4% Paraformaldehyd (keine Notwendigkeit zu waschen), und färben Sie mit kristallvioletter Lösung (20% Methanol, 0,5% Kristallviolett in 1x PBS) für 30 min.
- Entfernen Sie überschüssige Flecken, indem Sie die Platten vorsichtig in Leitungswasser spülen. Halten Sie die Platten bei RT trocknen.
- Lösen Sie das Kristallviolett in 100 l des 1x 1x nichtionischen Tensids, das in 1x PBS gelöst ist, wieder auf und messen Sie die Zelldichte, indem Sie die Absorption bei 570 nm in einem Mikroplattenleser messen.
5. Explorativer Test zur Beurteilung der Reaktion der Maus TEdefinitiv Modell auf Antigen-spezifische zytotoxische T-Zell-Angriff
- Isolierung und Aktivierung des zytotoxischen T-Zell-Angriffs (CTL) von OT-I CD8+
- Reinigen Sie CD8+-Zellen aus Milz von OT-I TCR Tg RAG-1-/-Mäusen durch magnetische Zelltrennung mit einem Maus-CD8 T-Zellisolationskit wie folgt:
- Ernte zwei Milz von zwei OT-I TCR Tg RAG-1-/- Mäusen in kompletten RPMI-Medien.
- Die Milz in einem 70-mm-Filter an einem 50 ml-Rohr, das mit 20 ml RPMI gefüllt ist, mit der Rückseite einer Spritze maschen, bis nur Fett im Filter zurückbleibt.
- Zentrifugieren Sie den Durchfluss bei 220 x g für 5 min bei 4 °C. Entsorgen Sie den Überstand.
- Fügen Sie dem Milzpellet aus dem vorherigen Zentrifugationsschritt 1 ml rote Blutkörperchen (RBC) Lysepuffer hinzu und pipette die Mischung für 1 min.
- Neutralisieren Sie die Lösung, indem Sie bis zu 10 ml RPMI hinzufügen.
- Zentrifuge bei 220 x g für 5 min bei 4 °C. Entsorgen Sie den Überstand und setzen Sie ihn in 10 ml RPMI wieder auf.
- Nehmen Sie ein kleines Aliquot zum Zählen. Zentrifugieren Sie den Rest bei 220 x g für 5 min bei 4 °C.
- Für jede gezählte Million Zellen das Pellet in 1 ml des handelsüblichen magnetischen Trennsystempuffers (Mojo-Puffer oder ein ähnlicher Puffer) wieder aufsetzen.
- Bereiten Sie in Schritt 5.1.1.8 einen Antikörpercocktail mit einem Volumen von 100 l für jede 1 ml Pelletzellen vor. Der Antikörper-Cocktail umfasst: Biotin-Anti-CD4, CD105, CD45R/B220, CD11c, CD49b, TER-119, CD19, CD11b, TCR und CD44.
- Fügen Sie diesen Cocktail zu den 1 ml Pelletzellen hinzu und halten Sie 15 min auf Eis.
- Fügen Sie den 1 ml resuspendierten Pellet-Milzzellen 100 L magnetische (Streptavidin)-Perlen hinzu. Halten Sie auf Eis für 15 min.
- Fügen Sie 7 ml des handelsüblichen magnetischen Trennsystempuffers hinzu. Nun aliquot etwa 3 x 4 ml der Mischung zu einem frischen Rohr. Gut mischen und 5 min am Magneten fixieren.
- Dekantieren Sie die Flüssigkeit (enthält CD8+ Zellen) zu einem frischen Rohr auf Eis. Nun aliquot die verbleibenden 3 x 4 ml Mischung von Schritt 5.1.1.12 bis zum Rohr und fixieren Sie es an den Magneten für 5 min. Decant die Flüssigkeit (zweite Charge von CD8+ Zellen isoliert) in die gleiche Röhre mit der ersten Charge von CD8+ Zellen auf Eis gehalten.
- Saatgut entwickelt haftenden Fibroblasten APC-(MEC. B7. SigOVA) zur Expressivwirkung eines spezifischen Ovalbumin (OVA)-abgeleiteten, H-2Kb-eingeschränkten Peptid-Epitops OVA257-264 (SIINFEKL), zusammen mit dem kostimulierenden Molekül B7.1, bei 75.000 Zellen pro Brunnen in 24-Well-Platten, bei 37 °C, 5%CO2 befeuchteter Inkubator.
HINWEIS: Der verwendete Anhänger-Fibroblast ist ein Geschenk aus dem Labor von Dr. Edith Janssen im CCHMC. Die Linie wurde ursprünglich im Labor von Dr. Stephen P. Schönberger im La Jolla Institute for Allergy and Immunology6erstellt. - Nach 24 h die Monoschicht von APC einmal mit dem modifizierten Dulbecco-Medium (IMDM) von Iscove kommerziell mit HEPES-Puffer, Natriumpyruvat, L-Glutamin und hoher Glukose zu waschen und 0,5 x 106 naive OT-I CD8+-Zellen (ab Schritt 5.1.1.13) in 2 ml IMDM hinzuzufügen. ergänzt mit 50 mM -ME, 2 ml EDTA, 4 mM L-Glutamin und HEPES und 10% FBS.
- Nach 20 h die nicht haftenden OT-I-Zellen vorsichtig ernten (durch Dassammeln der Medien in der Kulturschale mit schwimmenden OT-I-Zellen und Pelletieren der Zellen bei 191 x g für 2 min; zählen Sie die lebensfähigen OT-I-Zellen) und übertragen Sie sie für die Co-Kultur.
- Reinigen Sie CD8+-Zellen aus Milz von OT-I TCR Tg RAG-1-/-Mäusen durch magnetische Zelltrennung mit einem Maus-CD8 T-Zellisolationskit wie folgt:
- Kokultur von CD8+-Zellen mit B16/F10-OVA-Zellen
- Samen OT-I-abgeleitete CD8+-Zellen im Verhältnis 1:1 (jeweils 300.000 Zellen) in einer Kokultur mit B16/F10 (ohne Antigen Ovalbumin), unbehandelten B16/F10-OVA und B16/F10-OVA-Zellen, die 1 Woche lang mit Flavopiridol (25 nM) vorbehandelt wurden, in 6-Well-Gerichten komplett mit DMEM 20 h bei 37 °C in einem 5%CO2 befeuchteten Inkubator.
- Nach 20 h entfernen Sie die VON OT-I abgeleiteten CD8+-Zellen (durch Sammeln der Medien in der Kulturschale mit schwebenden OT-I abgeleiteten CD8+-Zellen). Waschen Sie die anhaftenden B16/F10-OVA-Zellen in 1x PBS.
- Trypsinisieren Sie die drei Gruppen der angeschlossenen B16/F10-OVA-Zellen in 0,05% EDTA, die Trypsin für 5 min enthalten. Pellet der trypsinisierten Zellen bei 191 x g für 5 min.
- Färben Sie die geernteten B16/F10-OVA-Zellen, indem Sie sie in kalten PBS (mit 0,5% FBS und 0,05% Natriumazid) mit Lebensfähigkeitsfarbstoff und relevanten markierten Antikörpern (fixierbare Lebensfähigkeit sergetisch Färbefarbstoff e780, AF647-konjugierte Maus CD8 und BV421-konjugierte Maus CD45) ).
- Analysieren Sie die Lebensfähigkeit der drei Gruppen von B16/F10-OVA-Zellen durch Durchflusszytometrie.
Ergebnisse
Hier stellen wir ein detailliertes Schema (Abbildung 1) zur Verfügung, um einTE-Zellmodell zu erstellen, das durch chronische subtödliche Behandlung(Abbildung 2) mit Flavopiridol bei 25 nM erhalten wurde. In Abbildung 3zeigen B16 OVA-Zellen an 3 Tagen behandlung mit Flavopiridol teilweise Merkmale vonTE, aber nach einer Woche Behandlung zeigen B16/F10 OVA-Zellen einen tiefen Verlust der Phosphorylierung an der Serin-2-Position auf der CTD von RNA Pol II entlang mit einer signifikanten Abnahme von H3K36me3 – einer Histonmodifikation, die bei der Definition von Exongrenzen und einem Inhibitor von ablaufenden kryptischen Transkriptionen verbunden ist. Infolgedessen zeigt TEdefinitiv Zellmodelle kritische mRNA-Verarbeitungsfehler mit offensichtlich erhöhten Verhältnissen von unsachgemäß gekappten und nicht poly-adenylierten mRNAs (Abbildung 4A,B). Auch die spezifische Unterdrückung wichtiger Entzündungsreaktionsweggene und fasL vermittelter Zelltodweg sind in Abbildung 5 und Abbildung 6zu sehen. Die auferlegte Resistenz gegen Interferon (IFN-, IFN) und TNF-- stimulierte Phosphorylierung von STAT1 und NF-B und die Resistenz gegen den Zelltod durch den Todesrezeptor-Ligand FasL reduziert die Zytotoxizität eines Immunzellangriffs gegen TEdefinitiv Tumoren. Diese Bestätigungstechniken wurden entwickelt, um das Ausmaß des Einflusses zu testen, das die chronische Störung der Transkriptionsdehnung auf eine breite Palette von stimulusresponsiven Genen hat, und ob eine solche Störung in einem bestimmten Mauszelllinienmodell ausreichend ist, um einen akuten Mangel an funktioneller mRNA in entzündlichen Reaktionen signalisieren Gene, imitieren die grundlegenden Grundlagen von TEdefinitiv Krebs klinisch. Basierend auf unserer Studie zur Flavopiridol-Behandlung ist die Unterdrückung der Phosphorylierung am zweiten Serinrückstand (pSER2) von RNA Pol II CTD entscheidend, da sie die Transkriptionsdehnung markiert. Eine subletale Dosis für eine bestimmte Mauskarzinom-Zelllinie muss eine Verringerung der pSER2-Spiegel erreichen und nicht auch eine unbedeutende Auswirkung auf die Wachstumsrate und Lebensfähigkeit der Zelllinie haben. Obwohl wir bei 25 nM Flavopiridol-Behandlungen eine konsequente Verringerung der PSER2- und H3K36me3-Spiegel feststellen, garantiert sie keine Unterdrückung sowohl der pSTAT1- als auch der pNF-B-Spiegel (auf IFN-, IFN- und TNF-Stimulationen). Jede Mauskarzinom-Zelllinie ist einzigartig (B16/F10 OVA oder CT26-Zellen, die in verschiedenen Labors über einen bestimmten Zeitraum kultiviert werden, können leicht veränderte Wirkungen haben) und sie können entweder JAK1 oder CCNT1 teilweise die Auswirkungen von Flavopiridol bei der Unterdrückung der Entzündungsreaktionsweggene. In solchen Fällen muss die Kinetik der pSTAT1- und pNF-B-Spiegel möglicherweise zu verschiedenen Zeitpunkten (5-70 min) überprüft werden, um die Zeitlichkeit der flavopiridol vermittelten Effekte und seine Rettung durch JAK1 oder CCNT1 zu verstehen. Dementsprechend müssen JAK1 und/oder CCNT1 möglicherweise abgerissen werden, um dieses Modell zu etablieren.
Sobald das Flavopiridol-Modell mit den oben genannten Assays etabliert und charakterisiert ist, bieten wir einen explorativen Test an, um zu testen, ob dasTE-Zellmodell definitiv eine Resistenz gegen zytotoxische T-Zell-Angriffe (CTL) verleiht. Basierend auf unserem optimierten Protokoll behandelte Flavopiridol B16/F10-Zellen stabil überexprozicht das OVA-Gen (B16 OVA), das mit den aktivierten CD8+ CTLs (spezifisch für das EPItop OVA257-264) mit selektiver Toxizität gegenüber OVA-exemitten Zellen (ein Geschenk von Dr. Stephen P. Schönbergers Labor6war nicht anfällig für OT-I CTL-vermittelte Tumorlyse. B16/F10 OVA-Zellen (nicht mit Flavopiridol vorbehandelt) erlitten massiven Zelltod in diesem System, während B16/F10 Elternzellen überlebten, da sie kein OVA-Antigen ausdrücken (Abbildung 7). Aus dem Ergebnis des vorgeschlagenen Sondierungstestes geht hervor, dass chronischflavopiridol-induzierte TEdefinitiv ein Mittel zur Flucht vor einem Anti-Tumor-Immunangriff auch in vivo geben kann. Dies kann in in vivo Tumormodellen weiter getestet werden, um die Neigung vonTE-Modellen zu überprüfen, um angeborenen und adaptiven Anti-Tumor-Immunreaktionen zu entkommen. Anti-Asialo-Behandlungen könnten verwendet werden, um die Aktivität von NK-Zellen in vivo bei tumortragenden Mäusen zu regulieren. Auch Immun-Checkpoint-Therapie (Anti-CTLA4 und Anti-PD1) kann TEdefinitiv tumortragende Mäuse verabreicht werden.
Insgesamt zeigen die TEdefinitiv bestätigende Assays zusammen mit dem vorgeschlagenen explorativen Assay zusammen den Nutzen der Integration diesesTE-Zellmodells in eine ganze Reihe anderer Tumorimmuntestbedingungen. Dieses Modell kann helfen, die molekularen Details, die sich aus einer defekten Transkriptionsdehnung in Tumorzellen ergeben, und ihre Reaktion auf Immunzellinteraktionen zu analysieren.

Abbildung 1: Schematische Darstellung des Arbeitsablaufs. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Zellwachstumsmerkmale von B16-OVA-Zellen, die chronisch mit niedrig dosierter Flavopiridol behandelt wurden: Lebensfähigkeit (gemessen durch Lebensfähigkeitsreagenz) der Kontroll- und Flavopiridol-behandelten Zellen B16 OVA an angegebenen Tagen nach der Behandlung. Diese Zahl wurde von Modur et al.3geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Bestätigender Test zur Beurteilung von RNA Pol II und Histonprofil: Immunoblots von indizierten Histon- und RNA-Pol-II-Markierungen in B16-OVA-Zellen, die 72 h oder 1 Woche lang mit Flavopiridol behandelt wurden. Diese Zahl wurde von Modur et al.3geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
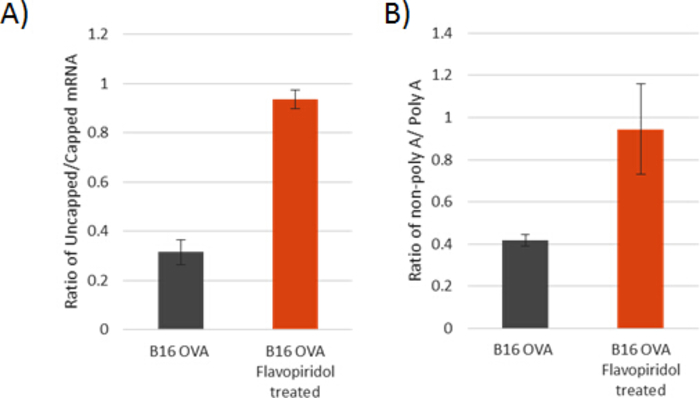
Abbildung 4: Bestätigender Test zur Beurteilung schwerer Defekte in der mRNA-Verarbeitung. Verhältnisse von 5-ungedeckelt zu 5-capped (A) und 3-nicht-polyadenyliert zu 3-polyadenylierten (B) mRNA-Konzentrationen nach rRNA-Erschöpfung in den angegebenen Zelllinien. Fehlerbalken stellen eine Standardabweichung dar, die auf drei technischen Replikationen basiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Bestätigender Test zur Beurteilung des Cytokin-Stimulationsprofils. Immunoblots von STAT1, pSTAT1, NF-B und p NF-B unter Kontrolle und Flavopiridol vorbehandelten B16 OVA-Zellen, stimuliert mit IFN-, IFN- oder TNF-B für 30 min bei (5 ng/mL). Diese Zahl wurde von Modur et al.3geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
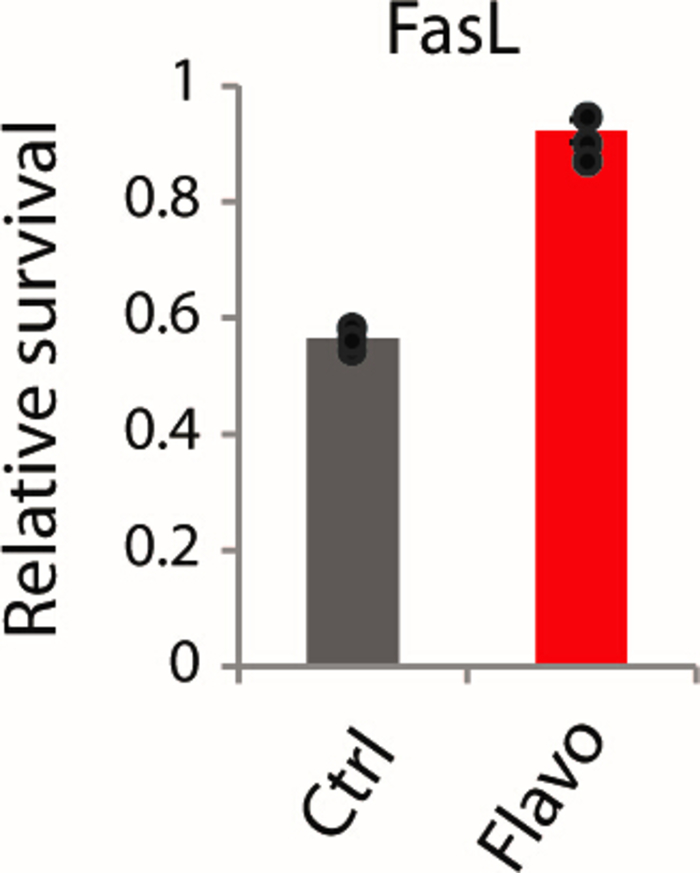
Abbildung 6: Bestätigender Test zur Beurteilung der Resistenz gegen den von FasL vermittelten Zelltod in vitro. Kontroll- und Flavopiridol vorbehandelte B16 OVA-Zellen, die mit FasL für 24-stunden-Auslesung behandelt wurden, gemessen durch Lebensfähigkeitstest. Diese Zahl wurde von Modur et al.3geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
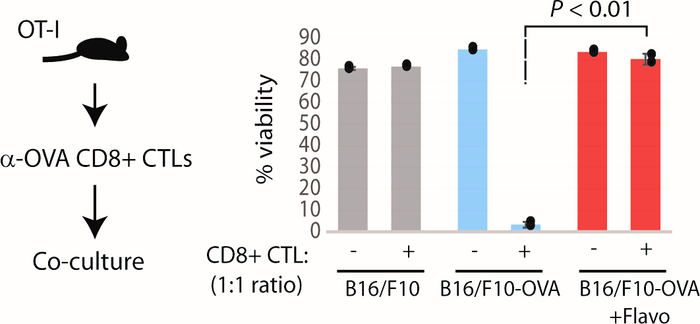
Abbildung 7: Explorativer Test zur Beurteilung der Resistenz von TEdefinitiv Modell gegen Antigen-beschränkte zytotoxische T-Zelle vermitteltangriff in vitro. Links: Schema des Sondierungsversuchs. Rechts: relative Lebensfähigkeit von B16/F10-OVA-Zellen, die mit aktivierten CD8 + CTLs (1:1-Verhältnis) aus den Milz von OT-I-Mäusen isoliert sind. P: Welch Zwei-Probe t-Test. Diese Zahl wurde von Modur et al.3geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die RNA Pol II Dehnungskontrolle hat sich als entscheidender Hebel für die Regulierung der stimulusresponsiven Genexpression zugunsten bösartiger Zellen5,7,8herauskristallisiert. Die Überwindung der promotor-proximalen Pausation bis zur Dehnung und der anschließenden mRNA-Produktion erfordert die Kinase-Aktivität von P-TEFb9,10,11. Unser Modell verwendet Flavopiridol (25 nM), einen Inhibitor der essentiellen cyclinabhängigen Kinase CDK9, um die während der Pol-II-Dehnung bei TE beobachteten Defektezu imitieren – ein bisher unbekannter Phänotyp bei Krebserkrankungen, der von unserer Gruppe entdeckt wurde. zuvor3.
Die CDK9-Kinase-Aktivität ist seit langem als wesentlich für die Phosphorylierung von Serin-2-Rückständen in der CTD der großen Untereinheit von Pol II bekannt. Entscheidend ist, dass es uns gelungen ist, die flavopiridol behandelte chronische Hemmung von CDK9 (25 nM für 1 Woche) in B16/F10 OVA so zu optimieren, dass neben der Hemmung der CTD-Phosphorylierung eine 25 nM Flavopiridol-Behandlung für 1 Woche eine ordnungsgemäße posttranskriptionelle Behandlung verhindert. Veränderungen der mRNA auf unvorhergesehene Weise und effektiv aufhebungn p-TEFb-abhängige produktive Dehnung entlang langer Gene wie pro-entzündliche Reaktion signalierende Gene, die ihre Expressionsmuster sowohl an der mRNA als auch an der mRNA signifikant verändern. Proteinspiegel. Nach bestem Wissen und Gewissen gibt es kein anderes Modell, das in der Literatur beschrieben wird und das auch effektiv erreicht.
Dieses einfach zu etablierende, verallgemeinerbare Modell von TE kann daherdefinitiv genutzt werden, um sowohl transkriptionelle als auch epigenetische Modifikationen zu sezieren, die es TEdefinitiv ermöglichen, sich an immunvermittelte Zellangriffe anzupassen. Darüber hinaus behält dieses murine Modell seine TEdefinitiv-wie die Reduktion der Gesamt- und Phospho-RNA-Pol-II-Spiegel 21 Tage nach der Flavopiridol-Freisetzung in in vivo Wachstumstest3 (hier nicht erwähnt), was auf das Ausmaß der Stabilität dieser nicht-genetisches Modell für weitere In-vivo-Experimente. Es muss jedoch darauf geachtet werden, die genaue subletle Dosis von Flavopiridol für andere murine Linien zu optimieren (z. B. ist etwa 20 nM Flavopiridol-Behandlung für 1 Woche die subletle Dosis für MC38-mininkarzinomlinie; nicht in diesem Protokoll verwendet), die Auswirkungen der Variation in der Zelle Beschichtungsdichte, Kulturbedingungen und Zytokinstimulationsbedingungen können für verschiedene murine Linien variieren. Das hier beschriebene Protokoll bietet ein grundlegendes Framework, um die Variablen zu minimieren, von denen bekannt ist, dass sie für die Erzeugung von TEdefinitiv-ähnliche Funktionen durch chronische CDK9-Hemmung entscheidend sind. Darüber hinaus wurden menschliche Karzinom-Zelllinien wie T47D und CAL51 mit kurzfristigen (3 Tage) Flavopiridol-Behandlungen getestet, die zu ähnlichenTE-ähnlichenRNA-Pol-II-Profilen führen, was auf die Nützlichkeit der Flavopiridol-basierten chronischen Hemmung hindeutet. von CDK9 vermittelt Transkriptionsdehnung bei der Schaffung sogar Modell menschliche Linien, um TEauf jeden Fallzu studieren.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde teilweise unterstützt durch NCI (CA193549) und CCHMC Research Innovation Pilot Awards an Kakajan Komurov und Department of Defense (BC150484) Award an Navneet Singh. Der Inhalt liegt allein in der Verantwortung der Autoren und stellt nicht unbedingt die offizielle Meinung des National Cancer Institute oder des Department of Defense dar. Die Geldgeber spielten keine Rolle bei der Erstellung, Datenerhebung und -analyse, der Entscheidung zur Veröffentlichung oder der Vorbereitung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| hhis6FasL | Cell Signaling | 5452 | |
| 10X TBS | Bio-Rad | 170-6435 | |
| 12 well plates | Falcon | 353043 | |
| 20% methanol | Fisher Chemical | A412-4 | |
| 24-well plates | Falcon | 351147 | |
| 4–18% SDS polyacrylamide gel | Bio-Rad | 4561086 | |
| 4% Paraformaldehyde | Thermo Fisher Scientific | AAJ19943K2 | |
| 5% dry milk | Bio-Rad | 170-6404 | |
| 7-Methylguanosine antibody | BioVision | 6655-30T | |
| 96-well plates | Cellstar | 655180 | |
| AF647-conjugated mouse CD8 | Biolegend | 100727 | |
| antibiotic and antimycotic | Gibco | 15240-062 | |
| anti-His antibody | Cell Signaling | 2366 P | |
| Anti-Rabit | Cell Signaling | 7074 | Dilution 1:5000 |
| Anti-Rat | Cell Signaling | 7077S | Dilution 1:5000 |
| Bradford assay Kit | Bio-Rad | 5000121 | |
| BSA | ACROS Organics | 24040-0100 | |
| BV421-conjugated mouse CD45 | Biolegend | 109831 | |
| crystal violet | Sigma | C3886-100G | |
| DMEM | Gibco | 11965-092 | |
| Dynabeads Oligo (dT)25 | Ambion | 61002 | |
| FBS | Gibco | 45015 | |
| Fixable Live/Dead staining dye e780 | eBioscience | 65-0865-14 | |
| Flavopiridol | Selleckchem | S1230 | |
| H3k36me3 | Abcam | ab9050 | Dilution 1:2000 |
| IFN-α | R&D systems | 12100-1 | |
| IFN-γ | R&D systems | 485-MI-100 | |
| IMDM | Gibco | 12440053 | |
| Immobilon Western Chemiluminescent HRP Substrate | Millipore | WBKLS0500 | |
| MojoSort Mouse CD8 T Cell Isolation Kit | Biolegend | 480007 | |
| NF-κB | Cell Signaling | 8242s | Dilution 1:1000 |
| PBS | Gibco | 14190-144 | |
| p-NF-κB | Cell Signaling | 3033s | Dilution 1:1000 |
| p-Ser2-RNAPII | Active Motif | 61083 | Dilution 1:500 |
| p-Ser5-RNAPII | Active Motif | 61085 | Dilution 1:1000 |
| p-STAT1 | Cell Signaling | 7649s | Dilution 1:1000 |
| RiboMinu Eukaryote Kit | Ambion | A10837-08 | |
| RIPA buffer | Santa Cruz Biotechnology | sc-24948 | |
| RNAPII | Active Motif | 61667 | Dilution 1:1000 |
| STAT1 | Cell Signaling | 9175s | Dilution 1:1000 |
| TNF-α | R&D systems | 410-MT-010 | |
| total H3 | Cell Signaling | 4499 | Dilution 1:2000 |
| Tri reagent | Sigma | T9424 | |
| Triton | Sigma | T8787-50ML | |
| Tween 20 | AA Hoefer | 9005-64-5 | |
| β-Actin | Cell Signaling | 12620S | Dilution 1:5000 |
| β-ME | G Biosciences | BC98 |
Referenzen
- Adelman, K., Lis, J. T. Promoter-proximal pausing of RNA polymerase II: emerging roles in metazoans. Nature Reviews Genetics. 13 (10), (2012).
- Margaritis, T., Holstege, F. C. Poised RNA polymerase II gives pause for thought. Cell. 133 (4), 581-584 (2008).
- Modur, V., et al. Defective transcription elongation in a subset of cancers confers immunotherapy resistance. Nature Communications. 9 (1), 4410 (2018).
- Hargreaves, D. C., Horng, T., Medzhitov, R. Control of inducible gene expression by signal-dependent transcriptional elongation. Cell. 138 (1), 129-145 (2009).
- Adelman, K., et al. Immediate mediators of the inflammatory response are poised for gene activation through RNA polymerase II stalling. Proceedings of the National Academy of Sciences of the United States of America. 106 (43), 18207-18212 (2009).
- van Stipdonk, M. J., Lemmens, E. E., Schoenberger, S. P. Naïve CTLs Require a Single Brief Period of Antigenic Stimulation for Clonal Expansion and Differentiation. Nature Immunology. 2 (5), 423-429 (2001).
- Gilchrist, D. A., et al. Regulating the regulators: the pervasive effects of Pol II pausing on stimulus-responsive gene networks. Genes & Development. 26 (9), 933-944 (2012).
- Danko, C. G., et al. Signaling pathways differentially affect RNA polymerase II initiation, pausing, and elongation rate in cells. Molecular Cell. 50 (2), 212-222 (2013).
- Nechaev, S., Adelman, K. Pol II waiting in the starting gates: Regulating the transition from transcription initiation into productive elongation. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms. 1809 (1), 34-45 (2011).
- Zhou, M., et al. Tat modifies the activity of CDK9 to phosphorylate serine 5 of the RNA polymerase II carboxyl-terminal domain during human immunodeficiency virus type 1 transcription. Molecular and Cellular Biology. 20 (14), 5077-5086 (2000).
- Palancade, B., Bensaude, O. Investigating RNA polymerase II carboxyl‐terminal domain (CTD) phosphorylation. European Journal of Biochemistry. 270 (19), 3859-3870 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten