Method Article
Alta resolución imagen Confocal de la barrera hemato - encefálica: proyección de imagen, reconstrucción 3D y cuantificación de transcitosis
En este artículo
Resumen
Aquí presentamos un protocolo basado en la microscopía para la proyección de imagen de alta resolución y una reconstrucción tridimensional del ratón unidad neurovascular y barrera blood - brain con secciones libres del cerebro. Este método permite la visualización, análisis y cuantificación de los organelos intracelulares en el BBB.
Resumen
La barrera blood - brain (BBB) es una interfaz multicelular dinámica que regula el transporte de moléculas entre la circulación y el cerebro. Transcitosis a través de la BBB regula la entrega de hormonas, metabolitos y anticuerpos terapéuticos a la parenquimia del cerebro. Aquí, presentamos un protocolo que combina la inmunofluorescencia de secciones libre-flotante con láser de barrido, microscopia confocal y análisis de imágenes para visualizar organelos subcelulares dentro de las células endoteliales en el BBB. La combinación de este conjunto de datos con software de análisis de imagen en 3D permite la segmentación semiautomática y cuantificación de volumen capilar y superficie, así como el número y la intensidad de los organelos intracelulares en el BBB. La detección de mouse endógena de la inmunoglobulina (IgG) dentro de vesículas intracelulares y su cuantificación en el BBB se utiliza para ilustrar el método. Potencialmente, este protocolo puede aplicarse a la investigación de los mecanismos de control BBB transcitosis de diferentes moléculas en vivo.
Introducción
La barrera blood - brain (BBB) es una barrera celular continua formada por astrocitos, pericitos, las neuronas y las células endoteliales que separa el sistema nervioso central (SNC) de la circulación de la sangre1. La regulación del transporte a través de la BBB desempeña un papel crucial en el mantenimiento de la homeostasis del cerebro y está mediada por las características especializadas de las células endoteliales del cerebro (BECs). La presencia de uniones intercelulares estrechas entre BECs y una baja tasa basal de transcitosis limitar el transporte paracelular y transcelular de moléculas por la sangre, respectivamente2. Recientemente, la vía transcitosis en BECs ha sido aprovechada para mejorar la entrega de grandes moléculas terapéuticas al cerebro3,4. Sin embargo, los mecanismos de la transcitosis a través de la BBB aún no han sido completamente caracterizadas5,6.
Trabajo extenso se ha hecho en vitro para descifrar los mecanismos celulares y moleculares que regulan el transporte intracelular a través de BECs7,8,9,10, 11, pero estos sistemas no recapitular la compleja arquitectura y fisiología de la unidad neurovascular (NVU). Por otro lado, estudios en vivo12,13 proporcionar información cuantitativa detallada sobre las tarifas de transporte a través de la BBB, pero no proporcionan penetraciones en los mecanismos intracelulares de transporte. Por lo tanto, investigar los componentes celulares e intracelulares de la NVU in vivo y ex vivo sigue siendo muy difícil14. Sólo un número limitado de técnicas es susceptible de analizar estructuras subcelulares dentro de las células del NVU. Mayoría de los estudios utiliza la microscopia electrónica, pero esta técnica está limitada por los protocolos complejos necesarios para preparación de tejido adecuado y manejo de la muestra. Por lo tanto, hemos establecido una metodología basada en microscopía confocal de alta resolución que facilite el procesamiento de muestras de cerebro, el análisis y la cuantificación de compartimentos subcelulares dentro de las células del NVU.
Aquí, describimos un protocolo que utiliza secciones libre-flotante del cerebro de ratón para realizar la proyección de imagen cuantitativa de la BBB y NVU a nivel celular y subcelular. Había probado y validado una serie de anticuerpos de la imagen y reconstruir el NVU en tres dimensiones. Además, este protocolo permite la proyección de imagen en la resolución óptica máxima de difracción limitada de orgánulos dentro de los capilares del cerebro. Junto con análisis de imagen, este protocolo puede utilizarse para investigar el transporte intracelular de macromoléculas a través de la BBB bajo diferentes condiciones experimentales, por ejemplo, en modelos de ratón de la enfermedad de la neurodegeneración.
Protocolo
aprobación ética para este estudio fue suministrada por la Federal la seguridad alimentaria y la Oficina veterinaria de Suiza. Todos los experimentos con animales se llevaron a cabo en estricta observancia a la ordenanza federal Suiza sobre protección animal y el bienestar, así como según las reglas de la Asociación para la evaluación y acreditación de laboratorio Animal Care Internacional (AAALAC).
1. generación de secciones del cerebro Free-floating
- para asegurar la calidad óptima de la muestra, preparar una solución fresca de 2% paraformaldehido (PFA) en solución salina buffer fosfato (PBS) en el día de la perfusión.
PRECAUCIÓN: PFA es moderadamente tóxico por contacto con la piel y un probable carcinógeno. Utilice guantes de nitrilo PFA para preparar la solución bajo una campana de vapores químicos.- Preparar 60 mL de solución PFA por animal.
- Traer PFA en solución aumentar el pH con 180-200 μL de una solución KOH de 5 M por cada 100 mL de PBS y calentando la solución hasta 60 ° C.
Nota: NaOH no debería utilizarse como afecta negativamente preservación de tejidos sobre fijación. - Deje que la solución se enfríe a temperatura ambiente y llevar el pH a 7.4 con HCl. filtro la solución utilizando papel de filtro (véase Tabla de materiales).
- Realizar una fijación de ratón toda via transcardial perfusión como se describió anteriormente 15 con algunas modificaciones. En primer lugar, limpiar la sangre de la vasculatura usando 20 mL de PBS y perfusión con 40 mL de 2% PFA.
- Quitar el cerebro del cráneo como se describió anteriormente 15.
- Sumergir un recién 2% perfunde por el PFA cerebro 20 ml 2% PDA de 7 h a 4 ° C para la posterior fijación.
Nota: Aumentar la incubación en PFA no se recomienda ya que puede prevenir la detección de estructuras intracelulares. - Extensivamente lavado el cerebro con PBS helado.
- Embed arreglado cerebros en agarosa.
Solución
- preparar una agarosa al 3% en PBS con un microondas para calentar. Agite suavemente la solución para enfriarlo, pero evitar la solidificación.
- Secar el exceso de PBS en el cerebro antes de la inmersión en la solución de agarosa en un recipiente de plástico. Gire el cerebro dentro de la agarosa para eliminar burbujas de aire. Permitir que la agarosa a solidificar por enfriamiento en hielo.
- Con cuidado retire el bloque de agarosa el envase de plástico y cortar un cubo alrededor del cerebro usando una cuchilla de afeitar. Montar el cerebro sobre un soporte de espécimen de vibratome (véase Tabla de materiales) con pegamento de cianocrilato (véase Tabla de materiales). Permitir tiempo suficiente para que el pegamento se solidifique antes de proceder con el seccionamiento.
- Transferencia del cerebro en las mordazas a la bandeja de búfer de vibratome lleno con PBS. Utilice el vibratome a la sección 100 rebanadas de cerebro μm (sagitales o coronales). Recoge secciones del cerebro en una placa de 6 pozos previamente llenado con PBS.
- En secciones de cerebro acabado, quite cuidadosamente PBS y reemplazar con una solución de 1:1 de PBS/glicerol.
- Almacene las secciones en PBS/glicerol a -20 ° C.
2. Célula o el orgánulo etiquetado manchando de la inmunofluorescencia
- cuidadosamente transferencia una sección del cerebro en un pozo de una placa de 24 pocillos previamente llenado con 500 μl de PBS por pozo. La sección se mantendrá en el mismo pozo hasta el final del procedimiento de.
- Enjuague la sección dos veces con 500 μl de PBS durante 5 minutos bajo agitación suave.
- Quitar el PBS y efectuar bloqueo simultáneo y permeabilización de rebanadas cerebrales.
Suero de burro de
- Prepare una solución de bloqueo y permeabilización con 0.3% Triton-X y 10% en PBS.
Nota: Suero de burro puede ser sustituido con suero de cabra para que coincida con la especie de los anticuerpos secundarios específicos utilizados. - Incubar secciones con 250 μl de solución de bloqueo y permeabilización por 1 h a temperatura ambiente en agitación suave.
- Prepare una solución de bloqueo y permeabilización con 0.3% Triton-X y 10% en PBS.
- Retirar la solución y agregar una solución de PBS con 5% de suero de burro y el anticuerpo primario en una dilución adecuada (p. ej., 1: 100 a 1:1, 000). Incubar durante una noche a 4 ° C bajo agitación suave.
Nota: Consulte la Tabla de materiales para obtener una lista de anticuerpos que etiquetar correctamente los diferentes tipos de células de NVU con este protocolo. La dilución óptima de anticuerpos primarios debe ser determinada empíricamente. Etiquetado simultánea de diferentes antígenos, diluir los anticuerpos primarios en la misma solución. Los anticuerpos primarios deben plantearse en diferentes especies. Para mejorar la penetración de anticuerpos, las muestras pueden incubarse hasta 72 h a 4 ° C. - Eliminar anticuerpo solución lavado secciones y tres veces durante 10 minutos en PBS bajo agitación suave a temperatura ambiente. Retirar el PBS y añadir 250 μl PBS solución que contiene 5% burro suero y el anticuerpo secundario marcado con fluorescencia específicos apropiado. Incubar las secciones a temperatura ambiente durante 1 hora bajo agitación suave.
- Ver Tabla de materiales para obtener una lista de los anticuerpos secundarios utilizados con este protocolo de.
- Eliminar las secciones de solución y lavado de anticuerpos tres veces durante 10 minutos en PBS bajo agitación suave a temperatura ambiente.
- PBS de quitar y añadir 250 μl de 4 ', 6-diamidino-2-phenylindole (DAPI) solución con una concentración final de 1 μg/mL. Incubar las secciones a temperatura ambiente durante 10 minutos bajo agitación suave. Retirar las secciones de la solución y lave DAPI 3 veces durante 5 minutos con PBS.
- Monte la sección del cerebro en vinculación portaobjetos de microscopía (e.g., diapositivas de vidrio de histo-bond). Retire con cuidado el exceso PBS alrededor de la sección de la diapositiva. Añada una gota de medio de montaje (véase tabla de materiales) en la parte superior de la sección del cerebro y con cuidado la tapa con un cubreobjetos de vidrio borosilicato de 0,17 mm (no. 1.5).
- Almacenar las muestras a 4 ° C protegido de la luz hasta realizar la adquisición de la imagen.
3. Alta resolución de imagen Confocal de la Barrera Blood - brain
- realizar adquisición de imágenes con un conveniente escaneo de láser confocal microscopio (véase Tabla de materiales) con las líneas láser en el 405, 488, 561 y 633 nm para la excitación de fluoróforos en las regiones del espectro de luz azul, verdes, naranjas y rojas. Para la adquisición de la imagen, utilice un 63 X objetivo de aceite con una apertura numérica de 1.4.
- En la adquisición menu del software que controla el microscopio, hay que configurar la imagen parámetros de adquisición. En el menú desplegable de ‘ tamaño de la imagen ’, seleccione un valor de 1024 x 1024 píxeles. Modificar el tamaño del pixel en un valor entre 200 y 300 nm ajustando el valor de la ‘ Zoom ’ menú ”
Nota: para el análisis de las estructuras intracelulares, reducir el tamaño de píxel a 75 nm. Este ajuste de tamaño de imagen considerablemente aumenta el tiempo de adquisición y puede reducirse a 512 x 512 píxeles para reducir el tiempo de adquisición por proyección de imagen un campo de visión más pequeño. - En el ' la velocidad de ' menú desplegable, seleccione un valor de 400 Hz, es decir, 400 líneas por segundo. En el ' de configuración del sistema & #39; menú, seleccione la ' profundidad de Pixel ' menú desplegable y cambie el valor a 12 bit.
- En el software del microscopio, dentro de la ' adquisición de ' pestaña, cambiar la opción para la adquisición de estructura secuencial. Establece el grosor de corte óptico en un valor entre 0.75 y 1 μm de cada canal modificando el valor de la ' agujero ' menú.
- En el panel de excitación fluorescente, activar el láser requerido óptimo excitar los fluoróforos en la muestra, por ejemplo un 488 nm línea láser para un fluoróforo de emisión verde.
Nota: Utilice un visor de espectros del fluoróforo (véase Tabla de materiales) para seleccionar el láser de excitación adecuada. - En el panel de detección fluorescente, mueva el control deslizante para seleccionar las longitudes de onda que se medirá en cada canal, por ejemplo entre 510 y 550 nm de un fluoróforo de emisión verde.
Nota: Utilice un visor de espectros del fluoróforo (véase Tabla de materiales) para seleccionar las longitudes de onda de detección adecuada. - Añadir una gota de aceite de inmersión con un índice de refracción de 1,52 encima el cubreobjetos con la sección del cerebro para emparejar el índice de refracción del vidrio cubreobjetos y objetivo. Coloque la muestra en el microscopio y encender la luz epifluorescente para visualizar la muestra usando los binoculares microscopio.
- Usando los botones en el stand de microscopio, cambiar la rueda de filtros para seleccionar un filtro apropiado para visualizar núcleos teñidos de DAPI. El foco grueso se usa para hacer la señal de los núcleos teñidos de DAPI en foco.
- Usando los botones en el stand de microscopio, cambio de filtros para visualizar la señal de los marcadores vasculares (por ejemplo, CollagenIV o CD31) y centro del campo de visión en un segmento capilar individual.
- Presione el botón para iniciar el modo live-scan. Durante la exploración de ajustar la ganancia y láser de intensidad para cada canal maximizar el rango dinámico de las imágenes y evitar la saturación de píxeles.
Nota: Use una tabla de búsqueda que etiquetas pixeles saturados para evaluar visualmente la sobresaturación. Para evitar la sobre saturación de señal, ajustar la configuración con la muestra que se espera que tenga la señal fluorescente más. - Establecer el valor de la línea con un promedio de 2.
Nota: Al utilizar mayores velocidades de adquisición, aumente este valor para reducir el ruido de. - Establecer comienza y terminan las secciones para realizar ópticas z-pilas que abarcan todo el volumen del tubo capilar. Utilizar un tamaño de paso de 0.45 μm.
Nota: Si va a utilizar imágenes para su posterior cuantificación, mantenga los mismos ajustes de adquisición para el conjunto de datos completo. - Para la cuantificación, adquirir z-pilas de 10 a 20 según la sección de al menos tres ratones diferentes para las comparaciones estadísticas.
Nota: Adquirir el conjunto completo de datos en la misma sesión para reducir la variabilidad derivadas de fluctuaciones de la intensidad del blanqueo y láser muestra.
4. Reconstrucción 3D y procesamiento de la unidad Neurovascular de la imagen
- (opcional) para aumentar la resolución axial de las pilas de z adquiridas, realizar deconvolución del conjunto de datos de imagen utilizando el software apropiado (véase la tabla de materiales ).
- En el software de deconvolución, cambie la configuración a realizar " ciega " deconvolución, (es decir, utilizando una función de punto de expansión adaptativa).
- En la configuración de software de deconvolución, alternar la opción de eliminación de fondo; esta opción determinará el valor mínimo de la intensidad de la pila de la imagen y restar de los valores de intensidad de los píxeles de la imagen.
- En la configuración de software de deconvolución, alternar desactivar las opciones de reescalado intensidad y cambiar el tamaño a 16 bits de profundidad; estas opciones mantienen los valores originales de intensidad y rango dinámico de las imágenes.
- En el menú de ' índice de refracción ', establezca el valor en 1.52. En el ' longitud de onda Set ' menú, seleccione la emisión de valores para cada canal de la imagen. Por ejemplo, seleccione 520 para un fluoróforo de emisión verde.
- Abrir el conjunto de datos de imagen utilizando el software adecuado para la visualización y análisis de conjuntos de datos de 3 dimensiones (véase Tabla de materiales). En el software de análisis de imagen, pulse la " Surpass " botón para procesar el volumen 3D de tubos capilares.
- En la prensa de software de análisis de imagen del " agregar nueva superficie " botón para segmentar la superficie capilar. Use la flecha inferior para moverse entre los pasos en el Asistente de creación superficie.
- En el ' crear ' pestaña, el canal de la fuente al canal con marcador capilar, por ejemplo CollagenIV y el detalle de la superficie a un valor de 0,5 μm.
Nota: La última opción aplica un filtro gaussiano a la imagen y determina la suavidad de la superficie. - En el ' crear ' pestaña, cambiar la opción umbral de intensidad absoluta.
Nota: Esta opción crea una superficie generando una máscara basada en la intensidad absoluta del canal seleccionado en la imagen. - En el siguiente paso en el Asistente de creación de superficie, ajustar el umbral de intensidad bajo la superficie moviendo la ventana a través del histograma de intensidad hasta que la máscara representada cubre el tubo capilar todo en la imagen. Determinar el rango de valor para este parámetro empíricamente para cada conjunto de datos.
- En el paso final del asistente de creación de superficie, haga clic en el menú desplegable en " tipo de filtro " y seleccione la opción ' número de Voxels '. Establece el número mínimo de voxels en un valor entre 1.0e5 a 2.0e5.
Nota: Esta opción excluye las superficies con un pequeño número de voxels, por ejemplo, pequeños segmentos de tubos capilares en el borde del marco de la. - Finalizar el Asistente de creación de superficie y guardar los parámetros de creación haciendo clic en " recordar parámetros " en la ficha de reconstrucción de la superficie menú.
- Repita el procedimiento para todo el conjunto de datos de imágenes por cargar el conjunto de parámetros utilizado para la primera imagen. Ajustar los parámetros de intensidad, umbral y mínimo número de voxels para cada imagen para tener en cuenta las diferencias en la intensidad de fondo y morfología capilar, respectivamente.
- En el ' crear ' pestaña, el canal de la fuente al canal con marcador capilar, por ejemplo CollagenIV y el detalle de la superficie a un valor de 0,5 μm.
- Segmento estructuras vesiculares intracelulares (por ejemplo, endosomas lleno de inmunoglobulina), primero crear un nuevo canal que incluye sólo una señal fluorescente de dentro del tubo capilar.
Nota: Este proceso definirá una región de interés mediante la creación de una máscara con la superficie capilar, creada en el paso 4.3- Seleccione el ' edición ' menú de la ' superficie capilar ' panel. En ' propiedades de la máscara ', haga clic en " máscara todos ". Seleccionar el canal que contiene la señal intracelular vesícula como el ' canal de la fuente ' y cambiar en la opción " duplicar canal antes de aplicar la máscara ".
- En el ' configuración de la máscara ' columna, seleccione " constante interior/exterior " y " conjunto de voxels fuera de la superficie a: " y establezca su valor a 0.00.
Nota: Este proceso creará un canal adicional en la imagen donde todos los vóxeles fuera de la mascarilla capilar tendrá un valor de intensidad de 0. Para cuantificar eventos fuera del tubo capilar (es decir, en el parénquima cerebral), elija " conjunto de voxels en superficie a: " y establezca su valor a 0.00. - Segmento estructuras vesiculares, presione el botón para iniciar el " agregar nuevos puntos " asistente. Use la flecha inferior para moverse entre los pasos en el Asistente de creación superficie.
- En la ficha crear, utilice el menú desplegable " canal de la fuente " para seleccionar el canal enmascarado intracelular creado en el punto 4.4.4.
- En la ficha crear, en el " punto detección de " sección, el diámetro estimado de XY a un valor entre 0,5 y 1 μm, dependiendo del tamaño promedio de vesículas observadas en el experimento. Esta opción determina el tamaño más pequeño que será detectado por el algoritmo de segmentación.
- En la ficha crear, en el " punto detección de " sección, cambiar la opción para " fondo ".
Nota: Esta opción alisa la imagen con un filtro gaussiano de 0,75 punto Radio (desde el valor seleccionado en el paso 4.4.7) y luego restando la intensidad de la imagen original de Gauss filtrados por 0.88 radio spot. - En el ' crear ' ficha, pulse el menú desplegable debajo de ' tipo de filtro ' y seleccione " calidad ". Tenga en cuenta que esto será segmentar la imagen mediante la aplicación de umbrales basados en la intensidad en el centro de los lugares. Ajuste del umbral de intensidad inferior al mover la ventana a través de la ' calidad ' histograma hasta la mayoría de las vesículas identificables está etiquetada.
Nota: El rango de valor de este parámetro debe ser determinado empíricamente para cada conjunto de datos. - Finalizar el Asistente de creación de spot y guardar los parámetros de creación pulsando el botón " recordar parámetros " en la ficha de reconstrucción de la superficie menú.
- Repita el procedimiento para todo el conjunto de datos de imágenes por cargar el conjunto de parámetros utilizado para la primera imagen. Ajustar los parámetros para el ' umbral de intensidad calidad ' para cada imagen para tener en cuenta las diferencias en la intensidad de fondo.
5. Cuantificación del transporte intracelular en el BBB
- cuantificar el volumen (en μm 3) y zona (en μm 2) del segmento del capilar. En el software de análisis, acceder al panel de estadísticas de la superficie vascular creado en el paso 4.3. Seleccione la ' detalle ' pestaña y utilice el menú desplegable para seleccionar " todos los valores " para encontrar los valores de volumen y área.
- Cuantificar el número de vesículas dentro del segmento de capilar. En el software de análisis, acceder al panel de estadísticas de los lugares que se creó en el paso 4.4. Seleccione el ' general ' ficha para encontrar el valor del número total de puntos en la imagen.
- Para calcular el número de vesículas por volumen capilar, para cada imagen normaliza el número de puntos por el volumen calculado en el paso 5.1. Multiplicar este valor por 1.000 para obtener el número de vesículas por 1.000 μm 3 del volumen capilar.
- Para cuantificar la intensidad total dentro del tubo capilar crea una nueva superficie que cubre los siguientes toda la imagen, las instrucciones se describen en los pasos 4.3 con las siguientes modificaciones. Seleccione el canal que contiene la señal pertinente (por ejemplo, mIgG) como canal de la fuente y ajuste el nivel de detalle de superficie a 5 μm. Para crear una superficie que cubre toda la imagen, establezca el valor del umbral de intensidad inferior en 0.
- En el software de análisis, acceder al panel de estadísticas de la superficie creada en el paso 5.4. Seleccione la " detalle " pestaña y utilice el menú desplegable para seleccionar " todos los valores ". Registrar los valores de ' intensidad suma ' de los canales de interés; Este parámetro corresponde a la suma de los valores de intensidad individual sobre todos los píxeles.
Nota: Para una señal intracelular, esto corresponde al canal duplicado con vóxeles fuera de la superficie a 0.0. Para una señal en el parénquima cerebral, esto corresponde al canal duplicado con voxels en superficie a 0.0. - Para calcular la intensidad de fluorescencia por volumen capilar, para cada imagen normaliza la intensidad por el volumen calculado en el paso 5.1. Multiplicar este valor por 1.000 para obtener el valor de la intensidad de fluorescencia por 1.000 μm 3 del volumen capilar.
Nota: Para señales fluorescentes en el parénquima cerebral, normalizar los valores por el volumen de la imagen total menos el volumen capilar y se multiplican por 1.000 para obtener la intensidad total por 1.000 μm 3 de la parenquimia del cerebro. - Repita el procedimiento para el conjunto de datos y utilizar software apropiado para realizar análisis estadístico de los datos.
Resultados
Como ejemplos representativos de las imágenes obtienen desde el protocolo descrito aquí, secciones de cerebro de ratón fueron teñidas con anticuerpos reconocer distintos componentes de NVU incluyendo la membrana basal, astrocitos, pericitos y células endoteliales (véase Tabla de materiales para anticuerpos específicos utilizados) (figura 1A, D y E). En esta resolución es posible distinguir los procesos astrocytic individuales y final-pies que están en contacto directo con los capilares.
Para resaltar la idoneidad de este protocolo para la detección de estructuras intracelulares, secciones del cerebro de animales inyectados periféricamente con el anticuerpo humano anti-Tau mAb86 de16 fueron teñidas con un anticuerpo antihumano marcado con fluorescencia ( Figura 1B). mAb86 es conocido específicamente las neuronas objetivo expresar de una forma patológica de Tau16. Utilizando el protocolo descrito en este documento, mAb86 fue detectado con la resolución de la difracción limitada dentro de estructuras vesiculares individuales dentro de las neuronas (figura 1B-C). Además, endógeno ratón IgG fue detectado en las estructuras intracelulares en las células endoteliales, pero no en pericitos (D-E de lafigura 1y figura 2).
La adquisición de alta resolución z-pila confocal de la vasculatura cerebral permite segmentación tridimensional de capilares y de vesículas intracelulares en el BBB. La figura 2 muestra un ejemplo del proceso de procesamiento y segmentación de un capilar con CollagenIV y ratón IgG positiva intracelular vesículas. Mediante la cuantificación de un conjunto completo de datos de imágenes segmentadas, por ejemplo midiendo el número de vesículas por volumen capilar, es posible estudiar los cambios en los procesos de transporte intracelular bajo diferentes condiciones. Figura 3 B-C muestra las diferencias en intensidad de número y de la fluorescencia de la vesícula de mIgG correspondientes a mIgG en el parénquima cerebral, respectivamente, sobre pericyte agotamiento en el modelo de ratón de pdgf-bret/ret como previamente divulgados 17. el mismo método fue utilizado recientemente para analizar cambios en el transporte intracelular en el BBB entre cerebro diferentes regiones18.

Figura 1: Etiquetado de múltiples tipos de células y estructuras subcelulares de la neurovascular unidad. Imágenes representativas de la unidad neurovascular (A y D) y vesículas intracelulares dentro de las neuronas (B) o las células endoteliales (E) obtenidas con este protocolo. La imagen de proyección de intensidad máxima en A (arriba) muestra la distribución de astrocitos GFAP-positivo (rojo) que rodean los capilares etiquetados por CollagenIV (verde). Las flechas apuntan hacia los procesos astrocytic. Barra de escala = 20 μm. En esta resolución, los procesos de los astrositos y final-pies son claramente visibles, como se muestra en la imagen ampliada de la región en caja (abajo). Puntas de flecha señalan al final-pies astrocíticos. Barra de escala = 10 μm. La imagen B muestra la acumulación de un anticuerpo inyectado periféricamente, mAb86 (verde), dentro de una neurona del hipocampo. Puntas de flecha señalan a vesículas mAb86-positivas individuales. Barra de escala = 10 μm. El gráfico c muestra la intensidad del perfil de línea de una sola vesícula. El tamaño de la vesícula se estimó de la anchura total en medio máximo de un ajuste gaussiano (línea continua negra) de la curva de intensidad (línea verde y círculos). Las imágenes en D muestran una reconstrucción tridimensional de una célula endotelial (verde) rodeada por un pericyte (rojo) dentro de la lámina basal (CollagenIV, gris). Los paneles inferiores muestran los canales individuales de la fluorescencia. Barra de escala = 10 μm. Las imágenes en E muestran la localización de mIgG (rojo) en vesículas intracelulares en las células endoteliales (panel, CD31 en verde a la izquierda) pero no en pericitos (panel de la derecha, CD13 en verde). En todas las imágenes, DAPI manchado núcleos aparecen en azul. Barra de escala = 5 μm. paneles D y E han sido modificados de la referencia17. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Representación tridimensional de capilares y de vesículas intracelulares en la barrera blood - brain. Con el protocolo descrito, alta resolución imágenes confocales de capilares CollagenIV-positiva (verde) y el ratón IgG vesículas intracelulares (rojo) fueron adquirieron (A). El panel izquierdo muestra una sola sección óptica con cortes transversales. Las flechas señalan individuales positivo mIgG vesículas dentro de las células endoteliales del cerebro. El panel sobre la reconstrucción de la derecha muestra el 3D de la z-stack completo utilizando software de procesamiento de la imagen (véase Tabla de materiales). El volumen capilar (B) y vesículas individuales (C) se representa en tres dimensiones y cuantificado utilizando software de procesamiento de imagen (véase Tabla de materiales). En todas las imágenes, DAPI manchado núcleos aparecen en azul. Barras de la escala = 5 μm. haga clic aquí para ver una versión más grande de esta figura.
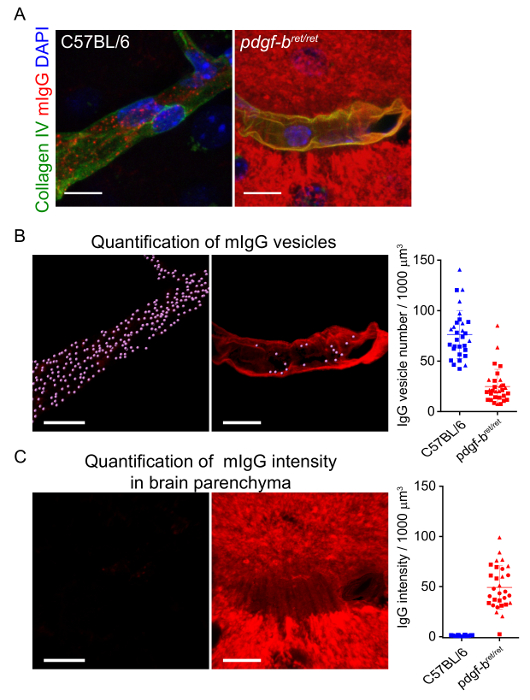
Figura 3 : Cuantificación de localización intracelular mIgG en el BBB. Imágenes representativas que muestran (A) reconstrucción tridimensional de capilares (etiquetados con collagenIV, verde) y la distribución de mIgG (rojo) en ratones C57BL/6 y el pdgf-bret/ret pericyte agotan ratones descrito previamente en19. Barras de la escala = 10 μm. Las imágenes en B muestran la segmentación de vesículas intracelulares dentro de la máscara de CollagenIV. THe el gráfico b muestra la cuantificación y comparación de número de vesícula mIgG por volumen del tubo capilar. Cada punto representa las medidas de los segmentos capilares individuales. La línea continua muestra la media y las barras de error representan el desvío estándar de los datos. Las imágenes de ver C el señal de fluorescencia mIgG fuera de la máscara de CollagenIV. Asimismo, el gráfico en C muestra la cuantificación y comparación de la intensidad de fluorescencia mIgG en el parénquima cerebral entre ratones C57BL/6 y pdgf-bret/ret ratones pericyte agotado. Unidades de intensidad de fluorescencia se normalizaron por la intensidad de parénquima mIgG promedio medida en todos los ratones C57BL/6. Esta figura se ha modificado de la referencia17. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo descrito anteriormente describe la preparación de secciones del cerebro flotante, tinción inmunofluorescente, adquisición de imágenes y parámetros de análisis de microscopía de alta resolución de la BBB. Este método se ha utilizado recientemente para investigar la localización del anticuerpo entrega plataformas3, el transporte de IgG endógeno a través de la BBB17y la heterogeneidad de la BBB a pericyte pérdida18. Diferentes pasos en el protocolo pueden ser modificados para adaptarse al objetivo específico del experimento. En primer lugar, el uso de secciones gruesas (100 μm) facilita su manipulación durante el procedimiento de inmunotinción y montaje. También permite para reconstrucción 3D de la red capilar, de la unidad neurovascular y para la generación de capilar y cortes transversales NVU. Sin embargo, penetración de anticuerpos dentro de las secciones de tejido puede variar y algunas manchas del anticuerpo pueden ser restringido a la capa superficial del tejido cerca el cubreobjetos. El protocolo puede modificarse aumentando la concentración de detergente durante el paso de permeabilización o la longitud del paso de permeabilización para mejorar la penetración de anticuerpos en el tejido. En segundo lugar, la calidad de imagen puede verse comprometida cuando se trata de adquisición de imágenes más profundas dentro del tejido (generalmente de 20 a 30 μm por debajo de la superficie) debido a la dispersión de la luz así como aberraciones ópticas de índice de refracción de desajuste. Para superar este problema, nuevos métodos de tejido claro y anticuerpo activa penetración20 pueden combinarse con este protocolo a volúmenes más grandes de la imagen de los tejidos. En tercer lugar, la deconvolución se realiza después de la adquisición de imagen para mejorar la resolución axial de la imagen. La elección del algoritmo de deconvolución ciega utilizado en este protocolo se basó en (i) su facilidad de uso, ya que ningún cálculo previo de la función de punto de propagación se requiere, (ii) su robustez para mejorar la calidad de imagen21y (iii) la falta de artefactos en mIgG estructuras intracelulares después de la implementación. Dependiendo de las estructuras intracelulares visualizadas en la muestra, pueden resultar otros algoritmos de deconvolución en alta calidad de imagen. Las siguientes referencias21,22 proporciona una discusión extensa sobre las ventajas y limitaciones de los algoritmos adicionales para la deconvolución de la imagen. Finalmente, el uso de un paquete de software de análisis de imagen permitió la segmentación de los capilares y estructuras intracelulares en tres dimensiones. Claramente el análisis de imagen no se limita al software descrito en el protocolo y paquetes alternativos, por ejemplo las que se discuten en la referencia23, puede utilizarse para imágenes de segmento. La idoneidad de los programas de software diferentes para el análisis de las estructuras intracelulares a través de la BBB debe ser verificada empíricamente mediante la evaluación de la precisión de la segmentación de la imagen.
Debido a que este método se basa en muestras fijadas, proporciona información directa sobre la dinámica de transcitosis a través de la BBB. Sin embargo, se puede combinar con experimentos del curso del tiempo24, por ejemplo por vía intravenosa inyección de la molécula de interés y midiendo su acumulación dentro de BECs en diferentes momentos después de la inyección, para reconstruir la cinética de transporte intracelular. La ventaja de este enfoque es que permite el análisis de regiones profundas del cerebro, como se muestra en el18, que son actualmente inaccesibles para enfoques imagen vivo intravital. Un paso crítico durante el protocolo es el monitoreo cuidadoso de la fijación del tejido. Fijación con 4% PFA dramáticamente reduce la inmunogenicidad de los organelos intracelulares y de inmunoglobulinas endógenas o administrado periféricamente17 (figura 1B). Una limitación de este protocolo es su requisito de anticuerpos de alta calidad (es decir, bajo tinción inespecífica, baja reactividad cruzada) adecuados para inmunofluorescencia. Siempre que tales reactivos están disponibles, el método puede ser aplicado para investigar la localización intracelular de cualquier proteína de interés. Por ejemplo, el protocolo se utilizó para identificar los lisosomas en las células endoteliales de cerebro17. Debe señalarse también que, puesto que este protocolo se basa en microscopía confocal, la resolución lateral está limitado por difracción y no puede resolver las estructuras más pequeñas de aproximadamente 175 a 250 nm (figura 2).
Estudios previos han realizado un análisis detallado de la composición celular de la unidad neurovascular utilizando microscopía confocal25,26. Sin embargo, investigando el transporte intracelular en el BBB se basa principalmente en el uso de microscopia electrónica de transmisión19,27,28. Mientras que este método ofrece la máxima resolución lateral de estructuras intracelulares, microscopía sigue siendo una técnica difícil con bajo rendimiento. Por otra parte, el número de dianas moleculares diferentes que pueden ser visualizados de EM es muy limitado. Este protocolo ofrece una alternativa accesible para investigar el transporte intracelular en el BBB. El procedimiento completo de colección de cerebro para análisis de imágenes, puede realizarse en 5 a 6 días. Si se dispone de anticuerpos adecuados, inmunofluorescencia permite la detección simultánea de múltiples tipos de célula/moléculas dentro de la misma muestra. Por otra parte, este protocolo podría combinarse con técnicas de microscopía de superresolución para superar las limitaciones de resolución espacial29. En general, el protocolo descrito anteriormente permite la cuantificación de los cambios en la localización intracelular de proteínas de interés dentro de la unidad neurovascular. Su aplicación para diferentes perturbaciones genéticas o farmacológicas permitirá investigar las funciones de estructura y transporte intracelulares de la BBB en vivo.
Divulgaciones
Autores están bajo empleo remunerado por Roche.
Agradecimientos
R.V. trabajo fue apoyado por una Beca Postdoctoral de la Roche (2014-2017).
Materiales
| Name | Company | Catalog Number | Comments |
| Rat monoclonal antibody clone ER-MP12 against CD31/PECAM | Novus Biologicals | MCA2388 | Labels Brain Endothelial Cells Use at dilution 1:100 detect with donkey polyclonal anti-rat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Rat monoclonal antibody against Podocalyxin | R&D Systems | MAB1556 | Labels Lumen of capillaries Use at dilution 1:100 detect with donkey polyclonal anti-rat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Rabbit polyclonal antibody against CollagenIV | Biotrend | BT21-5014-70 | Labels Basement membrane of capillaries Use at dilution 1:100 detect with donkey polyclonal anti-rabbit IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Goat polyclonal antibody against CD13 | R&D Systems | AF2335 | Labels pericytes Use at dilution 1:100 detect with donkey polyclonal anti-goat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Mouse monoclonal antibody clone G-A-5 against GFAP coupled to Cy3 | Abcam | ab49874 | Labels Astrocytes Use at dilution 1:100 |
| Rabbit polyclonal antibody against Iba-1 | Wako | 019-19741 | Labels Microglia Use at dilution 1:100 detect with donkey polyclonal anti-rat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Rat monoclonal antibody ABL93 gainst LAMP2 | Fitzgerald | 10R-CD107BBMSP | Labels Lysosomes Use at dilution 1:100 detect with donkey polyclonal anti-rat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| donkey polyclonal antibody against mouse IgG (H+L) AlexaFluor594 | LifeTechnologies | A21203 | Use at dilution 1:400 |
| donkey polyclonal antibody against mouse IgG (H+L) AlexaFluor488 | LifeTechnologies | A21202 | Use at dilution 1:400 |
| goat polyclonal antibody against mouse IgG (H+L) AlexaFluor555 | LifeTechnologies | A21422 | Use at dilution 1:400 |
| Filter paper | Sigma-Aldrich | WHA10334347 | Whatman prepleated qualitative filter paper Grade 0858 1/2, grained |
| Cyanoacrylate glue | Roth Carl | 258.1 | Roti Coll 1 |
| Fluorescent Mounting medium | Dako | S3023 | Dako fluorescent mounting medium |
| Adult mice | The Jackson Laboratory | 000664 | C57BL/6J male or female mice between 9 and 19 months of age |
| Vibratome | Leica Biosystems | 14047235612 | Leica VT100S vibrating blade microtome |
| Laser Scanning Confocal microscope | Leica Microsystems | NA | Leica TCS SP8 X with HyD detectors and White light laser |
| Image processing software | Leica Microsystems | NA | Leica Application Suite AF version 3.1.0 build 8587 |
| Image analysis software | Bitplane scientific software | NA | Imaris version 7.6.5 build 31770 for x64 |
| Fluorescence SpectraViewer | ThermoFisher Scientific | NA | https://www.thermofisher.com/ch/en/home/life-science /cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html |
Referencias
- Blanchette, M., Daneman, R. Formation and maintenance of the BBB. Mech Dev. 138, Pt 1 8-16 (2015).
- Chow, B. W., Gu, C. The Molecular Constituents of the Blood-Brain Barrier. Trends Neurosci. 38 (10), 598-608 (2015).
- Niewoehner, J., et al. Increased Brain Penetration and Potency of a Therapeutic Antibody Using a Monovalent Molecular Shuttle. Neuron. 81 (1), 49-60 (2014).
- Yu, Y. J., et al. Therapeutic bispecific antibodies cross the blood-brain barrier in nonhuman primates. Sci Transl Med. 6 (261), 154(2014).
- Preston, J. E., Joan Abbott, N., Begley, D. J. Transcytosis of macromolecules at the blood-brain barrier. Adv Pharmacol. 71, 147-163 (2014).
- De Bock, M., et al. Into rather unexplored terrain-transcellular transport across the blood-brain barrier. Glia. 64 (7), 1097-1123 (2016).
- Bien-Ly, N., et al. Transferrin receptor (TfR) trafficking determines brain uptake of TfR antibody affinity variants. J Exp Med. 211 (2), 233-244 (2014).
- Sade, H., et al. A human blood-brain barrier transcytosis assay reveals antibody transcytosis influenced by pH-dependent receptor binding. PLoS One. 9 (4), 96340(2014).
- Tian, X., et al. LRP-1-mediated intracellular antibody delivery to the Central Nervous System. Sci Rep. 5, 11990(2015).
- Hsu, J., Rappaport, J., Muro, S. Specific binding, uptake, and transport of ICAM-1-targeted nanocarriers across endothelial and subendothelial cell components of the blood-brain barrier. Pharm Res. 31 (7), 1855-1866 (2014).
- Siupka, P., et al. Bidirectional apical-basal traffic of the cation-independent mannose-6-phosphate receptor in brain endothelial cells. J Cereb Blood Flow Metab. , (2017).
- Zlokovic, B. V., et al. A saturable mechanism for transport of immunoglobulin G across the blood-brain barrier of the guinea pig. Exp Neurol. 107 (3), 263-270 (1990).
- Deane, R., et al. IgG-assisted age-dependent clearance of Alzheimer's amyloid beta peptide by the blood-brain barrier neonatal Fc receptor. J Neurosci. 25 (50), 11495-11503 (2005).
- Cabezon, I., et al. Serial block-face scanning electron microscopy applied to study the trafficking of 8D3-coated gold nanoparticles at the blood-brain barrier. Histochem Cell Biol. , (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Collin, L., et al. Neuronal uptake of tau/pS422 antibody and reduced progression of tau pathology in a mouse model of Alzheimer's disease. Brain. 137 (10), 2834-2846 (2014).
- Villasenor, R., et al. Trafficking of Endogenous Immunoglobulins by Endothelial Cells at the Blood-Brain Barrier. Sci Rep. 6, 25658(2016).
- Villasenor, R., et al. Region-specific permeability of the blood-brain barrier upon pericyte loss. J Cereb Blood Flow Metab. , (2017).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Sibarita, J. B. Deconvolution Microscopy. 95, 201-243 (2005).
- Shaw, P. J. Comparison of Widefield/Deconvolution and Confocal Microscopy for Three-Dimensional Imaging. , 453-467 (2006).
- Chenouard, N., et al. Objective comparison of particle tracking methods. Nat Methods. 11 (3), 281-289 (2014).
- Foret, L., et al. A general theoretical framework to infer endosomal network dynamics from quantitative image analysis. Curr Biol. 22 (15), 1381-1390 (2012).
- Daneman, R., Zhou, L., Kebede, A. A., Barres, B. A. Pericytes are required for blood-brain barrier integrity during embryogenesis. Nature. 468 (7323), 562-566 (2010).
- Bell, R. D., et al. Pericytes control key neurovascular functions and neuronal phenotype in the adult brain and during brain aging. Neuron. 68 (3), 409-427 (2010).
- Ben-Zvi, A., et al. Mfsd2a is critical for the formation and function of the blood-brain barrier. Nature. 509 (7501), 507-511 (2014).
- Stewart, P. A. Endothelial vesicles in the blood-brain barrier: are they related to permeability. Cell Mol Neurobiol. 20 (2), 149-163 (2000).
- Follain, G., Mercier, L., Osmani, N., Harlepp, S., Goetz, J. G. Seeing is believing - multi-scale spatio-temporal imaging towards in vivo cell biology. J Cell Sci. 130 (1), 23-38 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados