Method Article
Hochauflösende konfokale Bildgebung der Blut - Hirn-Schranke: Bildgebung, 3D-Rekonstruktion und Quantifizierung der Transcytosis
In diesem Artikel
Zusammenfassung
Hier präsentieren wir eine Mikroskopie-basiertes Protokoll für hochauflösende Bildgebung und eine dreidimensionale Rekonstruktion der Maus neurovaskuläre Einheit und Blut - Hirn-Schranke mit Gehirn frei schwebenden Abschnitten. Diese Methode ermöglicht die Visualisierung, Analyse und Quantifizierung der intrazellulären Organellen an der BBB.
Zusammenfassung
Die Blut - Hirn-Schranke (BBB) ist eine dynamische mehrzelligen Schnittstelle, die den Transport von Molekülen zwischen den Kreislauf und das Gehirn reguliert. Transcytosis über die BBB regelt die Lieferung von Hormonen, Metaboliten und therapeutische Antikörper, die in Anwesenheit von. Hier präsentieren wir eine Protokoll, die Immunfluoreszenz frei schwebenden Abschnitte mit Laser kombiniert-scanning-konfokalen Mikroskopie und Bildanalyse subzellularen Organellen innerhalb von Endothelzellen an der BBB zu visualisieren. Kombination dieser Datensatz mit 3D Bildanalyse-Software ermöglicht für die semi-automatischen Segmentierung und Quantifizierung der Kapillare Volumen und Fläche, sowie die Anzahl und Intensität von intrazellulären Organellen an der BBB. Die Erkennung der Maus endogenen Immunglobulin (IgG) in intrazellulären Vesikeln und deren Quantifizierung an der BBB wird verwendet, um die Methode zu veranschaulichen. Dieses Protokoll kann potenziell auf die Untersuchung der Mechanismen Steuern BBB Transcytosis von unterschiedlichen Molekülen in Vivoangewendet werden.
Einleitung
Die Blut - Hirn-Schranke (BBB) ist eine kontinuierliche zellulären Barriere bilden Astrozyten, Perizyten, Neuronen und Endothelzellen, die das zentrale Nervensystem (ZNS) aus dem Blutzirkulation1trennt. Die Regulierung der Transport über die BBB spielt eine entscheidende Rolle bei der Aufrechterhaltung der Homöostase des Gehirns und wird durch spezielle Eigenschaften des Gehirns Endothelzellen (BECs) vermittelt. Das Vorhandensein von enge interzelluläre Verbindungen zwischen BECs und eine niedrige basale Transcytosis begrenzen den parazellulär und intrazelluläre Transport von Blut übertragbare Molekülen, bzw.2. Vor kurzem hat Transcytosis Weg in BECs genutzt, um Lieferung von therapeutischen große Moleküle an das Gehirn3,4zu erhöhen. Jedoch wurden die Mechanismen der Transcytosis über die BBB vollständig charakterisierten5,6noch nicht.
Umfangreiche Arbeit geleistet in Vitro zu entziffern, die zellulären und molekularen Mechanismen intrazellulären Transport über BECs7,8,9,10, 11, aber solche Systeme nicht die komplexe Architektur und Physiologie des Referats neurovaskuläre (NVU) rekapitulieren. Auf der anderen Seite Studien in Vivo12,13 enthalten detaillierte quantitative Informationen zu Frachten über die BBB aber keine Einblicke in die intrazellulären Mechanismen des Verkehrs. Untersuchung der zellulären und intrazellulären Komponenten der NVU bleibt in Vivo und ex Vivo daher sehr anspruchsvoll14. Nur eine begrenzte Anzahl von Techniken sind zugänglich, subzelluläre Strukturen in den Zellen der NVU zu analysieren. Die meisten Studien verwenden Elektronenmikroskopie, aber diese Technik ist begrenzt durch die komplexe Protokolle erforderlich für die ordnungsgemäße Gewebe Vorbereitung und Probenbehandlung. Daher haben wir eine Methode basiert auf hochauflösenden konfokalen Mikroskopie, die die Verarbeitung von Gehirn-Proben, die Analyse und Quantifizierung der subzelluläre Kompartimente innerhalb der Zellen von der NVU erleichtern würde.
Hier beschreiben wir ein Protokoll, das nutzt Maus Gehirn frei schwebenden Abschnitte um quantitative Bildgebung des BBB und NVU auf zellulärer und subzellulärer Ebene durchzuführen. Wir haben getestet und validiert eine Anzahl von Antikörpern gegen Bild und NVU in drei Dimensionen zu rekonstruieren. Darüber hinaus ermöglicht dieses Protokolls Bildgebung mit der maximalen optischen Beugung begrenzte Auflösung des Organellen innerhalb Gehirn-Kapillaren. Zusammen mit Bildanalyse kann dieses Protokoll verwendet werden, um den intrazellulären Transport von Makromolekülen in der BBB unter verschiedenen experimentellen Bedingungen, zum Beispiel in Mausmodellen Krankheit der Neurodegeneration zu untersuchen.
Protokoll
ethische Genehmigung für diese Studie wurde vom Bundesamt für Lebensmittelsicherheit und Veterinary Office der Schweiz zur Verfügung gestellt. Alle Tierversuche verliefen unter strikter Einhaltung der Schweizer Verordnung über Tierschutz und das Wohlergehen sowie nach den Regeln der Gesellschaft für Prüfung und Akkreditierung von Laboratory Animal Care International (AAALAC).
1. Generation von Gehirn Free-floating Abschnitte
- um optimale Sample-Qualität zu gewährleisten, bereiten Sie eine frische Lösung von 2 % Paraformaldehyd (PFA) in Phosphat Puffer Kochsalzlösung (PBS) am Tag der Durchblutung.
Achtung: PFA ist mäßig giftig durch Hautkontakt und wahrscheinlich krebserregend. Nitril-Handschuhe zu handhaben PFA und bereiten Sie die Lösung unter einem chemischen Abzug zu verwenden.- 60 mL PFA-Lösung pro Tier vorbereiten.
- Bring PFA in Lösung durch die Erhöhung des pH-Wertes mit 180-200 µL einer 5 M KOH-Lösung für jede 100 mL PBS und Heizlösung bis zu 60 ° c
Hinweis: NaOH sollte nicht verwendet werden da es wirkt sich negativ auf Gewebe Bewahrung auf Fixierung. - Die Lösung auf Raumtemperatur abkühlen lassen und dem pH auf 7,4 mit HCl. Filter die Lösung mit Filterpapier zu bringen (siehe Tabelle der Werkstoffe).
- Eine ganze Maus Fixierung über Transcardial Perfusion als zuvor beschriebenen 15 mit einigen Änderungen durchführen. Erstens, spülen Sie das Blut aus dem Gefäßsystem mit 20 mL PBS dann durchspülen mit 40 mL 2 % PFA.
- Entfernen Sie das Gehirn aus dem Schädel wie zuvor beschriebenen 15.
- Tauchen ein frisch 2 % PFA durchblutet Gehirn in 20 mL 2 % PFA für 7 h bei 4 ° C für Post-Fixierung.
Hinweis: Erhöhung der Inkubation in PFA wird nicht empfohlen, da es Erkennung von intrazellulären Strukturen verhindern kann. - Ausgiebig waschen das Gehirn mit eiskaltem PBS.
- Embed Gehirne in Agarose fixiert.
- Bereiten Sie einen 3 % Agarose-Lösung mit PBS-Puffer mit Hilfe einer Mikrowelle für die Heizung. Vorsichtig schwenken die Lösung abkühlen, aber vermeiden erstarren.
- Trocknen Sie die überschüssige PBS um das Gehirn vor dem Eintauchen in die Agarose-Lösung in einem Kunststoffbehälter. Drehen Sie das Gehirn innerhalb der Agarose um Luftblasen zu entfernen. Ermöglichen die Agarose, verfestigen durch die Abkühlung auf Ice
- Sorgfältig die Agarose-Block aus dem Kunststoff Behälter zu entfernen und einen Würfel geschnitten, um das Gehirn mit einer Rasierklinge. Montieren Sie das Gehirn auf einem Vibratome Probenhalter (siehe Tabelle der Materialien) mit Cyanacrylat-Klebstoff (siehe Tabelle der Materialien). Lassen Sie genügend Zeit für den Kleber, bevor Sie mit dem Schneiden zu festigen.
- Übertragung des Gehirns im Probenhalter Vibratome Puffer Fach gefüllt mit PBS. Verwenden Sie die Vibratome 100 µm Gehirnscheiben (sagittale und koronale) Abschnitt. Sammeln Sie Gehirn-Abschnitte in einem 6-Well-Platte vorher gefüllt mit PBS.
- Nach Veredelung Gehirn schneiden, sorgfältig PBS zu entfernen und ersetzen Sie durch eine 1:1 Lösung von PBS/Glycerin.
- Lagerung Abschnitte in PBS/Glycerin bei-20 ° c
2. Zelle oder Organellen Kennzeichnung durch Immunfluoreszenz Färbung
- sorgfältig Transfer eine Gehirn-Abschnitt in einen Brunnen von einer 24-Well-Platte vorher gefüllt mit 500 µL PBS pro Bohrloch. Im Abschnitt bleibt bis zum Ende des Verfahrens in der gleichen gut.
- Spülen Sie den Abschnitt zweimal mit 500 µL PBS für 5 min unter sanften Agitation.
- Die PBS zu entfernen und führen Sie gleichzeitige Blockierung und Permeabilisierung der Gehirnscheiben.
- Bereiten Sie eine Blockierung und Permeabilisierung Lösung mit 0,3 % Triton-X und 10 % Esel Serum in PBS.
Hinweis: Esel Serum kann mit Ziegenserum Wirtsarten der bestimmten sekundären Antikörper verwendet entsprechend ersetzt werden. - Abschnitte mit 250 µL blockieren und Permeabilisierung Lösung für 1 h bei Raumtemperatur unter schonenden rühren inkubieren.
- Bereiten Sie eine Blockierung und Permeabilisierung Lösung mit 0,3 % Triton-X und 10 % Esel Serum in PBS.
- Die Lösung entfernen und hinzufügen eine PBS-Lösung mit 5 % Esel Serum und den primären Antikörper auf eine entsprechende Verdünnung (z. B. 1: 100 bis 1:1 000). Über Nacht bei 4 ° C unter schonenden rühren inkubieren.
Hinweis: Siehe die Tabelle der Materialien für eine Liste der Antikörper, die die verschiedenen Zelltypen von NVU mit diesem Protokoll erfolgreich beschriften. Die optimale Verdünnung der primären Antikörper muss empirisch ermittelt werden. Verdünnen Sie für die gleichzeitige Kennzeichnung von verschiedenen Antigenen alle primären Antikörper in der gleichen Projektmappe. Alle primären Antikörper müssen in verschiedene Arten ausgelöst werden. Zur Verbesserung der Antikörper eindringen können Proben bis zu 72 h inkubiert werden, bei 4 ° c - Entfernen Antikörper-Lösung waschen Abschnitte und drei Mal für 10 min in PBS unter schonenden Rühren bei Raumtemperatur. Entfernen Sie PBS zu und fügen Sie 250 µL PBS-Lösung mit 5 % Esel Serum und die entsprechende artspezifische Fluoreszent markierten Sekundärantikörper. Abschnitten bei Raumtemperatur 1 h unter schonenden rühren inkubieren.
- Siehe Tabelle der Materialien für eine Liste der sekundären Antikörper, die mit diesem Protokoll verwendet.
- Antikörper-Lösung waschen Abschnitt und drei Mal für 10 min in PBS unter schonenden Rühren bei Raumtemperatur zu entfernen.
- PBS zu entfernen und fügen Sie 250 µL einer 4 ', 6-Diamidino-2-Phenylindole (DAPI) Lösung mit einer Endkonzentration von 1 µg/mL. 10 Minuten unter sanften Agitation inkubieren Sie Abschnitte bei Raumtemperatur. Entfernen Sie die DAPI Lösung und waschen Teile 3 Mal für 5 min mit PBS.
- Abschnitt Gehirn auf Verklebung Mikroskopie Folien (z. B. Histo-Bond-Glas-Objektträger) montieren. Entfernen Sie vorsichtig die überschüssige PBS rund um den Bereich auf der Folie. Geben Sie einen Tropfen Eindeckmittel (siehe Tabelle der Materialien) an der Spitze des Abschnitts Gehirn und sorgfältig bedecken Sie es mit einem 0,17 mm (Nr. 1.5) Borosilikatglas Deckgläschen.
- Proben bei 4 ° C, vor Licht geschützt werden, bis die Bildaufnahme ausführen speichern.
3. Hochauflösende konfokale Imaging der Blut - Hirn-Schranke
- Perform Bildaufnahme mit einer geeigneten Laserscanning confocal Mikroskop (siehe Tabelle der Materialien) mit Laser-Linien 405, 488, 561 und 633 nm zur Anregung der Fluorophore in blauen, grünen, orangenen und roten Regionen des Lichtspektrums. Für die Bildaufnahme, verwenden eine 63 X Öl-Ziel mit einer numerischen Apertur von 1.4.
- In den Erwerb Menü der Software, die das Mikroskop kontrolliert das Bild Erwerb Parameter einstellen. Im Dropdown-Menü des ‘ Bildgröße ’, wählen Sie einen Wert von 1024 x 1024 Pixel. Ändern Sie die Pixelgröße auf einen Wert zwischen 200 und 300 nm durch Anpassen des Werts von der ‘ Zoom ’ Menü. ”
Hinweis: für die Analyse der intrazellulären Strukturen, reduzieren die Pixelgröße auf 75 nm. Diese Bildeinstellung Größe erheblich erhöht die Erfassungszeit und auf 512 x 512 Pixel, die Erfassungszeit von imaging eine kleinere Sichtfeld zu verringern reduziert werden kann. - In der ' Geschwindigkeit ' Drop-Down-Menü wählen Sie einen Wert von 400 Hz, d.h. 400 Zeilen pro Sekunde. In der ' Systemeinstellungen & #39; Menü, wählen Sie die ' Pixeltiefe ' drop-down-Menü und ändern Sie den Wert auf 12Bit.
- In der Mikroskop-Software innerhalb der ' Erwerb ' Registerkarte Umschalten auf die Option für fortlaufende Frame Erwerb. Legen die optische Schnittdicke auf einen Wert zwischen 0,75 und 1 µm für jeden Kanal durch Ändern des Werts in der ' Pinhole ' Menü.
- Im Bereich für fluoreszierende Erregung, aktivieren Sie die Laser benötigt, um optimal die Fluorophore in der Probe, z. B. eine 488 nm Laserlinie für eine grün-emittierende Fluorophor begeistern.
Hinweis: Verwenden Sie einen Fluorophor-Spektren-Viewer (siehe Tabelle der Materialien), die ausreichende Erregung Laser auszuwählen. - Im Bereich für Fluoreszenz-Detektion, bewegen Sie den Schieberegler auswählen die Wellenlängen, die gemessen werden in jedem Kanal, zum Beispiel zwischen 510 und 550 nm für eine grün-emittierende Fluorophor.
Hinweis: Verwenden Sie einen Fluorophor-Spektren-Viewer (siehe Tabelle der Materialien), wählen die entsprechende Erkennung Wellenlängen. - Einen Tropfen Immersionsöl mit einem Brechungsindex von 1,52 auf das Deckglas mit dem Gehirn-Abschnitt der Brechungsindex des Deckglases Glas und Ziel übereinstimmen. Legen Sie die Probe unter dem Mikroskop und schalten Sie die Epifluorescent-Lampe, die Probe mit dem Mikroskop Fernglas zu visualisieren.
- Mit den Tasten das Mikroskopstativ ändern das Filterrad einen Filter angebracht zur Visualisierung von DAPI-gefärbten Kernen auswählen. Die grobe Ausrichtung verwenden, um das Signal von DAPI-gefärbten Kernen in den Mittelpunkt zu Rücken.
- Filter, um das Signal vom vaskuläre Marker (z. B. CollagenIV oder CD31) zu visualisieren und in der Mitte des Sichtfeldes auf eine einzelne Kapillare Segment ändern mit den Tasten das Mikroskopstativ.
- Drücken Sie die Taste, um die live-Scan-Modus zu starten. Während des Scannens passen Sie die Verstärkung und Laser Intensität für jeden Kanal zu maximieren den Dynamikumfang der Bilder und Pixel Sättigung zu vermeiden.
Hinweis: Verwenden Sie eine Nachschlagetabelle die gesättigten Pixel um visuell beurteilen Übersättigung Etiketten. Zur Vermeidung von Signal Übersättigung passen Sie die Einstellungen mit der Probe, die voraussichtlich die höchste Fluoreszenzsignal. - Legen Sie den Wert für die Linie von durchschnittlich 2.
Hinweis: Bei der Verwendung von höherer Erwerb Geschwindigkeiten erhöhen Sie diesen Wert reduzieren. - Aufbau beginnen und Enden Abschnitte für die Durchführung von optischen Z-Stapel, die das gesamte Volumen der Kapillare erstrecken. Verwenden eine Schrittweite von 0,45 µm.
Hinweis: Wenn Bilder für die spätere Quantifizierung verwendet werden, halten Sie die gleichen Erwerb Einstellungen für den vollständigen Datensatz. - Für die Quantifizierung, erwerben Sie 10 bis 20 Z-Stapel pro Abschnitt von mindestens drei verschiedene Mäuse für statistische Vergleiche.
Hinweis: Den vollständigen Datensatz zu erwerben, in der gleichen Sitzung die Variabilität aus Probe bleichen und Laser Intensitätsschwankungen reduzieren.
4. Image Processing und 3D Rekonstruktion des Referats neurovaskuläre
- (Optional) erhöhen Sie die axiale Auflösung der erworbenen Z-Stapel, Entfaltung des Bild-Datensatzes mittels geeigneter Software durchführen (siehe Tabelle der Materialien ).
- In der Dekonvolution Software, ändern Sie die Einstellungen durchführen " Blind " Dekonvolution, (d.h., über eine adaptive Point-Spread Funktion).
- In den Softwareeinstellungen Dekonvolution, Umschalten auf die Option für Hintergrundentfernung; diese Option bestimmt den kleinsten Intensitätswert in den Bildstapel und subtrahieren sie von der Intensitätswerte aus alle Pixel im Bild.
- In der Dekonvolution Software-Einstellungen deaktivieren die Optionen für die Skalierung von Intensität und Größe bis zu 16-Bit-Tiefe; diese Optionen informieren die Originalwerte Intensität und Dynamik der Bilder.
- Im Menü des ' Brechungsindex ', legen Sie den Wert auf 1,52. In den ' legen Wellenlänge ' Menü, wählen Sie die Emission für jeden Bildkanal Werte. Wählen Sie z. B. 520 für eine grün-emittierende Fluorophor.
- Öffnen Sie das Bild-Daten-Gerät mit Software zur Visualisierung und Analyse von 3-dimensionalen Datensätzen (siehe Tabelle der Materialien) geeignet. Drücken Sie in der Bildanalyse-Software, die " übertreffen "-Taste, um das 3D Volumen der Kapillaren zu rendern.
- In der Bild-Analyse-Software-Presse der " neue Fläche hinzufügen "-Taste, um die Kapillare Oberfläche zu segmentieren. Die unteren Pfeile verwenden, um zwischen den Schritten im Assistenten Oberflächenerstellung verschieben.
- In der ' erstellen ' tab, der Quellkanal auf den Kanal mit Kapillar-Marker, z. B. CollagenIV und eingestellt Fläche Detail auf einen Wert von 0,5 µm.
Hinweis: Die letztere Option wendet einen Gaußschen Filter auf das Bild und die Glätte der Oberfläche bestimmt. - In der ' erstellen ' Registerkarte Umschalten auf die Option für die absolute Intensität Schwelle.
Hinweis: Diese Option erstellt eine Fläche durch die Erzeugung einer Maske basierend auf die absolute Intensität des ausgewählten Kanals in das Bild. - Auf den nächsten Schritt in der Oberfläche Erstellungsassistenten, die Untergrenze der Intensität für die Oberfläche durch Schiebefenster über das Histogramm Intensität bewegen, bis die gerenderte Maske die gesamte Kapillare im Bild bedeckt anpassen. Bestimmen den Wertebereich für diesen Parameter empirisch für jeden Datensatz.
- Der letzte Schritt des Assistenten Flächenerstellung, klicken Sie auf das Dropdown-Menü unter " Filtertyp " und wählen Sie die Option ' Anzahl der Voxel '. Legen Sie die Mindestanzahl der Voxel auf einen Wert zwischen 1.0e5, 2.0e5.
Hinweis: Diese Option wird Flächen mit einer kleinen Anzahl von Voxel, z. B. kleine Segmente des Kapillaren am Rand des Rahmens ausschließen. - Oberfläche Projekt-Assistenten zu beenden und speichern Sie die Erstellungsparameter durch Klicken auf " erinnern Parameter " in der Registerkarte "neu erstellen" im Menü Fläche.
- Wiederholen Sie den Vorgang für die gesamte imaging-Datensatz durch das Laden des Parametersatzes für das erste Bild verwendet. Passen Sie die Parameter für die Intensität, Schwelle und minimale Anzahl der Voxel für jedes Bild unterschieden in Hintergrundintensität und Kapillare Morphologie, Rechnung bzw..
- In der ' erstellen ' tab, der Quellkanal auf den Kanal mit Kapillar-Marker, z. B. CollagenIV und eingestellt Fläche Detail auf einen Wert von 0,5 µm.
- , Segment intrazelluläre vesikuläre Strukturen (z. B. Immunglobulin-gefüllte Endosomen), erstellen Sie zunächst einen neuen Kanal, das Fluoreszenzsignal aus innerhalb der Kapillare nur enthält.
Hinweis: Dieser Vorgang wird definieren eine Region of Interest durch Erstellen einer Maske mit der Kapillare Oberfläche erstellt in Schritt 4.3- Wählen Sie die ' bearbeiten ' Menü in der ' Kapillare Oberfläche ' Panel. Unter ' Maske Eigenschaften ', klicken Sie " Maske alle ". Wählen Sie den Kanal, die das intrazellulären Vesikel-Signal als enthält die ' Quellkanal ' und wechseln auf die Option " Kanal duplizieren, bevor Sie die Maske anwenden ".
- In der ' Maske Einstellungen ' Spalte, wählen Sie " konstant innen/außen " und " Voxel Außenfläche zu setzen: " und setzen Sie seinen Wert auf 0,00.
Hinweis: Dieser Vorgang wird einen zusätzlichen Kanal im Bild erstellen wo alle Voxel außerhalb der Kapillare Maske einen der Intensitätswert 0 haben. Ereignisse, die außerhalb der Kapillare (d.h., in der Gehirn-Parenchym) zu quantifizieren, wählen " Voxel Innenfläche zu setzen: " und setzen Sie seinen Wert auf 0,00. - Segment vesikuläre Strukturen, drücken die Taste zum Starten der " fügen Sie neue Spots " Assistent. Die unteren Pfeile verwenden, um zwischen den Schritten im Assistenten Oberflächenerstellung verschieben.
- In der Registerkarte "erstellen" verwenden Sie die Drop-down-Menü unter " Quellkanal " zum Auswählen des intrazellulären maskierte Kanals erstellt in Schritt 4.4.4.
- In der Registerkarte "erstellen" unter den " vor Ort Erkennung " Abschnitt, geben Sie die geschätzten XY Durchmesser einen Wert zwischen 0,5 und 1 µm, abhängig von der durchschnittlichen Größe von Vesikeln in beobachtet Das Experiment. Diese Option bestimmt die kleinste Größe, die durch die Segmentierungsalgorithmus erkannt werden.
- In der Registerkarte "erstellen" unter den " vor Ort Erkennung " Abschnitt, Umschalten auf die Option für " Hintergrundabzug ".
Hinweis: Diese Option wird das Bild mit einem Gaußsche Filter von 0,75 Stelle Radius (von dem Wert in Schritt 4.4.7 ausgewählt) zu glätten und dann subtrahieren die Intensität des Originalbildes Gauß von 0,88 vor Ort Umkreis gefiltert. - In der ' erstellen ' tab, drücken Sie das Dropdown-Menü unter ' Filtertyp ', und wählen Sie " Qualität ". Beachten Sie, dass dieses Bild segment werden anhand von Schwellenwerten anhand der Intensität in der Mitte der Flecken. Passen Sie die Untergrenze der Intensität durch Verschieben der Schiebefenster auf der ' Qualität ' Histogramm bis die Mehrheit der identifizierbaren Bläschen gekennzeichnet sind.
Hinweis: Der Wertebereich für diesen Parameter muss für jeden Datensatz empirisch ermittelt werden. - Vor Ort Projekt-Assistenten beenden und speichern Sie die Erstellungsparameter durch Drücken der Taste " erinnern Parameter " in der Registerkarte "neu erstellen" im Menü Fläche.
- Wiederholen Sie den Vorgang für die gesamte imaging-Datensatz durch das Laden des Parametersatzes für das erste Bild verwendet. Passen Sie die Parameter für die ' Qualität Intensität Schwelle ' für jedes Bild, um Unterschiede in der Hintergrundintensität berücksichtigen.
5. Quantifizierung der intrazellulären Transport an der BBB
- zu quantifizieren, das Volumen (in µm 3) und Fläche (in µm 2) des Segments Kapillare. Greifen Sie in der Analysesoftware zu, die Gruppe "Statistik" der vaskulären Oberfläche im Schritt 4.3 erstellt. Wählen Sie die ' detaillierte ' Registerkarte, und verwenden Sie die Drop-down-Menü auswählen " alle Werte ", die Werte für Volumen und Fläche finden.
- Beziffern die Zahl von Vesikeln innerhalb der Kapillare-Segment. Greifen Sie in der Analysesoftware zu, die Gruppe "Statistik" der Flecken im Schritt 4.4 erstellt. Wählen Sie die ' insgesamt ' Registerkarte, um den Wert der Gesamtzahl der Punkte im Bild zu finden.
- Zur Berechnung der Anzahl der Bläschen pro Kapillare Volumen, für jedes Bild normalisieren die Anzahl der Plätze durch das Volumen im Schritt 5.1 berechnet. Multiplizieren Sie diesen Wert mit 1.000 um die Anzahl von Vesikeln pro 1.000 µm 3 der Kapillare Lautstärke erhalten.
- , Die Gesamtintensität innerhalb der Kapillare zu quantifizieren erstellen Sie eine neue Oberfläche, die die gesamte Bild folgenden deckt die Anweisungen unter Schritt 4.3 mit folgenden Änderungen beschrieben. Wählen Sie den Kanal, der das entsprechende Signal (z. B. mIgG) als Quellkanal enthält, und legen Sie den Wert der Fläche Detaillierungsgrad bis 5 µm. Eine Oberfläche erstellen, die das ganze Bild abdeckt, legen Sie den Wert der unteren Schwelle Intensität auf 0.
- In der Analysesoftware Zugriff auf die Gruppe "Statistik", der im Schritt 5.4 erstellte Oberfläche. Wählen Sie die " detaillierte " Registerkarte, und verwenden Sie die Drop-down-Menü auswählen " alle Werte ". Zeichnen Sie die Werte für ' Intensität Summe ' für die Kanäle von Interesse; dieser Parameter entspricht der Summe der einzelnen Intensitätswerten über alle Pixel.
Hinweis: Für einen intrazellulären Signal, dies entspricht der duplizierte Kanal mit Voxeln Außenfläche auf 0,0 gesetzt. Für ein Signal im Gehirn Parenchym, dies entspricht der duplizierte Kanal mit Voxeln Innenfläche setzen auf 0.0. - Zur Berechnung der Fluoreszenzintensität pro Kapillare Volumen, für jedes Bild normalisieren die Intensität durch das Volumen im Schritt 5.1 berechnet. Multiplizieren Sie diesen Wert mit 1.000, Fluoreszenz Intensitätswert pro 1.000 µm 3 der Kapillare Volumen zu erhalten.
Hinweis: Für fluoreszierende Signale im Gehirn Parenchym, die Werte durch das Gesamtbild Volumen abzüglich der Kapillare Lautstärke normalisieren und multiplizieren Sie mit 1.000 zu die Gesamtintensität pro 1.000 µm 3 der in Anwesenheit von. - Wiederholen Sie den Vorgang für das gesamte Dataset und entsprechende Software verwenden, um statistische Analysen der Daten.
Ergebnisse
Repräsentative Beispiele von Bildern aus dem hier beschriebenen Protokoll abgerufen, Maus Gehirn Abschnitte waren voller Flecken mit Antikörpern, die verschiedene Komponenten der NVU, einschließlich die Basalmembran, die Astrozyten, die Perizyten zu erkennen sowie endothelialen Zellen (siehe Tabelle der Materialien für spezifische Antikörper verwendet) (Abbildung 1A, D und E). Bei dieser Auflösung ist es möglich, den astrocytic Einzelprozesse und Ende-Füße, die in direktem Kontakt mit Kapillaren sind zu unterscheiden.
Um die Eignung dieses Protokolls zur Erkennung von intrazellulären Strukturen hervorzuheben, wurden Gehirn Teile von Tieren, die am Rande mit den menschlichen Anti-Tau-mAb86 Antikörper16 injiziert mit einem Fluoreszent markierten Anti-Human-Antikörper ( gefärbt. Abbildung 1B). mAb86 ist speziell Ziel Neuronen mit dem Ausdruck einer pathologischen Form der Tau16bekannt. Hierin beschriebene Protokoll verwenden, wurde mAb86 mit Beugung begrenzte Auflösung innerhalb der einzelnen vesikuläre Strukturen innerhalb der Neuronen (Abbildung 1B-C) erkannt. Darüber hinaus war endogenen Maus IgG in intrazellulären Strukturen innerhalb der Endothelzellen, aber nicht in Perizyten (Abbildung 1-D-E und Abbildung 2) erkannt.
Der Erwerb von hochauflösenden konfokalen Z-Stapel des Gehirns Gefäßsystems ermöglicht dreidimensionale Segmentierung der Kapillaren und intrazellulären Vesikeln an der BBB. Abbildung 2 zeigt ein Beispiel für den Prozess der Rendern und Segmentierung eine Kapillare beschriftet mit CollagenIV und Maus IgG-positiven intrazellulären Vesikeln. Durch Quantifizierung der vollständigen Dataset segmentierte Bilder, zum Beispiel durch die Anzahl der Bläschen pro Kapillare Volumen messen, ist es möglich, Veränderungen in intrazelluläre Transportprozesse unter verschiedenen Bedingungen zu studieren. Abbildung 3 B-C zeigt die Unterschiede in mIgG Vesikel Anzahl und Fluoreszenz Intensität entsprechend mIgG bei der in Anwesenheit von, bzw. nach Erschöpfung der Pericyte im Mausmodell Pdgf-bret/ret als zuvor gemeldeten 17. der gleiche Ansatz wurde auch vor kurzem verwendet, um Änderungen in intrazellulären Transport an der BBB zwischen verschiedenen Regionen18zu analysieren.

Abbildung 1: Kennzeichnung von mehreren Zelltypen und subzelluläre Strukturen der neurovaskuläre Einheit Repräsentative Bilder der neurovaskuläre Einheit (A und D) und intrazellulären Vesikeln enthaltenen Neuronen (B) oder Endothelzellen (E) erhalten mit diesem Protokoll. Die maximale Intensität Projektionsbild in A (oben) zeigt die Verteilung der Astroglia-positiven Astrozyten (rot) umgebenden Kapillaren vom CollagenIV (grün) gekennzeichnet. Pfeile zeigen auf astrocytic Einzelprozesse. Maßstabsleiste = 20 µm. Bei dieser Auflösung sind die einzelnen Astrozyten Prozesse und Ende-Füße deutlich sichtbar, wie im gezoomten Bild die boxed Region (unten) dargestellt. Pfeilspitzen zeigen auf astrocytic Ende-Füße. Maßstabsleiste = 10 µm. Das Bild in B zeigt die Anhäufung von einem peripher injiziert Antikörper, mAb86 (grün), innerhalb einer hippocampal Neuronen. Pfeilspitzen zeigen, individuelle mAb86-positiven Vesikeln. Maßstabsleiste = 10 µm. Die Grafik in C zeigt die Linie Profil Intensität eines einzigen Vesikels. Die Vesikelgröße wurde aus die volle Breite am halben Maximum von einem "glockenförmig" Anfall (schwarze durchgezogene Linie) von der Intensitätskurve (grüne Linie und Kreis) geschätzt. Die Bilder in D zeigen eine dreidimensionale Rekonstruktion einer endothelial Zelle (grün), umgeben von einer Pericyte (rot) innerhalb der Basallamina (CollagenIV, grau). Die unteren Platten zeigen die einzelnen Fluoreszenz-Kanäle. Maßstabsleiste = 10 µm. Die Bilder in E zeigen die Lokalisierung von mIgG (rot) in intrazellulären Vesikeln innerhalb endothelial Zellen (CD31 in grün-Panel links) aber nicht im Perizyten (rechte Abbildung, CD13 in grün). In allen Bildern DAPI gefärbt Kerne sind in blau dargestellt. Maßstabsleiste = 5 µm. Platten D und E von Referenz17geändert wurden. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Dreidimensionale Darstellung der Kapillaren und intrazellulären Vesikeln an der Blut - Hirn-Schranke. Mit dem beschriebenen Protokoll erwarb hochauflösende konfokale Bilder von CollagenIV-Positive Kapillaren (grün) und Maus IgG intrazelluläre Vesikeln (rot) wurden (A). Die linke Tafel zeigt einen optischen Bereich mit Querschnitten. Die Pfeile verweisen auf einzelne mIgG-positiven Vesikeln innerhalb Gehirn endothelial Zellen. Das Gremium für die rechts zeigt die 3D Rekonstruktion des Z-Fullstack mit image-Processing-Software (siehe Tabelle der Materialien). Die Kapillare Volumen (B) und einzelne Vesikel (C) wurden in drei Dimensionen gerendert und quantifiziert mit Bildbearbeitungssoftware (siehe Tabelle der Materialien). In allen Bildern DAPI gefärbt Kerne sind in blau dargestellt. Skalieren von Balken = 5 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
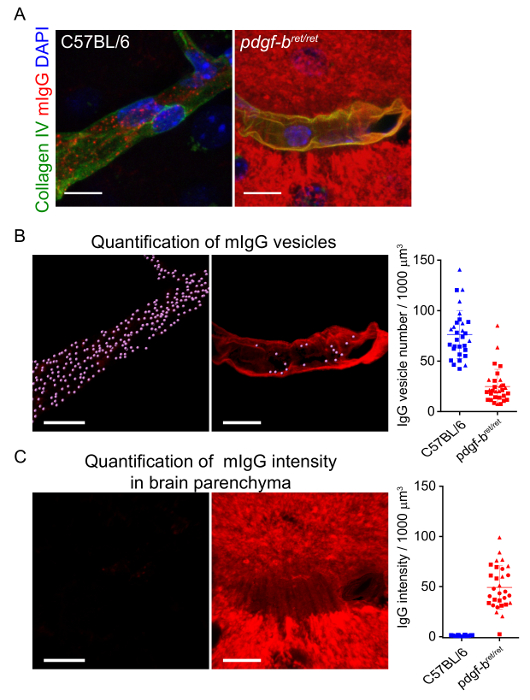
Abbildung 3 : Quantifizierung von mIgG intrazelluläre Lokalisation an der BBB. Repräsentative Bilder zeigen (A) dreidimensionale Rekonstruktionen der Kapillaren (beschriftet mit CollagenIV, grüne) und die Verteilung von mIgG (rot) bei C57BL/6 Mäusen und Pdgf-bret/ret Pericyte erschöpft Mäuse zuvor beschrieben im19. Skalieren von Balken = 10 µm. Die Bilder in B zeigen die Segmentierung von intrazellulären Vesikeln innerhalb der CollagenIV-Maske. The Graphen in B zeigt die Quantifizierung und Vergleich von mIgG Vesikel Anzahl pro Volumen der Kapillare. Jeder Punkt entspricht Messungen aus einzelnen Kapillaren Blöcken. Die durchgezogene Linie zeigt den Mittelwert und die Fehlerbalken repräsentieren die Standardabweichung der Daten. Die Bilder in C zeigen die mIgG Fluoreszenzsignal außerhalb der CollagenIV-Maske. Ebenso zeigt das Diagramm in C die Quantifizierung und Vergleich der Fluoreszenzintensität mIgG in das Gehirn Parenchym zwischen C57BL/6 Mäusen und Pdgf-bret/ret Pericyte erschöpft Mäuse. Fluoreszenz-Intensität-Einheiten wurden von der durchschnittlichen mIgG Parenchym Intensität gemessen an allen C57BL/6 Mäusen normalisiert. Diese Zahl wurde von Referenz17geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die oben beschriebene Protokoll beschreibt die Vorbereitung der Gehirn frei schwebenden Abschnitte, immunofluorescent Färbung, Bildaufnahme und Analyseparameter für hochauflösende Mikroskopie der BBB. Diese Methode hat vor kurzem verwendet, um die Lokalisierung der Antikörper Lieferung Plattformen3, den Transport von endogenen IgG über die BBB-17und die Heterogenität der BBB auf Pericyte Verlust18zu untersuchen. Verschiedene Schritte im Protokoll können zur Anpassung an die spezifischen Ziel des Experiments geändert werden. Zunächst erleichtert die Verwendung von dicken (100 µm) Abschnitte ihrer Handhabung beim Verfahren Immunostaining und Montage. Es ermöglicht auch für 3D Rekonstruktion des Kapillarnetzes, die neurovaskuläre Einheit und für die Generation der Kapillare und NVU Querschnitte. Allerdings Eindringen von Antikörper innerhalb der Gewebeschnitte variieren und einige Antikörper Färbung auf die oberflächliche Schicht des Gewebes in der Nähe des Deckglases beschränkt werden kann. Das Protokoll kann geändert werden, indem man die Konzentration der Reinigungsmittel während der Permeabilisierung Schritt bzw. die Länge der die Permeabilisierung Schritt zur Verbesserung der Antikörper Eindringen in das Gewebe. Zweitens kann Bildqualität gefährdet sein, wenn Sie versuchen, Bilder tiefer in das Gewebe (in der Regel 20 bis 30 µm unterhalb der Oberfläche) durch Lichtstreuung sowie optische Aberrationen von Brechungsindex Missverhältnis zu erwerben. Um dieses Problem zu überwinden, können neue Methoden für Gewebe, clearing und aktive Antikörper eindringen20 mit diesem Protokoll zu Bild größere Mengen an Gewebe kombiniert werden. Drittens erfolgt Dekonvolution nach der Bildaufnahme, axiale Auflösung des Bildes zu verbessern. Die Wahl des blind Deconvolution Algorithmus verwendet in diesem Protokoll stützte sich auf (i) seine einfache Bedienung, da keine Vorausberechnung der Point-Spread Funktion benötigt wird, (Ii) seine Robustheit für die Verbesserung der Bild Qualität21und (Iii) das Fehlen von Artefakten auf mIgG intrazelluläre Strukturen nach der Implementierung. Abhängig von der intrazellulären Strukturen visualisiert in der Probe führen andere Dekonvolution Algorithmen höhere Bildqualität. Die folgenden Referenzen21,22 geben eine ausführliche Diskussion über die Vorteile und Grenzen der zusätzliche Algorithmen für Bild Dekonvolution. Schließlich erlaubt die Verwendung von einer Bild-Analyse-Software-Paket die Segmentierung der Kapillaren und intrazellulären Strukturen in drei Dimensionen. Klar Bildanalyse beschränkt sich nicht auf die Software, die im Protokoll und alternative Pakete, zum Beispiel die Referenz23ausführlich beschrieben, Segment Bilder genutzt werden. Die Eignung der verschiedenen Software-Programmen für die Analyse der intrazellulären Strukturen über die BBB sollte empirisch überprüft werden, durch die Beurteilung der Genauigkeit der Bild Segmentierung.
Da diese Methode auf festen Proben basiert, bietet es keine direkten Informationen über die Dynamik des Transcytosis über die BBB. Jedoch mit Zeitverlauf Experimente24, z. B. kombinierbar durch intravenös injizieren das Molekül des Interesses und seine Ansammlung innerhalb BECs zu verschiedenen Zeitpunkten nach der Injektion zu rekonstruieren, die Kinetik der Messung intrazellulären Transport. Der Vorteil dieses Ansatzes ist, dass es für die Analyse von tiefen Hirnregionen wie gezeigt in18, die derzeit für intravitalen live bildgebenden Methoden nicht zugänglich sind. Ein wichtiger Schritt während des Protokolls ist die sorgfältige Überwachung der Gewebe Fixierung. Befestigung mit 4 % PFA drastisch reduziert die Immunogenität des intrazellulären Organellen und des endogenen oder peripher verabreichte Immunglobuline17 (Abbildung 1 b). Eine Einschränkung dieses Protokolls ist die Anforderung der qualitativ hochwertige Antikörper (d.h.niedrige unspezifische Färbung, geringe Kreuzreaktivität) geeignet für Immunfluoreszenz. Sofern solche Reagenzien zur Verfügung stehen, kann das Verfahren angewendet werden, um die intrazelluläre Lokalisation jedes Proteins des Interesses zu untersuchen. Zum Beispiel wurde das Protokoll zur Lysosomen im Gehirn endothelial Zellen17identifizieren. Es sollte auch angemerkt werden, dass da dieses Protokoll auf konfokalen Mikroskopie beruht, die laterale Auflösung durch Beugung begrenzt wird und nicht werden Strukturen, die kleiner als etwa 175 bis 250 aufgelöst kann nm (Abbildung 2).
Frühere Studien haben detaillierte Analyse der zellulären Zusammensetzung der konfokalen Mikroskopie25,26mit neurovaskuläre Einheit durchgeführt. Untersuchung von intrazellulären Transport an der BBB hängt jedoch vor allem auf die Verwendung von Transmission Electron Microscopy19,27,28. Während diese Methode die höchste laterale Auflösung der intrazellulären Strukturen bietet, bleibt Elektronenmikroskopie eine anspruchsvolle Technik mit niedrigem Durchsatz. Darüber hinaus ist die Anzahl der verschiedenen molekularen Ziele, die durch EM visualisiert werden können sehr begrenzt. Dieses Protokoll bietet eine zugängliche Alternative zu intrazellulären Transport an der BBB zu untersuchen. Die komplette Prozedur aus Gehirn Sammlung, Bildanalyse, kann in 5 bis 6 Tagen durchgeführt werden. Wenn geeignete Antikörper vorhanden sind, ermöglicht Immunfluoreszenz simultane Detektion von mehreren Zelle Arten/Moleküle innerhalb der gleichen Probe. Außerdem könnte dieses Protokoll mit Höchstauflösung Mikroskopie-Techniken zur Überwindung der Grenzen in räumlicher Auflösung29kombiniert werden. Insgesamt ermöglicht das oben beschriebene Protokoll die Quantifizierung von Veränderungen in die intrazelluläre Lokalisation innerhalb der neurovaskuläre Einheit interessierender Proteine. Seine Anwendung für verschiedene genetische oder pharmakologische Störungen ermöglicht die intrazellulären Struktur und Transport-Funktionen des BBB in Vivozu untersuchen.
Offenlegungen
Autoren sind unter Erwerbstätigkeit von Roche.
Danksagungen
R.V. wurde von einem Roche Postdoctoral Fellowship (2014-2017) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Rat monoclonal antibody clone ER-MP12 against CD31/PECAM | Novus Biologicals | MCA2388 | Labels Brain Endothelial Cells Use at dilution 1:100 detect with donkey polyclonal anti-rat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Rat monoclonal antibody against Podocalyxin | R&D Systems | MAB1556 | Labels Lumen of capillaries Use at dilution 1:100 detect with donkey polyclonal anti-rat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Rabbit polyclonal antibody against CollagenIV | Biotrend | BT21-5014-70 | Labels Basement membrane of capillaries Use at dilution 1:100 detect with donkey polyclonal anti-rabbit IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Goat polyclonal antibody against CD13 | R&D Systems | AF2335 | Labels pericytes Use at dilution 1:100 detect with donkey polyclonal anti-goat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Mouse monoclonal antibody clone G-A-5 against GFAP coupled to Cy3 | Abcam | ab49874 | Labels Astrocytes Use at dilution 1:100 |
| Rabbit polyclonal antibody against Iba-1 | Wako | 019-19741 | Labels Microglia Use at dilution 1:100 detect with donkey polyclonal anti-rat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| Rat monoclonal antibody ABL93 gainst LAMP2 | Fitzgerald | 10R-CD107BBMSP | Labels Lysosomes Use at dilution 1:100 detect with donkey polyclonal anti-rat IgG (H+L) coupled with suitable AlexaFluor dye, used at dilution 1:400 |
| donkey polyclonal antibody against mouse IgG (H+L) AlexaFluor594 | LifeTechnologies | A21203 | Use at dilution 1:400 |
| donkey polyclonal antibody against mouse IgG (H+L) AlexaFluor488 | LifeTechnologies | A21202 | Use at dilution 1:400 |
| goat polyclonal antibody against mouse IgG (H+L) AlexaFluor555 | LifeTechnologies | A21422 | Use at dilution 1:400 |
| Filter paper | Sigma-Aldrich | WHA10334347 | Whatman prepleated qualitative filter paper Grade 0858 1/2, grained |
| Cyanoacrylate glue | Roth Carl | 258.1 | Roti Coll 1 |
| Fluorescent Mounting medium | Dako | S3023 | Dako fluorescent mounting medium |
| Adult mice | The Jackson Laboratory | 000664 | C57BL/6J male or female mice between 9 and 19 months of age |
| Vibratome | Leica Biosystems | 14047235612 | Leica VT100S vibrating blade microtome |
| Laser Scanning Confocal microscope | Leica Microsystems | NA | Leica TCS SP8 X with HyD detectors and White light laser |
| Image processing software | Leica Microsystems | NA | Leica Application Suite AF version 3.1.0 build 8587 |
| Image analysis software | Bitplane scientific software | NA | Imaris version 7.6.5 build 31770 for x64 |
| Fluorescence SpectraViewer | ThermoFisher Scientific | NA | https://www.thermofisher.com/ch/en/home/life-science /cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html |
Referenzen
- Blanchette, M., Daneman, R. Formation and maintenance of the BBB. Mech Dev. 138, Pt 1 8-16 (2015).
- Chow, B. W., Gu, C. The Molecular Constituents of the Blood-Brain Barrier. Trends Neurosci. 38 (10), 598-608 (2015).
- Niewoehner, J., et al. Increased Brain Penetration and Potency of a Therapeutic Antibody Using a Monovalent Molecular Shuttle. Neuron. 81 (1), 49-60 (2014).
- Yu, Y. J., et al. Therapeutic bispecific antibodies cross the blood-brain barrier in nonhuman primates. Sci Transl Med. 6 (261), 154(2014).
- Preston, J. E., Joan Abbott, N., Begley, D. J. Transcytosis of macromolecules at the blood-brain barrier. Adv Pharmacol. 71, 147-163 (2014).
- De Bock, M., et al. Into rather unexplored terrain-transcellular transport across the blood-brain barrier. Glia. 64 (7), 1097-1123 (2016).
- Bien-Ly, N., et al. Transferrin receptor (TfR) trafficking determines brain uptake of TfR antibody affinity variants. J Exp Med. 211 (2), 233-244 (2014).
- Sade, H., et al. A human blood-brain barrier transcytosis assay reveals antibody transcytosis influenced by pH-dependent receptor binding. PLoS One. 9 (4), 96340(2014).
- Tian, X., et al. LRP-1-mediated intracellular antibody delivery to the Central Nervous System. Sci Rep. 5, 11990(2015).
- Hsu, J., Rappaport, J., Muro, S. Specific binding, uptake, and transport of ICAM-1-targeted nanocarriers across endothelial and subendothelial cell components of the blood-brain barrier. Pharm Res. 31 (7), 1855-1866 (2014).
- Siupka, P., et al. Bidirectional apical-basal traffic of the cation-independent mannose-6-phosphate receptor in brain endothelial cells. J Cereb Blood Flow Metab. , (2017).
- Zlokovic, B. V., et al. A saturable mechanism for transport of immunoglobulin G across the blood-brain barrier of the guinea pig. Exp Neurol. 107 (3), 263-270 (1990).
- Deane, R., et al. IgG-assisted age-dependent clearance of Alzheimer's amyloid beta peptide by the blood-brain barrier neonatal Fc receptor. J Neurosci. 25 (50), 11495-11503 (2005).
- Cabezon, I., et al. Serial block-face scanning electron microscopy applied to study the trafficking of 8D3-coated gold nanoparticles at the blood-brain barrier. Histochem Cell Biol. , (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Collin, L., et al. Neuronal uptake of tau/pS422 antibody and reduced progression of tau pathology in a mouse model of Alzheimer's disease. Brain. 137 (10), 2834-2846 (2014).
- Villasenor, R., et al. Trafficking of Endogenous Immunoglobulins by Endothelial Cells at the Blood-Brain Barrier. Sci Rep. 6, 25658(2016).
- Villasenor, R., et al. Region-specific permeability of the blood-brain barrier upon pericyte loss. J Cereb Blood Flow Metab. , (2017).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Sibarita, J. B. Deconvolution Microscopy. 95, 201-243 (2005).
- Shaw, P. J. Comparison of Widefield/Deconvolution and Confocal Microscopy for Three-Dimensional Imaging. , 453-467 (2006).
- Chenouard, N., et al. Objective comparison of particle tracking methods. Nat Methods. 11 (3), 281-289 (2014).
- Foret, L., et al. A general theoretical framework to infer endosomal network dynamics from quantitative image analysis. Curr Biol. 22 (15), 1381-1390 (2012).
- Daneman, R., Zhou, L., Kebede, A. A., Barres, B. A. Pericytes are required for blood-brain barrier integrity during embryogenesis. Nature. 468 (7323), 562-566 (2010).
- Bell, R. D., et al. Pericytes control key neurovascular functions and neuronal phenotype in the adult brain and during brain aging. Neuron. 68 (3), 409-427 (2010).
- Ben-Zvi, A., et al. Mfsd2a is critical for the formation and function of the blood-brain barrier. Nature. 509 (7501), 507-511 (2014).
- Stewart, P. A. Endothelial vesicles in the blood-brain barrier: are they related to permeability. Cell Mol Neurobiol. 20 (2), 149-163 (2000).
- Follain, G., Mercier, L., Osmani, N., Harlepp, S., Goetz, J. G. Seeing is believing - multi-scale spatio-temporal imaging towards in vivo cell biology. J Cell Sci. 130 (1), 23-38 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten