Method Article
A través del espejo: Microscopía de lapso de tiempo y de seguimiento longitudinal de las células individuales para el Estudio de la terapéutica contra el cáncer
En este artículo
Resumen
Here, we describe a method of long-term time-lapse microscopy to longitudinally track single cells in response to anti-cancer therapeutics.
Resumen
La respuesta de las células individuales a los medicamentos contra el cáncer contribuye de manera significativa en la determinación de la respuesta de la población, y por lo tanto es un factor contribuyente importante en el resultado global. Inmunotransferencia, citometría de flujo y experimentos con células fijas se utiliza a menudo para estudiar cómo las células responden a los fármacos contra el cáncer. Estos métodos son importantes, pero tienen varias deficiencias. La variabilidad en las respuestas de drogas entre el cáncer y las células normales, y entre las células del cáncer de origen diferente, y transitoria y respuestas raras son difíciles de entender utilizando ensayos de promedio de la población y sin ser capaz de rastrear y analizar longitudinalmente directamente. El microscopio está particularmente bien adaptado a las células de imágenes en vivo. Los avances en la tecnología nos permiten rutinariamente celdas de imagen a una resolución que permite no sólo el seguimiento de celda, sino también de la observación de una variedad de respuestas celulares. Se describe un enfoque en el detalle que permite la formación de imágenes continua de lapso de tiempo delas células durante la respuesta a los fármacos para la esencia tanto como se desee, típicamente hasta 96 horas. El uso de variaciones del enfoque, las células pueden ser monitorizados por semana. Con el empleo de biosensores fluorescentes genéticamente codificados procesos numerosas vías, y las respuestas pueden ser seguidos. Mostramos ejemplos que incluyen el seguimiento y la cuantificación del crecimiento celular y la progresión del ciclo celular, dinámica de los cromosomas, daño en el ADN, y la muerte celular. También se discuten las variaciones de la técnica y su flexibilidad, y poner de relieve algunos errores comunes.
Introducción
La microscopía de células vivas y el seguimiento longitudinal de las células individuales no es una técnica nueva. Desde los primeros microscopios, los aficionados y los científicos han observado y estudiado las células individuales y organismos, sus comportamientos y desarrollo 1-3. Un ejemplo famoso de la tarde David Rogers de la Universidad de Vanderbilt, en la década de 1950 muestra una neutrófilos humanos en un frotis de sangre persiguiendo una bacteria Staphylococcus aureus y, finalmente, el proceso de fagocitosis 4. Esta película en vivo de células es un excelente ejemplo de cómo los procesos se pueden observar múltiples y correlacionada en un solo experimento: detección de un gradiente químico, la mecánica y la velocidad de la motilidad celular, célula da forma a la dinámica, la adherencia y la fagocitosis de un patógeno.
El advenimiento de los microscopios totalmente automatizados y cámaras digitales de alta sensibilidad se ha traducido en un número cada vez mayor de investigadores usando microscopía de hacer preguntas fundamentales de la biología celular que van from cómo las células se mueven 5,6 y 7,8 dividen a orgánulos dinámica y el tráfico de membrana 9-11. No fluorescente, la microscopía de campo claro, incluyendo contraste de fase (PC), que obtuvo el Premio Nobel de Frits Zernike en 1953, y el contraste de interferencia diferencial (DIC) permitir la observación de células y núcleos sino también las estructuras subcelulares incluyendo haces de microtúbulos , cromosomas, nucleolos, la dinámica de los orgánulos, y fibras de actina gruesas 12. Genéticamente codificada proteínas fluorescentes y el desarrollo de los tintes fluorescentes contra orgánulos han repercutido notablemente en la microscopía de lapso de tiempo 13-15. Aunque no es el foco de este artículo, las imágenes en esferoides celulares e in situ (microscopía intravital) utilizando confocal y microscopía multifotónica representan otra expansión del enfoque, y hay artículos en circulación que usan y discutir estos enfoques 16-19.
Las respuestas de las células a la lucha contra la cancmedicamentos er o productos naturales se determinan en la escala molecular y celular. Comprensión de las respuestas celulares y los destinos después del tratamiento a menudo implica población ensayos de promedio (por ejemplo., Inmunotransferencia, medidas integrales así), o los puntos de tiempo fijos con la detección de inmunofluorescencia y citometría de flujo, que miden las células individuales. La heterogeneidad en las respuestas de células individuales a los fármacos dentro de una población, en particular en los tumores, puede explicar algunas de la variabilidad en la respuesta visto a través de las líneas celulares y los tumores que se tratan con el mismo fármaco a saturación. A largo plazo enfoques longitudinales para seguir una sola célula dada o una población de células es un enfoque menos común, pero muy poderosa que permite el estudio directo de las vías de respuesta moleculares, diferentes fenotipos (por ejemplo., La muerte celular o la división celular), la observación de la variabilidad de célula a célula dentro de una población, y cómo estos factores contribuyen a la dinámica de respuesta de la población de 20-22. Con optimismo, pudiendopara observar y cuantificar las respuestas de células individuales ayudará a mejorar nuestra comprensión de cómo funcionan las drogas, ¿por qué a veces no, y cómo utilizarlos mejor de ellos.
La técnica de microscopía de largo plazo de lapso de tiempo, el seguimiento longitudinal, y el análisis de las respuestas de drogas está disponible para muchos investigadores y puede ser simple, utilizando únicamente la luz transmitida para observar las respuestas fenotípicas 20,21. Los principales componentes del enfoque incluyen: preparación adecuada de las células de interés, un microscopio automatizado con cámara ambiental, una cámara integrada con un ordenador para adquirir y almacenar las imágenes, y software para revisar el lapso de tiempo y medir y analizar las células y cualquier biosensores fluorescentes. Proporcionamos un protocolo detallado con muchos consejos para llevar a cabo la microscopía de lapso de tiempo de las células cultivadas durante el tiempo que el uso de varios días de campo claro y / o microscopía de epifluorescencia de campo amplio. Este protocolo se puede utilizar para cualquier línea celular que se puede cultivar en cultivopara estudiar sus respuestas a las terapias contra el cáncer. Proporcionamos ejemplos de datos adquiridos y analizados mediante múltiples diferentes biosensores fluorescentes codificadas genéticamente y un ejemplo de la microscopía de contraste de fase, discutir brevemente los diferentes tipos de sondas, las ventajas y desventajas de largo plazo de lapso de tiempo y el seguimiento longitudinal, lo que puede ser aprendido de este enfoque que es difícil de entender desde enfoques no directos, y algunas variaciones que esperamos que sea de interés y utilidad para los investigadores sin experiencia que no han considerado el uso del enfoque, y para los investigadores experimentados.
Protocolo
El siguiente protocolo utiliza los parámetros definidos por los experimentos en las Figuras 4 y 6 ajustes de adquisición con respecto a y las condiciones experimentales. Muchos de estos parámetros pueden ser modificados para adaptarse a otros experimentos (es decir, los tiempos de exposición, de agrupación, canales fluorescentes, etc.). Todos los procedimientos deben cumplir con las directrices y normas institucionales y ser aprobados por el comité institucional de bioseguridad. sitios web de fabricantes microscopio contienen información relevante para imágenes de células vivas.
1. Los microscopios y software de imágenes
- Realizar imágenes de células vivas en una amplia variedad de microscopios invertidos. Los microscopios más comunes son de campo amplio de epifluorescencia y confocal de hilado-disco. A continuación, utilizar un microscopio automatizado y motorizado de campo amplio de epifluorescencia con fuente de luz de haluro metálico de 200 vatios.
- Obtener una etapa superior o un microscopio cámara ambiental. A continuación, utilice una etapa-tcámara ambiental op.
- Utilizar software comercial para operar microscopios con utilidades para ejecutar la microscopía de lapso de tiempo.
- Utilice el software ImageJ o disponible en el mercado para el análisis de imágenes. Muchas otras herramientas de análisis están disponibles comercialmente, y hay programas hechos a la medida muchos de los cuales han sido publicados 8,18.
2. La visualización de procesos celulares y respuestas fenotípicas
- Visualizar las células con microscopía de campo claro. Diferencial de contraste de interferencia y contraste de fases por sí solo puede ser muy informativo para estudiar las respuestas a las respuestas de drogas contra el cáncer. Estos procesos pueden incluir la mitosis, la motilidad celular y la apoptosis.
- Visualizar las estructuras celulares, orgánulos y procesos con biosensores fluorescentes. Las sondas fluorescentes son informativos en el seguimiento de los procesos subcelulares específicos. Estos pueden incluir la dinámica de los microtúbulos, y la dinámica mitocondrial del retículo endoplásmico, la acumulación de proteínas y localización, yseñalización molecular (por ejemplo., fosforilación, calcio).
3. Preparación de las muestras
- Se cultivan las células en placas de certificados de cultivo de células en un estándar, incubadora de cultivo celular humidificado (por ejemplo, 37 ° C, 5% de CO 2, 80% de humedad relativa).
- Se cultivan las células HT1080 en MEM con EBSS. Suplemento a los medios con 10% v / v FBS, 1% v / v Pen / Strep, 1% v piruvato / v de sodio y 1% v / v aminoácidos no esenciales.
- Dos días antes de la imagen, las células HT1080 placa de 50,000 Fucci en 3 pocillos de una placa inferior # 1.5 vidrio de 12 pocillos en una campana de flujo laminar estéril certificado. Ajustar el número de células sembradas para lograr ~ 60% de confluencia para el inicio del experimento. Dependiendo de la línea celular y la naturaleza del experimento, la densidad de las células puede ser menor.
Nota: La densidad celular puede tener profunda influencia en el crecimiento de la línea celular y en los resultados experimentales. Contar las células para minimizar experimento a experimento variability debido a la densidad.- Dependiendo de la cámara ambiental y las condiciones necesarias para el experimento, las células de la placa en platos individuales pocillos (típicamente de 35 o 60 mm), 4 bien placas de 35 mm, 6, placas de cultivo celular de 12 o 24 pocillos, o cubreobjetos diapositivas en varios formatos. Utilice placas con fondo de vidrio con vidrio # 1.5 como la mayoría de las lentes del objetivo están optimizados para este grosor del vidrio, y la imagen a través del plástico de cultivo de células es muy pobre.
Nota: Algunas líneas de células no crecen y sobreviven en el vidrio. En estos casos, el vidrio se puede recubrir con el fin de mejorar la adherencia de células (por ejemplo., Poli-lisina o colágeno). Algunas compañías de fabricación de plástico para cultivo celular óptica, se debe determinar empíricamente si esta es una opción viable.
- Dependiendo de la cámara ambiental y las condiciones necesarias para el experimento, las células de la placa en platos individuales pocillos (típicamente de 35 o 60 mm), 4 bien placas de 35 mm, 6, placas de cultivo celular de 12 o 24 pocillos, o cubreobjetos diapositivas en varios formatos. Utilice placas con fondo de vidrio con vidrio # 1.5 como la mayoría de las lentes del objetivo están optimizados para este grosor del vidrio, y la imagen a través del plástico de cultivo de células es muy pobre.
4. Cámara Ambiental Set-up
- Antes de cualquier experimentación, la configuración de la cámara del medio ambiente de manera que funcione en ~ 80% de humedad y así la temperatura en la posición de la muestra es 37 o C. Las células cultivadas crecen en la mayoría atmósfera de aire de CO2 / equilibrio 5% debido a tampón de bicarbonato de sodio en el medio. Dependiendo de la configuración, o bien configurar el controlador ambiental al 5% de CO2 y se mezclará 100% de CO 2 con el aire, o el uso de pre-mezclado, certificado de gas de aire 5% de CO 2 / equilibrio. Siga las instrucciones del fabricante para caudales de gas.
Nota: Algunas líneas celulares crecen en CO 2 medio -independiente en cuyo caso se pueden mantener sin CO 2. medios de formación de imágenes Específicamente diseñado también está disponible que limita la adición de compuestos autofluorescentes. El crecimiento en las tesis medios para el tipo celular deseado debe ser determinado empíricamente de antemano. - Antes de las imágenes, asegúrese de que se llene el depósito de agua (siguiendo las instrucciones del fabricante) con agua destilada estéril. Encienda la cámara ambiental a la temperatura deseada y colocarlo en el recuadro platina del microscopio. Para ahorrar combustible, no arranque el flujo en este momento.
Nota: Si hay algún espacio libre entre la cámara de etapa-top y la inserción fase y / o cualquier tipo de tensión en los cables de conexión a la cámara puede introducir artefactos de movimiento en el experimento.- Ponga los pedazos de lámina de parafina sobre los bordes de la abertura de inserción etapa antes de insertar la cámara en él para acoplar la cámara al escenario, y asegúrese de que no hay conexiones están tirando de la cámara.
- Deje que la cámara se equilibre a 37 ° C. Mantener una temperatura estable para evitar las fluctuaciones de temperatura durante la formación de imágenes que pueden afectar a la fisiología celular e introducir la deriva. Alcanzar equilibrado de la temperatura requiere típicamente 30 min a 1 hr, dependiendo del medio ambiente.
- Inserte un plato "maniquí" con el agua en los pozos en la cámara mientras se calienta. Un plato lleno de imágenes imita la muestra de agua, para ayudar a garantizar que la cámara se caliente lo suficiente y se estabilizó. Llenar la cámara con agua estéril pre-calentadoreduce el tiempo necesario para estabilización de la temperatura y reduce al mínimo la disminución de temperatura tras la adición de la muestra experimental.
5. Microscopio Set-up
- Encienda el microscopio, equipo asociado, y los periféricos necesarios.
- Dependiendo de la fuente de luz, esperar a encenderlo hasta que sea necesario (por ejemplo., LED).
- Con el objetivo de torreta en una posición baja, seleccionar el 20X 0,7 NA objetivo de ser utilizado.
- Coloque la muestra sobre el objetivo - esto hará que sea más fácil encontrar las células cuando la muestra está en la cámara.
- Definir los parámetros de imagen en este momento si se conocen a partir de los experimentos anteriores.
6. El transporte de las células al microscopio y en la Cámara
- Transportar a las células para obtener imágenes de la incubadora a la cámara ambiental. Asegúrese de que esto se hace rápidamente para limitar los efectos de una comparativamente baja de CO 2 ambiente y la disminución de la temperatura en las células. Siga todas las normas de bioseguridad institucionales para el transporte de muestras y de limpieza en caso de un derrame.
- Colocar las células en un recipiente de espuma de poliestireno sellado o bolsa de aislamiento para evitar grandes cambios ambientales.
- Inserte el plato de formación de imágenes de la muestra en la cámara siguiendo las instrucciones del fabricante.
- Después de que las células se han fijado dentro de la cámara ambiental, sellar la cámara para mantener un ambiente estable y gire inmediatamente a la fuente (s) de gas atmosférico.
- Como algunas cámaras ambientales no utilizan un apretado, tapa sellada, para retardar la evaporación, la capa estéril, aceite mineral embrión certificado en la parte superior del medio de crecimiento. Plástico para envolver de parafina de gas-permeable alrededor del perímetro bordes del plato de la muestra con cuidado de no obstruir el área de imagen de vidrio. , métodos de humidificación secundarias localizadas se pueden emplear. Condensación en la tapa de la placa de la muestra puede disminuir perforMance microscopía de campo claro de.
- Con el fin de minimizar los efectos de la deriva térmica temprano durante el experimento, espere 30 min antes de iniciar el lapso de tiempo. El tiempo requerido varía según el tamaño del plato de imagen y otros factores. Determinar empíricamente.
7. Configuración de la Imagen
- Seleccione las condiciones de imagen que mejor representan los datos. Tome precauciones para evitar la fototoxicidad mediante la limitación de los tiempos de exposición, utilizando menor intensidad de la luz y la selección de sondas que son excitados por longitudes de onda más largas de la luz.
- Definir x, y y z del plano y la longitud de onda deseada (s) para cada posición a explorar. La resolución de tiempo está limitado por el número de posiciones y longitudes de onda. Para largo plazo de lapso de tiempo de la mayoría de los procesos celulares, adquiere una imagen cada 10 - 20 minutos; mayor resolución temporal (intervalos cortos, por ejemplo., 1 min) ofrece más puntos de datos y, por tanto, más robusto de seguimiento celular, sino que también se traduce en más integradoexposición a la luz y grandes conjuntos de datos.
- Como HT1080 FUCCI tiene proteínas fluorescentes verdes y rojos dinámicos (ver resultados representativos), utilice los siguientes tiempos de exposición: FITC / GFP - 50 ms, Texas Red / TRITC - 40 ms, 20 ms - campo claro. Utilice una bandeja de 2 x 2.
- Habilitar el enfoque automático controlado por software utilizando los parámetros por defecto en la configuración avanzada. Definir un rango de enfoque automático de 10 m con el tamaño de paso recomendado. Asegúrese de hacer esto antes de iniciar el lapso de tiempo. El enfoque automático con imágenes de campo claro y nunca con fluorescencia para reducir la fototoxicidad y photobleaching.
- Utilizar sistemas de autoenfoque controlados por software en cualquier microscopio con una platina motorizada, y centrarse directamente en la muestra. Sin embargo, pueden limitar la velocidad de adquisición del experimento. Hardware controlado sistemas de enfoque continuo funcionan bien para la microscopía de lapso de tiempo y mejorar la velocidad, lo que permite más posiciones para formar una imagen o una mayor tasa de adquisición. Sin embargo,dependen de la detección de la interfaz aire-vidrio y puede perder el enfoque de la muestra con las variaciones en el espesor del vidrio a través del pozo.
- Vuelva a colocar la mitad de los medios de comunicación con los medios de comunicación que contiene la concentración de fármaco deseada que se ha calentado a 37 ° C. El reemplazo parcial de comunicación ayuda a reducir la deriva térmica. Las condiciones de este experimento son de vehículo (DMSO), 1 selinexor M y 10 M PD0332991.
Nota: Este paso también se puede hacer después de comenzar la adquisición por una pausa y reiniciar el experimento. Esto permite el seguimiento longitudinal de las respuestas antes y después de la droga de células individuales. Si la estabilidad del fármaco o el metabolismo es una preocupación, haciendo una pausa y la sustitución de los medios de comunicación se puede hacer con el mismo método. Para la prueba de degradación del fármaco o el metabolismo, medios de células tratadas también se pueden colocar en las células naïve a probar la acción del fármaco. - Iniciar el lapso de tiempo.
- A medida que el lapso de tiempo se ejecuta, asegúrese de que los campos fotografiados permanecen en el enfoque y la chamber mantiene una humedad de 37 ° C
- Ajuste el enfoque según sea necesario, tras interrumpir la adquisición durante el intervalo de tiempo entre los puntos de tiempo.
- Si es necesario, añadir agua a la cámara durante los experimentos más largos. Evitar el enfriamiento de la cámara mediante la adición de pre-calentado, agua destilada estéril a 37 ° C.
8. Poner fin al lapso de tiempo
- Cuando el experimento se ejecuta hasta que finaliza, detener la adquisición si no se ha configurado para detener automáticamente.
- Asegúrese de que el lapso de tiempo se ha guardado correctamente en el disco duro, aunque la mayoría de los paquetes de software se guardan automáticamente durante la adquisición si no ha terminado correctamente los datos se pueden perder.
- Retire la cámara del microscopio y disponer de las células en los residuos biológicos peligrosos siguiendo los procedimientos de bioseguridad institucional aprobados.
9. Seguimiento longitudinal y Análisis de Datos por lapsos de tiempo
- Elegir la metodología para el análisis de que esapropiarse de los procesos biológicos de interés. Muchos plugins para ImageJ, programas utilizando MATLAB, y plataformas personalizadas se han producido para aplicaciones específicas. La siguiente metodología abarca el seguimiento de los núcleos y el análisis de sondas fluorescentes nucleares como se demuestra en las Figuras 4 y 5.
- Abrir las pilas de imágenes .tif para los canales utilizados en ImageJ. Asimismo, los archivos nativos abiertos desde el programa de captura directamente en ImageJ usando el plugin Bioformats.
- Dibuje una región de interés (ROI) dentro del núcleo de una célula utilizando la imagen de campo claro o el canal del sello Nuclear (si se utiliza) y añadirlo a la gerente de retorno de la inversión. Nota: Si las células fotografiadas tienen una etiqueta nuclear (por ejemplo, la histona H2B-EGFP.), A continuación, el seguimiento automático de células puede ser utilizado para crear las regiones de interés (ROI) que representa los núcleos individuales a través del tiempo.
- Continúe con el siguiente punto en el tiempo y la posición del retorno de la inversión dentro de la misma nucleus. Añadir el retorno de la inversión con el gerente retorno de la inversión.
- Continuar para realizar un seguimiento y hacer ROIs para la célula individual hasta que haya un evento celular (mitosis, apoptosis, etc.) O de la célula ya no se puede seguir (es decir., Se mueve fuera de marco o termina el experimento).
- Cuando se han establecido ROIs para las células a través del tiempo que están en el campo, superponerlos en los canales fluorescentes de interés. Medir la intensidad media de la fluorescencia en cada canal para cada punto de tiempo. Guardar la lista de retorno de la inversión para su uso posterior.
- Varias mediciones se pueden realizar dentro de la ROI para aplicaciones en diferentes experimentos. Haga clic en Análisis → Set Medidas ... para que aparezca un menú para elegir el método analítico (por ejemplo., La intensidad media en el retorno de la inversión, la intensidad integrada, etc.).
- Nota destinos celulares de células individuales (por ejemplo., La apoptosis, la división, mientras que el seguimiento de supervivencia). Esto permite la creación de curvas de supervivencia y furtheanálisis de la población r.
- Con la intensidad media para ambos canales, crear un gráfico de dispersión para mostrar la dinámica del ciclo celular en respuesta a la terapéutica (Figura 5B, C).
Nota: Las parcelas pueden ser creadas para las células individuales en el tiempo o de media sobre una población de células de orugas. formación de imágenes cuantitativa puede ser crítica para el establecimiento de respuestas complejas y relaciones de células en respuesta a la terapéutica del cáncer. A largo plazo la microscopía de lapso de tiempo, el seguimiento longitudinal y análisis de datos es un proceso de múltiples pasos, con muchas opciones para el tipo de herramientas de microscopía y análisis, y sigue el esquema general proporcionado en la Figura 1.
Resultados
A largo plazo la microscopía de lapso de tiempo y el seguimiento longitudinal directa permite el estudio de muchos efectos contra el cáncer durante la respuesta a los fármacos. Siguiendo el esquema general en la Figura 1, múltiples ejemplos de células se muestran expresión de reporteros fluorescentes validados que trata con fármacos anti-cáncer, orugas, y se analizaron usando diferentes enfoques.
Fase microscopía de contraste por sí sola es muy informativo y robusta, informa sobre la interfase frente a la mitosis, la duración y el arresto mitótico, la división celular anormal, y la muerte celular 21,23,24. Los fármacos que se dirigen a la división celular, a menudo denominados fármacos anti-mitótico, se siguen desarrollando. Figura 2 y Películas 1 y 2 muestran ejemplos de un par de líneas de células MCF7 derivados del cáncer de mama emparejados que difieren sólo en su estado de p53, se trató con 500 nM de un tipo de medicamento contra el cáncer que los objetivose inhibe la proteína motora mitótica, Kinesin-5 (KSP1, Kif11, Eg5), resultando en mitosis prolongada 20. Células MCF7 de tipo salvaje (Figura 2A) son un paradigma para estudiar la detención del ciclo celular dependiente de p53 25-27. Células de tipo salvaje entran en mitosis, mantienen durante varias horas, con el tiempo y en gran medida dejar detención con la inducción de p53 25. Cuando p53 se elimina por caída p53 estable (MCF7 sh p53), en lugar de detener después de salir de la mitosis, las células pasan por ciclos repetidos (Figura 2B). Las células fueron rastreados manualmente y el índice mitótico y el porcentaje de células que entran en un segundo mitosis se puntuaron (Figura 2C, D). Observamos que la célula se divide p53 sh seguimiento cuando se entra en una segunda ronda de la mitosis en lugar de detener y salir de la mitosis sin división. Aunque no se muestra aquí la duración de los eventos de la mitosis, el tiempo entre la mitosis sucesivas, el por ciento de divisiones celulares, y los eventos de muerte celular asociados también puede ser ssin corazón 20,21.
Los taxanos, por ejemplo paclitaxel y docetaxel, son la quimioterapia común para muchos tipos de cáncer, incluyendo aquellos que son difíciles de tratar como el pecho de páncreas y avanzado. El paclitaxel se une al plus de fin de dinámica de los microtúbulos y los estabiliza, impidiendo su función normal. El paclitaxel ha observado efectos dependientes de la dosis, e incluso a bajas concentraciones puede perturbar el normal de la progresión mitótico y la segregación de los cromosomas 16. La segregación fiel de cromosomas es esencial para la proliferación celular normal y cuando anormal puede dar lugar a aneuploidía que pueden desencadenar la detención del ciclo celular, sino que también actúan como motor de la progresión del cáncer. Figura células HeLa derivadas de carcinoma de cuello uterino 3 y la película 3 muestran que expresan de forma estable la cromatina marcador de la histona-2b fusionado a mCherry y beta-tubulina fundido a EGFP (no mostrado) en medio de crecimiento normal tratado con 1 nM de paclitaxel. En estoejemplo, la entrada en la mitosis y la progresión a través se puede seguir. El momento de la mitosis parece normal en esta celda, sin embargo, la alineación y la segregación de cromosomas no es, lo que resulta en protuberancias nucleares y micronúcleos que son estructuras que indican mala segregación cromosómica. Micronúcleos son propensos al daño del ADN y cromotripsis, que es la fragmentación a gran escala de cromosomas o la cromatina - esto tiene implicaciones importantes en la evolución del tumor 28,29. Aunque no se muestra aquí, el origen de micronúcleos con relación a otras estructuras mitóticas y el destino de estas células puede ser directamente el seguimiento a través de largo plazo de lapso de tiempo. Además, un marcador de la cromatina expresó con un reportero de daño en el ADN se podría utilizar para establecer la relación entre la segregación de cromosomas, micronúcleos y daño en el ADN.
reporteros fluorescentes permiten procesos celulares enumerables a ser rastreados y se están desarrollando continuamente nuevos reporteros. para explo, el ciclo celular consiste en fases que son de especial interés en el desarrollo dirigido terapias contra el cáncer. Figura 4 y la película 4 muestra una línea celular de fibrosarcoma derivados (HT1080) que de forma estable co-expresa dos periodistas denominan, indicadores del ciclo celular ubiquitina fluorescente (FUCCI) 30. En el sistema aquí, una porción del polipéptido Cdt1 se fusiona a mKO2 (naranja monomérica Kusabira 2) y el aumento de la fase G1 y se degrada en la fase S temprana, y una porción de geminin se fusiona a mAG (monomérica verde Azami) y el aumento de mediados de la fase S y se degrada en la anafase. Esta célula está en medio de crecimiento normal y progresa a través del ciclo celular en 15 h. La Figura 5A, B y de la película 5 muestra las mismas células en medio normal tratados con 10 PD0332991 mu M, un inhibidor de Cdk4 / 6. Las células progresan a través de G2-fase y se dividen normalmente, y fuertemente detienen en la fase G1 posterior, lo que indica el potencial para el efectoive efectos citostáticos en los tumores en crecimiento. Figura 5C, D y de la película 6 muestran las mismas células en medio normal tratado con una pequeña molécula llamada selinexor (KPT-330), un potente inhibidor de la proteína de exportación nuclear, exportin-1 (XPO1, aka CRM1 ). Estos compuestos se denominan inhibidores selectivos de exportación nuclear (SINE) y sus efectos contra el cáncer están actualmente bajo investigación 31,32. Los resultados del tratamiento en SINE fuertes fenotipos del ciclo celular y la muerte celular 33,34. Este ejemplo muestra una célula que progresa a través de G1-fase con la cinética normal (aproximadamente 6 h), pero tiene un retraso en la progresión de la fase S, como se indica por el periodo tanto con la señal de rojo y verde (aproximadamente 3 horas en el control, pero 10 en SINE tratada ). Esta célula muere a finales de S o G2 fase después de 21 h 30 min; un ciclo normal de las células es de aproximadamente 15 hr. Los efectos de selinexor están siendo estudiados para diferentes sangre y tumores sólidos 35.
Un pilar de la terapia contra el cáncer es citotoxicidad causada por el deterioro del ADN catastrófica. daño del ADN puede ser inducida a través de muchas terapias que incluyen radiación, productos de adición a base de platino, y fármacos de moléculas pequeñas - por ejemplo, los que se dirigen a la topoisomerasa I y / o II. Muchas terapias de combinación también atacan el eje daño en el ADN, ya sea la inducción de daño a través de vías separadas o el bloqueo de la capacidad de las células para reparar el daño. La cinética y el grado de daño y si y cómo esto causa la muerte celular es de importancia generalizada en la terapéutica del desarrollo. Figura células HT1080 6 y 7 de la película muestran que expresan de manera estable un reportero daño de doble cadena de ADN, mCherry-BP1-2 36 en el crecimiento normal medio tratado con 10 M etopósido (VP-16), un veneno para topoisomerasa II. Este reportero se compone de una porción de la proteína sitio de rotura del DNA de doble cadena, 53BP1 que se fusiona a mCherry. El núcleo de esta célula fue rastreado USIng el plugin analizar partículas presentes en ImageJ y la señal mCherry-BP1-2 integrado se midió en cada fotograma después de umbralización a cabo los valores que eliminaron la sonda nuclear soluble. daño en el ADN es mínimo para el primer 10 horas y después se aumenta de manera constante. Inhibidores de la topoisomerasa II se sabe que afectan particularmente en fase G2 S- y, cuando la enzima es más activa 37,38. La cinética observada en este ejemplo podría indicar daño asociado del ciclo celular; combinando mCherry-BP1-2 con reporteros Fucci podría demostrar la temporización de los daños que puede ser vinculado a la celda destino.

Figura 1. Introducción al uso a largo plazo de microscopía de lapso de tiempo y de seguimiento longitudinal para estudiar anti-cáncer respuesta a los fármacos. Las células en placas de imágenes de células vivas apropiados etiquetados como se desea se le toman radiografías, se realiza un seguimiento células o regiones de interés, y los datos son analizado. Existen muchos métodos para rastrear y cuantificar células, algunos están indicados aquí. Por favor, haga clic aquí para ver una versión más grande de esta figura.
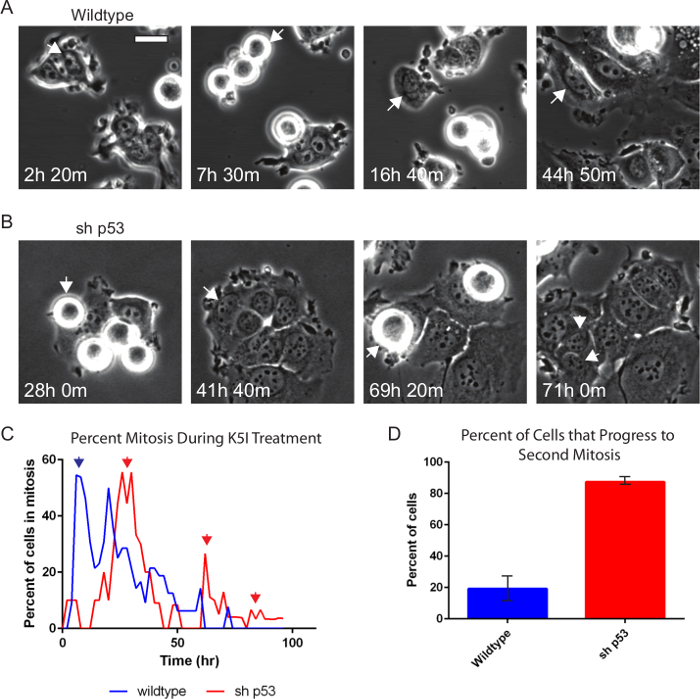
Figura 2. Fase de contraste de lapso de tiempo Microscopía Muestra p53-dependencia después de Anti-mitótico tratamiento de drogas. Wildtype (A) y p53-caída (B) las células MCF7 se trataron con 500 nM inhibidor Kinesin-5 y la imagen cada 10 min para 96 hr utilizando microscopía de contraste de fase con una lente de 20X NA PH2 0,70. Las células individuales fueron rastreados de forma manual y el porcentaje de mitosis y si la célula progresa la mitosis a otro nuevo durante el lapso de tiempo fueron anotados. Las flechas indican células que está siendo rastreado. La célula sh p53 (B) divide al entrar en una segunda mitosis. (C) Ambas líneas celulares shodetención mitótica prolongada w como se indica por el porcentaje mitosis pico alto (primera azul y flechas rojas). (C, D) Casi el 90% de las células sin p53 (p53 SH, n = 87) muestran una continua progresión (flechas rojas) en comparación con el 20% de tipo salvaje (n = 130). Las barras de error indican la desviación estándar. Bar = 20 micras. Películas 1 y 2. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. La cromatina marcador Histona 2B revela evidencia de la segregación cromosómica Las anormalidades después de dosis bajas de paclitaxel tratamiento. Paclitaxel es un fármaco dirigido a microtúbulos que se traduce en defectos complejos, dependientes de la concentración en el crecimiento y la división celular. La organización de la cromatina informa sobre los diferentes estados celulares, incluyendo la etapade la mitosis y la muerte celular. células HeLa que expresan establemente tanto H2b-mCherry y β-tubulina-EGFP se trataron con 1 nM de paclitaxel. Esta célula está inicialmente en la interfase, progresa a través de las etapas de la mitosis y divide. Mientras que el tiempo en la mitosis parece normal, no hay evidencia de errores de fijación de cromosomas y de segregación que se resuelven (flechas). El destino de estas células puede ser determinada directamente por el seguimiento longitudinal. De contraste de fases (no mostrado) y las imágenes fluorescentes se adquirieron en 1 cuadro por 10 min con una lente de NA 20X Ph2 0,70. Bar = 10 micras. Movie 3. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Los marcadores fluorescentes del Ciclo Celular permitir la supervisión directa de la progresión del ciclo celular.(A) Un campo de las células de fibrosarcoma HT1080 vivos que expresan el sistema FUCCI fotografiada por contraste de fase y fluorescencia. (B, C) La célula mitótica en el cuadro de trazos en el panel A se sigue. Normalmente el progreso a través del ciclo celular en aproximadamente 15 hr. Después de la mitosis, las células son brevemente tenue, y luego se vuelven de color rojo a medida que avanzan hacia ya través de la fase G1. Cuando las células entran en la fase S, la sonda roja Cdt1 se degrada y los verdes aumenta la sonda geminin. El breve período de aproximadamente 3 horas cuando ambas sondas están presentes, indica la fase S temprana. A medida que progresan a través de las células S y en fase G2 y en la siguiente mitosis que permanecen verdes. La sonda verde se degrada en la anafase de la división celular. De contraste de fases y las imágenes fluorescentes fueron adquiridas a 1 cuadro por 10 minutos con una lente de 20X NA PH2 0,70. Bar = 10 micras. Película 4. Haga clic aquí a view una versión más grande de esta figura.

Figura 5. Ciclo Celular efectos específicos y la muerte celular asociada. La misma línea celular como en la figura 4, pero se trata con dos moléculas diferentes que representan diferentes objetivos anti-cáncer. Momentos después del tratamiento se indican. (A, B) Después del tratamiento de un tarde de células en fase G2 / S con 10 mM PD0332991 inhibidor de Cdk4 / 6, que la célula progresa normalmente a la mitosis (M) y divide. Una célula hija es seguido por la medición de intensidades fluorescentes rojas y verdes en la región de interés en el núcleo. La célula permanece detenido en la fase G1 durante aproximadamente 40 horas. (C, D) Después del tratamiento de una célula en fase G2 tardía con 1 selinexor mu M, que celular progresa normalmente a la mitosis (M) y divide. Una célula hija se realiza un seguimiento y entra en la fase G1, progresa a través deuna fase S temprana prolongada (señal roja y verde), pasa al verde y exclusivamente muere después de 21 h 30 min. Los datos sugieren la progresión de la fase S se ve afectada por el tratamiento selinexor. De contraste de fases y las imágenes fluorescentes fueron adquiridas a 1 cuadro por 10 minutos con una lente de 20X NA PH2 0,70. Bar = 10 micras. Películas 5 y 6. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6. Dinámica de daño en el ADN después de tratamiento con medicamentos. Muchas terapias contra el cáncer resultan en daño del ADN que puede afectar profundamente la respuesta celular y el éxito del tratamiento. células HT1080 que expresan establemente tanto el marcador de daño en el ADN de doble cadena mCherry-BP1-2 y H2b-EGFP (no mostrado) fueron tratados con 10 mM del fármaco etopósido la topoisomerasa II y el ADN damage fue rastreado. (A) El número y la intensidad del aumento focos después de etopósido. No es inicialmente un retraso, indicando posibles efectos del ciclo celular consistentes con el mecanismo conocido de etopósido. En un 22 hr 50 min esta célula ha acumulado altos niveles de daño. Aunque no se muestra aquí, el destino de esta célula se puede determinar por seguimiento directo. (B) A ROI correspondiente al núcleo obtenida a través de la señal de H2b-EGFP fue rastreado mediante el seguimiento de partícula en ImageJ y la señal BP1-2 mCherry integrado se cuantificó y se representa en el tiempo. El retraso en la señal hasta aproximadamente 10 hr se observa, seguido de un aumento persistente. Fluorescente imágenes fueron adquiridas a 1 cuadro por 10 minutos con una lente de 40X NA PH2 0,75. Bar = 10 micras. Película 7. Haga clic aquí para ver una versión más grande de esta figura.

1. Película de contraste de fases microscopía de lapso de tiempo de wildtype células MCF7 después. Wildtype células MCF7 tratamiento anti-mitótico de la droga fueron tratados con 500 nM de inhibidor Kinesin-5 y la imagen cada 10 minutos durante 96 horas utilizando un microscopio de contraste de fase con una 20X PH2 0,70 lente NA. Mitótico detención prolongada y la salida de mitosis se pueden observar, como se describe en la Figura 2. Haga clic aquí para descargar este archivo.
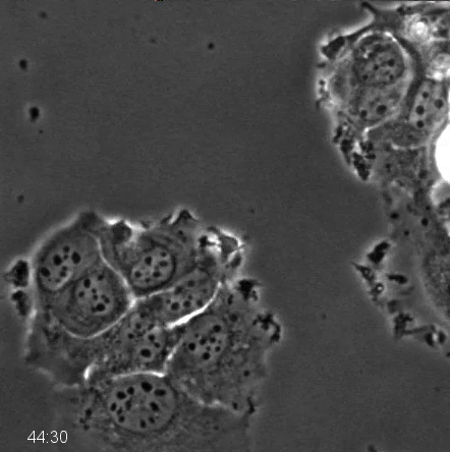
2. Película de contraste de fases microscopía de lapso de tiempo de células MCF7 p53 desmontables después de células anti-mitótico de tratamiento de drogas. MCF7 expresan de manera estable una pequeña horquilla de ARN de orientación para la degradación de p53 fueron tratados con 500 nM de inhibidor Kinesin-5 y fotografiado cada 10 min durante 96 horas usando microscopía de contraste de fase con una lente de NA 20X PH2 0,70. Mitótico detención prolongada y múltiples rondas de mitosis se pueden observar, como se describe en la Figura 2. Haga clic aquí para descargar este archivo.

3. Película microscopía de fluorescencia por lapsos de tiempo de células HeLa después de dosis bajas células paclitaxel tratamiento. HeLa que expresan establemente H2B-mCherry y β-tubulina-EGFP fueron tratadas con 1 nM de paclitaxel. Unión de cromosomas y los problemas de segregación se pueden observar, como se describe en la Figura 3. Las imágenes fueron adquiridas cada 10 minutos con una lente de 20X NA PH2 0,70. Por favor, haga clic aquí para descargar este archivo.
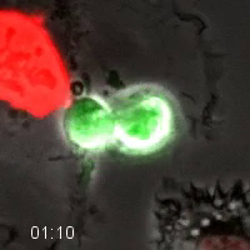
4. Película marcadores del ciclo celular fluorescentes permitir la supervisión directa de la progresión del ciclo celular. Las células HT1080 que expresan el sistema FUCCI fueron seguidos longitudinalmente durante la microscopía de lapso de tiempo. La célula pasa tenue después de salir de la mitosis, y luego se pone roja como la célula progresa a través de la fase G1. A medida que la célula entra en la fase S, se convierte en amarillo como el verde aumenta sonda geminin y la sonda roja Cdt1 se degrada. La célula se mantiene verde a medida que avanza a través de S y G2 fases. El verde degrada a medida que las células entran en la anafase. La cuantificación de esta celda se muestra en la Figura 4. Las imágenes fueron adquiridas cada 10 minutos con una lente de 20X NA PH2 0,70. Por favor, haga clic aquí para descargar este archivo.
Película 5 "src =" / files / ftp_upload / 53994 / 53994movie5.jpg "/>
Película Cell 5. HT1080 que expresan marcadores del Ciclo Celular fluorescentes después del tratamiento con un inhibidor de la fase G1. Células HT1080 que expresan el sistema FUCCI fueron tratados con 10 mM PD0332991, un inhibidor de Cdk4 / 6. La célula de seguimiento progresa normalmente a la mitosis y divide. Una hija es rastreado, y permanece en rojo en G1 durante la duración de la película. La cuantificación se muestra en la Figura 5. Las imágenes fueron adquiridas cada 10 minutos con una lente de 20X NA PH2 0,70. Por favor, haga clic aquí para descargar este archivo.

6. Película HT1080 celulares que expresan marcadores fluorescentes del Ciclo Celular después del tratamiento con el inhibidor de Exportin-1, Selinexor. Células HT1080 que expresan el sistema de tratamiento eran FUCCIed con selinexor 1 mM. Esta célula en fase G2 tardía fue rastreado a través de la mitosis. Una célula hija luego progresa a través de la fase G1 (rojo) y entra en la fase S (amarillo). La célula progresa lentamente a través de S-fases hasta que entra / G2-fase-S tarde y muere después de 21 h 30 min de tratamiento. La cuantificación se muestra en la Figura 5. Las imágenes fueron adquiridas cada 10 minutos con una lente de 20X NA PH2 0,70. Por favor, haga clic aquí para descargar este archivo.
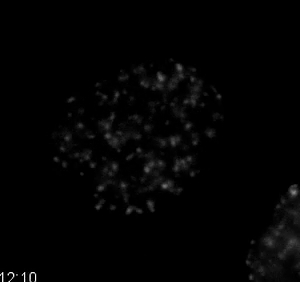
Película Dinámica Daños 7. ADN después del tratamiento con un inhibidor de topoisomerasa II las células HT1080 inhibidor. Expresan de forma estable el marcador de daño en el ADN de doble cadena mCherry-BP1-2 y H2B-EGFP fueron tratados con 10 mM etopósido, un inhibidor de la topoisomerasa II. El mCherry-BP1-2 se muestra en la película. A medida que el tratamiento continúes, la señal de los aumentos mCherry-BP1-2, lo que indica un aumento del daño de doble cadena de ADN. La cuantificación se muestra en la Figura 6. Las imágenes fueron adquiridas cada 10 minutos con una lente de 40X NA PH2 0,75. Por favor, haga clic aquí para descargar este archivo.
Discusión
Ventajas de la microscopía de lapso de tiempo y Seguimiento Longitudinal
El microscopio es un instrumento ideal para los estudios longitudinales de respuesta a los fármacos, ya que permite a los investigadores rastrear las células individuales y sus destinos, así como a toda la población. La variabilidad en la respuesta a los fármacos dentro de una población de células es un problema importante para el diseño terapéutica contra el cáncer. seguimiento longitudinal de células individuales permite a los investigadores observar esta variabilidad y comienzan a comprender los mecanismos subyacentes y las consecuencias en lo que respecta a la población de células. Utilizando una variedad de sondas fluorescentes proporciona una multitud de maneras de observar y comprender ambos fenotipos de respuesta comunes y raras. El momento y la contribución de los diferentes destinos celulares de la respuesta de la población, las relaciones entre los fenotipos y destinos específicos, y las diferencias en la respuesta entre líneas celulares o el estado tras el tratamiento son ejemplos de lo que se puede aprender. Muchos procesos relacionados con el cáncer pueden ser estudiados. Algunos de los que no se destacan en este artículo incluyen la muerte de las células a la apoptosis, autofagia, y los reporteros de necrosis 39-42, la invasión de células 43,44, y la dinámica de p53 que determinan las decisiones del destino celular 27. Además, este enfoque no se limita a los estudios en los estudios terapéuticos contra el cáncer. Los mismos principios se pueden utilizar para estudiar muchos otros procesos biológicos incluyendo la mitosis 45 dinámica del citoesqueleto 46,47 e intracelulares de señalización 48.
Time-lapse microscopía fluorescente también puede proporcionar datos de localización e intensidad de las proteínas y moléculas de interés. No sólo son los cambios en el nivel de proteína importante para la respuesta al fármaco, pero la correcta localización (o inadecuado) de las proteínas dentro de la célula es fundamental para la comprensión de respuesta. La microscopía de lapso de tiempo proporciona datos sobre dónde se localizan las proteínas (por ejemplo., Núcleo, citoplasma, orgánulos específicos,etc.) después del tratamiento de drogas y la forma en la localización y los niveles totales cambian con el tiempo en un mismo nivel celular y de la población.
Retos y limitaciones
A pesar de los puntos fuertes de la microscopía de lapso de tiempo y el análisis longitudinal de las células individuales, existen limitaciones. reporteros de fluorescencia están limitados por su estabilidad y especificidad. En el diseño de proteínas de fusión fluorescentes, es fundamental elegir una sonda que es foto-estable y brillante, pero también es necesario tener en cuenta los efectos de la etiqueta fluorescente está unido a la proteína de interés en cuanto a su función normal y la capacidad de localizar adecuadamente . Estas cuestiones se han discutido en detalle en otra parte y hay muchas proteínas fluorescentes etiquetadas disponibles que se han publicado 15,49,50. Otras etiquetas o marcadores fluorescentes se pueden añadir a las células, y se debe tener cuidado para asegurar que no son tóxicos. En nuestra experiencia, estos pbatas, por ejemplo, etiquetas mitocondriales (potencial de membrana) o de células permeables tintes de ADN, tienden a blanquear más fácil y se diluirá de salida debido a la proliferación celular.
Además, hay muchos problemas técnicos con el crecimiento y la observación de las células en un microscopio. La inestabilidad en cuanto a temperatura, humedad, atmósfera y la luz va a tener grandes efectos sobre las células, lo que resulta en la pérdida de datos o incluso todo el experimento. Problemas de estabilidad con respecto a la captura de imágenes se pueden ver en las películas 1 y 2. Este efecto se puede minimizar mediante el uso de película de parafina (Ver 4.2). También existen algoritmos de estabilización de imagen disponibles para el procesamiento posterior a la adquisición, por ejemplo usando ImageJ (NIH). Un aspecto de largo plazo de lapso de tiempo que a menudo se pasa por alto es la gestión de datos y tamaño de archivo. Incluso cuando binning los datos, un solo experimento de lapso de tiempo es a menudo más de 30 gigabytes. Alta capacidad y alta velocidad, almacenamiento de datos fiable y transferencia son fuertesLy animó. Dependiendo del biosensor (s) fluorescente que se explora, a menudo no es necesario adquirir imágenes de resolución completa, por ejemplo nuclear o sensores citoplásmicos. Recomendamos siempre que sea posible, a tomar medidas para archivos tengan un tamaño pequeño, lo que resulta en más fácil trabajar con datos, las necesidades informáticas menos exigentes, y la mejora del flujo de trabajo.
La fototoxicidad es una de las principales preocupaciones cuando se realiza la microscopía de lapso de tiempo a largo plazo. De luz de alta intensidad y exposiciones de larga duración pueden conducir a photobleaching de sondas fluorescentes, estrés celular y la muerte celular. Estos efectos pueden tener grandes efectos sobre los datos y dar lugar a la tergiversación del experimento. binning la cámara y la ganancia se pueden utilizar para reducir los tiempos de exposición. filtros de densidad neutra en la trayectoria de luz reducen la intensidad de la luz en la muestra. Las longitudes de onda de la luz que se utilizan para la imagen también afectarán a las células. longitudes de onda más cortas (UV, cerca UV) son más perjudiciales para las células y dan lugar a la foto-blanqueo a tasas más rápidas que laslongitudes de onda más largas (por ejemplo., rojo, rojo lejano). Elección del objetivo también puede afectar a la formación de imágenes condiciones. Las lentes superiores apertura numérica (NA) producirá imágenes de mayor resolución, pero mayor magnificación permite menos luz que se transmite desde la muestra resultante en los tiempos de exposición mayores o luz más intensa. Un objetivo debe ser seleccionado con una NA y ampliación adecuada que resolver su objeto de interés y sin sobremuestreo. En muchos casos, el objetivo más alto no puede ser la opción más adecuada. Con sondas nucleares (Figuras 4, 5), un objetivo de baja magnificación permite un mayor campo para ser capturado, el aumento efectivo de tamaño de la muestra, sin comprometer la resolución del objeto deseado. A largo plazo de lapso de tiempo en tres dimensiones se debe realizar con precaución debido a la exposición a la luz integrada. El uso de un disco giratorio microscopio confocal, cámara sensible (por ejemplo., EM-CCD), ganancia de la cámara, y un motor piezoeléctrico rápido para z-Series es suggested para reducir la exposición a la luz. Fast adquisición de la serie z también es importante para minimizar los artefactos de movimiento debido al movimiento celular y dinámicas que se producen durante el período de adquisición. El análisis empírico de las células no tratadas utilizando muchos entornos diferentes puede ser útil para determinar los efectos de la luz fluorescente en cualquier línea celular dada o reportero. Además, un control no tratado debe ser incluido en cada experimento para determinar los efectos citotóxicos de los parámetros experimentales.
Variaciones de la técnica
A largo plazo de lapso de tiempo es robusto y muy flexible. Utilizando técnicas de co-cultivo, diferentes líneas celulares o las mismas líneas celulares que expresan diferentes reporteros se puede utilizar. Un ejemplo destacado de esto es imágenes de células fagocíticas con células diana que están muriendo en respuesta a un fármaco contra el cáncer. Otro ejemplo podría ser estudiar el impacto de las células que responden en las células ingenuas drogas vecina. Junto con la foto-Activateable, foto-convertible, y las proteínas fluorescentes foto-conmutable, y las proteínas modificadas que pueden ser activadas por la luz, para crear efectos específicos (por ejemplo., KillerRed), hay muchas posibilidades. Más enfoques complejos se pueden utilizar, que emplean diversos tipos especializados de microscopía tales como la redistribución de fluorescencia después de photobleaching, la transferencia de energía de resonancia de Förster (FRET), y súper resolución (por ejemplo., Estocástico microscopía de reconstrucción óptica (Storm), estructural iluminación microscopía (SIM), o el agotamiento de emisión estimulada (STED)), y muchos otros y hay ventajas y limitaciones de cada enfoque.
A largo plazo (por ejemplo., Semanas, meses) las respuestas y la recuperación de las células después de la eliminación del fármaco es fundamental para la comprensión de la acción del fármaco anti-cáncer. vidrio platos de fondo cuadriculadas son una herramienta valiosa para monitorear las células o regiones específicas dentro de una población / área en varias ocasiones. Por ejemplo, con un plato cuadriculada, el dr inicialug respuesta se pueden obtener imágenes utilizando un lapso de tiempo, el fármaco se puede quitar, y áreas específicas en la red se pueden obtener imágenes con el tiempo o se somete a lapso de tiempo adicional en el momento deseado. El fondo de cristal en los platos se puede quitar por cualquiera de corte con una herramienta escriba o utilizando un reactivo comercial, y las células en el cristal se puede teñir para otros marcadores de interés, para la actividad de β-galactocidase asociado ejemplo senescencia, y se compara con el lapso de tiempo para entender la historia de cómo las células alcanzaron este estado. Si la población de células es lo suficientemente grande que también puede ser sometido a inmunotransferencia o citometría de flujo.
muestras gruesas han sido tradicionalmente difíciles de imagen, por ejemplo esferoides en diversos materiales de gel o matriz. Newer enfoques, incluyendo confocal fluorescente o microscopía multifotónica 16,18,19,51 se puede utilizar para extender el enfoque a una en la comprensión situ de cómo las células responden a la terapéutica anti-cáncer. losLos estudios se y un número creciente de científicos usando lapso de tiempo para estudiar la respuesta al fármaco anticancerígeno 24,52-54 demuestran claramente que nos estamos moviendo hacia el desarrollo de una comprensión de la farmacodinámica de células individuales que ayudará a mejorar nuestra capacidad de utilizar fármacos contra el cáncer predecir de manera más eficaz y tal vez la respuesta al fármaco anti-cáncer.
Divulgaciones
The authors have no conflicts of interest to disclose.
Agradecimientos
We thank Joshua Marcus for technical support and Jolien Tyler, Ph.D., Director of the Richard J. McIntosh Light Microscopy Core Facility, for technical advice. This work was supported by funds from the University of Colorado Boulder and the University of Colorado Boulder Graduate School to J.D.O. R.T.B. is partially supported by pre-doctoral training grant from the NIH (T32 GM008759). We thank Karyopharm Therapeutics, Inc. for selinexor and Merck Serono for Kinesin-5 inhibitor. FUCCI plasmids are from Atsushi Miyawaki (RIKEN, Japan) via MTA. mCherry-BP1-2 was from Addgene. HeLa expressing H2b-mCherry and β-tubulin-EGFP are from Daniel Gerlich (IMBA, Austrian Academy of Sciences, Austria).
Materiales
| Name | Company | Catalog Number | Comments |
| Taxol (paclitaxel) | Sigma | T7191 | microtubule stabilizing drug |
| Etoposide | Selleckchem | S1225 | topoisomerase II inhibitor |
| Selinexor | Karyopharm Therapeutics | na | XPO1/CRM1 inhibitor, gift |
| Kinesin-5 inhibitor | Merck Serono | na | gift, also available from American Custom Chemicals Corporation. CAS 858668-07-2 |
| Cell growth medium | HyClone (Fisher) or Mediatech | many companies available | |
| 5% CO2/balance air, certified | Airgas | Z03NI7222004379 | |
| 35 mm Dish, 20 mm glass bottom | Cellvis | D35-20-1.5-N | many companies available |
| 35 mm 4-well Dish, 20 mm glass bottom | Cellvis | D35C4-20-1.5-N | many companies available |
| 35 mm Dish, gridded glass bottom | MatTek | P35G-2-14-CGRD | many companies available |
| Multi-well, glass bottom | Cellvis | P12-1.5H-N | many companies available |
| Olympus IX81 inverted epifluorescence microscope | Olympus | ||
| Olympus IX2-UCB controller | Olympus | ||
| PRIOR LumenPro200 | Prior Scientific | Lumen200PRO | |
| PRIOR Proscan III motorized stage | Prio Scientific | H117 | |
| STEV chamber | InVivo Scientific | STEV.ECU.HC5 STAGE TOP | |
| Environmental Controller Unit | InVivo Scientific | STEV.ECU.HC5 STAGE TOP | |
| Hamamatsu ORCA R2 CCD with controller | Hamamatsu | C10600 | |
| Nikon Eclipse Ti | Nikon | ||
| Nikon laser launch | Nikon | ||
| SOLA light engine | lumencor | ||
| iXon Ultra 897 EM-CCD | ANDOR | ||
| TOKAI HIT inclubation chamber | TOKAI HIT | TIZSH |
Referencias
- Abercrombie, M., Heaysman, J. E., Pegrum, S. M. The locomotion of fibroblasts in culture I. Movements of the leading edge. Exp Cell Res. 59, 393-398 (1970).
- Abercrombie, M., Heaysman, J. E. Observations on the social behaviour of cells in tissue culture. I. Speed of movement of chick heart fibroblasts in relation to their mutual contacts. Exp Cell Res. 5, 111-131 (1953).
- Landecker, H. Seeing things: from microcinematography to live cell imaging. Nat Methods. 6, 707-709 (2009).
- The Chase - Panoramic QuickTime Movie of Classic Rogers Neutrophil Chasing S aureus Bacteria. Bepress. , Available from: http://works.bepress.com/gmcnamara (2012).
- van Roosmalen, W., Le Devedec, S. E., Zovko, S., de Bont, H., Bvan de Water, Functional screening with a live cell imaging-based random cell migration assay. Methods Mol Biol. 769, 435-448 (2011).
- Krueger, E. W., Orth, J. D., Cao, H., McNiven, M. A. A dynamin-cortactin-Arp2/3 complex mediates actin reorganization in growth factor-stimulated cells. Mol Biol Cell. 14, 1085-1096 (2003).
- Cluet, D., Stebe, P. N., Riche, S., Spichty, M., Delattre, M. Automated high-throughput quantification of mitotic spindle positioning from DIC movies of Caenorhabditis embryos. PLoS One. 9 (e93718), (2014).
- Held, M., et al. Cell Cognition: time-resolved phenotype annotation in high-throughput live cell imaging. Nat Methods. 7, 747-754 (2010).
- Orth, J. D., Krueger, E. W., Weller, S. G., McNiven, M. A. A novel endocytic mechanism of epidermal growth factor receptor sequestration and internalization. Cancer Res. 66, 3603-3610 (2006).
- Rowland, A. A., Chitwood, P. J., Phillips, M. J., Voeltz, G. K. ER contact sites define the position and timing of endosome fission. Cell. 159, 1027-1041 (2014).
- Merrifield, C. J., Feldman, M. E., Wan, L., Almers, W. Imaging actin and dynamin recruitment during invagination of single clathrin-coated pits. Nat Cell Biol. 4, 691-698 (2002).
- Centonze Frohlich, V. Phase contrast and differential interference contrast (DIC) microscopy. J Vis Exp. , (2008).
- Drummen, G. P. Fluorescent probes and fluorescence (microscopy) techniques--illuminating biological and biomedical research. Molecules. 17, 14067-14090 (2012).
- Guan, Y., et al. Live-cell multiphoton fluorescence correlation spectroscopy with an improved large Stokes shift fluorescent protein. Mol Biol Cell. 26, 2054-2066 (2015).
- Snapp, E. L. Fluorescent proteins: a cell biologist's user guide. Trends Cell Biol. 19, 649-655 (2009).
- Orth, J. D., et al. Analysis of mitosis and antimitotic drug responses in tumors by in vivo microscopy and single-cell pharmacodynamics. Cancer Res. 71, 4608-4616 (2011).
- Brown, E., Munn, L. L., Fukumura, D., Jain, R. K. In vivo imaging of tumors. Cold Spring Harb Protoc. (5452), (2010).
- Chittajallu, D. R., et al. In vivo cell-cycle profiling in xenograft tumors by quantitative intravital microscopy. Nat Methods. 12, 577-585 (2015).
- Nakasone, E. S., Askautrud, H. A., Egeblad, M. Live imaging of drug responses in the tumor microenvironment in mouse models of breast cancer. J Vis Exp. (50088), (2013).
- Orth, J. D., et al. Quantitative live imaging of cancer and normal cells treated with Kinesin-5 inhibitors indicates significant differences in phenotypic responses and cell fate. Mol Cancer Ther. 7, 3480-3489 (2008).
- Gascoigne, K. E., Taylor, S. S. Cancer cells display profound intra- and interline variation following prolonged exposure to antimitotic drugs. Cancer Cell. 14, 111-122 (2008).
- Yang, R., Niepel, M., Mitchison, T. K., Sorger, P. K. Dissecting variability in responses to cancer chemotherapy through systems pharmacology. Clin Pharmacol Ther. 88, 34-38 (2010).
- Orth, J. D., McNiven, M. A. Get off my back! Rapid receptor internalization through circular dorsal ruffles. Cancer Res. 66, 11094-11096 (2006).
- Li, J., et al. Co-inhibition of polo-like kinase 1 and Aurora kinases promotes mitotic catastrophe. Oncotarget. 6, 9327-9340 (2015).
- Orth, J. D., Loewer, A., Lahav, G., Mitchison, T. J. Prolonged mitotic arrest triggers partial activation of apoptosis, resulting in DNA damage and p53 induction. Mol Biol Cell. 23, 567-576 (2012).
- Batchelor, E., Loewer, A., Mock, C., Lahav, G. Stimulus-dependent dynamics of p53 in single cells. Mol Syst Biol. 7 (488), (2011).
- Purvis, J. E., et al. p53 dynamics control cell fate. Science. 336, 1440-1444 (2012).
- Zhang, C. Z., Leibowitz, M. L., Pellman, D. Chromothripsis and beyond: rapid genome evolution from complex chromosomal rearrangements. Genes Dev. 27, 2513-2530 (2013).
- Zhang, C. Z., et al. Chromothripsis from DNA damage in micronuclei. Nature. 522, 179-184 (2015).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132, 487-498 (2008).
- Neggers, J. E., et al. Identifying drug-target selectivity of small-molecule CRM1/XPO1 inhibitors by CRISPR/Cas9 genome editing. Chem Biol. 22, 107-116 (2015).
- Gravina, G. L., et al. XPO1/CRM1-Selective Inhibitors of Nuclear Export (SINE) reduce tumor spreading and improve overall survival in preclinical models of prostate cancer (PCa). Journal of hematology and oncology. 7 (46), (2014).
- Mendonca, J., et al. Selective inhibitors of nuclear export (SINE) as novel therapeutics for prostate cancer. Oncotarget. 5, 6102-6112 (2014).
- Marcus, J. M., Burke, R. T., DeSisto, J. A., Landesman, Y., Orth, J. D. Longitudinal tracking of single live cancer cells to understand cell cycle effects of the nuclear export inhibitor, selinexor. Scientific reports. 5, 14391(2015).
- Senapedis, W. T., Baloglu, E., Landesman, Y. Clinical translation of nuclear export inhibitors in cancer. Semin Cancer Biol. 27, 74-86 (2014).
- Dimitrova, N., Chen, Y. C., Spector, D. L., de Lange, T. 53BP1 promotes non-homologous end joining of telomeres by increasing chromatin mobility. Nature. 456, 524-528 (2008).
- D'Arpa, P., Beardmore, C., Liu, L. F. Involvement of nucleic acid synthesis in cell killing mechanisms of topoisomerase poisons. Cancer Res. 50, 6919-6924 (1990).
- Palmitelli, M., de Campos-Nebel, M., Gonzalez-Cid, M. Progression of chromosomal damage induced by etoposide in G2 phase in a DNA-PKcs-deficient context. Chromosome research : an international journal on the molecular, supramolecular and evolutionary aspects of chromosome biology. , (2015).
- Albeck, J. G., Burke, J. M., Spencer, S. L., Lauffenburger, D. A., Sorger, P. K. Modeling a snap-action, variable-delay switch controlling extrinsic cell death. PLoS biology. 6, 2831-2852 (2008).
- N'Diaye, E. N., et al. PLIC proteins or ubiquilins regulate autophagy-dependent cell survival during nutrient starvation. EMBO reports. 10, 173-179 (2009).
- Xu, J., Liu, Z. F., Wang, J., Deng, P., Jiang, Y. Study of localization and translocation of human high mobility group protein B1 in eukaryotic cells. Zhongguo wei zhong bing ji jiu yi xue = Chinese critical care medicine = Zhongguo weizhongbing jijiuyixue. 18, 338-341 (2006).
- Hoppe, G., Talcott, K. E., Bhattacharya, S. K., Crabb, J. W., Sears, J. E. Molecular basis for the redox control of nuclear transport of the structural chromatin protein Hmgb1. Exp Cell Res. 312, 3526-3538 (2006).
- Moshfegh, Y., Bravo-Cordero, J. J., Miskolci, V., Condeelis, J., Hodgson, L. A Trio-Rac1-Pak1 signalling axis drives invadopodia disassembly. Nat Cell Biol. 16, 574-586 (2014).
- Yu, X., Machesky, L. M. Cells assemble invadopodia-like structures and invade into matrigel in a matrix metalloprotease dependent manner in the circular invasion assay. PLoS One. 7 (e30605), (2012).
- Neumann, B., et al. Phenotypic profiling of the human genome by time-lapse microscopy reveals cell division genes. Nature. 464, 721-727 (2010).
- Burnette, D. T., et al. A role for actin arcs in the leading-edge advance of migrating cells. Nat Cell Biol. 13, 371-381 (2011).
- Matov, A., et al. Analysis of microtubule dynamic instability using a plus-end growth marker. Nat Methods. 7, 761-768 (2010).
- Wollman, R., Meyer, T. Coordinated oscillations in cortical actin and Ca2+ correlate with cycles of vesicle secretion. Nat Cell Biol. 14, 1261-1269 (2012).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society reviews. 38, 2887-2921 (2009).
- Kilgore, J. A., Dolman, N. J., Davidson, M. W., et al. A review of reagents for fluorescence microscopy of cellular compartments and structures, Part II: reagents for non-vesicular organelles. Current protocols in cytometry. Robinson, J. . P. aul 66, (2013).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147, 983-991 (2011).
- Shi, J., Zhou, Y., Huang, H. C., Mitchison, T. J. Navitoclax (ABT-263) accelerates apoptosis during drug-induced mitotic arrest by antagonizing Bcl-xL. Cancer Res. 71, 4518-4526 (2011).
- Tan, N., et al. Navitoclax enhances the efficacy of taxanes in non-small cell lung cancer models. Clin Cancer Res. 17, 1394-1404 (2011).
- Ramapathiran, L., et al. Single-cell imaging of the heat-shock response in colon cancer cells suggests that magnitude and length rather than time of onset determines resistance to apoptosis. J Cell Sci. 127, 609-619 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados