Method Article
Aspectos técnicos de la aortocava Fístula Ratón
En este artículo
Resumen
El objetivo es producir una fístula arteriovenosa que es simple y reproducible. Este método no utiliza suturas o adhesivos pegamento. Por lo tanto las muestras se pueden utilizar con la menor cantidad de materiales extraños para el análisis.
Resumen
Se discuten los aspectos técnicos de la creación de una fístula arteriovenosa en el ratón. Bajo anestesia general, se hizo una incisión abdominal, y la aorta y la vena cava inferior (IVC) están expuestos. La aorta infrarrenal proximal y la aorta distal se diseccionan para la colocación de la abrazadera y la punción de aguja, respectivamente. Se presta especial atención para evitar la disección entre la aorta y la vena cava inferior. Después de sujetar la aorta, se utiliza una aguja de 25 G para la punción ambas paredes de la aorta en la vena cava inferior. El tejido conectivo circundante se utiliza para la compresión hemostático. Creación y el éxito de la FAV se mostrará el flujo de sangre arterial pulsátil en la vena cava inferior. La confirmación adicional de FAV éxito se puede lograr mediante ecografía Doppler post-operatorio.
Introducción
La opción más común elegido para la terapia de reemplazo renal en pacientes con enfermedad renal en fase terminal es la hemodiálisis. Acceso para la hemodiálisis se realiza mediante una fístula arteriovenosa (FAV), injerto arteriovenoso o la colocación del catéter temporal. Aunque AVF son el modo preferido de acceso, AVF todavía están lejos de ser perfecto. Un año de primaria las tasas de permeabilidad AVF son sólo 60 a 65%, con muchas fallas debido a la hiperplasia neointimal. La biología molecular y la fisiología de la formación de AVF normal y la formación de mala adaptación sigue siendo mal caracterizado. Como tal, es mucho más que ganar para mejorar los resultados FAV con la ganancia de acompañamiento en la comprensión de la regulación de la formación de fístulas. 1-3
La exposición de una vena para el flujo arterial se estudia comúnmente en el contexto de los injertos de vena que son modelos directos de derivación quirúrgica. 4, 5 Aunque los injertos de vena y aVF similar exponen una vena para un entorno arterial, hay varios di críticoferencias entre ellos. En primer lugar, la resistencia de la cama escurrimiento distal es mucho más baja en FAV, como la FAV drena a la aurícula derecha, mientras que el injerto de la vena drena a los enfermos a menudo pequeñas arterias distales, lo que resulta en un aumento del flujo sanguíneo y la tensión de cizallamiento en la FAV. En segundo lugar, la sangre venosa en la extremidad de la FAV puede ser una mezcla de sangre venosa y arterial que conduce a una menor oxigenación en comparación con el contenido puramente arterial en el injerto de vena. En tercer lugar, la vena de la FAV no se quita de su cama, lo que lleva a la preservación de su vaso venorum y la inervación nerviosa, en comparación con la transposición completa de la vena del injerto en el lecho arterial. Por último, el número de anastomosis es por lo general dos en injertos de la vena mientras que una FAV típicamente tiene solamente una. En este estudio, se introduce un modelo de ratón de la fístula aorto-cava que se puede utilizar para el estudio de FAV.
Protocolo
1. Procedimientos de anestesia y pre-operatorio
- La inducción de la anestesia general
Se obtiene la aprobación por el Cuidado de Animales institucional apropiado y el empleo. C57/black ratones macho, de 10 semanas, se anestesian. Entregar 4% de isoflurano con 0,8 l / min de oxígeno a una caja de plexiglás a través de un vaporizador de isoflurano y colocar el ratón en el interior. Alternativamente, si se prefiere por el cirujano, la anestesia intraperitoneal se puede utilizar. - Preservar la anestesia
Después de la confirmación de la anestesia por la falta de reacción ante pizca dedo del pie, el ratón se pone en la mesa de operaciones en posición supina con una máscara de silicona. El isoflurano se disminuyó a 2% para mantener el nivel de anestesia apropiada. - Depilación
Pelo ventral se retira desde el cuello a la parte inferior del abdomen utilizando un removedor de pelo. Removedor de pelo se prefiere debido a que el cabello que se deja el uso de una máquina de afeitar puede interferir con el ultrasonido Doppler.
2. Ultrasoun preoperatoriad
- Objetivos de la ecografía
Ecografía Doppler se lleva a cabo antes de la cirugía FAV con el fin de registrar los resultados de nivel de base que se pueden comparar con los resultados postoperatorios para ver cambios anatómicos y fisiológicos. - Puntos de observación
La vena yugular, supra e infra-renal vena cava inferior (IVC), y la aorta abdominal se examinan usando tanto pulso Doppler y modo B.. - Mediciones
Usando el modo B, diámetro de cada vasculatura se mide. Además, la velocidad máxima (velocidad sistólica máxima en las arterias) y formas de onda se registran en cada uno de los puntos de medición descritos anteriormente.
3. Procedimientos Operativos
- Ratón Preparación
Prepare el sitio de la incisión con un antiséptico tópico y seguir una técnica aséptica apropiada durante la cirugía, incluyendo el uso de un paño quirúrgico, guantes e instrumentos estériles, etc - Laparotomía
Incisión de línea media abdominal se hace fROM borde inferior del hígado hasta justo por encima del pubis. - La exposición de la aorta y la vena cava inferior.
Un retractor se inserta y todos los intestinos se sacó de la cavidad abdominal en el lado derecho y se mantuvo envuelto en una gasa empapada con una solución salina. Disección de la membrana que conecta el retroperitoneo y la parte inferior del colon para tener una vista completa de la aorta y la vena cava inferior. Aplique presión sobre la vejiga si se dilata y se mete en camino. - La exposición del sitio de la punción
El sitio de punción será de entre media y tres cuartos de la distancia de la vena renal izquierda a la bifurcación aórtica. (Figura 1) diseccionar el margen izquierdo de la aorta de manera que pueda ser perforado. Tenga en cuenta que la aorta se coloca sobre 45 grados detrás de la vena cava inferior y debe ser diseccionada posterior, además de la izquierda. (Figura 2) El punto más importante de esta cirugía no es para diseccionar entre la aorta y la vena cava inferior. Mantener lejos de ellos. - La exposición del sitio de abrazadera de la AORta
Diseccionar la aorta infrarrenal de los tejidos circundantes. Tenga cuidado de no dañar el IVC en las venas renales derecha e izquierda con sus afluentes por la derecha. - De sujeción de la aorta
Sujete la aorta proximal mediante la aplicación de clips de microcirugía. - La rotación de la aorta
Por agarrar el tejido conectivo que rodea la aorta, girar la aorta de manera que la punción se puede hacer de un lado ligeramente dorsal de la aorta (Figura 2). - La punción de la aorta a través de IVC
Mantener la aorta en una posición girada, la punción de la aorta a través de la VCI para el uso de una aguja de 25 G. (Figura 2) Si tiene éxito, la aguja puede ser visto a través de la delgada pared IVC. - Hemostasia
Al tirar de los tejidos retroperitoneales, incluyendo los músculos, envolver el sitio de la punción de la aorta. No comprima la aorta contra la VCI, ya que se puede coagular la FAV (Figura 3). - De-sujeción de la aorta
Después de la confirmaciónde la hemostasia primaria, de-sujetar la aorta. Sangrado adicional puede ocurrir pero puede ser detenido con una mayor compresión se ha descrito anteriormente. Al de-sujeción, la sangre arterial se puede ver que desemboca en la vena cava inferior en lugar del flujo sanguíneo venoso oscuro. - Clausura del abdomen
Volver al intestino a su posición natural y cerrar el abdomen.
4. Procedimientos postoperatorios
- El cuidado post-operatorio
Tras el cierre del abdomen, isoflurano se detiene. Cuidados postoperatorios incluyendo la analgesia y cuidado de la herida se aplica de acuerdo con las instrucciones recomendadas por el Cuidado de Animales institucional y el empleo. Para la analgesia usamos buprenorfina a 0,1 mg / kg intrasmuscularly cada 12 horas durante 24 horas después de los procedimientos quirúrgicos. - Ecografía postoperatoria
En el primer día después de la operación, la ecografía Doppler se lleva a cabo para confirmar la FAV. Además, otras variables se miden para comprobar los cambios de pre-operatoriovalores.
Resultados
Después de la práctica, la supervivencia en el primer día post-operatorio es típicamente más del 95%; en el día 7 post-operatorio, la supervivencia fue 91,3% Figuras 1 y 2 muestran el sitio de punción ideales en vistas coronal y transversal;. Colocación de la punción El sitio es fundamental para obtener una buena supervivencia sin hemorragia excesiva. Muertes intraoperatorias y muertes postoperatorias tempranas se deben a hemorragias normalmente. Esto tiende a ocurrir con una disección excesiva entre la aorta y la vena cava inferior, o de una inadecuada presión hemostática. Figura 3 muestra un esquema de la importancia de envolver el sitio de la punción con el tejido conectivo antes de aplicar la presión para la hemostasia, que permite una buena hemostasia sin compresión de la AVF. En nuestra experiencia, todo AVF técnicamente exitosa puede confirmarse con una ecografía, el tercer día, una vez que la FAV se confirma en duplex de estar presente, la FAV suele ser estable al menos hasta el día 28 de la figura 4.muestra los resultados típicos de ultrasonido Doppler en la formación AVF éxito. Los cambios en las formas de onda se observaron en el nivel de la FAV en VCI y hacia el corazón. La tasa de confirmación AVF general en el post-operatorio día 3 fue del 71,4%.

Figura 1. Diagrama que muestra el lugar de la punción. El lugar ideal punción es entre media y tres cuartos de la distancia entre la vena renal izquierda y la bifurcación ilíaca. IVC: vena cava inferior.
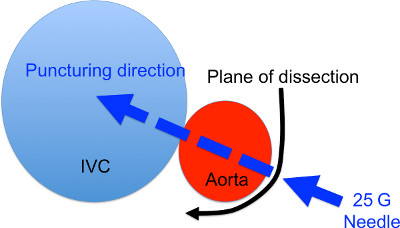
Figura 2. Diagrama de la sección transversal del sitio de formación de FAV. La flecha negro indica el sitio y Directivasel de la disección para exponer la aorta. La flecha azul indica el sitio de punción y la dirección.

Figura 3. Diagrama que muestra el método para la hemostasia Fila superior:. Envolver la aorta con los tejidos conectivos y los músculos. Fila inferior: la aplicación de presión directa. Las posibilidades de cierre AVF son altos con compresión directa.
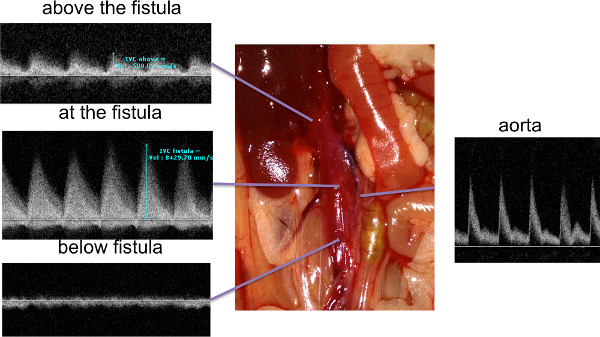
La Figura 4. Los hallazgos ecográficos después de la cirugía. AVF La FAV fue examinado con ultrasonido de alta resolución después de la operación. Formas de onda por debajo de la FAV eran formas de onda venosa típico, mientras que en y por encima de la FAV las formas de onda mostraron superposición de flujo arterial que no estaba presente por debajo de la FAV. Haga clic aquí para ver más grande la figura.
Discusión
Hay varios informes que han descrito FAV en ratas, incluyendo FAV femoral, 6, 7 carótida para yugular FAV 8 y aortocava FAV. 9, 10 La rata es varias veces más grande que el ratón, lo que facilita la cirugía en comparación con la rata el ratón. Sin embargo, con el fin de tomar ventaja de las cepas y variantes genéticos de ratón el procedimiento debe ser extendida para incluir modelos de ratón. Varios informes publicados anteriormente presentó el modelo de AVF en ratones, pero estos informes han sido por lo general en el contexto del desarrollo de un modelo para la insuficiencia cardíaca derecha, el uso de agujas de mayor tamaño 11-13 Guzmán ha informado de una técnica similar a la nuestra,. Sin embargo, en que el informe de los autores utilizan suturas para cerrar la arteriotomía. 13 No utilizamos suturas para evitar posibles interferencias con la posterior extracción de proteínas y ARN para el análisis molecular. Además el cierre de la arteriotomía con suturas conlleva un riesgo de aplicar excesivatensión en la fístula que puede llevar a un sangrado agudo o tardío. En otros informes, FAV se han creado entre las venas carótidas y yugular utilizando el método del manguito. 14 En este estudio se describe un método simple, reproducible, que puede ser utilizado en los estudios de sí mismo FAV que no dependen de un manguito de peri-anastomótica .
Creamos una FAV pinchando con el ratón aorta infra-renal con una aguja de 25 G y se amplía la punción a través de la pared lateral de la aorta en el infra-renal de la vena cava. Durante el desarrollo de la metodología de la actualidad, nos hemos dado cuenta de algunos puntos técnicos cruciales para mejorar el éxito técnico y la coherencia del procedimiento:
- El sitio de la punción de la aorta se coloca en la aorta abdominal distal. Como se muestra en la Figura 1, la parte proximal de la aorta infrarrenal no está colocado al lado de la vena cava inferior, y no hay más tejido conectivo entre estas dos vasos que inhibe la estabilización de la FAV,lo cual provoca hemorragia y baja permeabilidad.
- No se necesitan pinzas distalmente más allá del punto de punción en la aorta. Proximal de sujeción es suficiente para minimizar la presión de la sangre durante el procedimiento. Además, las abrazaderas distales interferirían con la punción de la aorta.
- Como se muestra en la Figura 2, la dirección más eficiente y fisiológica a la punción a través de la vena cava inferior es de la parte trasera izquierda a derecha ventral. No hacerlo puede conducir a menor tamaño de la fístula que conduce a la maduración más lenta u oclusión temprana. Por lo tanto se prefiere para diseccionar la porción posterior externa de la aorta y la aorta para girar ligeramente a la derecha con el fin de obtener la visión directa de la zona de la punción.
- Para la hemostasia, el orificio de entrada aórtica está reparado sólo con el uso de la compresión de los tejidos circundantes, y no requiere la reparación con sutura de la arteriotomía o cualquier pegamento adhesivo. La sutura puede tirar de la aorta lejos de la vena cava inferior, lo que puede conducir a la oclusión de la FAV. Cola puededar un refuerzo para la hemostasia, sino que también puede interferir durante el examen de ultrasonido Doppler, así como lo que hace difícil la extracción de tejido post-operatorio. En cuanto a la compresión, no aplicamos presión directa en el sitio de punción hacia el IVC, ya que también puede comprimir la fístula también. Como se describió anteriormente y se muestra en la Figura 3, que envuelven la aorta con los tejidos circundantes y los músculos conectivos.
Una posible limitación de este estudio es que este modelo se hace entre la aorta y el IVC, vasos grandes en el pequeño ratón. No está claro si este modelo imita la FAV tal como se utiliza en la atención clínica de los pacientes humanos, es decir, FAV hizo en pequeñas arterias periféricas. Además, los animales de control para los experimentos deben realizarse con cuidado, y dependen del protocolo experimental. Normalmente usamos operaciones simuladas para los controles, en los que llevamos a cabo el cierre laparotomía inmediata y bajo anestesia general, sin puncture en absoluto.
Se describe un protocolo corto en el que el operador puede realizar FAV en ratones, dentro de 15-20 minutos. Anticipamos que este modelo será útil para los estudios de adaptación fístula que pueden ser útiles para los pacientes humanos con enfermedad renal en etapa terminal, especialmente si se usa en conjunción con modelos de ratón de la enfermedad.
Divulgaciones
Ninguno.
Agradecimientos
Este trabajo fue apoyado en parte por el Instituto Nacional de Salud de subvención R01-HL095498, así como con los recursos y el uso de instalaciones de la VA Connecticut Healthcare System, West Haven, CT.
Materiales
| Name | Company | Catalog Number | Comments |
| Vevo 770 ultrasound machine | Visualsonics | 20-60 Mhz scan head; RMV-704 | |
| Vascular clamp | Roboz Surgical Instrument Co. | RS-5424 | |
| Clamp applying forceps | Roboz Surgical Instrument Co. | RS-5410 | |
| 25 Gauge Needle | Becton Dickinson | BD PrecisionGlide Needle 25G x 7/8 #305124 |
Referencias
- Allon, M. Current management of vascular access. Clinical Journal of the American Society of Nephrology. 2 (4), 786-800 (2007).
- Dixon, B. S. Why don't fistulas mature?. Kidney International. 70 (8), 1413-1422 (2006).
- Roy-Chaudhury, P., Spergel, L. M., Besarab, A., Asif, A., Ravani, P. Biology of arteriovenous fistula failure. Journal of Nephrology. 20 (2), 150-163 (2007).
- Kudo, F. A., Muto, A., et al. Venous identity is lost but arterial identity is not gained during vein graft adaptation. Arteriosclerosis, Thrombosis, and Vascular Biology. 27 (7), 1562-1571 (2007).
- Muto, A., Yi, T., et al. Eph-B4 prevents venous adaptive remodeling in the adult arterial environment. The Journal of Experimental Medicine. 208 (3), 561-575 (2011).
- Croatt, A. J., Grande, J. P., et al. Characterization of a model of an arteriovenous fistula in the rat: the effect of L-NAME. The American Journal of Pathology. 176 (5), 2530-2541 (2010).
- Misra, S., Fu, A. A., et al. The rat femoral arteriovenous fistula model: increased expression of matrix metalloproteinase-2 and -9 at the venous stenosis. Journal of Vascular and Interventional Radiology. 19 (4), 587-594 (2008).
- Kojima, T., Miyachi, S., et al. The relationship between venous hypertension and expression of vascular endothelial growth factor: hemodynamic and immunohistochemical examinations in a rat venous hypertension model. Surgical Neurology. 68 (3), 277-284 (2007).
- Caplice, N. M., Wang, S., et al. Neoangiogenesis and the presence of progenitor cells in the venous limb of an arteriovenous fistula in the rat. American Journal of Physiology Renal Physiology. 293 (2), F470-F475 (2007).
- Nath, K. A., Kanakiriya, S. K., Grande, J. P., Croatt, A. J., Katusic, Z. S. Increased venous proinflammatory gene expression and intimal hyperplasia in an aorto-caval fistula model in the rat. The American Journal of Pathology. 162 (6), 2079-2090 (2003).
- Karram, T., Hoffman, A., et al. Induction of cardiac hypertrophy by a controlled reproducible sutureless aortocaval shunt in the mouse. Journal of Investigative Surgery. 18 (6), 325-334 (2005).
- Perry, G. J., Mori, T., et al. Genetic variation in angiotensin-converting enzyme does not prevent development of cardiac hypertrophy or upregulation of angiotensin II in response to aortocaval fistula. Circulation. 103 (7), 1012-1016 (2001).
- Guzman, R. J., Krystkowiak, A., Zarins, C. K. Early and sustained medial cell activation after aortocaval fistula creation in mice. The Journal of Surgical Research. 108 (1), 112-121 (2002).
- Castier, Y., Lehoux, S., et al. Characterization of neointima lesions associated with arteriovenous fistulas in a mouse model. Kidney International. 70 (2), 315-320 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados