Method Article
Anticuerpos, químicamente bloqueado Microarray de multiplexado de alto rendimiento de perfiles de glicosilación de proteínas específicas en muestras complejas
En este artículo
Resumen
En este estudio, se describe un protocolo mejorado para una micromatriz anticuerpo multiplexado de alto rendimiento con el método de detección de lectina que se puede utilizar en perfiles de glicosilación de proteínas específicas. Este protocolo incluye nuevos reactivos fiables y reduce significativamente el tiempo, el coste y los requisitos de equipos de laboratorio, en comparación con el procedimiento anterior.
Resumen
In this study, we describe an effective protocol for use in a multiplexed high-throughput antibody microarray with glycan binding protein detection that allows for the glycosylation profiling of specific proteins. Glycosylation of proteins is the most prevalent post-translational modification found on proteins, and leads diversified modifications of the physical, chemical, and biological properties of proteins. Because the glycosylation machinery is particularly susceptible to disease progression and malignant transformation, aberrant glycosylation has been recognized as early detection biomarkers for cancer and other diseases. However, current methods to study protein glycosylation typically are too complicated or expensive for use in most normal laboratory or clinical settings and a more practical method to study protein glycosylation is needed. The new protocol described in this study makes use of a chemically blocked antibody microarray with glycan-binding protein (GBP) detection and significantly reduces the time, cost, and lab equipment requirements needed to study protein glycosylation. In this method, multiple immobilized glycoprotein-specific antibodies are printed directly onto the microarray slides and the N-glycans on the antibodies are blocked. The blocked, immobilized glycoprotein-specific antibodies are able to capture and isolate glycoproteins from a complex sample that is applied directly onto the microarray slides. Glycan detection then can be performed by the application of biotinylated lectins and other GBPs to the microarray slide, while binding levels can be determined using Dylight 549-Streptavidin. Through the use of an antibody panel and probing with multiple biotinylated lectins, this method allows for an effective glycosylation profile of the different proteins found in a given human or animal sample to be developed.
Introduction
Glycosylation of protein, which is the most ubiquitous post-translational modification on proteins, modifies the physical, chemical, and biological properties of a protein, and plays a fundamental role in various biological processes1-6. Because the glycosylation machinery is particularly susceptible to disease progression and malignant transformation, aberrant glycosylation has been recognized as early detection biomarkers for cancer and other diseases 7-12. In fact, most current cancer biomarkers, such as the L3 fraction of α-1 fetoprotein (AFP) for hepatocellular carcinoma 13-15, and CA199 for pancreatic cancer 16, 17 are all aberrant glycan moieties on glycoproteins. However, methods to study protein glycosylation have been complicated, and not suitable for routine laboratory and clinical settings. Chen et al. has recently invented a chemically blocked antibody microarray with a glycan-binding protein (GBP) detection method for high-throughput and multiplexed profile glycosylation of native glycoproteins in a complex sample 18. In this affinity based microarray method, multiple immobilized glycoprotein-specific antibodies capture and isolate glycoproteins from the complex mixture directly on the microarray slide, and the glycans on each individual captured protein are measured by GBPs. Because all normal antibodies contain N-glycans which could be recognized by most GBPs, the critical step of this method is to chemically block the glycans on the antibodies from binding to GBP. In the procedure, the cis-diol groups of the glycans on the antibodies were first oxidized to aldehyde groups by using NaIO4 in sodium acetate buffer avoiding light. The aldehyde groups were then conjugated to the hydrazide group of a cross-linker, 4-(4-N-MaleimidoPhenyl)butyric acid Hydrazide HCl (MPBH), followed by the conjugation of a dipeptide, Cys-Gly, to the maleimide group of the MPBH. Thus, the cis-diol groups on glycans of antibodies were converted into bulky none hydroxyl groups, which hindered the lectins and other GBPs bindings to the capture antibodies. This blocking procedure makes the GBPs and lectins bind only to the glycans of captured proteins. After this chemically blocking, serum samples were incubated with the antibody microarray, followed by the glycans detection by using different biotinylated lectins and GBPs, and visualized with Cy3-streptavidin. The parallel use of an antibody panel and multiple lectin probing provides discrete glycosylation profiles of multiple proteins in a given sample 18-20. This method has been used successfully in multiple different labs 1, 7, 13, 19-31. However, stability of MPBH and Cys-Gly, complicated and extended procedure in this method affect the reproducibility, effectiveness and efficiency of the method. In this new protocol, we replaced both MPBH and Cys-Gly with one much more stable reagent glutamic acid hydrazide (Glu-hydrazide), which significantly improved the reproducibility of the method, simplified and shorten the whole procedure so that the it can be completed within one working day. In this new protocol, we describe the detailed procedure of the protocol which can be readily adopted by normal labs for routine protein glycosylation study and techniques which are necessary to obtain reproducible and repeatable results.
Protocolo
1. Imprimir un microarray de anticuerpos para el ensayo
- Diluir todos los anticuerpos a 0,5 mg / ml en solución salina de tampón fosfato, pH 7,2 (PBS).
- Alícuota de 40 l de cada anticuerpo en la placa de la fuente de 384 pocillos.
- Coloque la placa de fuente de 384-y en el microarrayer sciFLEXARRAYER Scienion.
- Carga de 20 diapositivas de microarrays de PATH en el microarrayer como blanco.
- Ajuste el microarrayer para imprimir 48 subarreglos idénticos, en el que 27 anticuerpos y las proteínas de control detectadas por triplicado en un patrón de 9x9 (Figura 1E, 1F).
- Inicie el microarrayer para imprimir las diapositivas de microarrays de anticuerpos.
- Recoge las diapositivas de microarrays de anticuerpos, y almacenarlos en cassette de diapositivas con desecante. Pase la aspiradora sellar el cartucho en una bolsa de plástico mediante el uso de sellador al vacío (FoodSaver).
- Almacenar las diapositivas microarray cerrados a 4 ° C en el refrigerador.
2. Químicamente Bloquear el microarray de anticuerpos para prevenir EURLa unión a los anticuerpos de captura
El ensayo de microarrays se inicia una vez que las diapositivas de microarrays son químicamente bloqueado y tiene una duración de unas 8 horas. Una vez iniciado el ensayo de microarrays ha de ser completado (los pasos 2 a 8).
- Tome los microarrays se desliza fuera de la nevera, y equilibrar a temperatura ambiente durante 30 minutos.
- Retire la corredera de la caja de almacenamiento y brevemente enjuague con tampón fosfato salino pH 7,2 con Tween 20 al 0,1% (PBST0.1) una vez en una diapositiva de lavabo, y luego en 15 mM de sodio pH 5,0 con tampón de acetato de 0,1% de Tween (CBT0 0.1) de una manera secuencial. Incubar los portaobjetos en CBT0.1 durante 10 minutos en la cuenca de diapositivas de lavado.
- Preparar fresca 150 mM NaIO4 en 15 mM de tampón acetato de sodio pH 5,0 (CB), y guárdelo en en una diapositiva de lavabo en un refrigerador, evitando la luz antes de su uso.
- Retire el portaobjetos de la CB, y lo puso en la cuenca que contiene frescos NaIO4 con la cara de anticuerposhacia arriba. Cubra el recipiente con papel de aluminio para evitar la luz, y se incuba la cuenca de diapositivas durante 2 horas con agitación suave a 4 ° C en un refrigerador.
- Preparar 300 ml de 10 mM de ácido glutámico hidrazida (el bloqueador) en el CB.
- Retire la corredera de la cuenca, y enjuagarlo brevemente en el CB 3 veces durante 5 minutos cada vez, en la cuenca de diapositivas de lavado.
- Incubar las diapositivas en el bloqueador en una pileta de lavar durante 2 horas a temperatura ambiente con agitación suave.
- Retire las diapositivas de la cuenca, y los lavarás con PBST0.1 durante 3 minutos.
3. Bloquear no específicas de enlaces para la Microarray con albúmina sérica bovina (BSA)
- Preparar 300 ml de BSA al 1% en tampón fosfato pH 7,2 con solución salina al 0,5% de Tween (PBST0.5) en una cuenca de diapositivas de lavado, y se incuba la diapositiva microarrays en la cuenca durante 1 hora a temperatura ambiente con agitación suave.
- Enjuague los portaobjetos en PBST0.1 tres veces durante 3 minutos cada vez.
- Coloque la diapositivaen un estante de la diapositiva, y giran a 1.200 xg en una centrifugación durante 2 minutos para secar la diapositiva de microarrays.
4. Pie de imprenta Red de Cera en la diapositiva de microarrays para separar cada submatriz
- Pre-calentar el impresor de cera a 70 ° C durante 5 minutos.
- Cargue el microarreglo bloqueado en el impresor de cera con la cara de anticuerpos frente a la cera. Retire con cuidado el mango a la cera de sello en la diapositiva de manera uniforme.
5. Aplicar las muestras de suero en el microarreglo
- Durante el Paso 2.4, preparar las muestras de suero para el ensayo de cualquiera de los perfiles glico en una muestra (5.1.1), o la única medición de glico epiptope entre las múltiples muestras (5.1.2).
- En un experimento para los profilings glicanos de glicoproteínas séricas múltiples en una sola muestra de suero mediante el uso de múltiples Gbps (véase el experimento muestra 1), muestras de suero se aplica en todos los subcampos. En este caso, 40 l de suero amplio se diluye en 360 l de PBS que contenía 0,1%Tween-20, 0,1% de Brij 35, 100 ug / ml de IgG de ratón, 100 ug / ml de IgG de rata, 100 ug / ml de IgG de conejo, 100 ug / ml de IgG de cabra y 100 ug / ml de IgG de burro. Este volumen es suficiente para la aplicación de 6 l de solución de suero diluido en cada submatriz.
- En un experimento para la medición de un glicano en varias proteínas del suero entre múltiples muestras de suero mediante el uso de una detecciones GBP (véase el experimento muestra 2). En este caso, 1 l de suero amplio se diluye en 9 l de PBS que contenía 0,1% de Tween-20, 0,1% de Brij 35, 100 ug / ml de IgG de ratón, 100 ug / ml de IgG de rata, 100 ug / ml de IgG de conejo , 100 mg / ml de IgG de cabra y 100 ug / ml de IgG de burro. Este volumen es suficiente para la aplicación de 6 l de solución de suero diluido en cada submatriz.
- Después de sello de cera en el paso 4, aplique cuidadosamente 6 ml de muestra diluida o de muestras de control (PBST0.1) a cada submatriz de la diapositiva. Incubar el portaobjetos en un casete humidificado con toallas de papel mojadas a temperatura ambientedurante 1 hora.
- Enjuague el portaobjetos con PBST0.1 tres veces durante 3 minutos cada vez.
- Secar el portaobjetos haciéndolo girar a 1200 xg durante 2 minutos.
6. Aplicar biotinilado EUR (anticuerpo de lectina o Anti-glucano) en la diapositiva
- Durante el Paso 2.4, preparar 10μg/ml de las lectinas con biotina o Gbps en PBST0.1.
- En el experimento de perfiles de glicano que la sonda una muestra con las lectinas múltiples (experimento muestra 1), preparar 350 l de la lectina biotinilada que es suficiente para todas las submatrices.
- En un solo epítopo glicano / biomarcadores de detección en muestras múltiples mediante el uso de lectinas múltiples, preparar 10 l de cada lectina biotinilada que es suficiente para una submatriz.
- Aplicar 6 l de la lectina diluida con biotina (s) a cada submatriz de la corredera, y se incuba en el cuadro de diapositivas humidificado con toallas de papel húmedo a temperatura ambiente durante 1 hora.
- Enjuague los portaobjetos con PBST0.1 tres veces durante 3 minutos cada uno timí.
- Secar el portaobjetos haciéndolo girar a 1200 xg en centrifugar durante 2 minutos.
7. Aplicar neutravidin Dye etiquetados para la detección de fluorescencia
- Preparar 350 l de 549 DyLight neutravidin etiqueta que es suficiente para todas las submatrices.
- Aplicar 6 l de DyLight 549 neutravidin etiquetado en cada submatriz, e incubar el portaobjetos en el cassette deslizante humidificado a temperatura ambiente durante 1 hora.
- Enjuague el portaobjetos con PBST0.1 tres veces durante 3 minutos cada vez.
- Seque la diapositiva haciendo girar la que en 1200 xg en centrifugar durante 2 minutos.
8. Obtener imágenes de microarrays de diapositivas mediante el análisis del Slide
- Busque en la diapositiva mediante el uso de un escáner de fluorescencia de microarrays con una resolución de m 10. Los parámetros del láser y PMT debe ser tan fuerte como sea posible, pero no hay punto de saturación se observa.
9. Extracción de datos y análisis
- Abra la imagen en ArrayPro 3.2.
- Configurar la plantilla de conjunto de acuerdo con el mapa de matriz que muestra los puntos de anticuerpos lugares. Alinear cuidadosamente cada círculo plantilla sobre el punto correspondiente de la imagen.
- Extraer la intensidad de cada punto en un archivo de Excel para su posterior análisis.
10. Los resultados representativos
Ejemplo Experimento 1
Glicosilación perfiles de múltiples glicoproteínas de suero en la muestra del paciente carcinoma hepatocelular suero mediante el uso de microarrays químicamente bloqueado anticuerpo con detección de lectinas múltiple.
El objetivo de este experimento es estudiar el perfil de glicosilación individual de 20 glicoproteínas en el carcinoma hepatocelular (CHC) de la muestra el suero del paciente mediante el uso de microarrays de anticuerpos bloquean químicamente con la detección de lectina. Un microarray de anticuerpos, que contiene 48 subarreglos idénticos que incluyen 26 anticuerpos y biotina BSA-, fue diseñado y fabricado como se describe en Step 1. Estos anticuerpos fueron 26 contra 20 glicoproteínas de suero que identificados como prometedores valor diagnóstico precoz de pacientes con HCC mediante inmunoprecipitación lectina base combinado con la identificación de proteínas de espectrometría de masa 12, 32 como se muestra en la Tabla 1. El patrón y la disposición de las manchas de anticuerpos impresos por triplicado en un representante submatriz se muestra en la Figura 1E y 1F, respectivamente. Dos diapositivas microarrays idénticos, uno no era químicamente bloqueado (Figura 1A), mientras que la otra fue (Figura 1B), se utilizaron para llevar a cabo el experimento glicosilación perfilado mismo con el fin de demostrar la importancia del procedimiento de bloqueo químico para el análisis. Para la diapositiva químicamente bloqueado (Figura 1B), el experimento se inició en el Paso 2, por la diapositiva ninguno químicamente bloqueado (Figura 1A), el experimento se inició a partir del paso 3. El experimento fue llevado por following todos los pasos descritos en el protocolo, excepto para el paso 5.1.2 y 6.1.2. En el Paso 5,2, una muestra de control PBST0.1 se aplicó sobre subarreglos en la columna 1 y 3, y una muestra de suero agrupado CHC se aplicó sobre subarreglos en la columna 2 y 4, respectivamente (como se muestra en la Figura 1G). Esta comparación es mostrar la eficacia, la eficiencia del procedimiento, así como la afinidad de unión al antígeno de los anticuerpos después de bloqueo químico. 22 lectinas biotiniladas (como se muestra en la Tabla 1) que específico para glicanos diferentes 18, 20 se aplicaron a cada submatriz como se muestra en la Figura 1G para perfiles de glicosilación. Las imágenes de las químicamente bloqueados (Figura 1B) y bloqueado no químicamente (Figura 1A) micromatrices después del ensayo de perfiles de glicosilación, siguiendo el protocolo. Como se muestra en las submatrices de la columna 1 y 3 de no-químicamente bloqueados microarrays (Figura 1A y 1C Figura), en las quesólo PBST0.1 se aplicó, la mayoría de las lectinas obligado a capturar anticuerpos, y mostró fondo muy alto que comparables a aquellas subarreglos en la columna 2 y 4, en las que se aplicó la muestra de suero. Es imposible obtener información sobre el perfil de este glicano microarrays de diapositivas. Por el contrario, cuando el mismo experimento se realizó sobre un portaobjetos de anticuerpos microarrays químicamente bloqueado, los subarreglos en la columna 1 y 3, en la que sólo se aplicó PBST0.1, la mayoría de las lectinas mostró enlaces no o muy baja para capturar anticuerpos, mientras que el antígeno de alta fijaciones se observaron todavía en subarreglos en la columna 2 y 4, en la que muestra de suero se aplicó (Figura 1B y 1D). Estos resultados mostraron el procedimiento de bloqueo químico era un paso fundamental tanto la medición de los glicanos en las glicoproteínas de anticuerpos capturados. Siguiendo el protocolo, los perfiles de glicosilación de 22 glicoproteínas en HCC suero se puede obtener.
Experimento 2
Pantalla de fucos alteradosylation sobre determinadas glicoproteínas de suero como biomarcadores para la cirrosis hepática y la discriminación pacientes con carcinoma hepatocelular.
El objetivo de este experimento es para la detección de alteraciones en determinadas fucosilación glicoproteínas de suero como biomarcadores que discriminan a la cirrosis hepática y carcinoma hepatocelular (CHC) de los pacientes. A diferencia del Experimento 1, en la que sólo se aplicó una muestra de suero en cada subarreglos y probaron con diferentes lectinas, en este ensayo, el total de 40 muestras diferentes de suero de HCC y cirrosis pacientes se aplica sobre cada submatriz, y probaron con una lectina (AAL ). El análisis estadístico, como la prueba T, receptor de funcionamiento característico (ROC), se llevó a cabo para evaluar la distribución o el rendimiento diagnóstico de la epiptope glicano / biomarcadores de proteína en cada persona en todas las muestras de suero. Se utilizó el mismo anticuerpo microarrays fabricados en el Experimento 1, excepto para el anti-CA19-9 y anti-anticuerpos de Lewis X en este estudio. La expeperimento se llevó a cabo a partir de 02 de septiembre con el paso 9, excepto para el paso 5.1.1 y 6.1.1. Total de 40 muestras de suero de 20 cirrosis y 20 pacientes con HCC se aplicaron a submatriz aleatoria de los 48 subarreglos junto con las muestras de control de PBS como control negativo. Fucosilación de cada una de las proteínas de los capturados fue detectado mediante el uso de biotina Fucosa específico lectina. La imagen de microarrays muestra en la Figura 1 demuestra la AAL lectina sólo a las proteínas séricas capturados en el microarray (Figura 2D) en lugar de anticuerpos capturados (Figura 2E). Las intensidades de la AAL de unión de todos los puntos fueron extraídos y analizados mediante el uso de T de prueba y las curvas ROC para evaluar el desempeño de la fucosilación (intensidad vinculante AAL) de cada proteína de suero en la discriminación entre los grupos HCC y cirrosis. Los resultados mostraron que la fucosilación de proteína GP73 dio el mejor discriminación entre los dos grupos con una p = 0,03 y el área bajocurva de la curva ROC es igual a 0,72. Este experimento demostró este procedimiento es un método rápido, eficaz para el epítopo glicano / biomarcador cribado en muestras múltiples dentro de múltiples proteínas.
| Identificación | Nombre del reactivo | Abreviación | Empresa | Catálogo # |
| L1 | Biotinilado Concanavalina A | ConA | Vector Laboratories | BK-1000 |
| L2 | Biotinilado lectina Sambucus nigra | SNA | Vector Laboratories | B-1305 |
| L3 | Biotinilado Lens culinaris aglutinina | LCA | Vector Laboratories | BK-2000 |
| L4 | Biotinylated aglutinina de Ricinus communis que | RCA | Vector Laboratories | BK-1000 |
| L5 | Biotinilado Aleuria Aurantia lectina | AAL | Vector Laboratories | B-1395 |
| L6 | Biotinilado Erythrina crista lectina | ECL | Vector Laboratories | BK-3000 |
| L7 | Biotinilado Griffonia (Bandeiraea) Simplicifolia lectina II | GSL II | Vector Laboratories | BK-3000 |
| L8 | Biotinilada aglutinina de germen de trigo | Ventajas de Windows Original | Vector Laboratories | BK-1000 |
| L9 | Erythroagglutinin biotinilado Phaseolus vulgaris | PHA-E | Vector Laboratories | BK-2000 |
| L10 | Leucoaglutinina biotinilado Phaseolus vulgaris | PHA-L | Vector Laboratories | BK-2000 |
| L11 | Bioaglutinina de maní tinylated | ANP | Vector Laboratories | BK-1000 |
| L12 | Biotinylated Pisum sativum aglutinina | PSA | Vector Laboratories | BK-2000 |
| L13 | Biotinilado Dolichos biflorus aglutinina | DBA | Vector Laboratories | BK-1000 |
| L14 | Datura stramonium lectina biotinilada | DSL | Vector Laboratories | BK-3000 |
| L15 | Biotinilado aglutinina Sophora japónica | SJA | Vector Laboratories | BK-2000 |
| L16 | Aglutinina de soja biotinilado | SBA | Vector Laboratories | BK-1000 |
| L17 | Biotinilado Solanum tuberosum (papa) lectina | STL | Vector Laboratories | BK-3000 |
| L18 | Biotinilado Griffonia (Bandeiraea) Simplicifolia lectina I | GSL I | Vector Laboratories | BK-2000 |
| L19 | Biotinilado Vicia villosa lectina | VVL | Vector Laboratories | BK-2000 |
| L20 | Biotinilado Lycopersicon esculentum (tomate) lectina | LEL | Vector Laboratories | BK-3000 |
| L21 | Ulex europaeus biotinilado aglutinina I | UEA I | Vector Laboratories | BK-1000 |
| L22 | Biotinilado jacalin | Jacalin | Vector Laboratories | BK-3000 |
| A1 | F cabra (ab ') 2 Fragmento de IgM anti-humano, el anticuerpo Fc5μ | IgM | Jackson Immuno Research | 109-006-129 |
| A2 | Burro F (ab ') 2Frag anti-IgG humana (H + L) de anticuerpos | AB1 | Jackson Immuno Research | 709-006-149 |
| A3 | Ratón anti-humano IgG F (ab ') 2 anticuerpo monoclonal | AB3 | Jackson Immuno Research | 209-005-097 |
| A4 | Cabra anti-humano alfa 2 macroglobulina anticuerpo policlonal | A2M | GeneTex | GTX62924 |
| A5 | Conejo anti-humana de alfa-1-antitripsina anticuerpo policlonal | A1AT | Lee Biosiences | CA1T-80A |
| A6 | Ratón anti-humano alfa-1-antitripsina anticuerpo monoclonal | A1AT | Sigma Aldrich | SAB4200198 |
| A7 | Conejo anti-humana de alfa-1-antitripsina anticuerpo policlonal | ACT | NeoMarkers | RB-367-A1 |
| A8 | Conejo anti-humana de alfa-1-Antichymotrypsin anticuerpo policlonal | ACT | Fisher Scientific | RB9213R7 |
| A9 | Ratón anti-transferrina humana anticuerpo monoclonal | La transferrina | GeneTex | GTX101035 |
| A10 | Conejo anti-transferrina humana anticuerpo policlonal | La transferrina | GeneTex | GTX77130 |
| A11 | Cabra anti-humano apolipoproteína J anticuerpo policlonal | ApoJ | Abcam | ab7610 |
| A12 | Ratón anti-humano GP73 anticuerpo monoclonal | GP73 | Abbott | 14H4-23 |
| A13 | Ratón anti-humano GP73 anticuerpo monoclonal | GP73 | Santa Cruz de Biotecnología INC | sc-101275 |
| A14 | Conejo anti-humana de alfa-1-fetoproteína anticuerpo policlonal | AFP | GenWay | GWB-41C966 |
| A15 | Ratón anti-humano alfa-1-fetoproteína anticuerpo monoclonal | AFP | Fitzgerald | 10-A05A |
| A16 | Ratón anti-humano hemopexina anticuerpo monoclonal | Hemopexin | Assaypro | 60190-05011 |
| A17 | Ratón anti-humano glipicano-3 (1G12) del anticuerpo monoclonal | GPL3 | Santa Cruz Bio | sc-65443 |
| A18 | Ratón anti-humano Quininógeno (BPM) del anticuerpo monoclonal | Quininógeno | Assaypro | 20333-05011 |
| A19 | Conejo anti-humano MMP-21 anticuerpo monoclonal | MMP21 | Epitomic | 1955-1 |
| A20 | Ratón anti-humano CEACAM-1 anticuerpo monoclonal | CEACAM | R & D Systems | MAB1180 |
| A21 | Rata anti-humano DPPIV/CD26 anticuerpo monoclonal | DPPIV | R & D Systems | MAB22441 |
| A22 | Ratón anti-humano PIVKA II anticuerpo monoclonal | PIVICA | Crystal química | 8040 |
| A23 | Mouse anti-antígeno carcinoembrionario | CEA | EE.UU. biológica | C1300 |
| A24 | Mouse anti-cáncer de antígeno CA125 | CA125 | EE.UU. biológica | C0050-01D |
| A25 | Mouse anti-CA19-9 del cáncer de antígeno | CA19-9 | EE.UU. biológica | C0075-18 |
| A26 | Ratón anti-Lewis x anticuerpo monoclonal | Lewis X | Calbiochem | 434631 |
| bio | Biotinilada BSA (control positivo) | Bio | Hecho en casa | N / A |
Tabla 1. Lista de las lectinas y anticuerpos utilizados en este protocolo.
| Nombre de los equipos o el reactivo s | Empresa | Número de catálogo |
| Microarrayer sin contacto | BioDot Inc | sciFLEXARRAYER |
| 384 microplaca | Pescador | 14-230-243 |
| FoodSaver | FoodSaver | V3835 |
| Ultrafino de nitrocelulosa Coate microarrays se desliza | Gentel | TRAYECTORIA |
| Slide Imprinter (opcional) | La Compañía de gel | WSP60-1 |
| Shaker | Pescador | 15-453-211 |
| Centrifugar | Eppendorf | 5804 000.013 |
| Deslice lavabo / Slide tinción Dish wiº bastidor extraíble | Pescador | 08-812 |
| La incubación de diapositivas de cámara / caja portaobjetos del microscopio | Pescador | 03-448-5 |
| Brij 35, 30 w / v% en agua | Acros Organics | AC32958-0025 |
| Tween-20 al | Pescador | P337-100 |
| Peryodato de sodio (NaIO 4) | Sigma | 311448 |
| L-glutámico ácido γ-hidrazida | Sigma | G-7257 |
| Acetato de sodio anhidro (CH3COONa) | Sigma | S2889 |
| Albúmina de Suero Bovino (BSA) | Lampire Biológica Labs | 7500804 |
| Tampón fosfato salino (PBS) (10 veces) | Denville Científico | CP4390-48 |
| DyLight 549 neutravidin conjugado | Thermo | 22837 |
| Inhibidor de la proteasa cóctel comprimidos | Roche | 4693159001 |
| ChromPure IgG humana, fragmento Fc | Jackson Immunoresearch | 009-000-008 |
| ChromPure IgG humana, toda la molécula | Jackson Immunoresearch | 009-000-003 |
| ChromPure IgG de ratón, toda la molécula | Jackson Immunoresearch | 015-000-003 |
| ChromPure IgG de ratón, fragmento Fc | Jackson Immunoresearch | 015-000-008 |
| ChromPure IgG de conejo, molécula entera | Jackson Immunoresearch | 011-000-003 |
| ChromPure burro IgG, molécula entera | Jackson Immunoresearch | 017-000-003 |
| Microarray Scanner | Tecan | LS Reloaded |
Tabla 2. Listade equipos y reactivos utilizados en este protocolo.

Esquema 1 Un esquema que muestra el microarray de anticuerpos lectina basados en biomarcadores glicano proceso de descubrimiento 1 (Paso 2 a 4): Bloquee el microarray de anticuerpos con el antagonista (Glu-hidrazida) y BSA, 2 (Paso 5):.. Se aplican las muestras de suero y captura glicoproteínas específicas con anticuerpos específicos, 3 (Paso 6): se aplican lectina biotinilada (s), 4 (Paso 7): Sonda de la AAL biotina con DyLight 549 neutravidin etiquetado para microarrays de imágenes.
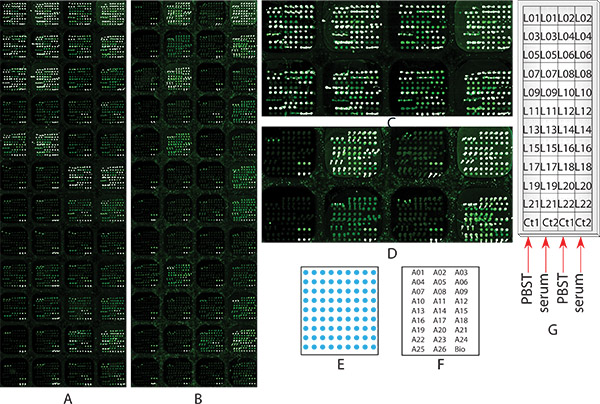
Figura 1. Microarray imágenes de la creación de perfiles de glicosilación Ejemplo de experimento 1 de múltiples glicoproteínas de suero en la muestra del paciente mediante el uso de suero de HCC isquémicaaliado bloqueado microarrays de anticuerpos con la detección de lectina múltiple. Dos diapositivas de microarrays idénticos, (a) ninguna químicamente bloqueado, o (B) químicamente bloqueado como se describe en el Paso 2, ambos pasaron por todos los pasos del 2 al 9 de perfiles de glicosilación, así como para fines de comparación. (A) y (B) son las imágenes escaneadas a microarrays Paso 8 en una resolución de 10 micras. (C) el zoom a la imagen de las dos primeras filas de la ninguno químicamente bloqueado microarreglo (A), (D) el zoom a la imagen de las dos primeras filas de la no químicamente bloqueado microarreglo (B)), (E) el diagrama de la disposición de anticuerpos dentro de cada submatriz; (F) los mapas de la matriz: la ubicación de cada anticuerpo en el subarreglo, cada nombre de anticuerpos representa 3 puntos; (G) Muestra de suero y la ubicación de lectina: muestra un diagrama que subarreglo cada muestra de suero y lectina se aplicó sobre.

Figura 2. Microarray imágenes delEjemplo de experimento 2 pantalla para fucosilación alterada en determinados glicoproteínas de suero como biomarcadores que discriminan a la cirrosis hepática y los pacientes con CHC. El ensayo de microarrays se llevó a cabo como se describe en el Experimento 2 muestra la sección. (A) La imagen de toda la diapositiva de la diapositiva de microarrays del Paso 8, (B) el diagrama de la disposición de anticuerpos dentro de cada submatriz; (C) de la matriz: los mapas de la ubicación de cada anticuerpo en el subarreglo, cada nombre de anticuerpos representa 3 puntos; (D) un zoom a la imagen de una submatriz que se incubaron con muestra de suero, (E) un zoom a la imagen de una submatriz que fueron incubadas con PBS de control.

Figura 3. Resultados de un experimento de creación de perfiles glicano muestra 1. Cada gráfico de barras representa el perfil de la lectina de unión (o perfiles de glicano) de una de la proteína 20 probada. Total de 22 diferentes lectinas se utilizaron para analizar ºe glicano perfil de cada proteína.
Discusión
1. Objetivo de proteínas y selección de anticuerpos de captura
Antes del ensayo de microarrays de anticuerpos, algunos reactivos y materiales son necesarios para ser considerado y preparado. Para diseñar un microarray de anticuerpos para el perfil de glicano o cribado glicano biomarcador, un panel de anticuerpos específicos a los candidatos la glicoproteína debe determinarse de acuerdo a la literatura o de los resultados anteriores. Estos anticuerpos fueron adquiridos por lo general de diferentes proveedores, tales como el R & D Systems, etc IgG se prefieren anticuerpos de captura ya que nuestras pruebas anteriores mostraron que algunos IgM e IgE puede perder por completo sus afinidades de unión al antígeno después de la modificación química.
2. Diseño y fabricación de microarrays de anticuerpos
Fabricación de los microarrays de anticuerpos es un paso opcional que necesita microarrayer profesional y caro, y personal bien capacitado para la operación. Sin embargo, a medida de anticuerpos microarrays fabricantetura puede ser fácilmente hecho desde un proveedor de servicios tales como Serome Biosciences Inc. Para obtener un resultado robusto, se recomienda una microarrayer sin contacto, tales como el volumen de sciFLEXARRAYER Scienion ultra bajo sin contacto microarrayer que se utilizó en nuestra fabricación de microarrays de anticuerpos. Alto grado de unión de la capacidad de microarrays de diapositivas, como el PATH (Gentel Bio Inc. WI) o H de diapositivas (Shott, PA).
3. Seleccionar y preparar glicano las proteínas de unión (Gbps) de perfiles de glicosilación
Gbps que objetivo diferente mono u oligosacáridos se pueden encontrar en la literatura y por medio de un motor de búsqueda desarrollado por el laboratorio Haab 29 y se mantiene a la traslacional Instituto de Genómica Para seleccionar Gbps con una alta especificidad y afinidadlos epítopes de glicano específicas, seleccionar el motivo (epítopo) de la lista desplegable y haga clic en "Buscar". La específica Gbps a este motivo (epítopo) se enumeran de acuerdo a su valor de log P de mayor a menor orden. Superior logP indica una mayor afinidad de unión y especificidad para el motivo de glicano / epítopo. Debido a la inherente no específica cuestión de unión de la lectina, este método todavía no es tan óptimo como el ensayo de anticuerpo basado. Por lo tanto, se recomienda encarecidamente que los anticuerpos anti-glicanos se utilizan, tales como anti-Lewis X o anti-sialil Lewis a los anticuerpos, si están disponibles. El uso de múltiples Gbps para la detección es otra estrategia para cotejarla con diferentes perfiles de unión y para obtener datos fiables sobre el enlace.
4. Análisis de los datos
Debido a que este método se utiliza para detectar nativas proteínas del suero, los complejos proteína-proteína pueden ser capturados y detectados. Western blot o la espectrometría de masas es un buen método para validar los datos de microarrays. En el entretanto, La detección de los niveles de proteína utilizando el mismo micromatriz es otro método para conocer los detalles de la alteración de glicosilación de la proteína, tales como si los cambios fueron debido al cambio del nivel de proteína total o simplemente que el nivel de glicosilación aumentado en cada una de las proteínas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Instituto de Investigaciones sobre el Virus Hepatitis y.
Materiales
| Name | Company | Catalog Number | Comments | |
| Identificación | Nombre del reactivo | Abreviación | Empresa | Catálogo # |
| L1 | Biotinilado Concanavalina A | ConA | Vector Laboratories | BK-1000 |
| L2 | Biotinilado lectina Sambucus nigra | SNA | Vector Laboratories | B-1305 |
| L3 | Biotinilado Lens culinaris aglutinina | LCA | Vector Laboratories | BK-2000 |
| L4 | Biotinylated aglutinina de Ricinus communis que | RCA | Vector Laboratories | BK-1000 |
| L5 | Biotinilado Aleuria Aurantia lectina | AAL | Vector Laboratories | B-1395 |
| L6 | Biotinilado Erythrina crista lectina | ECL | Vector Laboratories | BK-3000 |
| L7 | Biotinilado Griffonia (Bandeiraea) Simplicifolia lectina II | GSL II | Vector Laboratories | BK-3000 |
| L8 | Biotinilada aglutinina de germen de trigo | Ventajas de Windows Original | Vector Laboratories | BK-1000 |
| L9 | Erythroagglutinin biotinilado Phaseolus vulgaris | PHA-E | Vector Laboratories | BK-2000 |
| L10 | Leucoaglutinina biotinilado Phaseolus vulgaris | PHA-L | Vector Laboratories | BK-2000 |
| L11 | Aglutinina de maní biotinilado | ANP | Vector Laboratories | BK-1000 |
| L12 | Biotinylated Pisum sativum aglutinina | PSA | Vector Laboratories | BK-2000 |
| L13 | Biotinilado Dolichos biflorus aglutinina | DBA | Vector Laboratories | BK-1000 |
| L14 | Datura stramonium lectina biotinilada | DSL | Vector Laboratories | BK-3000 |
| L15 | Biotinilado aglutinina Sophora japónica | SJA | Vector Laboratories | BK-2000 |
| L16 | Aglutinina de soja biotinilado | SBA | Vector Laboratories | BK-1000 |
| L17 | Biotinilado Solanum tuberosum (papa) lectina | STL | Vector Laboratories | BK-3000 |
| L18 | Biotinilado Griffonia (Bandaeiraea) Simplicifolia me lectina | GSL I | Vector Laboratories | BK-2000 |
| L19 | Biotinilado Vicia villosa lectina | VVL | Vector Laboratories | BK-2000 |
| L20 | Biotinilado Lycopersicon esculentum (tomate) lectina | LEL | Vector Laboratories | BK-3000 |
| L21 | Ulex europaeus biotinilado aglutinina I | UEA I | Vector Laboratories | BK-1000 |
| L22 | Biotinilado jacalin | Jacalin | Vector Laboratories | BK-3000 |
| A1 | F cabra (ab ') 2 Fragmento de IgM anti-humano, el anticuerpo Fc5μ | IgM | Jackson Immuno Research | 109-006-129 |
| A2 | Burro F (ab ') 2 Frag anti-IgG humana (H + L) untibody | AB1 | Jackson Immuno Research | 709-006-149 |
| A3 | Ratón anti-humano IgG F (ab ') 2 anticuerpo monoclonal | AB3 | Jackson Immuno Research | 209-005-097 |
| A4 | Cabra anti-humano alfa 2 macroglobulina anticuerpo policlonal | A2M | GeneTex | GTX62924 |
| A5 | Conejo anti-humana de alfa-1-antitripsina anticuerpo policlonal | A1AT | Lee Biosiences | CA1T-80A |
| A6 | Ratón anti-humano alfa-1-antitripsina anticuerpo monoclonal | A1AT | Sigma Aldrich | SAB4200198 |
| A7 | Conejo anti-humana de alfa-1-antitripsina anticuerpo policlonal | ACT | NeoMarkers | RB-367-A1 |
| A8 | Conejo anti-humanaalfa-1-antiquimotripsina anticuerpo policlonal | ACT | Fisher Scientific | RB9213R7 |
| A9 | Ratón anti-transferrina humana anticuerpo monoclonal | La transferrina | GeneTex | GTX101035 |
| A10 | Conejo anti-transferrina humana anticuerpo policlonal | La transferrina | GeneTex | GTX77130 |
| A11 | Cabra anti-humano apolipoproteína J anticuerpo policlonal | ApoJ | Abcam | ab7610 |
| A12 | Ratón anti-humano GP73 anticuerpo monoclonal | GP73 | Abbott | 14H4-23 |
| A13 | Ratón anti-humano GP73 anticuerpo monoclonal | GP73 | Santa Cruz de Biotecnología INC | sc-101275 |
| A14 | Conejo anti-humana de alfa-1 fetoprotein anticuerpo policlonal | AFP | Genway | GWB-41C966 |
| A15 | Ratón anti-humano alfa-1-fetoproteína anticuerpo monoclonal | AFP | Fitzgerald | 10-A05A |
| A16 | Ratón anti-humano hemopexina anticuerpo monoclonal | Hemopexin | Assaypro | 60190-05011 |
| A17 | Ratón anti-humano glipicano-3 (1G12) del anticuerpo monoclonal | GPL3 | Santa Cruz Bio | sc-65443 |
| A18 | Ratón anti-humano Quininógeno (BPM) del anticuerpo monoclonal | Quininógeno | Assaypro | 20333-05011 |
| A19 | Conejo anti-humano MMP-21 anticuerpo monoclonal | MMP21 | Epitomic | 1955-1 |
| A20 | Ratón anti-humano CEACAM-1 anticuerpos monoclonalesy | CEACAM | R & D Systems | MAB1180 |
| A21 | Rata anti-humano DPPIV/CD26 anticuerpo monoclonal | DPPIV | R & D Systems | MAB22441 |
| A22 | Ratón anti-humano PIVKA II anticuerpo monoclonal | PIVICA | Crystal química | 8040 |
| A23 | Mouse anti-antígeno carcinoembrionario | CEA | EE.UU. biológica | C1300 |
| A24 | Mouse anti-cáncer de antígeno CA125 | CA125 | EE.UU. biológica | C0050-01D |
| A25 | Mouse anti-CA19-9 del cáncer de antígeno | CA19-9 | EE.UU. biológica | C0075-18 |
| A26 | Ratón anti-Lewis x anticuerpo monoclonal | Lewis X | Calbiochem | 434631 |
| bio | Biotinilada BSA (control positivo) | Bio | Hecho en casa | N / A |
Tabla 1. Lista de las lectinas y anticuerpos utilizados en este protocolo.
| Nombre de los equipos o el reactivo s | Empresa | Número de catálogo |
| Microarrayer sin contacto | BioDot Inc | sciFLEXARRAYER |
| 384 microplaca | Pescador | 14-230-243 |
| FoodSaver | FoodSaver | V3835 |
| Ultrafino de nitrocelulosa Coate microarrays se desliza | Gentel | TRAYECTORIA |
| Slide Imprinter (opcional) | La Compañía de gel | WSP60-1 |
| Shaker | Pescador | 15-453-211 |
| Centrifugar | Eppendorf | 5804 000.013 |
| Deslice el lavabo / Slide tinción Plato con bastidor extraíble | Pescador | 08-812 |
| La incubación de diapositivas de cámara / caja portaobjetos del microscopio | Pescador | 03-448-5 |
| Brij 35, 30 w / v% en agua | Acros Organics | AC32958-0025 |
| Tween-20 al | Pescador | P337-100 |
| Peryodato de sodio (NaIO 4) | Sigma | 311448 |
| L-glutámico ácido γ-hidrazida | Sigma | G-7257 |
| Acetato de sodio anhidro (CH3COONa) | Sigma | S2889 |
| Albúmina de Suero Bovino (BSA) | Lampire Biológica Labs | 7500804 |
| Tampón fosfato salino (PBS) (10 veces) | Denville Científico | CP4390-48 |
| DyLight 549 neutravidin conjugado | Thermo | 22837 |
| Inhibidor de la proteasa cóctel comprimidos | Roche | 4693159001 |
| ChromPure IgG humana, fragmento Fc | Jackson Immunoresearch | 009-000-008 |
| ChromPure IgG humana, toda la molécula | Jackson Immunoresearch | 009-000-003 |
| ChromPure IgG de ratón, toda la molécula | Jackson Immunoresearch | 015-000-003 |
| ChromPure IgG de ratón, fragmento Fc | Jackson Immunoresearch | 015-000-008 |
| ChromPure IgG de conejo, molécula entera | Jackson Immunoresearch | 011-000-003 |
| ChromPure burro IgG, molécula entera | Jackson Immunoresearch | 017-000-003 |
| Microarray Scanner | Tecan | LS Reloaded |
Tabla 2. Lista de equipos y reactivos utilizados en este protocolo.
Referencias
- Fang, M. The ER UDPase ENTPD5 promotes protein N-glycosylation, the Warburg effect, and proliferation in the PTEN pathway. Cell. 143, 711-724 (2010).
- Marino, K., Bones, J., Kattla, J. J., Rudd, P. M. A systematic approach to protein glycosylation analysis: a path through the maze. Nat. Chem. Biol. 6, 713-723 (2010).
- Shental-Bechor, D., Levy, Y. Effect of glycosylation on protein folding: a close look at thermodynamic stabilization. Proc. Natl. Acad. Sci. U. S. A. 105, 8256-8261 (2008).
- Hossler, P., Khattak, S. F., Li, Z. J. Optimal and consistent protein glycosylation in mammalian cell culture. Glycobiology. 19, 936-949 (2009).
- Nothaft, H., Szymanski, C. M. Protein glycosylation in bacteria: sweeter than ever. Nat. Rev. Microbiol. 8, 765-778 (2011).
- Sola, R. J., Griebenow, K. Effects of glycosylation on the stability of protein pharmaceuticals. J. Pharm. Sci. 98, 1223-1245 (2009).
- Li, C., Lubman, D. M. Analysis of serum protein glycosylation with antibody-lectin microarray for high-throughput biomarker screening. Methods Mol. Biol. 723, 15-28 (2011).
- Dwek, M. V., Jenks, A., Leathem, A. J. A sensitive assay to measure biomarker glycosylation demonstrates increased fucosylation of prostate specific antigen (PSA) in patients with prostate cancer compared with benign prostatic hyperplasia. Clin. Chim. Acta. 411, 1935-1939 (2010).
- Drake, P. M. Sweetening the pot: adding glycosylation to the biomarker discovery equation. Clin. Chem. 56, 223-236 (2010).
- Kim, Y. -. P., Park, S., Oh, E., Oh, Y. -. H., Kim, H. -. S. On-chip detection of protein glycosylation based on energy transfer between nanoparticles. Biosensors & Bioelectronics. 24, 1189-1194 (2009).
- Boland, M., Rudd, P. M. Disease related glycosylation changes and biomarker discovery: challenges and possibilities in an emerging field. Editorial. Dis. Markers. 25, 189-192 (2008).
- Norton, P. A. N-linked glycosylation of the liver cancer biomarker GP73. J. Cell Biochem. 104, 136-149 (2008).
- Nakagawa, T. Glycomic analysis of alpha-fetoprotein L3 in hepatoma cell lines and hepatocellular carcinoma patients. J. Proteome Res. 7, 2222-2233 (2008).
- Durazo, F. A. Des-gamma-carboxyprothrombin, alpha-fetoprotein and AFP-L3 in patients with chronic hepatitis, cirrhosis and hepatocellular carcinoma. J. Gastroenterol Hepatol. 23, 1541-1548 (2008).
- Kobayashi, M. Fucosylated fraction of alpha-fetoprotein, L3, as a useful prognostic factor in patients with hepatocellular carcinoma with special reference to low concentrations of serum alpha-fetoprotein. Hepatol. Res. 37, 914-922 (2007).
- Maisey, N. R. CA19-9 as a prognostic factor in inoperable pancreatic cancer: the implication for clinical trials. Br. J. Cancer. 93, 740-743 (2005).
- Talar-Wojnarowska, R. Clinical value of serum neopterin, tissue polypeptide-specific antigen and CA19-9 levels in differential diagnosis between pancreatic cancer and chronic pancreatitis. Pancreatology. 10, 689-694 (2010).
- Chen, S. Multiplexed analysis of glycan variation on native proteins captured by antibody microarrays. Nat. Methods. 4, 437-444 (2007).
- Shao, C. Antibody microarray analysis of serum glycans in esophageal spuamous cell carcinoma cases and controls. Proteomics Clinical Applications. 3, 923-931 (2009).
- Chen, S., Haab, B. B. Analysis of glycans on serum proteins using antibody microarrays. Methods Mol. Biol. 520, 39-58 (2009).
- Yue, T. The Prevalence and Nature of Glycan Alterations on Specific Proteins in Pancreatic Cancer Patients Revealed Using Antibody-Lectin Sandwich Arrays. Molecular & Cellular Proteomics. 8, 1697-1707 (2009).
- Wolf-Yadlin, A., Sevecka, M., MacBeath, G. Dissecting protein function and signaling using protein microarrays. Current Opinion in Chemical Biology. 13, 398-405 (2009).
- Richard, E. Proteomics as Applied to Inherited Metabolic Diseases. Current Proteomics. 6, 140-153 (2009).
- Nolen, B., Winans, M., Marrangoni, A., Lokshin, A. Aberrant tumor-associated antigen autoantibody profiles in healthy controls detected by multiplex bead-based immunoassay. Journal of Immunological Methods. 344, 116-120 (2009).
- Kuno, A. Focused Differential Glycan Analysis with the Platform Antibody-assisted Lectin Profiling for Glycan-related Biomarker Verification. Molecular & Cellular Proteomics. 8, 99-108 (2009).
- Hsu, K. -. L., Mahal, L. K. Sweet tasting chips: microarray-based analysis of glycans. Current Opinion in Chemical Biology. 13, 427-432 (2009).
- Borrebaeck, C. A. K., Wingren, C. High-throughput proteomics using antibody microarrays: an update. Expert Review of Molecular Diagnostics. 7, 673-686 (2007).
- Sanchez-Carbayo, M. Antibody array-based technologies for cancer protein profiling and functional proteomic analyses using serum and tissue specimens. Tumor Biology. 31, 103-112 (2010).
- Porter, A. A motif-based analysis of glycan array data to determine the specificities of glycan-binding proteins. Glycobiology. 20, 369-380 (2010).
- Maupin, K. A. Glycogene Expression Alterations Associated with Pancreatic Cancer Epithelial-Mesenchymal Transition in Complementary Model Systems. Plos One. 5, (2010).
- Sevecka, M., Wolf-Yadlin, A., MacBeath, G. Lysate Microarrays Enable High-throughput, Quantitative Investigations of Cellular Signaling. Molecular & Cellular Proteomics. 10, (2011).
- Wang, M. Novel fucosylated biomarkers for the early detection of hepatocellular carcinoma. Cancer Epidemiol. Biomarkers Prev. 18, 1914-1921 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados