Method Article
Todo el monte In Situ La hibridación de E8.5 a E11.5 embriones de ratón
En este artículo
Resumen
Este monte se In situ Protocolo de hibridación se analizan los pasos críticos que garantizan resultados reproducibles de alta calidad para estudios de expresión génica en E8.5-E11.5 embriones de ratón días de edad.
Resumen
Todo el montaje hibridación in situ es un enfoque muy informativo para la definición de patrones de expresión genética en los embriones. La hibridación in situ en los procedimientos son largos y técnicamente exigente con varios pasos importantes que en conjunto contribuyen a la calidad del resultado final. Este protocolo describe en detalle varios pasos clave de control de calidad para el etiquetado de la optimización de la sonda y el rendimiento. En general, el protocolo ofrece una descripción detallada de las medidas necesarias fundamental para obtener resultados de alta calidad reproducible. En primer lugar, se describe la generación de digoxigenina (DIG) marcado con sondas de ARN mediante transcripción in vitro de las plantillas de ADN generados por PCR. Se describen tres ensayos críticos de control de calidad para determinar la cantidad, la integridad y la actividad específica de la etiqueta DIG-sondas. Estos pasos son importantes para la generación de una sonda de la sensibilidad suficiente para detectar ARNm endógeno en un embrión de ratón entero. Además, se describen los métodos para la fijación y almacenamiento de E8.5-E11.5 embriones de ratón días de edad para la hibridación in situ. A continuación, se describen los métodos detallados para la digestión de proteinasa K limitado de los embriones rehidratado seguido de los detalles de las condiciones de hibridación, lavados post-hibridación y el tratamiento de RNasa para eliminar inespecíficos hibridación de la sonda. Un anticuerpo AP-conjugado se utiliza para visualizar la sonda marcada y revelar el patrón de expresión de la transcripción endógena. Los resultados representativos se muestran a partir de experiencias exitosas y las típicas experiencias óptimas.
Protocolo
1. Riboprobe generación a través de la transcripción in vitro
- La preparación de productos de PCR para las plantillas de transcripción in vitro.
- El diseño de cebadores de PCR con las secuencias de fagos promotor de la transcripción en sus extremos 5 '.
Nota: La secuencia promotora añadido a extremo 5 'del primer sentido capítulo de PCR se utiliza para la transcripción de la sonda de sentido, y la secuencia del promotor añadido a extremo 5' del primer antisentido PCR será utilizado para la síntesis de la sonda anti-sentido 1.3. No hemos detectado ninguna diferencia en la eficacia de la transcripción entre las plantillas que contienen sólo las secuencias del promotor núcleo vs plantillas que contienen el núcleo promotor, además secuencias adicionales 5 '. Este método ha sido utilizado con la T3, T7 y SP6 promotores del fago.
Secuencias que son altamente conservadas entre los miembros de la familia de genes o secuencias altamente repetitivas se debe evitar ya que pueden resultar en la no-hibridación y así aumentar la tinción de fondo. Sondas con alto contenido de GC se han limitado digoxigenina rUTP constitución y las secuencias de ADN plantilla con carreras de residuos T limitará la incorporación de la dig-UTP debido a la interferencia estérica entre las moléculas de digoxigenina. La longitud de la sonda puede variar de 300bp a 1kb. Pero siempre y cuando los criterios anteriores se cumplen, por lo general las sondas ya no tienen mayores actividades específicas. - La plantilla para la PCR puede ser un clon de plásmido, clon genómico o de ADN genómico. Por lo general compramos de larga duración clones EST (por ejemplo, ATCC o Biosystems abierto) para utilizar como plantillas de PCR. Amplificar el ADN de la plantilla utilizando los procedimientos estándar de PCR para producir un producto de PCR que contiene las secuencias del promotor. Para hacer las plantillas suficientes para apoyar la sonda varias reacciones de síntesis de la sonda que normalmente se establece un aumento del 8 x 50μl PCR. Las reacciones se reúnen para el siguiente paso. En general, una PCR pocas de gran volumen o reacciones más pequeñas (como las reacciones de 50μl usamos) son suficientes para generar la plantilla suficiente para varias reacciones de síntesis de la sonda.
- Para eliminar las proteínas contaminantes, especialmente las huellas de RNasa en la preparación de plásmido, asimilar cada 100μl de la reacción de PCR con 1μl de 20mg/ml proteinasa K a 55 ° C durante al menos 30 minutos. Todos los reactivos y demás elementos utilizados después de la digestión de proteinasa K debe ser libre de RNasa y dedicada específicamente para el trabajo de ARN.
- Durante la digestión de proteinasa K, ejecutar un ejemplo de la reacción de PCR en un gel para comprobar la integridad del producto de PCR. Usamos mini-geles de acrilamida para resolver los pequeños productos de PCR (menos de 600-700 pb) y geles de agarosa para resolver grandes productos de la PCR (> 600 a 700 pb) para el análisis de control de calidad. Si ves a varias bandas en el gel, le recomendamos que optimice la reacción de PCR para que usted obtenga un solo producto de PCR del tamaño correcto.
- Bien extraer la proteinasa K digestión reacción de PCR con un volumen igual de un fenol / cloroformo (1:1) mezcla, seguido por una extracción con un volumen igual de cloroformo. Mezcla en cada paso por el tubo de vórtice por lo menos 30 segundos. Estos pasos se deben realizar en una campana química.
- Precipitar el producto de PCR purificado mediante la adición de 0,1 volúmenes de acetato de sodio 3M y 2 volúmenes de etanol al 100%. Deja de -20 ° C durante al menos 30 minutos.
- Girar durante 5 minutos a 13.000 rpm en una microcentrífuga, eliminar el sobrenadante y lavar con etanol al 70%. Dejar que el precipitado de ADN se seque por completo.
- Resuspender el ADN en un volumen adecuado (por ejemplo, 50μl) de 1xTE. Medir la concentración de ADN utilizando un fluorómetro.
- Determinar la secuencia de nucleótidos de la preparación de cada plantilla de PCR utilizando los cebadores que corresponden a las secuencias de fagos o promotor con una secuencia interna dentro de la sonda. Este es un paso crítico de control de calidad que asegura que la plantilla de la sonda es la secuencia correcta.
- El ADN está listo para servir como plantilla para la transcripción in vitro. Guarde la plantilla de la DNA a 4 ° C.
- El diseño de cebadores de PCR con las secuencias de fagos promotor de la transcripción en sus extremos 5 '.
- transcripción in vitro utilizando el producto de la PCR como una plantilla.
- Establecer la reacción de un ARN de transcripción en un volumen final de 50μl. La reacción de transcripción incluye 500 - 1000 ng de ADN, la transcripción 5μl de Buffer 10X (con TDT 100 mm), 10μl de 2,5 mm dig-NTP mezcla, 3μl (50 ~ 90 unidades) de la ARN polimerasa, 1μl alfa-32 P CTP (hasta a 6 meses de edad) y el resto del volumen está formado por la adición de agua dietilpirocarbonato tratados. El 2,5 dig-NTP mezcla se hace típicamente como un archivo 40μl de trabajo que contiene 10 mM CTP 10μl, 10μl 10 mM GTP, 10μl 10 mM ATP, UTP 6.5μl 10 mM, 10 mM 3.5μl digoxigenina-11 UTP. En el montaje de la reacción de transcripción, asegúrese de que todos los componentes de la reacción (a excepción de la enzima) se calientan a la temperatura ambiente. Mezcla el ADN y el agua primero, y luego añadir el tampón de reacción, la mezcla y luego añadir los otros componentesde lo contrario la espermidina en el buffer de la transcripción se precipita el ADN. Incubar durante 2 horas a la temperatura recomendada para la ARN polimerasa utilizada.
Nota: la α P-32 se añade a la reacción que le permite determinar la proporción de la piscina a partir de nucleótidos que se incorpora en la sonda de ARN. Esta es una medida importante de la eficacia de la reacción. Todos los siguientes pasos seguir los procedimientos para el manejo de 32 p.
Un método alternativo para medir la cantidad de sonda de ARN sintetizado es el uso de un espectrofotómetro de pequeño volumen. Esto evita el uso de 32 P etiquetado (ver notas en el paso 1.3.1) - Durante los últimos minutos de incubación, preparar la columna paseo rápido (Roche) de acuerdo con las instrucciones del fabricante.
- Después de la incubación, añadir 1μl de RNasa libre de DNasa I y se incuba a 37 ° C durante 10 min.
- Diluir a 100μl con 50μl de tampón de reacción de dilución (20 mM Tris pH 7,5, 1% SDS, 20 mM EDTA, 100 mM NaCl (RNasa libre, hacer una reserva 50 ml y almacenar a temperatura ambiente)). Tome 1μl (por lo general en 4μl de 1x TE) para recuento de centelleo de las cuentas totales de partida para el análisis y gel.
- Aplicar el resto de la reacción en el centro del lecho de la columna y giran a 1100 X g durante 4 minutos en una mesa clínica centrífuga superior. Después de la vuelta de su sonda de ARN se encuentra en el tubo de recogida.
- Agregar 2 volúmenes de etanol al 100% en la reacción de eluido. Mezclar bien y mantener en hielo durante 5 minutos (o -20 ° C o 30 minutos).
- Girar el tubo en una microcentrífuga a máxima rpm durante 5 minutos para que sedimenten las sonda de ARN.
- Eliminar completamente el sobrenadante con una pipeta y dejar que el pellet de aire seco. No permita que el sedimento seque en exceso, ya que será muy difícil que se disuelva.
- Disolver la sonda de ARN con 50 l - 100 l 1xTE o DEPC-H 2 O. Tomar una muestra de 1 l para la determinación de la incorporación por ciento y para el análisis en un gel de acrilamida desnaturalizante. Ajustar la concentración de la sonda a 100 ng / l de acuerdo con el rendimiento estimado.
- Las sondas que han pasado todos los controles de calidad de tres puede ser entonces almacenado en -20 ° C durante 6 a 12 meses. Por lo general, las acciones de escape de la sonda dentro de 12 meses. Es muy probable que las sondas se pueden almacenar por períodos muy extendidos a-20C.
- Establecer la reacción de un ARN de transcripción en un volumen final de 50μl. La reacción de transcripción incluye 500 - 1000 ng de ADN, la transcripción 5μl de Buffer 10X (con TDT 100 mm), 10μl de 2,5 mm dig-NTP mezcla, 3μl (50 ~ 90 unidades) de la ARN polimerasa, 1μl alfa-32 P CTP (hasta a 6 meses de edad) y el resto del volumen está formado por la adición de agua dietilpirocarbonato tratados. El 2,5 dig-NTP mezcla se hace típicamente como un archivo 40μl de trabajo que contiene 10 mM CTP 10μl, 10μl 10 mM GTP, 10μl 10 mM ATP, UTP 6.5μl 10 mM, 10 mM 3.5μl digoxigenina-11 UTP. En el montaje de la reacción de transcripción, asegúrese de que todos los componentes de la reacción (a excepción de la enzima) se calientan a la temperatura ambiente. Mezcla el ADN y el agua primero, y luego añadir el tampón de reacción, la mezcla y luego añadir los otros componentesde lo contrario la espermidina en el buffer de la transcripción se precipita el ADN. Incubar durante 2 horas a la temperatura recomendada para la ARN polimerasa utilizada.
- Evaluación de la calidad de la riboprobe - rendimiento de la sonda de medición.
- Para estimar el rendimiento de la sonda, divida el recuento recuperado después de la columna de giro de la cuenta en la reacción ante la columna de giro (medida con las muestras tomadas en el protocolo de síntesis de la sonda). Para esta reacción, el 100% de incorporación = 33 mg. Una reacción de éxito por lo general da un rendimiento del 15-50%. Sondas con menos del 15% de incorporación (<5 mg de rendimiento) no se debe utilizar.
Nota: Un método alternativo para medir el rendimiento de la sonda es el uso de un espectrofotómetro de pequeño volumen o fluorómetro para medir directamente la cantidad de ARN presente después de la cromatografía de columna de giro. Este enfoque alternativo evita el uso de 32 P etiquetado rastro. Hemos medido la concentración de riboprobe usando un espectrofotómetro de microplacas BioTek época. Una comparación de los valores obtenidos del espectrofotómetro de las estimaciones de la masa riboprobe de los 32 la incorporación P mostró que los dos métodos dan resultados comparables con un volumen similar pequeños (2 l) de muestra de la preparación de la sonda final.
Casi siempre un rendimiento muy bajo o no se debe a la contaminación procedente de la RNasa preparación de plásmidos utilizados como plantilla para la PCR. Asegúrese de tratar el ADN del plásmido y el producto de PCR con proteinasa K como se describe en el paso 1.1.3.
- Para estimar el rendimiento de la sonda, divida el recuento recuperado después de la columna de giro de la cuenta en la reacción ante la columna de giro (medida con las muestras tomadas en el protocolo de síntesis de la sonda). Para esta reacción, el 100% de incorporación = 33 mg. Una reacción de éxito por lo general da un rendimiento del 15-50%. Sondas con menos del 15% de incorporación (<5 mg de rendimiento) no se debe utilizar.
- Evaluación de la calidad de la riboprobe - medición de la actividad específica.
- Para medir el grado de digoxigenina - incorporación UTP realizar una prueba de la mancha. Esta es una prueba de control de calidad crucial.
Ajustar la concentración de la sonda a 100 ng / l. Spot 1 l de diluciones seriadas (10 -2 a 10 -5) de la sonda en un diámetro de 82 mm de Hybond-N + (GE Healthcare) o el filtro de otros equivalentes de nylon. Incluye una muestra de ADN no marcado como control negativo. Reticular el filtro húmedo de inmediato en un agente de reticulación UV a 125mJoules o de acuerdo a las instrucciones del fabricante para el filtro de nylon que está utilizando.
Todos los pasos siguientes (1.4.2 - 1.4.6) se llevan a cabo en una placa de Petri en una plataforma oscilante a temperatura ambiente. Usted no tiene que preocuparse de RNasa después de detectar las diluciones de la sonda en el filtro - Bloquear el filtro durante 30 minutos a temperatura ambiente en 10 ml de 1% del reactivo de bloqueo (Roche) en 1X TN (10X tampón TN = 1M Tris pH 7,5, 1,5 M NaCl)
- Lavado 1 X 15 min en 10 ml de amortiguador 1X TN.
- Incubar con el fragmento Fab contra digoxigenina a la dilución 1 / 5000 en tampón 1X TN durante 30 minutos.
- Lavado de 2 x 15 min en 10 ml de amortiguador 1X TN.
- La reacción de color se realiza con el sustrato BM púrpura (necesitan alrededor de 5 ml en el plato). El color debe ser visible en el lugar de la dilución 10 -4 en 30 minutos. En ese momento, detener la reacción de color mediante el lavado dos veces durante 5 minutos cada uno con 5 veces TE. Si la señal no es visible en el lugar que corresponde a la dilución 10 -4 continuación, la sonda debe ser desechada.
Nota: En nuestra experiencia, la actividad específica adecuada sólo se encuentra con sondas cortas. El aumento del tamaño de la plantilla de la sonda (hasta 1kb), si bien respetando los criterios de diseño especificados en este protocolo debería aumentar la actividad específica de la sonda. De baja actividad específica conduce a niveles bajos o no detectables de la señal.
- Para medir el grado de digoxigenina - incorporación UTP realizar una prueba de la mancha. Esta es una prueba de control de calidad crucial.
- Comprobar la integridad de la sonda por electroforesis en un gel de acrilamida al 5% de desnaturalización.
Esta es otra prueba de control de calidad importante. Este protocolo supone que la sonda se ha marcado con 32 P en la reacción de síntesis (ver paso 1.2.1). Usamos desnaturalización geles de acrilamida para proporcionar una resolución muy alta, lo que nos permite detectar fácilmente las sondas degradados o incompleta. Normalmente, un 5% de acrilamida desnaturalizantes minigel (7,5 g de urea, 1.9ml 40% de acrilamida, 1.9ml 2% bis-acrilamida (o utilizar un acrilamida 20:01: acrilamida bis-soluciones), 1,5 ml de gel buffer 10X MOPS (0,2 M morpholinopropanesulfonic ácido, pH 7,0, acetato de sodio 50 mM EDTA 5 mM) y H 2 O hasta un volumen final de 15 ml) funciona muy bien para la resolución de las sondas en el tamaño de los intervalos empleados en este protocolo.
Nota: Como alternativa, TBE-urea geles prefabricados se pueden comprar a diferentes proveedores. Siga las instrucciones del fabricante para el funcionamiento de geles prefabricados.- Mezclar la muestra con un volumen igual de tampón de carga de gel (Ambion) y mezclar bien.
- Calor a 95 ° C durante 5 minutos para desnaturalizar cualquier estructura secundaria.
- Inmediatamente enfriar en hielo antes de cargar en el gel para prevenir la re-recocido.
- Ejecute el antes y después de las muestras de columna junto a 200V hasta que el colorante azul se ejecuta al final del gel. El gel se ejecuta en gel 1X buffer MOPS.
- Envuelva el gel en una envoltura de plástico y lo exponga a la película de rayos X o la pantalla de fósforo de imágenes para detectar el ARN radiomarcado. Si 32 P etiquetado no se utiliza se puede manchar el gel con un colorante fluorescente convencional para detectar el ARN
- Una síntesis de la sonda con éxito dará lugar a una sonda de ARN que migra como una banda fuerte muy cerca de la parte superior del gel.
2. Recogida y almacenamiento de embriones de ratón
- Embriones de ratón se deben recoger en el hielo frío PBST (PBS + 0,1% Tween 20, (dietilpirocarbonato (DEPC) tratados)) y se mantuvieron en hielo durante la disección.
- Los embriones se procesan en 4 viales tornillo ml de vidrio tapado. Embriones múltiples se puede fijar en un vial. Como muchos de 10 a 15 E9.5 o 5 embriones E10.5 se puede fijar en un solo vial. Debido al tamaño creciente de los embriones, embriones E11.5 deben hemiseccionada con una hoja de afeitar antes de la fijación de la ayuda en el acceso de la sonda durante la hibridación. Hasta 3 hemiseccionada embriones E11.5 se puede colocar en un solo vial.
- Para maximizar la efectividad de los pasos de este protocolo y para reducir el daño a los embriones, la fijación del embrión y todos los lavados se llevan a cabo en los viales con las soluciones de lleno hasta el nivel inferior del cuello vial de forma que sólo una pequeña burbuja de aire sigue siendo, a menos que especificado. Para todas las etapas de lavado viales se establecen en su lado en una plataforma oscilante.
- Fix durante 6 horas a la noche a 4 ° C en una mesa oscilante con 4% de paraformaldehído (PFA) en PBST. Viales se colocan horizontalmente y se mecía en una plataforma oscilante a 4 ° C.
- Después de la fijación, los embriones se lavaron dos veces durante 5 minutos cada uno en PBST en hielo y luego paso a paso deshidratados a través de una serie de metanol / PBST (25% de metanol en PBST, 50% de metanol en PBST y el 75% de metanol en PBST) en metanol al 100% mediante la sustitución de soluciones en el frasco de vidrio con pipetas Pasteur. Los embriones pueden ser almacenados a 20 º C en el 100% de metanol durante 8 meses e incluso más.
3. La hibridación de la sonda marcada con digoxigenina de embriones de ratón todo
- Corazones de punción y jefes de E10.5 embriones y mayores con un cuchillo de microdisección mientras los embriones siguen siendo en metanol (si esto no se hizo durante la disección). Esta sencilla medida permite a las soluciones de lavado para entrar en las vesículas cerebrales y las cámaras del corazón reduciendo enormemente la tinción de fondo.
- Rehidratar los embriones por lavados sucesivos en una serie de metanol / PBST (75% de metanol en PBST, 50% de metanol en PBST y luego 25% de metanol en PBST) durante 5-10 minutos en cada concentración de metanol. Lavar dos veces durante 5 minutos cada lavado en el 100% PBST.
- Incubar en 04:01 PBST: 30% H 2 O 2durante 1 hora en hielo. Luego lavar con 3 cambios de 5 minutos cada uno en 1X PBST.
- Eliminar el lavado PBST pasado y reemplazarlo con 1 ml 10 mg / ml de proteinasa K en PBST. En el lugar la digestión de proteinasa K los tubos verticalmente en un bastidor en un baño de agua a 25 º C.
Nota: Las soluciones de proteinasa K perder actividad con el tiempo debido a la auto-digestión. Para asegurar la máxima actividad y constante de la solución de proteinasa K debe ser fresca, inmediatamente antes de cada uso. Para cada uso que una pequeña cantidad de una acción 1mg/ml luego diluido. El tiempo de incubación debe ser determinado para cada lote de proteinasa K en polvo y para cada edad del embrión. Por ejemplo, los embriones E9.5 un buen momento es por lo general 10 a 15 minutos a 25 ° C, mientras que para E10.5 es de 20-30 minutos a 25 ° C. El tiempo de incubación con proteinasa K también debe medirse con precisión durante los experimentos para permitir comparaciones válidas entre los viales y entre los experimentos. La temperatura debe ser cuidadosamente mantenida durante la digestión para aumentar la reproducibilidad. Las diferencias tan pequeñas como 1 ° C puede alterar la cantidad de la digestión entre los experimentos. Se recomienda encarecidamente que las digestiones proteinasa K se hace en una incubadora o un baño de agua para el control preciso de la temperatura. Este paso es clave para permitir a la sonda para penetrar en el tejido lo que genera una señal fuerte. Sin embargo, durante la digestión puede dañar los embriones y poco a poco se va a desintegrar en el transcurso de los pasos restantes. - Detener la digestión de proteinasa K por lavado dos veces por 5 minutos cada lavado a temperatura ambiente con recién hecho 2 mg / ml de glicina en PBST. A continuación, lavar dos veces durante 5 minutos cada uno en PBST.
- Fijar los embriones digerido por 20 minutos a temperatura ambiente en un 4% PFA / PBST, glutaraldehído 0,2% (Polysciences). No sobre-o underfix. Lavar 3 veces durante 5 minutos cada uno en PBST.
- En este punto, los embriones deben ser divididos en grupos para la hibridación. Retire la PBST. Añadir 1 ml de tampón de hibridación (50% formamida ultrapura (Invitrogen), 5x SSC, pH 5, 1% SDS, 50 mg / ml de heparina (Acros), 50 mg / ml de ARN de torula (Sigma)) que se ha calentado a 65 ° C (sin sonda). Permita que los embriones para resolver, a continuación, eliminar todos los buffer hybrization y reemplazar con 1 ml de tampón de hibridación fresco calentado sin sonda.
- Prehybridize durante 1 hora a 65 ° C en un baño de agua agitando o en un horno en una plataforma de balanceo (por ejemplo, el Batido Boekle 'n' Bake Oven, ver Tabla 1). Si se incuban los frascos en un baño de agua asegúrese de agua llega hasta, pero no más, las tapas de los frascos. La temperatura de hibridación se puede aumentar hasta 70 ° C. Las temperaturas de hibridación por encima de 65 ° C no afectan a la intensidad de señal o de fondo con la mayoría de las sondas que hemos probado. Los embriones se vuelven translúcidas, pegajosa, y frágil en los tampones de formamida (por ejemplo, tampón de hibridación) tener cuidado al manejarlos.
- Vuelva a colocar el tampón de prehibridación con tampón de hibridación que contiene 0,4 ml de la sonda a una concentración de 0.25 a 1 mg / ml. Use 0,5 mg / ml de la sonda para los embriones hasta aproximadamente E8.5. Para los mayores de embriones, las sondas se debe ajustar 1 a 0,1 mg / ml para determinar la concentración óptima para una buena señal con bajo fondo (por lo general 0,25-0,5 mg / ml o menos). Tenga en cuenta que un mayor volumen de hibridación puede ser necesario para los embriones más grandes. Hibridación noche a la mañana a 65 ° C.
- Si los embriones han sido más tratados con proteinasa K. aparecerán muy transparentes. También pueden pegarse a las paredes del vial, o desmoronarse. Los embriones que aparecen de esta manera debe ser desechado en este punto en el protocolo. Su procesamiento posterior no se traducirá en datos interpretables.
- Vuelva a colocar el tampón de hibridación con la solución caliente I (50% formamida, 5 x SSC pH 5, 1% SDS) a 70 ° C. Lavar dos veces durante 30 minutos cada lavado de embriones E8.5, tres veces durante 30 minutos por lavado de E9.5 y mayores.
- Lavar una vez con el pre-calentado solución al 50% I: 50% Solución II (0,5 M NaCl, 10 mM Tris-HCl pH 7,5, el 0,1% de Tween 20) a 70 ° C durante 10 minutos.
- Lavar tres veces durante 5 minutos por lavado con la solución II a temperatura ambiente.
- Vuelva a colocar con la solución buffer II contiene RNasa A 100 mg / ml, RNasa T1 100 unidades / ml. Incubar en una mecedora en la habitación caliente a 37 º C durante 30 minutos dos veces por lavado. El lavado de RNasa es esencial para reducir el fondo el resultado de las sondas de hibridación no específica.
- De lavado en solución III (50% formamida, 2x SSC pH 5) a 65 ° C durante 30 minutos dos veces por cada lavado de E8.5, 3 veces durante 30 minutos por lavado de E9.5 y mayores.
- Lavar 3 veces durante 5 minutos por lavado con 1X TBST (100 ml de 10X TBS contiene 8 gramos de NaCl, KCl 0,2 g, 12.5ml 2M Tris-HCl pH 7,6 en el agua. Para 1X TBST diluir el 10X TBS en un volumen adecuado de agua y añadir Tween 20 al 0,1% de concentración final)
- Salvo que se especifique, todos los lavados se llevan a cabo en los viales con las soluciones de lleno a la planta baja de lavial cuello. Para todas las etapas de lavado, los viales se establecen a su lado en una plataforma oscilante.
4. La detección de anticuerpos de la sonda marcada con digoxigenina
- Los embriones son pre-bloqueada en 0,5 ml de 1X TBST + calor 10% de suero de ovinos tratados. Luego de roca vertical de los viales a temperatura ambiente (~ 20 ° C) durante por lo menos 2,5 horas.
- Reemplace la solución de bloqueo con nuevas 1X TBST + 10% de suero que contiene un 1:2000 - 1:5000 dilución de conjugado con fosfatasa alcalina fragmentos Fab ovejas anti-digoxigenina (resta mediante la incubación con polvo de embriones acetona, ver más abajo). Mayor uso de las diluciones de los embriones E9.5 y mayores, de hasta 1:5000 para minimizar el fondo. Incubar en posición vertical del eje de balancín a 4 ° C durante la noche.
Nota: Hemos encontrado que la incubación de los fragmentos Fab anti-digoxigenina con un polvo de acetona embrión reduce los niveles de tinción de fondo en este protocolo. Para preparar el polvo de acetona embrión homogeneizar agrupados E12.5-14.5 embriones de ratón en un volumen mínimo de PBS. Agregar 4 volúmenes de acetona fría de hielo mezclar, e incubar en hielo durante 30 minutos. Aspirar el sobrenadante al girar a 10.000 xg durante 10 minutos. Lavar el precipitado con acetona fría y girar de nuevo. Difundir el pellet a cabo y se muelen en un polvo en una hoja de papel de filtro y dejar secar al aire. El polvo puede ser almacenado en un tubo hermético a 4 ° C por año.
Para la deducción de anticuerpos, los anticuerpos se pre-absorbida por el polvo de acetona de embriones para reducir la unión no específica durante o antes de pre-bloqueo. Incubar anticuerpos en 1 / 100 con una pequeña cantidad de polvo de embriones (la cantidad no es crítica) en 1xTBST/10% de suero durante al menos 1 hora a 4 ° C con mecedora. Elimine el polvo girando en una microcentrífuga durante 10 minutos a 4 ° C. Anticuerpos resta se puede almacenar a 4 ° C durante al menos 6 meses. - Lavar tres veces 5 minutos cada uno con TBST 1X, luego 5-6 veces durante 1 hora cada una a temperatura ambiente para eliminar el exceso de anticuerpo. Si se prefiere, hacer un lavado prolongado durante la noche a 4 ° C para reducir el fondo. El lavado de la noche puede reducir drásticamente los niveles de fondo lo que aumenta la relación señal-ruido.
- Lavar dos veces durante 20 minutos por lavado con tampón recién hecho fosfatasa alcalina (100 mM Tris, pH 9,5, 50 mM MgCl 2, 100 mM NaCl, 0,1% de Tween 20. Añadir levamisol 0.5mg/ml, un inhibidor endógeno de AP, para E9.5 y mayores embriones).
- Vuelva a colocar el último lavado con BM Purple sustrato AP (Roche) precalentado a temperatura ambiente.
- Deje que la reacción de color de incubar a temperatura ambiente, y esté pendiente de la señal periódica a través de un microscopio de disección. Para las reacciones de colores ampliada (varias horas o toda la noche) los viales deben ser protegidos de la luz. Señal de ARNm abundante debe ser visible dentro de los 15 minutos. Las reacciones se debe interrumpir cuando esté satisfecho con la señal, o cuando el fondo comienza a ser un problema. Si la solución en sí misma empieza a ponerse oscura puede ampliar la reacción de color mediante la sustitución de la solución de sustrato.
- Detenga la reacción de lavar dos veces durante 5 minutos por lavado 1X en PBST/5mM EDTA.
- Traslado al 4% de paraformaldehído / PBST para volver a fijar, de varias horas a la noche. O los embriones pueden ser almacenados en un 4% PBST paraformaldehyde/1X durante años o puede ser procesado inmediatamente por el corte. Esta etapa de fijación final es crucial para la preservación a largo plazo del patrón de tinción.
5. Parafina inclusión y corte de embriones teñidos
- Antes de que los embriones se fija después de la reacción de color (paso 4.8) imágenes de todo el montaje de embriones teñidos se toman cuando el nivel de coloración es en la intensidad deseada. Después de documentar los patrones de expresión en los embriones se incuban toda la noche a la mañana sustrato púrpura BM a 24 horas a temperatura ambiente hasta que el embrión se convierte en toda azul oscuro. Este paso es asegurarse de que la mancha sea lo suficientemente oscuro para aparecer en las secciones de tejido. Tenga en cuenta que el color azul del embrión se debe a la deposición de una capa muy fina de pigmento en toda la superficie del embrión. Esta tinción de fondo no detectable en el tejido de interés después de la sección.
- Lavado de los embriones teñidos con PBS tres veces para eliminar el exceso de sustrato precipitados y fijar la noche en PFA al 4% a 4 ° C.
- Lavar con PBS tres veces, y luego los embriones se deshidratan en metanol al 100% (como se describe en 2.4).
- Reemplazar el metanol pasado con xileno. Lave en xileno 2 a 3 veces durante 2 minutos cada lavado hasta que los embriones se aclarará. No más lavado en xileno, ya que hará que el tejido muy frágil después de que se incorpora lo que es muy difícil de recuperar secciones intactas. Controlar visualmente cada incubación xileno para hacer embriones que son sólo para el punto de ser claras y ser muy cuidadosos para no permitir la incubación xileno extenderse más allá de este punto.
- Transferencia de embriones (E10.5 y mayores) En la biopsia del Seguro-Tek cassettes (Fisherbrand), y se incuba toda la cinta de cera (Fisherbrand) durante 15 ~ 30 min a 65 ° C. Cambio en la cera fresca durante 15 ~ 30 minutos y luego cambiar de nuevo. Pequeños embriones / troncos de los tejidos requieren menor tiempo de incubación de la cera. E9.5 embriones se pueden colocar en los moldes de tejido incorporación de todos los cambios de cera. En estos casos se puede quitar la cera del molde en lugar de transferir los embriones.
- Después de tres cambios de cera, la transferencia de embriones en los moldes de tejido incrustación (Polysciences) e integrar con cera fresca. Cuidadosamente la posición de los embriones para el plano deseado de la sección. Deje que la cera se enfríe hasta que se solidificó.
- Sección de la cera de los bloques en 8 ~ 14μm rebanadas con microtomo estándar (por ejemplo, Leica RM2155). Recoger las secciones en portaobjetos de microscopio (Fisherbrand).
- Deje que los portaobjetos plano y seco en un slidewarmer. Las diapositivas se pueden almacenar a 4 ° C durante meses.
- Secciones secas son desparafinado por dos 5 lavados min xileno y rehidratada en agua por serie de metanol / agua limpia (100% de metanol 2 minutos, 100% de metanol 2 min, 90% de metanol / agua 2 minutos, el 70% de metanol / agua 2 minutos, el agua desionizada 5 min).
- Tinción de las secciones con la solución de tinción nuclear rojo rápido (Sigma) durante 1 minuto. Para generar la solución rápida nuclear tinción con rojo, diluir una acción concentrada de la energía nuclear rojo rápido (0,1% de rojo nuclear sólido de sulfato de aluminio al 5% en agua, se disuelven con el calor y el filtro de papel de filtrar Whatman) 1:5 en una solución acuosa de 5 % de sulfato de aluminio. Después de la tinción este lavado con agua corriente hasta que el agua se vuelve transparente. El rojo rápido nuclear actúa como contratinción y revela la estructura del tejido en general en las secciones. Su color contrasta con la coloración púrpura-azul que marca la localización de la sonda de ARN. Nuclear rojo rápido es una saturación de la mancha y la intensidad de la tinción es controlada por la concentración de la solución de tinción. Si la intensidad de la tinción con rojo nuclear rápido no es suficiente cuando se utiliza esta solución de tinción puede repetir este paso con una mayor concentración de solución de rojo nuclear rápido.
- Preparar los portaobjetos para cubreobjetos de montaje de lavados en cada una de las soluciones en las siguientes series: 90% de metanol / agua, seguido de 2 lavados en el 100% de metanol seguido de dos lavados en xileno. Incubar el portaobjetos durante 2 minutos en cada uno de los lavados.
- Montar las diapositivas con 60 Cytoseal medio de montaje (Richard Allan-Ciencia). Tenga en cuenta que los medios acuosos de montaje se disolverá el rojo rápido tinción nuclear.
Nota: también hemos utilizado una resina de plástico incrustación (Immuno-cama, Polysciences Inc) para generar secciones de embriones teñidos con excelentes resultados 4.
6. Los resultados representativos:
La Figura 1 ilustra los resultados representativos obtenidos con este protocolo. Figura 1A muestra el patrón de expresión de Gata3 en embriones de ratón E10.5. Este panel muestra un buen resultado con una elevada relación señal de fondo. Figura 1 C, en cambio, no muestra una hibridación in situ para Gata3 ARNm que se utiliza una sonda de ARN parcialmente degradado. Una sonda de baja actividad específica se traducirá en resultados similares con la señal baja a cambio de fondo. Una comparación de los grupos A y C ilustra la importancia de llevar a cabo una cuidadosa evaluación de control de calidad de calidad de la sonda para asegurar resultados de alta calidad. El resultado obtenido con la sonda Foxg1 (fig. 1B) también muestra un buen resultado con la tinción específica en el telencéfalo con el fondo de baja en otras partes del cerebro. El cerebro y el corazón son los sitios comunes de tinción de fondo causado por la captura de la sonda. Al perforar el cerebro y el corazón con unas pinzas permite lavar las soluciones en el embrión y reduce al mínimo la tinción de fondo (ver paso 3.1). Figura 1D muestra el típico fondo azul claro encontrado cuando el cerebro no está pinchada. Esto muestra un resultado óptimo obtenido con una sonda Pax1. Pax1 no se expresa en cualquier parte del cerebro y de todas las manchas se ve en el cerebro de este embrión se debe a que no específica de fondo.
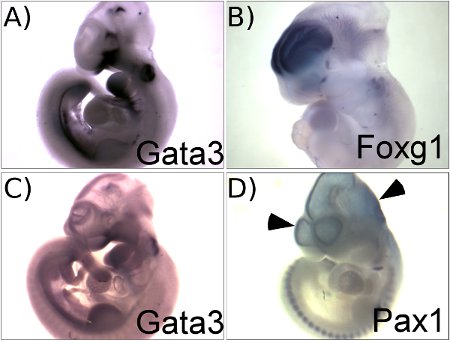
Figura 1. Los resultados representativos que muestra ejemplos de éxito (A, B) y de óptimo (C, D) los resultados. A. embrión E10.5 hibridado con la sonda Gata3. B. embrión E11.5 hibridado con la sonda Foxg1. C. E10. 5 embrión híbrido con Gata3 sonda que está parcialmente degradado, muestra una señal muy débil, pero de fondo de alta a través de todo el embrión. D. embrión E10.5 hibridado con la sonda Pax1 sin perforar la cabeza, mostrando la tinción de fondo en los ventrículos (puntas de flecha).
Discusión
Los métodos descritos en este protocolo ha sido adaptado de una serie de fuentes diferentes y optimizado para montaje en toda E8.5-E11.5 embriones día de vida del ratón. Los métodos para montar toda la hibridación in situ de embriones de los vertebrados aparecieron por primera vez a principios de 1990 2,5-12. Este protocolo fue adaptado sobre todo de los métodos desarrollados para embriones de Xenopus 7,8 y 2,11 ratón. En nuestro protocolo de una gran cantidad de se hace hincapié en la evaluación de la calidad de cuidado de la sonda. La atención cuidadosa a la generación de una alta calidad y alta actividad específica de la sonda de ARN según lo determinado por los primeros pasos de este protocolo, aumentará enormemente la calidad de los datos y ahorrar una cantidad considerable de tiempo y esfuerzo en el largo plazo. El protocolo también incluye el uso de plantillas de PCR de ADN generados por la transcripción de la RNA polimerasa del fago. Este enfoque es rápido y muy escalable. Se puede activar la generación de un gran número de sondas de ARN de gran escala en las pantallas de hibridación in situ 13-15.
Varios pasos en este protocolo debe ser considerada cuando el fondo es alto, pero la señal es baja. Una consideración es la de la sonda. Nunca hemos tenido de fondo de alta con sondas de ARN que cumplieron con los criterios de diseño especificados en este protocolo y que habían pasado las tres pruebas de control de calidad (actividad rendimiento, específico y longitud de la sonda). Otro factor que puede afectar los niveles de fondo es la capacidad de la sonda para penetrar en los tejidos embrionarios. Se debe tener cuidado durante la disección para eliminar completamente las membranas extraembrionarias que cubren el embrión. Además, el paso de la digestión de proteinasa K es absolutamente esencial para los embriones de más de E9.5. K ya veces digestión de proteinasa dar más bajos de fondo y una señal más fuerte, sin embargo, los tiempos de digestión excesiva puede conducir a daño tisular mayor y puede resultar en la desintegración del embrión durante el procedimiento. Optimización del tiempo de digestión para cada lote de proteinasa K es necesaria para obtener los mejores resultados. Otro paso que puede ser optimizado para obtener la señal de alto a las relaciones de fondo es la incubación de RNasa (paso 3,14). Nuestro protocolo utiliza una mezcla de RNasa A y T1 RNasa. Ambas enzimas digieren ARN monocatenario pero cada enzima tiene una especificidad de base diferente. La combinación de las dos enzimas en la digestión de los resultados de extensas ARN monocatenario de oligonucleótidos pequeños. Esto permite que la mayor parte de la sonda no hibridada específicamente para ser eliminado por los lavados post-hibridación que resulta en una gran disminución en la tinción de fondo. El uso de RNasa A o T1 resultados solo en el fondo mayor y debe ser evitado. También hemos encontrado que la calidad de la reacción de color final se mejora mediante el uso de nuevas buffer AP, hechas inmediatamente antes de su uso.
El protocolo puede ser adaptado para mayores embriones o tejidos adultos con tratamiento adicional. Por ejemplo, hemos utilizado este protocolo para realizar hibridaciones in situ en la gruesa (100 micras) secciones vibratome de cerebro de ratón adulto (datos no mostrados). También hemos utilizado este protocolo para estudiar la expresión génica en embriones más viejos. En algunos casos, han utilizado este protocolo para visualizar la expresión de genes en la superficie de E13.5 E14.5 embriones y, como GAD1 expresión en los folículos de las vibrisas 4. En otros casos se ha utilizado una hoja de afeitar o un bisturí para cortar E12.5-E14.5 embriones para facilitar el acceso de la sonda a tejidos específicos en el embrión. Fragmentos de embrión preparado de esta manera puede ser procesada usando este protocolo, con algunas modificaciones. En estos casos, la duración de todos los tratamientos y los pasos de lavado debe ser ajustada de acuerdo al tamaño del tejido y optimizado empíricamente.
El protocolo también incluye los métodos de corte post-hibridación y análisis de patrones de expresión. En combinación con la visualización de montar todo de la expresión génica este paso adicional puede agregar una gran cantidad de información adicional sobre el patrón de expresión de un gen. Hemos incorporado los embriones después de someterse a la hibridación in situ en parafina, así como en resina de plástico 4,16. Secciones de embriones teñidos se puede utilizar para generar una reconstrucción tridimensional del patrón de expresión revelada por todo el monte en el procedimiento de hibridación in situ. Hemos utilizado el software de reconstrucción de software SURFdriver para este propósito.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el NIH subvenciones R21MH082360 (BGC) y R01HD056315 (MNR), así como la Universidad de Georgia.
Materiales
| Name | Company | Catalog Number | Comments | |
| Nombre | Tipo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|---|
| Digoxigenina-11-uridina-5'-trifosfato | Reactivo | Roche | 11209256910 | |
| Ribonucleósido Set trifosfato | Reactivo | Roche | 11277057001 | |
| Columnas Un paseo rápido por la purificación de ARN radiomarcado | Suministro | Roche | 11274015001 | |
| T7 RNA polimerasa | Reactivo | Roche | 10881767001 | |
| SP6 RNA polimerasa | Reactivo | Roche | 10810274001 | |
| T3 ARN polimerasa | Reactivo | Roche | 11031163001 | |
| CTP, [α-32P] - 800Ci/mmol 10mCi/ml, 250 Ci | Reactivo | Perkin Elmer | BLU008X250UC | |
| DNasa I recombinante, libre de RNasa | Reactivo | Roche | 4716728001 | |
| Urea, cristales incoloros a blancos o polvo cristalino | Reactivo | Pescador | BP169-500 | |
| Gel de tampón de carga | Reactivo | Ambion | AM8547 | |
| Hybond-N +, Amersham | Suministro | GE Healthcare | RPN82B | |
| UV Stratalinker 2400 | Equipo | Stratagene | ||
| Dietil pirocarbonato | Reactivo | Sigma | D5758-100ML | |
| Heparina sódica | Reactivo | Acros | 41121-0010 | |
| peróxido de hidrógeno al 30% en agua | Reactivo | Fisher Scientific | BP2633-500 | |
| Glutaraldehído, el 8% de grado EM | Reactivo | Polysciences | 0 / 710 | Utilizar con precaución de acuerdo con las instrucciones del fabricante de |
| El bloqueo de los reactivos | Reactivo | Roche | 11096176001 | Convertirlo en un 5% de acciones y almacenar a -20 ° C |
| Proteinasa K | Reactivo | Roche | 3115852001 | |
| RNasa A | Reactivo | Roche | 10109142001 | Hacer como 10 mg / ml y almacenar a -20 ° C. |
| RNasa T1 | Reactivo | Roche | 10109193001 | |
| Ultrapura formamida | Reactivo | Invitrogen | 15515-026 | |
| Levamisol clorhidrato | Reactivo | ICN Biomedicals. Inc | 155228 | |
| El ácido ribonucleico de la levadura torula, Tipo VI | Reactivo | Sigma | R6625 | fenol / cloroformo y precipitado en varias ocasiones, se resuspendió en DEPC dH2O y se almacenan a -20 ° C |
| Anti-digoxigenina-AP Fab fragmentos | Reactivo | Roche | 11093274910 | |
| BM púrpura AP sustrato, lo que precipitó. Listo para usar la solución. | Reactivo | Roche | 11 442 074 001 | |
| 4 ml, transparente, cerrado arriba, Vial de almacenamiento de conveniencia para la antorcha | Suministro | Científica nacional | B7800-2 | |
| Shake N Hornee horno de hibridación | Equipo | Boekel Científico | 136400 | |
| Biopsia del Seguro-Tek | Suministro | Fisherbrand | 15 a 200-402C | |
| Además Paraplast tejido medio de inclusión | Reactivo | Fisherbrand | 23-021-400 | |
| Pele-A-Way moldes de plástico desechables tejido incrustación | Suministro | Polysciences | 18646A | |
| Además Colorfrost Portaobjetos | Suministro | Fisherbrand | 12-550-17 | |
| Fast Red nuclear | Reactivo | Sigma | N8002 | |
| Cytoseal 60 | Reactivo | Richard Allan-Científico | 8310-16 |
Referencias
- Divjak, M., Glare, E. M., Walters, E. H. Improvement of non-radioactive in situ hybridization in human airway tissues: use of PCR-generated templates for synthesis of probes and an antibody sandwich technique for detection of hybridization. J. Histochem. Cytochem. 50, 541-548 (2002).
- Wilkinson, D. G., Nieto, M. A. Detection of messenger RNA by in situ hybridization to tissue sections and whole mounts. Methods Enzymol. 225, 361-373 (1993).
- Logel, J., Dill, D., Leonard, S. Synthesis of cRNA probes from PCR-generated DNA. Biotechniques. 13, 604-610 (1992).
- Maddox, D. M., Condie, B. G. Dynamic expression of a glutamate decarboxylase gene in multiple non-neural tissues during mouse development. BMC Dev Biol. 1, 1-1 (2001).
- Conlon, R. A., Rossant, J. Exogenous retinoic acid rapidly induces anterior ectopic expression of murine Hox-2 genes in vivo. Development. 116, 357-368 (1992).
- Krauss, S. Zebrafish pax[zf-a]: a paired box-containing gene expressed in the neural tube. EMBO J. 10, 3609-3619 (1991).
- Hemmati-Brivanlou, A. Localization of specific mRNAs in Xenopus embryos by whole-mount in situ hybridization. Development. 110, 325-330 (1990).
- Harland, R. M. In situ hybridization: an improved whole-mount method for Xenopus embryos. Methods Cell Biol. 36, 685-695 (1991).
- Herrmann, B. G. Expression pattern of the Brachyury gene in whole-mount TWis/TWis mutant embryos. Development. 113, 913-917 (1991).
- Conlon, R. A., Herrmann, B. G. Detection of messenger RNA by in situ hybridization to postimplantation embryo whole mounts. Methods Enzymol. 225, 373-383 (1993).
- Parr, B. A., Shea, M. J., Vassileva, G., McMahon, A. P. Mouse Wnt genes exhibit discrete domains of expression in the early embryonic CNS and limb buds. Development. 119, 247-261 (1993).
- Rosen, B., Beddington, R. S. Whole-mount in situ hybridization in the mouse embryo: gene expression in three dimensions. Trends Genet. 9, 162-167 (1993).
- Quiring, R. Large-scale expression screening by automated whole-mount in situ hybridization. Mech. Dev. 121, 971-976 (2004).
- Thut, C. J., Rountree, R. B., Hwa, M., Kingsley, D. M. A large-scale in situ screen provides molecular evidence for the induction of eye anterior segment structures by the developing lens. Dev. Biol. 231, 63-76 (2001).
- Neidhardt, L. Large-scale screen for genes controlling mammalian embryogenesis, using high-throughput gene expression analysis in mouse embryos. Mech. Dev. 98, 77-94 (2000).
- Gordon, J., Bennett, A. R., Blackburn, C. C., Manley, N. R. Gcm2 and Foxn1 mark early parathyroid- and thymus-specific domains in the developing third pharyngeal. 103, 141-143 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados