Method Article
Visualizar el vivo Drosophila Gliales-unión neuromuscular con tintes fluorescentes
En este artículo
Resumen
Se describen las características estructurales de la sinapsis neuromuscular Glia-en una nueva preparación de tejidos de adentro hacia afuera de las larvas de mosca en directo con tintes fluorescentes con microscopía confocal. Hemos marcado terminales de las neuronas en vivo con anticuerpos fluorescentes primaria de HRP, y también se visualiza el espacio perisynaptic con dextranos fluorescentes.
Resumen
Nuestro proyecto identificó GFP etiquetados estructuras gliales en la mosca en desarrollo larval sinapsis neuromuscular. Para ver el desarrollo de vida de la glía sinapsis nervio-músculo, hemos desarrollado una preparación de tejidos larvarios que tenían características de las larvas intactas en vivo, sino que también tenía buenas propiedades ópticas. Esta nueva preparación también se permitió el acceso de perfusates a la sinapsis. Hemos utilizado larvas de mosca, inmerso en la hemolinfa artificial, y se relajó sus contracciones rítmicas normales del cuerpo por el frío ellos. A continuación se diseca los segmentos posteriores de cada animal y con un alfiler de insectos contundente empujó la partes de la boca hacia atrás a través de la cavidad del cuerpo. Esta eversión de la pared cuerpo de la larva, como convertir un calcetín del revés. Hemos completado la disección con tijeras de disección ultra-fino y por lo tanto expuesto el lado visceral de los músculos de la pared del cuerpo. Las estructuras gliales en la UNM expresa GFP membrana dirigidos bajo el control de promotores específicos gliales. La membrana post-sináptica, la República Socialista Soviética (Reticula subsináptica) en el músculo expresado sinápticamente objetivo dsRed. Necesitábamos etiqueta agudamente la terminales de las neuronas motoras, la tercera parte de la sinapsis. Para ello se aplicaron anticuerpos primarios a HRP, conjugado con una emisión flurophore rojo lejano. Para probar las propiedades de la difusión de color en el espacio perisynaptic entre los terminales de las neuronas motoras y la SSR, se aplicó una solución de grandes moléculas de dextrano conjugado con flurophore emitiendo ahora de color rojo y las imágenes recogidas.
Protocolo
Parte 1: Preparación del tejido
- Nuestro objetivo es una preparación de tejidos de larvas de mosca en el sistema nervioso está intacto, pero la superficie interior de la pared muscular del cuerpo se expone a una hemolinfa artificial, y se pueden colocar cerca de un cubreobjetos microscopio para ópticas. En otras palabras, un interior a cabo la preparación de larvas.
Dado que las preparaciones convencionales de tejidos se refieren al corte, fijación y estiramiento de la pared muscular del cuerpo, ya veces la eliminación de parte del sistema nervioso, necesitamos un enfoque diferente.
Queríamos que los animales de dentro a fuera porque quería conseguir un buen vistazo a las características estructurales y los cambios estructurales en el tiempo en la sinapsis, y hemos querido mantener el sistema nervioso intacto. También hemos querido evitar el estiramiento del tejido, y la activación de los receptores de estiramiento, lo que haría que los músculos de contracción y la ruina de nuestras imágenes. - Para empezar, el estadio de los animales. La alimentación de las larvas de tercer y errante larvas de tercera son grandes y fáciles de diseccionar lo que vamos a demostrar en W3 larvas. Este animal se tiene el fenotipo Tubby, y es muy amplia, por lo que es fácil de Evert.
Hemos utilizado las larvas que vimos activamente gatear, incluyendo larvas de W3. - Limpie la superficie de un gusano con un pincel muy suave en una placa de Petri de H2O bidestilada. Las larvas tienen una mejor óptica limpia y la limpieza reduce las bacterias.
- La transferencia de los animales a una pequeña placa de Petri de alrededor de 3 ml de hielo frío HL-6, y en la hemolinfa artificial. Coloque el plato en el hielo hasta que el animal deja de moverse, y se relaja (unos 5 minutos).
- Sujete con fórceps punta muy fina en una mano y las tijeras de primavera en el otro. Yo uso las tijeras con la mano dominante. Haz un pequeño agujero en la pared del cuerpo con las tijeras para equlibrate la presión a través de la pared del cuerpo.
- Sujetar al animal suavemente con las pinzas hacia abajo en la parte inferior de la placa y cortar la parte posterior de dos segmentos. Diseccionar las vísceras y la grasa corporal es probable que se mueven fuera de la cavidad del cuerpo. Cortar este tejido también.
- Mantenga las larvas contra la parte inferior plato con unas pinzas finas. Mantenga un pin # 0 de insectos en (con punta roma) y empujarla contra la partes de la boca de las larvas. Empuje el aparato bucal a través de la cavidad del cuerpo como el que está girando un calcetín del revés.
- El revés del tejido se parecerá a la figura: a continuación. Con ultra-fino de herramientas de disección, diseccionar los de grasa corporal y trachioles de la pared del cuerpo. Realmente difícil tratar de no tirar la trachioles, o desconectar el sistema nervioso. Rasga el trachioles rasgar los agujeros en la pared muscular del cuerpo.
Extraer el cuerpo tanta grasa como sea posible. Ambas estructuras alterar la calidad óptica de sus tejidos. Es posible que desee omitir el café antes de hacer esta preparación. - Cuando haya terminado el músculo será transparente, no opaco o blanco. Si ponemos la preparación de tejidos en HL-6 sin glutamato, a temperatura ambiente, es probable que se contraen rítmicamente, porque los generadores de patrón motor en el sistema nervioso central están trabajando.
Evite el uso de preparaciones con los músculos contraídos, obviamente, o contratados irregularmente pared del cuerpo.
El interior de la pared del cuerpo intacto fácilmente tiende a doblar por la mitad a lo largo de la línea media dorsal y ventral, por lo que la preparación le da a la izquierda oa la derecha "hemi-animal" para visualizar. - 1.9 Montar el tejido, ya sea en una cámara de pequeño volumen comercial, tales como la cámara de Warner, o un portaobjetos de microscopio con una disposición de cubierta antideslizante puente. Ver la parte 3 de sugerencias sobre el tejido de montaje.
Parte 2: Etiquetado de Bouton neuronal con anticuerpos marcados con fluorescencia primaria contra el HRP.
- Poner 50 microlitros de la etiqueta fluorescente primario anti-cuerpo contra el HRP en HL-6 en una gota en una placa de Petri. Sumergir la preparación del cuerpo de adentro hacia afuera de la pared en el baño de tinte. Usted puede ver el etiquetado neurona terminal después de unos 5 minutos, pero se incuba durante 10-20 minutos, de una etiqueta completa y brillante.
- Enjuague el tinte fuera durante 10-30 segundos en HL-6 a temperatura ambiente. No obligado tinte enjuaga rápidamente, así que el ciclo de enjuague no es necesario ser agresivo.
- Variar la concentración de colorante y el tiempo de incubación, según sea necesario.
Parte 3: etiquetado espacio Perisynaptic con dextrano conjugado flurophore
- Diluir con fluorescencia conjugada con dextrano tintura diluida en HL-6. Una concentración que funcionó bien para nuestros propósitos fue:
- Si usted no está preocupado por el tiempo de acceso medio de contraste dentro de su espacio extracelular, poner una gota 20 micro litros de colorante en un "puente" cubreobjetos (véase la parte 4) y el depósito de preparación en el baño de tinte.
Parte 4: Montaje del tejido para la visualización (con microscopía confocal).
Si no es necesario para perfundir su preparación (breves observaciones) o si desea mantener el volumen de baño HL-6 pequeños, utilice el método de doble cara en puente
Si desea perfundir su preparación, pruebe a usar una cámara de perfusión. Se utilizó un moCámara dified de instrumentos de Warner.
Detalles para los dos siguientes.
Montaje de preparación en un portaobjetos de doble puente.
- Use un portaobjetos muy limpio. Superglue dos cuadrados de 18 mm (# 1.5) cubreobjetos sobre el portaobjetos. Deje un espacio de 2 mm entre los bordes del cubreobjetos.
- Deje que el pegamento seque completamente, o se forma una película extraña en los medios acuosos alrededor de su preparación.
- Posición de la parte interior de larvas entre los bordes de los cubreobjetos. Es posible que necesite la posición de la preparación en una diagonal, si las larvas es grande y su sistema de adquisición de imágenes tiene una matriz de píxeles limitados.
- Cubrir el tejido con un cubreobjetos # 1.5 mm, 18 mm (muy limpio). Se adhieren al "top" de la diapositiva colocada cubreobjetos se desliza el tejido de acompañamiento, con vaselina mínimo.
- Ponga una gota de aceite de Cargill objetivo personalizado con un índice de refracción de 1,3379 (si se utiliza HL-6) en el cubreobjetos encima y voltear esta asamblea otra vez.
- Coloque el conjunto del tejido en el microscopio de lado el petróleo, hacia el objetivo, y enfocará su objetivo.
Montaje del tejido en una cámara de perfusión modificado. - Pegue un cubreobjetos de 1,5 a formar un piso en la cámara de RC 20. Coloque el tejido en la cámara de acuerdo con las instrucciones de RC-20. Use un pedazo de malla en lugar de Nytex un cubreobjetos para formar un techo de la cámara.
Parte 5: Resultados del representante:
- De adentro hacia fuera la preparación del tejido disección de la secuencia:

W3 larvas, se lavó ("Tubby" fenotipo) (5.1.1). W3 larvas, posterior dos segmentos disecados. Usted puede ver el cuerpo de grasa empujado fuera de la cavidad del cuerpo por cuerpo trans-presión de la pared (flecha). Trate de minimizar visceral "erupción", haciendo un pequeño agujero en la pared del cuerpo un minuto antes de la disección (5.1.2). La preparación de las vísceras disecados antes de encender la preparación de adentro hacia afuera (5.1.3). La preparación, en su mayoría evertido, con el pasador (flecha) dentro de la luz de la preparación (5.1.4). El músculo se encuentra ahora en el exterior y la cutícula está en el interior, con alguna grasa corporal y trachioles adjunta (5.1.5). Un tejido completamente disecados preparación con casi todos los de la grasa corporal y trachioles disecados (5.1.6).
- Vivir el etiquetado el uso de anti-HRP en la UNM larval. Un representante W3 larval músculos y nervios hacen sinapsis con una extensión gliales (de adentro hacia afuera-prep). Los terminales de las neuronas motoras bouton se etiquetan con un primario anti-cuerpo contra HRP (magenta), que se conjuga con Cy5. Los procesos gliales están etiquetados con las buenas prácticas agrarias (verde).
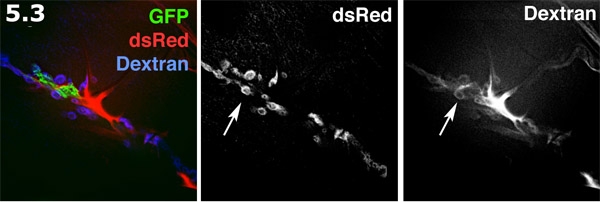
- Espacio Perisynaptic fluorescencia visualiza con Alexa 680 dextrano en un revés de preparación. El proceso gliales (verde) está marcada con GFP membrana específicos. La República Socialista Soviética de post-sináptica en la superficie del músculo (azul) está marcado con dsRed. El dextrano Alexa (rojo) formas concentra en las zonas extracelular. El tinte de dextrano forma piscinas en forma de anillo en los espacios perisynaptic. El etiquetado de dextrano y SSR dsRed etiqueta se muestra en escala de grises. Tenga en cuenta las piscinas con forma de donut múltiples tinte destacando los espacios perisynaptic (flecha).
Discusión
Este procedimiento permite a largo plazo de imágenes en vivo de proteínas marcadas y los procesos celulares. La preparación en el tejido in situ que se describe tiene un sistema nervioso central intacto y funcionando, PNS y circuitos reflejos. Esta preparación de tejidos tiene ventajas sobre los protocolos estándar de larvas de mosca de los músculos, donde se estira el músculo de la pared del cuerpo larval (cuando se fija a cabo). El estiramiento puede distorsionar la morfología sináptica y desencadenar las contracciones reflejas base. Nuestra preparación fue de adentro hacia afuera mecánicamente estable, y tenía excelente sistema óptico que facilita el análisis de alta resolución de los cambios celulares en tiempo real. Además de adentro hacia afuera preparación sobrevivido por más de una hora y visualización permite de cambios sinápticos en un curso de tiempo.
Durante la disección, tenga cuidado para evitar dañar el SNP o sistema nervioso central. También evitar que se rompa o tirando de la tráquea, ya que daña las células del músculo. Mantenga la pared muscular del cuerpo lo más relajado posible. El enfriamiento de la HL-6 y el tejido se relaja el músculo de la pared del cuerpo y reduce la trans-tensión de la pared del cuerpo. De calcio (2 mM) en la en la hemolinfa artificial es esencial para la salud y la morfología de las células gliales.
Imagen debe ser realizada en el tejido estable, el músculo no contratantes. Mientras que el 5 mM de glutamato de manera eficiente los bloques neuralmente evocada contracciones musculares, el bloqueador del canal del calcio Nifedipina puede ser una alternativa útil. Nifedipina en 10 bloques micromolar la mayoría (pero no todos) los nervios provocado la contracción muscular. Nifedipina bloquea canales de calcio voltaje cerrada en la membrana de las células musculares con mayor eficacia que los canales asociados con la liberación de neurotransmisores, lo que bloquea la contracción muscular al tiempo que permite la función normal del MNJ sináptica (morrales et al 1999).
Mediante el procedimiento de etiquetado de anticuerpos, la etiqueta con firmeza los residuos de carbohidratos extracelular expresadas en los terminales de las neuronas, que son reconocidos por el anticuerpo anti-HRP primaria. Se obtuvieron excelentes etiquetado utilizando el anticuerpo anti-HRP de los laboratorios de Jackson, disponible de forma pre-conjugado con una gran variedad de fluoróforos (Cy5-en nuestros estudios). Este enfoque puede ser adaptado para su uso con cualquier anticuerpo primario que reconoce un epítopo extracelular, por ejemplo, el etiquetado moléculas de la matriz extracelular.
El in situ "de adentro hacia fuera" la preparación del tejido, junto con una modificación del protocolo utilizado por Stork et al 2008, es útil para sondear las barreras celulares difusión. Dextrano la difusión del colorante fluorescente también puede ser útil para la sincronización y la visualización de entrada de perfusión y de drogas en los espacios intercelulares, como las hendiduras sinápticas.
Con tintes fluorescentes dextrano, es fundamental utilizar una cámara de volumen pequeño de perfusión. Si no es demasiado "gruesa", una capa límite de solución de tinte que cubre la estructura que tratan de la imagen, la solución de colorante puede oscurecer la característica de interés, debido a la falta de contraste entre el tinte para espacios infusión y las estructuras circundantes.
Por último, nuestras técnicas de etiquetado estructurales requieren un sistema de exposición de alta resolución adecuada para el tejido vivo. Hemos utilizado microscopios disco giratorio confocal (tecnologías de quórum y los sistemas de Perkin-Elmer) en conjunción con software Volocity (Improvisación), una longitud de trabajo de largo, de alta apertura numérica del objetivo 63X de inmersión en agua, y los láseres y filtros apropiados para la visualización de las buenas prácticas agrarias, dsRed y rojo ahora fluoróforos. Para obtener imágenes que utilizan aceite de encargo formulado objetivo de microscopio de los laboratorios de Cargill para que coincida con el índice de refracción de la hemolinfa artificial, HL-6, en conjunción con el objetivo de inmersión en agua 63X. Sin este petróleo, el error de refracción era importante y dio lugar a las imágenes distorsionadas. Nuestra preparación en situ se puede usar con otros 3-D los sistemas de imágenes, tales como el sistema API DeltaVision Restauración de exploración. Sin embargo, se debe tener cuidado para superar los altos niveles de dispersión de la luz de la preparación de espesor, el tejido vivo.
Agradecimientos
Este proyecto fue financiado por el CIHR y NSERC. Nos gustaría agradecer Jusiak Barb para contribuir a la creación de las cepas de moscas que expresan dsRed etiquetados SSR (línea BJ), y el Fondo para el UBC Bio-imágenes.
Materiales
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | N/A | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma).2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph.References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes, Life Technologies | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearch | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes, Life Technologies | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tools | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum Technologies | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
Referencias
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados