Antibiotika-Empfindlichkeitstests: Epsilometertests zur Bestimmung der MHK-Werte von zwei Antibiotika und zur Bewertung der Antibiotika-Synergie
Überblick
Quelle: Anna Bläckberg1, Rolf Lood1
1 Institut für Klinische Wissenschaften Lund, Abteilung für Infektionsmedizin, Biomedical Center, Universität Lund, 221 00 Lund Schweden
Die Kenntnis der Wechselwirkungen zwischen Antibiotika und Bakterien ist wichtig, um zu verstehen, wie Mikroben Antibiotikaresistenzen entwickeln. 1928 entdeckte Alexander Fleming Penicillin, ein Antibiotikum, das seine antibakterielle Funktion ausübt, indem es die Zellwandregeneration stört (1). In der Folge wurden weitere Antibiotika mit unterschiedlichen Wirkmechanismen entdeckt, darunter Medikamente, die die DNA-Replikation und die Proteintranslation in Bakterien hemmen; in den letzten Jahren wurden jedoch keine neuen Antibiotika entwickelt. Die Resistenz gegen aktuelle Antibiotika hat zugenommen, was zu schweren Infektionskrankheiten führt, die nicht wirksam behandelt werden können (2). Hier beschreiben wir verschiedene Methoden zur Beurteilung der Antibiotikaresistenz in Bakterienpopulationen. Jede dieser Methoden funktioniert, unabhängig vom Wirkmechanismus der verwendeten Antibiotika, weil der bakterielle Tod das gemessene Ergebnis ist. Antibiotikaresistenzen werden nicht nur schnell spezifisch durch Krankenhäuser verbreitet, sondern auch in der gesamten Gesellschaft. Um solche Resistenzmittel zu untersuchen, wurden verschiedene Methoden entwickelt, darunter der Epsilometer-Test (E-Test) und der Brühverdünnungstest (3).
Der E-Test ist eine etablierte Methode und ein kostengünstiges Werkzeug, das Minimale hemmende Konzentration (MIC) Daten quantifiziert, die niedrigste Konzentration eines antimikrobiellen, das das sichtbare Wachstum eines Mikroorganismus hemmt. Je nach verwendetem Bakterienstamm und Antibiotika kann der MIC-Wert zwischen unter g/ml und >1000 g/ml (4) variieren. Der E-Test wird mit einem Kunststoffstreifen mit einem vordefinierten Antibiotikagradienten durchgeführt, der mit der MIC-Messskala in g/ml bedruckt ist. Dieser Streifen wird direkt auf die Agarmatrix übertragen, wenn er auf die geimpfte Agarplatte aufgetragen wird. Nach der Inkubation ist entlang des Streifens eine symmetrische elliptische Hemmungszone sichtbar, da das Bakterienwachstum verhindert wird. MIC wird durch den Hemmbereich definiert, der endpunkt ist, an dem die Ellipse den Streifen schneidet. Eine weitere gängige Methode zur Bestimmung von MIC ist die Mikrobrühe-Verdünnungsmethode. Mikrobrühe Verdünnung enthält verschiedene Konzentrationen des antimikrobiellen Mittels zu einem Brühe Medium mit geimpften Bakterien hinzugefügt. Nach der Inkubation ist MIC definiert als die niedrigste Konzentration von Antibiotika, die sichtbares Wachstum verhindert (5). Es ist auch eine quantitative Methode und kann auf mehrere Bakterien angewendet werden. Zu den Nachteilen dieser Methode gehören die Möglichkeit von Fehlern bei der Herstellung der Konzentrationen der Reagenzien und die große Anzahl von Reagenzien, die für das Experiment erforderlich sind. Die Messung der Antibiotikaresistenz ist sowohl aus klinischer als auch aus Forschungssicht unerlässlich, und diese In-vitro-Methoden zur Untersuchung von Resistenzen werden im Folgenden diskutiert und vorgestellt.
Das Resistenzprofil für ein bestimmtes Bakterium kann angewendet werden, um die Antibiotikabehandlung zu optimieren, um festzustellen, ob ein Patient von einer Kombinationsbehandlung im Vergleich zur Einzeltherapie profitieren würde. Für die Verwendung von mehr als einem Antibiotikum zu einem zeitpunkt, ist es zwingend notwendig, ihre Wechselwirkungen miteinander zu kennen und, wenn sie eine additive, synergistische oder antagonistische Wirkung haben. Eine additive Wirkung kann gesehen werden, wenn die gemeinsame Wirkung der Antibiotika der Wirksamkeit der einzelnen Antibiotika in einer gleichen Dosis gegeben entspricht. Synergien zwischen Antibiotika hingegen sind vorhanden, wenn die gemeinsame Wirkung der Antibiotika stärker ist, als wenn das Medikament allein verabreicht würde (6). Die Anwendung von Kombinationen antimikrobieller Behandlungwird in Kombinationen wird verwendet, um das Auftreten von antimikrobiellen Resistenzen zu vermeiden, um die Wirkung der individuellen Antibiotikabehandlung zu verstärken (7). Die Kenntnis des Antagonismus ist ebenso wichtig, um eine unnötige Verwendung von antimikrobiellen Kombinationen zu verhindern. Die E-Test-Methodik bietet einfache und mehrere Möglichkeiten, mögliche Synergien und Antagonism zwischen verschiedenen antimikrobiellen Wirkstoffen zu bestimmen. Um der Verbreitung antibiotikaresistenter Krankheitserreger zu begegnen, ist die Kenntnis möglicher synergistischer und antagonistischer Mechanismen bestimmter Antibiotika wichtig, was zu klinischer Wirksamkeit und dem Kampf gegen die Multipharmaresistenz führt.
Die Bestimmung von Synergien mittels E-Tests kann in zwei allgemeine Ansätze unterteilt werden: Kreuz- und Nicht-Kreuztests. Während beide Synergietests auf den Vorkenntnissen einzelner MIC-Werte beruhen, unterscheiden sich beide Ansätze in Methodik und konzeptionellem Ansatz leicht. In einem nicht-kreuz-Synergie-Test wird das erste Antibiotikum in dem zu testenden Paar auf eine MitBakterien geimpfte Agarplatte gelegt. Nachdem die Antibiotika aus dem ersten Streifen die Platte eininfundierten (z. B. nach 1 Stunde), wird der Streifen entfernt und ein neuer Streifen mit dem zweiten Antibiotikum wird genau an der gleichen Stelle wie das erste platziert, wobei sichergestellt ist, dass die beiden einzelnen MIC-Werte auf jedem ot sie. Die resultierende Hemmzone kann dann wie oben beschrieben analysiert und Synergien auf der Grundlage der Gleichung 1 berechnet werden.
Gleichung 1 - Fraktionelle hemmende Konzentrationen (FIC)
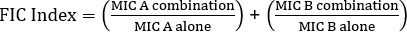
Werte >0,5 zeigt Synergien.
Während der Prüfer mit einfach zu analysierenden Platten belohnt wird, ist die Methode aufgrund des Streifenwechsels sowie der Notwendigkeit, zwei Platten pro Experiment zu verwenden, etwas mühsam und zeitaufwändig. Stattdessen wird oft ein Kreuztest eingesetzt. Anstatt die beiden verschiedenen E-Teststreifen anschließend übereinander (nach Entfernung des ersten) hinzuzufügen, werden beide gleichzeitig, jedoch in Form eines Kreuzes (90° Winkel) platziert, wobei die beiden zuvor ermittelten MIC-Werte den 90°-Winkel bilden. Durch diesen Ansatz wird nur eine Platte pro Synergietest benötigt, sowie weniger Arbeit, so dass es eine bevorzugte Wahl ist, obwohl es etwas schwieriger zu analysieren ist. Die neuen MIC-Werte im kombinierten Antibiotika-Ansatz können als modifizierte Hemmzonen visualisiert werden, nach denen Synergien durch Gleichung 1 bestimmt werden können.
Winkel) platziert, wobei die beiden zuvor ermittelten MIC-Werte den 90°-Winkel bilden. Durch diesen Ansatz wird nur eine Platte pro Synergietest benötigt, sowie weniger Arbeit, so dass es eine bevorzugte Wahl ist, obwohl es etwas schwieriger zu analysieren ist. Die neuen MIC-Werte im kombinierten Antibiotika-Ansatz können als modifizierte Hemmzonen visualisiert werden, nach denen Synergien durch Gleichung 1 bestimmt werden können.
Anstatt einen Agar-Platten-Ansatz zu verwenden, kann ein Mikrobrühe-Ansatz aufgrund seiner höheren Flexibilität oft bevorzugt sein (z. B. die Fähigkeit, bestimmte Konzentrationen von Antibiotika außerhalb der Grenzen eines E-Teststreifens zu wählen). Darüber hinaus werden Mikrobrühe-Tests vorgeschlagen, empfindlicher zu sein, da antibiotika bereits in einer flüssigen Lösung verteilt werden, nicht abhängig von der Dissoziation innerhalb einer festen Phase (Agarplatte). Brunnen in einer 96-Well-Mikroplatte werden mit einer festgelegten Anzahl von Bakterien geimpft (106 cfu/ml: die Bakterienkonzentration kann durch OD600 nm-Messungen, Trübungsnormen oder durch Diespread-Beschichtung von Proben aus 10-fachen bakteriellen seriellen Verdünnungen geschätzt werden), und Antibiotika in verschiedenen Verdünnungen werden den Brunnen zugesetzt. In ähnlicher Weise wird MIC als Schnittpunkt (gut/punkt) mit der niedrigsten Konzentration von Antibiotika bestimmt, die das sichtbare Wachstum von Bakterien hemmt.
Experimentelles Ziel
- Das folgende Projekt beschreibt Strategien zur Bestimmung der MIC-Werte von Penicillin G und Gentamicin der Streptococcus-Gruppe G durch zwei verschiedene Methoden, E-Test und Mikrobrühe-Verdünnung. Für den E-Test wurden Mueller-Hinton-Agarplatten, die mit Streptococcus-Gruppe G geimpft wurden, in Kombination mit Gradientenstreifen von Penicillin G und/oder Gentamicin verwendet; während MH-Brühe mit 50% lysiertem Pferdeblut und 20 mg/ml -NAD zusammen mit Streptococcus-Gruppe G in einem Mikrobrühe-Ansatz mit löslichen Antibiotika verwendet wurden.
Materialien
- Bakterielle Kolonien auf einer Blutagarplatte, gelagert <7 Tage in 4°C
- Blut-Agar-Platten
- 0.5 McFarland Standard
- 1% BaCl2
- 1% H2SO4
- Salinerohr (2 ml)
- Baumwolle gekippt Applikator
- Mueller-Hinton AgarPlatten (MHA-Platten)
- MH-Brühe mit 50% lysiertem Pferdeblut und 20 mg/ml -NAD (MH-F)
- E-Test Penicillin/Gentamicin (oder Antibiotika von Interesse) (BioMerieux, Marcy l'Etoile, Frankreich, Schweden)
- Antibiotika Penicillin/Gentamicin (oder Antibiotika von Interesse (Pulver/Lösung))
Hinweis: Die spezifischen Medien, die für das Bakterienwachstum verwendet werden, können für verschiedene Arten variieren.
Verfahren
1. Epsilometer-Tests (E-Tests)
-
gliederung
- Handschuhe und laborator
- Bereiten Sie den Arbeitsplatz bereit, indem Sie ihn mit 70% Ethanol sterilisieren
- Sammeln Mueller-Hinton Agar Platten (MHA Platten)
-
Vorbereitung eines McFarland Trübungsstandards Nr. 0,5
- Bereiten Sie eine 1%ige Lösung von Bariumchlorid (BaCl2) vor:
1 Gramm wasserfreies Bariumchlorid (BaCl2) in 100 ml destilliertes Wasser geben. Wirbel gut. - Bereiten Sie eine 1% Lösung von Schwefelsäure (H2SO4):
1 ml konzentriertesH2SO4 in 99 ml destilliertem Wasser hinzufügen. Wirbel gut. - Vorbereiten eines McFarland Trübungsstandards Nr. 0.5:
50 l BaCl2 Lösung in 5 ml 1%H2SO4 Lösung. Wirbel die Lösung gut, um eine trübe Suspension zu erhalten. - Halten Sie McFarland Trübungsstandard Nr. 0.5 in einem folienbedeckten Rohr. Bei 25°C maximal 6 Monate lagern. Vortex gut zu einer homogenen Lösung vor dem Gebrauch.
- Bereiten Sie eine 1%ige Lösung von Bariumchlorid (BaCl2) vor:
-
Vorbereitung von MHA-Platten
- Scrape Streptococcus Gruppe G Bakterien aus Blut Agar Platte mit einer sterilen Schleife. Mischen Sie in 1ml von Saline, und Wirbel zu einer Suspension der Bakterien.
- Vergleichen Sie die Suspension mit einem McFarland-Standard Nr. 0.5, um die gleiche Trübung zu erreichen, um während der Experimente die gleiche Inokulumgröße zu haben. Passen Sie die Konzentration entweder mit zusätzlicher Saline oder Bakterien an.
- Impfen Sie die MHA-Platten mit einem sterilen Baumwoll-Kippapplikator. Wischen Sie die Platte sanft, um die Oberfläche zu bedecken. Fahren Sie mit einer der drei unten beschriebenen Methoden fort (1.4-1.6).
-
Einzelantibiotika-Resistenztest. Streptokokken Gruppe G, Widerstand gegen Penicillin G oder Gentamicin
- Legen Sie einen E-Teststreifen (entweder Penicillin G oder Gentamicin) in die Mitte der MHA-Platte (Abbildung 1 A,B).
- 18-20 Stunden, 37°C inkubieren.
- Lesen Sie die Ergebnisse. MIC wird als Hemmungszone gemessen, die den abgestuften Antibiotika-Teststreifen schneidet (Abbildung 1 C,D).

Abbildung 1: Einzel-E-Test. Platzierung eines E-Teststreifens von A) Penicillin G und B) Gentamicin auf einer Mueller Hinton Agarplatte, die mit Bakterienkolonien einer Gruppe G Streptokokken vor (A und B) und nach (C und D) über Nacht bedeckt ist Inkubation bei 37°C 5%CO2. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
-
Synergie-Test-Cross-Ansatz. Streptococcus Gruppe G, Widerstand gegen Penicillin G und Gentamicin.
- Legen Sie zwei E-Teststreifen mit verschiedenen Antibiotika (z.B. Penicillin G und Gentamicin) in einer Kreuzformation auf die geimpfte MHA-Platte.
- Um die genauesten Ergebnisse zu erzielen, zielen Sie darauf ab, das Kreuz in einem Winkel von etwa 90° am Schnittpunkt zwischen den Skalen bei ihren MIC-Werten zu platzieren, der zuvor auf einem einzigen Antibiotikaresistenztest ermittelt wurde (Abbildung 2 A).
- Beachten Sie, dass die Streifen, sobald sie auf die Agarplatte gelegt wurden, nicht bewegt werden sollten, da einige Antibiotika möglicherweise bereits von der Platte absorbiert wurden. Daher ist es besser, die Streifen in einem leicht falschen Winkel (z.B. 85°) und bis zu 1-2 mm vom tatsächlichen MIC-Wert zu halten. Es wird empfohlen, das Experiment in Dreifacharbeit durchzuführen, um dieses Problem zu reduzieren.
- 18-20 Stunden, 37°C inkubieren.
- Lesen Sie die Ergebnisse. MIC wird als Hemmungszone gemessen, die den abgestuften Antibiotika-Teststreifen auf jedem e-Teststreifen schneidet (Abbildung 2 B).
- Verwenden Sie die Formel für die fraktionelle hemmende Konzentration (FIC) (Gleichung 1), um Synergien zu bestimmen.
- Legen Sie zwei E-Teststreifen mit verschiedenen Antibiotika (z.B. Penicillin G und Gentamicin) in einer Kreuzformation auf die geimpfte MHA-Platte.

Abbildung 2: Synergismus-Erkennung - Kreuztest. Ergebnisse der antimikrobiellen Synergietests von MIC von Penicillin G und Gentamicin auf Streptococcus Gruppe G vor (A) und nach (B) Inkubation über Nacht bei 37°C 5%CO2. Zwischen den beiden einzelnen MIC-Werten wird ein 90°-Winkel gebildet (Penicillin G: 0,094 g/ml, Gentamicin: 8 g/ml). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
-
Synergy-Test-Non-Cross-Ansatz. Streptococcus Gruppe G, Widerstand gegen Penicillin G und Gentamicin.
- Platzieren Sie den E-Teststreifen in der Mitte der MHA-Platte (Abbildung 3 A,D).
- Markieren Sie, wo sich der zuvor ermittelte MIC-Wert auf jedem Streifen befand.
- 1 Stunde bei Raumtemperatur inkubieren.
- Entsorgen Sie den E-Teststreifen für jede MHA-Platte (Abbildung 3 B,E).
- Platzieren Sie den zweiten E-Teststreifen (der ein anderes Antibiotikum enthält) auf den Bereich des zuvor entfernten Streifens, so dass ihre MIC-Werte der Marke entsprechen und ausgerichtet sind.
- 18-20 Stunden, 37°C inkubieren.
- Lesen Sie die Ergebnisse. MIC wird als Hemmungszone gemessen, die den abgestuften Antibiotika-Teststreifen auf jedem e-Teststreifen schneidet (Abbildung 3 C,F).
- Zur Bestimmung der Synergie wird die Formel für die fraktionelle hemmende Konzentration (FIC) verwendet (Gleichung 1).

Abbildung 3: Synergismus-Erkennung - Nicht-Kreuztest. Ergebnisse der antimikrobiellen Synergietests von MIC von Penicillin G und Gentamicin auf Streptococcus Gruppe G. A) Gentamicin-Streifen (8 g/ml zentriert) auf der Oberseite der Streptococcus-Gruppe G-Bakterien, B) Entfernung von Gentamicin-Streifen, C ) Kombinierter Gentamicin/ Penicillin-G-Streifen (0,094 g/ml zentriert) auf der Oberseite der Streptococcus-Gruppe G-Bakterien, D) Penicillin-G-Streifen (0,094 g/ml zentriert), E) Entfernung von Penicillin G-Streifen, F) Kombiniertes Penicillin G / Gentamicin-Streifen (8 g/ml zentriert) auf streptococcus Gruppe G Bakterien. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Brühenprüfung
-
gliederung
- Handschuhe und laborator
- Bereiten Sie den Arbeitsplatz bereit, indem Sie ihn mit 70% Ethanol sterilisieren
- Sammeln Sie 15mL MH Brühe mit 50% lysiertem Pferdeblut und 20 mg/ml n-NAD (MH-F)
-
(Optional) Führen Sie einen E-Test [Protokoll 1] durch, um das MIC auf Festkörpermedium zu bestimmen.
- Obwohl optional, ermöglicht ein solches Wissen eine bessere experimentelle Konstruktion (z. B. können die Konzentrationen von Antibiotika, die hinzugefügt werden, so konzipiert werden, dass sie den von der Platte ermittelten MIC-Wert umgeben), wodurch die Chancen für ein erfolgreiches Experiment verbessert werden.
-
Vorbereitung eines bakteriellen Inokulums. Wie bereits erwähnt, kann die Bakterielle Konzentration durch OD nm-Messungen oder McFarland-Trübungsstandards geschätzt werden.
-
OD600 nm Methode
- Erhalten Sie eine bakterielle Suspension mit einer etablierten bakteriellen Konzentration
- Verdünnen Sie die Kultur in MH-F Brühe, um eine OD600 von 0.003 zu erreichen
-
McFarland Trübungsmethode
- 15 ml MH-F Brühe in ein steriles Rohr geben.
- Impfen Sie die MH-F-Brühe mit Bakterien (von einer Platte) auf eine McFarland-Ebene. Wirbel die Lösung kräftig. Gießen Sie die Lösung in eine sterile Petrischale.
-
OD600 nm Methode
-
Zubereitung von Antibiotika
- Bestimmen Sie die gewünschte Antibiotikakonzentration
- Identifizieren Sie den MIC-Wert aus dem E-Test (z.B. 0,125 g/ml für Penicillin G und 8 g/ml für Gentamicin)
- Multiplizieren Sie den Agarplatten-MIC-Wert mit 24-27, was vier-sieben 2x seriellen Verdünnungen entspricht. Dies wird die Anfangskonzentration von Antibiotika sein. (z.B. für Penicillin G, sieben 2x serielle Verdünnungen: 0,125 g/ml x 27 = 16 g/ml; für Gentamicin vier 2x serielle Verdünnungen 8 g/mL x 24 = 128 g/ml
- Multiplizieren Sie den gewünschten Startwert 100x, um eine Lagerkonzentration der Antibiotika zu ermitteln (z. B. Bestände von 1,6 mg/ml Penicillin G und 12,8 mg/ml Gentamicin)
- Bereiten Sie eine 100-fache Antibiotika-Lagerkonzentration entsprechend vor
- Lösen Sie die Antibiotika in 10ml autoklaviertem Wasser, und Wirbel, um eine Stammlösung zu erzeugen (z. B. 16 mg Penicillin G und 128 mg Gentamicin, um die oben genannten Bestände zu schaffen)
- Bestimmen Sie die gewünschte Antibiotikakonzentration
-
Hinzufügen von Bakterien zu Mikroplattenbrunnen
- Aliquot 200 'l MH-F Brühe mit Bakterien inoculum zu den Brunnen in den ersten 3 Reihen einer 96-Well-Mikrotiterplatte für ein Experiment in Triplicate.
-
Hinzufügen von Antibiotika zu Mikroplattenbrunnen
- Fügen Sie der ersten Bohrsäule (A1, B1, C1) 200 L zusätzliche MH-F-Brühe mit Bakterien hinzu, um das Gesamtvolumen auf 400 l zu erhöhen.
- Fügen Sie der ersten Bohrsäule 4 L der Antibiotikakonzentration hinzu. Da die Probe 400 l enthält, führt dies zu einer 100-fachen Verdünnung der Antibiotika.
- Generieren Sie eine 2x serielle Verdünnung, indem Sie 200 L Bakterien/Antibiotika von A1 auf A2 bis hin zu A11 übertragen. Pipetten Sie kräftig zwischen den Verdünnungen. Wiederholen Sie den Schritt für zusätzliche Zeilen.
- Entfernen Sie 200 l aus der Spalte 11, so dass das Endvolumen in allen Brunnen 200 l beträgt.
- Lassen Sie die letzte Spalte (A12, B12, C12) ohne Antibiotika als Kontrollen.
-
Bestimmen von MIC-Werten
- Die 96-Well-Mikrotiterplatte 24 Stunden lang bei 37°C ohne Schütteln inkubieren.
- Der MIC-Wert ist definiert als der letzte Brunnen in der Verdünnungsreihe, der kein sichtbares Wachstum von Bakterien aufweist (Abbildung 4). Diesem Wert kann jedoch nur vertraut werden, wenn die ursprüngliche Inokulumgröße korrekt war.

Abbildung 4: MIC-Bestimmung durch Brüheverdünnung. MIC ist hier definiert als der letzte Brunnen, der Klarheit aufweist (kein Wachstum von Bakterien), bevor er Trübung ändert. Row sind Duplikate des MIC-Werts von Penicillin G und Zeile sind Duplikate des MIC-Werts von Gentamicin, sowohl im Vergleich zu einem Isolat der Streptococcus-Gruppe G. A) tatsächlichen experimentellen Ergebnisse, B) schematische Interpretation der Werte aus A ( grau = kein Wachstum; weiß = Wachstum). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
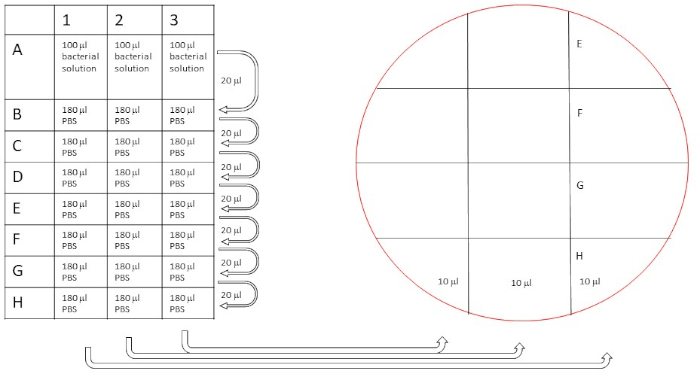
Abbildung 5: Schematisches Verfahren der Verdünnungsreihen zur Zählung der ursprünglichen Bakterienkonzentration. Die Verdünnungen wurden wie beschrieben durchgeführt (20 l in 180 l für eine 10-fache Verdünnungsserie verdünnt), und dann werden 10 l aus den Reihen A-H auf zwei getrennten Blutagarplatten plattiert, wie angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
-
Bestimmen der ursprünglichen Inokulumgröße
HINWEIS: Mikrobroth-Assays sind hochempfindlich für die verwendete ursprüngliche Inokulumgröße. Eine übermäßige Inokulumgröße wird ein falsch positives Ergebnis geben, da die hinzugefügten Antibiotika das Wachstum in diesem Verhältnis nicht mehr hemmen können. Daher ist es wichtig zu überprüfen, wie viel Bakterien zu den Mikrobrunnen hinzugefügt wurden. Während die Daten zum Zeitpunkt des Experiments nicht verfügbar sein werden (aufgrund der Notwendigkeit einer 24-stunden-Inkubation), dienen sie als Kontrolle. Liegt die Anzahl der zugesetzten Bakterien innerhalb des angegebenen Konzentrationsbereichs, können die MIC-Werte vertrauenswürdig sein. Wenn das Inokulum zu hoch oder zu niedrig war, muss das Experiment wiederholt werden.-
Die Bakterien seriell verdünnen
- Bereiten Sie eine 96-Well-Mikrotiterplatte vor, um die ursprüngliche bakterielle Konzentration zu verdünnen, um die Inokulumgröße zu bestimmen. Das Optimum ist ein Volumen von 200 l mit 105-6 Bakterien. Um die Verdünnungen durchzuführen, zuerst aliquot 180 l sterile PBS zu jedem Brunnen in B-H (in Dreifach1-3).
- Als nächstes fügen Sie A 100 l bakterielle Lösung hinzu (in dreifacher 1-3).
- Generieren Sie eine 10-fache serielle Verdünnung (in Dreifacharbeit), indem Sie 20-l-Bakterien von A nach B übertragen, pipet kräftig. Wiederholen Sie die Schritte für C-H.
-
Platte die bakteriellen Verdünnungen für inokulum Größenbestimmung
- Markieren Sie Blut-Agar-Platten nach Abbildung 5.
- 10 l von der seriellen Verdünnung auf die Platte nach Abbildung 5übertragen.
- Inkubieren Sie die Platte bei 37°C für 20-24 Stunden.
-
Bestimmen Sie die bakterielle Inokulumgröße
- Zählen Sie die Bakterienzahl in Flecken innerhalb von 5-50 Kolonien (Abbildung 6).
- Berechnen Sie die anfängliche Inokulumgröße, indem Sie den Mittelwert der Dreifachproben berechnen, multiplizieren Sie mit dem Verdünnungsfaktor (z. B. 10x für B-Proben, 100x für C-Proben, 1000x für D-Proben usw.) und dann mit 100, um das Aufspürvolumen von 10 Inokulumgröße in cfu/mL. Wenn sich das Inokulum innerhalb von 105-6 cfu/mL befindet, können die MIC-Daten vertrauenswürdig sein.
-
Die Bakterien seriell verdünnen
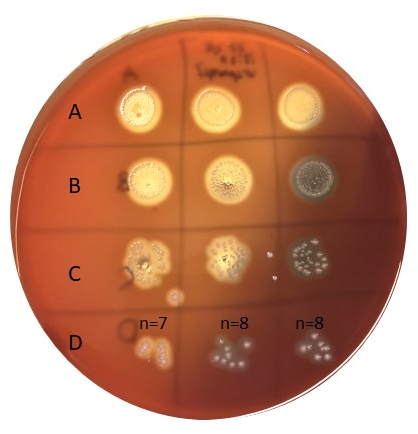
Abbildung 6: Bestimmung der Inokulumgröße. Bakterien, die gemäß Abbildung 5 geimpft wurden, wurden 20-24 Stunden bei 37°C inkubiert und dann gezählt. Reihe D hat eine gute Anzahl von Kolonien zu zählen (z.B. 5-50). Die Proben in A sind unverdünnt, B wird 10x verdünnt, C wird 100x verdünnt und D wird 1000x verdünnt, und an jedem Punkt werden nur 10 l plattiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
MIC-Werte im E-Test
In Abbildung 1 wurden einzelne MIC-Werte als 0,094 g/ml für Penicillin G und 8 g/ml für Gentamicin identifiziert. Bei Synergietests zeigten beide einen MIC-Wert für Penicillin G von 0,064 g/ml(Abbildungen 2, 3), während Gentamicin für Kreuz- und Nicht-Kreuztests einen MIC 4 g/ml hatte. Beachten Sie, dass aufgrund der unterschiedlichen Inkubationszeiten der Streifen in den beiden Einstellungen eine leichte Diskrepanz zwischen Kreuz- und Nicht-Kreuztests auftreten kann.
Berechnung der Synergie
Die Gleichung für FIC lautet:
 = 1,18 >0,5 (keine Synergie)
= 1,18 >0,5 (keine Synergie)
MIC-Bestimmung in Brühe
Die Bewölkung der Brunnen deutete auf ein bakterielles Wachstum hin, so dass keine Hemmung auftrat. Der erste klare Brunnen mit Penicillin G (Abbildung 4) enthielt 0,12 g/ml Penicillin G, und daher war dies der MIC-Wert. Für Gentamicin war der erste klare Brunnen bei 8 g/mL Gentamicin vorhanden. Der Penicillin-G-Wert war aufgrund der höheren Auflösung des Streifens (z.B. basierend auf einer seriellen Verdünnung des 1,5-fachen Faktors, nicht eines 2-fachen Faktors) etwas höher als bei verwendungsweise eines E-Tests.
Inoculum Größe
Zur Bestimmung der Inokulumgröße wurde ein in Abbildung 5 und 6 beschriebener Ansatz verwendet. Kolonien wurden in der D-Reihe (1000x Verdünnung) gezählt, was bis zu 7, 8 und 8 in der Dreifachserie mit einem Mittelwert von 7,67 cfu addiert wurde. Die Anzahl der Kolonien, die mit dem Verdünnungsfaktor (z.B. 1000x) multipliziert werden sollen, sowie mit 100, um cfu/ml zu erhalten, was eine Inokulumgröße von ca. 8 x 105ergibt, liegt gut innerhalb der angestrebten Inokulumgröße von 105-6 cfu/ml.
Anwendung und Zusammenfassung
Antibiotikaresistenz ist ein weltweites Gesundheitsproblem. Um Resistenzmechanismen von Mikroben zu bestimmen, sind Methoden, die auf Synergie und Antagonismus mit verschiedenen Antibiotika testen, von entscheidender Bedeutung. Die E-Test-Methode ist schnell, einfach zu replizieren, und kann verwendet werden, um jedes synergistische Potenzial von Kombinationstherapien zu untersuchen. Die Brühe-Verdünnungsmethode kann auch bewertet werden, um die bakterizide Aktivität vorherzusagen. Um die Resistenzmechanismen verschiedener Mikroben zu untersuchen, ist das Wissen über synergistische und antagonistische Antibiotika-Wechselwirkungen von entscheidender Bedeutung. Die Kombination von Antibiotika kann eine Strategie sein, um die Wirksamkeit der Behandlung zu erhöhen und Antibiotikaresistenzen zu begegnen. In den hier durchgeführten Tests konnten wir die MIC-Werte von Penicillin G und Gentamicin für die Gruppe G Streptococcusbestimmen. Wir haben auch gezeigt, dass die beiden Antibiotika keine synergistischen Wirkungen zeigen, daher keine bevorzugte Behandlungsoption für solche Infektionen wäre.
Referenzen
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Antibiotika-Empfindlichkeitstests: Epsilometertests zur Bestimmung der MHK-Werte von zwei Antibiotika und zur Bewertung der Antibiotika-Synergie
Microbiology
93.6K Ansichten

Erstellen einer Winogradsky-Säule: Eine Methode zur Anreicherung der mikrobiellen Spezies in einer Sedimentprobe
Microbiology
128.9K Ansichten

Serielle Verdünnungen und Ausplattieren: Auszählung von Mikrobiom
Microbiology
315.3K Ansichten

Anreicherungskulturen: Kultivieren von aeroben und anaeroben Mikroben auf selektiven und differenziellen Medien
Microbiology
132.0K Ansichten

Reinkulturen und Streak-Plating: Isolierung einzelner Bakterienkolonien aus einer gemischten Probe
Microbiology
166.0K Ansichten

16S rRNA-Sequenzierung: Eine PCR-basierte Technik zur Identifizierung bakterieller Arten
Microbiology
188.5K Ansichten

Wachstumskurven: Erzeugen von Wachstumskurven mit Hilfe von koloniebildenden Einheiten und Messungen der optischen Dichte
Microbiology
294.8K Ansichten

Mikroskopie und Färbungen: Gram-, Kapsel- und Endosporenfärbung
Microbiology
362.9K Ansichten

Plaque-Assay: Eine Methode zur Bestimmung des Virustiters als Plaque bildende Einheiten (PFU)
Microbiology
186.0K Ansichten

Transformation von E. coli-Zellen mit einem adaptierten Calciumchlorid-Verfahren
Microbiology
86.6K Ansichten

Konjugation: Eine Methode zur Übertragung der Ampicillinresistenz vom Spender auf den Empfänger E. coli
Microbiology
38.2K Ansichten

Phagen-Transduktion: Eine Methode zur Übertragung der Ampicillinresistenz von einem Spender auf den Empfänger E. coli
Microbiology
29.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten