Reinkulturen und Streak-Plating: Isolierung einzelner Bakterienkolonien aus einer gemischten Probe
Überblick
Quelle: Tilde Andersson1, Rolf Lood1
1 Institut für Klinische Wissenschaften Lund, Abteilung für Infektionsmedizin, Biomedical Center, Universität Lund, 221 00 Lund, Schweden
Die mikrobielle Biodiversität scheint unmöglich zu bestimmen, und die mikrobielle Artenvielfalt ist mit schätzungsweise einer Billion koexistierender Arten (1,2) wirklich erstaunlich. Obwohl besonders raue Klimazonen, wie die saure Umgebung des menschlichen Magens (3) oder die subglazialen Seen der Antarktis (4), von einer bestimmten Art dominiert werden können, sind Bakterien typischerweise in Mischkulturen zu finden. Da jede Sorte das Wachstum einer anderen (5) beeinflussen kann, ist die Fähigkeit, "reine" (nur aus einem Typ bestehende) Kolonien zu trennen und zu kultivieren, sowohl im klinischen als auch im akademischen Umfeld unerlässlich geworden. Reine Kulturen ermöglichen weitere genetische (6) und proteomische Untersuchungen (7), die Analyse der Probenreinheit und, vielleicht bemerkenswerter, die Identifizierung und Charakterisierung von Infektionserregern aus klinischen Proben.
Bakterien haben eine breite Palette von Wachstumsanforderungen und es gibt zahlreiche Arten von Nährstoffmedien, die entwickelt wurden, um sowohl die unanspruchsvollen als auch die anspruchsvollen Arten zu erhalten (8). Wachstumsmedien können entweder in flüssiger Form (als Brühe) oder in einer typisch engarbasierten (einem gelierenden Mittel aus Rotalgen) feste Form hergestellt werden. Während die direkte Impfung in die Brühe das Risiko birgt, eine genetisch vielfältige oder sogar gemischte Bakterienpopulation zu erzeugen, schafft die Beschichtung und Neuung eine reinere Kultur, in der jede Zelle ein sehr ähnliches genetisches Make-up hat. Die Streifenplattentechnik basiert auf der progressiven Verdünnung einer Probe (Abbildung 1), mit dem Ziel, einzelne Zellen voneinander zu trennen. Jede lebensfähige Zelle (im Folgenden als koloniebildende Einheit, KBE bezeichnet), die von den Medien und der bezeichneten Umgebung getragen wird, kann anschließend eine isolierte Kolonie von Tochterzellen durch binäre Spaltung finden. Trotz der schnellen Mutationsraten innerhalb bakterieller Gemeinschaften wird diese Zellgruppe allgemein als klonal betrachtet. Die Ernte und Erneute Verwesung dieser Population stellt somit sicher, dass die nachfolgende Arbeit nur einen einzigen bakteriellen Typ umfasst.
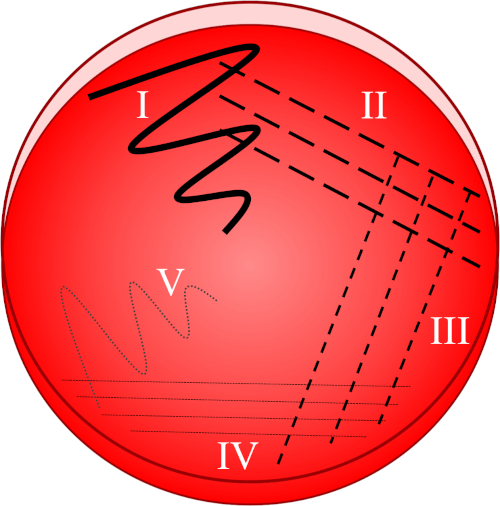
Abbildung 1: Eine Streifenplatte basiert auf der progressiven Verdünnung der Originalprobe. I) Das Inokulum wird zunächst mit einer Zick-Zack-Bewegung verteilt, wodurch ein Gebiet mit einer relativ dichten Bakterienpopulation entsteht. II-IV) Streifen werden aus dem vorhergehenden Bereich gezogen, wobei jedes Mal eine sterile Impfschleife verwendet wird, bis der vierte Quadrant erreicht ist. V) Eine letzte Zick-Zack-Bewegung, die auf die Mitte der Platte gerichtet ist, bildet einen Bereich, in dem das Inokulum deutlich verdünnt wurde, so dass Kolonien getrennt voneinander erscheinen können.
Die Streifenplattentechnik kann auch mit dem Einsatz selektiver und/oder differentialer Medien kombiniert werden. Ein selektives Medium hemmt das Wachstum bestimmter Organismen(z. B. durch Zugabe von Antibiotika), während ein Differenzmedium nur dazu beiträgt, sich voneinander zu unterscheiden(z. B. durch Hämolyse auf Blutagarplatten).
Allen Arbeiten in der Mikrobiologie liegt der Einsatz aseptischer (steriler) Techniken zugrunde. Jede Bakterienkultur sollte als potenziell pathogen betrachtet werden, da die Gefahr eines unbeabsichtigten Wachstums tückischer Stämme, Aerosolbildung und Kontamination von Geräten/Personal besteht. Um diese Risiken zu minimieren, werden alle Medien-, Kunststoff-, Metall- und Glaswaren in der Regel durch Autoklavieren vor und nach dem Gebrauch sterilisiert und mit hochdruckgesättigtem Dampf bei etwa 121°C belastet, der alle verweilenden Zellen effektiv auslöscht. Der Arbeitsbereich wird in der Regel mit Ethanol sowohl vor als auch nach der Verwendung desinfiziert. Labormantel und Handschuhe werden immer bei der Arbeit mit Infektionserregern getragen.
Verfahren
1. Einrichten
- Alle Mikroben sollten so behandelt werden, als wären sie gefährlich. Tragen Sie immer einen Labormantel und Handschuhe, binden Sie lange Haare zurück und sorgen Sie dafür, dass alle Wunden besonders gut geschützt sind.
- Bereiten Sie den Arbeitsbereich bereit, indem Sie ihn mit 70% Ethanol sterilisieren.
- Stellen Sie sicher, dass Agarplatten, Probenlösung(en) und entweder eine Schachtel mit vorsterilisierten Kunststoff-Impfschlaufen oder eine Metallschlaufe plus eine Bunsenflamme in der Nähe sind. Einweg-Kunststoffschlaufen sind in der Regel vorsterilisiert. Metallschlaufen sollten in 70% Ethanol getaucht und dann in der Nähe des blauen Bereichs einer Bunsenflamme gehalten und erhitzt werden, bis es heiß ist. Lassen Sie den Draht abkühlen, indem Sie den Deckel der Platte anheben (nur leicht, um eine Kontamination zu verhindern) und ihn gegen das erstarrte Medium anzapfen.
- Beenden Sie jedes Verfahren mit einer wiederholten Sterilisation des Arbeitsbereichs und einer gründlichen Waschen/Sterilisation von Händen und Handgelenken.
2. Protokoll
- Vorbereitung von Medien
- Identifizieren und vorbereiten Sie ein festes Medium (in der Regel 1,5% (w/v) Agar), das die genutzte Bakterienart/-sorte aufrechterhält. Mischen Sie das Medium in einer Flasche in der Lage, das Doppelte der endgültigen Lautstärke zu halten, um Überlauf beim Autoklavieren zu vermeiden.
- Sterilisieren Sie die Medien, indem Sie die Flasche mit einer halbangezogenen Kappe in einem Autoklaven auf 121°C für 20 min setzen.
- Schließen Sie die Kappe richtig, sobald die Flasche aus dem Autoklaven entfernt wird. Wenn das Medium in Kürze verwendet werden soll, legen Sie die Flasche in ein Wasserbad, das auf 45°C eingestellt ist, um sie in einem flüssigen Zustand zu erhalten. Der Agar erstarrt sonst bei weniger als 32-40°C und kann später (typischerweise mit einer Mikrowelle) zu einem Schmelzpunkt bei 85°C wieder erhitzt werden.
- Zubereitung von Kulturplatten
- Markieren Sie die Basis steriler Petrischalen (in der Regel 100 x 15 mm) auf der Seite oder am Boden mit dem Namen des Experimentators, dem Datum und dem Medientyp.
- 20-25 ml 45°C Agarkulturmedium (zuvor zubereitet) in jede der beschrifteten Platten gießen. Sollte Schaum an den Rändern auftreten, sollte dieser mit einer normalen Pipette und einer sterilen Spitze schnell entfernt werden.
- Legen Sie sofort alle Deckel wieder auf das Geschirr, um eine Kontamination zu verhindern.
- Lassen Sie den Agar ca. 2 h bei Raumtemperatur oder über Nacht bei 4°C erstarren. Einmal gesetzt, sollten Bakterienkulturplatten anschließend kopfüber bei 4°C gelagert werden, um die Kondensation auf der mittleren Oberfläche zu minimieren.
- Streak-Beschichtung
- Eine sterile Schleife in das gewünschte Inokulum untertauchen und die gesammelte Probe sofort mit einer Zick-Zack-Bewegung auf den ersten Quadranten der Platte verteilen (Abbildung 1, I).
- Schließen Sie den Deckel und sterilisieren Sie die Impfschleife neu oder sammeln Sie eine neue sterile Einwegschleife.
- Machen Sie 3-4 Striche, die vom ersten Quadranten (der eine relativ dichte Bakterienpopulation enthält) in Richtung des zweiten Quadranten der Platte ausstrahlen(Abbildung 1, II).
- Schließen Sie den Deckel und sterilisieren Sie die Impfschleife neu oder entsorgen Sie die Einwegschleife und sammeln Sie eine neue sterile Schleife.
- Wiederholen Sie diese Streifzüge von 3-4 Schlägen vom zweiten in den dritten Quadranten und dann vom dritten zum vierten Quadranten, wobei sie jedes Mal eine sterile Schleife verwenden(Abbildung 1, III - IV).
- Mit einer sterilen Schleife, machen Sie einen letzten Schlag in einem Zick-Zack-Muster vom vierten Quadranten in Richtung der Mitte der Platte (Abbildung 1, V). Die bakterielle Prävalenz wird in diesem Bereich geringer sein, was idealerweise die Einrichtung einzelner Kolonien aus einer einzigen, lebensfähigen Mutterzelle ermöglicht.
- Schließen Sie den Deckel und (falls von der Bakterienart benötigt) Versiegelung mit Parafilm, um Luftstrom zu verhindern.
- Je nach Bakterienart/Stamm die Kulturplatte nach oben in eine geeignete Umgebung stellen und brüten, bis Bakterienkolonien sichtbar sind (getrennte Kolonien können in beiden Bereichen der Platte erscheinen, da die Anfangskonzentration variieren kann).
- Um eine klonale Bakterienpopulation zu erzeugen, streichen Sie eine weitere Platte aus und tauschen Sie das auf die ursprüngliche Platte plattierte Inokulum gegen Zellen aus einer einzigen Kolonie der ursprünglichen Platte.
Ergebnisse
Die anfängliche Streifenplatte kann Kolonien enthalten, die aus Zellen mit unterschiedlicher genetischer Zusammensetzung oder (je nach Probenreinheit) von verschiedenen Bakterienarten stammen (Abbildung 2A).
Durch die nachfolgende Isolierung einer einzelnen Kolonie, bei der alle Einheiten aus einer gemeinsamen Mutterzelle abgeleitet sind, erzeugt das zweite Streifenverfahren eine relativ klonale Bakterienpopulation, die für eine weitere Charakterisierung oder Impfung in Brühe geeignet ist ( Abbildung 2B).
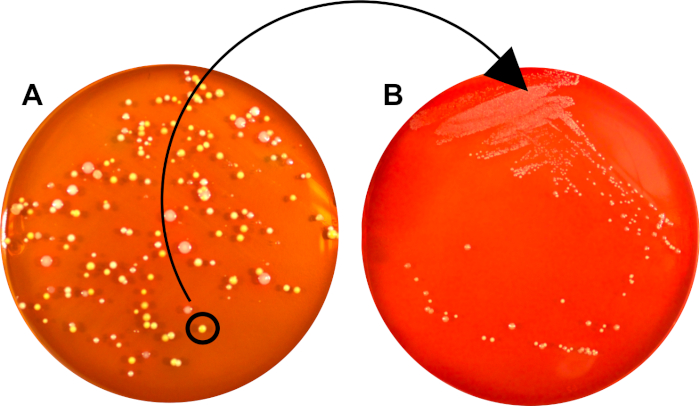
Abbildung 2: Eine reine Kultur kann aus einer gemischten Probe durch Isolierung einer einzelnen, abgeschiedenen Kolonie erzeugt werden. A) Das Wachstum einer einzelnen Bakterienzelle (KBE) erzeugte eine Klonkolonie, die von denen anderer Arten und Stämme getrennt war. Diese KBE wurde für das anschließende Streichen auf eine neue Platte B) Eine zweite Platte verwendet, bei der die Bakterienpopulation ausschließlich aus Zellen besteht, die aus der ursprünglichen CFU abgeleitet wurden.
Anwendung und Zusammenfassung
Die Fähigkeit, eine reine Bakterienkolonie zu erhalten und zu kultivieren, ist sowohl im klinischen als auch im akademischen Umfeld unerlässlich. Die Streak-Beschichtung ermöglicht die Isolierung einer relativ klonalen Zellpopulation, die aus einer gemeinsamen KBE stammt und während der Diagnose oder für eine zusätzliche Charakterisierung des Isolats von besonderem Interesse sein kann. Eine Probe wird auf ein geeignetes Nährmedium auf Agarbasis gestreift und inkubiert, bis Kolonien sichtbar werden. Eine isolierte Kolonie wird anschließend geerntet und auf eine zweite Platte zurückgestreift.
Referenzen
- The Human Microbiome Project C. Structure, Function and Diversity of the Healthy Human Microbiome. Nature. 486:207-214. (2012)
- Locey KJ, Lennon JT. Scaling laws predict global microbial diversity. Proceedings of the National Academy of Sciences. 113 (21) 5970-5975 (2016)
- Skouloubris S, Thiberge JM, Labigne A, De Reuse H. The Helicobacter pylori UreI protein is not involved in urease activity but is essential for bacterial survival in vivo. Infection and Immunity. 66:4517-21. (1998)
- Mikucki JA, Auken E, Tulaczyk S, Virginia RA, Schamper C, Sørensen KI, Doran PT, Dugan H, Foley N. Deep groundwater and potential subsurface habitats beneath an Antarctic dry valley. Nature Communications. 6:6831. (2015)
- Mullineaux-Sanders C, Suez J, Elinav E, Frankel G. Sieving through gut models of colonization resistance. Nature Microbiology. 3:132-140. (2018)
- Fournier PE, Drancourt M, Raoult D. Bacterial genome sequencing and its use in infectious diseases. Lancet Infectious Diseases. 7:711-23 (2007)
- Yao Z, Li W, Lin Y, Wu Q, Yu F, Lin W, Lin X. Proteomic Analysis Reveals That Metabolic Flows Affect the Susceptibility of Aeromonas hydrophila to Antibiotics. Scientific Reports. 6:39413 (2016)
- Medina D, Walke JB, Gajewski Z, Becker MH, Swartwout MC, Belden LK. Culture Media and Individual Hosts Affect the Recovery of Culturable Bacterial Diversity from Amphibian Skin. Frontiers in Microbiology. 8:1574 (2017)
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Reinkulturen und Streak-Plating: Isolierung einzelner Bakterienkolonien aus einer gemischten Probe
Microbiology
166.0K Ansichten

Erstellen einer Winogradsky-Säule: Eine Methode zur Anreicherung der mikrobiellen Spezies in einer Sedimentprobe
Microbiology
128.9K Ansichten

Serielle Verdünnungen und Ausplattieren: Auszählung von Mikrobiom
Microbiology
315.2K Ansichten

Anreicherungskulturen: Kultivieren von aeroben und anaeroben Mikroben auf selektiven und differenziellen Medien
Microbiology
132.0K Ansichten

16S rRNA-Sequenzierung: Eine PCR-basierte Technik zur Identifizierung bakterieller Arten
Microbiology
188.5K Ansichten

Wachstumskurven: Erzeugen von Wachstumskurven mit Hilfe von koloniebildenden Einheiten und Messungen der optischen Dichte
Microbiology
294.7K Ansichten

Antibiotika-Empfindlichkeitstests: Epsilometertests zur Bestimmung der MHK-Werte von zwei Antibiotika und zur Bewertung der Antibiotika-Synergie
Microbiology
93.6K Ansichten

Mikroskopie und Färbungen: Gram-, Kapsel- und Endosporenfärbung
Microbiology
362.9K Ansichten

Plaque-Assay: Eine Methode zur Bestimmung des Virustiters als Plaque bildende Einheiten (PFU)
Microbiology
185.9K Ansichten

Transformation von E. coli-Zellen mit einem adaptierten Calciumchlorid-Verfahren
Microbiology
86.6K Ansichten

Konjugation: Eine Methode zur Übertragung der Ampicillinresistenz vom Spender auf den Empfänger E. coli
Microbiology
38.2K Ansichten

Phagen-Transduktion: Eine Methode zur Übertragung der Ampicillinresistenz von einem Spender auf den Empfänger E. coli
Microbiology
29.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten