Pruebas de susceptibilidad a los antibióticos: Pruebas con epsilometro para determinar los valores de la CMI de dos antibióticos y evaluar la sinergismos
Visión general
Fuente: Anna Bl'ckberg1, Rolf Lood1
1 Departamento de Ciencias Clínicas Lund, División de Medicina de Infecciones, Centro Biomédico, Universidad de Lund, 221 00 Lund Suecia
El conocimiento de las interacciones entre antibióticos y bacterias es importante para entender cómo los microbios evolucionan la resistencia a los antibióticos. En 1928, Alexander Fleming descubrió la penicilina, un antibiótico que ejerce su función antibacteriana interfiriendo con la regeneración de la pared celular (1). Otros antibióticos con diversos mecanismos de acción han sido descubiertos posteriormente, incluyendo medicamentos que inhiben la replicación del ADN y la traducción de proteínas en bacterias; sin embargo, no se han desarrollado nuevos antibióticos en los últimos años. La resistencia a los antibióticos actuales ha ido en aumento, lo que ha dado lugar a enfermedades infecciosas graves que no pueden tratarse eficazmente (2). Aquí, describimos varios métodos para evaluar la resistencia a los antibióticos en poblaciones bacterianas. Cada uno de estos métodos funciona, independientemente del mecanismo de acción de los antibióticos utilizados, porque la muerte bacteriana es el resultado medido. La resistencia a los antibióticos no sólo se disemina rápidamente específicamente a través de los entornos hospitalarios, sino también en toda la sociedad. Con el fin de investigar estos medios de resistencia, se han desarrollado diferentes métodos, incluyendo la prueba del epsilometro (prueba E) y la prueba de dilución del caldo (3).
La prueba E es un método bien establecido y es una herramienta rentable que cuantifica los datos de la concentración mínima de inhibidores (MIC), la concentración más baja de un antimicrobiano que inhibe el crecimiento visible de un microorganismo. Dependiendo de la cepa bacteriana y de los antibióticos utilizados, el valor de la MIC puede variar entre sub g/ml y >1000 g/ml (4). La prueba E se realiza utilizando una tira de plástico que contiene un degradado antibiótico predefinido, que se imprime con la escala de lectura MIC en g/ml. Esta tira se transfiere directamente en la matriz de agar cuando se aplica a la placa de agar inoculada. Después de la incubación, una zona de inhibición elíptica simétrica es visible a lo largo de la tira a medida que se evita el crecimiento bacteriano. MIC se define por el área de inhibición, que es el punto final donde la elipse interseca la tira. Otro método común para determinar el MIC es el método de dilución de microcalina. La dilución de microcalina incorpora diferentes concentraciones del agente antimicrobiano añadido a un medio de caldo que contiene bacterias inoculadas. Después de la incubación, MIC se define como la concentración más baja de antibióticos que impide el crecimiento visible (5). También es un método cuantitativo y se puede aplicar a varias bacterias. Las desventajas de este método incluyen la posibilidad de errores al preparar las concentraciones de los reactivos y el gran número de reactivos necesarios para el experimento. La medición de la resistencia a los antibióticos es imprescindible tanto desde una perspectiva clínica como de investigación, y estos métodos in vitro para investigar la resistencia se discuten y se muestran a continuación.
El perfil de resistencia de una bacteria específica se puede aplicar con el fin de optimizar el tratamiento antibiótico para determinar si un paciente se beneficiaría del tratamiento combinado frente a la terapia única. Para el uso de más de un antibiótico a la vez, es imperativo conocer sus interacciones entre sí y si tienen un efecto aditivo, sinérgico o antagónico. Un efecto aditivo se puede ver cuando el efecto articular de los antibióticos es igual a la potencia de los antibióticos individuales dados a una dosis igual. La sinergia entre los antibióticos, por otro lado, está presente cuando el efecto articular de los antibióticos es más potente que si el medicamento se administrara solo (6). La aplicación de combinaciones de tratamiento antimicrobiano se utiliza para evitar la aparición de resistencia a los antimicrobianos, por lo tanto, para mejorar el efecto del tratamiento antibiótico individual (7). El conocimiento del antagonismo también es tan importante para prevenir el uso innecesario de combinaciones antimicrobianas. La metodología de prueba electrónico ofrece formas sencillas y varias de determinar posibles sinergias y antagonismo entre diferentes agentes antimicrobianos. Con el fin de hacer frente a la proliferación de patógenos resistentes a los antibióticos, el conocimiento de los posibles mecanismos sinérgicos y antagónicos de ciertos antibióticos es importante dando lugar a la eficacia clínica y luchando contra la resistencia multifármaco.
La determinación de la sinergia mediante pruebas E puede dividirse en dos enfoques generales: pruebas cruzadas y no cruzadas. Si bien ambas pruebas de sinergia se basan en el conocimiento previo de los valores individuales del MIC, los dos enfoques son ligeramente diferentes en metodología y enfoque conceptual. En una prueba de sinergia no cruzada, el primer antibiótico en el par a probar se coloca en una placa de agar inoculada con bacterias. Después de permitir que los antibióticos de la primera tira infundan la placa (por ejemplo, después de 1 hora), se retira la tira y se coloca una nueva tira que contiene el segundo antibiótico en el mismo lugar que la primera, asegurándose de colocar los dos valores individuales de MIC encima de cada ot Su. La zona de inhibición resultante se puede analizar como se describió anteriormente, y la sinergia calculada sobre la base de la Ecuación 1.
Ecuación 1 - Concentraciones inhibidoras fraccionarias (FIC)
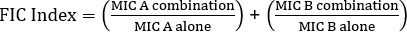
Valores >0.5 muestra sinergia.
Al recompensar al examinador con placas fáciles de analizar, el método es algo laborioso y lento debido al cambio de tiras, así como la necesidad de usar dos placas por experimento. En su lugar, a menudo se emplea una prueba cruzada. En lugar de añadir las dos tiras de prueba E diferentes posteriormente una encima de la otra (después de la eliminación de la primera), ambas se colocan simultáneamente pero en forma de una cruz (ángulo de 90o), con los dos valores MIC previamente determinados formando el ángulo de 90o. Con este enfoque sólo se necesita una placa por prueba de sinergia, así como menos trabajo, por lo que es una opción preferida a pesar de ser un poco más difícil de analizar. Los nuevos valores MIC en el enfoque combinado de antibióticos se pueden visualizar como las zonas de inhibición modificadas, después de lo cual la sinergia puede ser determinada por la Ecuación 1.
de 90o), con los dos valores MIC previamente determinados formando el ángulo de 90o. Con este enfoque sólo se necesita una placa por prueba de sinergia, así como menos trabajo, por lo que es una opción preferida a pesar de ser un poco más difícil de analizar. Los nuevos valores MIC en el enfoque combinado de antibióticos se pueden visualizar como las zonas de inhibición modificadas, después de lo cual la sinergia puede ser determinada por la Ecuación 1.
En lugar de utilizar un enfoque de placa de agar, un enfoque de microcaldo a menudo puede ser preferencial debido a su mayor flexibilidad (por ejemplo, la capacidad de elegir concentraciones específicas de antibióticos fuera de los límites de una tira de prueba E). Además, se sugiere que las pruebas de microcaldeo son más sensibles debido a su distribución uniforme de antibióticos en una solución líquida, no dependiendo de la disociación dentro de una fase sólida (placa de agar). Los pozos en una microplaca de 96 pocillos serán inoculados con un número determinado de bacterias (106 cfu/ml: la concentración bacteriana se puede estimar mediante mediciones OD600 nm, estándares de turbidez o por muestras de chapado de propagación de diluciones seriales bacterianas 10x), y antibióticos en diferentes diluciones se añadirán a los pozos. Del mismo modo, a las tiras de prueba E MIC se determina como la intersección (pozo/ punto) con la concentración más baja de antibióticos que inhiben el crecimiento visible de bacterias.
Objetivo experimental
- El siguiente proyecto describe estrategias para determinar los valores MIC de la penicilina G y la gentamicina del grupo G de Streptococcus mediante dos métodos diferentes, la prueba electrónica y la microdilución. Para la prueba E, las placas de agar Mueller-Hinton inoculadas con Streptococcus grupo G se utilizaron en combinación con tiras de gradiente de penicilina G y/o gentamicina; mientras que el caldo MH con 50% de sangre de caballo lysed y 20 mg/ml-NAD se utilizaron con antibióticos solubles junto con Streptococcus grupo G en un enfoque de microcaldo.
Materiales
- Colonias bacterianas en una placa de agar en sangre, almacenadas <7 días en 4oC
- Placas de agar de sangre
- 0.5 Estándar McFarland
- 1% BacI2
- 1% H2SO4
- Tubo salino (2 mL)
- Aplicador con punta de algodón
- Placas de agar Mueller-Hinton (placas MHA)
- Caldo MH con 50% de sangre de caballo lysed y 20 mg/mL-NAD (MH-F)
- E-test penicilina/gentamicina (o antibióticos de interés) (BioMerieux, Marcy l'Etoile, Francia, Suecia)
- Antibióticos penicilina/gentamicina (o antibióticos de interés (polvo/solución))
Nota: Los medios específicos utilizados para el crecimiento bacteriano pueden variar para diferentes especies.
Procedimiento
1. Pruebas de epsiómetro (pruebas E)
-
Configuración
- Use guantes y un abrigo de laboratorio
- Preparar el espacio de trabajo esterilizando con 70% de etanol
- Recoger placas de agar Mueller-Hinton (placas MHA)
-
Preparación de un estándar de turbidez de McFarland No. 0.5
- Preparar una solución al 1% de cloruro de bario (BaCl2):
Añadir 1 gramo de cloruro de bario anhidro (BaCl2) en 100 ml de agua destilada. Vórtice bien. - Preparar una solución al 1% de ácido sulfúrico (H2SO4):
Añadir 1 mL de concentrado H2SO4 en 99 mL de agua destilada. Vórtice bien. - Preparar un estándar de turbidez de McFarland No. 0.5:
50 L BaCl2 solución en 5 ml de 1% H2SO4 solución. Vortex la solución bien para obtener una suspensión turbia. - Mantenga el estándar de turbidez De McFarland No. 0.5 en un tubo cubierto de papel de aluminio. Conservar a 25oC durante un máximo de 6 meses. Vórtice bien a una solución homogénea antes de su uso.
- Preparar una solución al 1% de cloruro de bario (BaCl2):
-
Preparación de placas MHA
- Raspar Streptococcus grupo G bacterias de la placa de agar de la sangre utilizando un lazo estéril. Mezclar en 1 ml de salina, y vórtice a una suspensión de la bacteria.
- Compare la suspensión con un estándar McFarland No. 0.5 para lograr la misma turbidez con el fin de tener el mismo tamaño de inóculo durante los experimentos. Ajuste la concentración utilizando salina adicional o bacterias.
- Inocular las placas MHA utilizando un aplicador estéril de punta de algodón. Swab la placa suavemente para cubrir la superficie. Continúe con uno de los tres métodos descritos a continuación (1.4-1.6).
-
Prueba única de resistencia a antibióticos. Streptococcus grupo G, resistencia a la penicilina G o gentamicina
- Coloque una tira de prueba en E (ya sea penicilina G o gentamicina) en el centro de la placa MHA(Figura 1 A,B).
- Incubar durante 18-20 horas, 37oC.
- Lea los resultados. MIC se mide como la zona de inhibición que interseca la tira de prueba de antibióticos calificada(Figura 1 C,D).

Figura 1: Prueba E única. Colocación de una tira de prueba E de A) penicilina G y B) gentamicina en una placa de agar Mueller Hinton cubierta con colonias bacterianas de un grupo G estreptococos antes (A y B) y después (C y D) durante la noche incubación a 37oC 5% CO2. Haga clic aquí para ver una versión más grande de esta figura.
-
Pruebas de sinergia entre enfoques. Streptococcus grupo G, resistencia a la penicilina G y gentamicina.
- Coloque dos tiras de prueba en E con diferentes antibióticos (por ejemplo, penicilina G y gentamicina) en la placa de MHA inoculada en una formación cruzada.
- Para obtener los resultados más precisos, el objetivo es colocar la cruz en un ángulo de aproximadamente 90o en la intersección entre las escalas en sus valores MIC, previamente determinados en una sola prueba de resistencia a los antibióticos(Figura 2 A).
- Tenga en cuenta que una vez que las tiras se colocan en la placa de agar, no se deben mover, ya que algunos antibióticos ya pueden haber sido absorbidos por la placa. Por lo tanto, es más apropiado mantener las tiras en un ángulo ligeramente incorrecto (por ejemplo, 85o) y hasta 1-2 mm desde el valor REAL de MIC. Se recomienda ejecutar el experimento en triplicado para reducir este problema.
- Incubar durante 18-20 horas, 37oC.
- Lea los resultados. MIC se mide como la zona de inhibición que interseca la tira de prueba de antibióticos calificada en cada tira de prueba E respectiva(Figura 2 B).
- Utilice la fórmula para la concentracióninhibitoriafraccionaria (FIC) (Ecuación 1 ) con el fin de determinar la sinergia.
- Coloque dos tiras de prueba en E con diferentes antibióticos (por ejemplo, penicilina G y gentamicina) en la placa de MHA inoculada en una formación cruzada.

Figura 2: Detección de sinergismo - prueba cruzada. Resultados de las pruebas de sinergia antimicrobiana de MIC de penicilina G y gentamicina en Streptococcus grupo G antes (A) y después (B) incubación durante la noche a 37oC 5% CO2. Se forma un ángulo de 90o entre los dos valores individuales de MIC (penicilina G: 0,094 g/ml, gentamicina: 8 g/ml). Haga clic aquí para ver una versión más grande de esta figura.
-
Pruebas de sinergia enfoque no cruzado. Streptococcus grupo G, resistencia a la penicilina G y gentamicina.
- Coloque la tira de prueba E en el centro de la placa MHA(Figura 3 A,D).
- Marque dónde estaba el valor MIC previamente determinado en cada tira.
- Incubar durante 1 hora a temperatura ambiente.
- Deseche la tira de prueba E para cada placa MHA(Figura 3 B,E).
- Coloque la segunda tira de prueba E (que contiene un antibiótico diferente) en el área de la tira eliminada anteriormente, respectivamente, para que sus valores MIC se correspondan con la marca y estén alineados.
- Incubar durante 18-20 horas, 37oC.
- Lea los resultados. MIC se mide como la zona de inhibición que interseca la tira de prueba de antibióticos calificada en cada tira de prueba E respectiva(Figura 3 C,F).
- Para determinar la sinergia, se utiliza la fórmula para la concentracióninhibitoriafraccionaria (FIC) ( Ecuación 1 ).

Figura 3: Detección de sinergismo - prueba no cruzada. Resultados de las pruebas de sinergia antimicrobiana de MIC de penicilina G y gentamicina en Streptococcus grupo G. A) Tira de gentamicina (8 g/ml centrada) sobre la bacteria Streptococcus group G, B) Extirpación de la tira de gentamicina, C ) Tira combinada de gentamicina/penicilina G (0,094 g/ml centrada) sobre bacterias Streptococcus grupo G, D) Tira G de penicilina (0,094 g/ml centrada), E) Eliminación de la tira de penicilina G, F) Penicilina combinada G / tira de gentamicina (8 g/ml centrada) encima de la bacteria Streptococcus grupo G. Haga clic aquí para ver una versión más grande de esta figura.
2. Pruebas de caldo
-
Configuración
- Use guantes y un abrigo de laboratorio
- Preparar el espacio de trabajo esterilizando con 70% de etanol
- Recoger caldo MH de 15 ml con 50% de sangre de caballo lysed y 20 mg/mL-NAD (MH-F)
-
(Opcional) Realizar una prueba E [Protocolo 1] para determinar el MIC en medio sólido
- Si bien es opcional, estos conocimientos permitirán un mejor diseño experimental (por ejemplo, las concentraciones de antibióticos añadidos se pueden diseñar para rodear el valor MIC determinado a partir de la placa), mejorando las posibilidades de un experimento exitoso.
-
Preparación de un inóculo bacteriano. Como se indicó anteriormente, la concentración bacteriana puede estimarse mediante mediciones de OD nm o normas de turbidez de McFarland
-
OD600 nm Método
- Obtener una suspensión bacteriana con una concentración bacteriana establecida
- Diluir el cultivo en caldo MH-F para lograr un OD600 de 0.003
-
Método de turbidez de McFarland
- Poner 15 ml de caldo MH-F en un tubo estéril.
- Inocular el caldo MH-F con bacterias (desde un plato) hasta un nivel mcFarland. Vortex la solución vigorosamente. Vierta la solución en un plato estéril de Petri.
-
OD600 nm Método
-
Preparación de antibióticos
- Determinar la concentración de antibióticos deseados
- Identificar el valor MIC a partir de la prueba E- (por ejemplo, 0,125 g/ml para la penicilina G y 8 g/ml para la gentamicina)
- Multiplique el valor MIC de la placa de agar por 24-27, correspondiente a cuatro-siete 2x diluciones en serie. Esta será la concentración inicial de antibióticos. (por ejemplo, para la penicilina G, siete 2x diluciones en serie: 0,125 g/ml x 27 x 16 g/mL; para la gentamicina, cuatro diluciones en serie 2x 8 g/ml x 2x 128 g/ml
- Multiplicar el valor inicial deseado 100x para determinar generar una concentración en stock de los antibióticos (por ejemplo, existencias de 1,6 mg/ml de penicilina G y 12,8 mg/ml de gentamicina)
- Preparar una concentración de 100 x reservas de antibióticos en consecuencia
- Disolver los antibióticos en agua autoclave de 10 ml y vórtice para generar una solución en stock (por ejemplo, 16 mg de penicilina G y 128 mg de gentamicina para crear las existencias anteriores)
- Determinar la concentración de antibióticos deseados
-
Añadir bacterias a los pozos de microplacas
- Aliquot 200 l caldo MH-F que contiene bacterias inóculo a los pozos en las primeras 3 filas de una placa microtíter de 96 pocillos para un experimento en triplicado.
-
Añadir antibióticos a los pozos de microplacas
- Añadir 200 l de caldo MH-F extra con bacterias a la primera columna de pozos (A1, B1, C1) para llevar el volumen total a 400 l.
- Añadir 4 l de la concentración de antibióticos a la primera columna de pozos. Dado que la muestra contiene 400 l, dará lugar a una dilución 100x de los antibióticos.
- Genere una dilución en serie 2x transfiriendo bacterias/antibióticos de 200 l de A1 a A2, hasta A11. Pipet a la fuerza entre las diluciones. Repita el paso para filas adicionales.
- Retire 200 l de la columna 11 para que el volumen final en todos los pozos sea de 200 l.
- Deje la última columna (A12, B12, C12) sin antibióticos, como controles.
-
Determinar los valores MIC
- Incubar la placa microtíter de 96 pocillos durante 24 horas a 37oC sin agitar.
- El valor MIC se define como el último pozo de la serie de dilución que no presenta crecimiento visible de bacterias(Figura 4). Este valor, sin embargo, solo se puede confiar si el tamaño del inóculo original era correcto.

Figura 4: Determinación de MIC por dilución de caldo. MIC se define aquí como el último pozo que exhibe claridad (sin crecimiento de bacterias) antes de que cambie la turbidez. Fila son duplicados del valor MIC de penicilina G y fila son duplicados del valor MIC de gentamicina, ambos frente a un aislado de Streptococcus grupo G. A) resultado experimental real, B) interpretación esquemática de los valores de A ( gris- sin crecimiento; blanco- crecimiento). Haga clic aquí para ver una versión más grande de esta figura.
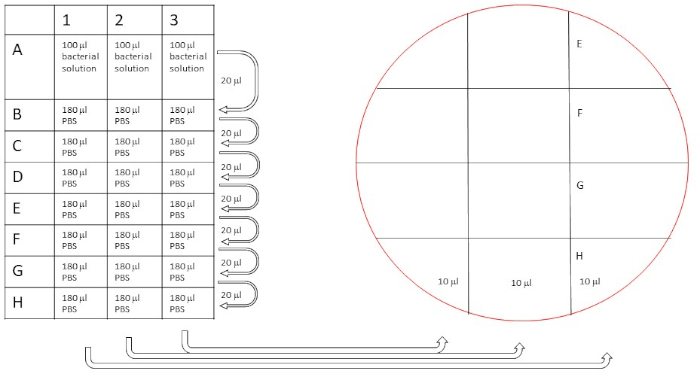
Figura 5: Procedimiento esquemático de la serie de dilución para contar la concentración de bacterias originales. Las diluciones se realizaron como se describe (20 l diluidos en 180 l para una serie de dilución de 10x), y luego 10 l de las filas A-H se chapan en dos placas de agar sanguíneo separadas como se indica. Haga clic aquí para ver una versión más grande de esta figura.
-
Determinar el tamaño original del inóculo
NOTA: Los ensayos de microbroth son muy sensibles para el tamaño original del inóculo utilizado. Un tamaño excesivo de inóculo dará un resultado falso positivo, ya que los antibióticos añadidos no serán capaces de inhibir el crecimiento por más tiempo en esa proporción. Por lo tanto, es fundamental verificar cuántas bacterias se han añadido a los micropozos. Si bien los datos no estarán disponibles en el punto del experimento (debido a la necesidad de 24 horas de incubación) servirá naseado como control. Si el número de bacterias añadidas está dentro del rango de concentración indicado, se puede confiar en los valores MIC. Si el inóculo era demasiado alto o demasiado bajo, el experimento debe repetirse.-
Diluir en serie las bacterias
- Preparar una placa microtíter de 96 pocillos para diluir la concentración bacteriana original con el fin de determinar el tamaño del inóculo. El óptimo es un volumen de 200 l con 105-6 bacterias. Para realizar las diluciones, primero alícuota 180 l PBS estéril a cada pocto en B-H (en triplicado 1-3).
- A continuación, añadir 100 l de solución bacteriana a A (en triplicado 1-3).
- Generar una dilución en serie de 10x (en triplicado) transfiriendo 20 l de bacterias de A a B, pipeteo vigorosamente. Repita los pasos para C-H.
-
Placa las diluciones bacterianas para la determinación del tamaño del inóculo
- Marque las placas de agar de sangre de acuerdo con la Figura 5.
- Transfiera 10 l de la dilución en serie a la placa de acuerdo con la figura 5.
- Incubar la placa a 37oC durante 20-24 horas.
-
Determinar el tamaño del inóculo bacteriano
- Contar números bacterianos en manchas dentro de 5-50 colonias(Figura 6).
- Calcular el tamaño inicial del inóculo calculando la media de las muestras triplicadas, multiplicar por el factor de dilución (por ejemplo, 10x para muestras B, 100x para muestras C, 1000x para muestras D, etc.) y luego por 100 para compensar el volumen de detección de 10 sL, lo que resulta en el tamaño del inóculo en cfu/ml. Si el inóculo está dentro de 105-6 cfu/mL los datos MIC pueden ser de confianza.
-
Diluir en serie las bacterias
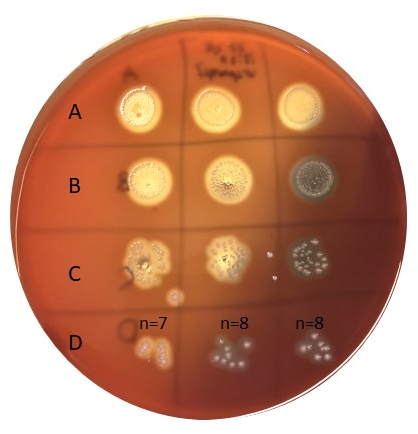
Figura 6: Determinación del tamaño del inóculo. Las bacterias inoculadas según la figura 5 fueron incubadas durante 20-24 horas a 37oC y luego contadas. La fila D tiene un buen número de colonias que contar (por ejemplo, 5-50). Las muestras en A no se diluyen, B se diluye 10x, C se diluye 100x, y D se diluye 1000x, y sólo 10 l se chapa en cada punto. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Valores MIC en la prueba E
Los valores individuales de MIC se identificaron en la Figura 1 como 0,094 g/ml para la penicilina G y 8 g/ml para la gentamicina. Para las pruebas de sinergia, ambas demostraron un valor MIC para la penicilina G de 0,064 g/ml(Figuras 2, 3),mientras que la gentamicina tenía un MIC de 4 g/ml para pruebas cruzadas y no cruzadas. Tenga en cuenta que puede producirse una ligera discrepancia entre las pruebas cruzadas y no cruzadas debido a los diferentes tiempos de incubación de las tiras en los dos ajustes.
Cálculo de la sinergia
La ecuación para FIC es:
 1.18 >0.5 (sin sinergia)
1.18 >0.5 (sin sinergia)
Determinación de MIC en caldo
La nubosidad de los pozos indicaba crecimiento bacteriano, y por lo tanto no se produjo ninguna inhibición. El primer pozo claro con penicilina G(Figura 4) contenía 0,12 g/ml de penicilina G, y por lo tanto este era el valor MIC. En el caso de la gentamicina, el primer pozo transparente estuvo presente a 8 g/ml de gentamicina. El valor de la penicilina G fue ligeramente superior al de la utilización de una prueba E, debido a la mayor resolución de la tira (por ejemplo, basada en una dilución en serie de factor 1.5x, no en un factor 2x).
Tamaño del inóculo
Para determinar el tamaño del inóculo, se utilizó un enfoque como se describe en las figuras 5 y 6. Las colonias se contaron en la fila D (dilución de 1000x), sumando hasta 7, 8 y 8 en la serie de triplicados con un valor medio de 7,67 cfu. El número de colonias nebadas para ser multiplicado con el factor de dilución (por ejemplo, 1000x), así como con 100 para obtener cfu/ml, dando un tamaño de inóculo de aproximadamente 8 x 105, bien dentro del tamaño de inóculo objetivo de 105-6 cfu/ml.
Aplicación y resumen
La resistencia a los antibióticos es un problema de salud mundial. Con el fin de determinar los mecanismos de resistencia de los microbios, los métodos de prueba de sinergia y antagonismo con diferentes antibióticos es crucial. El método de prueba E es rápido, fácil de replicar y se puede utilizar para investigar cualquier potencial sinérgico de las terapias combinadas. El método de dilución del caldo también se puede evaluar para predecir la actividad bactericida. Con el fin de investigar los mecanismos de resistencia de diferentes microbios, el conocimiento de las interacciones sinérgicas y antagónicas de antibióticos es crucial. La combinación de antibióticos puede ser una estrategia para aumentar la eficacia del tratamiento y enfrentar la resistencia a los antibióticos. En las pruebas realizadas aquí, pudimos determinar los valores MIC de penicilina G y gentamicina para el grupo G Streptococcus. También demostramos que los dos antibióticos no muestran efectos sinérgicos, por lo que no sería una opción de tratamiento preferida para tales infecciones.
Referencias
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
Saltar a...
Vídeos de esta colección:

Now Playing
Pruebas de susceptibilidad a los antibióticos: Pruebas con epsilometro para determinar los valores de la CMI de dos antibióticos y evaluar la sinergismos
Microbiology
93.6K Vistas

Creación de la columna de Winogradsky: Un método que sirve para enriquecer las especies microbianas en una muestra de sedimento
Microbiology
128.9K Vistas

Diluciones en serie y enchapado: enumeración microbiana
Microbiology
315.3K Vistas

Cultivos de enriquecimiento: Cultivo de bacterias aerobias y anaerobias en medios selectivos y diferenciales
Microbiology
132.0K Vistas

Cultivos puros y siembra por estrías: aislamiento de colonias bacterianas únicas de una muestra mixta
Microbiology
166.0K Vistas

Secuenciación del ARNr 16s: Una técnica basada en PCR para identificar especies bacterianas
Microbiology
188.5K Vistas

Curvas de crecimiento: Generación de curvas de crecimiento utilizando unidades formadoras de colonias y mediciones de densidad óptica
Microbiology
294.8K Vistas

Microscopía y tinción: Tinción de Gram, cápsula y endosporas
Microbiology
362.9K Vistas

Ensayo de placa: Un método para determinar los títulos virales como unidades formadoras de placas (UFP)
Microbiology
186.0K Vistas

Transformación de células E. coli mediante un procedimiento con cloruro de calcio
Microbiology
86.6K Vistas

Conjugación: Un método para transferir resistencia a ampicilina de un donante a una E. Coli receptora
Microbiology
38.2K Vistas

Transducción de fagos: Un método para transferir resistencia a ampicilina de un donante una E. coli receptora
Microbiology
29.0K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados