Method Article
Entwicklung eines Rattenmodells für die bipolare Störung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In diesem Artikel wird ein Protokoll für die Induktion eines einzigartigen Rattenmodells der bipolaren Störung vorgestellt, das sowohl manieartiges als auch depressives Verhalten erfasst.
Zusammenfassung
Die bipolare Störung ist eine psychische Erkrankung, die durch extreme Stimmungsschwankungen gekennzeichnet ist, einschließlich Perioden emotionaler Höhen (Manie) und Tiefs (Depression). Während die genaue zugrunde liegende Neurobiologie noch nicht vollständig verstanden ist, scheinen Ungleichgewichte in den Neurotransmittersystemen, insbesondere Dopamin, eine zentrale Rolle zu spielen. Aus diesem Grund wurden Manipulationen dopaminerger Signalwege verwendet, um Manie oder Depression bei Nagetieren zu modellieren. Modelle, die den typischen Wechsel zwischen diesen beiden Episoden genau darstellen, sind jedoch selten, was die Gesichtsvalidität einschränkt. In einem einzigartigen Modell werden moderne Techniken verwendet, um die Dopamin-D1-Rezeptorexpression vorübergehend zu erhöhen, was mit der Pathologie der bipolaren Störung in Verbindung gebracht wird. Ein Tetracyclin-induzierbares lentivirales Konstrukt, das den Dopamin-D1-Rezeptor unter der Kontrolle des Calmodulinkinase-II-alpha-Promotors exprimiert, wird stereotaktisch in den medialen präfrontalen Kortex erwachsener Ratten injiziert. Die Überexpression des Dopamin-D1-Rezeptors wird durch Zugabe des Tetracyclin-Analogons Doxycyclin zum Trinkwasser der Tiere erreicht, was zu einer Zunahme von belohnungsbezogenem, impulsivem und risikobereitem Verhalten und einer Abnahme von Angstzuständen führt. Diese Verhaltensweisen ähneln einem wahnsinnigen Phänotyp. Durch die Entfernung von Doxycyclin aus dem Trinkwasser kann ein depressiver Phänotyp, der durch erhöhte Hilflosigkeit und Anhedonie gekennzeichnet ist, bei ein und demselben Tier induziert werden. Dieser Artikel enthält ein Schritt-für-Schritt-Protokoll für die Durchführung der Operation sowie Verfahren zur Induktion des bipolaren störungsähnlichen Phänotyps. Darüber hinaus werden Überlegungen zur Bewertung von Verhaltensänderungen beschrieben, die mit manieartigem und depressivem Verhalten verbunden sind. Dieses vielversprechende Modell, das eine gute Konstrukt- und Gesichtsvalidität aufweist, bietet ein wertvolles Werkzeug, um die pathophysiologischen Mechanismen der bipolaren Störung weiter zu untersuchen.
Einleitung
Die bipolare Störung (BD) ist eine schwere Stimmungsstörung, von der etwa 1 % der Weltbevölkerung betroffen ist1. Sie ist gekennzeichnet durch Episoden extremer Stimmungen, Depressionen und Manie sowie euthymische Zustände. Die Symptome depressiver Episoden bei BD ähneln denen einer unipolaren Depression. Die Patienten zeigen ein vermindertes Interesse und eine verminderte Freude an Aktivitäten und Gefühle von Traurigkeit, Hoffnungslosigkeit und Wertlosigkeit. Darüber hinaus können häufig Veränderungen des Appetits, des Schlafverhaltens sowie kognitive Beeinträchtigungen beobachtet werden2. Manische Episoden sind gekennzeichnet durch abnormal erhöhte Stimmung, vermindertes Schlafbedürfnis, soziale Enthemmung, erhöhtes Selbstwertgefühl und Gefühle der Grandiosität sowie erhöhte Risikobereitschaft und Reizbarkeit2.
Die Ätiologie der Pathologie der BD scheint ein komplexes Zusammenspiel von genetischen und Entwicklungsfaktoren zu sein3, aber die genauen Mechanismen, die an ihrer Pathophysiologie beteiligt sind, sind noch nicht vollständig verstanden. Es wird angenommen, dass die Symptome durch ein Ungleichgewicht in den Neurotransmittersystemen entstehen4 und insbesondere Studien, die sich auf das Dopaminsystem konzentrieren, waren einflussreich5. Zum Beispiel postulierten Berk et al.6 die Dopamin-Hypothese und gingen davon aus, dass ein hyperdopaminerger Zustand der Manie zugrunde liegt, während Depression aus Hypodopaminergie entsteht. Seitdem haben Beweise aus Tiermodellen sowie pharmakologischen und bildgebenden Studien starke Unterstützung für einen Zusammenhang zwischen manischen Symptomen und Hyperdopaminergie gefunden. Auch ein Zusammenhang zwischen verminderter dopaminerger Signalgebung und depressiven Episoden konnte gefunden werden, wenn auch in geringerem Maße7. Darüber hinaus haben Ergebnisse aus genetischen Untersuchungen die Idee einer Dopamin-Hypothese von BD8 verstärkt.
Um die Rolle des Dopaminsystems bei BD weiter zu beleuchten, können Tiermodelle verwendet werden, um die neurobiologischen Mechanismen zu untersuchen, die den Symptomen zugrunde liegen. Anwendungen und Grenzen von Krankheitsmodellen werden häufig auf der Grundlage von drei Validierungskriterien bewertet, die ursprünglich von Willnervorgeschlagen wurden 9. Dazu gehören Gesichts-, Konstrukt- und prädiktive Validität. Die Gesichtsvalidität beschreibt die Fähigkeit des Modells, die Verhaltensmerkmale der Störung nachzuahmen. Die Konstruktvalidität ist erreicht, wenn die Pathophysiologie und Ätiologie der Störung die Grundlage des Modells sind, während die prädiktive Validität impliziert, dass die pharmakologische Behandlung der Störung innerhalb des Modells reproduziert werden kann.
Bisher haben verschiedene Nagetiermodelle zum Verständnis von BDbeigetragen 10 und umfassen ein breites Spektrum an genetischen Modifikationen, pharmazeutischen Eingriffen sowie Umweltmanipulationen11.
Experimentelle Manipulationen des Clock-Gens haben z.B. gezeigt, dass sie bei Mäusen einen manieähnlichen Phänotyp induzieren. Der Transkriptionsfaktor CLOCK spielt eine wichtige Rolle bei der Regulierung des zirkadianen Rhythmus, und genetisch veränderte Mäuse, die ein Protein exprimieren, das die Clock-Transkription nicht aktivieren kann, zeichnen sich durch Hyperaktivität und erhöhte Belohnungsreaktionen aus12. Der resultierende Phänotyp scheint durch differentiell regulierte Gene für dopaminerge Signale im ventralen tegmentalen Bereich des Gehirns vermittelt zu werden13.
Es wurde gezeigt, dass die direkte Beeinflussung der Dopamin-Signalübertragung durch die Verabreichung von Dopamin-steigernden Medikamenten, wie dem Psychostimulans Amphetamin, eine Hyperlokomotion induziert, und der anschließende Entzug wurde mit depressiven Symptomen, einschließlich Anhedonie, in Verbindung gebracht14. Es wurde ebenfalls gezeigt, dass pharmakologische Herausforderungen mit Ketamin oder dem Dopamin-D2/D3-Rezeptoragonisten Quinpirol ein für BD relevantes Verhalten induzieren15,16.
Zusätzlich zu pharmakologischen Interventionen können Manipulationen der Umgebung, wie z. B. Schlafentzug, eingesetzt werden, um Verhaltensphänotypen zu induzieren, die für BDrelevant sind 17. Tiere mit Schlafentzug zeigen einen wahnsinnigen Phänotyp, der durch eine erhöhte Fortbewegung und die Emission von Ultraschalllauten gekennzeichnet ist, die mit Veränderungen der Dopamin-Signalübertragung verbunden sind18.
Es gibt zahlreiche andere Nagetiermodelle, um depressives19 - oder manieähnliches20-Verhalten zu untersuchen. Obwohl alle diese Modelle stark zum Verständnis der BD-Pathologie beigetragen haben, sind sie durch die Untersuchung von jeweils nur einer Episode oder kurzfristigen Effekten eingeschränkt. Im Gegensatz dazu war es schwierig, den charakteristischen Wechsel zwischen affektiven Zuständen zu modellieren.
Hier wird ein Protokoll für ein einzigartiges Rattenmodell für BD vorgestellt. Es zeigt eine erhöhte Gesichtsvalidität, indem beide Episoden bei einem Tier durch eine einzige gezielte Manipulation des Dopaminsystems induziert werden, d.h. durch bedingte Überexpression des Dopamin-D1-Rezeptors (DRD1) im medialen präfrontalen Kortex (mPFC) aus einem Tetracyclin-induzierbaren lentiviralen Konstrukt. Durch die Steuerung der Gentranskription unter der Kontrolle des Calmodulinkinase II alpha (CamKIIa)-Promotors wird DRD1 hauptsächlich in glutamatergen Neuronen exprimiert, wodurch die Spezifität der genetischen Manipulation erhöht wird.
Das ursprüngliche Lentivirus-Rückgrat pRRL.cPPT.WPRE.Sin wurde von Dr. Didier Trono (Ecole Polytechnique Fédérale de Lausanne, Schweiz)21 zur Verfügung gestellt und modifiziert, indem das GFP-Minigen durch eine Polylinkerstelle (Lentivirus-Vektor PL13) ersetzt wurde. PL13 wurde dann verwendet, um PL13.pTRE2.DRD1.CamKIIa.rtTA3 oder PL13.pTRE2.dsRedExpress.CamKIIa.rtTA3 zu erzeugen. Die cDNA von Ratten-DRD1 wurde von Dr. David Sibley (NINDS/NIH)22 und die cDNA des reversen Tetracyclin-kontrollierten Aktivators 3 (rtTA3) von Dr. Atze Das und Dr. Ben Berkhout (Akademisches Medizinisches Zentrum, Universität Amsterdam)23 gewonnen. Die CamKIIa-Promotor-DNA wurde von Dr. Karl Deisseroth (Stanford University, CA) zur Verfügung gestellt, und die dsRedExpress- und die Tetracyclin-Response-Element 2 (pTRE2)-Sequenzen wurden von den hauseigenen Plasmiden pcDNA3.1-dsRedExpress bzw. pcDNA3.1-pTRE2 subkloniert. Virale Vektoren wurden durch Subklonierung von PCR-amplifizierten DNA-Sequenzen erzeugt, die von Restriktionsstellen flankiert wurden.
Das Modell, das diesen viralen Vektor verwendet, hat gezeigt, dass die Überexpression von DRD1 in mPFC CamKIIa-positiven Neuronen zu einem manieähnlichen Phänotyp führt24,25, während die anschließende Herunterregulierung der Genexpression depressives Verhalten induziert26. Da der krankheitsähnliche Phänotyp bei einem Tier wiederholt induziert werden kann27, spiegelt das Modell ein hohes Maß an Gesichtsvalidität wider. Darüber hinaus haben Manipulationen des Dopaminsystems eine starke Konstruktvalidität für Tiermodelle von BD7, da Veränderungen der DRD1-Spiegel28,29 oder der DRD1-Polymorphismen mit der BD-Pathologie in Verbindung gebracht wurden 30,31,32.
Auch andere Tierversuche haben zu einem besseren Verständnis der Funktionen der präfrontalen DRD1 geführt. Zum Beispiel war eine Abnahme von DRD1 ein konsistenter Befund in Modellen der Depression33,34, während die optogenetische Stimulation von DRD1 in mPFC-glutamatergen Neuronen Angstzustände reduziert und antidepressive Wirkungen induziert35. In einer kürzlich erschienenen Veröffentlichung von Wu et al.36 wurde die Rolle von mPFC DRD1 bei affektiven Zustandsübergängen nachgewiesen. Diese Studie zeigt, dass diese Rezeptoren entscheidend für die zugrunde liegenden Veränderungen der exzitatorischen Synapsenplastizität sind.
Insgesamt stellt die Verwendung eines Rattenmodells von BD, das aus einer gezielten und bedingten Manipulation von DRD1 in CamKIIa-positiven Neuronen des mPFC besteht, ein Modellsystem mit hoher Konstrukt- und Gesichtsvalidität dar und weist daher ein starkes Potenzial für die translationale Forschung an BD auf.
Im Folgenden werden chirurgische Vorgehensweisen zur Modellgenerierung beschrieben. Darüber hinaus werden methodische Überlegungen zur Modellinduktion und Verhaltensbewertung neben repräsentativen Ergebnissen des resultierenden krankheitsähnlichen Phänotyps vorgestellt. Mögliche Hemmnisse und Einflussfaktoren bei der Modellgenerierung und Verhaltensbewertung werden diskutiert und ein Ausblick auf die zukünftige Ausrichtung gegeben.
Protokoll
Das hier beschriebene Protokoll zur stereotaktischen Injektion ist vom LANUV (Landesamt für Natur, Umwelt und Verbraucherschutz, Nordrhein-Westfalen, Deutschland) zugelassen. Es wurden adulte männliche Sprague-Dawley-Ratten (350-650 g Körpergewicht) verwendet. Die in dieser Studie verwendeten Reagenzien und Geräte sind in der Materialtabelle aufgeführt.
1. Die lentiviralen Konstrukte
HINWEIS: Ein lentivirales System der dritten Generation wird für die bedingte Expression von DRD1 oder rot fluoreszierendem Protein (dsRed) als Kontrollbedingung verwendet 25,27.
- Herstellung des Lentivirus auf der Grundlage des Protokolls von Stewart et al.37 mit den Verpackungsplasmiden 8454 und 8455 aus dem Addgene-Repository.
HINWEIS: Wenn die Virusproduktion nicht eigenständig geplant wird, stellen viele Kerneinrichtungen Lentiviren mit hohem Titer zur Verfügung, wie z. B. die Charité Berlin, Deutschland. - Titern Sie konzentrierte Viren und lagern Sie sie bei -80 °C.
- Bereiten Sie 2 × 107 Transducing Units (TU) pro μl für die Injektion vor.
- Transportieren Sie Viren auf Trockeneis in den Operationssaal.
2. Tiere
HINWEIS: Das Rattenmodell für BD wurde bei erwachsenen männlichen Sprague Dawley-Ratten (350-650 g Körpergewicht) etabliert. Für die Untersuchung von weiblichen Ratten oder früheren Entwicklungszeitpunkten ist es wichtig zu berücksichtigen, dass sich die Expression von DRD1 im mPFC während der Entwicklung ändert und durch den Östruszyklus beeinflusst werden kann 38,39,40.
- Ratten werden mit Tieren des gleichen Zustands unter konstanten Temperatur- und Feuchtigkeitsbedingungen (45%-65 % relative Luftfeuchtigkeit, Temperatur 22 °C ± 2 °C) paarweise mit Futter und Wasser ad libitum untergebracht.
- Halten Sie Ratten unter einem umgekehrten 12-stündigen Hell-Dunkel-Zyklus (Licht aus um 11 Uhr), da die Verhaltensuntersuchung während der aktiven Phase der Tiere im Dunkeln durchgeführt werden sollte.
- Geben Sie den Tieren mindestens sieben Tage Zeit, sich vor Beginn der Versuche an die Einrichtung und die Handhabung durch die Versuchsleiter zu gewöhnen.
3. Stereotaktische Injektion des viralen Konstrukts
HINWEIS: Führen Sie die Operation unter einer Sicherheitshaube (Vorsichtsmaßnahme für die Arbeit mit Lentiviren) und unter aseptischen Bedingungen durch.
- Präparat
- Stellen Sie sicher, dass alle erforderlichen Materialien verfügbar und funktionsfähig sind (Materialtabelle).
- Richten Sie den stereotaktischen Rahmen so ein, dass der Spritzenhalter am stereotaktischen Arm befestigt ist. Verbinden Sie den Spritzenhalter mit der Spritzenpumpe.
- Richten Sie den Zahnbohrer ein und montieren Sie einen 0,9 mm Fräser.
- Legen Sie das Heizkissen auf und stellen Sie es auf 37 °C ein. Heben Sie das Heizkissen auf eine geeignete Höhe an, um die Positionierung der Ratte zu erleichtern.
- Decken Sie das Heizkissen mit einem saugfähigen Tuch ab.
- Bereiten Sie autoklavierte chirurgische Instrumente auf einer sterilen Oberfläche vor.
- Montieren Sie eine stereotaktische 10-μl-Injektionsspritze mit einer 33-G-Injektionsnadel auf den Spritzenhalter.
- Entnahme von 2,3 μl Virussuspension für bilaterale Injektionen von je 1 μl. Bestätigen Sie visuell die erfolgreiche Abhebung. Stellen Sie sicher, dass Sie diesen Schritt als letzten vorbereitenden Schritt durchführen, um die Zeit zu minimieren, die das Lentivirus benötigt, um Raumtemperatur zu haben.
- Analgesie und Anästhesieeinleitung
- Am Morgen der Operation ist Meloxicam (1 mg/kg Körpergewicht, p.o.) zu verabreichen.
- Zwanzig Minuten vor Beginn der chirurgischen Eingriffe zur Analgesie injizieren Sie der Ratte Buprenorphin (0,5 mg/kg Körpergewicht, s.c.).
- Schalten Sie das Anästhesiegerät mit einem Sauerstofffluss von 0,8-1 L/min ein.
- Fluten Sie die Induktionskammer mit 4 % Isofluran und setzen Sie die Ratte in die Induktionskammer.
- Nach erfolgreicher Einleitung der Anästhesie, die sich durch verlangsamte Atmung und Bewusstlosigkeit bemerkbar macht, nehmen Sie die Ratte aus der Induktionskammer und bringen Sie sie in den stereotaktischen Rahmen.
- Positionierung der Ratte
- Stellen Sie sicher, dass der Anästhesiefluss auf die Nasenmaske umgeschaltet ist.
- Übertragen Sie die Ratte aus der Induktionskammer in den stereotaktischen Rahmen und setzen Sie ihre Vorderzähne in die Halterung.
- Legen Sie die Anästhesiemaske richtig über die Nase und drehen Sie das Isofluran zur Aufrechterhaltung auf 1,5-2,3%.
- Schützen Sie die Augen mit steriler Augencreme.
- Mindestens 10 Minuten vor dem Einschnitt ist der Ratte Lidocain (10 mg/kg Körpergewicht, s.c.) direkt unterhalb der geplanten Inzisionsstelle zu injizieren.
- Sichern Sie die Ratte mit Ohrstangen im stereotaktischen Rahmen. Stellen Sie sicher, dass die Ohrbügel gleichmäßig und in einer waagerechten Kopfposition sind.
- Schneiden Sie das Fell mit einer Schere um die Schnittstelle herum. Entfernen Sie die Fellstücke mit einem Zellulosepad, das mit einem Hautantiseptikum angefeuchtet ist.
- Desinfizieren Sie das Operationsfeld mit einem Hautantiseptikum.
- Kraniotomie und Injektion eines viralen Konstrukts
- Stellen Sie eine ordnungsgemäße Anästhesie sicher, indem Sie überprüfen, ob kein Zehenreflex vorhanden ist.
- Desinfizieren Sie die Hände und wechseln Sie zu sterilen Handschuhen, bevor Sie Geräte berühren.
- Machen Sie einen kleinen medialen Schnitt (~1,5 cm) mit einer Skalpellklinge.
- Sichern Sie den Zugang zum Operationsfeld, indem Sie die Haut mit Bulldoggenklemmen an die Seiten schieben.
- Reinigen Sie das Operationsfeld mit sterilen Swaps von Blut und Geweberesten. Stellen Sie sicher, dass das Bregma richtig sieht und genügend Platz im Frontzahnbereich vorhanden ist.
- Setzen Sie die A/P- und M/L-Koordinate basierend auf dem Bregma auf Null.
- Bewegen Sie den stereotaktischen Arm auf die Koordinaten A/P + 2,7 und M/L ± 0,4 und visualisieren Sie mit einem desinfizierten Bleistift.
- Bohren Sie ein Loch mit einem Durchmesser von ~1 mm, das die Injektionsseiten für beide Halbkugeln abdeckt.
- Entferne jegliches Blut mit einem sterilen Swap.
- Stellen Sie die D/V-Koordinaten an der Oberfläche des Gehirns auf Null und senken Sie die Injektionsnadel langsam auf -2,8 ab, um in den prälimbischen Bereich des mPFC zu injizieren.
- Warten Sie 5 Minuten, um eine Entspannung des Gewebes zu ermöglichen.
- Injizieren Sie 1 μl Virussuspension mit einer Geschwindigkeit von 0,1 μl/min.
- Warten Sie 5 Minuten für die Absorption, bevor Sie die Nadel langsam entfernen.
- Wiederholen Sie die Injektion in die andere Hemisphäre.
- Verschluss und postoperative Betreuung
- Entferne die Nadel und verschließe die Öffnung im Schädel mit Knochenwachs.
- Entfernen Sie die Bulldog-Klemmen und vernähen Sie die Haut (3-0 chirurgische Naht).
- Injizieren Sie der Ratte Meloxicam (1 mg/kg, s.c.) zur postoperativen Analgesie.
- Schalten Sie die Anästhesie aus, nehmen Sie das Tier aus dem stereotaktischen Rahmen und setzen Sie es in seinen Heimkäfig. Stellen Sie sicher, dass die Ratte vollständig aufwacht.
- Spülen Sie die Spritze mit 100 % Ethanol, um das verbleibende Lentivirus zu deaktivieren, gefolgt von destilliertem H2O zur Vorbereitung der nächsten Injektion.
- Führen Sie eine postoperative Analgesie mit Meloxicam (1 mg/kg, p.o.) alle 24 Stunden über 3 Tage durch und beurteilen Sie den Gesundheitszustand der Tiere für 1 Woche.
- Einzelne Haustiere für die ersten 24 Stunden nach der Operation, um zu verhindern, dass andere die Nähte manipulieren. Setzen Sie sie danach wieder zu ihren Käfiggenossen zurück.
4. Doxycyclin-Behandlung zur Modellinduktion
HINWEIS: Beginnen Sie mit der Modelleinweisung frühestens 24 Stunden nach der Injektion. Man kann auch längere Zeiträume von bis zu mehreren Monaten zwischen Injektion und Einleitung warten, um z.B. größere Kohorten von Tieren gleichzeitig zu testen. Es hat sich gezeigt, dass dies die Funktionalität des viralen Konstrukts nicht beeinflusst.
- Einleitung einer wahnsinnigen Episode
- Um einen manieähnlichen Phänotyp zu induzieren, geben Sie den Tieren 0,5 g/l Doxycyclinhyclat, indem Sie es dem Trinkwasser hinzufügen. Dies induziert die virale Transkription und die Überexpression von zusätzlichem DRD1.
- Bereiten Sie das doxycyclinhaltige Wasser alle 48 bis 72 h frisch zu, eine Zeitspanne, in der die Stabilität von Doxycyclin auch in nicht undurchsichtigen Wasserflaschen nicht beeinflusst wird41.
HINWEIS: Nach einer siebentägigen Behandlung mit Doxycyclin hat die virusvermittelte Überexpression ihr Maximum erreicht, und man kann während der manieähnlichen Episode eine Verhaltensuntersuchung durchführen.
- Induktion einer depressiven Episode
- Stellen Sie die Tiere wieder auf normales Trinkwasser um, um eine depressive Episode auszulösen.
- Warten Sie 4 Tage, bis die virale Transkription gestoppt wurde, und führen Sie dann eine Verhaltensbewertung der depressiven Episode durch.
- Führen Sie nachfolgende Episodeneinleitungen nach dem gleichen Muster durch.
5. Verhaltensbewertung
HINWEIS: Nach der Modellinduktion kann man bipolares Verhalten beurteilen. Es wurden verschiedene Rahmenbedingungen für die Übersetzung von klinischen Symptomen zu Verhaltensmustern vorgeschlagen, die bei Nagetieren beobachtet werden können. Eines der einflussreichsten ist das Forschungsbereichskriterium42, in dem Veränderungen in Funktions- und Verhaltensbereichen, die möglicherweise bei psychiatrischen Störungen betroffen sind, untersucht werden. Es ist jedoch wichtig zu beachten, dass aufgrund der Artenbarriere einige Symptome, z. B. Suizidalität, bei Nagetieren nicht untersucht werdenkönnen 43. Aufgrund ihrer fortgeschrittenen kognitiven und emotionalen Fähigkeiten haben Rattenmodelle ein besonders großes Potenzial für die translationale Symptombewertung44, was aufwändigere Testverfahren ermöglicht. Überlegungen zur Verhaltensbewertung sind in Tabelle 1 beschrieben.
- Planen Sie die Verhaltensuntersuchung als eine Reihe von Verhaltenstests45, um ein umfassendes Bild des resultierenden Phänotyps zu erhalten.
- Achten Sie darauf, dass Sie zuletzt invasivere Tests durchführen.
- Berücksichtigen Sie Verhaltensänderungen, die möglicherweise aus früheren Testerfahrungen resultieren, wenn Sie versuchen, ein Tier in beiden krankheitsähnlichen Episoden zu testen.
HINWEIS: Abhängig von der Fragestellung kann es von Vorteil sein, verschiedene Gruppen von Ratten entweder während der Manie- oder der depressiven Episode zu testen, was auch eine Gewebeentnahme während der jeweiligen Episode ermöglicht. Die Erfahrung hat gezeigt, dass das Testen von verhaltensnaiven Tieren bei bestimmten Verhaltenstests zu einem ausgeprägteren Phänotyp führen kann. - Berücksichtigen Sie auch andere Faktoren, wie z. B. die Wohnbedingungen46 oder das Geschlecht des Experimentators47.
- Ergreifen Sie alle möglichen Maßnahmen, um unbeabsichtigten Stress für die Tiere zu reduzieren, nicht nur zum Wohle der Tiere, sondern auch, um mögliche Wechselwirkungen psychiatrischer Phänotypen mit Stress auszuschließen48.
- Achten Sie besonders auf den zirkadianen Rhythmus, da Störungen des zirkadianen Rhythmus ein Symptom von BD17 sind. Da Ratten in der Dämmerung und im Morgengrauen am aktivsten sind, sollte man unter schwachem rotem Licht mit Tieren testen, die unter einem inversen Hell-Dunkel-Zyklus gehalten wurden49.
HINWEIS: Die meisten der hier vorgestellten repräsentativen Ergebnisse wurden nach diesem Ansatz erhoben. Ein krankheitsähnlicher Phänotyp ist jedoch immer noch beobachtbar, wenn die Verhaltensbewertung durchgeführt wird, ohne den Tag-Nacht-Zyklus der Tiere umzuschalten27. - Registrieren Sie den Versuch immer vor und führen Sie ihn gemäß den Richtlinien von PREPARE50 und ARRIVE51 durch und beschreiben Sie diese.
Ergebnisse
Wenn Doxycyclin dem Trinkwasser der Tiere zugesetzt wird, wird zusätzliches DRD1 exprimiert, und nach 7 Tagen kommt es zu einer ausreichenden Überexpression, um das Tier auf manieähnliches Verhalten zu testen. Bisher wurde eine Zunahme von belohnungsbezogenen Verhaltensweisen nachgewiesen. Manienähnliche Tiere trinken im Vergleich zu Kontrollen mehr Saccharoselösung im Vergleich zu Wasser in einem Zwei-Flaschen-Auswahltest25. Wenn sie mit einem empfänglichen Weibchen in eine Beobachtungsbox gesteckt und 25 Minuten lang beobachtet wurden, zeigten maniaähnliche Tiere im Vergleich zu Kontrollen mehr sexuelle Reittiere27 (Abbildung 1A). In einem Paradigma der Kokain-Selbstverabreichung verabreichen sie mehr Kokain nach einem festen Verhältnis und weisen in einem progressiven Schema einen höheren Breakpoint auf. Ihre Dosis-Wirkungs-Kurve ist in Richtung einer höheren Empfindlichkeit gegenüber niedrigen Dosen verschoben25. Diese Verschiebung der Sensibilität wird auch in einer erhöhten motivationalen Salienz in mehreren Ortskonditionierungsparadigmen beobachtet. Mania-ähnliche Tiere verbrachten im Vergleich zu den Kontrollen mehr Zeit in den konditionierten Seiten für Nikotin, Alkohol und Kokain25. Eine erhöhte Suche nach Neuem und impulsivere Entscheidungen in einem T-Labyrinth-basierten Test zur verzögerten Diskontierung wurden ebenfalls festgestellt25. In einer operanten Rattenversion des Iowa Gambling Task entscheiden sich manieähnliche Tiere häufiger für die nachteiligen Entscheidungen (hohes Risiko, hoher Gewinn) im Vergleich zu Kontrollen24 (Abbildung 1B). Die Angst bei manieähnlichen Tieren ist reduziert, was durch mehr Zeit auf den offenen Armen im erhöhten Plus-Labyrinth25 angezeigt wird.
Ein depressiver Phänotyp kann durch Beendigung der DRD1-Überexpression induziert werden. In der depressiven Episode konnte eine Zunahme der Hilflosigkeit beobachtet werden. In einem triadischen Paradigma der Hilflosigkeit waren sowohl die Gruppe, die zum ersten Mal mit einem Elektroschock konfrontiert wurde (Abbildung 1C), als auch die Gruppe, die gelernt hatte, den Schock zu kontrollieren, hilfloser mit erhöhten Fluchtlatenzen im Vergleich zu ihrenjeweiligen Kontrollen. Die Gruppen, in denen Hilflosigkeit induziert wurde, zeigten keine Unterschiede zwischen dem Versuchs- und dem Kontrolltier. Anhedonie wurde im Zwei-Flaschen-Auswahltest für Saccharose27 und im Sexualverhalten (unveröffentlichte Daten) gefunden. Im Marmorvergrabungstest waren depressive Tiere auch ängstlicher26 (Abbildung 1D).
Das beschriebene Tiermodell bietet nicht nur die Möglichkeit, manisches oder depressives Verhalten zu untersuchen, sondern es bietet auch die einzigartige Möglichkeit, einen Verhaltenswechsel bei Beendigung der DRD1-Überexpression zu beobachten, der dem Wechsel von Manie zu Depression bei Patienten ähnelt. Hier ist es wichtig, die Gewöhnung an bestimmte Verhaltensweisen im Auge zu behalten und Tests mit minimaler Gewöhnung zu wählen. Zum Beispiel zeigte sich ein erhöhtes Sexualverhalten in der manischen Episode und in der depressiven Episode, eine Reduktion dieses Verhaltens auf ein Niveau, wie es bei Kontrolltieren beobachtet wurde. In diesem Experiment wurden drei manie-/depressive Zyklen innerhalb desselben Tieres induziert27. Beim Trinken von Saccharose war die Präferenz für die Saccharoselösung im manieähnlichen Zustand nicht nur auf ein Kontrollniveau reduziert, wenn in den depressiven Zustand umgeschaltet wurde, sondern verringerte sich27. In der Rattenversion der Iowa-Glücksspielaufgabe war die Anzahl der nachteiligen Auswahlmöglichkeiten bei manieähnlichen Tieren erhöht, unterschied sich jedoch nicht signifikant von den Kontrollen, wenn sich die Tiere im depressiven Zustand befanden. In letzterem Zustand war die Anzahl der insgesamt verdienten Pellets im Vergleich zu Kontrolltierenum 24 reduziert.
Insgesamt zeigen die Tiere einen robusten bipolaren Phänotyp, der in beiden Episoden in verschiedenen Verhaltensbereichen zu beobachten ist. Der Wechsel zwischen den Episoden in diesem Modell trägt zu einer verbesserten Gesichtsvalidität bei. Eine Übersicht über die betroffenen Verhaltensdomänen ist in Abbildung 2 dargestellt.
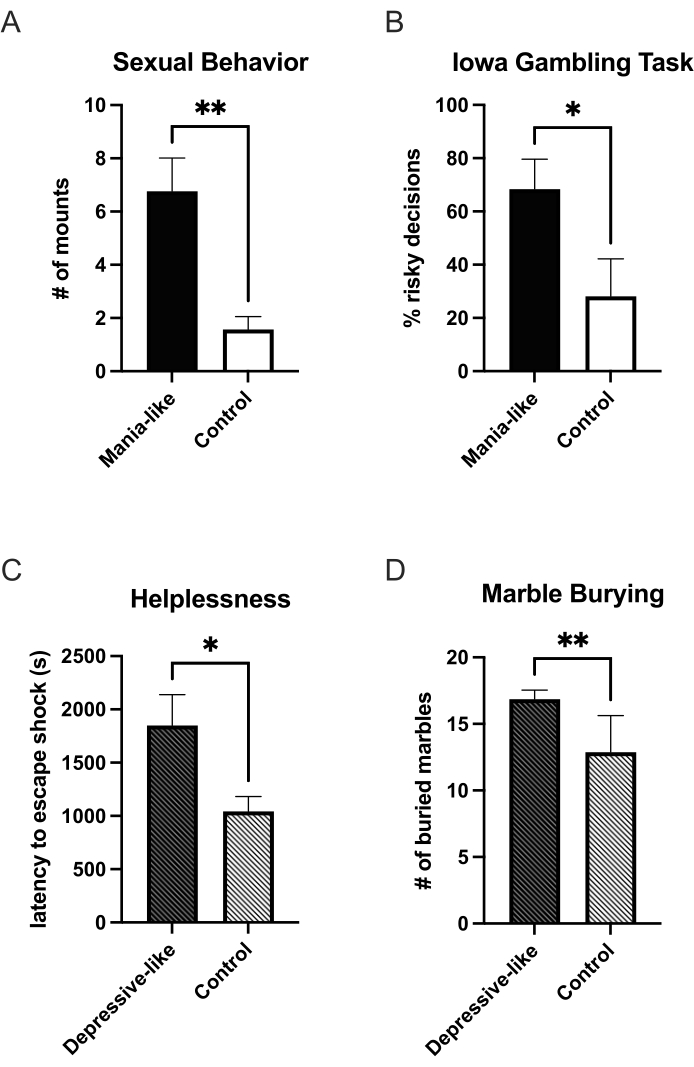
Abbildung 1: Verhaltensänderungen in manie- und depressionsähnlichen Zuständen nach viraler DRD1-Überexpression. Während der viralen DRD1-Überexpression zeigen die Tiere im manieähnlichen Zustand im Vergleich zu den Kontrollen mehr sexuelle Reittiere (A) und eine Zunahme riskanter Entscheidungen in der Iowa Gambling Task (B). Nach Beendigung der Überexpression wechseln die Tiere in einen depressiven Zustand. Sie zeigen eine Zunahme von Hilflosigkeit (C) und Angst (D). *p < 0,05; **p < 0,01; Fehlerbalken zeigen den Standardfehler des Mittelwerts an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Verhaltensphänotyp des Modells. In der Manie-ähnlichen Episode kommt es zu einer Zunahme von belohnungsbezogenen Verhaltensweisen (z. B. Sexualverhalten), Impulsivität und Risikobereitschaft. Die Angst wurde im Test mit erhöhtem Plus Labyrinth reduziert. Während der depressiven Episode war die Angst im Marmorvergrabungstest erhöht, das Sexualverhalten wurde reduziert und die Tiere zeigten mehr Hilflosigkeit. Das Bild der Ratte in der Abbildung stammt von Servier Medical Art und ist lizenziert unter CC BY 4.0. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Überlegungen zur Verhaltensbewertung. Die Tabelle zeigt wichtige Überlegungen zu den wichtigsten experimentellen Schritten während der Verhaltensbewertung. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
In dieser Arbeit wird ein neuartiges Rattenmodell für BD mit erhöhter Gesichtsvalidität vorgestellt. Eine gezielte Manipulation von DRD1 im mPFC ermöglicht die Induktion eines manischen und depressiven Phänotyps im selben Tier. Repräsentative Ergebnisse zeigen einen beobachtbaren krankheitsähnlichen Phänotyp in beiden Episoden. Das Modell ist relativ einfach anzuwenden. Es werden zwei induzierbare lentivirale Vektoren benötigt, die entweder DRD1 oder dsRed als Kontrolle exprimieren. Für die Herstellung und die Verwendung von lentiviralen Systemen bei Tieren sind bestimmte Sicherheitsniveaus erforderlich, die vorhanden sein müssen. Wenn die notwendige Ausrüstung für die Virusproduktion nicht zur Verfügung steht, sind die Erfahrungen mit den Core Facilities positiv.
Der wichtigste Schritt zur Generierung des Modells ist die stereotaktische Injektion des lentiviralen Systems. Stereotaktische Operationen sind in den Neurowissenschaften etablierte Verfahren, und die Erfolgsquoten bei geschulten Untersuchern sind hoch. Es gibt zwei mögliche Hauptfehlerquellen. Probleme mit der Anästhesie können während des chirurgischen Eingriffs zum Tod führen. Hier hat sich die Verwendung einer Isofluran-Inhalationsanästhesie, wie sie im Protokoll beschrieben ist, als bester Ansatz erwiesen, da die leicht einstellbaren Wirkstoffspiegel einen klaren Vorteil im Vergleich zur Injektionsanästhesie darstellen. Da Isofluran keine analgetische Wirkung hat und meningeale Nozizeptoren empfindlich auf Stimulationreagieren 52, wird empfohlen, ein Opioid zur intraoperativen Analgesie zu verwenden. In Kombination mit einer geeigneten postoperativen Medikation, wie im Protokoll beschrieben, gibt es keine beobachtbaren Anzeichen von postoperativen Schmerzen. Mögliche Einflüsse auf Forschungsfragen, z.B. im Hinblick auf Wechselwirkungen von Dopamin mit dem Opioidsystem, sollten jedoch immer in Betracht gezogen und ein entsprechendes Medikationsregime gewählt werden53. Wird die Operation unter aseptischen Bedingungen durchgeführt, kommt es selten zu Infektionen oder einer Beeinträchtigung der Wundheilung. Wenn während der Operation oder der Genesung Probleme auftreten, sollte sich die Fehlerbehebung auf die korrekte Ausführung des beschriebenen Protokolls konzentrieren. Die Sicherstellung aseptischer Arbeitsbedingungen und eine präzise Dosierung der Medikamente sind unerlässlich. Die Verabreichung von Flüssigkeit oder Glukoselösungen kann die Genesung zusätzlich unterstützen. Wenn Infektionen auftreten, sollte die Behandlung keine Tetracycline enthalten, da diese mit der Transkription der viralen Systeme interagieren. Die Erstlinienbehandlung für postoperative Wundinfektionen wäre Enrofloxacin, möglicherweise in Kombination mit Carprofen.
Eine weitere mögliche Fehlerquelle während der Operation ist die Platzierung der Injektion außerhalb des Zielbereichs. Dies ist jedoch selten der Fall, wenn das Protokoll korrekt befolgt wird und die korrekte Positionierung des Tierkopfes gewährleistet ist. Eine erfolgreiche Vermittlung sollte immer überprüft werden. Während die Platzierung des dsRed-exprimierenden Virus bei Kontrolltieren leicht nachweisbar ist, erfordert die Überprüfung der Platzierung von DRD1-exprimierenden Viren zusätzliche Schritte. Die Durchführung von Antikörperfärbungen gegen verschiedene Teile des viralen Konstrukts führte zu keinen zufriedenstellenden Ergebnissen. Es wird empfohlen, die Virusplatzierung durch Präparierung des mPFC und Durchführung einer PCR zum Nachweis von rtTA3-Transkripten zu überprüfen, wie in Beyer et al.24 beschrieben. Es ist auch wichtig zu beachten, dass die Injektion des Virus bilateral mit gleichen Virusmengen erfolgen sollte. Es hat sich gezeigt, dass sich die zerebrale und die verhaltensbezogene Lateralisierung bei Patienten mit bipolarer Störung unterscheiden54,55, und unilaterale Virusinjektionen induzieren möglicherweise nicht den gewünschten Verhaltensphänotyp.
Die Induktion der viralen DRD1-Expression und der manieähnlichen Episode durch Zugabe von Doxycyclin zum Trinkwasser funktioniert sehr gut. Die Substitution von normalem Trinkwasser durch Doxycyclin führt nachweislich nicht zu deutlichen Veränderungen des Trinkverhaltens. Der Flüssigkeitsverbrauch sollte jedoch überwacht werden. Modulationen sind möglich, wenn andere Substanzen, z.B. Medikamente, über das Trinkwasser verabreicht werden sollen. Die Verabreichung von Doxycyclin kann auch über Lebensmittelpellets erfolgen. Dies ist jedoch noch nicht validiert.
Für die Verhaltensuntersuchung sind in Tabelle 1 mehrere Überlegungen aufgeführt. Insbesondere modellspezifische Anforderungen müssen bei der Planung eines Experiments evaluiert werden. Zum Beispiel sollte entschieden werden, ob zwei Gruppen von Tieren getestet werden oder ob ein Tier während beider Episoden einer Verhaltensbeurteilung unterzogen wird, die möglicherweise einen erneuten Test erfordert. Wenn der bipolare Phänotyp während der Verhaltensuntersuchung nicht nachweisbar ist, obwohl die Platzierung verifiziert werden konnte, kann sich die Fehlerbehebung auf verschiedene Faktoren konzentrieren, die möglicherweise das Verhaltensergebnis beeinflussen. Veränderungen der Experimentatoren oder des zirkadianen Rhythmus sollten während des Prozesses kritisch bewertet werden, da stressige Bedingungen in der Umgebung die Verhaltensergebnisse beeinflussen können.
Während das Modell eine gute Konstrukt- und Gesichtsvalidität aufweist, muss die prädiktive Validität noch evaluiert werden. Die chronische Verabreichung von Lithium als Erstlinienbehandlung von BD56 sollte erfolgreich sein, um modellinduzierte Verhaltensänderungen zu verhindern. Reaktionen auf andere Medikamente, die bei BD verwendet werden, wie z. B. Antipsychotika oder Antikonvulsiva, könnten untersucht werden, um die prädiktive Validität des Modells vollständig zu testen.
Darüber hinaus besteht eine derzeitige Einschränkung darin, dass die Validität des Modells bei weiblichen Tieren in zukünftigen Studien noch bewertet werden muss. Es gibt zwar einen Trend, weibliche Tiere in die präklinische Forschung einzubeziehen, aber dies wird oft noch vernachlässigt. Für das vorgestellte Modell sind Wechselwirkungen des Dopaminsystems mit dem Östruszyklus zu erwarten. Es ist jedoch unklar, in welchem Ausmaß sie auftreten werden. Es ist auch wichtig, die generellen Grenzen psychiatrischer Tiermodelle im Auge zu behalten. Während die Möglichkeit, beide krankheitsähnlichen Episoden bei einer Ratte zu induzieren, zu einer erhöhten Gesichtsvalidität führt, unterscheiden sich extern induzierte Veränderungen immer noch vom spontanen Auftreten und Zyklus von Krankheitsepisoden bei Patienten mit BD. Da das Modell ausschließlich auf einer gezielten Manipulation des Dopaminsystems basiert, werden wesentliche Effekte durch Veränderungen der Dopaminübertragung und damit verbundene Nebeneffekte verursacht. Beiträge anderer Systeme zur Symptomologie der BD werden daher nicht berücksichtigt.
Zusammenfassend lässt sich sagen, dass das vorgestellte Modell ein großes Potenzial für die Untersuchung von BD hat, da beide Krankheitsepisoden an einem einzigen Tier untersucht werden können. Dies bietet einzigartige Möglichkeiten für die Untersuchung von Übergängen zwischen den Episoden im Vergleich zu den meisten etablierten Modellen. Das vorgestellte Protokoll erfordert Geräte und technische Fähigkeiten, die in den meisten präklinischen Forschungslabors verfügbar sind, so dass es breit anwendbar ist. Bisher war der resultierende Verhaltensphänotyp über verschiedene Verhaltensweisen hinweg robust. Andere Bereiche wie das Sozialverhalten57 oder kognitive Funktionen müssen noch erforscht werden. Während sich das vorgestellte Protokoll auf Verhaltensergebnisse konzentrierte, gibt es verschiedene Möglichkeiten für zukünftige Anwendungen, um molekulare Mechanismen weiter zu untersuchen. Die Erweiterung der Untersuchungen zum Verständnis der zugrundeliegenden Mechanismen der BD-Pathogenese, insbesondere im Hinblick auf den Übergang zwischen den Episoden, könnte zur Identifizierung therapeutischer Ziele führen, die schließlich in zukünftige klinische Anwendungen überführt werden könnten.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch Zuwendungen der Deutschen Forschungsgemeinschaft (DFG) unterstützt: Projektnummer 552842155 und GRK2862/1, Projektnummer: 492434978. JA erhielt eine Förderung aus dem FoRUM-Forschungsfonds der Medizinischen Fakultät der Ruhr-Universität Bochum (Förderkennzeichen P109-24). Das Bild der Ratte in Abbildung 2 stammt von Servier Medical Art und ist lizenziert unter CC BY 4.0.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9 mm burr | FST | 19007-09 | Burr for craniotomy |
| 10 µl Neuros Syringe | Hamilton | 65460-06 | Mounted to syringe pump for injection |
| 1ml single use Syringes | Braum | 9166017V | Administration of medication |
| 33 G Needles | Hamilton | 65461-02 | Replacement needles for neuros syringe |
| 4-way valve | UNO | 180000259 | For simultaneous connection of induction chamber and face mask |
| Absorbent Drape | Sabanindas | 1834014 | Covering equipment before placing the animal |
| Anaesthetic Gas Filter | UNO | 180000140 | Anesthesia fume collection |
| Anasthesia mask for stereotactic | Hugo Sachs Electronic | 73-4922 | Administering anesthesia during surgery |
| Anesthesia vaporiser | UNO | 180000002 | Provide and adjust levels of vaporised isoflurane |
| Bone wax | SMI | Z046 | Closing the hole in the skull |
| Bulldog clamps | FST | 18038-45 | To retain skin and allow access to the surgical field |
| Buprenorphine | Elanco | 18760711 | Interoperative analgesia |
| Cannula | Tegler | T138339 | Administration of medication |
| Cellulose swabs | Meditrade | 1177 | Cleaning Skin |
| Connector | UNO | 180000005 | Connecting anesthesia tubing to face mask |
| Control Unit for heating pad | UNO | 180000122 | Controlling heating pad |
| Dental Dril | Saeyang | SMT K-38 | Dental drill for craniotomy; equipable with fine dental burrs |
| Desktop digital stereotaxic instrument | RWD | E03135-002 | Fully equipped stereotactic frame with digital manipulator |
| Destilled H2O | - | - | Rinsing the syringe |
| Doxycycline hyclate | Sigma aldrich | D9891 | For model induction |
| Dry ice | - | - | Transporting viral suspension |
| Earbars | RWD | 68302 | Head fixation in the stereotactic frame |
| Ethanol | - | - | Rinsing the syringe and deactivating virus |
| Flowmeter | UNO | CM2 | Verify and adjust flow rate |
| Forceps - anatomical | FST | 11000-12 | Holding skin |
| Forceps - surgical | FST | 11027-12 | Holding skin |
| Heating pad | UNO | 180000028 | Heating pad for keeping the animal warm during surgery |
| Induction chamber | UNO | 180000233 | Chamber for initial induction of anesthesia |
| Isoflurane | CP Pharma | V7005232.00.00 | Anesthesia |
| Lentiviral suspension | - | - | Lentiviral construct coding for DRD1 or dsRed for model induction |
| Lidocaine | Combustin | 8780701 | Local analgesia |
| Meloxicam | Boehringer Ingelheim | 7578423 | Pre- and postoperative analgesia |
| Needle holder | FST | 91201-13 | Sutering |
| Oxygen concentrator | UNO | 180000399 | Providing oxygen for anesthesia |
| PE Tubing | - | - | Connecting components of the anesthesia machine to induction chamber & face mask |
| Pencil | - | - | Marking the correct side for craniotomy |
| Scalpel blade holder | FST | 10003-12 | To hold scalpel blade |
| Scapel blades | FST | 10011-00 | Fine surgical blade for incision |
| Scavenger Unit | UNO | 180000260 | Controlling capacity of fume collector |
| Skin disinfectant | Bode | 975042 | Disinfacting skin before incision |
| Sterile cotton swabs | Boettger | 1102241 | Cleaning surgical field |
| Sterile eye cream | Bayer | 1578675 | Protect eyes during surgery |
| Surgical Scissors | FST | 14000-12 | Trimming fur and cutting suture material |
| Suture 3-0 polyglycolic acid | SMI | 11201519 | Suturing skin |
| Syringe pump | KdScientific | 788130 | Syring pump with connectable holder |
Referenzen
- Müller-Oerlinghausen, B., Berghöfer, A., Bauer, M. Bipolar disorder. Lancet. 359 (9302), 241-247 (2002).
- Grande, I., Berk, M., Birmaher, B., Vieta, E. Bipolar disorder. Lancet. 387 (10027), 1561-1572 (2016).
- Vieta, E., et al. Bipolar Disorders. Nat Rev Dis Primers. 4 (1), 1-16 (2018).
- Lee, J. G., et al. Neuromolecular etiology of bipolar disorder: Possible therapeutic targets of mood stabilizers. Clin Psychopharmacol Neurosci. 20 (2), 228-239 (2022).
- Mohamadian, M., et al. Mood and behavior regulation: Interaction of lithium and dopaminergic system. Naunyn Schmiedebergs Arch Pharmacol. 396 (7), 1339-1359 (2023).
- Berk, M., et al. Dopamine dysregulation syndrome: implications for a dopamine hypothesis of bipolar disorder. Acta Psychiatr Scand. 116 (s434), 41-49 (2007).
- Ashok, A. H., et al. The dopamine hypothesis of bipolar affective disorder: the state of the art and implications for treatment. Mol Psychiatry. 22 (5), 666-679 (2017).
- Zhang, C. -. Y., et al. Genetic evidence for the "dopamine hypothesis of bipolar disorder.". Mol Psychiatry. 28 (2), 532-535 (2023).
- Willner, P. The validity of animal models of depression. Psychopharmacology. 83 (1), 1-16 (1984).
- Beyer, D. K. E., Freund, N. Animal models for bipolar disorder: From bedside to the cage. Int J Bipolar Disord. 5 (1), 35 (2017).
- Valvassori, S. S., Gava, F. F., Cararo, J. H., Quevedo, J. Chapter 9 - The evolution of animal models for bipolar disorder. Neurobiol Bipol Dis. , 109-115 (2021).
- McClung, C. A., et al. Regulation of dopaminergic transmission and cocaine reward by the Clock gene. Proc Natl Acad Sci U S A. 102 (26), 9377-9381 (2005).
- Roybal, K., et al. Mania-like behavior induced by disruption of CLOCK. Proc Natl Acad Sci U S A. 104 (15), 6406-6411 (2007).
- Pathak, G., Ibrahim, B. A., McCarthy, S. A., Baker, K., Kelly, M. P. Amphetamine sensitization in mice is sufficient to produce both manic- and depressive-related behaviors as well as changes in the functional connectivity of corticolimbic structures. Neuropharmacol. 95, 434-447 (2015).
- Krug, J. T., et al. Effects of chronic lithium exposure in a modified rodent ketamine-induced hyperactivity model of mania. Pharmacol Biochem Behav. 179, 150-155 (2019).
- Shaldubina, A., Einat, H., Szechtman, H., Shimon, H., Belmaker, R. H. Preliminary evaluation of oral anticonvulsant treatment in the quinpirole model of bipolar disorder. J Neural Transm. 109 (3), 433-440 (2002).
- Freund, N., Haussleiter, I. Bipolar chronobiology in men and mice: A Narrative review. Brain Sci. 13 (5), 738 (2023).
- Wendler, E., et al. Mania-like elevated mood in rats: Enhanced 50-kHz ultrasonic vocalizations after sleep deprivation. Prog Neuropsychopharmacol Biol Psychiatry. 88, 142-150 (2019).
- Krishnan, V., Nestler, E. J. Animal models of depression: molecular perspectives. Curr Top Behav Neurosci. 7, 121-147 (2011).
- Schmerder, K., Freund, N. Animal models for mania. Psychiatr Vulnerab Mood Anxiety Disord. 190, 233-277 (2023).
- Zufferey, R., et al. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72 (12), 9873-9880 (1998).
- Gardner, B., Liu, Z. F., Jiang, D., Sibley, D. R. The role of phosphorylation/dephosphorylation in agonist-induced desensitization of D1 dopamine receptor function: Evidence for a novel pathway for receptor dephosphorylation. Mol Pharmacol. 59 (2), 310-321 (2001).
- Das, A. T., et al. Viral evolution as a tool to improve the tetracycline-regulated gene expression system. J Biol Chem. 279 (18), 18776-18782 (2004).
- Beyer, D. K. E., Horn, L., Klinker, N., Freund, N. Risky decision-making following prefrontal D1 receptor manipulation. Transl Neurosci. 12 (1), 432-443 (2021).
- Sonntag, K. C., et al. Viral over-expression of D1 dopamine receptors in the prefrontal cortex increase high-risk behaviors in adults: Comparison with adolescents. Psychopharmacology. 231 (8), 1615-1626 (2014).
- Beyer, D. K. E., Mattukat, A., Freund, N. Prefrontal dopamine D1 receptor manipulation influences anxiety behavior and induces neuroinflammation within the hippocampus. Int J Bipolar Disord. 9 (1), 9 (2021).
- Freund, N., Thompson, B. S., Sonntag, K., Meda, S., Andersen, S. L. When the party is over: Depressive-like states in rats following termination of cortical D1 receptor overexpression. Psychopharmacology. 233 (7), 1191-1201 (2016).
- Pantazopoulos, H., Stone, D., Walsh, J., Benes, F. M. Differences in the cellular distribution of D1 receptor mRNA in the hippocampus of bipolars and schizophrenics. Synapse. 54 (3), 147-155 (2004).
- Suhara, T., et al. D1 dopamine receptor binding in mood disorders measured by positron emission tomography. Psychopharmacology. 106 (1), 14-18 (1992).
- Dmitrzak-Weglarz, M., et al. Dopamine receptor D1 Gene -48A/G polymorphism is associated with bipolar illness but not with schizophrenia in a polish population. Neuropsychobiology. 53 (1), 46-50 (2006).
- Rybakowski, J., Dmitrzak-Weglarz, M., Suwalska, A., Leszczynska-Rodziewicz, A., Hauser, J. Dopamine D1 receptor gene polymorphism is associated with prophylactic lithium response in bipolar disorder. Pharmacopsychiatry. 42 (01), 20-22 (2009).
- Severino, G., et al. A48G polymorphism in the D 1 receptor genes associated with bipolar I disorder. Am J Med Genet B Neuropsychiatr Genet. 134B (1), 37-38 (2005).
- Shinohara, R., et al. Dopamine D1 receptor subtype mediates acute stress-induced dendritic growth in excitatory neurons of the medial prefrontal cortex and contributes to suppression of stress susceptibility in mice. Mol Psychiatry. 23 (8), 1717-1730 (2018).
- Yang, Y., Zhong, Z., Wang, B., Wang, Y., Ding, W. Activation of D1R signaling in the medial prefrontal cortex rescues maternal separation-induced behavioral deficits through restoration of excitatory neurotransmission. Behav Brain Res. 441, 114287 (2023).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nat Commun. 10 (1), 223 (2019).
- Wu, M., et al. Dopamine pathways mediating affective state transitions after sleep loss. Neuron. 112 (1), 141-154 (2024).
- Stewart, S. A., et al. Lentivirus-delivered stable gene silencing by RNAi in primary cells. RNA. 9 (4), 493-501 (2003).
- Andersen, S. L., Thompson, A. T., Rutstein, M., Hostetter, J. C., Teicher, M. H. Dopamine receptor pruning in prefrontal cortex during the periadolescent period in rats. Synapse. 37 (2), 167-169 (2000).
- Brenhouse, H. C., Sonntag, K. C., Andersen, S. L. Transient D1 dopamine receptor expression on prefrontal cortex projection neurons: Relationship to enhanced motivational salience of drug cues in adolescence. J Neurosci. 28 (10), 2375-2382 (2008).
- Thompson, T. L., Moss, R. L. Modulation of mesolimbic dopaminergic activity over the rat estrous cycle. Neurosci Lett. 229 (3), 145-148 (1997).
- Redelsperger, I. M., et al. Stability of doxycycline in feed and water and minimal effective doses in tetracycline-inducible systems. J Am Assoc Lab Anim Sci. 55 (4), 467-474 (2016).
- Insel, T., et al. Research domain criteria (RDoC): Toward a new classification framework for research on mental disorders. Am J Psychiatry. 167 (7), 748-751 (2010).
- von Mücke-Heim, I. -. A., et al. Introducing a depression-like syndrome for translational neuropsychiatry: a plea for taxonomical validity and improved comparability between humans and mice. Mol Psychiatry. 28 (1), 329-340 (2023).
- Ben-Ami Bartal, I. The complex affective and cognitive capacities of rats. Science. 385 (6715), 1298-1305 (2024).
- Jaehne, E. J., Corrone, M., van den Buuse, M. Administering a behavioral test battery in rodents. Neurobiol Methods Protoc. , 87-100 (2024).
- Prager, E. M., Bergstrom, H. C., Grunberg, N. E., Johnson, L. R. The Importance of reporting housing and husbandry in rat research. Front Behav Neurosci. 5, 38 (2011).
- Sorge, R. E., et al. Olfactory exposure to males, including men, causes stress and related analgesia in rodents. Nat Methods. 11 (6), 629-632 (2014).
- Du Preez, A., et al. Do different types of stress differentially alter behavioral and neurobiological outcomes associated with depression in rodent models? A systematic review. Front Neuroendocrinol. 61, 100896 (2021).
- Burn, C. C. What is it like to be a rat? Rat sensory perception and its implications for experimental design and rat welfare. Appl Anim Behav Sci. 112 (1), 1-32 (2008).
- Smith, A. J., Clutton, R. E., Lilley, E., Hansen, K. E. PREPARE: Guidelines for planning animal research and testing. Lab Anim. 52 (2), 135-141 (2018).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), e1000412 (2010).
- Messlinger, K., Ellrich, J. Meningeal nociception: Electrophysiological studies related to headache and referred pain. Microsc Res Tech. 53 (2), 129-137 (2001).
- Jirkof, P. Side effects of pain and analgesia in animal experimentation. Lab Anim. 46 (4), 123-128 (2017).
- Moebus, L., Quirin, M., Ehrlenspiel, F. Cerebral asymmetry in bipolar disorders: A scoping review. Biol Psychol. 179, 108551 (2023).
- Mundorf, A., Borawski, J., Ocklenburg, S. Behavioral lateralization in bipolar disorders: A systematic review. Int J Bipolar Disord. 11 (1), 37 (2023).
- Alda, M. Lithium in the treatment of bipolar disorder: Pharmacology and pharmacogenetics. Mol Psychiatry. 20 (6), 661-670 (2015).
- Reinhardt, P. R., Theis, C. D. C., Juckel, G., Freund, N. Rodent models for mood disorders - understanding molecular changes by investigating social behavior. Biol Chem. 404 (10), 939-950 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten