Method Article
开发双相情感障碍的大鼠模型
* 这些作者具有相同的贡献
摘要
本文提出了一种诱导独特的双相情感障碍大鼠模型的方案,该模型可捕获躁狂样和抑郁样行为。
摘要
双相情感障碍是一种以极端情绪波动为特征的心理健康状况,包括情绪高涨(躁狂症)和低谷(抑郁)时期。虽然神经生物学的确切基础尚不完全清楚,但神经递质系统的失衡,尤其是多巴胺,似乎起着核心作用。出于这个原因,多巴胺能途径的纵已被用于模拟啮齿动物的躁狂或抑郁。然而,准确代表这两次发作之间典型转换的模型很少见,这限制了面孔的有效性。在一个独特的模型中,现代技术被用来暂时增加多巴胺 D1 受体的表达,这与双相情感障碍的病理学有关。在钙调蛋白激酶 II α 启动子的控制下表达多巴胺 D1 受体的四环素诱导慢病毒构建体被立体定向注射到成年大鼠的内侧前额叶皮层中。多巴胺 D1 受体过表达是通过在动物的饮用水中添加四环素类似物多西环素来实现的,导致与奖励相关、冲动和冒险行为的增加,并减轻焦虑。这些行为类似于躁狂症样表型。通过从饮用水中去除多西环素,可以在同一只动物体内诱导一种抑郁样表型,其特征是无助感和快感缺乏增加。本文提供了进行手术的分步方案,以及诱导双相情感障碍样表型的程序。此外,还描述了评估与躁狂样和抑郁样行为相关的行为变化的注意事项。这个有前途的模型展示了良好的结构和表面效度,为进一步研究双相情感障碍的病理生理机制提供了有价值的工具。
引言
双相情感障碍 (BD) 是一种严重的情绪障碍,影响着世界约 1% 的人口1。它的特点是极端情绪、抑郁和躁狂发作,以及心境畅通。BD 抑郁发作的症状类似于单相抑郁症的症状。患者对活动的兴趣和愉悦感降低,并感到悲伤、绝望和无价值。此外,通常可以观察到食欲、睡眠行为以及认知障碍的变化2。躁狂发作的特征是情绪异常高涨、睡眠需求减少、社交去抑制、自尊心增加和自大感,以及冒险和易怒加剧2。
BD 的疾病病因似乎是遗传和发育因素3 的复杂相互作用,但其病理生理学所涉及的确切机制仍不完全清楚。症状被认为是由神经递质系统的失衡引起的4 ,特别是,专注于多巴胺系统的研究具有影响力5。例如,Berk 等人 6 假设了多巴胺假说,假设高多巴胺能状态是躁狂症的基础,而抑郁症则源于低多巴胺血症。从那时起,来自动物模型以及药理学和影像学研究的证据为躁狂症状与多巴胺增多症之间的关联提供了强有力的支持。此外,可以发现多巴胺能信号降低与抑郁发作之间的联系,尽管程度较小7。此外,遗传调查的结果加强了 BD8 多巴胺假说的观点。
为了进一步阐明多巴胺系统在 BD 中的作用,可以使用动物模型来研究导致症状的神经生物学机制。疾病模型的应用和局限性通常根据最初由 Willner9 提出的三个验证标准进行评估。这些包括面孔效度、构造效度和预测效度。人脸效度描述了模型模仿疾病行为特征的能力。当疾病的病理生理学和病因学是模型的基础时,即达到结构效度,而预测效度意味着疾病的药物治疗可以在模型内重现。
到目前为止,各种啮齿动物模型都有助于理解 BD10 ,包括广泛的基因改造、药物干预以及环境作11。
例如, Clock 基因的实验作已被证明可在小鼠中诱导躁狂样表型。转录因子 CLOCK 在调节昼夜节律中起重要作用,基因改变的小鼠表达一种无法激活 Clock 转录的蛋白质,其特征是多动和奖励反应增加12。由此产生的表型似乎是由大脑腹侧被盖区多巴胺能信号传导的差异调节基因介导的 13。
通过施用增加多巴胺的药物(例如精神兴奋剂苯丙胺)直接影响多巴胺信号传导,已被证明会诱导过度运动,随后的戒断与抑郁样症状有关,包括快感缺乏14。氯胺酮或多巴胺 D2/D3 受体激动剂喹吡罗的药理学挑战也被证明会诱导与 BD相关的行为 15,16。
除了药物干预外,还可以采用环境纵(例如睡眠剥夺)来诱导与 BD17 相关的行为表型。睡眠不足的动物表现出躁狂样表型,其特征是运动增加和发出与多巴胺信号变化相关的超声波发声18。
还有许多其他啮齿动物模型可以研究抑郁19 或类似躁狂症20 的行为。然而,虽然所有这些模型都为理解 BD 病理学做出了巨大贡献,但它们受到一次仅研究一次发作或短期影响的限制。相比之下,对情感状态之间的特征转换进行建模一直很难实现。
在这里,提出了一种用于 BD 的独特大鼠模型的方案。它通过使用多巴胺系统的单一靶向作在一只动物中诱导两种发作,即在内侧前额叶皮层 (mPFC) 中有条件地过表达来自四环素诱导的慢病毒构建体的多巴胺 D1 受体 (DRD1),从而证明了更高的面部有效性。通过在钙调蛋白激酶 II α (CamKIIa) 启动子的控制下驱动基因转录,DRD1 主要在谷氨酸能神经元中表达,从而提高了遗传作的特异性。
原始慢病毒骨架 pRRL.cPPT.WPRE.Sin 由 Didier Trono 博士(瑞士洛桑联邦理工学院)21 提供,并通过用多接头位点(慢病毒载体 PL13)替换 GFP 小基因进行修饰。然后使用 PL13 生产 PL13.pTRE2.DRD1.CamKIIa.rtTA3 或 PL13.pTRE2.dsRedExpress.CamKIIa.rtTA3。大鼠 DRD1 的 cDNA 来自 David Sibley 博士 (NINDS/NIH)22,反向四环素控制激活剂 3 (rtTA3) cDNA 来自 Atze Das 和 Ben Berkhout 博士(阿姆斯特丹大学学术医学中心)23。CamKIIa 启动子 DNA 由 Karl Deisseroth 博士(加利福尼亚州斯坦福大学)提供,dsRedExpress 和四环素反应元件 2 (pTRE2) 序列分别从内部质粒 pcDNA3.1-dsRedExpress 和 pcDNA3.1-pTRE2 中亚克隆。通过亚克隆两侧有限制性位点的 PCR 扩增 DNA 序列来生成病毒载体。
使用这种病毒载体的模型已经证明,DRD1 在 mPFC CamKIIa 阳性神经元中的过表达会导致躁狂样表型24,25,而随后基因表达的下调会诱导抑郁样行为26。由于疾病样表型可以在一只动物中反复诱导27,因此该模型反映了高水平的面部效度。此外,多巴胺系统的作对 BD7 的动物模型具有很强的构建有效性,因为 DRD1 水平 28,29 或 DRD1 多态性的变化与 BD 病理学 30,31,32 有关。
其他动物研究也导致对前额叶 DRD1 功能的理解增加。例如,DRD1 的降低是抑郁症模型中的一致发现33,34,而 mPFC 谷氨酸能神经元中 DRD1 的光遗传学刺激可减少焦虑并诱导抗抑郁作用35。在 Wu 等人 36 最近发表的一篇文章中,已经证明了 mPFC DRD1 在情感状态转换中的作用。这项研究强调,这些受体对于兴奋性突触可塑性的潜在变化至关重要。
总而言之,采用 BD 大鼠模型,该模型包括在 mPFC 的 CamKIIa 阳性神经元中对 DRD1 的靶向和条件作,构成了一个具有高构建体和面效度的模型系统,因此,在 BD 的转化研究中表现出强大的潜力。
在下文中,描述了用于模型生成的外科手术。此外,模型诱导和行为评估的方法学考虑将与产生的疾病样表型的代表性结果一起呈现。讨论了模型生成和行为评估中可能存在的障碍和影响因素,并对未来的发展方向进行了展望。
研究方案
此处描述的立体定向注射方案已获得 LANUV (Landesamt für Natur, Umwelt und Verbraucherschutz, Northrhine-Westfalia, Germany) 的批准。使用成年雄性 Sprague Dawley 大鼠 (350-650 g 体重)。本研究中使用的试剂和设备列在 材料表中。
1. 慢病毒构建体
注:第三代慢病毒系统用于 DRD1 或红色荧光蛋白 (dsRed) 的条件表达作为对照条件25,27。
- 根据 Stewart 等人 37 的方案,使用来自 Addgene 存储库的包装质粒 8454 和 8455 生产慢病毒。
注:如果不独立规划病毒生产,许多核心设施提供高滴度慢病毒,例如德国柏林夏里特医学院。 - 滴度浓缩病毒并将其储存在 -80 °C。
- 每 μL 准备 2 × 107 个转导单位 (TU) 用于进样。
- 将病毒运送到干冰上的手术室。
2. 动物
注意:BD 的大鼠模型已在成年雄性 Sprague Dawley 大鼠(350-650 克体重)中建立。对于雌性大鼠或早期发育时间点的研究,关键是要考虑到 DRD1 在 mPFC 中的表达在发育过程中发生变化,并且可能受发情周期 38,39,40 的影响。
- 在恒温恒湿条件下(45%-65%相对湿度,温度22°C±2°C)随意将相同条件的动物与食物和水配对。
- 将大鼠置于 12 小时的逆光暗循环下(上午 11 点关灯),因为应在动物在黑暗中的活跃期进行行为调查。
- 在开始任何实验之前,给动物至少 7 天的时间来适应设施和实验人员的处理。
3. 病毒构建体的立体定向注射
注意:在安全罩下进行手术(使用慢病毒的预防措施)和无菌条件下。
- 制备
- 确保所有必要的材料都可用且功能齐全(材料表)。
- 设置立体定向框架,将注射器支架连接到立体定向臂上。将注射器支架连接到注射泵。
- 设置牙钻并安装一个 0.9 毫米的毛刺。
- 放置加热垫并将其设置为 37 °C。 将加热垫升高到适当的高度,以便于定位大鼠。
- 用吸水帘盖住加热垫。
- 在无菌表面上准备高压灭菌的手术器械。
- 将带有 33 G 注射针头的 10 μL 立体定位注射注射器安装到注射器支架上。
- 取出 2.3 μL 病毒悬浮液进行双侧注射,每次 1 μl。目视确认提款成功。确保将此步骤作为最后的准备步骤执行,以最大限度地减少慢病毒在室温下所需的时间。
- 镇痛和麻醉诱导
- 手术当天早上,给予美洛昔康(1 mg/kg 体重,口服)。
- 在镇痛外科手术开始前20分钟,向大鼠注射丁丙诺啡(0.5 mg / kg体重,sc)。
- 以 0.8-1 L/min 的氧气流量打开麻醉机。
- 用 4% 异氟醚淹没感应室,然后将大鼠放入感应室中。
- 成功诱导麻醉后,通过呼吸减慢和意识丧失可见,将大鼠从诱导室中取出并将其移至立体定向框架。
- 大鼠的体位
- 确保麻醉流量切换到鼻罩。
- 将大鼠从感应室转移到立体定向框架,将其门牙放入支架中。
- 将麻醉面罩正确放在鼻子上,并将异氟醚调至 1.5-2.3% 进行维护。
- 使用无菌眼霜保护眼睛。
- 至少在做任何切口前 10 分钟,在计划切口部位的正下方局部注射大鼠利多卡因(10 mg/kg 体重,sc)。
- 使用耳杆将大鼠固定在立体定向框架中。确保耳杆均匀并处于水平头部位置。
- 用剪刀修剪切口部位周围的毛皮。使用蘸有皮肤防腐剂的纤维素垫去除毛皮片。
- 使用皮肤消毒剂对手术区域进行消毒。
- 开颅手术和病毒构建体注射
- 通过检查是否有脚趾反射来确保适当的麻醉。
- 在接触任何设备之前,请对双手进行消毒并换上无菌手套。
- 使用手术刀刀片做一个小的内侧切口 (~1.5 cm)。
- 通过使用 Bulldog 夹将皮肤推向两侧,确保进入手术区域。
- 使用无菌交换清洁手术区域的血液和剩余组织。确保前囟的正常视野和足够的前部空间。
- 根据 Bregma 将 A/P 和 M/L 坐标设置为零。
- 将立体定向臂移动到坐标 A/P + 2.7 和 M/L ± 0.4,并使用消毒的铅笔进行可视化。
- 钻一个直径为 ~1 mm 的孔,覆盖两个半球的注射侧。
- 使用无菌交换去除所有血液。
- 在大脑表面将 D/V 坐标设置为零,然后慢慢将注射针降低到 -2.8 以注射到 mPFC 的前边缘区域。
- 等待 5 分钟,让组织放松。
- 以 0.1 μL/min 的速率注入 1 μL 病毒悬浮液。
- 等待 5 分钟吸收,然后慢慢取下针头。
- 在另一个半球重复注射。
- 闭合和术后护理
- 取下针头并使用骨蜡关闭颅骨上的开口。
- 取下斗牛犬夹并缝合皮肤(3-0 手术缝合)。
- 用美洛昔康(1 mg/kg,sc)注射大鼠进行术后镇痛。
- 关闭麻醉剂,将动物从立体定向框架中取出,然后将其放入家笼中。确保老鼠完全醒来。
- 用 100% 乙醇冲洗注射器以使剩余的慢病毒失活,然后蒸馏 H2O 以准备下一次注射。
- 在 3 天内每 24 小时用美洛昔康 (1 mg/kg, po) 进行术后镇痛,并对动物的健康状况进行 1 周的评分。
- 手术后前 24 小时单舍动物,以防止其他人篡改缝合线。之后将它们与笼中伙伴一起放回原处。
4. 多西环素治疗用于模型诱导
注意:注射后 24 小时开始模型诱导。人们也可以在注射和诱导之间等待长达数月的较长时间,例如,同时测试更大的动物队列。这已被证明不会影响病毒构建体的功能。
- 诱发躁狂样发作
- 为了诱导躁狂样表型,将 0.5 g/L 多西环素盐添加到饮用水中,给动物服用。这会诱导病毒转录和额外 DRD1 的过表达。
- 每 48 小时至 72 小时新鲜制备一次含多西环素的水,即使在不透明水瓶中,多西环素的稳定性也不受影响41。
注意:多西环素治疗 7 天后,病毒介导的过表达将达到最大值,可以在躁狂样发作期间进行行为调查。
- 诱发抑郁样发作
- 将动物换回正常的饮用水,以诱发类似抑郁的发作。
- 等待 4 天,直到病毒转录停止,然后对抑郁样发作进行行为评估。
- 按照相同的模式进行后续的发作诱导。
5. 行为评估
注意:在模型归纳之后,可以评估双相情感障碍样行为。已经提出了从临床症状到在啮齿动物中观察到的行为模式的不同翻译框架。其中最有影响力的是研究领域标准42,其中检查了可能受精神疾病影响的功能和行为领域的变化。然而,重要的是要注意,由于物种屏障,一些症状,例如自杀倾向,无法在啮齿动物中进行调查43。由于大鼠模型具有先进的认知和情感能力,因此在转化症状评估44 方面具有特别大的潜力,从而允许进行更复杂的测试程序。 表 1 描述了行为评估的注意事项。
- 将行为调查计划为一系列行为测试45,以提供所得表型的全面图片。
- 注意最后进行更具侵入性的检查。
- 在尝试在两种疾病样发作中测试一只动物时,考虑可能由先前的测试经验导致的行为变化。
注意:根据手头的问题,在躁狂症或抑郁样发作期间测试不同组的大鼠可能是有益的,这也允许在相应的发作期间收集组织。经验表明,测试行为幼稚的动物会导致某些行为测试中出现更突出的表型。 - 此外,还要考虑其他因素,例如住房条件46 或实验者的性别47。
- 采取一切可能的措施来减少对动物的意外压力,不仅是为了动物福利,也是为了排除精神表型与压力的可能相互作用48。
- 特别注意昼夜节律,因为昼夜节律的紊乱是 BD17 的症状。由于大鼠在黄昏和黎明时分最活跃,因此应该在昏暗的红光下与处于逆明暗循环下的动物进行测试49。
注意:此处介绍的大多数代表性结果都是按照这种方法收集的。然而,如果在不切换动物的昼夜周期的情况下进行行为评估,仍然可以观察到疾病样表型27。 - 始终预先注册实验并按照 PREPARE50 和 ARRIVE51 指南进行和描述。
结果
当多西环素添加到动物的饮水中时,会表达额外的 DRD1,7 天后,将有足够的过表达来测试动物的躁狂样行为。到目前为止,已经证明与奖励相关的行为有所增加。与对照组25 相比,在两瓶选择测试中,类似躁狂症的动物喝更多的蔗糖溶液而不是水。当与接受性雌性一起放入观察箱中并观察 25 分钟时,与对照组27 相比,躁狂样动物显示出更多的性坐骑(图 1A)。在可卡因自我给药范式中,他们在固定比例时间表下施用更多的可卡因,并在渐进比例时间表中显示出更高的断点。它们的剂量反应曲线向对低剂量的更高敏感性转移25。这种敏感性的转变也体现在几个地方条件反射范式中动机显著性的增加中。与对照组相比,类似躁狂症的动物在尼古丁、酒精和可卡因的条件反射中花费了更多的时间25。在基于 T 迷宫的延迟贴现测试中,还发现了增加的新奇寻求和更多的冲动选择25。在爱荷华州赌博任务的作性大鼠版本中,与对照组24 相比,类似躁狂症的动物更频繁地决定不利(高风险、高收益)的选择(图 1B)。躁狂样动物的焦虑减轻了,这在高架迷宫25 中花在张开双臂上的时间更多就表明了这一点。
通过终止 DRD1 过表达,可以诱导抑郁样表型。在类似抑郁的发作中,可以观察到无助感的增加。在无助的三联体范式中,第一次出现电击的组(图 1C)以及已经学会控制电击的组,与他们各自的控制相比,逃脱潜伏期增加,更加无助27。诱导无助的组,实验动物和对照动物之间没有显示出任何差异。在蔗糖27 的两瓶选择测试和性行为(未发表的数据)中发现了快感缺乏。在大理石掩埋测试中,抑郁样动物也更加焦虑26 (图 1D)。
所描述的动物模型不仅提供了研究躁狂或抑郁样行为的可能性,而且还提供了一个独特的机会来观察终止 DRD1 过表达时的行为转变,类似于患者从躁狂到抑郁的转变。在这里,重要的是要牢记对某些行为的习惯并选择习惯程度最低的测试。例如,在躁狂样发作和抑郁样发作中,性行为增加,显示这种行为减少到与对照动物一样的水平。在这个实验中,在同一只动物体内诱导了三个躁狂/抑郁样循环27。对于蔗糖饮用,当切换到抑郁样状态时,对躁狂样状态下蔗糖溶液的偏好不仅降低到控制水平,而且下降了 27。在爱荷华州赌博任务的大鼠版本中,类似躁狂症的动物的不利选择数量增加,但当动物处于抑郁样状态时,与对照组没有显着差异。在后一种状态下,与对照动物相比,总获得的颗粒数量减少24。
总体而言,动物表现出强大的双相情感障碍样表型,在两次发作期间都可以在不同的行为领域观察到。此模型中剧集之间的切换有助于提高人脸效度。 图 2 给出了受影响行为域的概述。
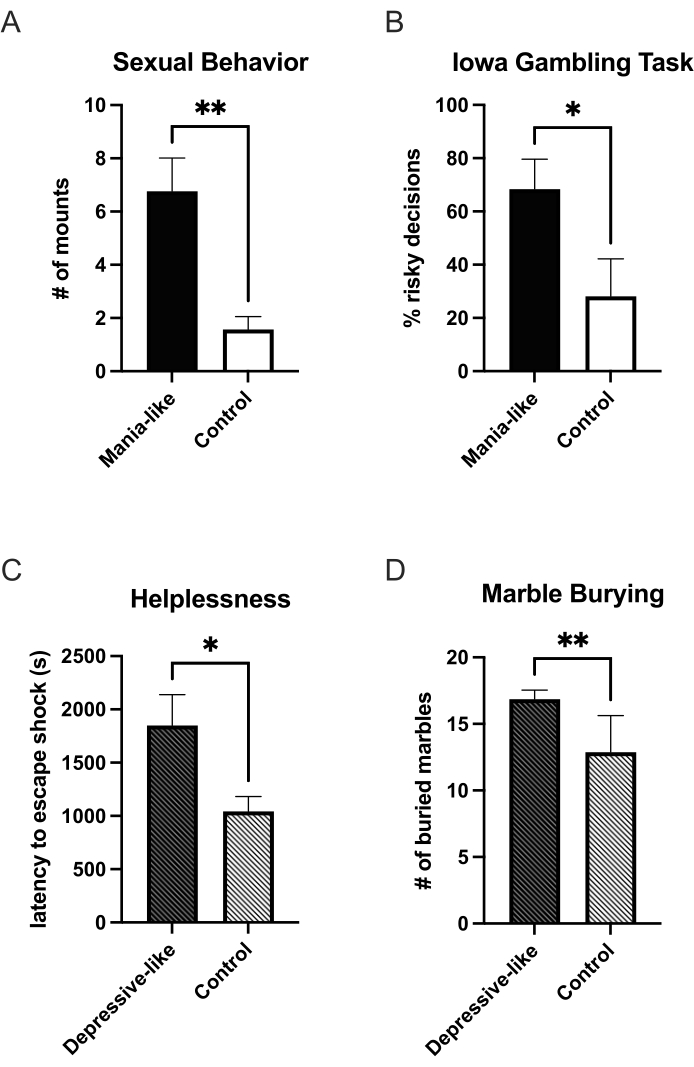
图 1:病毒 DRD1 过表达后躁狂和抑郁样状态的行为变化。 在病毒 DRD1 过表达期间,在躁狂样状态下,与对照组相比,动物在爱荷华州赌博任务 (B) 中表现出更多的性坐骑 (A) 和风险选择增加。过表达终止后,动物切换到类似抑郁的状态。他们表现出无助 (C) 和焦虑 (D) 的增加。*p < 0.05;**p < 0.01;误差线表示均值的标准误差。请单击此处查看此图的较大版本。

图 2:模型的行为表型。 在类似躁狂症的发作中,与奖励相关的行为(例如性行为)、冲动和冒险行为增加。在高架加迷宫测试中焦虑减轻。在抑郁样发作期间,大理石埋葬试验中的焦虑增加,性行为减少,动物表现出更多的无助。图中老鼠的图像取自 施维雅医学艺术 并已获得 CC BY 4.0 许可。 请单击此处查看此图的较大版本。
表 1:行为评估的注意事项。 下表突出显示了行为评估期间主要实验步骤的重要注意事项。 请点击此处下载此表格。
讨论
在这里,提出了一种具有更高面部效度的新型 BD 大鼠模型。在 mPFC 中靶向作 DRD1 可在同一只动物中诱导躁狂和抑郁样表型。代表性结果突出了在两次发作中可观察到的疾病样表型。该模型相对容易应用。需要两种表达 DRD1 或 dsRed 作为对照的诱导型慢病毒载体。对于动物慢病毒系统的生产和使用,需要一定的安全水平,这些安全水平需要到位。如果没有生产病毒所需的设备,与核心设施合作的经验是积极的。
生成模型最关键的步骤是慢病毒系统的立体定向注射。立体定向手术是神经科学领域成熟的手术,训练有素的研究人员的成功率很高。有两个主要的可能错误来源。麻醉问题可能导致外科手术过程中死亡。在这里,如方案中所述,使用异氟醚吸入麻醉已被证明是最好的方法,因为与注射麻醉相比,易于调节的药物水平构成了明显的好处。由于异氟醚不提供任何镇痛作用,并且脑膜伤害感受器对刺激敏感52,因此建议使用阿片类药物进行术中镇痛。如方案中所述,结合适当的术后药物,没有可观察到的术后疼痛迹象。然而,应始终考虑对研究问题的可能影响,例如,关于多巴胺与阿片类药物系统的相互作用,并应相应地选择合适的药物治疗方案53。如果在无菌条件下进行手术,则感染或伤口愈合受损的发生是罕见的。如果在手术或恢复过程中出现问题,故障排除的重点应集中在正确执行所述方案上。确保无菌工作条件和精确的药物剂量至关重要。液体或葡萄糖溶液的给药还可以帮助恢复。如果发生感染,治疗不应包括任何四环素类药物,因为这些药物会与病毒系统的转录相互作用。术后伤口感染的一线治疗是恩诺沙星,可能与卡洛芬联合使用。
手术过程中另一个可能的错误来源是将注射剂放置在目标区域之外。然而,当正确遵循协议并确保动物头部的正确定位时,这种情况很少发生。应始终验证成功的放置。虽然在对照动物中很容易检测到表达 dsRed 病毒的放置,但表达 DRD1 的病毒的放置验证需要额外的步骤。对病毒构建体的不同部分进行抗体染色未产生令人满意的结果。建议通过解剖 mPFC 并进行 PCR 来检测 rtTA3 转录本,如 Beyer 等人 24 所述来验证病毒的位置。同样重要的是要注意,病毒的注射应该是双侧的,病毒量相等。双相情感障碍患者的大脑和行为偏侧化已被证明不同54,55,单侧病毒注射可能无法诱导所需的行为表型。
通过在饮用水中添加多西环素来诱导病毒 DRD1 表达和躁狂样发作效果非常好。用多西环素代替普通饮用水已被证明不会引起饮酒行为的显着变化。但是,应监测液体消耗量。如果其他物质(例如药物)打算 通过 饮用水给药,则可以进行调制。多西环素给药 也可以通过食物颗粒 进行。但这尚未得到验证。
对于行为调查, 表 1 中列出了几个注意事项。在规划实验时,尤其需要评估特定于模型的要求。例如,应该决定是否将对两组动物进行测试,或者是否在两次发作期间都会对一只动物进行行为评估,这可能需要重新测试。如果在行为调查过程中无法检测到双相情感障碍样表型,尽管可以验证位置,但故障排除可以集中在可能影响行为结果的各种因素上。在此过程中应严格评估实验者或昼夜节律的变化,因为环境中的压力条件会影响行为结果。
虽然该模型展示了良好的结构和面效度,但仍需要评估预测效度。长期锂给药作为 BD56 的一线治疗,应该可以成功防止模型诱导的行为改变。可以调查对 BD 中使用的其他药物(例如抗精神病药或抗惊厥药)的反应,以充分测试模型的预测有效性。
此外,目前的一个限制是雌性动物的模型有效性仍然需要在未来的研究中进行评估。虽然有将雌性动物纳入临床前研究的趋势,但这仍然经常被忽视。对于所提出的模型,多巴胺系统与发情周期的相互作用是可以预期的。然而,目前尚不清楚它们会在多大程度上发生。牢记精神病学动物模型的一般局限性也很重要。虽然在一只大鼠中诱导两种疾病样发作的可能性提供了更高的面部效度,但外部诱导的变化仍然不同于 BD 患者的自发发生和疾病发作的循环。由于该模型仅基于多巴胺系统的靶向作,因此多巴胺传递的改变和相关的次要效应将导致主要影响。因此,没有考虑其他系统对 BD 症状的贡献。
总之,所提出的模型在研究 BD 方面具有很强的潜力,因为这两种疾病发作都可以在一只动物中进行研究。与大多数已建立的模型相比,这为研究剧集之间的过渡提供了独特的可能性。所提出的方案需要大多数临床前研究实验室中可用的设备和技术技能,使其具有广泛的适用性。到目前为止,由此产生的行为表型在不同的行为中是稳健的。其他领域,如社会行为57 或认知功能,还有待探索。虽然所提出的方案侧重于行为结果,但未来的应用有多种可能性来进一步研究分子机制。扩大研究以了解 BD 发病机制的潜在机制,特别是关于发作之间的过渡,可能会导致确定最终可能转化为未来临床应用的治疗靶点。
披露声明
作者没有什么可披露的。
致谢
这项工作得到了德国研究基金会 (Deutsche Forschungsgemeinschaft, DFG) 的资助:项目编号 552842155 和 GRK2862/1,项目编号:492434978。JA 获得了波鸿鲁尔大学医学院 FoRUM 研究基金(批准号 P109-24)的资助。图 2 中大鼠的图像取自 施维雅医学艺术 并已获得 CC BY 4.0 许可。
材料
| Name | Company | Catalog Number | Comments |
| 0.9 mm burr | FST | 19007-09 | Burr for craniotomy |
| 10 µl Neuros Syringe | Hamilton | 65460-06 | Mounted to syringe pump for injection |
| 1ml single use Syringes | Braum | 9166017V | Administration of medication |
| 33 G Needles | Hamilton | 65461-02 | Replacement needles for neuros syringe |
| 4-way valve | UNO | 180000259 | For simultaneous connection of induction chamber and face mask |
| Absorbent Drape | Sabanindas | 1834014 | Covering equipment before placing the animal |
| Anaesthetic Gas Filter | UNO | 180000140 | Anesthesia fume collection |
| Anasthesia mask for stereotactic | Hugo Sachs Electronic | 73-4922 | Administering anesthesia during surgery |
| Anesthesia vaporiser | UNO | 180000002 | Provide and adjust levels of vaporised isoflurane |
| Bone wax | SMI | Z046 | Closing the hole in the skull |
| Bulldog clamps | FST | 18038-45 | To retain skin and allow access to the surgical field |
| Buprenorphine | Elanco | 18760711 | Interoperative analgesia |
| Cannula | Tegler | T138339 | Administration of medication |
| Cellulose swabs | Meditrade | 1177 | Cleaning Skin |
| Connector | UNO | 180000005 | Connecting anesthesia tubing to face mask |
| Control Unit for heating pad | UNO | 180000122 | Controlling heating pad |
| Dental Dril | Saeyang | SMT K-38 | Dental drill for craniotomy; equipable with fine dental burrs |
| Desktop digital stereotaxic instrument | RWD | E03135-002 | Fully equipped stereotactic frame with digital manipulator |
| Destilled H2O | - | - | Rinsing the syringe |
| Doxycycline hyclate | Sigma aldrich | D9891 | For model induction |
| Dry ice | - | - | Transporting viral suspension |
| Earbars | RWD | 68302 | Head fixation in the stereotactic frame |
| Ethanol | - | - | Rinsing the syringe and deactivating virus |
| Flowmeter | UNO | CM2 | Verify and adjust flow rate |
| Forceps - anatomical | FST | 11000-12 | Holding skin |
| Forceps - surgical | FST | 11027-12 | Holding skin |
| Heating pad | UNO | 180000028 | Heating pad for keeping the animal warm during surgery |
| Induction chamber | UNO | 180000233 | Chamber for initial induction of anesthesia |
| Isoflurane | CP Pharma | V7005232.00.00 | Anesthesia |
| Lentiviral suspension | - | - | Lentiviral construct coding for DRD1 or dsRed for model induction |
| Lidocaine | Combustin | 8780701 | Local analgesia |
| Meloxicam | Boehringer Ingelheim | 7578423 | Pre- and postoperative analgesia |
| Needle holder | FST | 91201-13 | Sutering |
| Oxygen concentrator | UNO | 180000399 | Providing oxygen for anesthesia |
| PE Tubing | - | - | Connecting components of the anesthesia machine to induction chamber & face mask |
| Pencil | - | - | Marking the correct side for craniotomy |
| Scalpel blade holder | FST | 10003-12 | To hold scalpel blade |
| Scapel blades | FST | 10011-00 | Fine surgical blade for incision |
| Scavenger Unit | UNO | 180000260 | Controlling capacity of fume collector |
| Skin disinfectant | Bode | 975042 | Disinfacting skin before incision |
| Sterile cotton swabs | Boettger | 1102241 | Cleaning surgical field |
| Sterile eye cream | Bayer | 1578675 | Protect eyes during surgery |
| Surgical Scissors | FST | 14000-12 | Trimming fur and cutting suture material |
| Suture 3-0 polyglycolic acid | SMI | 11201519 | Suturing skin |
| Syringe pump | KdScientific | 788130 | Syring pump with connectable holder |
参考文献
- Müller-Oerlinghausen, B., Berghöfer, A., Bauer, M. Bipolar disorder. Lancet. 359 (9302), 241-247 (2002).
- Grande, I., Berk, M., Birmaher, B., Vieta, E. Bipolar disorder. Lancet. 387 (10027), 1561-1572 (2016).
- Vieta, E., et al. Bipolar Disorders. Nat Rev Dis Primers. 4 (1), 1-16 (2018).
- Lee, J. G., et al. Neuromolecular etiology of bipolar disorder: Possible therapeutic targets of mood stabilizers. Clin Psychopharmacol Neurosci. 20 (2), 228-239 (2022).
- Mohamadian, M., et al. Mood and behavior regulation: Interaction of lithium and dopaminergic system. Naunyn Schmiedebergs Arch Pharmacol. 396 (7), 1339-1359 (2023).
- Berk, M., et al. Dopamine dysregulation syndrome: implications for a dopamine hypothesis of bipolar disorder. Acta Psychiatr Scand. 116 (s434), 41-49 (2007).
- Ashok, A. H., et al. The dopamine hypothesis of bipolar affective disorder: the state of the art and implications for treatment. Mol Psychiatry. 22 (5), 666-679 (2017).
- Zhang, C. -. Y., et al. Genetic evidence for the "dopamine hypothesis of bipolar disorder.". Mol Psychiatry. 28 (2), 532-535 (2023).
- Willner, P. The validity of animal models of depression. Psychopharmacology. 83 (1), 1-16 (1984).
- Beyer, D. K. E., Freund, N. Animal models for bipolar disorder: From bedside to the cage. Int J Bipolar Disord. 5 (1), 35 (2017).
- Valvassori, S. S., Gava, F. F., Cararo, J. H., Quevedo, J. Chapter 9 - The evolution of animal models for bipolar disorder. Neurobiol Bipol Dis. , 109-115 (2021).
- McClung, C. A., et al. Regulation of dopaminergic transmission and cocaine reward by the Clock gene. Proc Natl Acad Sci U S A. 102 (26), 9377-9381 (2005).
- Roybal, K., et al. Mania-like behavior induced by disruption of CLOCK. Proc Natl Acad Sci U S A. 104 (15), 6406-6411 (2007).
- Pathak, G., Ibrahim, B. A., McCarthy, S. A., Baker, K., Kelly, M. P. Amphetamine sensitization in mice is sufficient to produce both manic- and depressive-related behaviors as well as changes in the functional connectivity of corticolimbic structures. Neuropharmacol. 95, 434-447 (2015).
- Krug, J. T., et al. Effects of chronic lithium exposure in a modified rodent ketamine-induced hyperactivity model of mania. Pharmacol Biochem Behav. 179, 150-155 (2019).
- Shaldubina, A., Einat, H., Szechtman, H., Shimon, H., Belmaker, R. H. Preliminary evaluation of oral anticonvulsant treatment in the quinpirole model of bipolar disorder. J Neural Transm. 109 (3), 433-440 (2002).
- Freund, N., Haussleiter, I. Bipolar chronobiology in men and mice: A Narrative review. Brain Sci. 13 (5), 738 (2023).
- Wendler, E., et al. Mania-like elevated mood in rats: Enhanced 50-kHz ultrasonic vocalizations after sleep deprivation. Prog Neuropsychopharmacol Biol Psychiatry. 88, 142-150 (2019).
- Krishnan, V., Nestler, E. J. Animal models of depression: molecular perspectives. Curr Top Behav Neurosci. 7, 121-147 (2011).
- Schmerder, K., Freund, N. Animal models for mania. Psychiatr Vulnerab Mood Anxiety Disord. 190, 233-277 (2023).
- Zufferey, R., et al. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72 (12), 9873-9880 (1998).
- Gardner, B., Liu, Z. F., Jiang, D., Sibley, D. R. The role of phosphorylation/dephosphorylation in agonist-induced desensitization of D1 dopamine receptor function: Evidence for a novel pathway for receptor dephosphorylation. Mol Pharmacol. 59 (2), 310-321 (2001).
- Das, A. T., et al. Viral evolution as a tool to improve the tetracycline-regulated gene expression system. J Biol Chem. 279 (18), 18776-18782 (2004).
- Beyer, D. K. E., Horn, L., Klinker, N., Freund, N. Risky decision-making following prefrontal D1 receptor manipulation. Transl Neurosci. 12 (1), 432-443 (2021).
- Sonntag, K. C., et al. Viral over-expression of D1 dopamine receptors in the prefrontal cortex increase high-risk behaviors in adults: Comparison with adolescents. Psychopharmacology. 231 (8), 1615-1626 (2014).
- Beyer, D. K. E., Mattukat, A., Freund, N. Prefrontal dopamine D1 receptor manipulation influences anxiety behavior and induces neuroinflammation within the hippocampus. Int J Bipolar Disord. 9 (1), 9 (2021).
- Freund, N., Thompson, B. S., Sonntag, K., Meda, S., Andersen, S. L. When the party is over: Depressive-like states in rats following termination of cortical D1 receptor overexpression. Psychopharmacology. 233 (7), 1191-1201 (2016).
- Pantazopoulos, H., Stone, D., Walsh, J., Benes, F. M. Differences in the cellular distribution of D1 receptor mRNA in the hippocampus of bipolars and schizophrenics. Synapse. 54 (3), 147-155 (2004).
- Suhara, T., et al. D1 dopamine receptor binding in mood disorders measured by positron emission tomography. Psychopharmacology. 106 (1), 14-18 (1992).
- Dmitrzak-Weglarz, M., et al. Dopamine receptor D1 Gene -48A/G polymorphism is associated with bipolar illness but not with schizophrenia in a polish population. Neuropsychobiology. 53 (1), 46-50 (2006).
- Rybakowski, J., Dmitrzak-Weglarz, M., Suwalska, A., Leszczynska-Rodziewicz, A., Hauser, J. Dopamine D1 receptor gene polymorphism is associated with prophylactic lithium response in bipolar disorder. Pharmacopsychiatry. 42 (01), 20-22 (2009).
- Severino, G., et al. A48G polymorphism in the D 1 receptor genes associated with bipolar I disorder. Am J Med Genet B Neuropsychiatr Genet. 134B (1), 37-38 (2005).
- Shinohara, R., et al. Dopamine D1 receptor subtype mediates acute stress-induced dendritic growth in excitatory neurons of the medial prefrontal cortex and contributes to suppression of stress susceptibility in mice. Mol Psychiatry. 23 (8), 1717-1730 (2018).
- Yang, Y., Zhong, Z., Wang, B., Wang, Y., Ding, W. Activation of D1R signaling in the medial prefrontal cortex rescues maternal separation-induced behavioral deficits through restoration of excitatory neurotransmission. Behav Brain Res. 441, 114287 (2023).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nat Commun. 10 (1), 223 (2019).
- Wu, M., et al. Dopamine pathways mediating affective state transitions after sleep loss. Neuron. 112 (1), 141-154 (2024).
- Stewart, S. A., et al. Lentivirus-delivered stable gene silencing by RNAi in primary cells. RNA. 9 (4), 493-501 (2003).
- Andersen, S. L., Thompson, A. T., Rutstein, M., Hostetter, J. C., Teicher, M. H. Dopamine receptor pruning in prefrontal cortex during the periadolescent period in rats. Synapse. 37 (2), 167-169 (2000).
- Brenhouse, H. C., Sonntag, K. C., Andersen, S. L. Transient D1 dopamine receptor expression on prefrontal cortex projection neurons: Relationship to enhanced motivational salience of drug cues in adolescence. J Neurosci. 28 (10), 2375-2382 (2008).
- Thompson, T. L., Moss, R. L. Modulation of mesolimbic dopaminergic activity over the rat estrous cycle. Neurosci Lett. 229 (3), 145-148 (1997).
- Redelsperger, I. M., et al. Stability of doxycycline in feed and water and minimal effective doses in tetracycline-inducible systems. J Am Assoc Lab Anim Sci. 55 (4), 467-474 (2016).
- Insel, T., et al. Research domain criteria (RDoC): Toward a new classification framework for research on mental disorders. Am J Psychiatry. 167 (7), 748-751 (2010).
- von Mücke-Heim, I. -. A., et al. Introducing a depression-like syndrome for translational neuropsychiatry: a plea for taxonomical validity and improved comparability between humans and mice. Mol Psychiatry. 28 (1), 329-340 (2023).
- Ben-Ami Bartal, I. The complex affective and cognitive capacities of rats. Science. 385 (6715), 1298-1305 (2024).
- Jaehne, E. J., Corrone, M., van den Buuse, M. Administering a behavioral test battery in rodents. Neurobiol Methods Protoc. , 87-100 (2024).
- Prager, E. M., Bergstrom, H. C., Grunberg, N. E., Johnson, L. R. The Importance of reporting housing and husbandry in rat research. Front Behav Neurosci. 5, 38 (2011).
- Sorge, R. E., et al. Olfactory exposure to males, including men, causes stress and related analgesia in rodents. Nat Methods. 11 (6), 629-632 (2014).
- Du Preez, A., et al. Do different types of stress differentially alter behavioral and neurobiological outcomes associated with depression in rodent models? A systematic review. Front Neuroendocrinol. 61, 100896 (2021).
- Burn, C. C. What is it like to be a rat? Rat sensory perception and its implications for experimental design and rat welfare. Appl Anim Behav Sci. 112 (1), 1-32 (2008).
- Smith, A. J., Clutton, R. E., Lilley, E., Hansen, K. E. PREPARE: Guidelines for planning animal research and testing. Lab Anim. 52 (2), 135-141 (2018).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), e1000412 (2010).
- Messlinger, K., Ellrich, J. Meningeal nociception: Electrophysiological studies related to headache and referred pain. Microsc Res Tech. 53 (2), 129-137 (2001).
- Jirkof, P. Side effects of pain and analgesia in animal experimentation. Lab Anim. 46 (4), 123-128 (2017).
- Moebus, L., Quirin, M., Ehrlenspiel, F. Cerebral asymmetry in bipolar disorders: A scoping review. Biol Psychol. 179, 108551 (2023).
- Mundorf, A., Borawski, J., Ocklenburg, S. Behavioral lateralization in bipolar disorders: A systematic review. Int J Bipolar Disord. 11 (1), 37 (2023).
- Alda, M. Lithium in the treatment of bipolar disorder: Pharmacology and pharmacogenetics. Mol Psychiatry. 20 (6), 661-670 (2015).
- Reinhardt, P. R., Theis, C. D. C., Juckel, G., Freund, N. Rodent models for mood disorders - understanding molecular changes by investigating social behavior. Biol Chem. 404 (10), 939-950 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。