Method Article
Untersuchung des Anti-Adipositas-Potenzials von Papaver somniferum-Samen in einem adipösen Rattenmodell
In diesem Artikel
Zusammenfassung
Die Studie untersucht die Wirksamkeit von Papaver somniferum-Samen bei Albino-Ratten, die durch Fettleibigkeit induziert werden. Gewaschener Mohn reduzierte effektiv das Gewicht, senkte den Glukosespiegel und verbesserte die Lipidprofile ohne Toxizität. Im Gegensatz dazu veränderten ungewaschene Samen die Blutparameter, was auf eine mögliche Toxizität und den Bedarf an weiterer Forschung hindeutet.
Zusammenfassung
Fettleibigkeit ist ein großes globales Gesundheitsproblem, von dem fast 30 % der Bevölkerung weltweit betroffen sind. Trotz der Prävalenz von Adipositas gibt es derzeit keine Daten über die Anti-Adipositas- und metabolischen Wirkungen von Papaver somniferum. Das Ziel der Studie war es, die Anti-Fettleibigkeits- und metabolischen Wirkungen von Papaver somniferum (Mohn) Samen bei fettreichen Ratten, die durch fettreiche Diät (HFD) induziert wurden, zu bestätigen und ihre Auswirkungen auf die Gewichtsreduktion, das Lipidprofil und die Organtoxizität zu bewerten. Das Experiment wurde in zwei Phasen durchgeführt: eine 4-wöchige Mohn-Intervention und eine 6-wöchige Induktionsstudie bei Fettleibigkeit. Die Ratten wurden in Gruppen eingeteilt und erhielten sowohl gewaschenen als auch ungewaschenen Mohn, HFD und ein verschreibungspflichtiges Medikament zur Gewichtsabnahme. Die Ergebnisse zeigten, dass das Waschen von Mohnsamen die Gewichtszunahme signifikant verringerte und die Lipidprofile verbesserte, insbesondere die Reduzierung von Triglyceriden, Low-Density-Lipoprotein (LDL) und Very Low-Density-Lipoprotein (VLDL). Darüber hinaus zeigten die behandelten Gruppen eine Abnahme des Glukosespiegels. Höhere Dosen von ungewaschenem Mohn verursachten jedoch einen moderaten Leberstress, was sich durch erhöhte Alanin-Aminotransferase (ALT)- und Aspartat-Aminotransferase (AST)-Spiegel zeigte, und die renale Histopathologie zeigte eine leichte Entzündung, aber die hämatologischen Parameter waren konstant. Diese Ergebnisse deuten darauf hin, dass gewaschener Mohn das Potenzial haben könnte, Fettleibigkeit zu reduzieren und die Stoffwechselgesundheit ohne nachteilige Schäden zu verbessern, was auf den Bedarf an weiterer Forschung hinweist, um ihr therapeutisches Potenzial zu erforschen.
Einleitung
Adipositas ist eine Erkrankung, die durch einen zu hohen Körperfettanteil trotz eines Body-Mass-Index (BMI) von weniger als 20 1,2 gekennzeichnet ist. Wenn das kontrollierte System des Körpers nicht in der Lage ist, das richtige Gleichgewicht zwischen Nährstoffen und Energie im Regulationssystem des Körpers aufrechtzuerhalten, führt dies zur Ansammlung von überschüssigem Körperfett, das sich im Körper ablagert3. Der BMI ist das primäre diagnostische Instrument zur Bestimmung von Normalgewicht, Übergewicht und Adipositas. Es wird häufig in der klinischen Forschung verwendet, um Personen mit Übergewicht oder Fettleibigkeit zu identifizieren. Die Forschung zeigt, dass Fettleibigkeit an und für sich eine Krankheit ist und nicht die Hauptursache für chronische Krankheiten4. Sie wird in erster Linie durch den Verzehr von übermäßig kalorienhaltigen Lebensmitteln und eine sitzende Lebensweise verursacht5. Genetische Mechanismen der Gewichtszunahme und eine längere und übermäßige Exposition gegenüber energiereichen Lebensmitteln können ebenfalls zu Fettleibigkeit beitragen. Die weltweite Prävalenz von Fettleibigkeit hat in den letzten Jahren rapide zugenommen: Schätzungsweise 2,1 Milliarden Menschen weltweit oder 30 % der Weltbevölkerung leiden an Fettleibigkeit und Übergewicht. Es wird prognostiziert, dass dieser Anteil bis 2030 40 % erreichen wird, wenn die aktuellen Trends weiter steigen. Umweltfaktoren wie Ökosysteme und soziale Probleme beeinflussen ebenfalls die Entwicklung von Adipositas 6,7. Fettleibigkeit wurde mit verschiedenen Formen von Krebs in Verbindung gebracht, darunter Gebärmutter-, Brust- und Dickdarmkrebs sowie Komorbiditäten wie Fettstoffwechselstörungen, Diabetes und Muskel-Skelett-Erkrankungen (insbesondere Osteoarthritis). Darüber hinaus ist Fettleibigkeit auch mit kardialen Risikofaktoren wie Hyperglykämie und einem hohen Body-Mass-Index verbunden. Zu den bekanntesten Faktoren, die zu Fettleibigkeit beitragen, gehören hormonelle Probleme und zwanghaftes Essen8. Obwohl traditionelle Behandlungen für Fettleibigkeit nicht umfassend untersucht wurden, bergen sie im Allgemeinen nur minimale Risiken. Auf der anderen Seite sind westliche Medikamente oft mit kostspieligen Nebenwirkungen verbunden, die erhebliche Gesundheitsrisiken darstellen können. Daher kann ein alternativer Ansatz zur Entwicklung sicherer, effizienter Medikamente gegen Fettleibigkeit darin bestehen, Naturprodukte gegen Fettleibigkeit zu untersuchen. Die Weiterentwicklung phytochemischer Studien unterstützt die traditionelle Verwendung von Heilkräutern9, die als alternative Therapie bei Fettleibigkeit eingesetzt werden können. Mehrere wissenschaftliche Untersuchungen haben seit Jahrhunderten die Wirksamkeit pflanzlicher Arzneimittel bei der Behandlung von Fettleibigkeit gezeigt. Frühere Studien haben gezeigt, dass Heilkräuter, die eine Vielzahl von pharmakologischen Bestandteilen enthalten, als Lebensmittel verzehrtwerden 10. Es wurde über das Interesse an der Verwendung von natürlichen Kräutern als Medikamente diskutiert. Die Verwendung dieser Kräuter wurde mit sehr wenigen negativen Folgen in Verbindung gebracht11; Diese Pflanzen können die Verdauung verbessern und die Gewichtsreduktion beschleunigen12. Heilpflanzen verfolgen einen vielschichtigen Ansatz zur Bekämpfung von Fettleibigkeit, der fünf Hauptmechanismen umfasst: Appetitunterdrückung, Stimulation der Thermogenese und des Fettstoffwechsels, Hemmung der Lipaseaktivität der Bauchspeicheldrüse, Prävention der Pathogenese und Förderung der Lipolyse13. Darüber hinaus enthalten natürliche Kräuter oft bioaktive Verbindungen, die als Hemmer der Verdauungsenzyme wirken und dadurch die Hydrolyse und Aufnahme von Kohlenhydraten und Fetten aus der Nahrung behindern14.
Papaver somniferum, auf dem Subkontinent allgemein als Schlafmohn oder Chaschchasch bekannt, ist eine weltweit anerkannte traditionelle Pflanze mit einer reichen Geschichte der Verwendung. Verschiedene sekundäre Pflanzenstoffe, darunter Alkaloide wie Morphin, Codein, Noscapin, Papaverin und Thebain, wurden aus Opiumisoliert 15. Während die Mohnpflanze in erster Linie mit ihren psychoaktiven und schmerzlindernden Eigenschaften in Verbindung gebracht wird, werden ihre Samen zunehmend für ihre potenziellen gesundheitlichen Vorteile anerkannt. Mohn ist eine reiche Quelle für mehrfach ungesättigte Fettsäuren, insbesondere Omega-3-Fettsäuren, die mit der Gewichtskontrolle in Verbindung gebracht werden16. Mohn enthält α-Linolensäure, eine Omega-3-Fettsäure, deren Anti-Fettleibigkeits-Potenzial große Aufmerksamkeit erregt hat. Die 10- und 12-Isomere der α-Linolensäure wurden speziell mit der Gewichtsabnahme in Verbindung gebracht. Zahlreiche Studien am Menschen haben gezeigt, dass eine Supplementierung mit einer Kombination dieser Isomere den Körperfettanteil senken kann17. Das primäre Ziel dieser Untersuchung war es, die Auswirkungen von P. somniferum auf die Gewichtsreduktion im Tiermodell zu evaluieren. Darüber hinaus zielte die Studie darauf ab, die Auswirkungen auf das Lipidprofil, die hämatologischen Parameter, die Nieren- und Leberfunktion sowie die Histologie des Fettgewebes zu bewerten.
Protokoll
Alle Verfahren wurden durchgeführt, nachdem die Ethikkommission der Universität Lahore, Pakistan, sie in der Sitzung am 21.04.2021 mit der Registrierungsnummer: REG. # genehmigt hatte EPZOOL02193026
1. Unterbringung von Tieren
- Halten Sie 35 männliche Wistar Albino-Ratten (3 Wochen alt) einzeln in Standard-Laborkäfigen. Bieten Sie während des gesamten Experiments ad libitum Zugang zu Nagetierfutter und Wasser.
- Halten Sie das Vivarium auf einer konstanten Temperatur von 22 ± 1 °C und einer relativen Luftfeuchtigkeit von 50 % ± 10 %. Implementieren Sie einen Hell-Dunkel-Zyklus von 12 h:12 h mit künstlicher Beleuchtung.
2. Gruppierung von Tieren
- Zu Beginn des Versuchs werden die Tiere in 2 Gruppen eingeteilt: fettleibig und nicht fettleibig. Versorgen Sie die adipöse Gruppe zusätzlich zur normalen Ernährung mit einer fettreichen Ernährung. Füttern Sie die nicht-adipöse Gruppe mit normaler Ernährung und verwenden Sie diese als Kontrollgruppe (Kontrolle negativ) im Experiment.
3. Zubereitung einer fettreichen Diät (HFD)
- Formulieren Sie eine fettreiche Ernährung (HFD), indem Sie den Anteil an Fetten erhöhen, die sowohl aus pflanzlichen als auch aus tierischen Quellen stammen. Kombinieren Sie den HFD mit dem Standard-Chow, um Pellets vorzubereiten.
- Stellen Sie den Fettgehalt in der HFD auf 4 g pro 30 g Futter ein. Legen Sie die Pellets für 24 h in die Tierkäfige. Wiegen und notieren Sie nach 24 Stunden das restliche Pellet und entfernen Sie es dann. Stellen Sie jeden Tag frische Pellets bereit. Behalten Sie dieses HFD-Fütterungsschema für 6 Wochen bei, um Fettleibigkeit zu induzieren.
- Überwachen Sie das Körpergewicht der Tiere und zeichnen Sie es jede Woche auf, um zu überprüfen, ob es zunimmt oder nicht. Um das Körpergewicht zu messen, stellen Sie das Glas auf die Kraftmaschine und decken Sie es ab. Gib die Ratte in das Glas, um das Gewicht zu überprüfen.
- Ergänzen Sie die gleichen Pellets in den restlichen 4 Wochen mit Mohn, um ihre möglichen Auswirkungen auf die Gewichtsabnahme zu untersuchen.
4. Gruppierung adipöser Tiere
- Nach 6 Wochen werden die adipösen Tiere weiter in vier Gruppen eingeteilt: Gruppe 1 ist die adipöse Kontrolle (Kontrollpositiv), die weiterhin mit HFD fütterte, aber keine Behandlung erhielt. Gruppe 2 (Standard) wird mit kommerziell erhältlichen Arzneimitteln (siehe Materialtabelle) zur Kontrolle von Fettleibigkeit behandelt. Gruppe 3 (ungewaschen) und Gruppe 4 (gewaschen) werden mit gewaschenem bzw. ungewaschenem Mohn gefüttert.
5. Zubereitung von Mohn
- Besorge dir Mohn (P. somniferum) von einem lokalen kommerziellen Anbieter, da er im Handel leicht erhältlich ist. Trocknen Sie die Samen einige Stunden lang in der Sonne. Teilen Sie die Samen in zwei Gruppen ein: ungewaschen und gewaschen.
- Waschen Sie den gewaschenen Gruppenmohn 7x mit destilliertem Wasser und trocknen Sie ihn anschließend in der Sonne. 500 g Mohn in ein 1 L Becherglas geben, Wasser dazugeben und mit den Händen verrühren. Entsorgen Sie dann das Wasser und wiederholen Sie den Vorgang 7x, um sicherzustellen, dass alle Verunreinigungen, Staub und andere Partikel von den Samen entfernt werden. Legen Sie die Samen nach dem Waschen zum Trocknen in das Sonnenlicht.
6. Berechnung der Dosierung und Zubereitung des Futters
- Bestimmen Sie die Dosierung basierend auf der Futteraufnahme des Tieres, standardisiert auf 30 g pro Person. Mohn in einer Konzentration von 0,5 g pro 30 g Futter verabreichen.
- Den Mohn in das Futter einarbeiten, indem er mit destilliertem Wasser zu einem Pellet vermischt wird. Bereiten Sie die Pellets während des Versuchszeitraums von 4 Wochen täglich frisch vor.
7. Sezieren von Ratten und Blutentnahme
- Fasten Sie die Ratten für 24 Stunden. Opfern Sie das Tier mit Chloroform und sammeln Sie die Blut- und Organproben für weitere Verfahren, wie unten beschrieben.
- Betäuben Sie die Ratten mit Chloroform. Verabreichen Sie Chloroform durch einen geschulten Labortechniker in einer Menge von 1 % inhaliertem Chloroform (0,05 ml/l) und stellen Sie sicher, dass die Ratte zuvor ordnungsgemäß betäubt wird, indem Sie den Fuß der Ratte einklemmen.
- Führen Sie die Dissektion mit Standard-Präparierkasteninstrumenten durch. Desinfizieren Sie ein scharfes Messer, eine Schere und eine Pinzette, bevor Sie mit der Dissektion beginnen. Entnehmen Sie während der Dissektion Nieren-, Leber- und Fettgewebeproben. Bewahren Sie die herausgeschnittenen Proben in mit Formalin gefüllten Zentrifugenröhrchen auf.
- Sammeln Sie Blutproben in EDTA-beschichteten Fläschchen. Extrahieren Sie 12 ml Blut von jedem Tier und teilen Sie dann jeweils 3 ml weiter, um die Nierenfunktion, den Leberfunktionstest und die Lipidprofilierung zu testen.
- Zentrifugieren Sie die entnommenen Blutproben bei 1.957 x g für 5 min. Trennen Sie das Blutserum vom Rest als klare oder gelbliche Flüssigkeit. Trennen Sie das Serum und aliquotieren Sie es in Mikrozentrifugenröhrchen für weitere biochemische Analysen.
8. Analyse der Probe
- Bestimmung des Gesamtlipidprofils, einschließlich Gesamtcholesterin, HDL-Cholesterin, LDL-Cholesterin, Triglyceriden und VLDL, unter Verwendung enzymatischer kolorimetrischer Standardmethoden18. Die Bestimmung des HDL-Cholesterins stützt sich auf ein zeitaufwändiges Fällungsverfahren18.
- Überwachen Sie die Glukosespiegel der Ratte während des gesamten Experiments regelmäßig mit einem Blutzuckermessgerät GL-11019.
9. Bewertung der Toxizität
- Beurteilen Sie die toxikologischen Auswirkungen von Papaver somniferum auf die Parameter ALT, AST, ALP, TP und Bilirubin mit Hilfe von Leberfunktionstests20. Messen Sie den Serumkreatininspiegel nach der in 21 beschriebenen Methodik.
- Bestimmen Sie hämatologische Parameter, einschließlich der Anzahl der roten Blutkörperchen (RBC) und der weißen Blutkörperchen (WBC), mit einem Neubauer-Hämozytometer. Bestimmen Sie die Hämoglobinkonzentration mit der Cyanmethämoglobin-Methode.
- Führen Sie eine histopathologische Untersuchung der entnommenen Gewebeproben durch. Färbeschnitte mit Hämatoxylin und Eosin (H&E) für die mikroskopische Auswertung.
10. Statistische Auswertung
- Verwenden Sie die SPSS-Software Version 16 für statistische Analysen. Wenden Sie einen unabhängigen t-Test auf die Daten des ersten Monats für die Adipositas-Induktionsstudie an.
- Verwenden Sie die ANOVA wiederholter Messungen mit LSD-Post-hoc-Test für die zweite Phase. Einsatz einer unidirektionalen ANOVA mit LSD zur Analyse von Blutparametern zur Bewertung der Toxizität
- Definieren Sie die statistische Signifikanz als p ≤ 0,05, wobei p ≤ 0,001 als hochsignifikant angesehen wird.
Ergebnisse
Ratten mit einem Anfangskörpergewicht von 40-45 g (Entwöhnungsstadium) wurden für das 70-tägige Experiment ausgewählt, das in zwei Phasen unterteilt war. In der ersten Phase, die 6 Wochen dauerte, wurde in der Versuchsgruppe Fettleibigkeit induziert, indem die Standardkost durch eine fettreiche Diät (HFD; Abbildung 1). In der anschließenden 4-wöchigen Phase wurde den adipösen Ratten Papaver somniferum verabreicht. Zu Beginn und am Ende des Experiments wurde das Körpergewicht gemessen. Wiederholte Messungen der ANOVA zeigten einen signifikanten Unterschied im Körpergewicht zwischen der Kontroll- und der Versuchsgruppe (p < 0,001) sowie einen signifikanten Einfluss der Zeit (Wochen) auf das Körpergewicht (p < 0,001). Wie in Abbildung 2 dargestellt, war das endgültige Körpergewicht der adipösen Ratten signifikant höher (p < 0,001) im Vergleich zum anfänglichen Körpergewicht der Kontrollgruppe.
Der Mohnversuch erstreckte sich über 4 Wochen (28 Tage) und umfasste die Einteilung der adipösen Ratten in vier Versuchsgruppen: Kontrollpositiv (nur HFD), Kontrollnegativ (nur Standardfutter), Gruppenstandard (HFD + kommerzielles Medikament zur Gewichtsabnahme (siehe Materialtabelle)), Gruppe gewaschen (HFD + gewaschener Mohn), Gruppe ungewaschen (HFD + ungewaschener Mohn).
Die positive Kontrollgruppe erhielt nur die fettreiche Diät (HFD) mit dem Futter, während die negative Kontrollgruppe Standardfutter erhielt. Die Standardtiere der Gruppe wurden mit einem kommerziell erhältlichen Medikament zur Gewichtsreduktion (0,5 g) behandelt. In der gewaschenen und der ungewaschenen Gruppe wurde Mohn (0,5 g) in das HFD-Futter eingearbeitet.
In Woche 1 wurde eine signifikante Gewichtszunahme sowohl in der gewaschenen als auch in der ungewaschenen Gruppe beobachtet. Im Gegensatz dazu zeigte der Gruppenstandard keine signifikante Gewichtsveränderung im Vergleich zur Kontroll-Positivgruppe (p < 0,01). In Woche 2 gab es eine Gewichtszunahme in der ungewaschenen Gruppe im Vergleich zu den anderen (p < 0,01). Dieser Trend setzte sich in Woche 3 fort, wobei die ungewaschene Gruppe eine deutliche Gewichtszunahme aufwies. In Woche 4 zeigten sowohl die ungewaschene als auch die Standardgruppe eine signifikante Gewichtszunahme im Vergleich zu den anderen Gruppen (p < 0,05). Diese Ergebnisse sind in Abbildung 3 visuell dargestellt. Wiederholte Messungen der ANOVA bestätigten einen hochsignifikanten Effekt sowohl der Zeit (Wochen) als auch der Gruppe auf das Körpergewicht (p < 0,001 für beide).
Abbildung 3 zeigt die Glukosespiegel in verschiedenen Versuchsgruppen. A steht für den höchsten Wert, während D für den niedrigsten Wert steht. Die Grafik mit hochsignifikanten Ergebnissen mit p-Wert (p < 0,001) zeigt die Hemmung der Alpha-Amylase durch Mohn. Abbildung 4A zeigt die Dichte des Lipoproteins während des Experiments, die in den Versuchsgruppen im Vergleich zur Kontrolle abnimmt; Statistisch gesehen ist der Unterschied nicht signifikant. Mohnsamen helfen, Lipoproteine niedriger und sehr niedriger Dichte (LDL und VLDL) im Blut zu reduzieren, wie in Abbildung 4B,C gezeigt. Statistisch gesehen ist der Unterschied hochsignifikant. Es gibt keinen signifikanten Einfluss auf die Triglyceride, die in Abbildung 4D dargestellt sind.
Die Anzahl der roten Blutkörperchen, die Anzahl der weißen Blutkörperchen, die Lymphozyten, die ESR, die Eosinophilen, die Thrombozytenzahl und das mittlere korpuskuläre Hämoglobin wurden in CBC-Studien untersucht. Es gibt keinen statistisch signifikanten Einfluss von Mohn auf das Blut-CBC und die Hämatologie, was darauf hindeutet, dass Mohn keine Nebenwirkungen auf die Blutparameter hat. Alanin-Transaminase (ALT), Aspartat-Aminotransaminase (AST), Bilirubin und alkalisches Phosphat wurden im Leberfunktionstest untersucht, um zu überprüfen, ob Mohn negative Auswirkungen auf die Leber hat. Es wurde keine signifikante Wirkung auf Bilirubin und alkalische Phosphate beobachtet. Ein signifikanter Anstieg von ALT (p < 0,01) und AST (p < 0,01) wurde in Standard- und ungewaschenen Gruppen beobachtet, wie in Abbildung 5 gezeigt. Dies zeigt die ungiftige Wirkung von Mohn, da er in der gewaschenen Gruppe nicht zunimmt. Serumkreatinin wird auf die Nierenfunktion untersucht und es gab keinen signifikanten Einfluss auf die Nierenfunktion (Abbildung 6). Die histopathologische Analyse ergab eine normale Leberarchitektur in der negativen Kontrollgruppe. Im Gegensatz dazu zeigten alle behandelten Gruppen unterschiedliche Ausprägungen von Leberentzündungen, die von leicht bis mittelschwer reichten. Hepatozyten zeigten Hinweise sowohl auf mikrovesikuläre als auch auf makrovesikuläre Steatose, die überwiegend um die Pfortadern und Zentralvenen lokalisiert war. (Abbildung 7). Histopathologische Untersuchung des Nierengewebes der jeweiligen Gruppen (Abbildung 8). Die histopathologische Untersuchung des Fettgewebes aus den verschiedenen Gruppen zeigte eine normale Fettgewebsarchitektur in der Kontrollgruppe. Im Gegensatz dazu zeigten die HFD-gefütterten Gruppen Hinweise auf Gefäßleckagen und leichte Entzündungen im Fettgewebe (Abbildung 9).
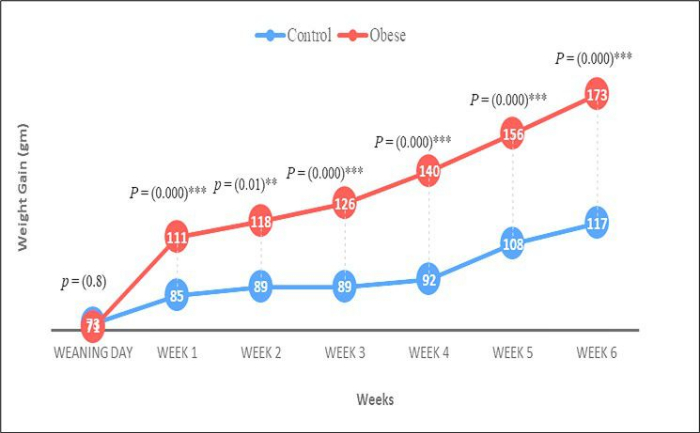
Abbildung 1: Gewichtszunahme. Die Grafik zeigt eine signifikante Zunahme des Gewichts von Ratten im Vergleich zur ersten Woche. Der Vergleich wurde mit Hilfe eines unabhängigen t-Tests durchgeführt. Die Daten werden als Mittelwert ± SE dargestellt, für den p-Wert * zeigt die am wenigsten signifikanten Ergebnisse; ** signifikante Ergebnisse zeigen und *** sehr signifikante Ergebnisse zeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Unterschied in der Gewichtszunahme. Die Grafik zeigt mehrere Vergleiche eines 4-wöchigen Experiments unter Anwendung der ANOVA mit wiederholten Messungen, die Unterschiede in der Gewichtszunahme in Versuchsgruppen zeigen, während es keinen Effekt von kommerziell gebrachten Arzneimittel- und Papaver somniferum-Samen (gewaschen und ungewaschen) gibt, um die Tiere schlank zu machen. Die Daten werden in Bezug auf (Mittelwert ± SE) dargestellt, Für den P-Wert zeigt ein Stern (*) die am wenigsten signifikanten Ergebnisse. Zwei Sterne (**) zeigen signifikante Ergebnisse an. Drei Sterne (***) zeigen hochsignifikante Ergebnisse an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
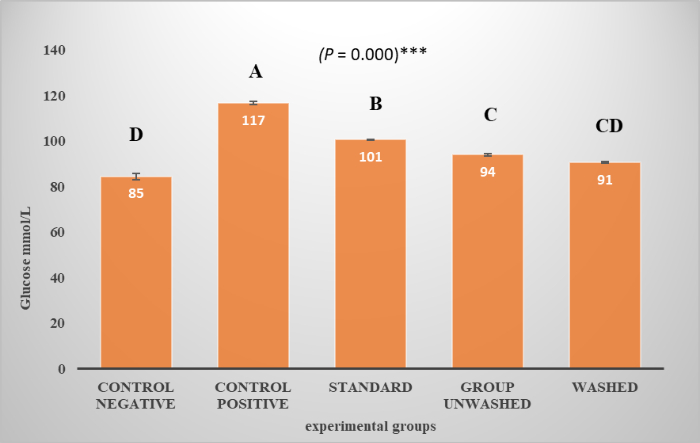
Abbildung 3: Glukosespiegel. Die Grafik zeigt die Glukosespiegel in verschiedenen Versuchsgruppen. Der P-Wert wird in einer unidirektionalen ANOVA und einer vergleichsweisen ANOVA ausgedrückt, die durch LSD angezeigt wird. Die Daten werden in Bezug auf (Mittelwert ± SE) dargestellt, Für den P-Wert zeigt ein Stern (*) die am wenigsten signifikanten Ergebnisse. Zwei Sterne (**) zeigen signifikante Ergebnisse an. Drei Sterne (***) zeigen hochsignifikante Ergebnisse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
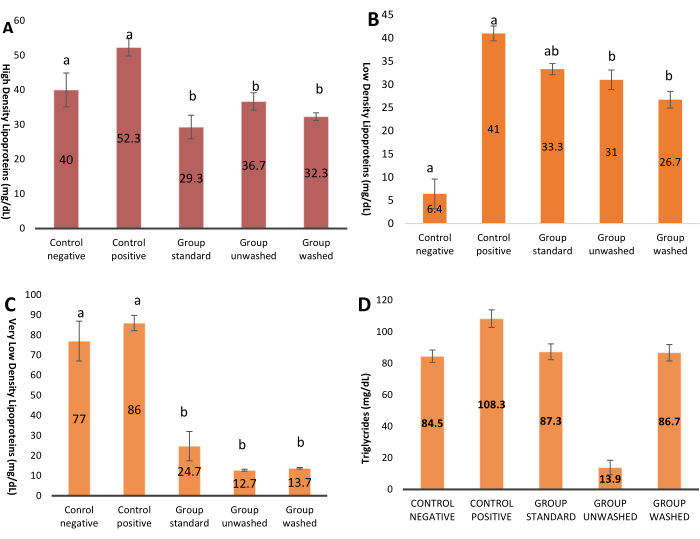
Abbildung 4: Lipidprofil. (A) Die Grafik zeigt einen Anstieg des High-Density-Lipoproteins in Versuchsgruppen. Der P-Wert wird in ONE WAY ANOVA ausgedrückt, und der paarweise Vergleich wird durch LSD gezeigt. Die Daten werden in (Mean ± SE) dargestellt. p = 0,06. (B) Das Diagramm zeigt den Gehalt an Low-Density-Lipoprotein in Versuchsgruppen. Der P-Wert, ausgedrückt in ONE WAY ANOVA und paarweiser Vergleich, wird durch LSD angezeigt. Die Daten werden in Bezug auf (Mittelwert ± SE) dargestellt, p = 0,05*. (C) Das Diagramm stellt die Höhe des VLDL-Niveaus in experimentellen Gruppen dar. Der P-Wert, ausgedrückt in ONE WAY ANOVA und paarweiser Vergleich, wird durch LSD angezeigt. Die Daten werden in Bezug auf (Mittelwert ± SE) dargestellt, p=0,000***. (D) Diagramm, das den Triglyceridspiegel in Versuchsgruppen darstellt. Der P-Wert, ausgedrückt in ONE WAY ANOVA und paarweiser Vergleich, wird durch LSD angezeigt. Die Daten werden in Bezug auf (Mittelwert ± SE) dargestellt, p = 0,22. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
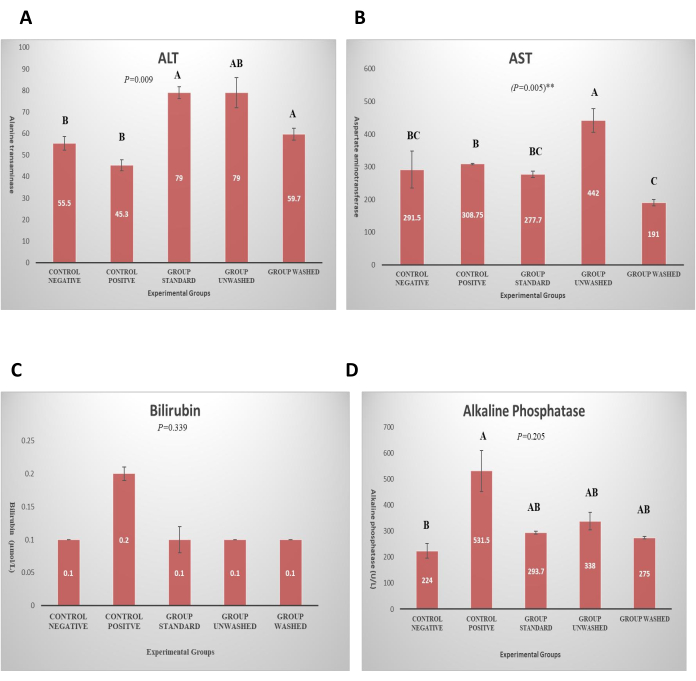
Abbildung 5: Leberfunktionstest. (A) Das Diagramm stellt ALT in verschiedenen experimentellen Gruppen dar. Der P-Wert wird in einer unidirektionalen ANOVA ausgedrückt, und der paarweise Vergleich wird durch LSD gezeigt. Die Daten werden in (Mean ± SE) dargestellt. (B) Die Grafik zeigt AST in verschiedenen Versuchsgruppen. Der P-Wert wird in einer unidirektionalen ANOVA ausgedrückt, und der paarweise Vergleich wird durch LSD gezeigt. Die Daten werden in (Mean ± SE) dargestellt. (C) Das Diagramm zeigt den Bilirubinspiegel in verschiedenen Versuchsgruppen. Der P-Wert wird in einer unidirektionalen ANOVA ausgedrückt und ein paarweiser Vergleich, der durch LSD dargestellt wird. Die Daten werden in (Mean ± SE) dargestellt. (D) Das Diagramm zeigt den alkalischen Phosphatase-Spiegel in verschiedenen Versuchsgruppen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
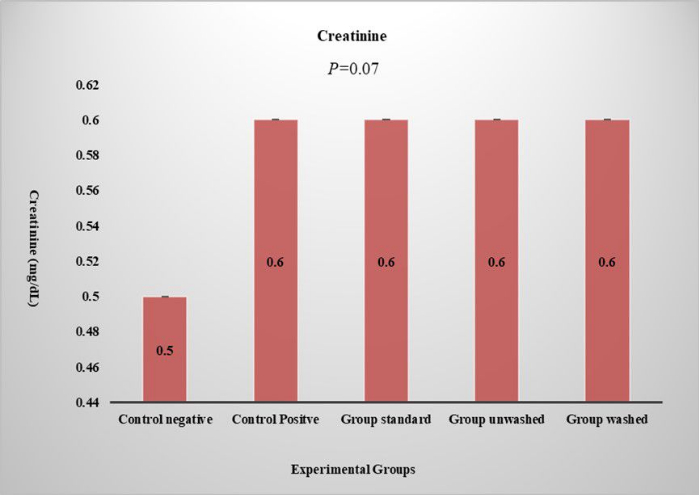
Abbildung 6: Serumkreatininspiegel. Die Grafik zeigt die Kreatininspiegel in verschiedenen Versuchsgruppen. Der P-Wert wird in einer unidirektionalen ANOVA und einer vergleichsweisen ANOVA ausgedrückt, die durch LSD angezeigt wird. Die Daten werden in (Mean ± SE) dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Histopathologische Untersuchung des Lebergewebes. Die histopathologische Untersuchung zeigt eine normal aussehende Leber in kontrollierter Haltung, aber alle anderen behandelten Gruppen zeigen eine leichte bis mittelschwere Entzündung. Hepatozyten zeigen eine Mikro- und Makrosteatose um die Pfortaderräume und perivenulären Bereiche. 40-fache Auflösung von (A) Gruppenkontrolle negativ (B) Gruppenkontrolle positiv (C) Gruppenstandard (D) Gruppe ungewaschen (E) Gruppe gewaschen zeigt normal aussehende kontrollnegative Leber, während sie in anderen Gruppen fettig und geschädigt ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
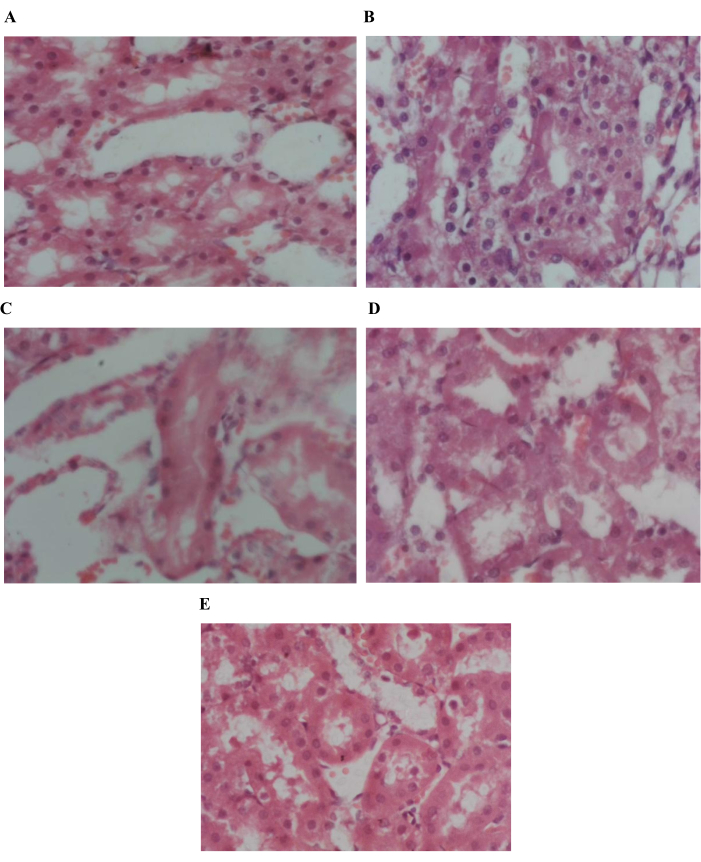
Abbildung 8: Histopathologische Untersuchung des Nierengewebes. 40-fache Auflösung von (A) Gruppenkontrolle negativ (B) Gruppenkontrolle positiv (C) Gruppe Standard (D) Gruppe ungewaschen (E) Gruppe gewaschen zeigt normales Fettgewebe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 9: Histopathologische Untersuchung des Fettgewebes. Die histopathologische Untersuchung des Fettgewebes der jeweiligen Gruppen zeigt normales Fettgewebe mit undichten Blutgefäßen und leichten Entzündungen aufgrund von HFD. 40-fache Auflösung von (A) Gruppenkontrolle negativ (B) Gruppenkontrolle positiv (C) Gruppe Standard (D) Gruppe ungewaschen (E) Gruppe gewaschen zeigt normales Fettgewebe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das Protokoll umfasst die folgenden kritischen Schritte, die beachtet werden müssen. Der erste entscheidende Schritt bestand darin, Fettleibigkeit bei den Tieren durch fettreiche Ernährung zu induzieren. Der zweite Schritt bestand darin, Tiere, die sich fettreich ernähren, darauf zu überwachen, dass sie aufgrund von HFD keinen Diabetes oder eine andere Krankheit entwickeln.
Das Protokoll weist außerdem die folgenden Einschränkungen auf. Aufgrund akademischer Einschränkungen betrug die experimentelle Zeit, um die genaue Wirkung von Mohn zu untersuchen, nur 10 Wochen. Eine genauere Untersuchung von Mohnsamen mit unterschiedlichen Dosierungen sollte untersucht werden. Aufgrund der Nichtverfügbarkeit von fortschrittlicher Ausrüstung, Ressourcen und Finanzierung konnten wir nur grundlegende Tests durchführen, und dies ist die größte Einschränkung.
Die Ergebnisse dieser Studie zeigen, dass es aufgrund dieser Samen keinen Gesamteffekt oder Gewichtsverlust gibt. Irgendwie helfen Papaver somniferum-Samen , die Lipide zu senken, indem sie gewaschenen Mohnsamen verwenden, was die Aussage unterstützt, dass mit einer genaueren Dosierung und Dauer der Versuchsdurchführung das Gewicht durch die Verwendung von gewaschenen Mohnsamen reduziert werden kann. Ungewaschener Mohn hat aufgrund von Morphin und Beruhigungsmitteln, die in großen Mengen in ihm enthalten sind, nachteilige Auswirkungen auf das Lipidprofil und die Hämatologie. Da an diesen Samen keine Untersuchungen zur Gewichtsabnahme durchgeführt wurden, wird empfohlen, experimentelle Arbeiten durchzuführen, um ihre Auswirkungen auf das Gewichtskontrollmanagement durch die Kontrolle von Lipiden zu überprüfen. Ein Dyslipidämieprofil, das durch erhöhte Serum-Gesamtcholesterinwerte, Low-Density-Lipoprotein-Cholesterin (LDL-C) und Triglyceride in Verbindung mit einem reduzierten HDL-C-Spiegel (High-Density-Lipoprotein-Cholesterin) gekennzeichnet ist, ist ein gut etablierter Risikofaktor für Herz-Kreislauf-Erkrankungen. Es ist bemerkenswert, dass selbst bei normalen LDL-C- und Triglyceridspiegeln ein niedriger HDL-C-Spiegel ein erhebliches Risiko für die koronare Gesundheit darstellen kann, vergleichbar mit einem erhöhten LDL-C-Spiegel. HDL-C spielt eine entscheidende Rolle bei der Umkehrung des Cholesterintransports und mildert dadurch die atherosklerotische Belastung. Darüber hinaus weist HDL-C entzündungshemmende, antioxidative, antithrombotische, antiapoptotische und gefäßerweiternde Eigenschaftenauf 22.
In der vorliegenden Studie führte die Verabreichung von Papaver somniferum-Samen in der gewählten Dosierung zu keinen signifikanten Veränderungen der Lipidprofilparameter, mit Ausnahme von Triglyceriden. Bemerkenswert ist, dass die ungewaschene Gruppe im Vergleich zu den anderen Gruppen die niedrigsten Triglyceridspiegel aufwies.
Die Verwendung von gewaschenem und ungewaschenem Mohn in der Studie zeigt, dass die Zubereitungsmethode die Ergebnisse erheblich beeinflusst. Die ungewaschenen Samen zeigten zwar einige positive Auswirkungen auf den Triglyceridspiegel, führten aber auch zu nachteiligen Auswirkungen, insbesondere auf die Blutwerte und den potenziellen Leberstress. Der Waschprozess entfernt oder reduziert wahrscheinlich die Konzentration bestimmter Verbindungen, die in den Samen vorhanden sind, was den Unterschied in den Ergebnissen erklären könnte. Der potenzielle Leberstress, der durch erhöhte ALT- und AST-Spiegel in den Gruppen angezeigt wird, die ungewaschenen Mohn erhalten, ist ein kritisches Problem. Der Waschvorgang kann diese toxischen Substanzen entfernen oder verdünnen, da die Gruppe, die gewaschene Samen erhielt, nicht das gleiche Maß an Leberenzymerhöhung aufwies23. Die Studie erwähnt, dass Opium, das aus der Mohnpflanze gewonnen wird, verschiedene Alkaloide enthält, darunter Morphin, Codein und Thebain. Es ist bekannt, dass diese Alkaloide potenziell hepatotoxische Wirkungen haben, insbesondere wenn sie in höheren Dosen oder über längere Zeiträume konsumiert werden. Restmengen dieser Alkaloide oder anderer toxischer Verbindungen können auf den ungewaschenen Samen verbleiben und zu dem beobachteten Leberstress beitragen. Die Ergebnisse der Studie unterstreichen, wie wichtig die richtige Zubereitung und Verarbeitung von Naturprodukten ist, auch wenn sie traditionell als sicher gelten. Das Vorhandensein potenziell giftiger Verbindungen in ungewaschenem Mohn unterstreicht die Notwendigkeit weiterer Forschung, um diese Stoffe zu identifizieren und zu charakterisieren und Richtlinien für den sicheren Verzehr festzulegen. Das Waschverfahren scheint eine wirksame Methode zur Verringerung der potenziellen Toxizität von Mohn zu sein, aber es sind weitere Untersuchungen erforderlich, um die optimalen Waschverfahren zu bestimmen und die langfristige Sicherheit des Verzehrs von gewaschenem Mohn zu bewerten.
Die Ergebnisse der Studie unterstreichen eine klare Unterscheidung zwischen den Auswirkungen von gewaschenem und ungewaschenem Mohn. Gewaschenes Saatgut scheint potenzielle Vorteile bei der Behandlung von Fettleibigkeit und der Verbesserung der Stoffwechselgesundheit zu bieten, ohne signifikante Nebenwirkungen zu verursachen24. Im Gegensatz dazu zeigen ungewaschene Samen zwar einige positive Auswirkungen auf den Triglyceridspiegel, weisen aber auch eine potenzielle Toxizität auf, insbesondere in Bezug auf die Lebergesundheit. Die beobachtete Leberentzündung, auch wenn sie kurzfristig leicht bis mittelschwer verläuft, gibt Anlass zur Besorgnis über die langfristigen Auswirkungen des Verzehrs von ungewaschenem Mohn. Chronische Entzündungen können zu fortschreitenden Leberschäden führen, die möglicherweise zu Fibrose, Zirrhose oder sogar Leberversagen führenkönnen 25. Daher ist es wichtig, beim Verzehr von ungewaschenem Mohn Vorsicht walten zu lassen und der Verwendung von gewaschenem Saatgut Vorrang einzuräumen, das ein sichereres Profil zu haben scheint. Die Ergebnisse der Studie unterstreichen die Notwendigkeit weiterer Forschung, um das Sicherheitsprofil von P. somniferum vollständig aufzuklären, insbesondere im Hinblick auf die Langzeitwirkungen seines Verzehrs in verschiedenen Formen und Dosierungen.
Die beobachtete Zunahme des Körpergewichts in der ungewaschenen Samengruppe in Verbindung mit einer möglichen Lebertoxizität deutet darauf hin, dass die Behandlung unbeabsichtigte und potenziell schädliche Auswirkungen haben kann. Es ist wichtig, strengere und langfristigere Studien durchzuführen, um die Sicherheit und Wirksamkeit von P. somniferum als Mittel gegen Fettleibigkeit umfassend zu bewerten. In diesen Studien sollten verschiedene Zubereitungsmethoden, Dosierungen und Behandlungsdauern untersucht werden, um sichere und wirksame Verzehrrichtlinien festzulegen. Darüber hinaus sind weitere Forschungen erforderlich, um die spezifischen Verbindungen zu identifizieren und zu charakterisieren, die für die beobachteten positiven und nachteiligen Wirkungen verantwortlich sind, um standardisierte und sichere Präparate von P. somniferum für einen möglichen therapeutischen Einsatz zu entwickeln.
Es wird postuliert, dass eine Verringerung der Pankreas-Amylase-Aktivität zu einer verminderten Glukoseabsorption führen kann, indem sie die Verdauung behindert, was folglich zu einer geringeren Kalorienaufnahme führt26. Mehrere wissenschaftliche Untersuchungen haben das Potenzial von pflanzlichen α-Amylase-Hemmern gezeigt, die postprandiale Hyperglykämie abzuschwächen und so zur Kontrolle des gestörten Glukosestoffwechsels und zur Vorbeugung von Stoffwechselstörungen beizutragen. Zum Beispiel hat sich gezeigt, dass eine orale Supplementierung mit Bauhinia purpurea-Extrakt die Pankreas-Lipase- und Amylase-Aktivitäten bei Ratten, die mit Hypercholesterinämie gefüttert werden, verringert19. Amylase und Lipase, Schlüsselenzyme, die am Kohlenhydrat- und Fettstoffwechsel beteiligt sind, werden zunehmend als therapeutische Ziele für die Behandlung verschiedener Stoffwechselerkrankungen, einschließlich Fettleibigkeit, erforscht. Diätetische Interventionen und Naturprodukte, die als Amylase- und Pankreaslipasehemmer wirken, gewinnen als potenzielle Strategien zur Hemmung der Darmfettaufnahme an Bedeutung, was das Gewichtsmanagement erleichtern kann27.
In der aktuellen Studie wurde in den behandelten Gruppen im Vergleich zu den Kontrollgruppen eine Abnahme des Glukosespiegels beobachtet. Darüber hinaus waren die Triglyceridspiegel in der ungewaschenen Gruppe reduziert. Weitere Untersuchungen, bei denen unterschiedliche Dosierungen und Konzentrationen von Papaver somniferum verwendet werden, können Aufschluss über seine mögliche Rolle bei der Modulation des Fettstoffwechsels geben, insbesondere in Bezug auf die Lipasehemmung.
Die behandelten Gruppen wiesen im Vergleich zu den Kontrollgruppen auch erhöhte HDL-Spiegel auf, was möglicherweise auf die Dosisdifferenzierung zurückzuführen ist. Ebenso waren die LDL-Spiegel in den behandelten Gruppen höher als in der negativen Kontrollgruppe, wobei die positive Kontrollgruppe die höchsten LDL-Werte aufwies. Umgekehrt waren die VLDL- und Triglyceridspiegel in den behandelten Gruppen niedriger als in der Kontrollgruppe. Diese Variabilität der Ergebnisse kann durch die fettreiche Ernährung beeinflusst werden.
Undichte Blutgefäße und Entzündungen in behandelten Gruppen, Standard- und Kontroll-positiven Gruppen werden aufgrund der Akkumulation von HFD gezeigt. Laut einer Studie verringert Muskatnussextrakt die Anzahl der Adipozyten28. In einer Studie wurde Tamarindus indica L verwendet. Pulpa zur Reduzierung des Gesamtkörpergewichts durch Reduzierung der Anzahl der Adipozyten29. Unser Ergebnis zeigt, dass die unbehandelte Gruppe im Vergleich zur behandelten Gruppe, die eine reduzierte Größe der Adipozyten aufweist, signifikant höhere Nebenhoden aufweist (p = 0,05; Abbildung 8). Die Ergebnisse dieser Forschung zeigten, dass Papaver somniferum-Samen (gewaschen) dazu beitragen, den Lipidspiegel im Körper zu senken, während ungewaschene Papaver somniferum-Samen die Triglyceride senken. Gleichzeitig beeinflussen die Samen von Papaver somniferum die Histopathologie des Fettgewebes nicht nachteilig. Ungewaschene Samen wirken sich negativ auf die Blutwerte aus, indem sie ihren Spiegel im Blut erhöhen. Daher kann die Verwendung von gewaschenen Papaver somniferum-Samen die Fettleibigkeit kontrollieren, möglicherweise mit einer Verlängerung der Dauer für die Durchführung des Experiments und die Berechnung der Dosis. Es sollten weitere Studien mit der Erhöhung der Dosis und der Zeitdauer durchgeführt werden, um unterschiedliche Ergebnisse zu erzielen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren möchten der Researchers Supporting Project Number (RSPD2025R986) der King Saud University, Riad, Saudi-Arabien, ihre aufrichtige Anerkennung aussprechen.
Materialien
| Name | Company | Catalog Number | Comments |
| Blood glucose monitor GL-110 | Certeza | GL-110 | A portable device used to measure blood glucose levels. |
| Centrifuge | Eppendorf | 22620005 | A laboratory equipment that spins samples at high speeds to separate components based on density. |
| EDTA-coated vials | BD Vacutainer | 367861 | Tubes used for collecting blood samples, preventing clotting by binding calcium ions. |
| Eppendorf tubes | Eppendorf | 0030 120.094 | Small plastic tubes used for storing and handling small volumes of liquid. |
| Falcon tubes | Corning | 352059 | Conical tubes used for centrifugation and various laboratory applications. |
| Microscope | Olympus | CX23RF100 | An optical instrument used for viewing small objects, typically magnified through lenses. |
| Neubauer hemocytometer | Hawksley | H.H1 | A specialized slide used for counting cells under a microscope. |
| Orlistat120 mg | Windlas Biotech Ltd | ||
| Pipette tips | Eppendorf | 0030 073.435 | Disposable tips used with pipettes for transferring liquids accurately. |
| Serological pipettes | Falcon | 357551 | Graduated pipettes used for transferring liquids in larger volumes. |
| SPSS software version 16 | IBM | N/A (software, not a physical product) | A statistical software package used for data analysis. |
| Standard laboratory cage (Super Mouse 750) | Lab Products, Inc. | 10021 | A cage designed to house laboratory mice, providing a controlled environment. |
Referenzen
- Da Costa, G. F., et al. The beneficial effect of anthocyanidin-rich Vitis vinifera l. Grape skin extract on metabolic changes induced by a high-fat diet in mice involves anti-inflammatory and antioxidant actions. Phytother Res. 31 (10), 1621-1632 (2017).
- Andersen, M. M., Varga, S., Folker, A. P. On the definition of stigma. J Evaluat Clin Pract. 28 (5), 847-853 (2022).
- Archer, E., Hill, J. O. Body, and fat mass are not regulated, controlled, or defended: An introduction to the invisible hand and 'competition ' models of metabolism. Progr Cardiovasc Dis. 79, 56-64 (2023).
- Imhagen, A., Karlsson, J., Jansson, S., Anderzén-Carlsson, A. A lifelong struggle for a lighter tomorrow: A qualitative study on experiences of obesity in primary healthcare patients. J Clin Nurs. 32 (5-6), 834-846 (2023).
- Alonso-Castro, A. J., et al. Self-treatment with herbal products for weight loss among overweight and obese subjects from central Mexico. J Ethnopharmacol. 234, 21-26 (2019).
- Alsareii, S. A., et al. Iot framework for a decision-making system of obesity and overweight extrapolation among children, youths, and adults. Life. 12 (9), 1414 (2022).
- Bautista, R. J. H., Mahmoud, A. M., Königsberg, M., Guerrero, N. E. L. D. Obesity: Pathophysiology, monosodium glutamate-induced model and anti-obesity medicinal plants. Biomed Pharmacother. 111, 503-516 (2019).
- Radin, R. M., et al. Do stress eating or compulsive eating influence metabolic health in a mindfulness-based weight loss intervention. Health Psychol. 39 (2), 147 (2020).
- De Freitas Junior, L. M., De Almeida Jr, E. B. Medicinal plants for the treatment of obesity: Ethnopharmacological approach and chemical and biological studies. Am J Transl Res. 9 (5), 2050 (2017).
- Awuchi, C. G. Medicinal plants: The medical, food, and nutritional biochemistry and uses. Int J Adv Acad Res. 5 (11), 220-241 (2019).
- Ozioma, E. O. J., Chinwe, O. a. N. Herbal medicines in african traditional medicine. Herbal Med. 10, 191-214 (2019).
- Al-Snafi, A. E., Singh, S., Bhatt, P., Kumar, V. A review on prescription and non-prescription appetite suppressants and evidence-based method to treat overweight and obesity. GSC Biol Pharmaceut Sci. 19 (3), 148-155 (2022).
- Saad, B., Zaid, H., Shanak, S., Kadan, S. . Anti-diabetes and Anti-obesity Medicinal Plants and Phytochemicals: Safety, Efficacy, and Action Mechanisms. , (2017).
- Ardeshirlarijani, E., et al. Potential anti-obesity effects of some medicinal herbs: In vitro α-amylase, α-glucosidase, and lipase inhibitory activity. Int Biol Biomed J. 5 (2), 1-8 (2019).
- Haber, I., Pergolizzi, J., Lequang, J. A. Poppy seed tea: A short review and case study. Pain Ther. 8, 151-155 (2019).
- Liu, R., et al. Omega-3 polyunsaturated fatty acids prevent obesity by improving tricarboxylic acid cycle homeostasis. J Nutri Biochem. 88, 108503 (2021).
- Basak, S., Duttaroy, A. K. Conjugated linoleic acid and its beneficial effects in obesity, cardiovascular disease, and cancer. Nutrients. 12 (7), 1913 (2020).
- Mcclatchey, K. . Clinical laboratory medicine. , (2002).
- Padmaja, T. K., Naidu, P. B., Kumar, G. E. N. H., Ganapathy, S., Balaji, M. Antiobesity activity of bauhinia purpurea extract: Effect on hormones and lipid profile in high-calorie diet-induced obese rats. Adv Biosci Biotechnol. 5 (11), 861 (2014).
- Bülbül, T., Gür, E., Bozkurt, F., Eryavuz, A., Bülbül, A. Biochemical, hematological and histopathological evaluation of the food-safety of the leaf extract of Papaver somniferum in rats. J Trad Compl Med. 10 (6), 544-554 (2021).
- Precious, I. O., Ayoka, T. O., Nnadi, C. O. In-vivo sub-chronic toxicological evaluation of extract of vernonia glaberrima leaves in experimental rats. Notulae Sci Biol. 14 (2), 11181-11181 (2022).
- Bonizzi, A., Piuri, G., Corsi, F., Cazzola, R., Mazzucchelli, S. Hdl dysfunctionality: Clinical relevance of quality rather than quantity. Biomedicines. 9 (7), 729 (2021).
- Cabot, S. Hepatitis and aids: A plan to recover with complementary and modern treatments. SCB International. , (2015).
- Mohamed, S. S., Fayed, A. H. M. Anti-obesity synergistic effect of pomegranate seed oil (pso) and arabic gum (ag) in albino rats. Int J Vet Sci. 9 (1), 84-89 (2020).
- Czaja, A. J. Hepatic inflammation and progressive liver fibrosis in chronic liver disease. World J Gastroenterol. 20 (10), 2515 (2014).
- Barrett, A. H., Farhadi, N. F., Smith, T. J. Slowing starch digestion and inhibiting digestive enzyme activity using plant flavanols/tannins-a review of efficacy and mechanisms. Lwt. 87, 394-399 (2018).
- Nakajima, K., Muneyuki, T., Munakata, H., Kakei, M. Revisiting the cardiometabolic relevance of serum amylase. BMC Res Notes. 4, 1-5 (2011).
- Lesmana, R., et al. Nutmeg extract potentially alters the characteristics of white adipose tissue in rats. Vet Med Sci. 7 (2), 512-520 (2021).
- Azman, K. F., et al. Antiobesity effect of tamarindus indica l. Pulp aqueous extract in high-fat diet-induced obese rats. J Natural Med. 66, 333-342 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten