Method Article
Ein hochdurchsatzgesteuertes, stereotaktisches Neuronavigations- und fokussiertes Ultraschallsystem für die Öffnung der Blut-Hirn-Barriere bei Nagetieren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Blut-Hirn-Schranke (BBB) kann vorübergehend mit mikrobubble-vermitteltem fokussiertem Ultraschall (FUS) gestört werden. Hier beschreiben wir ein Schritt-für-Schritt-Protokoll für bBB-Hochdurchsatzöffnung envivo mit einem modularen FUS-System, das für Nicht-Ultraschall-Experten zugänglich ist.
Zusammenfassung
Die Blut-Hirn-Schranke (BBB) war eine große Hürde für die Behandlung verschiedener Hirnerkrankungen. Endothelzellen, die durch enge Knoten verbunden sind, bilden eine physiologische Barriere, die verhindert, dass große Moleküle (>500 Da) in das Gehirngewebe gelangen. Mikrobubble-vermittelter fokussierter Ultraschall (FUS) kann verwendet werden, um eine transiente lokale BBB-Öffnung zu induzieren, so dass größere Medikamente in das Blutparenchym gelangen.
Zusätzlich zu groß angelegten klinischen Geräten für die klinische Übersetzung erfordert die präklinische Forschung zur Beurteilung von Therapiereaktionen von Wirkstoffkandidaten spezielle Kleintier-Ultraschall-Setups für eine gezielte BBB-Öffnung. Vorzugsweise ermöglichen diese Systeme Hochdurchsatz-Workflows sowohl mit hoher räumlicher Präzision als auch bei integrierter Kavitationsüberwachung, während sie sowohl bei den Anfangsinvestitionen als auch bei den betriebskostenden Kosten kostengünstig sind.
Hier präsentieren wir ein biolumineszierendes und röntgengeführtes stereotaktisches Kleintier-FUS-System, das auf handelsüblichen Komponenten basiert und die oben genannten Anforderungen erfüllt. Ein besonderer Schwerpunkt wurde auf einen hohen Automatisierungsgrad gelegt, der die Herausforderungen erleichtert, die typischerweise in hochvolumigen präklinischen Arzneimittelbewertungsstudien auftreten. Beispiele für diese Herausforderungen sind die Notwendigkeit einer Standardisierung, um die Reproduzierbarkeit der Daten sicherzustellen, die gruppeninterne Variabilität zu reduzieren, die Stichprobengröße zu reduzieren und damit ethische Nonden zu erfüllen und unnötige Arbeitsbelastung zu verringern. Das vorgeschlagene BBB-System wurde im Rahmen der BBB-Eröffnung erleichterter Arzneimittelabgabestudien an patientenabgeleiteten Xenograft-Modellen von Glioblastom multiforme und diffusem Mittelliniengliom validiert.
Einleitung
Die Blut - Hirn-Schranke (BBB) ist ein großes Hindernis für die Verabreichung von Medikamenten in das Gehirn Parenchym. Die meisten therapeutischen Medikamente, die entwickelt wurden, kreuzen die BBB aufgrund ihrer physikalisch-chemischen Parameter (z. B. Lipophilie, Molekulargewicht, Wasserstoffbindungsakzeptoren und Spender) nicht oder werden aufgrund ihrer Affinität zu Efflux-Transportern im Gehirn nicht beibehalten1,2. Die kleine Gruppe von Medikamenten, die die BBB überqueren können, sind in der Regel kleine lipophile Moleküle, die nur bei einer begrenzten Anzahl von Gehirnerkrankungen wirksam sind1,2. Infolgedessen sind für die meisten Hirnerkrankungen die möglichkeiten der pharmakologischen Behandlung begrenzt und neue Strategien zur Medikamentenabgabe erforderlich3,4.
Therapeutischer Ultraschall ist eine neue Technik, die für verschiedene neurologische Anwendungen wie BBB Disruption (BBBD), Neuromodulation und Ablation4,5,6,7verwendet werden kann. Um eine BBB-Öffnung mit einem extrakorporalen Ultraschall-Emitter durch das Schädel zu erreichen, wird fokussierter Ultraschall (FUS) mit Mikroblasen kombiniert. Mikrobubble-vermittelte FUS führt zu erhöhter Bioverfügbarkeit von Medikamenten im Gehirn Parenchym5,8,9. In Gegenwart von Schallwellen beginnen Mikroblasen zu oszillieren, die Transzytose und Störungen der engen Kreuzungen zwischen den Endothelzellen des BBB zu stören, was den parazellulären Transport größerer Moleküleermöglicht 10. Frühere Studien bestätigten den Zusammenhang zwischen der Intensität der akustischen Emission und den biologischen Auswirkungen auf die BBB-Öffnung11,12,13,14. FUS in Kombination mit Mikroblasen wurde bereits in klinischen Studien zur Behandlung von Glioblastom mit Temozolomid oder liposomalem Doxorubicin als Chemotherapeutikum oder zur Therapie der Alzheimer-Krankheit und der amyotrophen Lateralsklerose5,9,15,16eingesetzt.
Da ultraschallvermittelte BBB-Eröffnung zu völlig neuen Möglichkeiten der Pharmakotherapie führt, ist eine präklinische Forschung für die klinische Translation erforderlich, um die Therapiereaktion ausgewählter Arzneimittelkandidaten zu bewerten. Dies erfordert in der Regel einen Workflow mit hohem Durchsatz mit hoher räumlicher Präzision und vorzugsweise einer integrierten Kavitationsdetektion zur Überwachung der gezielten BBB-Öffnung mit hoher Reproduzierbarkeit. Wenn möglich, müssen diese Systeme sowohl bei den Anfangsinvestitionen als auch bei den laufenden Kosten kosteneffektiv sein, um je nach Studiengröße skalierbar zu sein. Die meisten präklinischen FUS-Systeme werden mit MRT zur Bildführung und Behandlungsplanung15,17,18,19kombiniert. Obwohl MRT detaillierte Informationen über die Tumoranatomie und das Volumen liefert, ist es eine teure Technik, die in der Regel von ausgebildeten/qualifizierten Bedienern durchgeführt wird. Darüber hinaus ist eine hochauflösende MRT für Forscher in präklinischen Einrichtungen möglicherweise nicht immer verfügbar und erfordert lange Scanzeiten pro Tier, was sie weniger für pharmakologische Studien mit hohem Durchsatz geeignet macht. Bemerkenswert ist, dass für die präklinische Forschung auf dem Gebiet der Neuroonkologie, insbesondere infiltrative Tumormodelle, die Möglichkeit, den Tumor zu visualisieren und zu zielen, für den Behandlungserfolg20von entscheidender Bedeutung ist. Derzeit wird diese Anforderung nur durch MRT oder durch mit einem Photoprotein transduzierte Tumore erfüllt, die eine Visualisierung mit Biolumineszenzbildgebung (BLI) in Kombination mit der Verabreichung des Photoproteinsubstrats ermöglichen.
MRT-geführte FUS-Systeme verwenden oft ein Wasserbad, um eine Ultraschallwellenausbreitung für transkranielle Anwendungen zu gewährleisten, wobei der Kopf des Tieres teilweise im Wasser versunken ist, die sogenannten "Bottom-up"-Systeme15,17,18. Während diese Designs in kleineren Tierstudien im Allgemeinen gut funktionieren, sind sie ein Kompromiss zwischen Tiervorbereitungszeiten, Portabilität und realistisch zu wartenden Hygienestandards während des Einsatzes. Als Alternative zur MRT umfassen andere Leitmethoden für die stereotaktische Navigation die Verwendung eines anatomischen Nagetieratlas21,22,23, Laserpointer unterstützte Visuelle Sichtung24, lochgestütztes mechanisches Scangerät25oder BLI26. Die meisten dieser Designs sind "Top-down"-Systeme, bei denen der Messumformer auf dem Kopf des Tieres platziert wird, wobei das Tier in einer natürlichen Position ist. Der Workflow ''top-down'' besteht entweder aus einem Wasserbad22,25,26 oder einem wassergefüllten Kegel21,24. Der Vorteil eines Messumformers in einem geschlossenen Kegel ist die kompaktere Grundfläche, kürzere Rüstzeiten und geradlinige Dekontaminationsmöglichkeiten, die den gesamten Arbeitsablauf vereinfachen.
Die Wechselwirkung des akustischen Feldes mit den Mikroblasen ist druckabhängig und reicht von Schwingungen mit geringer Amplitude (als stabile Kavitation bezeichnet) bis zum transienten Blasenkollaps (bezeichnet als Inertialkavitation)27,28. Es besteht ein fester Konsens, dass Ultraschall-BBBD einen akustischen Druck weit über der stabilen Kavitationsschwelle benötigt, um eine erfolgreiche BBBD zu erreichen, aber unterhalb der Trägheitskavitationsschwelle, die in der Regel mit vaskulären/neuronalen Schäden verbunden ist29. Die häufigste Form der Überwachung und Steuerung ist die Analyse des (rücken-)streunenden akustischen Signals mittels passiver Kavitationserkennung (PCD), wie von McDannold et al.12vorgeschlagen. PCD stützt sich auf die Analyse der Fourier-Spektren von Mikroblasen-Emissionssignalen, bei denen die Stärke und das Aussehen stabiler Kavitationsmerkmale (Harmonika, Subharmonik und Ultraharmonik) und Trägialkavitationsmarker (Breitbandantwort) in Echtzeit gemessen werden können.
Eine "One Size fits all" PCD-Analyse zur präzisen Druckregelung ist aufgrund der Polydispersität der Mikroblasenformulierung (die Schwingungsamplitude hängt stark vom Blasendurchmesser ab), den Unterschieden in den Blasenschaleneigenschaften zwischen den Marken und der akustischen Schwingung, die stark von Frequenz und Druck30,31,32abhängt, kompliziert. Als Konsequenz wurden viele verschiedene PCD-Detektionsprotokolle vorgeschlagen, die an bestimmte Kombinationen all dieser Parameter angepasst wurden und in verschiedenen Anwendungsszenarien (von In-vitro-Experimenten über Kleintierprotokolle bis hin zu PCD für den klinischen Einsatz) für eine robuste Kavitationsdetektion und sogar für die rückwirkende Rückkopplungskontrolle des Drucks11,14,30,31,32,33,34,35. Das im Rahmen dieser Studie verwendete PCD-Protokoll wird direkt von McDannold et al.12 abgeleitet und überwacht die harmonische Emission auf das Vorhandensein stabiler Kavitation und Breitbandrauschen zur Trägzkavitationserkennung.
Wir haben ein bildgesteuertes Neuronavigations-FUS-System zur vorübergehenden Öffnung des BBB entwickelt, um die Medikamentenabgabe in das Hirnparenchym zu erhöhen. Das System basiert auf handelsüblichen Komponenten und kann je nach den verfügbaren bildgebenden Verfahren in der Tieranlage einfach an verschiedene bildgebende Modalitäten angepasst werden. Da wir einen Workflow mit hohem Durchsatz benötigen, haben wir uns für die Bildführung und Behandlungsplanung für Röntgen und BLI entschieden. Tumorzellen, die mit einem Photoprotein (z.B. Luziferase) transduziert werden, eignen sich für die BLI-Bildgebung20. Nach Verabreichung des Photoproteinsubstrats können Tumorzellen in vivo und Tumorwachstum und -ort bestimmt werden20,36. BLI ist eine kostengünstige bildgebende Modalität, es ermöglicht es, das Tumorwachstum im Laufe der Zeit zu verfolgen, es hat schnelle Scanzeiten und es korreliert gut mit Tumorwachstum gemessen mit MRT36,37. Wir haben uns entschieden, das Wasserbad durch einen mit Wasser gefüllten Kegel zu ersetzen, der am Messumformer befestigt ist, um Flexibilität zu ermöglichen, die Plattform, auf der das Nagetier montiert ist, frei zu bewegen8,24. Das Design basiert auf einer abnehmbaren Plattform, die mit der Integration von (I) kleintierischen Stereotaktik-Plattformen (II) mit Röntgen- und optischer Bildkompatibilität (III), schnell abnehmbarer Anästhesiemaske und (IV) integriertem temperaturregulierten Tierheizungssystem ausgestattet ist. Nach der ersten Induktion der Anästhesie wird das Tier in einer genauen Position auf der Plattform montiert, wo es während des gesamten Eingriffs verbleibt. Folglich übergibt die gesamte Plattform alle Stationen des Workflows der gesamten Intervention, wobei eine genaue und reproduzierbare Positionierung und anhaltende Anästhesie beibehalten werden. Die Steuerungssoftware ermöglicht die automatische Erkennung der Treuhandmarker und registriert automatisch alle Arten von Bildern und Bildmodalitäten (z.B. Micro-CT, Röntgen- und Fluoreszenzbildgebung) in den Referenzrahmen der stereotaktischen Plattform. Mit Hilfe eines automatischen Kalibrierverfahrens ist die Brennweite des Ultraschallwandlers genau bekannt, was die automatische Verschmelzung von interventioneller Planung, akustischer Abgabe und Nachbearbeitungs-Bildgebungsanalyse ermöglicht. Wie in Abbildung 1 und Abbildung 2dargestellt, bietet dieses Setup ein hohes Maß an Flexibilität bei der Gestaltung spezieller experimenteller Arbeitsabläufe und ermöglicht einen überläßten Umgang mit dem Tier an verschiedenen Stationen, was wiederum Experimente mit hohem Durchsatz ermöglicht. Wir haben diese Technik für die erfolgreiche Medikamentenabgabe in Maus-Xenografts von hochwertigem Gliom wie diffusem Mittelliniengliom verwendet.
Protokoll
Alle In-vivo-Experimente wurden von der niederländischen Ethikkommission (Lizenznummer AVD114002017841) und dem Tierschutzorgan der Vrije Universiteit Amsterdam, Niederlande, genehmigt. Die Forscher wurden in den Grundlagen des FUS-Systems geschult, um das Unbehagen der Tiere zu minimieren.
1. Fokussiertes Ultraschallsystem
HINWEIS: Das beschriebene Setup ist ein eigens gebautes BBB-Disruptionssystem, das auf handelsüblichen Komponenten basiert und eine 3D-gedruckte, maßgeschneiderte Kegel- und abnehmbare stereotaktische Plattform enthält. Das System ist modular aufgebaut, was Änderungen je nach verfügbarer Ausrüstung und spezifischer Nutzung ermöglicht. Das Protokoll beschreibt das Verfahren zur Sinnoporation eines größeren Bereichs im Pontinbereich des Maushirns. Durch die Anpassung der Zielposition könnten verschiedene Teile des Gehirns gezielt werden. In dieser Studie wurde ein 1 MHz Monoelement-Wandler mit einer Brennweite von 75 mm, einer Blende von 60 mm und einer Brennweite von 1,5 x 1,5 x 5 mm (FWHM Spitzendruck) verwendet. Die Brennebene des Messumformers wird durch den Schädel des Tieres in der horizontalen Ebene positioniert, die sich mit den Ohrstangen schneidet.
- Wählen Sie einen geeigneten Messumformer für die BBB-Öffnung bei Nagetieren aus.
HINWEIS: Basierend auf den Eigenschaften der Mikroblasen und der verwendeten Frequenz können sich die akustischen Einstellungen, insbesondere der mechanische Index (MI), ändern13,38. - Legen Sie den Messumformer in den 3D-gedruckten Kegel.
- Verwenden Sie eine akustisch transparente Mylarmembran am unteren Ende des Kegels, um eine akustische Kopplung des Strahlausbreitungsweges zu erreichen, und füllen Sie den Kegel mit entgastem Wasser.
- Montieren Sie den Messumformer über dem Tier auf einer motorisierten linearen Stufe, wie in Abbildung 1 dargestellt, die eine automatische vertikale Positionierung des Messumformers ermöglicht.
- Entwerfen Sie eine abnehmbare stereotaktische Plattform, die auf den Anforderungen der Studie basiert, die temperaturgeregelte Heizung, Biss- und Ohrbügel, Anästhesie und multimodale Treuhandmarker umfasst, wie in Abbildung 1 und Abbildung 2dargestellt. Die Montage der stereotaktischen Plattform besteht aus einem linearen 2D-Bühnensystem, das eine präzise automatische Positionierung (< 0,1 mm) des Tieres unter dem Strahl ermöglicht.
- Schließen Sie den Messumformer an die in Abbildung 1 dargestellte akustische Emissionskette an, die aus einem Messumformer, einem Funktionsgenerator und einem Leistungsverstärker besteht.
- Entwickeln Sie eine Bildverarbeitungspipeline, um die multimodalen Treuhandmarker zu erkennen, die eine präzise Sorporation-Targeting des Gehirnbereichs von Interesse und die Sammlung der kavitationsdaten ermöglicht, die vom Nadelhydrophon erfasst werden.
- Kalibrieren Sie das System und bestimmen Sie den Fokuspunkt des Messumformers in Übereinstimmung mit der vertikalen Positionierung des Tieres auf der stereotaktischen Plattform.
2. Tierzubereitung
HINWEIS: Das folgende Protokoll ist für Mäuse spezifiziert, kann aber für Ratten angepasst werden. Für diese Experimente wurden weibliche athymische Nackte Foxn1-/- Mäuse (6-8 Wochen alt) verwendet.
- Lassen Sie das Tier für mindestens eine Woche in der Tieranlage akklimatisieren und wiegen Sie das Tier regelmäßig.
- Verabreichen Sie Buprenorphin (0,05 mg/kg) durch subkutane (s.c.) Injektion 30 min vor der FUS-Behandlung, um mit der analgetischen Behandlung zu beginnen.
- Anästhesisieren Sie das Tier mit 3% Isofluran, 2 L/minO2 und überprüfen Sie, ob das Tier tief beästhestisiert ist. Halten Sie die Tiere während des gesamten Eingriffs anästhesierhaltig und überwachen Sie die Atemfrequenz und Herzfrequenz, um die Konzentration von Isofluran nach Bedarf anzupassen.
- Tragen Sie Augensalbe auf, um trockene Augen zu verhindern und mögliche Verletzungen zu vermeiden.
- Entfernen Sie das Haar auf der Oberseite des Kopfes mit einem Rasiermesser und Enthaarungscreme und waschen Sie anschließend mit Wasser, um Rückstände zu entfernen, um Reizungen der Haut zu vermeiden.
- Für Experimente mit BLI-Tumormodellen injizieren Sie 150 l D-Luziferin (30 mg/ml) intraperitoneal (i.p.) mit einer 29 G Insulinspritze zur BLI-Bildführung.
- Legen Sie einen 26-30 G Schwanzvenenkatheter ein und spülen Sie Katheter und Vene mit einem kleinen Volumen von Heparin-Lösung (5 UI/ml). Füllen Sie den Katheter mit Heparin-Lösung, um Blutgerinnung zu vermeiden.
HINWEIS: Eine gute Katheterisierung ist zu beobachten, wenn es einen Blutrückfluss in den Katheter gibt. Vermeiden Sie Luftblasen im Katheter, um Emboli zu verhindern. Um einen übermäßigen Injektionsdruck zu vermeiden, stellen Sie sicher, dass die Länge des Katheters so kurz wie möglich ist. - Platzieren Sie das Tier auf der temperaturregulierten stereotaktischen Plattform, um Unterkühlung zu vermeiden.
HINWEIS: Hypothermie reduziert die Durchblutung, die die Injektion /Zirkulation von Mikroblasen und die Pharmakokinetik der Medikamente beeinflussen kann39. - Immobilisieren und fixieren Sie den Kopf des Tieres auf der stereotaktischen Plattform mit Ohrbügeln und einer Bissstange. Fixieren Sie den Körper mit einem Gurt und klebe den Schwanz des Tieres auf die Plattform.
3. In vivo bildgesteuerter fokussierter Ultraschall
HINWEIS: Für dieses Protokoll wurde ein 1 MHz Monoelement-Wandler mit einem Ton-Burst-Impuls mit einer Dauer von 10 ms, einem MI von 0,4 und einer Pulswiederholungsfrequenz von 1,6 Hz mit 40 Zyklen für 240 s verwendet. Das Protokoll ist für Mikroblasen optimiert, die durch Phosphorlipide stabilisiert werden, die Schwefelhexafluorid (SF6) als harmloses Gas enthalten, wobei der mittlere Blasendurchmesser 2,5 m beträgt und mehr als 90 % der Blasen kleiner als 8 m sind.
- Platzieren Sie die stereotaktische Plattform mit dem montierten Tier in der bildgebenden Modalität (z. B. BLI oder Röntgen) und nehmen Sie Bilder des Tieres auf.
- Verwenden Sie die multimodalen Fiducial-Marker in Kombination mit der Bildverarbeitungs-Pipeline, um die Position des Tieres entsprechend dem Fokuspunkt des Messumformers zu markieren.
- Bestimmen Sie den Zielbereich, indem Sie eine Gehirnumrisslinie über dem erfassten Röntgenbild platzieren oder BLI-Bilder verwenden, um das Zentrum des Tumors zu bestimmen (Abbildung 2). Die Position bestimmter Teile des Gehirns wird im Paxinos Brain Atlas40 unter Verwendung der Schädelmarkierungen Bregma und Lambda als Bezugspunkte angegeben. Zum Beispiel befinden sich die Pons x=-1.0, y=-0.8 und z=-4.5 von lambda.
- Schützen Sie die Nasenlöcher und den Mund des Tieres mit Klebeband, um zu verhindern, dass Ultraschallgel die Atmung beeinträchtigt.
- Tragen Sie Ultraschallgel auf den Kopf des Tieres auf.
- Ziehen Sie die Haut des Halses der Tiere zurück, schmieren Sie das Nadelhydrophon mit Ultraschallgel und legen Sie das Nadelhydrophon in die direkte Nähe des Okzipitalknochens.
- Führen Sie den Messumformer mit der Bildverarbeitungspipeline und dem Fokuspunkt an die richtige Position.
- Wenden Sie die vorkonfigurierten Einstellungen auf alle angeschlossenen Geräte an und zielen Sie auf die von Interesse verfügbare Gehirnregion ab.
HINWEIS: Je nach Forschungsfrage können Tumor- oder Hirnregionen als ein einziger Brennpunkt oder als volumetrische Form aufs wir kleben, wie in Abbildung 2dargestellt. - Aktivieren Sie Mikroblasen, wie vom Hersteller beschrieben. Injizieren Sie einen Bolus von 120 l (5,4 g) Mikroblasen.
- Spülen Sie den Schwanzvenenkatheter mit Einer Linie, um die Öffnung des Katheters zu überprüfen.
- Die Mikroblasen injizieren und die Insonation starten.
- Nehmen Sie Mikroblasenkavitation mit dem Nadelhydrophon auf.
- Verabreichen Sie ein intravaskuläres Kontrastmittel oder Medikament nach Sonnoporation. Die Dosis, Timing und Planung sind abhängig vom Zweck der Studie und dem Medikament.
HINWEIS: Evans blue ist ein gängiges Farbmittel, um BBB Öffnung41zu bewerten. - Überwachen Sie das Tier bis zum vorgegebenen Zeitpunkt oder vor dem humanen Endpunkt.
4. Analyse der Mikroblasenkavitation
ANMERKUNG: Hier wird das angewandte Verfahren beschrieben, das fürIn-vivo-Experimente für SF 6-Phospholipid-Mikroblasen mit einem durchschnittlichen Durchmesser von 2,5 m (80 % der Blasen unter 8 m) geeignet ist, angeregt mit einem Bursttonimpuls von 10 ms Dauer bei einer Frequenz von 1 MHz, wie ursprünglich von McDannold et al.12vorgeschlagen.
- Fourier transformiert das aufgezeichnete PCD-Signal aus der Zeitdomäne in den Frequenzbereich.
- Integrieren Sie die resultierende Spektralleistung zur stabilen Kavitationsdetektion um die2. und3. Oberschwingung (± 50 kHz), wie in Abbildung 3 dargestellt (grüne Box bei 2 und 3 MHz).
- Integrieren Sie die Spektralleistung zur Trägheitskavitationsdetektion zwischen Hauptfrequenz,2.,3. Oberschwingung, der1. und2. Ultraharmonie und der ersten Subharmonie (± 150 kHz), wie in Abbildung 3 (rote Felder) dargestellt.
- Integrieren Sie die Spektralleistung um die Prinzipfrequenz (1 MHz ± 50 kHz) zur Normalisierung der beiden zuvor erhaltenen PCD-Signale.
HINWEIS: Das PCD-Signal für SF6-phospholipid-Mikroblasen in vivo-Experimenten mit 1 MHz zeigt keine Ultraharmonien oder Subharmonikas an, bevor die Trägheitskavitation eingeht, wie in Abbildung 3dargestellt.
Ergebnisse
Das beschriebene FUS-System (Abbildung 1 und Abbildung 2) und der zugehörige Workflow wurden bei über 100 Tieren eingesetzt und produzierten reproduzierbare Daten sowohl über gesunde als auch an tumortragende Mäuse. Basierend auf der aufgezeichneten Kavitation und der Spektraldichte an den Oberschwingungen im Spitzenmoment der Mikroblasen-Bolusinjektion kann die Spektralleistung jeder Frequenz mit der Fourier-Analyse berechnet werden, wie in Schritt 4 des Protokolls erläutert. Basierend auf dem akustischen Protokoll (1 MHz, 10 ms Pulsdauer) mit einem MI von 0,4 in Kombination mit Mikroblasen normalisierte das normalisierte integrierte Leistungsspektrum an der2. und3. Oberschwingung das in Abbildung 3beobachtete integrierte Leistungsspektrum der Anregungsfrequenz . Dies bot ein sehr empfindliches und zuverlässiges Mittel zur stabilen Kavitationsdetektion, im Vergleich zu keiner Detektion von Subharmonien, wenn keine Mikroblasen injiziert wurden, oder der Beobachtung einer Trägheitskavitation, wenn ein MI von 0,6 angewendet wurde. Bei Trägheitskavitation wurde ein erhöhter Breitband-Rauschboden von bis zu 25 dB sowie das Auftreten von Ultraschall- und Subharmonien festgestellt. Obwohl ein akustischer Druck eines MI von 0,4 und 0,6 keine makroskopischen Schäden verursachte, wurde ein mikroskopischer Schaden histologisch bei einem MI von 0,6 nachgewiesen, wie in Abbildung 4dargestellt. Eine weitere Erhöhung der Druckamplitude um einen MI von 0,8 führte zu einer makroskopischen Hirnblutung größerer Gefäße und einer weit verbreiteten Gewebelyse mit der Extravasation von Erythrozyten. Die histologischen Befunde entsprachen den akustischen Daten des passiven Kavitationssensors, wie in Abbildung 3dargestellt, was die schädlichen Eigenschaften der Trägzienkavitation des Hirngewebes bestätigt. Infolgedessen wurde ein MI von 0,4 als sichere Druckamplitude gewählt, die eine sehr reproduzierbare BBB-Öffnung bot und gleichzeitig einen sicheren Rand des Trägheitskavitationsregimes bot, wie vor11beobachtet.
Intravenöses Evans blau wurde injiziert, um die Öffnung des BBB in der Pontinregion zu validieren. Die starke Albumin-Bindung von Evans blue führt zu einem großen Molekül von mehr als 66 kDa42. Auf der Ebene der Pons und teilweise des Kleinhirns wurde die Extravasation von Evans blau konjugiertem Albumin bei der mit FUS und Mikroblasen behandelten Maus im Gegensatz zur Maus ohne Mikroblasen beobachtet (Abbildung 5). Dies unterstreicht die präzise Ausrichtung der Interessenregion auf Basis der bildgesteuerten stereotaktischen Navigation mit dem hauseigenen Build-FUS-System und dem beschriebenen Protokoll.

Abbildung 1: Fokussierte Ultraschalleinrichtung.
(A) Schematische Darstellung des fokussierten Ultraschallaufbaus. (B) Bild des fokussierten Ultraschall-Setups. Das System besteht aus einem von oben nach unten montierten Messumformer auf einer 1D linearen Stufe über eine zweite 2D-Stufe für die automatische 3D-Positionierung. Der Messumformer ist in einem wassergefüllten Strahlkegel eingebaut, der unten mit einer akustisch transparenten Mylarmembran geschlossen ist, die den Klang zum Schädel des Tieres leitet. Der Messumformer ist an einen Leistungsverstärker angeschlossen, der zur Signalerzeugung wiederum an einen beliebigen Wellenformgenerator (AWG) angeschlossen ist. Zur Kavitationserkennung wird ein abnehmbares Hydrophon in Kombination mit einem Geräuschniederspannungsverstärker verwendet. Das Hydrophon befindet sich in unmittelbarer Nähe des Okzipitalknochens. Das externe Hydrophon hat eine 2 mm aktive Oberfläche und ist akustisch mit Ultraschallgel gekoppelt. Sowohl das Hochspannungssignal des Anregungsimpulses als auch das aufgezeichnete Kavitationssignal werden durch ein standardmäßiges 200 MHz Oszilloskop digitalisiert und zur Spontanverarbeitung und Echtzeitsteuerung an einen Steuerrechner (nicht gezeigt) weitergeleitet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Fokussierter Ultraschall-Workflow.
Der vorgeschlagene Workflow des fokussierten Ultraschallsystems beginnt mit (A) der anfänglichen Positionierung des Tieres auf einer abnehmbaren stereotaktischen Plattform, beachten Sie die Anwendung des akustischen Kopplungsgels (angewendet nach BLI/Röntgen). Gleichzeitig kann multimodale Bildgebung für das Targeting durchgeführt werden. (B) Zunächst ist Röntgenbildgebung eine Möglichkeit, während ein Bereich von Interesse mit Hilfe eines Umrisses des Gehirns (die wiederum auf die Maus Gehirn Atlas40verwiesen wird, angepasst an die Größe und Haltung des Schädels) gezielt werden kann. (C) Alternativ kann ein BLI-Bild eines luziferase transfizierten diffusen Mittellinien-Gliomtumors, der auf einer Röntgenprojektion mit maximaler Intensität überlagert ist, für das Targeting angewendet werden. (D) Anschließend wird die stereotaktische Plattform mit dem Tier in Therapieposition sowohl mit Hydrophon als auch mit Messumformer montiert. Der Messumformer treibt automatisch in Therapieposition und beschallt die gewählte Bahnnach der Bolusinjektion. Das System ist für Experimente mit hohem Durchsatz optimiert, wobei mehrere Plattformen, wie oben gezeigt, interleavedes Arbeiten ermöglichen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
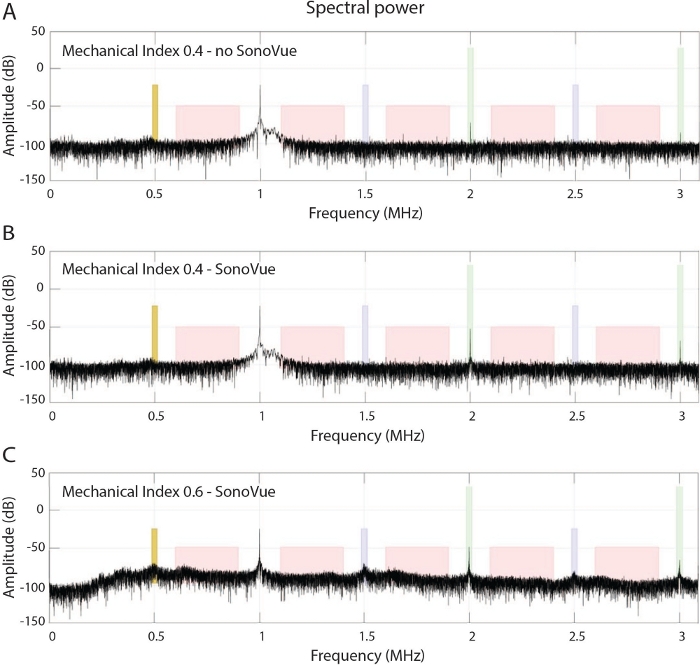
Abbildung 3: Kavitationsüberwachung.
(A) Frequenzspektrum eines In-vivo-Experiments in Abwesenheit einer Mikrobubble-Administation bei einem MI von 0,4 bei 1 MHz. (B) Gezeigt ist das entsprechende Spektrum am Peak-Bolus nach Injektion von Mikroblasen. Beachten Sie die Zunahme der höheren Oberschwingungen, die auf eine stabile Kavitation der Mikroblasen hindeutet. (C) Entsprechendes Spektrum, das bei einem höheren MI von 0,6 in Kombination mit Mikroblaseninjektion im Übergangsband zum Beginn der Trägheitskavitation beobachtet wird, was zu einer Erhöhung des Geräuschpegels bis zu 25 dB und dem Auftreten von Ultraharmonik und Subharmonik führt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: BBB-Eröffnung und zugehörige Histologie.
(A) Eine stabile Kavitation mit einem MI von 0,4 belegte ein intaktes Hirnparenchym sowohl in der Weißlichtmakroskopie als auch in der HE-Gebeizmikroskopie. (B) Nach einem MI von 0,6 werden erste Anzeichen einer lokalen irreversiblen Gewebeschädigung des Gehirnparenchyms in den HE-gefärbten histologischen Daten deutlich. (C) Bei einem noch höheren mechanischen Druck von MI 0,8 sind makroskopische Blutungen sowie eine weit verbreitete Gewebelyse des Gehirnparenchyms und die Extravasation von Erythrozyten durch Mikroblutungen erkennbar. Der blaue Farbton in der Weißlichtmakroskopie ist ein Hinweis auf die Extravasation des mitinjizierten intravenkulären Kontrastmittels Evans blue, das auf die BBB-Öffnung hinweist (siehe Abbildung 5 für eine sagittale Ansicht). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
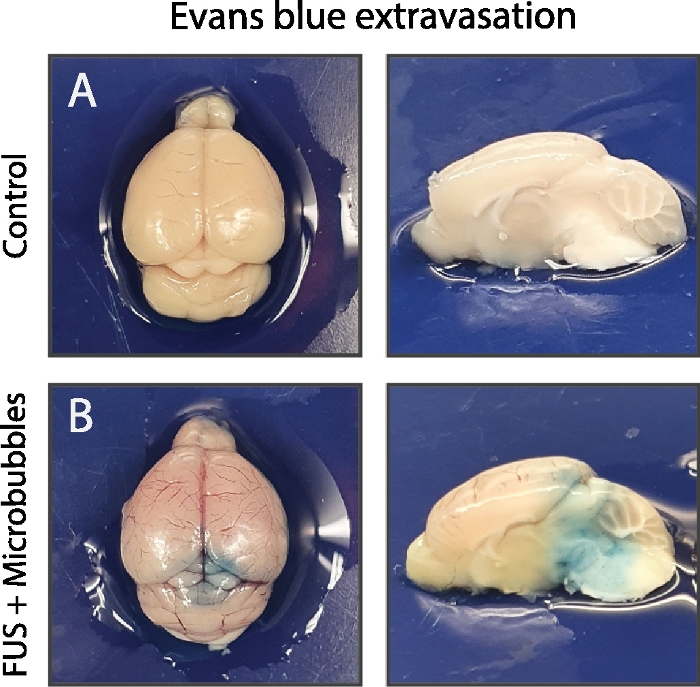
Abbildung 5: Validierung der BBB-Öffnung.
Demonstration einer erfolgreichen BBB-Öffnung im stabilen Kavitationsregime (B) im Vergleich zur Steuerung (A), keine Mikroblasen injiziert. In diesem Fall wurde Evans blue als intravaskuläres Kontrastmittel eingesetzt. Die starke Albumin-Bindung von Evans blue führt zu einem großen Molekül von mehr als 66 kDa. Infolgedessen deutet dies auf die blaue Extravasation von Evans hin, da die bBB aufgrund einer (teilweisen) Öffnung der engen Kreuzungen (teilweise) geöffnet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Studie haben wir ein kostengünstiges bildgesteuertes FUS-System für vorübergehende BBB-Störungen zur erhöhten Medikamentenabgabe in das Gehirnparenchym entwickelt. Das System wurde größtenteils mit handelsüblichen Komponenten und in Verbindung mit Röntgen und BLI gebaut. Die Modularität des vorgeschlagenen Designs ermöglicht den Einsatz mehrerer bildgebender Verfahren für die Planung und Bewertung in Workflows mit hohem Durchsatz. Das System kann mit umfassenderen hochauflösenden 3D-Bildgebungsmodalitäten kombiniert werden, z. B. hochauflösende MRT oder Micro-CT, während für den Großteil der Studie 2D-Bildgebungsmodalitäten wie 2D-Röntgen und/oder BLI verwendet werden. 2D-Röntgen und/oder BLI sind aufgrund ihrer jeweils kurzen Erfassungszeiten sowohl deutlich kostengünstiger als auch ideal für großvolumige Studien. Der hier beschriebene Messumformer eignet sich gut, um BBBD in größeren Bereichen (auf der Skala eines Maushirns) in tieferen Teilen des Gehirns (f Anzahl von 1,25) zu produzieren. Wir haben das System für diffus wachsende Tumoren in der Pontinregion43,44verwendet. Für diese Regionen muss ein größeres Volumen salbt werden, das die gesamte Tumorregion in den Pons umfasst. Das modulare System lässt sich leicht für andere Arten von Hirntumoren in supratentorialen Teilen des Gehirns einstellen. Um über den Messumformertyp zu entscheiden, sollte man die f-Zahl, Brennweite und Frequenz berücksichtigen.
Das Gesamtdesign schlägt dabei zwei Verfeinerungen im Vergleich zu den zuvor vorgeschlagenen Entwürfen vor. (I) Häufig wird ein Wasserbad für die Ultraschallwellenübertragung von therapeutischen Systemen verwendet. Für transkranielle Anwendungen bei Kleintieren führt diese Art der Konstruktion zu größeren und invertierten Setups, wobei das Tier teilweise untergetaucht ist11,22,25. Während diese Designs im Allgemeinen sehr gut im Rahmen kleinerer Tierstudien funktionieren, sind sie ein Kompromiss in Bezug auf Rüstzeiten, Portabilität und realistisch verwaltbare Hygienestandards während des Einsatzes. Letzteres ist insbesondere in den Scope-Studien, die immungeschwächte Tiere und damit strenge Hygienestandards umfassen, von erheblicher Bedeutung. Um ein System mit einer kompakteren Grundfläche, kürzerer Rüstzeit, einfachen Dekontaminationsmöglichkeiten und einer natürlichen Position des Tieres während des gesamten Workflows zu konstruieren, wurde daher ein "Top-Down"-Design gewählt. (II) Die zweite Entwurfsentscheidung, die sich von mehreren zuvor beschriebenen Konstruktionen unterscheidet, bestand darin, die direkte Integration des akustischen Trägersystems in ein medizinisches Bildgebungssystem wie ein MRT oder ein Mikro-CT15,17,18,19,45zu unterlassen. Während vollintegrierte Systeme ideal für längspharmazeutische Studien oder explorative Forschungansammlungen an einer begrenzten Anzahl von Tieren sind, sind solche Setups aufgrund erheblich erhöhter Komplexität, hoher Betriebskosten und des Bedarfs an ausgebildeten/qualifizierten Bedienern in der Regel weniger geeignet für hochvolumige pharmakologische Studien. Darüber hinaus sind solche Systeme in der Regel auf eine bildgebende Modalität beschränkt. Daher stützt sich das vorgeschlagene Design hier auf eine modular abnehmbare stereotaktische Plattform, die mit mehreren bildgebenden Modalitäten (Mikro-CT, Kleintier-MRT, eine Vielzahl von BLI/Fluoreszenzkameras, diese mit oder ohne integrierte Röntgenbildgebung) kompatibel ist und auch multimodale fiduziale Marker für die automatische Verschmelzung aller Bilddaten in einem gemeinsamen Bezugsrahmen sowohl für die interventionelle Planung als auch für die Nachbearbeitung nach der BBB-Eröffnung bietet.
In Bezug auf praktische Erwägungen ist der kritischste Punkt des Scheiterns des Verfahrens die Stabilität der Mikroblasen aufgrund ihrer begrenzten Lebensdauer und ihrer zerbrechlichen Natur. Wir möchten betonen, dass die folgende Diskussion Mikroblasen betrifft, die durch Phospholipide stabilisiert werden und Schwefelhexafluorid (SF6) als harmloses Gas46,47enthalten, während andere Mikroblasenformulierungen in der Regel unterschiedliche Eigenschaften aufweisen.
Timing vor Mikrobubble-Injektion: Die beworbene Lebensdauer von kommerziell erhältlichen Mikroblasen nach Derrehydrierung liegt zwischen 3 und 4 Stunden. Während dies für diagnostische Ultraschallanwendungen geeignet ist, ist zu beachten, dass während dieser gesamten Periode die Mikroblasen kontinuierlich Gas verlieren und folglich der mittlere Blasendurchmesser einer kontinuierlichen Abwärtsdrift von der ursprünglichen durchschnittlichen Größe von 2,5 m unterliegt. Für therapeutische Anwendungen wie ultraschallvermittelte BBBD bedeutet dies wesentlich strengere Zeit-Imperative, da die Schwingungsamplitude stabiler Kavitation (bei einer bestimmten Frequenz und einem bestimmten Druck) und die Eindringschwelle der Trägheitskavitation als direkte Folge auch einer kontinuierlichen Drift unterliegen. Nach unserer Erfahrung haben wir beobachtet, dass Mikroblasen am besten innerhalb von 30 Minuten nach der Rehydratation verwendet werden, um reproduzierbare Ergebnisse zu erhalten, ähnlich wie frühere Berichte48.
Timing nach Mikrobubble-Injektion: Bei größeren Primaten zeigen handelsübliche SF 6-Phospholipid-Mikroblasen eine Halbwertszeit der Blut-Plasma-Eliminierung von etwa 6 Minuten und mehr als 80% des verabreichten Gases wird nach nur 11 Minuten48über die Lunge ausgeatmet. Bei kleinen Säugetieren wie Mäusen und Ratten ist die Blut-Plasma-Eliminationshalbwertszeit dieser Art von Mikroblasen in vivo aufgrund der höheren Herzfrequenz20deutlich kürzer. Infolgedessen stellt die schnelle Dynamik der Mikroblasenkonzentration direkt nach der Bolusinjektion und die schnelle anschließende Plasmaeliminierung in Verbindung mit dem kontinuierlichen Gasvolumenverlust der Blasen strenge zeitliche Anforderungen an das Beschallungs-/Injektionsprotokoll, um innerhalb der kurzen Dauer von 3-4 Minuten nach der Injektion reproduzierbare Ergebnisse zu erzielen. Längere Verfahren oder umfangreichere BBBD-Mengen erfordern vorzugsweise eine kontinuierliche Verabreichung von Mikroblasen. Ein solcher Ansatz wird jedoch durch den Auftrieb der Blasen sowohl in der Spritze als auch im Fütterungssystem erschwert und führt auch zu einem deutlich erhöhten Totvolumen durch die erforderlichen Infusionsschläuche ein. Unserer Erfahrung nach lieferte die einfachere Lösung, das gesamte Injektionsvolumen in 2 bis 3 kleinere Unterdosen aufzuteilen, ein robustes und reproduzierbares Ergebnis.
Darüber hinaus sind Mikroblasen sehr druckempfindlich und hohe hydrostatische Drücke während der Injektion werden daher nicht empfohlen. Große Nadeln (>19 G) werden für den Transfer von Mikroblasen in ein Kunststoffrohr oder zum Erstellen von Mikroblasen mit einer Spritze49empfohlen. Für i.v. Injektion bei Mäusen werden 26-30 G Nadeln empfohlen; da größere Nadeln schwieriger in die Schwanzvene einzufügen sind. Die 26 G Nadel wird empfohlen, da der hydrostatische Druck mit dieser Nadel niedriger ist. Bei schwierigem Venenzugang wird jedoch die 30 G Nadel empfohlen.
Der Schädel der Maus ist ein wichtiger Dämpfer der Druckamplitude, der die Druckamplitude im Fokus deutlich senkt. Die Dämpfung wird durch die Frequenz des Messumformers und die Dichte des Mediums bestimmt, das sich die Ultraschallwelle ausbreitet. Höhere Ultraschallfrequenzen und hohe Gewebedichten, wie Knochen, führen zu einer hohen Dämpfung. Die Druckamplitude wird teilweise vom Knochen absorbiert und eine gewisse Druckamplitude geht durch Reflexion und Streuung50verloren. In unseren Experimenten haben wir in Mauskadavern festgestellt, dass die Dämpfung bei 1 MHz 14,5 ± 1,3 dB/cm mit einer durchschnittlichen Schädeldicke von 0,9 mm beträgt, wie vor21,50gezeigt. Kavitationsüberwachung ist sehr zu empfehlen, da Mikroblasen unterschiedliche akustische Emissionen bei stabiler Kavitation und Trägialkavitation widerspiegeln. Die Breitbandemission ist eine ausgeprägte akustische Emission für Trägialkavitation12. Die Echtzeitüberwachung ermöglicht es, Trägheit zu erkennen und die Druckamplitude entsprechend zu senken, um Gewebeschäden zu vermeiden.
Frühere Berichte beschrieben den Einfluss der Art der Anästhesie auf die erreichte BBB-Permeabilität11,31. Bei Isofluran-basierter Anästhesie tritt kurz nach der Anästhesieeinleitung eine Vasodilatation auf, die mit einer leichten Verringerung des zerebralen Blutflusses verbunden ist. Darüber hinaus führt eine Anästhesie über längere Dauer, insbesondere in Ermangelung einer Temperaturstabilisierung, zu einer verminderten Herzfrequenz. Da beide Faktoren potenziell zu einer größeren Varianz der zerebralen Konzentration von Mikroblasen oder co-administereden Medikamenten führen können, ist ein strenges Anästhesieprotokoll ratsam, um reproduzierbare Ergebnisse zu erzielen51. Anästhesie mit 1,5% v/v Isofluran in 2 L/min Sauerstoff für 35 bis 45 Minuten war nicht problematisch, wie von Constantinides et al.51empfohlen. Im Gegensatz zu McDannold et al., die zeigten, dass dieses Gasgemisch in Kombination mit der spezifischen Art ihrer Mikroblasen problematisch war52, haben wir keine nennenswerten Probleme mit dieser Art von Mikroblasen beobachtet. Alternativ können die Tiere mit einer Mischung aus Ketamin/Xylazin beäpft werden, die keine bekannten vasoaktiven Wirkungen hat53.
Zusammenfassend lässt sich sagen, dass die hier beschriebene bildgebende BBB-Öffnungstechnik für hochvolumige präklinische Arzneimittelbewertungsstudien eingesetzt wurde, die die Effizienz des vorgeschlagenen Workflows demonstrierten. Das System konnte dadurch aufgrund des hohen Automatisierungsgrades nach einer kurzen Schulung von nicht-technischem Personal betrieben werden. Dies in Kombination mit der Einfachheit des Setups führte zu einem hohen Standardisierungsgrad, der wiederum experimentelle Reproduzierbarkeit sicherstellt, die gruppeninterne Variabilität reduziert und somit die erforderliche Probengröße reduziert.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Dieses Projekt wurde vom KWF-STW (Drug Delivery by Sonoporation in Childhood Diffuse Intrinsic Pontine Glioma and High-grade Glioma) finanziert. Wir danken Ilja Skachkow und Charles Mougenot für ihren Beitrag zur Entwicklung des Systems.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL luer-lock syringe | Becton Dickinson | 309628 | Plastipak |
| 19 G needle | Terumo Agani | 8AN1938R1 | |
| 23 G needle | Terumo Agani | 8AN2316R1 | |
| 3M Transpore surgical tape | Science applied to life | 7000032707 | or similar |
| Arbitrary waveform generator | Siglent | n.a. | SDG1025, 25 MHz, 125 Msa/s |
| Automated stereotact | in-house built | n.a. | Stereotact with all elements were in-house built |
| Bruker In-Vivo Xtreme | Bruker | n.a. | Includes software |
| Buffered NaCl solution | B. Braun Melsungen AG | 220/12257974/110 | |
| Buprenorfine hydrochloride | Indivior UK limitd | n.a. | 0.324 mg |
| Cage enrichment: paper-pulp smart home | Bio services | n.a. | |
| Carbon filter | Bickford | NC0111395 | Omnicon f/air |
| Ceramic spoon | n.a | n.a. | |
| Cotton swabs | n.a. | n.a. | |
| D-luciferin, potassium salt | Gold Biotechnology | LUCK-1 | |
| Ethanol | VUmc pharmacy | n.a. | 70% |
| Evans Blue | Sigma Aldrich | E2129 | |
| Fresenius NaCl 0.9% | Fresenius Kabi | n.a. | NaCl 0.9 %, 1000 mL |
| Histoacryl | Braun Surgical | n.a. | Histoacryl 0.5 mL |
| Hydrophone | Precision Acoustics | n.a. | |
| Insulin syringe | Becton Dickinson | 324825/324826 | 0.5 mL and 0.3 mL |
| Isoflurane | TEVA Pharmachemie BV | 8711218013196 | 250 mL |
| Ketamine | Alfasan | n.a. | 10 %, 10 mL |
| Mouse food: Teklad global 18% protein rodent diet | Envigo | 2918-11416M | |
| Neoflon catheter | Becton Dickinson | 391349 | 26 GA 0.6 x 19 mm |
| Oscilloscope | Keysight technologies | n.a. | InfiniiVision DSOX024A |
| Plastic tubes | Greiner bio-one | 210261 | 50 mL |
| Power amplifier | Electronics & Innovation Ltd | 210L | Model 210L |
| Preamplifier DC Coupler | Precision Acoustics | n.. | Serial number: DCPS94 |
| Scissors | Sigma Aldrich | S3146-1EA | or similar |
| Sedazine | AST Farma | n.a. | 2% |
| SonoVue microbubbles | Bracco | n.a. | 8 µl/ml |
| Sterile water | Fresenius Kabi | n.a. | 1000 mL |
| Syringe | n.a. | n.a. | various syringes can be used |
| Temgesic | Indivior UK limitd | n.a. | 0.3 mg/ml |
| Transducer | Precision Acoustics | n.a. | 1 MHz |
| Tweezers | Sigma Aldrich | F4142-1EA | or similar |
| Ultrasound gel | Parker Laboratories Inc. | 01-02 | Aquasonic 100 |
| Vidisic gel | Bausch + Lomb | n.a. | 10 g |
Referenzen
- Lipinski, C. A. Lead- and drug-like compounds: the rule-of-five revolution. Drug Discovery Today: Technologies. 1 (4), 337-341 (2004).
- Pardridge, W. M. Blood-brain barrier delivery. Drug Discovery Today. 12 (1-2), 54-61 (2007).
- Alli, S., et al. Brainstem blood brain barrier disruption using focused ultrasound: A demonstration of feasibility and enhanced doxorubicin delivery. Journal of Controlled Release. 281, 29-41 (2018).
- Burgess, A., Hynynen, K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chemical Neuroscience. 4 (4), 519-526 (2013).
- Meng, Y., et al. Safety and efficacy of focused ultrasound induced blood-brain barrier opening, an integrative review of animal and human studies. Journal of Controlled Release. 309, 25-36 (2019).
- Darrow, D. P. Focused Ultrasound for Neuromodulation. Neurotherapeutics. 16 (1), 88-99 (2019).
- Zhou, Y. F. High intensity focused ultrasound in clinical tumor ablation. World Journal of Clinical Oncology. 2 (1), 8-27 (2011).
- O'Reilly, M. A., Hough, O., Hynynen, K. Blood-Brain Barrier Closure Time After Controlled Ultrasound-Induced Opening Is Independent of Opening Volume. Journal of Ultrasound in Medicine. 36 (3), 475-483 (2017).
- Mainprize, T., et al. Blood-Brain Barrier Opening in Primary Brain Tumors with Non-invasive MR-Guided Focused Ultrasound: A Clinical Safety and Feasibility Study. Scientific Reports. 9 (1), 321 (2019).
- Dasgupta, A., et al. Ultrasound-mediated drug delivery to the brain: principles, progress and prospects. Drug Discovery Today: Technologies. 20, 41-48 (2016).
- O'Reilly, M. A., Waspe, A. C., Chopra, R., Hynynen, K. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model. Journal of Visualized Experiments. (61), (2012).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Physics in Medicine & Biology. 51 (4), 793 (2006).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Blood-brain barrier disruption induced by focused ultrasound and circulating preformed microbubbles appears to be characterized by the mechanical index. Ultrasound in Medicine and Biology. 34 (5), 834-840 (2008).
- Sun, T., et al. Closed-loop control of targeted ultrasound drug delivery across the blood-brain/tumor barriers in a rat glioma model. Proceedings of the National Academy of Sciences. 114 (48), 10281-10290 (2017).
- Lipsman, N., et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound. Nature Communications. 9 (1), 2336 (2018).
- Carpentier, A., et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound. Science Translational Medicine. 8 (343), 342 (2016).
- Chopra, R., Curiel, L., Staruch, R., Morrison, L., Hynynen, K. An MRI-compatible system for focused ultrasound experiments in small animal models. Medical Physics. 36 (5), 1867-1874 (2009).
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Targeted delivery of antibodies through the blood–brain barrier by MRI-guided focused ultrasound. Biochemical and Biophysical Research Communications. 340 (4), 1085-1090 (2006).
- Larrat, B., et al. MR-guided transcranial brain HIFU in small animal models. Physics in Medicine & Biology. 55 (2), 365 (2009).
- Contag, C. H., Jenkins, D., Contag, P. R., Negrin, R. S. Use of reporter genes for optical measurements of neoplastic disease in vivo. Neoplasia. 2 (1-2), 41 (2000).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound in Medicine & Biology. 33 (1), 95-104 (2007).
- Bing, C., et al. Trans-cranial opening of the blood-brain barrier in targeted regions using astereotaxic brain atlas and focused ultrasound energy. Journal of Therapeutic Ultrasound. 2 (1), 13 (2014).
- Marquet, F., et al. Real-time, transcranial monitoring of safe blood-brain barrier opening in non-human primates. PloS One. 9 (2), (2014).
- Anastasiadis, P., et al. characterization and evaluation of a laser-guided focused ultrasound system for preclinical investigations. Biomedical Engineering Online. 18 (1), 36 (2019).
- Liu, H. L., Pan, C. H., Ting, C. Y., Hsiao, M. J. Opening of the blood-brain barrier by low-frequency (28-kHz) ultrasound: a novel pinhole-assisted mechanical scanning device. Ultrasound in Medicine & Biology. 36 (2), 325-335 (2010).
- Zhu, L., et al. Focused ultrasound-enabled brain tumor liquid biopsy. Scientific Reports. 8 (1), 1-9 (2018).
- Bader, K. B., Holland, C. K. Gauging the likelihood of stable cavitation from ultrasound contrast agents. Physics in Medicine & Biology. 58 (1), 127 (2012).
- Neppiras, E. Acoustic cavitation series: part one: Acoustic cavitation: an introduction. Ultrasonics. 22 (1), 25-28 (1984).
- Aryal, M., Arvanitis, C. D., Alexander, P. M., McDannold, N. Ultrasound-mediated blood-brain barrier disruption for targeted drug delivery in the central nervous system. Advanced Drug Delivery Reviews. 72, 94-109 (2014).
- Tung, Y. S., Choi, J. J., Baseri, B., Konofagou, E. E. Identifying the inertial cavitation threshold and skull effects in a vessel phantom using focused ultrasound and microbubbles. Ultrasound in Medicine & Biology. 36 (5), 840-852 (2010).
- Arvanitis, C. D., Livingstone, M. S., Vykhodtseva, N., McDannold, N. Controlled ultrasound-induced blood-brain barrier disruption using passive acoustic emissions monitoring. PloS One. 7 (9), (2012).
- Tsai, C. H., Zhang, J. W., Liao, Y. Y., Liu, H. L. Real-time monitoring of focused ultrasound blood-brain barrier opening via subharmonic acoustic emission detection: implementation of confocal dual-frequency piezoelectric transducers. Physics in Medicine & Biology. 61 (7), 2926 (2016).
- Chen, W. S., Brayman, A. A., Matula, T. J., Crum, L. A. Inertial cavitation dose and hemolysis produced in vitro with or without Optison. Ultrasound in Medicine & Biology. 29 (5), 725-737 (2003).
- Qiu, Y., et al. The correlation between acoustic cavitation and sonoporation involved in ultrasound-mediated DNA transfection with polyethylenimine (PEI) in vitro. Journal of Controlled Release. 145 (1), 40-48 (2010).
- Sun, T., Jia, N., Zhang, D., Xu, D. Ambient pressure dependence of the ultra-harmonic response from contrast microbubbles. The Journal of the Acoustical Society of America. 131 (6), 4358-4364 (2012).
- Rehemtulla, A., et al. Rapid and quantitative assessment of cancer treatment response using in vivo bioluminescence imaging. Neoplasia. 2 (6), 491-495 (2000).
- Puaux, A. L., et al. A comparison of imaging techniques to monitor tumor growth and cancer progression in living animals. International Journal of Molecular Imaging. 2011, (2011).
- Wu, S. K., et al. Characterization of different microbubbles in assisting focused ultrasound-induced blood-brain barrier opening. Scientific Reports. 7, 46689 (2017).
- van den Broek, M. P., Groenendaal, F., Egberts, A. C., Rademaker, C. M. Effects of hypothermia on pharmacokinetics and pharmacodynamics. Clinical Pharmacokinetics. 49 (5), 277-294 (2010).
- Paxinos, G., Franklin, K. B. . Paxinos and Franklin's the mouse brain in stereotaxic coordinates. , (2019).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 385, 385 (2015).
- Yao, L., Xue, X., Yu, P., Ni, Y., Chen, F. Evans blue dye: a revisit of its applications in biomedicine. Contrast Media & Molecular Imaging. 2018, (2018).
- Caretti, V., et al. Monitoring of tumor growth and post-irradiation recurrence in a diffuse intrinsic pontine glioma mouse model. Brain Pathology. 21 (4), 441-451 (2011).
- Yoshimura, J., Onda, K., Tanaka, R., Takahashi, H. Clinicopathological study of diffuse type brainstem gliomas: analysis of 40 autopsy cases. Neurologia Medico-Chirurgica. 43 (8), 375-382 (2003).
- Yang, F. Y., et al. Micro-SPECT/CT-based pharmacokinetic analysis of 99mTc-diethylenetriaminepentaacetic acid in rats with blood-brain barrier disruption induced by focused ultrasound. Journal of Nuclear Medicine. 52 (3), 478-484 (2011).
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science, Engineering & Technology. 1 (1-2), 3-17 (2009).
- Greis, C. Technology overview: SonoVue. European Radiology. 14, 11-15 (2004).
- Schneider, M. Characteristics of sonovue. Echocardiography. 16, 743-746 (1999).
- Talu, E., Powell, R. L., Longo, M. L., Dayton, P. A. Needle size and injection rate impact microbubble contrast agent population. Ultrasound in Medicine & Biology. 34 (7), 1182-1185 (2008).
- Pinton, G., et al. Attenuation, scattering, and absorption of ultrasound in the skull bone. Medical Physics. 39 (1), 299-307 (2012).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR journal/National Research Council, Institute of Laboratory Animal Resources. 52, 21 (2011).
- McDannold, N., Zhang, Y., Vykhodtseva, N. The effects of oxygen on ultrasound-induced blood-brain barrier disruption in mice. Ultrasound in Medicine & Biology. 43 (2), 469-475 (2017).
- McDannold, N., Zhang, Y., Vykhodtseva, N. Blood-brain barrier disruption and vascular damage induced by ultrasound bursts combined with microbubbles can be influenced by choice of anesthesia protocol. Ultrasound in Medicine and Biology. 37 (8), 1259-1270 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
ISSN 1940-087X
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.