Method Article
Die Quantifizierung des Immunsuppressivums Tacrolimus auf Getrocknetes Blut mittels LC-MS / MS
In diesem Artikel
Zusammenfassung
Here we describe a high-performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) assay to quantify the immunosuppressant tacrolimus in dried blood spots using a simple manual protein precipitation step and online column extraction.
Zusammenfassung
Die Calcineurin-Inhibitor Tacrolimus ist der Eckpfeiler der meisten immunsuppressiven Behandlungsprotokolle nach Organtransplantation in den Vereinigten Staaten. Tacrolimus ist eine geringe therapeutische Droge und als solche erfordert therapeutischen Drug-Monitoring und Dosisanpassung basierend auf seiner Vollblut-Talspiegel. Nach Hause zu therapeutischen Drug-Monitoring und die Einhaltung zu erleichtern, ist die Sammlung von getrockneten Blutflecken ein attraktives Konzept. Nach einer Finger-Stick, sammelt der Patient einen Bluttropfen auf Filterpapier zu Hause. Nachdem das Blut getrocknet ist, es an die analytischen Labor, in dem Tacrolimus wird mit Hochleistungs-Flüssigchromatographie-Tandem-Massenspektrometrie quantifiziert geschickt wird (HPLC-MS / MS) in Kombination mit einem einfachen Handproteinfällung Schritt und Online-Spaltenextraktion.
Für Tacrolimus Analyse wird eine 6-mm-Scheibe aus dem gesättigten Zentrum der Blutfleck ausgestanzt. Der Blutfleck wird mit einer Kugel ein Mixer homogenisiertnd dann Proteine werden mit Methanol / 0,2 M ZnSO 4, die den internen Standard D 2, 13 C-Tacrolimus fällt. Nach dem Vortexen und Zentrifugieren wird 100 ul Überstand in ein Online-Extraktionskolonne injiziert und mit 5 ml / min von 0,1 Ameisensäure / Acetonitril gewaschen (7: 3, v: v) für 1 min. Danach wird das Schaltventil aktiviert, und die Analyten rückgespült auf die analytische Säule (und getrennt unter Verwendung einer 0,1% Ameisensäure / Acetonitril-Gradient). Tacrolimus wird in der positiven Mehrreaktionsmodus (MRM) mit einem Tandem-Massenspektrometer quantifiziert.
Der Test ist linear von 1 bis 50 ng / ml. Inter-Assay-Varianz (3,6% -6,1%) und Genauigkeit (91,7% -101,6%) als in 20 Tagen beurteilt treffen Akzeptanzkriterien. Durchschnittliche Extraktion Erholung ist 95,5%. Es gibt keine relevante Übertrag, Matrix-Interferenzen und Matrixeffekte. Tacrolimus ist in getrockneten Blutflecken bei RT und bei +4 ° C für 1 Woche stabil. Extrahierten Proben in derProbengeber sind bei +4 ° C für mindestens 72 Stunden stabil.
Einleitung
Tacrolimus ist ein potenter immonosuppressant 1-7 die Makrolidstruktur 8 (Figur 1) besitzt. Aufgrund cis - trans-Isomerie der CN Bindungen sie zwei Rotameren in Lösung 9, die durch Umkehrphasen-Hochleistungs-Flüssigkeits-Chromatographie getrennt werden können bildet (HPLC) Tacrolimus ist lipophil und löslich in Alkoholen (Methanol: 653 g / l, Ethanol: 355 g / L), halogenierte Kohlenwasserstoffe (Chloroform: 573 g / L) und Äther. Es ist in aliphatischen Kohlenwasserstoffen (Hexan kaum löslich: 0,1 g / l und Wasser (pH 3. 0,0047 g / l) 9 Das Molekül keinerlei Chromophor, und das UV-Absorptionsmaximum nicht enthalten, ist 192 nm Tacrolimus über eine Hemmung der Calcineurin wirkt. . Sein Wirkungsmechanismus ist in den Referenzen 10,11 prüft worden. Es ist derzeit in mehr als 80% der Festorgantransplantationspatienten in den Vereinigten Staaten 12 verwendet.
Der therapeutische Index von Tacrolimus ist stattd schmalen 13 zu sein. Darüber hinaus ist die Korrelation zwischen Tacrolimus-Dosen und Konzentrationen im Blut arm und Pharmakokinetik ist variabel 14,15. Therapeutische Medikamentenüberwachung auf Tacrolimus Dosierung bei Transplantationspatienten zu führen ist daher allgemeine klinische Praxis 16-20. Das Ziel ist, die Tacrolimus-Blutkonzentrationen innerhalb einer vorgegebenen therapeutischen Bereich zu halten. Tacrolimus-Blutspiegel unter dem therapeutischen Bereich kann in einer erhöhten Aktivität der chronischen oder akuten Allo-Immunreaktionen führen, während die oberhalb des therapeutischen Fensters erhöhen das Risiko für Über Immunsuppression, Krebs und Toxizitäten, wie Nierentoxizität, Neurotoxizität, Bluthochdruck und Diabetes. Hohe pharmakokinetischen intraindividuellen Schwankungen von Tacrolimus kann sich nachteilig auf beiden Transplantationsorgan und das Überleben der Patienten 21,22 sein. Während interindividuelle Variabilität der Pharmakokinetik von Tacrolimus wird hauptsächlich durch CYP3A5-Polymorphismen, Gründe für intraindividuelle verursachtVariabilität beinhalten, sind aber nicht beschränkt auf, Arzneimitteln, krankheits Drogen-und Lebensmittel Wechselwirkungen 14,15 begrenzt. Auch fehlt der Einhaltung der immunsuppressiven Therapie Drogen-Regime ist ein Faktor und ein Hauptgrund für Transplantatverlust 23,24.
Diese Überlegungen zeigen, dass häufige Hause therapeutischen Drug-Monitoring und die Einhaltung von Tacrolimus-Vollblutkonzentration kann vorteilhaft sein, um sicherzustellen, dass Patienten Tacrolimus Exposition innerhalb des gewünschten therapeutischen Fenster zu allen Zeiten. Allerdings, die Logistik und die Kosten der häufigeren therapeutischen Drug-Monitoring, wie es der gängigen klinischen Praxis 15 ist unerschwinglich. Einer der Gründe ist, dass der Patient zu sehen, ein phlebotomist, um die erforderliche venöse Blutprobe gezogen haben. Getrocknetes Blut wurden vor kurzem als attraktives Konzept 25-28 entstanden. Nach einer einfachen Finger-Stick, den Patienten sammelt einen Blutstropfen auf einem speziellen Filterpapierkarte und nach der Blutfleck ist dRied, kann es zu einem zentralen Labor zur Analyse von Tacrolimus und einer anderen Immunsuppressivum, dass der Patient möglicherweise gerade unter zugesandt. Dies hat sich auf die Entwicklung von hochempfindlichen und spezifischen LC-MS / MS-Assays zur Quantifizierung von Tacrolimus und anderen Immunsuppressiva in sehr kleinen Blutvolumina, wie beispielsweise Trockenblut (typischerweise 20 & mgr; l Blut) 25,29-43 möglich. Ein weiterer Vorteil ist, dass minimal-invasive, geringes Volumen Probennahme-Strategien wie Trockenblut therapeutischen Drug-Monitoring und pharmakokinetischen Untersuchungen bei Kleinkindern 28 erheblich erleichtern.
Tacrolimus wird in der Regel in venösen EDTA-Vollblut 15 gemessen. Gründe sind, dass Tacrolimus weitgehend verteilt in Blutzellen und klinische Studien haben eine bessere Korrelation zwischen Tacrolimus Talspiegel im Blut als im Plasma mit klinischen Ereignissen 15,18 ausgewiesen. Zum Vergleich: Die Analyse tacrolimus in getrockneten Blutflecken auf Kapillarblut, die mit der Filterpapiermatrix eingemischt basiert. Dies stellt Herausforderungen in Bezug auf die Solubilisierung von Tacrolimus und mögliche Interferenzen mit der LC-MS / MS-Analyse. Hier präsentieren wir einen etablierten und validierten Assay basierend auf Homogenisierung der getrocknete Blut vor Ort mittels einer Kugel Mixer in Kombination mit einem High-Flow-Online Spalte Probenvorbereitungsverfahren und LC-MS / MS-Analyse. Bis heute hat dieser Test erfolgreich zur Quantifizierung von mehr als fünftausend Tacrolimus Trockenblut-Proben für die Einhaltung Überwachung in klinischen Studien eingesetzt.
Protokoll
De-identifizierte Blutproben von gesunden Personen waren von der University of Colorado Hospital (Aurora, Colorado). Die Verwendung von de-identifizierten Blutbank-Proben für die Validierungsstudien sowie für die Herstellung von Kalibratoren und Qualitätskontrollproben wurde als von der Colorado Mehr Institutional Review Board (COMIRB, Aurora, Colorado) "befreit".
1. Herstellung von Referenzen und Lösungen
- Kauf Tacrolimus und der interne Standard D 2, 13 C-Tacrolimus aus den in der Materialliste aufgeführt Anbieter.
- Stammlösungen in reinem Methanol bei einer Konzentration von 1 mg / ml für Tacrolimus und einer Konzentration von 10 ug / ml D 2, 13 C-Tacrolimus. Machen Stammlösungen von Referenzmaterialien auf Basis von drei unabhängigen Gewichtungen. Aliquot Stammlösungen und bei -70 ° C oder darunter.
- Bereiten Lösung Proteine auszufällenund extrahieren Tacrolimus Verwendung von Methanol / 0,2 M ZnSO 4 in Wasser (7: 3, V: V). Diese Lösung enthält auch den internen Standard D 2, 13 C-Tacrolimus in einer Konzentration von 2,5 ng / ml und wird für die Extraktion von allen Proben mit Ausnahme der Entnahme von Leerproben (siehe 1.3.3) verwendet.
- Bereiten Sie diese Proteinfällungslösung frisch auf jeder Extraktion Tag und stellen Sie den Ablauf der Lösung bei 12 Stunden.
- Herstellung der Eichkurve und Qualitätskontrolle (QC) Proben
- Bereiten Stammlösungen von Tacrolimus, indem geeignete Verdünnungen der Stammlösung mit reinem Methanol.
- Um Kalibratoren und Qualitätskontrollproben vorzubereiten, Spike 20 ul entsprechend verdünnten Stammlösung in EDTA-Vollblut, bei 37 ° C unter leichtem im Wasserbad Schütteln, um eine homogene Verteilung von Tacrolimus in die zellulären Blutbestandteile für 20 min und aliquoten ermöglichen in 1,5 ml Polypenropylene Röhrchen mit konischem Boden und Schnappdeckel. Sicherzustellen, dass das relative Volumen an organischem Lösungsmittel 5% nicht übersteigen.
- Spot 50 ul der Stachelvollblut in der Mitte jedes Kreises auf der Filterkarten unter Verwendung einer Pipette.
- Trocknen Sie die Blutflecken auf Filterkarten bei RT für 3 h.
- Vorbereitung Tacrolimus Kalibrierstandards humanes EDTA-Vollblut bei Tacrolimus Konzentrationen von 1, 2,5, 5, 10, 25 und 50 ng / ml. Bereiten Sie eine leere Probe für die Extraktion wie die Kalibrierungsstandards mit der Proteinfällung Lösung, die den internen Standard D 2, 13 C-Tacrolimus ("Nullprobe").
- Vorbereitung QC Proben menschlichen EDTA-Vollblut bei Konzentrationen von 0, 2, 4, 20, 40 ng / ml. Bereiten Sie eine leere Probe. Im Gegensatz zu den QC-Proben, die mit Ausfällen den internen Standard enthält D 2 extrahiert werden, 13 C-Tacrolimus, extrahieren Sie diese Blindprobe mit Proteinfällungslösung, die funktioniertnicht enthalten, die den internen Standard D 2, 13 C-Tacrolimus ("Blindprobe").
- Sammlung von klinischen Proben
- Sammeln getrocknete Blutflecken wie in 43,44 beschrieben.
2. Extraktion von Tacrolimus Trockenblut Proben
- Sichtprüfung der getrockneten Blutfleck auf akzeptable Probenqualität und Volumen 45 zu gewährleisten.
- Punch Zentrum der Blutfleck auf der Filterkarte mit einem 6-mm-Lochung.
Hinweis: Die Qualität von Schlägen kann durch Wiegen kontrolliert werden. Eine Stanz gesättigten Filterscheibe wiegt durchschnittlich 5,02 mg ± 0,09 mg (Bereich: 4.83- 5.14 mg, n = 12). - Platz Scheiben in 1,5 ml Polypropylen-Röhrchen mit konischem Boden und Schnappdeckel.
- Hinzufügen 20-30 Kugeln in jedes Röhrchen.
- Fügen Sie 500 ul der Proteinfällungslösung (Methanol: 0,2 M ZnSO 4, 7: 3, V: V mit 2,5 ng / ml interner Standard) in jedes Röhrchen. Für die extrWirkung von Leerproben, verwenden Proteinfällungslösung ohne inneren Standard.
- Homogenisieren die Scheiben in der Kugel-Mischer für 1 min (Maximaldrehzahl, der Einstellung "10").
- Schütteln Sie Proben bei RT auf Mehrrohr Vortex (Maximaldrehzahl, die Einstellung "10") für 10 min.
- Zentrifuge Proben bei 16.000 × g und 4 ° C für 10 min.
- Die Überstände in Glas HPLC-Ampullen mit einer 300 ul Einsatz ausgestattet. Verwenden vorgeschlitzten Teflondichtungen.
Anmerkung: Die extrahierten Proben können bei -20 ° C oder darunter, bis LC-MS / MS-Analyse gespeichert werden.
3. LC-MS / MS-Analyse
- Last 100 ul des Überstands der extrahierten Probe auf die Extraktionssäule C8 Patrone und waschen mit einem 7: 3-Verhältnis von 0,1% Ameisensäure in Wasser: Acetonitril, bei einem Fluss von 5 ml / min für 1 min. Die Anschlüsse des Schaltventils sind in Figur 2 gezeigt und die Steigung durch die Extraktionspumpe in Tabelle 1 ausgeführt .
- Jenseits, aktivieren Sie die Schaltventil, was zu Rückspülung der Analyten aus der Vorsäule auf die analytische Säule.
- Stellen Sie den Säulenthermostat auf 65 ° C.
- Elution der Analyten aus der analytischen Säule mit Hilfe der Durchflussraten und Gradienten in Tabelle 1 dargestellt.
- Schließen Sie die Trennsäule mit einem Tandem-Massenspektrometer über das Turbo-Elektrospray-Ionisations-Quelle. Anpassung der wesentlichen Parameter des Massenspektrometers gemäß Tabelle 2.
- Erkennung von positiven Ionen ([M + Na] +) in der Mehrfachreaktionsmodus (MRM). Verwenden Sie die folgenden Ionenübergänge für die Quantifizierung: Tacrolimus: m / z (Masse / Ladungs) = 826,6 → 616,2 und D 2, 13 C-Tacrolimus: m / z = 829,6 → 619,2.
Hinweis: Die Gesamtlaufzeit beträgt 4,6 min.
4. Quantifizierung
- Für jeden Durchlauf, erzeugen eine Eichkurve auf der Grundlage der in 1.3.5 und hergestellt Kalibratorengehören in jede Analysenserie.
- Generieren Sie eine Eichkurve Nennkonzentrationen gegenResponseFaktor des Analyten (Peakfläche [Analyt] / Peak-Bereich [interner Standard]) unter Verwendung des Massenspektrometers Software.
- Setzen Sie die Kalibratoren mit einer quadratischen Anpassung in Verbindung mit 1 / X Gewichtung.
- Quantität Tacrolimus in den getrockneten Blutflecken integrieren die Tacrolimus und des internen Standardpeaks in den extrahierten MRM Chromatogramme. Berechnen Sie die Reaktionsfaktor für Tacrolimus (Peakfläche [Analyt] / Peak-Bereich [interner Standard]) und vergleichen Sie mit der Eichkurve unter Verwendung der Massenspektrometrie-Software.
5. Validierungsverfahren
- Untere Nachweisgrenze (untere Nachweisgrenze) und Untergrenze (LLOQ).
- Betrachten wir die niedrigste Konzentration von Tacrolimus mit einer Spitze-zu-Rausch-Verhältnis von 4: 1 als die untere Nachweisgrenze (untere Nachweisgrenze). Definieren Sie die untere Grenze der Quantifizierung (LLOQ) alsniedrigste Konzentration der Eichkurve mit einer Genauigkeit, die gleich oder besser als ± 20% Abweichung von der Soll-Konzentration und Präzision gleich oder besser als 20% (Variationskoeffizient).
- Intra- und inter Tag Genauigkeiten und Präzisierungen.
- Testen der Genauigkeit und Präzision bei vier Konzentrationen von 2 ng / ml (QC1), 4 ng / ml (QC2), 20 ng / ml (QC3) und 40 ng / ml (QC4).
- Bereiten Sie die QC-Proben auf jeder Validierung Tag im menschlichen EDTA-Vollblut, Trocken auf Filterkarten, extrahieren und zu analysieren, wie oben beschrieben.
- Bestimmen Sie Intraday-Genauigkeit und Präzision mit 6 Proben pro QC Konzentration.
- Beurteilen Sie Inter-Day-Genauigkeit und Präzision über 20 Tage. Messen Sie jedes QC-Ebene mit 4 Proben pro Tag.
- Analysieren Sie zwei Kalibrierungskurven zusammen mit den QC-Proben an jedem Tag.
- Intraday-Genauigkeit zu berechnen als% der Nominalkonzentration (sechs Proben pro Konzentrationsstufe, siehe 5.2.2). CalcUlate Präzision als Varianzkoeffizienten (CV%).
- Betrachten Sie Intraday-Genauigkeit akzeptabel, wenn sie fällt in der vorgegebenen Grenzwerte in 85% bis 115% des Nominalkonzentration. Sehen untertägigen Genauigkeit akzeptabel ist, wenn er gleich oder besser als ein CV (Variationskoeffizient) von 15%.
- Berechnen inter Tag Genauigkeit und Präzision als Mittelwert für jeden QC Konzentration an den 20 Validierungs Tagen analysiert.
- Betrachten mittlere Inter-Day-Genauigkeit akzeptabel, wenn sie fällt in der vorgegebenen Grenzwerte in 85% bis 115% des Nominalkonzentration. Prüft unter Tages Genauigkeit akzeptabel ist, wenn er gleich oder besser als ein CV (Variationskoeffizient) von 15%.
- Ausschluss von Matrixinterferenzen.
- Für den Ausschluss von Störungen, die durch die Matrix-Signale verursacht werden können, zu analysieren leere getrocknete Blutflecken (8 verschiedenen Individuen, vorzugsweise 4 Männer und 4 Frauen).
- Sichtprüfung Ionenchromatogramme. Wenn Spitzen innerhalb der RetentionszeitFenster von Tacrolimus festgestellt werden, zu integrieren und vergleichen Sie die Flächen unter der Kurve mit denen von Tacrolimus Spitzen im Leerproben gespickt mit Tacrolimus im LLOQ. Die Fläche der Peaks in den Leerproben sollen nicht 15% der von Tacrolimus im LLOQ überschreiten.
- Ionensuppression / ion Verbesserung.
- Verwenden Sie einen Post-Spalte Infusionsprotokoll, wie beschrieben, 45, um mögliche Störungen von Ionenunterdrückung / ion Verbesserung durch koeluierenden Matrixkomponenten verursacht zu bewerten.
- Infundieren Tacrolimus in einer Konzentration von 10 ug / ml in 0,1% iger Ameisensäure gelöst: Methanol (30:70, v / v) post-Säule mit einer Geschwindigkeit von 10 ul / min.
- Verbinden einer Spritzpumpe über T-Stück zwischen der Trennsäule und dem Elektrosprayquelle des Massenspektrometers.
- Überwacht die MS / MS-Signalintensität der MRM Gänge für Tacrolimus und seiner internen Standard (m / z = 826,6 → 616,2 und m / z = 829,6 → 619,2) nach der Injektion von extracted Leerproben (n = 8 Proben von verschiedenen Individuen).
Anmerkung: In Abwesenheit von Ionenunterdrückung / Ionenanreicherungs sollte das Dauersignal von einer Infusion der Analyten verursacht nicht durch Injektion des Blindmatrix beeinflusst werden, während Ionensuppression bewirkt einen Sprung des Signals und Ionenanreicherungs ein Peak.
- Übertrag.
- Bewertung der potenziellen Übertrag durch Analysieren extrahierten Leerproben nach den höchsten Kalibratoren (50 ng / ml, n = 6).
- Sichtprüfung Ionenchromatogramme. Wenn Peaks innerhalb des Retentionszeitfenster von Tacrolimus festgestellt werden, zu integrieren und vergleichen Sie die Flächen unter der Kurve mit denen von Tacrolimus Spitzen im Leerproben gespickt mit Tacrolimus im LLOQ. Die Fläche der Peaks in den Leerproben sollen nicht 15% der von Tacrolimus im LLOQ überschreiten.
- Extraction Erholungen.
- Bestimmen Sie, Rückforderungen durch Vergleich der Signale der Analyten nach der Extraktion des QC samsätze an allen vier Konzentrationsstufen (n = 6 pro Konzentration) mit denen der leere getrocknete Blutflecken versetzt mit der entsprechenden Beträge von Tacrolimus nach der Extraktion.
- Vorbereitung vier Sätze von QC (Konzentration: 2, 4, 20, 40 ng / ml).
- Bereiten Sie weitere 4 Sätze von entsprechenden "Rückgewinnung Testproben" durch Spotting 50 ul blank EDTA-Vollblut auf die Filterpapierkarten und Trocknen 2 h.
- Im Folgenden wird sowohl für die QC und blank "Recovery-Testproben", schneiden Sie die gesamte Blutfleck auf der Filterkarte mit einer Schere und legen Sie die resultierenden Scheiben in eine Polypropylen-Röhrchen mit konischem Boden und Schnappdeckel.
- Extrahieren Sie alle Proben.
- Die Überstände (400 & mgr; l) in Glas HPLC-Ampullen.
- In Tacrolimus-Stammlösung zu den blank "extrahiert Recovery-Testproben", um Konzentrationen von 2, 4, 20 und 40 ng / ml (4 & mgr; l von 200, 400, 2.000, 4.000 ng / ml Tacrolimus stock Sol erreichenutions bis 400 & mgr; l Überstand).
- Nach dem LC-MS / MS-Analyse, zu vergleichen, die Signale in beide QC Proben und "Recovery Testproben" der entsprechenden Konzentration (Rückgewinnung% = Signalproben versetzt vor der Extraktion / Signalproben versetzt nach der Extraktion x 100).
- Dilution Integrität.
- Herzustellen Verdünnungs Integrität mit dotierten Proben mit den Analyten bei 500, 250 und 100 ng / ml.
- Nach der Extraktion, verdünnte Proben unter Verwendung von Protein-Fällungslösung (1.10, n = 3 pro Konzentrationsstufe).
- Berechnen Sie Abweichungen von den Nennkonzentrationen. Betrachten Sie Ergebnisse, die innerhalb von 85% -115% der Nenn akzeptabel fallen.
- Stabilitäten.
- Untersuchen Stabilitäten Verwendung der QC-Proben an allen vier Konzentrationsstufen (n = 4 pro Konzentration) analysiert zu verschiedenen Zeitpunkten und unter unterschiedlichen Lagerbedingungen.
- Ergebnisse nach Lagerung mit den Sollwerten zu vergleichen. Betrachten rrgebnisse, die innerhalb 85% -115% der Nenn akzeptabel fallen.
- Stellen Sie die Probenstabilität für 1 Woche bei Raumtemperatur, 1 Woche bei 4 ° C, 1 Monat bei -20 ° C und 1 Monat bei -80 ° C.
- Test Gefrier-Tau-Stabilität über drei Zyklen (-20 ° C). Test extrahierten Probe und Autosampler-Stabilität, indem Proben in den thermostatisierten Autosampler auf 4 ° C eingestellt. Injizieren Proben nach 72 h.
Ergebnisse
Vertreter Ionenchromatogramme einer Blindprobe, versetzt eine Probe, an der unteren Grenze der Quantifizierung und eine Patientenprobe werden in Abbildung 3 dargestellt.
Kalibrierungskurven
Die untere Detektionsgrenze lag bei 0,5 ng / ml, und die Untergrenze der Quantifizierung, betrug 1,0 ng / ml. Fünfzig ng / ml wurde als die höchste Kalibrator gewählt, da höhere Konzentrationen sind unwahrscheinlich, dass in der Klinik unter normalen Umständen erreicht werden.
Eichkurven wurden frisch auf jeder Validierung Tag im menschlichen EDTA-Vollblut bereit, auf Filterkarten getrocknet und extrahiert mit Methanol / 0,2 M ZnSO4 (70:30 v / v) + interner Standard (Endkonzentration von interner Standard: 2,5 ng / ml ). Für den Tag 1 Validierung (n = 6 für Kalibratoren und n = 6 für QC-Ebene) und seit Tagen 2-20 (n = 2 für Kalibratoren und n = 4 für die einzelnen QC-Ebene) wurden mit Konzentrationen 1, 2,5, 5 analysiert, 10, 25, 50 ng / ml für calibratoren. Eine typische Eichkurve ist in Abbildung 4 dargestellt. Die mittlere Genauigkeit von 85% bis 115% des nominalen, in den Arbeitsbereich für 2/3 der Kalibratoren (mit einem Minimum von 6 nicht-Nullkalibratoren) wurden als akzeptabel angesehen. Die Durchschnittskorrelationskoeffizient betrug (r) = 0,999 (n = 40 Eichkurven).
Genauigkeiten und Präzisierungen
Die Ergebnisse sind im Detail in Tabelle 3 gezeigt.
Extraction Rettung
Durchschnittliche Extraktions Ausbeute war 98,2% (2 ng / ml), 92,2 (4 ng / ml), 95,5 (20 ng / ml), 96,2 (40 ng / ml).
Matrixinterferenzen, Ionensuppression / Ion Enhancement Testen mit Continuous Post-Column Infusion und Übertragungen
Analyse der Blindproben aus acht verschiedenen Individuen (n = 4 weiblichen und n = 4 männlich) zeigte Signale weniger als 15% des LLOQ (1 ng / ml) bei der Retentionszeit entspricht, dieTacrolimus Peak anzeigt, dass die erfasste Tacrolimus Peak Ausführlichere berücksichtigen. Ein repräsentatives Beispiel ist in Abbildung 3 dargestellt. Mögliche Störungen durch Ionensuppression / ion Verbesserung wurden mit leeren getrockneten Blutproben aus acht gesunden Personen getestet. Ein repräsentatives Experiment ist in Figur 5 gezeigt. Keine Hinweise auf eine erhebliche Ionensuppression / ion Verbesserung beobachtet. Keine relevante Übertrag resultierenden Spitzen in mehr als 15% des Signals bei LLOQ nachgewiesen.
Dilution Integrität
Dilution Integrität wurde durch Analyse von Proben mit Konzentrationen über dem höchsten Kalibrator (100, 250 und 500 ng / ml) hergestellt und in Protein-Fällungslösung nach der Extraktion 1:10 verdünnt, um die Zielkonzentrationen zu erreichen untersucht: 10, 25, und 50 ng / ml. Mittlere Genauigkeiten musste innerhalb der Akzeptanzkriterien von 85% bis 115% der Nennkonzentrationen sinken. Alle Verdünnungen tesTed erfüllt Akzeptanzkriterien (Tabelle 4).
Stabilitäten
Stabilität von Tacrolimus in getrockneten Blutflecken wurde durch Analysieren QC-Proben auf allen vier Ebenen (n = 4 / Konzentration), die unter verschiedenen Bedingungen gelagert wurden, untersucht.
Mittlere Genauigkeiten musste innerhalb der Akzeptanzkriterien von 85% bis 115% der Nennkonzentrationen sinken. Ergebnisse sind im Detail in Tabelle 5 gezeigt. Keine Verluste nach 1 Woche Lagerung bei RT, nach 1 Woche Lagerung bei 4 ° C, nach 1 Monat Lagerung bei -20 ° C, nach 1 Monat Lagerung bei -80 ° C, nach 3 Frost-Tau-Zyklen und nach 72 h der extrahierten Proben in Autosampler bei 4 ° C erkennbar waren.
| Absaugpumpe | Pump Analytical (Elution) | ||||||
| Zeit [min] | Wasser + 0,1% Ameisensäure | Acetonitril | Durchfluss [ml / min] | Zeit [min] | Wasser + 0,1% Ameisensäure | Acetonitril | Durchfluss [ml / min] |
| 0 | 70 | 30 | 5000 | 0 | 13 | 87 | 1000 |
| 1 | 70 | 30 | 5000 | 2 | 2 | 98 | 1.200 |
| 1.1 | 2 | 98 | 100 | 3.5 | 2 | 98 | 1.200 |
| 3 | 2 | 98 | 100 | 3.6 | 13 | 87 | 1000 |
| 3.1 | 20 | 80 | 2.000 | 4.6 | 13 | 87 | 1000 |
| 4 | 70 | 30 | 5000 | ||||
| 4.6 | 70 | 30 | 5000 | ||||
Tabelle 1 Gradient Programm für die Extraktion und analytische HPLC-Pumpen.
| Parameter | Einstellung |
| Kollisionsgas (CAD) | 10 |
| Curtain-Gas (CUR) (psi) | 30 |
| Ionenquelle Gas 1 (GS1) (psi) | 50 |
| Ionenquelle Gas 2 (GS2) (psi) | 30 |
| Vernebler Strom (NC) (V) | 1 |
| Temperatur (TEM) (° C) | 600 |
| Ionenspray Spannung (IS) (V) | 5500 |
| Schnittstelle Heizung (IHE) | Am |
| Declustering Potential (DP) (V) | 136 |
| Eingangspotential (EP) (V) | 10 |
| Kollisionsenergie (CE) (V) | 47 |
| Kollisionszelle Austrittspotential (CXP) (V) | 16 |
Tabelle 2. Turbo Elektrospray-Interface und Massenspektrometer-Parameter. Die Nomenklatur entspricht der in der Massenspektrometrie-Software verwendet werden (Herstellerinformationen finden Sie Materialliste).
| Validation Day | QC Ebene [% der nominalen Konzentration] | |||
| 2 | 4 | 20 | 40 | |
| Tag 1 | 9.30 | 86,3 | 88,9 | 93,4 |
| 101 | 90,4 | 95,3 | 100 | |
| 85,6 | 95,9 | 99,0 | 97,5 | |
| 88,6 | 93,6 | 105 | 103 | |
| 85,0 | 97,4 | 97,2 | 109 | |
| 89,1 | 96,7 | 100 | 101 | |
| Intraday-Genauigkeit [%] | 90,4 | 93,4 | 97,6 | 100,7 |
| Intra-Day Ungenauigkeit [CV%] | 6.6 | 4.6 | 5.5 | 5.2 |
| Tag 2 | 92,8 | 86,0 | 103 | 95,4 |
| 91,1 | 88,8 | 94,7 | 87,0 | |
| 88,6 | 90,9 | 92,8 | 94,2 | |
| 97,2 | 93,7 | 94,2 | 115 | |
| Intraday-Genauigkeit [%] | 92,4 | 89,9 | 96,2 | 97,9 |
| Intra-Day Ungenauigkeit [CV%] | 3.9 | 3.6 | 4.8 | 12.2 |
| Tag 3 | 97,6 | 101 | 98,4 | 112 |
| 104 | 85,6 | 102 | 110 | |
| 99,2 | 88,4 | 99,4 | 105 | |
| 96,3 | 87,2 | 108 | 117 | |
| Intraday-Genauigkeit [%] | 99,3 | 90,6 | 102,0 | 111,0 |
| Intra-Day Ungenauigkeit [CV%] | 3.4 | 7.8 | 4.2 | 4.5 |
| Tag 4 | 95,2 | 88,6 | 112 | 94,5 |
| 105 | 87,3 | 93,2 | 116 | |
| 99,8 | 96,2 | 103 | 103 | |
| 100 | 104 | 97,2 | 99,4 | |
| Intraday-Genauigkeit [%] | 100,0 | 94,0 | 101,4 | 103,2 |
| Intra-Day Ungenauigkeit [CV%] | 4.0 | 8.2 | 8.1 | 8.9 |
| Tag 5 | 106 | 90,4 | 101 | 106 |
| 108 | 89,0 | 106 | 100 | |
| 102 | 101 | 96,6 | 128 | |
| 105 | 88,8 | 105 | 107 | |
| Intraday-Genauigkeit [%] | 105,3 | 92,3 | 102,2 | 110,3 |
| Intra-Day Ungenauigkeit [CV%] | 2.4 | 6.3 | 4.2 | 11.1 |
| Tag 6 | 90,9 | 93,7 | 119 | 106 |
| 98,8 | 88,1 | 96,4 | 110 | |
| 94,6 | 96,3 | 99,1 | 108 | |
| 108 | 100 | 102 | 102 | |
| Intraday-Genauigkeit [%] | 98,1 | 94,5 | 104,1 | 106,5 |
| Intra-Day Ungenauigkeit [CV%] | 7.5 | 5.3 | 9.8 | 3.2 |
| Tag 7 | 85,1 | 87,5 | 99,5 | 95,4 |
| 86,4 | 85,4 | 94,7 | 101 | |
| 94,5 | 87,3 | 98,9 | 94,6 | |
| 85,5 | 97,0 | 101 | 99,6 | |
| Intraday-Genauigkeit [%] | 87,9 | 89,3 | 98,5 | 97,7 |
| Intra-Day Ungenauigkeit [CV%] | 5.1 | 5.8 | 2.7 | 3.2 |
| Tag 8 | 86,1 | 92,5 | 91,9 | 102 |
| 87,5 | 91,5 | 95,2 | 88,5 | |
| 115 | 85,6 | 92,1 | 102 | |
| 85,8 | 85,9 | 95,4 | 108 | |
| Intraday-Genauigkeit [%] | 93,6 | 88,9 | 93,7 | 100,1 |
| Intra-Day Ungenauigkeit [CV%] | 15,3 | 4.1 | 2.0 | 8.2 |
| Tag 9 | 88,9 | 91,4 | 96,9 | 100 |
| 90,0 | 89,8 | 95,0 | 100 | |
| 69,7 | 85,9 | 95,8 | 109 | |
| 91,9 | 87,0 | 105 | 101 | |
| Intraday-Genauigkeit [%] | 85,1 | 88,5 | 98,2 | 102,5 |
| Intra-Day Ungenauigkeit [CV%] | 12.2 | 2.9 | 4.7 | 4.3 |
| Tag 10 | 90,9 | 91,3 | 96,2 | 100 |
| 97,7 | 89,5 | 94,4 | 100 | |
| 99,9 | 109 | 98,7 | 96,8 | |
| 99,1 | 90,0 | 95,7 | 96,1 | |
| Intraday-Genauigkeit [%] | 96,9 | 95,0 | 96,3 | 98,2 |
| Intra-Day Ungenauigkeit [CV%] | 4.2 | 9.9 | 1.9 | 2.1 |
| Tag 11 | 92,7 | 91,9 | 88,2 | 104 |
| 96,6 | 91,2 | 97,0 | 110 | |
| 109,0 | 92,8 | 970,6 | 102 | |
| 98,3 | 107 | 93,7 | 111 | |
| Intraday-Genauigkeit [%] | 99,2 | 95,7 | 94,1 | 106,8 |
| Intra-Day Ungenauigkeit [CV%] | 7.0 | 7.9 | 4.6 | 4.1 |
| Tag 12 | 87,7 | 85,5 | 105 | 95,3 |
| 112 | 88,1 | 101 | 96,1 | |
| 102 | 89,1 | 89,7 | 97,5 | |
| 106 | 92,5 | 102 | 104 | |
| Intraday-Genauigkeit [%] | 101,9 | 88,8 | 99,4 | 98,2 |
| Intra-Day Ungenauigkeit [CV%] | 10.1 | 3.3 | 6.7 | 4.0 |
| Tag 13 | Gescheitert | 85,7 | 93,3 | 102 |
| 101 | 105 | 88,0 | 93,9 | |
| 112 | 98,0 | 91,4 | 102 | |
| 104 | 113 | 104 | 101 | |
| Intraday-Genauigkeit [%] | 105,7 | 100,4 | 94,2 | 99,7 |
| Intra-Day Ungenauigkeit [CV%] | 5.4 | 11,5 | 7.3 | 3.9 |
| Tag 14 | 91,5 | 89,1 | 97,4 | 93,1 |
| 90,4 | 87,1 | 93,9 | 99,8 | |
| 89,7 | 97,0 | 94,8 | 106 | |
| 97,4 | 86,8 | 89,9 | Gescheitert | |
| Intraday-Genauigkeit [%] | 92,3 | 90,0 | 94,0 | 99,6 |
| Intra-Day Ungenauigkeit [CV%] | 3.8 | 5.3 | 3.3 | 6.5 |
| Tag 15 | 92,8 | 92,8 | 92,5 | 95,4 |
| 97,5 | 96,3 | 96,2 | 95,5 | |
| 95,5 | 108 | 97,3 | 99,3 | |
| 110 | 109 | 115 | 113 | |
| Intraday-Genauigkeit [%] | 99,0 | 101,5 | 100,3 | 100,8 |
| Intra-Day Ungenauigkeit [CV%] | 7.7 | 8.1 | 100 | 8.3 |
| Tag 16 | 93,7 | 97,8 | 90,7 | 112 |
| 90,3 | 87,1 | Gescheitert | 101 | |
| 97,9 | 88,3 | 95,5 | 107 | |
| 91,4 | 85,7 | 89,3 | 96,7 | |
| Intraday-Genauigkeit [%] | 93,3 | 89,7 | 91,8 | 104,2 |
| Intra-Day Ungenauigkeit [CV%] | 3.6 | 6.1 | 3.5 | 6.4 |
| Tag 17 | 88,0 | 86,0 | 93,7 | 103 |
| 89,8 | 90,8 | 94,8 | 93,2 | |
| 85,9 | 91,1 | 99,7 | 94,8 | |
| 86,7 | 88,1 | 95,6 | 91,7 | |
| Intraday-Genauigkeit [%] | 87,6 | 89,0 | 96,0 | 95,7 |
| Intra-Day Ungenauigkeit [CV%] | 1.9 | 2.7 | 2.7 | 5.3 |
| Tag 18 | 89,6 | 85,8 | 91,0 | 98,3 |
| 89,6 | 86,2 | 88,3 | 93,6 | |
| Gescheitert | 86,7 | 96,8 | 104 | |
| 88,1 | 85,8 | 95,2 | 111 | |
| Intraday-Genauigkeit [%] | 89,1 | 86,1 | 92,8 | 101,7 |
| Intra-Day Ungenauigkeit [CV%] | 1.0 | 0,5 | 4.2 | 7.4 |
| Tag 19 | 98,0 | 89,7 | 94,2 | 102 |
| 88,3 | 86,0 | 97,6 | 102 | |
| 91,6 | 88,1 | 95,8 | 97,5 | |
| 90,7 | 90,1 | 92,8 | 88,3 | |
| Intraday-Genauigkeit [%] | 92,2 | 88,5 | 95,1 | 97,5 |
| Intra-Day Ungenauigkeit [CV%] | 4.5 | 2.1 | 2.2 | 6.6 |
| Tag 20 | 9.30 | 87,0 | 99,4 | 101 |
| 97,3 | 87,6 | 95,5 | 91,9 | |
| 89,0 | 88,4 | 91,2 | 93,5 | |
| 104 | 90,7 | 97,7 | 115 | |
| Intraday-Genauigkeit[%] | 95,8 | 88,4 | 96,0 | 100,4 |
| Intra-Day Ungenauigkeit [CV%] | 6.7 | 1.8 | 3.7 | 10.5 |
Inter-Day Genauigkeit und Ungenauigkeit | ||||
| Inter-Tage-Genauigkeit | 95,2 | 91,7 | 97,2 | 101,6 |
| Inter-Day Ungenauigkeit | 6.1 | 4.5 | 3.6 | 4.2 |
Tabelle 3. Ergebnisse der Proben zur Qualitätskontrolle über 20 Tage. Die Daten werden als% der Nenn vorgestellt. Proben als "nicht bestanden" aufgeführt sind Proben, die zu Labor / Instrumentenfehler verloren gegangen sind. In den meisten cases wurden keine Peaks wurden bei allen oder erfasst der interne Standardpeak fehlte.
| Verdünnung | 1.10 |
| Nennzielkonzentration nach Verdünnung | 50 ng / ml |
| 98,6 | |
| 94,5 | |
| 91,4 | |
| Genauigkeit [%] | 94,8 |
| Ungenauigkeit [CV%] | 3.6 |
| Verdünnung | 1.10 |
| Nennzielkonzentration nach Verdünnung | 10 ng / ml |
| 103 | |
| 99,5 | |
| 101 | |
| Genauigkeit [%] | 101,2 |
| Ungenauigkeit [CV%] | 1.8 |
| Verdünnung | 1.10 |
| Nennzielkonzentration nach Verdünnung | 25 ng / ml |
| 91,7 | |
| 98,2 | |
| 103 | |
| Genauigkeit [%] | 97,6 |
| Ungenauigkeit [CV%] | 5.7 |
Tabelle 4. Ergebnisse der Verdünnung Integritätstest. Die Daten werden als% der Nenn vorgestellt.
| EIN | ||||
| Stabilität bei RT, Tag 1 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 91,9 | 85,8 | 86,0 | 102 | |
| 86,7 | 85,7 | 88,5 | 102 | |
| 86,0 | 85,9 | 90,1 | 103 | |
| 89,2 | 98,0 | 90,8 | 112 | |
| % Der nominalen Konzentration | 88,5 | 88,9 | 88,9 | 104,8 |
| Ungenauigkeit [% CV] | 2.7 | 6.1 | 2.1 | 4.9 |
| Stabilität bei RT, Tag 3 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 88,6 | 105 | 101 | 113 | |
| 94,1 | 100 | 98,5 | 103 | |
| 100 | 101 | 106 | 109 | |
| 99,5 | 102 | 102 | 108 | |
| % Der nominalen Konzentration | 95,6 | 102,0 | 101,9 | 108,3 |
| Ungenauigkeit [% CV] | 5.3 | 2.2 | 3.1 | 4.1 |
| Stabilität bei RT, Tag 7 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 105 | 103 | 91,7 | 109 | |
| 101 | 107 | 100 | 110 | |
| 102 | 108 | 107 | 105 | |
| 93,8 | 105 | 109 | 111 | |
| % Der nominalen Konzentration | 100,5 | 105,8 | 101,9 | 108,8 |
| Ungenauigkeit [% CV] | 4.7 | 2.2 | 7.8 | 2.6 |
| B | ||||
| Stabilität bei 4 ° C, Tag 1 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 101 | 89,9 | 95,8 | 100 | |
| 88,9 | 91,0 | 94,1 | 99,0 | |
| 96,2 | 100 | 102 | 96,7 | |
| 89,5 | 87,8 | 95,4 | 88,6 | |
| % Der nominalen Konzentration | 93,9 | 92,2 | 96,8 | 96,1 |
| Ungenauigkeit [% CV] | 5.8 | 5.4 | 3.5 | 5.2 |
| Stabilität bei +4 ° C, Tag 3 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 87,3 | 85,2 | 105 | 95,3 | |
| Gescheitert | 87,8 | 101 | 96 | |
| 101 | 88,8 | 89,6 | 97,5 | |
| 106 | 92,2 | 102 | 104 | |
| % Der nominalen Konzentration | 98,1 | 88,5 | 99,4 | 98,2 |
| Ungenauigkeit [% CV] | 9.7 | 2.9 | 6.8 | 4.0 |
| Stabilität bei +4 ° C, Tag 7 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 94,0 | 98,5 | 96,1 | 110 | |
| 92,9 | 96,4 | 109 | 109 | |
| 91,7 | 96,3 | 97,9 | 115 | |
| 94,7 | 96,9 | 99,8 | 113 | |
| % Der nominalen Konzentration | 93,3 | 97,0 | 100,7 | 111,8 |
| Ungenauigkeit[%CV] | 1.3 | 1.0 | 5.7 | 2.8 |
| C | ||||
| Stabilität bei -20 ° C, Tag 3 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 87,3 | 98,7 | 111 | 111 | |
| 93,5 | 89,6 | 108 | 105 | |
| 89,5 | 91,5 | 107 | 112 | |
| 88,2 | 99,1 | 108 | 92,4 | |
| % Der nominalen Konzentration | 89,6 | 94,7 | 108,5 | 105,1 |
| Ungenauigkeit [% CV] | 2.7 | 4.9 | 1.7 | 9.0 |
| Stabilität bei -20 ° C, Tag 7 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 96,5 | 98,7 | 102 | 109 | |
| 94,8 | 94,6 | 114 | 106 | |
| 95,5 | 102 | 98,1 | 108 | |
| 107 | 99,5 | 115 | 105 | |
| % Der nominalen Konzentration | 98,5 | 98,7 | 107,3 | 107 |
| Ungenauigkeit [% CV] | 5.7 | 3.1 | 8.5 | 1.8 |
| Stabilität bei -20 ° C, Tag 30 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 82,3 | 83,1 | 90,4 | 93,2 | |
| 87,9 | 85,8 | 85,3 | 97,9 | |
| 85,7 | 88,6 | 98,3 | 98,0 | |
| 92,0 | 95,6 | 110 | 103 | |
| % Der nominalen Konzentration | 87,0 | 88,3 | 96,0 | 98,0 |
| Ungenauigkeit [% CV] | 4.1 | 5.4 | 10,8 | 4.0 |
| D </ td> | ||||
| Stabilität bei -80 ° C, Tag 3 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 87,5 | 96,5 | 96,7 | Gescheitert | |
| Gescheitert | 97,6 | 98,7 | 110 | |
| 88,8 | 96,4 | 106 | 109 | |
| 87,3 | 101 | 96,5 | 109 | |
| % Der nominalen Konzentration | 87,9 | 97,9 | 99,5 | 109,3 |
| Ungenauigkeit [% CV] | 0.8 | 2.2 | 4.5 | 0.6 |
| Stabilität bei -80 ° C, Tag 7 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| Gescheitert | 98,0 | 105 | 99,8 | |
| 97,1 | 106 | 104 | 105 | |
| 99,7 | 102 | 99,3 | 102 | |
| 101 | 99,9 | 109 | 106 | |
| % Der nominalen Konzentration | 99,3 | 101,5 | 104,3 | 103,2 |
| Ungenauigkeit [% CV] | 2.0 | 3.4 | 4.0 | 2.8 |
| Stabilität bei -80 ° C, Tag 30 | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 88,2 | 85,3 | 89,6 | 96,7 | |
| 96,2 | 92,6 | 85,8 | 94,1 | |
| 83,9 | 93,7 | 91,0 | 105 | |
| 95,6 | 94,0 | 98,9 | 102 | |
| % Der nominalen Konzentration | 91,0 | 91,4 | 91,3 | 99,5 |
| Ungenauigkeit [% CV] | 6.0 | 4.1 | 5.5 | 4.9 |
| E | ||||
| Gefrier-Tau-Stabilität bei -20 ° C, 1 Zyklus | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 92,5 | 86,2 | 90,2 | 94,3 | |
| 89,8 | 90,5 | 85,4 | 104 | |
| 94,7 | 88,6 | 93,4 | 104 | |
| 101 | 89,2 | 93,7 | 96,3 | |
| % Der nominalen Konzentration | 94,5 | 88,6 | 90,7 | 99,7 |
| Ungenauigkeit [% CV] | 4.8 | 1.8 | 3.9 | 5.1 |
| Gefrier-Tau-Stabilität bei -20 ° C, 2 Zyklen | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 99,1 | 97,6 | Gescheitert | 85,3 | |
| 93,1 | 88,1 | 93,4 | 92,0 | |
| 94,9 | 91,5 | 85,8 | 93,9 | |
| Gescheitert | 90,5 | 86,8 | 85,4 | |
| % Der nominalen Konzentration | 95,7 | 91,9 | 88,7 | 89,2 |
| Ungenauigkeit [% CV] | 3.1 | 4.0 | 4.1 | 4.5 |
| Gefrier-Tau-Stabilität bei -20 ° C, 3 Zyklen | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 95,7 | Gescheitert | 86,0 | 93,3 | |
| 95,5 | 87,4 | 85,0 | 91,3 | |
| 90,5 | 89,1 | 86,0 | 86,0 | |
| 96,9 | 85,7 | 90,2 | Gescheitert | |
| % Der nominalen Konzentration | 94,7 | 87,4 | 86,8 | 90,2 |
| Ungenauigkeit [% CV] | 2.8 | 1.7 | 2.3 | 3.8 |
| F | ||||
| Extrahierten Probe Stabilität bei 4 ° C, 24 Stunden | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 122 | 112 | 91,0 | 104 | |
| 93,5 | 106 | 91,8 | 96,1 | |
| 111 | 94,8 | 98,2 | 93,5 | |
| 98,4 | 97,6 | 91,3 | 89,8 | |
| % Der nominalen Konzentration | 106,2 | 102,6 | 93,1 | 95,9 |
| Ungenauigkeit [% CV] | 12,8 | 7.9 | 3.4 | 6.0 |
| Extrahierten Probe Stabilität bei 4 ° C, 48 h | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 106 | 108 | 93,7 | 110 | |
| 105 | 98,1 | 94,6 | 98,9 | |
| 103 | 98,4 | 95,0 | 92,6 | |
| 108 | 93,1 | 89,7 | 85,5 | |
| % Der nominalen Konzentration | 105,5 | 99,4 | 93,3 | 96,8 |
| Ungenauigkeit [% CV] | 2.1 | 6.2 | 2.4 | 10.4 |
| Extrahierten Probe Stabilität bei 4 ° C, 72 h | ||||
| QC-Ebene [ng / ml] | 2 | 4 | 20 | 40 |
| 96,5 | 112 | 96,4 | 104 | |
| 101 | 95,3 | 103 | 95,2 | |
| 94,2 | 105 | 93,5 | 99,5 | |
| 100 | 96,9 | 92,6 | 89,3 | |
| % Der nominalen Konzentration | 97,9 | 102,3 | 96,4 | 97,0 |
| Ungenauigkeit [% CV] | 3.1 | 7.7 | 4.7 | 6.3 |
Tabelle 5. Ergebnisse der Stabilitätsprüfungen. A: Stabilität von Tacrolimus auf getrocknete Blutflecken bei RT über 7 Tage, B: Stabilität von Tacrolimus auf getrocknete Blutflecken im Kühlschrank (+4 ° C) über 7 Tage, C: Stabilität von Tacrolimus auf getrocknete Blutflecken bei -20 ° C über 1 Monat, D: Stabilität von Tacrolimus auf getrocknete Blutflecken bei -80 ° C über 1 Monat, E: Stabilität von Tacrolimus auf getrocknete Blutflecken über drei Gefrier-Auftau-Zyklen (-20 ° C), F : Extrahierten Probe / Probengeber Stabilität bei 4 ° C über 72 Stunden. Daten werden als% der Soll-Konzentration dargestellt. Proben als "nicht bestanden" aufgeführt sind Proben, die zu Labor / Instrumentenfehler verloren gegangen sind. In den meisten Fällen wurden keine Peaks bei allen oder erfasst der interne Standardpeak fehlte.

Abbildung 1. Struktur von Tacrolimus. Atom Nummerierung entspricht der Internationalen Union für reine und angewandte Chemie (IUPAC) Nomenklatur. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Anschluss des Schaltventils.424fig2large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
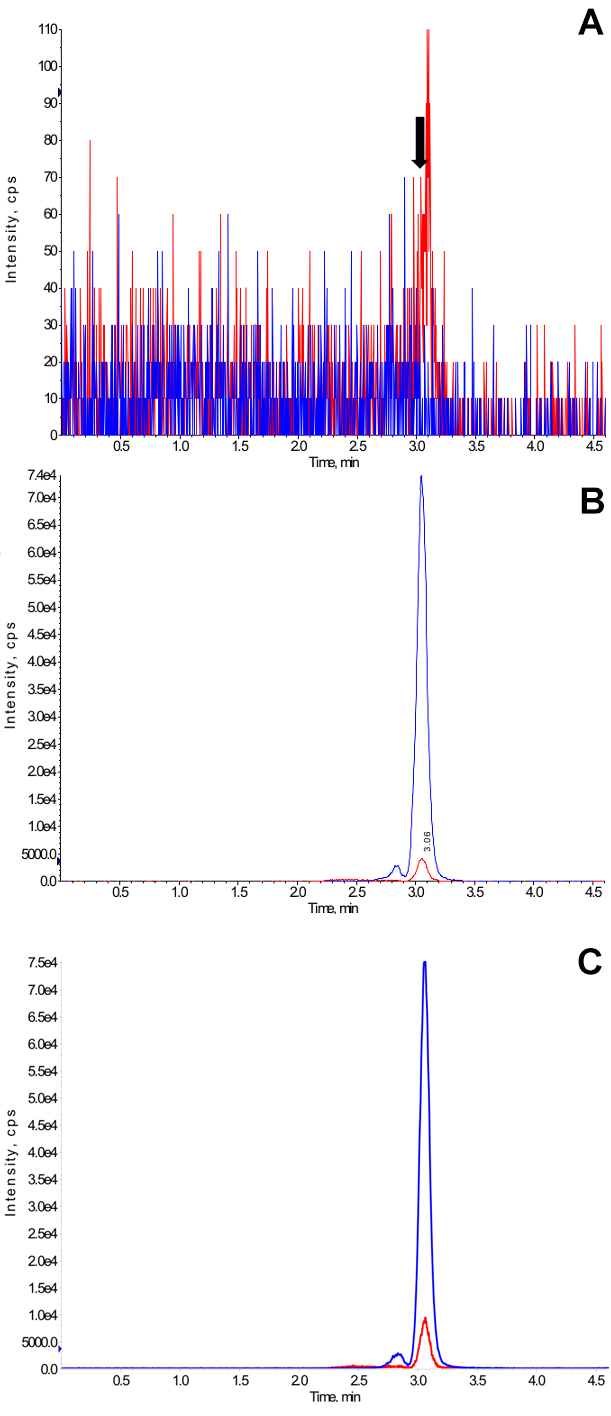
Figur 3. Repräsentative Ionenchromatogramme. (A) Repräsentative Ionenchromatogramm von einer leeren Blutproben auf Filterpapier getupft (für Hersteller Details siehe Materialliste) und getrocknet. Der Pfeil markiert die Retentionszeit der Tacrolimus-Peak, (B) Repräsentative Ionenchromatogramm einer leeren Blutproben am unteren Bestimmungsgrenze (1 ng / ml) versetzt auf das Filterpapier aufgetragen und getrocknet wird, und (C) Repräsentative Ionenchromatogramm einer Probe durch ein Transplantationspatient auf Filterpapier gesammelt. Dies ist ein Trog Probe, und die gemessene Konzentration von Tacrolimus betrug 2,1 ng / ml. Diese Probe wurde durch den Patienten zu Hause gewonnen und ist aus einer klinischen Studie, die war von der University of Cincinnati Institutional Review Board (Cincinnati, OH) zugelassen. Alle Patienten gaben ihre entsprechenden schriftlichen Zustimmung. Ionenchromatogramme sind original Ausdrucke, wie durch die Massenspektrometrie Software generiert (für Hersteller Details siehe Materialliste). Blaue und rote Linien in Ionenchromatogramme stellen den internen Standard D 2, 13 C-Tacrolimus und Tacrolimus sind. Der Peak eluierenden vor dem Haupt Tacrolimus und des internen Standardpeaks sind die Rotamere. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 4. Repräsentative Eichkurve. Ein Original-Ausdruck, wie durch die Massenspektrometrie Software generiert wird angezeigt.424 / 52424fig4large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
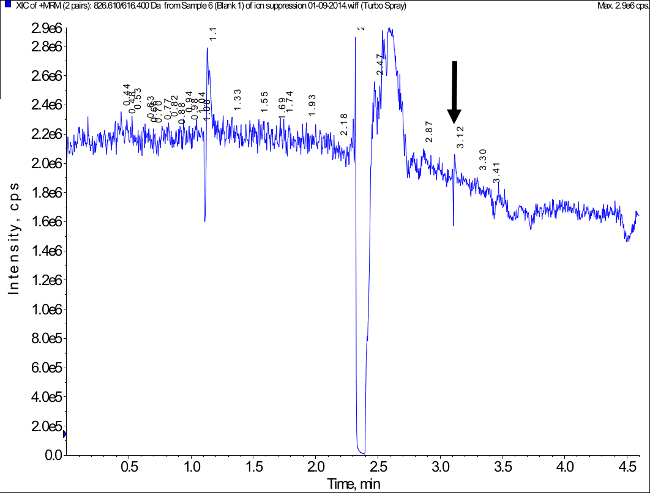
Abbildung 5. Vertreter Ionenchromatogramm Gemessen Während Post-Column Infusion von Tacrolimus und Injektion eines extrahierten Blank Blutprobe auf ein Potential Matrix Effect Beurteilen (Ionensuppression / Ion Enhancement). Der Pfeil markiert die Retentionszeit der Tacrolimus-Gipfel. Matrixeffekt Prüfung wurde auf der in 46 beschriebene Verfahren basiert. Keine relevanten Matrixeffekt festgestellt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Obwohl, wie oben erwähnt, ist das Konzept der therapeutischen Arzneimittel und Einhaltung Überwachung der Tacrolimus auf Basis von Trockenblut attraktiv, es gibt analytische Herausforderungen, die über die in der Regel mit der LC-MS / MS-Analyse von Tacrolimus im venösen EDTA-Vollblut-Proben verbunden zu gehen. Diese schließen ein, sind aber nicht beschränkt auf die Tatsache, dass die Matrix Kappilarblut in die Baumwolllinters Material des hier verwendeten Filterkarte Materials und der geringen Blutvolumen (20 ul) getränkt beschränkt. Dennoch Analyse mit hohem Durchsatz in einem Zentrallabor erfordert eine schnelle und zuverlässige Extraktionsverfahren, die in Proben, die Matrixinterferenzen und Matrixeffekte fehlen in Verbindung mit einer robusten, spezifische und hochempfindliche LC-MS / MS-Assay führt. Zuverlässigkeit des Assays ist kritisch, da es in der Regel nicht genügend Material an den bereits ausgestanzten Filterkarte zum Wiederanalyse bei der Extraktion / LC-MS / MS-Analyse fehlschlägt gelassen.
Der filter Karten in der vorliegenden Studie verwendet (für Hersteller Details siehe Materialliste) wurden ausgewählt, da diese ein von der FDA zugelassenen Geräteklasse II, sind in Übereinstimmung mit NCCLS Führung LA4-A5 44 und die CE-Kennzeichnung in Europa. Wenn vollständig gefüllt ist, einen Kreis auf dem Whatman 903 Filterkarte hält ≈50 ul Blut 46. Allerdings ist die Größe der Bluttropfen von den einzelnen Patienten gesammelt variieren und Ausbildung in der richtigen Sampling-Technik ist von wesentlicher Bedeutung 46.
Der erste wichtige Schritt zum Extrahieren eines ausgestanzten Trockenblut Probe Homogenisierung. Basierend auf unserer Erfahrung ist die Verwendung einer Kugel Mixer effizienter und reproduzierbarer als andere Methoden verwendet werden, um die Extraktionseffizienz zu verbessern, wie beispielsweise Ultraschallbehandlung. Die Verwendung der Kugel Mixer war notwendig, um die Extraktion Ausbeuten erzielen durchweg über 90%. Zuverlässigkeit des Extraktionsverfahrens war es auch wichtig, um sicherzustellen, dass alle Zentrifugen TEMPERATure gesteuert (4 ° C) und daß das Verwirbeln Schritt war nicht kürzer als 10 min, die in variabler und unteren Extraktions Ausbeuten geführt. Darüber hinaus ist es wichtig, daß das Methanol / ZnSO 4-Verhältnis nicht verändert wird, wie Tacrolimus Rückgewinnung ist sehr empfindlich auf die richtige Zusammensetzung des Proteinfällungslösung.
Die nächste Herausforderung ist es, eine saubere Extrakt idealerweise frei von Materialien, die Matrix-Interferenzen und Wirkungen verursachen kann zu erhalten. Auf diese Weise wurde ein einfaches Ein-Schritt-Protein-Fällungsschritt so oft zur Gewinnung von Tacrolimus aus EDTA-Blutproben nicht als eine praktikable Option. Nach der Proteinfällung mit ZnSO 4 (einschließlich der Zugabe eines isotopenmarkierten internen Standards), Vortexen und Zentrifugieren wurden die Überstände in eine 2D-HPLC-System und auf einer Online-Extraktionskolonne eingespritzt. Online Spaltenextraktion unter Verwendung hoher Ströme von 5 ml / min auf herkömmlichen Vorsäule Patronen mit Hilfe eines einfachen 6-fachSchaltventil für die Analyse von Tacrolimus vor der 47 beschrieben worden. Die mobile Phase wurde so gewählt, dass Tacrolimus und seine internen Standards in der vor dem Extraktionskolonne konzentriert und nicht über die Säule während des Aufräumsegments zu migrieren. Die Online-Extraktion in dem vorliegenden Protokoll hat mehrere Vorteile einschließlich der Injektion von relativ großen Probenvolumina ohne HPLC-Analyse negativ zu beeinflussen. Die Rückspülung nach der Anreicherung der Analyten auf der Oberseite der Extraktionskolonne ("peak Fokussierung") führten zu schärferen Peaks und so für mehr zuverlässige Integration der Software-Algorithmus besonders für Proben mit niedriger Tacrolimus-Konzentrationen. 48 Die Online-Bereinigung Schritt nicht nur entfernen, potenziell störende Matrixverbindungen, aber auch entsalzt die Probe. Eine wichtige aber selten diskutierte Problem für hochvolumige Hochdurch LC-MS / MS-Assays ist der allmähliche Verlust der Empfindlichkeit der LC-MS / MS-System aufgrund der zunehmendenVerunreinigung der Elektrospray-Quelle während der Analyse von großen Chargen. Keine signifikanten Matrixeffekte (Ionensuppression / Ionen-Enhancement) beobachtet. Der negative Effekt der potentiellen Matrixeffekte wurden durch Kombination von reduziertem / vermeiden die folgenden: effektive Proteinfällung unter Verwendung von Methanol / ZnSO4, Zentrifugation nach Proteinfällung bei 16.000 · g, High-Flow Online-Extraktion, klare chromatographische Trennung von Tacrolimus vor möglichen Störungen früh eluierenden aus der analytischen Säule und die Verwendung von isotopenmarkierten Tacrolimus als interner Standard anstelle von strukturell verwandten internen Standards wie Ascomycin.
Die untere Grenze der Quantifizierung wurde 1 ng / ml und somit niedriger als die der meisten Immunoassays, die derzeit häufig für therapeutische Überwachung der Tacrolimus in EDTA-Blutproben verwendet. Diese untere Bestimmungsgrenze ist ausreichend, auch bei so genannten Low Calcineurin-Inhibitor langfristige immunosuppressive Wartungsprotokolle.
Im Vergleich zu den zuvor beschriebenen LC-MS / MS-Assays auf Tacrolimus in getrockneten Blutflecken zu quantifizieren 29-34,36,39,41,42 die vorliegenden Testspielen oder in Bezug auf die untere Grenze der Quantifizierung, Extraktion Erholung, Genauigkeit übertrifft ihre Leistung und Präzision bei gleichzeitiger Vermeidung potenziell riskante Konzepte wie Ein-Schritt-Protein-Fällungsverfahren und Ultrakurz Chromatographie Zeiten, die in der Regel geben akzeptable Ergebnisse bei der Validierung auf Basis von Blutproben von gesunden Personen. Allerdings Transplantationspatienten sind eine sehr komplexe Gruppe von Patienten, die Krankheiten, die die Zusammensetzung des Blutes auswirken und die mehrere Medikamente einnehmen müssen. Dies macht es praktisch unmöglich, alle möglichen Störungen, die bei der Validierung bei einzelnen Patienten vorhanden sein können, und die einzige praktikable Strategie ist es, den Test in einer Weise, dass es das Risiko eines solchen potenziellen Interferenzen minimiert Einrichtung auszuschließen. Getrocknetes Blut spots haben Probleme wie die Wirkung des Hämatokrit auf die Viskosität des Blutes und damit die Diffusionseigenschaften der auf Filterpapier 49 aufgebracht Blut. Dies wurde hier nicht noch einmal getestet, wie solche Effekte wurden bereits beschrieben nicht auf Tacrolimus-Analyse in getrockneten Blutflecken am Hämatokrit und Tacrolimus-Konzentrationen im klinisch vernünftigen Grenzen 29,32 beeinflussen. Auch die Stabilität von Tacrolimus in getrockneten Blutflecken bei erhöhten Temperaturen wurde bereits von anderen und Tacrolimus in getrockneten Blutflecken untersucht wurde festgestellt, dass stabile 5 Tage lang bei 37 ° C und sogar 60 ° C 32, das ist wichtig für den Versand von getrocknetem Blut ist Flecken unter nicht temperaturgesteuerten Bedingungen vor allem im Sommer.
Dieser Test basiert auf einer Kombination von Bullet Mixer Homogenisierung kann High-Flow-Online Spalte Bereinigung und LC-MS / MS-Analyse einer Plattform-Strategie für die Entwicklung von bioanalytischen Assays zur Quantifizierung von anderen imm liefernunosuppressants allein oder gleichzeitigen, als auch von anderen Drogen in Trockenblut-Proben.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by the United States Federal Drug Administration (FDA) contract HHSF223201310224C and the United States National Institutes of Health/FDA grant 1U01FD004573-01.
Materialien
| Name | Company | Catalog Number | Comments |
| Tacrolimus | U.S. Pharmacopeial Convention | 1642802 | |
| D2,13C-Tacrolimus | Toronto Research Chemicals Inc. | F370002 | |
| Red blood cells | University of Colorado Hospital | W20091305500 V | |
| Plasma | University of Colorado Hospital | W2017130556300Q | |
| Acetone CHROMASOLV, HPLC, ≥99,9% | Sigma-Aldrich | 439126-4 L | |
| Acetonitrile Optima LC/MS, UHPLC-UV | Thermo Fisher Scientific | A955-4 | |
| Isopropanol 99.9%, HPLC | Fisher Scientific | BP2632-4 | |
| Methanol Optima LC/MS | Thermo Fisher Scientific | A452-4 | |
| Water Optima LC/MS, UHPLC-UV | Thermo Fisher Scientific | W6-4 | |
| Formic acid | Thermo Fisher Scientific | A118P-500 | |
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | D8537 | |
| Zinc sulfate | Thermo Fisher Scientific | Z68-500 | |
| 0.5 – 10 µl pipet, VoluMate LIQUISYSTEMS | Mettler Toledo | 17008649 | |
| 1.5 ml Eppendorf tube | Thermo Fisher Scientific | 02-682-550 | |
| 10 – 100 µl pipet, VoluMate LIQUISYSTEMS | Mettler Toledo | 17008651 | |
| 10 μl pipet tips with filter, sterile | Neptune | BT 10XLS3 | |
| 100 – 1,000 µl pipet, VoluMate LIQUISYSTEMS | Mettler Toledo | 17008653 | |
| 100 μl pipet tips with filter, sterile | Neptune | BT 100 | |
| 1,000 μl pipet tips with filter, sterile | Multimax | 2940 | |
| 2 – 20 µl pipet, VoluMate LIQUISYSTEMS | Mettler Toledo | 17008650 | |
| 2 ml Eppendorf tube | Thermo Fisher Scientific | 02-681-258 | |
| 20 – 200 µl pipet, VoluMate LIQUISYSTEMS | Mettler Toledo | 17008652 | |
| 20 μl pipet tips with filter, sterile | GeneMate | P-1237-20 | |
| 200 μl pipet tips with filter | Multimax | 2938T | |
| 200 μl pipet tips with filter, sterile | Multimax | 2936J | |
| 50 ml Falcon tube | BD Falcon | 352070 | |
| 300 μl inserts for HPLC vials | Phenomenex | ARO-9973-13 | |
| Balance PR2002 | Mettler Toledo | 1117050723 | |
| Balances AX205 Delta Range | Mettler Toledo | 1119343379 | |
| Bullet Blender Homogenizer | Next Advance | BBX24 | |
| Centrifuge Biofuge Fresco | Heraeus | 290395 | |
| Disposable Wipes | PDI | Q55172 | |
| Glass v ials, 4 ml | Thermo Fisher Scientific | 14-955-334 | |
| Glass vials, 20 ml | Thermo Fisher Scientific | B7800-20 | |
| Gloves, nitrile | Titan Brand Gloves | 44-100S | |
| HPLC vials, 9 mm, 2 ml, clear | Phenomenex | ARO- 9921-13 | |
| Lids for HPLC vials | Phenomenex | ARO- 8952-13-B | |
| Needle, 18 G 1.5 | Precision Glide | 305196 | |
| Rack for Eppendorf tubes | Thermo Fisher Scientific | 03-448-11 | |
| Rack for HPLC Vials | Thermo Fisher Scientific | 05-541-29 | |
| Steel beads 0.9 – 2 mm | Next Advance | SSB14B | |
| Storage boxes for freezers / refrigerators | Thermo Fisher Scientific | 03-395-464 | |
| Standard multi-tube vortexer | VWR Scientific Products | 658816-115 | |
| Whatman Paper, 903 Protein Saver US 100/PK | GE Whatman | 2016-05 | |
| Autosampler | CTC PAL | PAL.HTCABIx1 | |
| Binary pump, Agilent 1260 Infinity | Agilent Technologies | 1260 G1312B | |
| Binary pump, Agilent 1290 Infinity | Agilent Technologies | 1290 G4220A | |
| Micro vacuum degasser, Agilent 1260 | Agilent Technologies | 1260 G13798 | |
| Column oven, Agilent 1290 with 2 position | Agilent Technologies | 1290 G1216C | |
| Thermostated column compartment with integrated 6 port switching valve | Agilent Technologies | 1290 G1316C | |
| HPLC pre-column cartridge, Zorbax XDB C8 (5 µm particle size), 4.6 · 12.5 mm | Phenomenex | 820950-926 | |
| HPLC analytical column, Zorbax Eclipse-XDB-C8 (5 µm particle size), 4.6 · 150 mm | Phenomenex | 993967-906 | |
| Tandem Mass Spectrometer | |||
| API5000 MS/MS with TurboIonspray source | AB Sciex | 4364257 | |
| Mass spectrometry software | AB Sciex | Analyst 1.5.1 |
Referenzen
- Goto, T., et al. Discovery of FK506, a novel immunosuppressant isolated from Streptomyces Tsukubaensis. Transplant Proc. 19 (5 Suppl 6), 4-8 (1987).
- Kino, T., Hatanaka, H., Miyata, S. FK506, a novel immunosuppressant isolated from a streptomyces. I: Fermentation, isolation and physico-chemical and biological characteristics. J. Antibiotics. 40 (9), 1249-1255 (1987).
- Starzl, T. E., et al. FK506 for liver, kidney and pancreas transplantation. Lancet. 2 (8670), 1000-1004 (1989).
- . Randomised trial comparing tacrolimus (FK506) and cyclosporin in prevention of liver allograft rejection. European FK506 Multicentre Liver Study Group. Lancet. 344 (8920), 423-428 (1994).
- . A comparison of tacrolimus (FK 506) and cyclosporine for immunosuppression in liver transplantation. The U.S. Multicenter FK506 Liver Study Group. N. Engl. J. Med. 331 (17), 1110-1115 (1994).
- Mayer, A. D., et al. Multicenter randomized trial comparing tacrolimus (FK506) and cyclosporine in the prevention of renal allograft rejection: a report of the European Tacrolimus Multicenter Renal Study Group. Transplantation. 64 (3), 436-443 (1997).
- Pirsch, J. D., Miller, J., Deierhoi, M. H., Vincenti, F., Filo, R. S. A comparison of tacrolimus (FK506) and cyclosporine for immunosuppression after cadaveric renal transplantation. FK506 Kidney Transplant Study Group.. Transplantation. 15 (7), 977-983 (1997).
- Tanaka, H., et al. Physicochemical properties of FK506 a novel immunosuppressant isolated from Streptomyces Tsukubaensis. Transplant Proc. 14 ((5 Suppl 6)), 11-16 (1987).
- Spencer, C. M., Goa, K. L., Gills, J. C. Tacrolimus. An update of its pharmacology and clinical efficacy in the management of organ transplantation. Drugs. 54 (6), 925-975 (1997).
- Clipstone, N. A., Crabtree, G. R. Identification of calcineurin as a key signalling enzyme in T-lymphocyte activation. Nature. 357 (6380), 695-697 (1992).
- Barbarino, J. M., Staatz, C. E., Venkataramanan, R., Klein, T. E., Altman, R. B. PharmGKB summary: cyclosporine and tacrolimus pathways. Pharmacogenet. Genomics. 23 (10), 563-585 (2013).
- Christians, U., Benet, L. Z., Lampen, A. Mechanisms of clinically significant drug interactions associated with tacrolimus. Clin. Pharmacokinet. 41 (11), 813-851 (2002).
- Christians, U., Pokaiyavananichkul, T., Chan, L., Burton, M. E., Shaw, L. M., Schentag, J. J., Evans, W. e. b. b. Tacrolimus In: Pharmacokinetics and Pharmacodynamics. Principles of Therapeutic Drug Monitoring. , 529-562 (2005).
- Holt, D. W., et al. International Federation of Clinical Chemistry/ International Association of Therapeutic Drug Monitoring and Clinical Toxicology working group on immunosuppressive drug monitoring. Ther. Drug Monit. 24 (1), 59-67 (2002).
- Holt, D. W., Jones, K., Lee, T., Stadler, P., Johnston, A. Quality assessment issues of new immunosuppressive drugs and experimental experience. Ther. Drug Monit. 18 (4), 362-367 (1996).
- Jusko, W. J., et al. Consensus document: therapeutic drug monitoring of tacrolimus (FK-506). Ther. Drug Monit. 17 (6), 606-614 (1995).
- Oellerich, M., et al. Therapeutic drug monitoring of cyclosporine and tacrolimus. Update on Lake Louise Conference on cyclosporine and tacrolimus. Clin. Biochem. 31 (5), 309-316 (1998).
- Wong, S. H. Therapeutic drug monitoring for immunosuppressants. Clin. Chim. Acta. 313 (1-2), 241-253 (2001).
- Kahan, B. D., et al. Low intraindividual variability of cyclosporin A exposure reduces chronic rejection incidence and health care costs. J. Am. Soc. Nephrol. 11 (6), 1122-1131 (2000).
- Kahan, B. D., et al. Variable oral absorption of cyclosporine. A biopharmaceutical risk factor for chronic renal allograft rejection. Transplantation. 62 (5), 599-606 (1996).
- Kelly, D. A. Current issues in pediatric transplantation. Pediatr. Transplant. 10 (6), 712-720 (2006).
- Spivey, C. A., Chisholm-Burns, M. A., Damadzadeh, B., Billheimer, D. Determining the effect of immunosuppressant adherence on graft failure risk among renal transplant recipients. Clin. Transplant. 28 (1), 96-104 (2014).
- Taylor, P. J., Tai, C. H., Franklin, M. E., Pillans, P. I. The current role of liquid chromatography-tandem mass spectrometry in therapeutic drug monitoring of immunosuppressant and antiretroviral drugs. Clin. Biochem. 44 (1), 14-20 (2011).
- Edelbroek, P. M., van der Heijden, J., Stolk, L. M. Dried blood spot methods in therapeutic drug monitoring: methods, assays, and pitfalls. Ther. Drug Monit. 31 (3), 327-336 (2009).
- Meesters, R. J., Hooff, G. P. State-of-the-art dried blood spot analysis: an overview of recent advances and future trends. Bioanalysis. 5 (17), 2187-2208 (2013).
- Pandya, H. C., Spooner, N., Mulla, H. Dried blood spots, pharmacokinetic studies and better medicines for children. Bioanalysis. 3 (7), 779-786 (2011).
- Koster, R. A., Alffenaar, J. W., Greijdanus, B., Uges, D. R. Fast LC-MS/MS analysis of tacrolimus, sirolimus, everolimus and cyclosporin A in dried blood spots and the influence of the hematocrit and immunosuppressant concentration on recovery. Talanta. 115 (Oct 15), 47-54 (2013).
- Hinchliffe, E., Adaway, J., Fildes, J., Rowan, A., Keevil, B. G. Therapeutic drug monitoring of ciclosporin A and tacrolimus in heart lung transplant patients using dried blood spots. Ann Clin. Biochem. 51 (Pt 1), 106-109 (2014).
- Koop, D. R., Bleyle, L. A., Munar, M., Cherala, G., Al-Uzri, A. Analysis of tacrolimus and creatinine from a single dried blood spot using liquid chromatography tandem mass spectrometry. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci.. 926 ((May 1)), 54-61 (2013).
- Sadilkova, K., Busby, B., Dickerson, J. A., Rutledge, J. C., Jack, R. M. Clinical validation and implementation of a multiplexed immunosuppressant assay in dried blood spots by LC-MS/MS. Clin. Chim. Acta.. 421 ((Jun 5)), 152-156 (2013).
- Li, Q., Cao, D., Huang, Y., Xu, H., Yu, C., Li, Z. Development and validation of a sensitive LC-MS/MS method for determination of tacrolimus on dried blood spots. Biomed. Chromatogr. 27 (3), 327-334 (2013).
- Hinchliffe, E., Adaway, J. E., Keevil, B. G. Simultaneous measurement of cyclosporin A and tacrolimus from dried blood spots by ultra-high performance liquid chromatography tandem mass spectrometry. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci.. 883-884 ((Feb 1)), 102-107 (2012).
- Webb, N. J., Roberts, D., Preziosi, R., Keevil, B. G. Fingerprick blood samples can be used to accurately measure tacrolimus levels by tandem mass spectrometry). Pediatr. Transplant. 9 (6), 729-733 (2005).
- Keevil, B. G., Fildes, J., Baynes, A., Yonan, N. Liquid chromatography-mass spectrometry measurement of tacrolimus in finger-prick samples compared with venous whole blood samples. Ann. Clin. Biochem. 46 (Pt 2), 144-145 (2009).
- Yonan, N., Martyszczuk, R., Machaal, A., Baynes, A., Keevil, B. G. Monitoring of cyclosporine levels in transplant recipients using self-administered fingerprick sampling. Clin. Transpl. 20 (2), 221-225 (2006).
- Keevil, B. G., et al. Simultaneous and rapid analysis of cyclosporin A and creatinine in finger prick blood samples using liquid chromatography tandem mass spectrometry and its application in C2 monitoring. Ther Drug Monit. 24 (6), 757-767 (2002).
- Hoogtanders, K., et al. Dried blood spot measurement of tacrolimus is promising for patient monitoring. Transplantation. 83 (2), 237-238 (2007).
- Heijden, J., et al. Therapeutic drug monitoring of everolimus using the dried blood spot method in combination with liquid chromatography-mass spectrometry. J. Pharm. Biomed. Anal. 50 (4), 664-670 (2009).
- Cheung, C. Y., et al. Dried blood spot measurement: application in tacrolimus monitoring using limited sampling strategy and abbreviated AUC estimation. Transpl. Int. 21 (2), 140-145 (2008).
- Hoogtanders, K., et al. Therapeutic drug monitoring of tacrolimus with the dried blood spot method. J. Pharm. Biomed. Anal. 44 (3), 658-664 (2007).
- Wilhelm, A. J., den Burger, C. J., Vos, R. M., Chahbouni, A., Sinjewel, A. Analysis of cyclosporin A in dried blood spots using liquid chromatography tandem mass spectrometry. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 877 (14-15), 1595-1598 (2009).
- Ostler, M. W., Porter, J. H., Buxton, M. O. Dried blood spot collection of health biomarkers to maximize participation in population studies. J. Vis. Exp. (83), e50973 (2014).
- Schäfer, P., Störtzel, M., Vogt, S., Weinmann, W. Ion suppression effects in liquid chromatography-electrospray-ionisation transport-region collision induced dissociation mass spectrometry with different serum extraction methods for systematic toxicological analysis with mass spectra libraries. J. Chromatogr. B. 773 (1), 47-52 (2002).
- Peck, H. R., Timko, D. M., Landmark, J. D., Stickle, D. F. A survey of apparent blood volumes and sample geometries among filter paper bloodspot samples submitted for lead screening. Clin. Chim. Acta. 400 (1-2), 103-106 (2009).
- Christians, U., et al. Automated, fast and sensitive quantification of drugs in blood by liquid chromatography-mass spectrometry with on-line extraction: immunosuppressants. J. Chromatogr. B. 748 (1), 41-53 (2000).
- Clavijo, C., et al. Development and validation of a semi-automated assay for the highly sensitive quantification of Biolimus A9 in human whole blood using high performance liquid chromatography-tandem mass spectrometry. J. Chromatogr. B. Analyt. Technol. Biomed. Life Sci. 877 (29), 3506-3514 (2009).
- Mei, J. V., Alexander, J. R., Adam, B. W., Hannon, W. H. Use of filter paper for the collection and analysis of human whole blood specimens. J. Nutr. 131 (5), S1631-S1636 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten