Method Article
Methoden für die quantitative Bestimmung von Antikörper-induzierte Komplementaktivierung auf Red Blood Cells
In diesem Artikel
Zusammenfassung
Hier beschreiben wir zwei Assays zur Messung von Komplement-Aktivierung durch Antikörper gegen rote Blutzellen induziert. Der große Vorteil gegenüber den aktuellen Untersuchungen ist die quantitative und einfach zu interpretieren Natur.
Zusammenfassung
Antikörper gegen rote Blutkörperchen (Erythrozyten) kann dazu führen, Aktivierung, was zu einer beschleunigten Genehmigungs über Komplement-Rezeptoren in der Leber (extravaskulären Hämolyse) oder die zu intravaskulären Lyse von Erythrozyten zu ergänzen. Alloantikörper (zB ABO) oder Autoantikörper gegen RBC-Antigene (wie in der Autoimmun-hämolytische Anämie, AIHA zu sehen), die zur Aktivierung ergänzen sind potenziell schädlich und kann - vor allem, wenn die zu intravaskulären Lyse - tödlichen ein. Derzeit Komplement-Aktivierung durch (auto)-Antikörpern auf Erythrozyten in vitro mit Hilfe der Coombs-Test reflektierende Ergänzung Abscheidung auf RBC oder durch eine nicht-quantitative Assay hämolytische reflektieren RBC Lyse 1-4 bewertet. Um jedoch die Wirksamkeit von Inhibitoren Ergänzung zu bewerten, ist es zwingend erforderlich, um quantitative Techniken haben. Hier beschreiben wir zwei solche Techniken. Zuerst wird ein Test zur C3 und C4 Abscheidung auf rote Blutzellen, die von Antikörpern in Patientenserum induziert wird erkennen vorgepräsentierte. Hierzu ist die FACS-Analyse mit Fluoreszenz-markierten anti-C3-oder Anti-C4 Antikörper verwendet. Als nächstes wird eine quantitative hämolytischen Assay beschrieben. In diesem Assay Komplement-vermittelte Hämolyse von Patientenserum induziert ist die Nutzung der spektrophotometrischen Nachweis des freigesetzten Hämoglobins gemessen. Diese beiden Tests sind sehr reproduzierbare und quantitative erleichtert Untersuchungen der Antikörper-induzierten Komplementaktivierung.
Einleitung
Antikörper gegen rote Blutkörperchen (Erythrozyten) durch Transfusion von roten Blutkörperchen, die ein Antigen, das nicht auf Empfänger RBCs vorhanden ist exprimieren, induziert werden. Diese Allo-Antikörper können schwere akute hämolytische Transfusionsreaktionen aufgrund der Aktivierung auf die nach der Transfusion 5 ergänzen verursachen. In Auto-Immun-hämolytische Anämie (AIHA) haben die Patienten Auto-Antikörper gegen ihre eigenen roten Blutkörperchen. Dies führt zu einer beschleunigten Clearance der Zellen durch die Interaktion von IgG mit Fc &ggr; RBC-Rezeptoren auf Phagocyten in der Milz und / oder im Falle von Autoantikörpern in der Lage, mittels Komplement-Komplement-Rezeptoren in der Leber 6,7 aktivieren gebunden. Fulminante Komplement-Aktivierung intravaskulären Hämolyse was ist selten, aber oft tödlich. Beschleunigte ergänzen vermittelten RBC Zerstörung entweder durch Allo-oder Autoantikörpern führt zu akuter Anämie und damit potenziell tödlichen Hypoxie induziert. Die Autoantikörper in AIHA sind in warmen und kalten Antikörper eingestuft, dependinG auf der optimalen Temperatur sie Erythrozyten (37 ° C oder geringer) zu binden. Die warmen Antikörper sind in der Regel von IgG-Isotyp und die kalten Antikörper vom IgM-Isotyp 8,9. AIHA kann sekundär zB lymphoprolyferative Erkrankungen, Bindegewebserkrankungen, soliden Tumoren, Infektionen oder Medikamente sein, aber in 50% der Fälle ist idiopathischen AIHA 9.
Detektion Gammaglobuline (zB. IgG oder IgM) und Komplement gebunden Patienten RBCs mittels einer semiquantitativen direkten Antiglobulin (Coombs)-Test (DAT) durchgeführt. In dem DAT-Patienten RBCs mit Anti-IgG-oder Anti-C3d inkubiert. Das Auftreten von RBC Agglutination zeigt die Anwesenheit von Komplement-Komponenten befestigt oder IgG-Bindung. Nachweis von Allo-oder Autoantikörpern im Serum des Patienten wird mittels der indirekten Antiglobulintest (IAT) durchgeführt. In der IAT werden Bromelain behandelten Test RBCs mit Patientenserum inkubiert, gewaschen und dann mit anti-h inkubiertuman IgG. Im Falle haben RBCs mit Anti-RBC-IgG, die in dem Patientenserum Agglutination auftritt sensibilisiert. IgM-Antikörper gegen Erythrozyten wird direkt an Agglutination nach der Inkubation von Bromelain-behandelten Test Erythrozyten mit Patientenserum führen. RBC Agglutination in der direkten Coombs-Test oder im IAT wird optisch entweder mit dem Auge in einem Reagenzglas oder durch das Laden der Probe auf einer kleinen Sephadexsäule Trennung agglutinierten Erythrozyten-und Einzel nach Größe 1 bewertet.
Ein anderes häufig verwendetes Verfahren zur Komplementaktivierung auf RBCs messen, ist der hämolytischen Assay 1, bei dem die Kapazität von Patientenserum (Komplement-vermittelte) Hämolyse von Bromelain behandelten RBC 10 zu induzieren, beurteilt. Der Test wird als positiv festgestellt, wenn der Überstand nach dem Zentrifugieren wird rot wegen freigesetzte Hämoglobin gefärbt und als negativ zu sein, wenn es farblos bleibt. Sowohl das Coombs-Test und der Test sind hämolytische semiquantitative, da die höchste serum Verdünnung bezeichnet, in dem der Test ist immer noch positiv.
Der Coombs-Test und dem hämolytisch-Assay sind robust Tests, die routinemäßig in der Diagnostik eingesetzt werden. Da diese Tests sind semiquantitative und abhängig von der Erfahrung des Technikers Durchführung des Assays sie geeignet ist, subtile Unterschiede der Komplementaktivierung auf Erythrozyten zu untersuchen sind nicht, wie erforderlich, wenn die Bewertung der Wirksamkeit von Komplement-Inhibitoren. Daher entwickelten wir zwei quantitative Tests, um die Komplement-Aktivierung von (Auto-) Antikörper gegen Erythrozyten, die wir in diesem Papier beschreiben, zu bestimmen.
Zuerst wird ein Test, um die Ablagerung von Komplement-Aktivierung Fragmente C3 und C4 auf RBCs (1A) messen wir entwickelt. In diesem Test werden menschliche Bromelain behandelten Typ 0 RBCs mit hitzeinaktiviertem Patientenserum (anti-RBC Antikörper Quelle), frisch AB-Serum (Komplement-Quelle) und Anti-C5-Antikörper (Eculizumab) inkubiert. Während dieser inc.ubation wird C3 und C4 Abscheidung auftreten, wenn das Patientenserum enthält ergänzen Aktivierung anti-RBC Antikörper. Um RBC Lyse durch nachgeschaltete Komplementaktivierung verhindern eine Sperr Anti-C5-monoklonaler Antikörper wird hinzugefügt. Als nächstes wird C3 und C4 Abscheidung auf der RBCs durch FACS unter Verwendung von Fluoreszenz-markierten monoklonalen Antikörpern oder Fab-Fragmenten Umsetzung mit C3 und C4, die jeweils detektiert. Gating auf einzelne Erythrozyten ist wichtig, um die Zuverlässigkeit der Ergebnisse zu gewährleisten. Vorteile dieses Verfahrens beinhalten, dass ein kleines Volumen des Patientenmaterials erforderlich ist, Komplementaktivierung in einer frühen Stufe der Kaskade bewertet wird und das Verfahren ist reproduzierbar und quantitativ. Ein weiterer Vorteil der Blick auf beide C3 und C4 ist, dass eine Unterscheidung zwischen der klassischen und Lektin-Weg-Aktivierung (sowohl C3-und C4-Deposition) und den alternativen Weg der Aktivierung (nur C3 Deposition) hergestellt werden. Die Verwendung von Bromelain behandelten Erythrozyten statt unbehandelten roten Blutkörperchen erhöht die Empfindlichkeit der alszu sagen.
Der zweite Test basiert auf der gegenwärtig verwendeten hämolytischen Assay (Fig. 1B) auf. Menschen Bromelain-behandelten Typ-0-Erythrozyten werden mit Hitze-inaktiviertem Patientenserum (anti-RBC Antikörper-Quelle) und frischem AB-Serum (Komplement-Quelle) inkubiert. Wenn Komplement von Patienten anti-RBC-Antikörper aktiviert, wird eine dosisabhängige RBC-Lyse auftreten, was zu der Hämoglobin freizusetzen. Die Menge an freigesetztem Hämoglobin wird durch Messen seiner Absorption bei 414 nm im Überstand nach Abzentrifugieren der intakten und fragmentierten Erythrozyten quantifiziert. Die Extinktion korreliert mit der Menge der Hämolyse aufgetreten. Im Gegensatz zu den derzeit verwendeten Assay erlaubt eine objektive, quantitative Wert der Hämolyse, die sehr gut reproduzierbar und unabhängig von der Person, die Interpretation des Assays ist das Protokoll.
Eine Anwendung dieser Methoden ist in 11, wobei die mögliche Verwendung von C1-Inhibitor als Komplement-Inhibitor in AIHA war s beschriebentudied.
Protokoll
1. Herstellung von Bromelain-behandelten roten Blutzellen
- Waschen 0 typisierte roten Blutkörperchen 3x mit 1x PBS (Zentrifugation bei 664 g für 2-5 min).
- Inkubieren 1 Volumen Erythrozytenkonzentrat mit zwei Volumina einer 0,5% Bromelain Lösung für 10 min bei 37 ° C.
- Waschen Sie die Zellen 3x mit 1x PBS.
- Die Zellen können als eine 3% ige Lösung bei 4 ° C in 1 × PBS für mindestens eine Woche gelagert werden.
2. C3 und C4 Deposition Analyse auf RBCs durch FACS
- Wärme-Inaktivierung die erforderliche Menge an Patientenserum (oder andere anti-RBC Antikörper Quelle) durch Erhitzen der Probe für 30 min bei 56 ° C.
- Dreimal waschen Bromelain behandelten Erythrozyten in VBG - (5 mM Veronal, 150 mM NaCl, 0,05% Gelatine, pH 7,4) und resuspendieren sie in VBG + + (VBG - + 2 mM MgCl 2 + 10 mM CaCl 2), um ein zu geben 0,5% igen Lösung.
- Pipettieren Sie die folgenden Komponenten in einem Rundbodenplatte mit einer Glasperle (foder richtige Mischung): 25 ul 0,5% Erythrozyten, 37,5 ul frisch AB-Serum (Komplement-Quelle) und 37,5 ul 200 ug / ml anti-C5. Anti-C5 ist teuer und vielleicht schwer zu bekommen sein. Man könnte überlegen, C5-/C6-/C7- oder C8-defizienten Serum anstelle von AB-Serum und Anti-C5.
- Hinzufügen Patientenserum pro Vertiefung bis zu einer Endkonzentration von 0,1 bis 33%. Richtige für Unterschiede in der Serumkonzentration pro Vertiefung durch Verwendung von hitzeinaktiviertem AB-Serum. In VBG + +, um eine endgültige Volumen von 150 ul / gut. Schließen ELISA-Platte mit Folie.
- Inkubieren 1,5-2 h bei 37 ° C unter Schütteln.
- Die Erythrozyten dreimal mit PBS + 0,5% BSA (Zentrifugation bei 664 × g für 2 min) waschen.
- Hinzufügen fluoreszenzmarkierten anti-C3 und C4 monoklonalen anti-Antikörper oder deren Fab-Fragmente in PBS + 0,5% BSA bis zu einer Endkonzentration von 1 ug / ml (um die Agglutination zu verringern). Hier speziell entwickelte Anti-C3-Alexa Fluor 488 und Anti-C4-Alexa Fluor 647 monoklonale Antikörper verwendet werden, die Wahl der these fluoreszierenden Markierungen erlaubt die gleichzeitige Detektion von C3 und C4 durch FACS.
- Inkubiere 30-45 Minuten bei Raumtemperatur unter leichtem Schütteln inkubiert.
- Wash Erythrozyten 3x mit PBS + 0,5% BSA.
- Resuspendieren RBC 150 ul in PBS + 0,5% BSA und pipettieren sie in eine neue Platte (auf der Glasperlen loswerden, bevor FACS Analyse).
- FACS-Analyse durchführen. Separate Einzelzellen von Dubletten in einem Streu Plotten FSC-A; setzen das Tor zu den einzelnen Erythrozyten, wählen Sie die entsprechende Detektionskanal für die Fluoreszenz-Signale (z. B. FITC und APC).
- Quantifizieren Ergebnisse mit dem Median der Fluoreszenzintensität.
Hinweis: Es ist möglich, eine Isotyp-Kontrolle (zB Fluoreszenz-markierten anti-IL-6-Maus-IgG1) zu verwenden. Es wird jedoch empfohlen, um eine echte Negativkontrolle zB durch Inkubation von Erythrozyten ohne Patientenserum (nur AB-Serum) oder ohne Ergänzung Quelle (hitzeinaktiviertem AB-Serum und Hitze-inaktiviertes Patientenserum) gehören, eind dann färben diese mit der gleichen anti-C3-Alexa Fluor 488 und Anti-C4-Alexa Fluor 647-Antikörper. Dies ergibt eine weitere gültige Steuer als eine Isotyp-Kontrolle im Falle der roten Blutzellen 12, wobei diese verschiedenen Steuerungen geben typischerweise die gleichen, negativen Ergebnis.
3. Quantitative hämolytisch-Assay
- Wärme-Inaktivierung die erforderliche Menge von Patientenseren (oder andere anti-RBC Antikörper Quelle) durch Erhitzen der Probe 30 min bei 56 ° C.
- Wash Erythrozyten 3x VBG - und einmal mit VBG + +.
- Pipettieren Sie die folgenden Komponenten in einem Rundbodenplatte mit einer Glasperle (für die richtige Durchmischung): 35 ul 3% Erythrozyten, 25 ul frisch AB-Serum (Komplement-Quelle) und 1-50% Patientenserum. Richtige für Unterschiede im Serum-Konzentration mit hitzeinaktiviertem AB-Serum. In VBG + +, um eine endgültige Volumen von 150 ul / gut. Schließen ELISA-Platte mit Folie.
- Bei 37 ° C für 1,5 bis 2 h mit Schütteln.
- Centrifuge Platte bei 664 × g für 5 min mit reduzierten Verzögerung (z. B. Verzögerung zu Punkt in 2-3 min).
- Vorsichtig pipettieren, 90 ul Überstand in eine neue Mikrotiterplatte. Es ist wichtig, in diesem Schritt, um Luftblasen zu verhindern und um zu verhindern, entlang intakten Zellen zu übernehmen.
- Messen Sie A414/690 in einem geeigneten Spektrophotometer.
- Ausdruck der Lyse in Prozent Lyse einer Probe RBCs mit reinem Wasser.
Ergebnisse
2A zeigt eine repräsentative Streudiagramm für Erythrozyten. FSC-A-Grundstück (P1) - Geeignet für Einzel Gating Erythrozyten in de FSC-W zu sehen. In der Regel rund 95% der roten Blutkörperchen, gehören zu dieser P1-Gate (Einzelzellen), aber wenn ein hoher Prozentsatz der Patientenserum verwendet wird, kann diese auf 70-80% sinken, vor allem, wenn anti-RBC IgM im Serum des Patienten vorhanden ist.
Repräsentative Ergebnisse für die Wirkung von Patientenserum auf AIHA C4 Abscheidung sind in Fig. 2B und C3 Abscheidung in Fig. 2C gezeigt. Wie in diesen Figuren zu sehen ist, führt weitere Patientenserum in mehreren Komplement-Abscheidung, wie zu erwarten wäre. Seltsamerweise tritt das Komplement Abscheidung in zwei verschiedene positive Spitzen. Dies ist wahrscheinlich nicht von Heterogenität in der RBC Population verursacht, da die roten Blutkörperchen aus einem einzigen Spender entnommen. Wir sind immer noch die Untersuchung der Ursache dieses Phänomens. Figuren 2D und 2E Demonstrationte der Reproduzierbarkeit der C4 (Fig. 2D) und C3 (Fig. 2E) Abscheidung Assays. Sie zeigen auch die großen Unterschiede in der Ergänzung Ablagekapazität der verschiedenen AIHA Patientenproben.
Ein repräsentatives Ergebnis des hämolytischen Assay mit einer AIHA Patientenserumprobe enthält, Auto-Antikörpern, um die RBCs in Figur 3A gesehen werden. Normalerweise wird eine Titration mit Serumprobe ergibt einen schönen, reproduzierbare Kurve. Patienten-Seren sind sehr unterschiedlich in Ergänzung Aktivieren Kapazität, also eine Titration von jedem Patientenserum durchzuführen. Proben ohne Patientenserum Regel geben einen Hintergrund um 10-15% aufgrund der Absorption durch die Serumprobe als Ergänzung Quelle verwendet. Daher sollte darauf geachtet werden, eine ausreichend hohe Patienten-Serum-Konzentration zu verwenden, um ein Signal, das im wesentlichen über diesem Hintergrund erhalten. Mit einer geeigneten Ergänzung Hemmer als Anti-C5, kann das hämolytisch-Signal weg wie in F gezeigt titriert werdenild 3B.
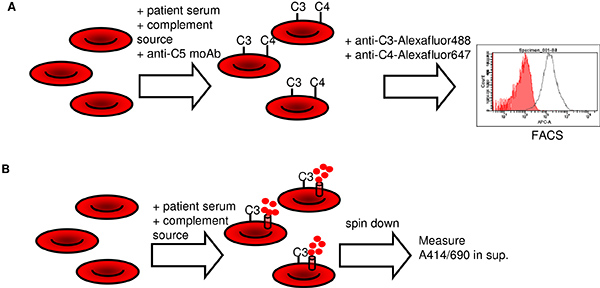
Fig. 1 ist. Schematische Übersicht über die C3-und C4-Abscheidungstest (A) und der quantitativen hämolytischen Assay (B). Kurz, in der C3-und C4-Abscheidung Assay ergänzen Abscheidung von AIHA Patientenserum induziert wird, gemessen wird, während im hämolytischen Assay Hämolyse AIHA durch Patientenserum erkannt wird induziert. Klicken Sie hier für eine größere Ansicht .

2. Repräsentative Ergebnisse für die C3-und C4-Abscheidung einssay. A) Empfohlene Gating-Strategie. Hier dargestellt ist, wie man nur für die einzelnen Erythrozyten (P1, rot) zu wählen. Die Agglutinaten sind grün (P2) gezeigt. B) Die Wirkung einer Titration von AIHA Patientenserum auf C4-Abscheidung. Die Isotyp-Kontrolle (anti-IL-6-Maus-IgG1) als feste grau dargestellt, während die Probe in schwarz dargestellt. Erhöhung der Menge an Patientenserum führt zu einer Erhöhung der Abscheidungs C4. C) Ähnlich wie b), jedoch nun mit Erkennung für C3-Abscheidung. D) C4 Abscheidung FACS Ergebnisse in einem Diagramm, das die Reproduzierbarkeit des Tests und zeigt die deutlichen Unterschiede dargestellt zwischen Serumproben von verschiedenen Patienten. Die Y-Achse repräsentiert die mittlere Fluoreszenzintensität. E) Ähnlich wie D), aber jetzt für C3-Abscheidung. Klicken Sie hier, umgrößeres Bild zu betrachten.

3. Repräsentative Ergebnisse für die quantitative hämolytisch-Assays. A) AIHA Patientenserum Titration im hämolytischen Test zeigt, dass die Lyse steigt reproduzierbar mit dem Patienten Serumkonzentration. Keine Lyse tritt bei gesunden Spenderserum (in orange; negative Kontrolle) b) ein geeignetes Komplement-Inhibitor (Anti-C5 in diesem Fall) können Komplement-vermittelte Lyse aufzuheben.. Dargestellt ist hier eine Titration von Anti-C5, während der AIHA Patientenserum wurde bei einer konstanten Konzentration gehalten. Klicken Sie hier für eine größere Ansicht .
Diskussion
Die obigen Tests sind reproduzierbar und stabil. Sie sind einfach durchzuführen und es ist möglich, sie mit vielen Proben gleichzeitig (in einer 96-well-Platte) durchzuführen. Daher würde dieser Ansatz auch für ein vollautomatisches System, z. B. eine ELISA-Robotersystem. Im Gegensatz zu den gegenwärtig verwendeten Techniken sind diese Assays quantitativ und dies wird in der Studie über die Wirkung von Komplement-Inhibitoren helfen zB. Außerdem ist die objektive Interpretation, welche eine Verbesserung gegenüber den derzeit verwendeten Assays.
Beide Tests haben ein entscheidender Schritt. Wichtig in der FACS-Analyse ist es, Tor auf die einzelnen roten Blutkörperchen, Erythrozyten, weil verklebt wird ein künstlich hohes Signal zu geben, da sie als ein Ereignis gezählt. Es ist sogar besser, Agglutination von Patienten mit niedrigen Serumkonzentrationen zu verhindern, da niedrige Konzentrationen zu noch gute Signale. In der hämolytischen Test, ist es wichtig, vorsichtig den Überstand einach Inkubation in einer neuen Platte, da Verschleppung von Erythrozyten führt zu einer unzuverlässigen Signal (wie Luftblasen) führen. Es wird empfohlen, 0 typisierte Erythrozyten in beiden Tests verwenden, um Verwechslungen mit AB0-Mismatch-Komplement-Aktivierung zu verhindern.
Aufgrund ihrer Robustheit und Zuverlässigkeit dieser Assays sind geeignet, um die Wirksamkeit von Komplement-Inhibitoren zur AIHA studieren, wie in 11 gezeigt, Bezug, um quantitativ feine Unterschiede in Komplement-Aktivierung festzustellen. Aufgrund ihrer Empfindlichkeit dieser Assays kann die Komplementaktivierung bei Patienten erkennen, wo Komplementaktivierung auf RBC wird nachdrücklich empfohlen, aber nicht durch den Routine-Assays, wie beispielsweise in Coombs-negative AIHA erkannt, wenn diese Anweisung Überprüfung erfordert immer noch. Sie können auch verwendet werden, um die Aktivierung Ergänzung Kapazität von Allo-Antikörpern (zB durch Bluttransfusionen oder in einem RhD induziert - Mutter trägt eine RhD + Kind) bestimmen, die die Kliniker, Vorhersage helfen könntet das klinische Verhalten eines detektierten Alloantikörper.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
SZ und DW erhalten eine zweckgebundene Zuwendung von Viropharma.
Materialien
| Name | Company | Catalog Number | Comments |
| PBS | Fresenius Kabi | ||
| BSA | Sigma | B-4287 | |
| Barbital | Fagron | 0261 | This chemical is subject to drug regulation. |
| Sodium Barbital | Fagron | 0263 | This chemical is subject to drug regulation. |
| Gelatin | Merck | 1.0470.0500 | |
| Sodium chloride | Merck | 1.06404.1000 | |
| Magnesium Chloride | Merck | 1.05833.0250 | |
| Calcium chloride | Merck | 1.0238.0500 | |
| Dylight 488 amine reactive dye | Pierce | 46402 | |
| Dylight 650 amine reactive dye | Pierce | 62265 | |
| αC5 (Eculizumab) | Alexion Pharmaceuticals | ||
| FACS (Canto) | BD | Any FACS can be used that has the appropiate lasers. | |
| Spectrophotometer (e.g. Multiskan spectrum) | Thermo Labsystems | 1500-193 | Any spectrophotometer with the right wavelength range can be used |
| BD FACSDiva software v 6.1.2 | BD | 643629 | Any compatible FACS analysis software can be used |
| Bromelain | Sanquin | K1121 |
Referenzen
- Zeerleder, S. Autoimmune haemolytic anaemia - a practical guide to cope with a diagnostic and therapeutic challenge. Neth. J. Med. 69 (4), 177-184 (2011).
- Reardon, J. E., Marques, M. B. Laboratory evaluation and transfusion support of patients with autoimmune hemolytic anemia. Am. J. Clin. Pathol. 125, 71-77 (2006).
- Lai, M., Leone, G., Landolfi, R. Autoimmune hemolytic anemia with gel-based immunohematology tests. Am. J. Clin. Pathol. 139 (4), 457-463 (2013).
- Zantek, N. D., Koepsell, S. A., Tharp Jr, ., R, D., Cohn, C. S. The direct antiglobulin test: A critical step in the evaluation of hemolysis. Am. J. Hematol. 87 (7), 707-709 (2012).
- Natukunda, B., Brand, A., Schonewille, H. Red blood cell alloimmunization from an African perspective. Curr. Opin. Hematol. 17 (6), 565-570 (2010).
- Packman, C. H. Hemolytic anemia due to warm autoantibodies. Blood Rev. 22 (1), 17-31 (2008).
- Berentsen, S., Tjønnfjord, G. E. Diagnosis and treatment of cold agglutinin mediated autoimmune hemolytic anemia. Blood Rev. 26 (3), 107-115 (2012).
- Petz, L. D. Cold antibody autoimmune hemolytic anemia. Blood Rev. 22 (1), 1-15 (2008).
- Barros, M. M. O., Blajchman, M. A., Bordin, J. O. Warm autoimmune hemolytic anemia: recent progress in understanding the immunobiology and the treatment. Transfus. Med. Rev. 24 (3), 195-210 (2010).
- Endoh, T., et al. Optimal prewarming conditions for Rh antibody testing. Transfusion. 46 (9), 1521-1525 (2006).
- Wouters, D., et al. C1-esterase inhibitor concentrate rescues erythrocytes from complement-mediated destruction in autoimmune hemolytic anemia. Blood. 121 (7), 1242-1244 (2013).
- Arndt, P. A., Garratty, G. A Critical Review of Published Methods for Analysis of Red Cell Antigen-Antibody Reactions by Flow Cytometry, and Approaches for Resolving Problems with Red Cell Agglutination. Transfus. Med. Rev. 24 (3), 172-194 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten