Method Article
通过实时 FRET 显微镜和免疫荧光评估早期斑马鱼 Noonan 综合征模型中 ERK 活性调节的有效方案
摘要
RASopathies 是由 RAS-MAPK 通路过度激活引起的多系统遗传综合征。等待验证的潜在致病性变异不断出现,而临床前证据不佳限制了治疗。在这里,我们描述了我们的 体内 方案,通过 青少年报告斑马鱼的实时 FRET 成像来测试和交叉验证 RASopathy 相关的 ERK 激活水平及其胚胎发生过程中的药理学调节。
摘要
RASopathies 是由 ERK 过度激活引起的遗传综合征,可导致多系统疾病,也可能导致癌症易感性。尽管存在广泛的遗传异质性,但 RAS-MAPK 通路关键调节因子中的种系功能获得性突变是大多数病例的基础,并且由于先进的测序技术,影响 RAS-MAPK 通路的潜在致病性变异继续被鉴定出来。这些变异的致病性功能验证对于准确诊断至关重要,需要快速可靠的方案,最好 是在体内。 鉴于儿童早期有效治疗方法的稀缺性,此类方案,特别是如果在具有成本效益的动物模型中可扩展,有助于为药物重新定位/再利用提供临床前基础。
在这里,我们逐步描述了在斑马鱼胚胎中快速生成瞬时 RASopathy 模型的方案,并通过实时多光谱 Förster 共振能量转移 (FRET) 成像直接检查原肠胚形成过程中已经发生的活体疾病相关 ERK 活动变化。该协议使用最近建立并与商用显微镜硬件集成的转基因 ERK 报告基因。我们提供了通过表达 Shp2D61G 获得的 Noonan 综合征 (NS) 斑马鱼模型的示例应用。我们描述了一种简单的方法,该方法能够在可用的低剂量 MEK 抑制剂进行药理学信号调节之前和之后在 NS fish 模型中记录 ERK 信号变化。我们详细介绍了如何在治疗前后从多光谱采集中生成、检索和评估比率式 FRET 信号,以及如何在早期通过经典免疫荧光对整个胚胎进行交叉验证结果。然后,我们描述了如何通过检查标准形态测量参数来查询胚胎形状的晚期变化,表明导致原肠胚形成受损,在受精后 6 小时通过活 FRET 评估 ERK 活性的相同胚胎。
引言
RASopathies 是损害正常发育并影响各种器官和组织的遗传综合征。这些情况通常是由参与 RAS/MAK 信号传导的关键基因和参与者的种系功能获得性 (GoF) 突变引起的,导致细胞外信号调节激酶 (ERK) 的过度激活(磷酸化增加)。ERK 通过易位到细胞核来调节发育过程中重要的一些基本过程 - 组织生长- 1,2。参与 RAS-MAPK 通路的基因的体细胞突变是导致癌症的最常见事件3。因此,毫不奇怪,在 RASopathies 中也观察到癌症易感性。Noonan 综合征 (NS) 是最常见的 RASopathy2 形式,其特征是发育迟缓、身材矮小、严重程度不一的认知缺陷和心肌病。在大多数情况下,这种疾病是由 PTPN11 中的 GoF 突变引起的,PTPN11 是 2000 年初发现的第一个 RASopathy 基因4,编码酪氨酸磷酸酶 SHP2 蛋白,该蛋白充当该通路的正调节因子。
从那时起,由于在未确诊患者中呈指数级使用外显子组测序方法,影响 RAS-MAPK 相关因素的潜在致病性变异,并且可能与各种形式的 RASopathies 有关,不断被发现,并等待功能表征以实现有效的患者分层2。为了实现这一目标,需要保证在生物体水平上进行快速和信息丰富的功能验证的实验方案。采用经典和标准化的哺乳动物模型来测试意义未知的变异将成本高昂、极其耗时,并且需要在不透明的大型动物中使用侵入性方法。鉴于目前没有管理或治疗的贫穷或未确诊的 RASopathy 患者所代表的社会负担,这种策略显然与快速检测的要求不相容。对整个生物体中的关键表型特征和分子相关性进行定量评估的方案也将有助于通过重新利用/重新定位来加速 RASopathy 患者可能获得的药物的可能临床转化。
斑马鱼是研究影响早期发育的疾病的理想脊椎动物模型。首先,斑马鱼与人类具有高水平的遗传同源性。成年鱼的高繁殖力导致大量胚胎产生,这些胚胎体积小且发育迅速。胚胎在早期阶段是透明的,因此可以使用标准显微镜毫不费力地观察主要发育过程(上消化、原肠胚形成、轴和身体平面形成)。此外,可用于在发育过程中跟踪特定细胞行为和动态分子事件的转基因品系的可用性,以及生成遗传模型的先进技术,是无与伦比的。此外,可以在斑马鱼的多个层面(从生物体到细胞缺陷)评估表型读数,并且已经为包括 RASopathies5 在内的几种疾病建立了专门的检测方法。此外,在早期阶段相对简单的药物给药浴浸方法,至少对于水溶性化合物,允许在 96 孔 格式中进行 体内高通量药物筛选。
从分子角度来看,使用标准方法(如免疫组织化学和免疫印迹)的研究有力地证明了 ERK 激活与鱼胚胎中 RASopathy 相关发育缺陷之间的相关性 6,7。最近开发的斑马鱼中的 EKAR 型 FRET 生物传感器 (Tg[ef1a:ERK biosensor-nes], Teen) 提供了一种可靠的体内工具,可以在胚胎发生过程中以时空分辨的方式记录 ERK 激活。因此,它对于更好地评估 RASopathy 鱼模型中的动态 ERK 改变和药理学调节可能很有价值。
在 Teen 传感器中,报告基因中的特异性 ERK 底物在 ERK 激活时被磷酸化,触发构象变化,使荧光 CFP 供体 (D) 和荧光 Ypet(改进的 YFP)受体 (A) 靠近。如果 D 发射光谱与 A 的吸收光谱相当重叠,就会发生 FRET(从 D 到 A 的能量吸收)。这与 D 和 A 之间的距离成正比,因此,在 Teen 中,与 ERK 激活状态成正比。使用标准或共聚焦显微镜的标准和高级成像模块,可以在活体和固定样品中设置不同的成像方案。在 D 激发时,沿从 CFP 到 YFP 的指定发射光谱 (λ) 采集多光谱扫描,然后进行光谱“解混”算法是配准和量化 FRET 数据的最可靠方法之一8。它也可以应用于活斑马鱼标本,以记录 体内 组织动力学。
继之前的报告 6,9 和我们最近的应用7 之后,我们在这里详细介绍了使用 Teen fish 评估 NS 模型动物极边缘细胞中 ERK 激活的分步工作流程,并将其与仅在发育后期可见的特征性体轴缺陷相关联。我们展示了如何在用可用的 MEKi 处理前后从活 NS 原肠中获取和检查定量 FRET 数据,以及如何通过针对磷酸化(活性)ERK 的标准免疫组织化学交叉验证结果或对胚胎伸长缺陷进行相关形态测量分析。
该工作流程可用于促进推定与 RASopathies 相关的新出现的变异和疾病基因的功能测试,并深入了解脊椎动物发育过程中 ERK 激活动力学在空间和时间上与胚胎形态缺陷的相关性。我们表明该方案也可用于测试调节 ERK 激活的候选药物的疗效。
研究方案
所有涉及动物饲养和繁殖的实验程序均根据意大利卫生部 (Direzione Generale della Sanità Animale e dei Farmaci veterinari - DGSAF) 授权的 ARRIVE 动物指南进行。所有 DNA/RNA 反应和成像过程都可以根据需要按比例放大或缩小,具体取决于所需的最终材料或测试的基因和变异的数量。
1. 瞬时斑马鱼 RASopathy 模型的生成和药物治疗
注:为了监测 RASopathy 相关变体的表达,可以使用在带有小非荧光标签(如 myc 或类似标签)的 cds 的框架中携带目标蛋白质所需编码序列 (cds) 的特异性构建体。这样,可以通过针对标签的标准蛋白质印迹来评估突变蛋白的表达水平。如果有针对目标特异性蛋白质的抗体,则可以避免使用标签。免疫荧光也可用于按照标准方案评估胚胎组织内的蛋白质表达。这种类型的对照实验可用于将突变蛋白表达与诱导的 ERK 激活水平相关联。鉴于显微镜检查过程中可能存在荧光发射串扰,不建议将荧光标签与 FRET 成像结合使用。
- 质粒线性化(第 1-2 天)(图 1A)
注意:当在斑马鱼中生成由影响特定基因的 GoF 突变引起的瞬时疾病模型(此处为 RAsopathy)时,一种快速的方法是制备编码野生型 (WT) 和感兴趣的突变蛋白的 mRNA,然后应按照以下步骤将其注射到斑马鱼胚胎中。用作转录 mRNA 模板的质粒应包含克隆在 T7、Sp6 或 T3 聚合酶启动子下游和多聚腺苷酸化 (polyA) 信号上游的目标基因所需的全长 CDS(编码序列)。如果不可用,第一步是通过在合适的载体中克隆斑马鱼或人类所需的 CDS 来生产它10 ,并通过 SANGER 测序进行验证。对于克隆,请考虑额外的时间(平均 1 周,包括克隆、筛选集落以及分离和扩增正确的克隆)。- 用合适的限制性内切酶线性化质粒,仅在 polyA 信号下游切割一次(此处为 KpnI)。为了实现高效的质粒线性化,将 3 γ (μg/μL) 质粒 DNA、2 μL 限制性内切酶 (20,000 Unit/mL) 和 10 μL 10x 反应缓冲液混合,最终体积为 100 μL,溶于无核酸酶水中。通过移液几次彻底混合组分,并将反应混合物在 37 °C 下孵育 2-4 小时。
- 通过在 1.5% 琼脂糖凝胶上进行电泳检查线性化的结果。
- 用无核酸酶的水稀释 10 倍 TBE 储备溶液(48.5 g Tris、11.4 mL 冰醋酸、20 mL 0.5 M EDTA [pH 8.0])。
- 通过在微波炉中溶解 1.5 g 琼脂糖和终体积为 100 mL 的 1x TBE 溶液来制备琼脂糖凝胶。然后,加入 3.5 μL 染料凝胶染料。
- 通过将琼脂糖溶液倒入合适大小的腔室中来灌注凝胶,具体取决于条件/质粒的数量。放置梳子并等待约 1 小时,直到凝胶凝固;然后,取下电泳梳,将聚合凝胶放在合适的凝胶托盘中进行电泳。
- 将几 μL 消化质粒(“切割”)和 1.5 μL 6x 上样缓冲液(包含用于监测电泳的染料)混合,最终体积为 10 μL 无核酸酶水。以相同的方式制备带有未消化质粒(“未切割”)的单独对照样品。在琼脂糖泳道中上样样品,在第一个泳道中上样 1 Kb DNA 分子量标准。在 100 V 下进行 DNA 电泳 30 分钟。
- 可视化并记录在标准 UV 透射仪上运行产生的 DNA 条带。通过比较“切割”和“未切割”的 DNA 条带模式来检查质粒线性化的效率。
注意:充分线性化的质粒作为一个尖锐的条带应该运行得更快。确保 DNA 切割完成,因为转录反应的起始是一个关键的限制步骤,环状质粒形式的存在可能会阻碍它,从而导致 mRNA 产量不佳。
- 使用市售的基于离心柱的 DNA 纯化试剂盒继续纯化线性化质粒,并将纯化的 DNA 制备物储存在 -20 °C 直至需要。
注:可以使用 PCR 产物作为 mRNA 转录的模板,而不是线性化,前提是它包括终止密码子上游的聚合酶启动子序列和 polyA 信号序列下游。在继续之前,还应纯化 PCR 产物并在琼脂糖凝胶上检查。
- In vitro mRNA 转录、纯化和质量控制(第 2-3 天) (图 1A)
注意:用 RNAse 去污溶液仔细清洁工作区域和移液器。使用不含核酸酶的材料和试剂;戴手套。这将最大限度地减少 RNase 污染,并提高全长 mRNA 的产量。
使用标准试剂盒转录编码线性化质粒中WT和突变蛋白的加帽和多聚腺苷酸化mRNA,并遵循制造商的说明进行转录。- 将纯化的线性化质粒以 17,949 × g 离心几秒钟,以确保碎片收集在试管底部,而不会转移到转录反应中。
- 在室温 (RT) 下解冻除 NTP 和 CAP 类似物的混合物外的所有组分,它们保存在冰上。将聚合酶保持在 -20 °C 直至使用。
- 使用前将所有试剂以 17,949 × g 短暂离心,以防止试剂损失或意外污染,并短暂涡旋 10x 反应缓冲液和即用型 NTP/CAP 类似物混合物,直到它们完全溶解。将 10x 反应缓冲液保持在 RT 中。
- 将 600-800 ng 线性化和纯化的质粒加入到含有 10 μL 2x NTP/CAP 类似物混合物、2 μL 10x 反应缓冲液、2 μL SP6、T7 或 T3 酶(取决于质粒中 CDS 上游的特异性启动子)的溶液中,制备转录反应,最终体积为 20 μL,由无核酸酶水配制。通过上下吹打几次充分混合。
- 在热循环仪中于 37 °C 孵育转录反应。确保还将盖子的温度设置为 37 °C 并运行反应 2 小时。
- 要去除反应过程中未转录的残留质粒,请添加 1 μL 标准 DNAse 溶液(2 单位/μL)。通过移液几次充分混合反应物,并在 37 °C 下再孵育 30 分钟。
- 在继续之前,通过 TBE/甲酰胺琼脂糖电泳检查 体外 合成的 mRNA 的质量和完整性。将 1.0 g 琼脂糖溶解在 50 mL 1x TBE 溶液中,加入 5.5 mL 37% 甲酰胺和 3.5 μL 染料凝胶染色剂,混合,如上所述灌注凝胶。
注意: 处理甲酰胺时,请穿戴个人防护装备 (PPE) 并使用化学头罩。 - 将 1 μL 转录的 mRNA 与 2.5 μL 2x 甲酰胺染料上样缓冲液在无核酸酶的水中混合,总体积为 5 μL。通过移液几次彻底混合组分,然后将样品加载到凝胶泳道中。将凝胶在预冷的 1x TBE 缓冲液中以 100 mV 运行10-15 分钟。同时运行 1 kb DNA 和/或 RNA 分子量标准。
- 可选:将分子量标准和 mRNA 在 70 °C 下变性 10 分钟。
- 在标准紫外透射仪上可视化和记录得到的 mRNA 条带。
注:长运行和高温会增加 RNA 降解的可能性。 - 如果合成的加帽 RNA 的完整性和大小最佳,则通过添加以下试剂进行 C 端多聚腺苷酸化:36 μL 无核酸酶水、20 μL 5x 变性上样缓冲液、10 μL 25 mM MnCl2、10 μL 10 mM ATP 和 4 μL 聚腺苷酸化酶(如纯化的大 肠 杆菌 Poly(A) 聚合酶)。通过移液几次充分混合反应物,并将 100 μL 的最终反应在 37 °C 下再孵育 1 小时。
注:不建议在 polyA 反应后通过凝胶电泳检查 RNA 质量,因为 RNA 会因 polyA 尾部而出现拖尾。 - 使用适当的盐(如 LiCl)沉淀并回收合成的加帽和多聚腺苷酸化 mRNA。简而言之,将等体积的无核酸酶水和标准 2.5 M LiCl 溶液 (30 μL) 混合,并在 -20 °C 下孵育 >30 分钟。
注:2 小时后可获得高效沉淀,但过夜孵育通常会增加 mRNA 的最终产量。 - 为了沉淀纯化的 mRNA,将反应物在 4°C 下以 17,949 × g 离心 30 分钟,并去除上清液。现在,用 ~1 mL 的 70% 乙醇 (EtOH) 洗涤沉淀,并在 4 °C 下以 17,949 × g 离心 15 分钟,以去除反应中的污染物和残留核苷酸。
- 将沉淀物风干,然后将其重新悬浮在 20 μL 无核酸酶的水中。通过在 RT 下轻轻重复移液使 RNA 充分溶解,并在 10 分钟时孵育。
注:每 5 分钟检查一次沉淀,以确保 EtOH 蒸发。重悬时,鉴于 RNA 的粘性,移液直至其正确溶解在水中。 - 通过在分光光度计中测量 260 nm 和 280 nm(260/280 比率)处的吸光度来评估制备的 mRNA 的浓度和纯度。测量 RNA 制备物的不同标量稀释度,以确保正确的浓度估计。
注:通常,合成的 RNA 浓度为 1 至 2 μg/mL,但最终量可能因 CDS 长度和起始材料量而异。 - 在评估质量时,将 mRNA 原液保存在冰中,然后将其分装成 5 μL 等分试样并储存在 -80 °C 直至需要注射。
- 胚胎注射和药物治疗的标准溶液和材料的制备(第 2-3 天, 图 1B)
- 使用无菌毛细管(标准毛细管尺寸:1.0 OD x 0.58 ID x 100 L mm)拉动斑马鱼胚胎的显微注射针。使用市售的拉拔装置,并在输出电压、拉动模式(一步或两步)和拉拔力方面应用所需的设置,以获得可变的尖端长度、直径和针形状。有关斑马鱼常用的针特征,请参阅 Abdelrahman 及其同事11。
注:最佳设置可能因实验室而异,因为环境条件(如湿度或室温)会影响针头拔针结果。应定期重新测试和校准设置。拔出的针头可以在 RT 中存放在干净的容器中几个月。 - 通过将 101.7 g NaCl、1.56 g KCl、2.96 g MgSO4 x 7H2O、4.25 g Ca(NO3)2 和 35.75 g HEPES 溶解在 1 L 双蒸 (DD) 水中,制备 pH 值为 7.6 的 30x“Danieau”储备溶液用于制备显微注射溶液。还制备 5% 酚红的 DD 水储备液,用作注射混合物的可见示踪剂。
- 通过稀释 4 mL NaCl (5 M)、680 μL KCl (1 M)、1.32 mL CaCl2 x 2H2O (1 M) 和 1.32 mL MgSO4 (1 M) 在终体积为 4 L 反渗透水中,制备用于胚胎生长的 E3 培养基溶液。
- 根据产品数据表和溶解度(通过将 5 mg 溶解在 1.036 mL DMSO 中,将 10 mM 所选 MEKi PD032590)制备所需药物的储备液(在本例中:MEK 抑制剂 [MEKi] )作为储备液。充分混合并生成小等分试样以在 -80 °C 下储存直至使用。
注:DMSO 是一种常用溶剂,用于溶解极性和非极性化合物,在各种有机溶剂和水中均具有溶解性。 - 让 卤虫盐 沼藻囊肿在 28-30 °C 的孵化溶液(2 g/L 卤 藻囊肿 溶于 30 g/L 先前溶于反渗透水中的海洋盐中)孵化至少 18 小时,制备活盐水虾悬浮液,提供恒定的通气。
注:培养条件和孵化时间可能受设施环境条件和包囊批次的影响,应定期重新测试,必要时重新设置。
- 使用无菌毛细管(标准毛细管尺寸:1.0 OD x 0.58 ID x 100 L mm)拉动斑马鱼胚胎的显微注射针。使用市售的拉拔装置,并在输出电压、拉动模式(一步或两步)和拉拔力方面应用所需的设置,以获得可变的尖端长度、直径和针形状。有关斑马鱼常用的针特征,请参阅 Abdelrahman 及其同事11。
- 为 Tg[ef1α:ERK biosensor-nes] (青少年) 鱼准备繁殖对(第 3 天)
- 交配当天,根据批准的动物设施协议定期喂养成年对。
- 用两个不同过滤器尺寸的过滤器过滤掉未孵化或空的囊肿,清洁含有孵化盐水虾的培养物(过滤步骤 I:180 μm,过滤步骤 II:112 μm)。
- 收集过滤后的盐水虾,并在 200 mL 反渗透水中清洗,用大约 5-10 mL 的盐水虾溶液喂养 10-15 条成年鱼。
注意:检查孵化的盐水虾溶液的质量,查看它们的活力、运动性、大小和颜色,并确保去除未孵化或空的囊肿,这些囊肿对鱼来说是不可消化的,可能对鱼的胃肠道造成伤害。对于繁殖对,最好在将配对隔离在繁殖池中之前至少 3 小时提供一天中的最后一餐,以允许食物消化并保持高水质水平。
- 选择在过去 2 周内(至少)未配对交配的鱼对,以尽量减少痛苦并允许配子发育。将选定的成年 青少年 鱼对(通常采用以下成分:1 ♂ : 2 ♀ )适应适当的繁殖池。使用水箱隔板将雌性和雄性分开,直到第二天早上。确保 14/10 小时的标准光照/暗循环。
注意:也可以安排组交叉。然而,在这种情况下,产卵可能发生在不同的时间,从混合窝中选择同一阶段的胚胎变得更加困难。从深色到浅色的过渡对于成功交配至关重要。
- 交配当天,根据批准的动物设施协议定期喂养成年对。
- 胚胎收集和 WT 和突变 mRNA 的显微注射(第 4 天)
- 设施内的灯一打开,就拆下分隔雄性和雌性的水箱隔板,如有必要,用来自循环水产养殖系统的淡水更换大约 20% 的水箱水,以保持水质高,而不会过度稀释鱼释放的激素。
- 不要打扰鱼,定期检查产卵情况(通常在日光的前 30 分钟到 1 小时)。产卵(2-3 毫米)并落到水箱底部,由网格隔开,这样成虫就不能吃它们。隔离成功繁殖的成鱼,并通过标准过滤器(如滤茶器)过滤含有鸡蛋的水箱水以保留鸡蛋。
注意:可以将同一条鱼放回繁殖箱中进行另一轮交配,或者将鱼放回原来的饲养箱中,记录交配对、日期和性能。 - 用新鲜的 E3 培养基清洗收集的胚胎,并使用巴斯德移液管从成对中取出未受精、退化的鸡蛋、粪便和其他种类的碎片。
注意:在直径为 90 mm 的培养皿中收集 ~n = 100 个受精 的青少年 卵,以避免胚胎数量过多。 - 通过在 E3 培养基中塑造 2% 琼脂糖来获得定制的显微注射板中排列和对齐受精 的青少年 卵子,以产生适当的泳道,这些泳道在显微注射过程中必须包含和限制卵子。
注意:为此,可以使用定制或商业模具。 - 制备新鲜的显微注射混合物以生成突变胚胎,如下所示:30-60 pg 加帽和多聚腺苷酸化 mRNA(此处为 shp2)溶于 0.3x Danieau 溶液(从储备液中稀释)中,最终体积为 20 μL。加入 0.2 μL (0.05%) 酚红储备溶液作为显微注射示踪剂。
- 使用微量装载器移液器将 2 μL 注射材料倒装到针头上。使用市售的压力显微注射装置将溶液注射到青少年斑马鱼胚胎的单细胞阶段,手动调整压力和时间设置,以根据针头和胚胎质量校准每次注射。请参阅文献11,12 中提供的标准斑马鱼显微注射方案。
- 在受控饲养条件下(温度:28 °C,湿度:70%,光照/黑暗周期:14/10 小时)培养显微注射 的青少年 胚胎以实现最佳发育,并在沉积后接下来的 3 小时内清除任何看起来浑浊或退化的鸡蛋。
- 在受精后 ~4 小时 (hpf),使用具有适当灯和滤光片设置 (465-500 nm) 的标准荧光立体显微镜筛选胚胎的荧光(报告基因表达)。使用 青少年阳性鱼进行 FRET 成像,使用阴性兄弟姐妹进行免疫组织化学 (IHC) 评估(见下文)。
注意:鉴于基于 Tol2 的转基因13 表达的已知可变性,胚胎可以显示不同水平的 Teen 荧光。建议检查未注射的兄弟姐妹,以控制批次内荧光的个体间变异性,并且考虑到 FRET 成像的低动态范围,丢弃基础荧光水平极低的胚胎。
- 用 MEK 抑制剂 (MEKi) 处理斑马鱼胚胎(第 4 天)
- 通过将 1 μL 的 10 mM 储备液和 9 μL 的 E3 培养基稀释,制备 MEKi PD0325901 (1 mM) 的中间溶液。使用中间溶液获得最终的低剂量溶液。通过将 0.75 μL 的 1 mM 中间溶液与 2.25 μL 的 E3 培养基混合,制备总体积为 3 mL 的低剂量 (0.25 μM) MEKi PD0325901。用 2.25 mL E3 培养基稀释 0.75 μL 10% DMSO,得到对照 (Ctrl) 溶液。
- 将等数胚胎池置于 6 孔板的不同孔中,并通过浴浸开始处理:对于每个孔,将 E3 培养基与含有载体对照(0.0025% DMSO)或所需浓度(0.25 μM,0.0025% DMSO)的稀释药物的 E3 培养基交换如前所述。每孔使用 3 mL 药物溶液。
注:为了消除不同浓度的载体 (DMSO) 引起的任何影响,确保对照溶液和处理溶液具有相同的最终 DMSO 浓度非常重要。 - 在收集胚胎之前,将处理过的胚胎保持在 28 °C,直到后续测定所需的发育阶段(此处:形态学分析和 IHC 验证)。
2. 原肠期 RASopathy 斑马鱼模型的实时多光谱 FRET 成像和数据分析
- 用于实时成像的安装原浆(第 4 天)(图 2A)
- 通过将 1.5 g 低熔点琼脂糖 (LMA) 溶解在 1x PBS 中以制备 1.5% LMA/E3 来制备活胚胎的封固剂。
注:根据发育阶段和抑制鱼的具体需要,从 0.8% 到 1.5% 中选择琼脂糖浓度。将新鲜制备的 LMA 溶液以所需形式的等分试样分发,并在 RT 下以聚合状态储存 LMA(稳定几个月)。这样可以最大限度地减少细菌和真菌污染,但在使用前要定期检查 LMA 等分试样的质量。 - 样品封固前,将 1.5% LMA 等分试样在 50 °C 的热混合器或无菌水浴中熔化。 溶解后,将热混合器的温度降低至约 30 °C。
- 将单个注射的 Teen + 胚胎(这里是表达 ShpD61G 的原肠)放在直径为 35 毫米的玻璃底培养皿的中心进行实时成像,并使用一根细毛定向。去除多余的 E3 培养基,并在顶部滴一滴 LMA 并使其在 RT 下聚合,从而固定胚胎。
注意:在聚合过程开始时,可以将鱼定向到所需的位置。严禁建议在不高于 35 °C 的温度下使用 LMA,以免损伤组织。
- 通过将 1.5 g 低熔点琼脂糖 (LMA) 溶解在 1x PBS 中以制备 1.5% LMA/E3 来制备活胚胎的封固剂。
- 设置显微镜参数并进行原肠胚的多光谱 FRET 成像(第 4 天)(图 2B)
注意:该协议适用于使用任何配备执行 FRET 成像所需的所有硬件和软件的共聚焦显微镜平台。在这里,我们使用了配备波长线为 458-476-488-496-514 nm 的氩离子激光器、分离激发光和发射光的可编程声光分束器 (AOBS)、两个光谱混合 (HyD) 检测器和一个载物台培养箱,以在样品的实时成像期间保持稳定的温度(28 °C)和湿度条件。
如Fasano等人所示,所描述的实时多光谱FRET成像方案可以应用于早期原肠胚之后不同发育阶段的胚胎。7.在后期开发阶段(例如,24 hpf)应考虑更大的 z 堆栈以及适当的 z 和 t 间隔设置,以允许在光谱 FRET 图像采集期间进行多光谱检测步骤。- 在开始采集前至少 1 小时打开培养箱控制器,并将温度设置为 28 °C,以保持斑马鱼胚胎处于健康状态。培养箱温度稳定后,将带有胚胎的成像皿放在样品架上,并使用 10 倍/干燥物镜(数值孔径为 0.4)快速观察样品。
- 在参考软件的 Laser Configuration(激光配置 )中,打开氩离子激光器并使用滑块将 激光功率 调整到 50%。在 硬件设置中,选择将获取图像的 8 位深度分辨率 。
- 在采集面板中选择光谱检测 XYλZ 扫描模式,并设置以下采集参数:格式图像:512 x 512 px;扫描速度 400 Hz;光学变焦为 0.75。
- 激活氩离子激光器的 458 nm 激光线并设置其强度值,通常为 <10%(此处为 8.5%)。
- 选择一个 HyD 探测器,并通过输入所需的值(此处为 500)来调整探测器的灵敏度(增益)。
注:对于活的弱荧光样品并积累较少的背景噪声,建议使用混合检测器而不是光电倍增管 (PMT)。
在参考软件中,显示染料的发射光谱需要激活检测器。 - 首先,激活第一个检测器 (HyD) 并选择 青色荧光蛋白 (CFP) 以显示其发射曲线。打开软件 检测器 栏的下拉菜单,打开 CFP 发射曲线的选择列表。现在,激活第二个检测器以显示第二个染料 黄色荧光蛋白 (YFP) 的发射曲线。要同时显示 Ypet 发射曲线,请激活第二个探测器,然后在关闭第二个探测器后选择将出现在光谱图像中的 YFP 发射曲线 。
注意:完成此步骤后,应停用第二个检测器,因为在光谱采集模式下仅使用一个检测器。 - 要开始实时采集,请将检测光标定位在最强信号发射的范围(在本例中为 YFP 的信号)范围内,以可视化样品,在 z 堆栈 LAS X 窗口中决定并设置样品厚度的开始和结束位置。
- 对于 λ 扫描范围属性,请设置以下参数:检测范围的开始 (460 nm) 和结束 (570 nm); 检测带宽度:5 nm; λ 扫描步长:5 nm。开始 z 堆栈采集。
注意:指示的参数允许用户获得具有可接受分辨率的相对较快的成像,但可以使用不同的设置。在 Fluorifier Disc Settings(荧光片设置)中,可以取消选择自动插入的 NOTCH 滤光片,以避免单次强度损失。 - 为了评估 MEKi 暴露后的实时信号变化,将单个突变胚胎(此处为 Shp2D61G)安装在玻璃皿中,并在药物治疗前后成像。对于这些实时实验,在成像过程中使用最多 2 mL 含有溶解药物的溶液,通过浴浸泡直接进行药物处理。
- 图像后处理和多光谱染料分离以获得比率式 FRET 图像(第 5 天)(图 2C)
- 为了分离供体 (CFP) 和受体 (Ypet) 发射,请务必消除两种分子在 FRET 通道中荧光发射的贡献,称为光谱渗漏 (SBT)。
- 请参阅公开可用的染料/荧光蛋白数据库,以显示和下载相对于标准 CFP 发射光谱(激发和发射光谱)的 .cvs 文件。
- 在 .cvs 文件的 Data 面板中 ,选择 Text to columns 选项,并使用逗号作为分隔符将数据拆分为多个列。生成的文件将包含应删除的其他信息(例如 CFP 激发、CFP 2P)。仅保留相对于波长和发射的色谱柱数据。
- 在 CFP 发射列中,删除 501 nm 以上的所有强度数据。
- 以 .xls 格式保存从 460 到 500 nm 的改编后的 CFP 发射光谱文件(在 图 2C 中称为“eCFP modified”)。
- 重复相同的步骤以下载和处理 YFP 蛋白质发射光谱,并仅保留相对于波长和发射的色谱柱数据。去除所有高达 524 nm 的发射值。将 525 至 650 nm 的改编 YFP 发射光谱文件保存为in.xls格式(在 图 2C 中称为“525 nm 的 Ypet”)。
- 为了允许在软件的 Configuration 窗口提供的染料数据库中排除光谱渗漏 (SBT),请插入并保存两个适用于 CFP 和 YFP 的参考发射光谱。
- 从成像会话中选择生成的光谱图像文件,打开 Process(处理)窗口,然后在 Dye Separation(染料分离)工具中选择 Spectral Dye Separation(光谱染料分离)。按如下方式配置染料分离的设置:在对话框左侧的下拉列表中,在第一个位置选择新的 CFP 发射光谱(修改的 eCFP),并从光谱数据库中选择新的 YFP 发射光谱(来自 525 nm 的 Ypet)。
- 在 “重新缩放”下,选择 “每通道 ”以单独缩放通道,然后在图像的 λ扫描 中,选择信号强度最大的通道(对应于FRET通道发射峰水平上光谱扫描的步骤14,由图 2B右侧显示检测步骤的面板中的白色箭头表示)).然后,沿着样品的 Z 扫描移动,并选择突出显示边缘区域感兴趣区域的光学部分。
- 在动物杆的边缘区域上使用 ROI 选择模式来定义具有最佳光谱的区域。单击显示窗口顶部指示的 ROICrosshair 以调用十字准线,并通过在测量区域中输入 40 个体素的值来调整参考 ROI 的大小。通过 ROICrosshair 精确定义感兴趣的区域。在图像图中,选择 Data normalization(数据标准化),然后单击 Apply(应用)以使用配置的设置执行染料分离。
- 打开这个新生成的文件,将两个通道分开,并从三维图像系列(最大强度投影)中生成二维投影图像,用于数据可视化。
- 在 Process(处理 )窗口中,选择 Crop(裁剪 )以将通道分成两个单独的文件,即 CH1 和 CH2(或 FRET)通道。
- 在“处理”窗口中,选择“合并图像”,选择 CH2 文件并将其插入到第一个选项中,然后选择 CH1 文件并将其插入到第二个选项中。设置因子为 5 的重新缩放,然后选择 Ratio作。然后,单击 Apply 生成包含比率图像 (YFP/CFP) 的新文件。保存文件以进行后续数据分析。
- 为了分离供体 (CFP) 和受体 (Ypet) 发射,请务必消除两种分子在 FRET 通道中荧光发射的贡献,称为光谱渗漏 (SBT)。
- FRET信号和图像渲染的定量分析(第5-6天)(图2D)
- 对于来自 FRET/CFP 比率图像的 FRET 信号的定量测量,根据基于预期效果的 先验 统计评估,对 N>2 个胚胎(重复)进行实验。使用图像处理包,例如开源软件 Fiji。将从光谱成像和染料分离获得的图像文件导入到图像分析包中,例如开源 Fiji。
- 在开始对原浆图像进行 ROI 选择之前,使用 Analyze 函数 |设置测量 | 选择感兴趣的参数,例如 Area、Integrated density 和 Mean gray value。
- 使用工具栏中的多边形选择工具选择感兴趣的区域(在本特定研究中:原肠的边缘)。通过单击 Analyze |工具 |ROI 管理器。
- 要在选定的 ROI 中执行测量,请单击 Analyze |测量。对每个 ROI 和图像/条件重复这些步骤。
注意:如果需要,请将图像另存为 。TIFF 格式。可以将来自多个图像的所有 ROI 测量值保存为一个 ROI 文件。使用相对于每个样本/图像的正确名称重命名 ROI 管理器列表中的每个度量。 - 对于每个条件(此处的突变体和突变体 + 处理),提取获得的每个选定 ROI 的所有 FRET/CFP 比率值,并通过组织例如,将实验组组织在列中,将每个原始值组织在行中。
- 使用任何合适的软件来评估不同实验条件下 FRET 信号的统计差异,并用于图形生成和数据可视化。
注意:开源和许可软件可用于数据分析和绘图解决方案。 - 组织一个特定的统计评估项目,考虑所有原始测量值和每个实验条件的重复次数。对于单个生物仿行的统计分析,请创建一个具有一个分组变量的列表,每个组由一列定义。对于多个生物重复的统计分析,请创建至少具有两个分组变量的分组表,一个由列定义(例如,实验条件),另一个由行定义(例如,重复的平均值)。
- 在工作表中适当安排实验组后,评估数据分布(正态性检验,例如 D'Agostino-Pearson、Anderson-Darling)并根据结果选择最合适的统计检验。
- 对参数数据(服从高斯分布)执行单因子方差分析,对非参数数据执行 Kruskal-Wallis 检验。如果存在更多因素(遗传和药物浓度),请考虑使用双向方差分析。将每个条件的平均 FRET 值相互比较(多重比较),并使用 事后 检验(例如,分别用于参数和非参数数据的 Tukey 检验和 Dunn 检验)校正多重比较。
3. FRET 结果的 IHC 验证和原肠胚形成缺陷的相关形态测量分析
- 针对 tERK 和 pERK 的 IHC 溶液的制备和胚胎固定和安装(第 7 天)(图 3A)
- 准备 IHC 所需的工作溶液。
- 通过将 80 g NaCl、2 g KCl、14.4 g Na2HPO4 和 2.4 g KH2PO4 溶解在 1 L DD 水中,制备 10x PBS 的储备溶液。高压灭菌溶液以保持无菌。
- 通过将 8 mL 的 10% Triton X-100 溶解在最终体积为 100 mL 的 1x PBS 中,制备 0.8% PBS-Triton (PBSTr) 溶液。
- 通过分别稀释 3 mL、7.5 mL 和 12 mL 的 100% 甘油,制备 20%、50% 和 80% 甘油溶液,最终体积为 15 mL 的 1x PBS。
- 通过将 2.5 mL 的 16% PFA 混合在 250 μL 的 10% Triton X-100 中,制备 4% 多聚甲醛 (PFA)/0.25% PBSTr(固定液),该溶液先前溶解在终体积为 10 mL 的 1x PBS 中。使用该解决方案在 4 °C 下以 6 hpf 固定胚胎过夜。 使用 2 mL 试管,每管最多 5 个胚胎,以实现高效固定和洗涤。
注:建议为每轮固定准备新鲜的固定剂。注意:处理 16 的甲醛时,请穿戴个人防护装备 (PPE) 并戴在化学罩下。 - 用 1.5 mL 的 0.8% PBSTr 填充试管几次,洗涤 2 mL 试管中的胚胎。将胚胎转移到新的 2 mL 试管中,并将胚胎储存在 1x PBS 中直至使用。
注意:如果不熟悉早期斑马鱼胚胎的处理,请在立体显微镜下工作,以避免移液过程中胚胎丢失。使用“低结合”塑料器皿来减少胚胎对管壁的可能粘性。
- 准备 IHC 所需的工作溶液。
- 针对 pERK 和 tERK 的组织透化和 IHC(第 7-9 天)
注意:IHC 结果取决于多个变量,这些变量可能因实验室而异,因此可能需要对方案进行特定优化。- 在 RT 下,在 1 mL 的 0.8% PBSTr 中洗涤固定的斑马鱼胚胎 3 x 10 分钟。
- 在 RT 下,用 2 μL 蛋白酶 K 在 0.8% PBSTr (1:1,000) 中稀释 2 分钟,透化样品。
- 通过在 1 mL 的 0.8% PBSTr 中洗涤样品 3 x 10 分钟来终止组织的透化,并在室温下将样品后固定在 500 μL 的 4% PFA/1x PBS 中 20 分钟。然后,在 1 mL 的 0.8% PBSTr 中洗涤样品 3 x 10 分钟。
注:用于组织透化的方法和时间是关键步骤,可能受抗原类型、组织保存质量和环境因素的影响。在将实验步骤应用于珍贵样品之前对其进行优化。 - 用含有 5% 正常山羊血清 (NGS)、1% 牛血清白蛋白 (BSA)、1% DMSO 的 1x 封闭缓冲液 (BB) 孵育样品,制备方法如下:75 μL 100% NGS、150 μL 10% BSA 和 15 μL 100% DMSO,终体积为 1.5 mL 0.8% PBSTr。每管使用 200 μL 溶液,并在溶液中在 RT 下孵育胚胎 20-30 分钟。
- 从上一步中取出 1x BB,并在含有所需一抗混合物的溶液中孵育样品(此处:稀释 1 μL 小鼠一抗 p44/42 MAPK、总 ERK、tERK,+ 1 μL 兔多克隆磷酸化-p44/42 MAPK、磷酸化 ERK、pERK)在 250 μL 新鲜制备的 1x BB 溶液中。每管使用 200 μL 溶液,并将胚胎在 20 °C 的溶液中孵育过夜。
- 为了消除非特异性结合,用 1 mL 的 0.8% PBSTr 洗涤样品数次(先每 10 分钟洗涤一次,然后每 30 分钟洗涤一次)。
- 将样品在新鲜制备的 1x BB 中在 RT 下孵育 20 分钟。每管使用 200 μL。
- 从上一步中取出 1x BB,并将样品与二抗混合物(1 μL 荧光 488 偶联山羊抗小鼠,+ 1 μL 荧光偶联 633 山羊抗兔在 600 μL 1x BB 溶液中)。让胚胎在 20 °C 下轻轻摇动过夜。
注意:我们对来自同一批次的阴性(非转基因) 青少年 鱼进行了 IHC,用于 FRET 成像。或者,也可以使用 Teen+ 鱼,但在这种情况下,应改用与荧光团偶联的二抗,这些荧光团与 CFP 或 YFP 的发射光谱不重叠。 - 如上所述消除非特异性结合。
- 在室温下,用甘油/1x PBS 溶液(20%、50%、80%)的梯度洗涤样品,每种溶液 15 分钟。将样品储存在 4 °C 的 90% 甘油/1x PBS 中。
注:为了最大限度地减少可能的荧光衰减,请将样品存放在黑暗中。
- 免疫染色组织的共聚焦显微镜检查和定量分析(第 10-11 天)(图 3B-E)
- 如前所述安装胚胎。
- 将共聚焦显微镜采集参数设置如下:80% 的白色激光,荧光偶联山羊抗小鼠的荧光发射范围为 507 - 551 nm(在这种情况下,发射光谱为 488 nm,用于 tERK),荧光偶联山羊抗兔为 644 - 740 nm(在这种情况下,发射光谱为 633 nm,用于 pERK)。选择顺序采集模式、512 x 512 像素的格式扫描和 400 Hz 的速度。使用 4 - 5 μm 的 z 步长尺寸和 1 的标准数字变焦定义扫描的开始和结束。使用水浸 25 倍物镜(数值孔径为 0.05)以 6 hpf 采集整个原肠胚
注意:该协议包括使用可能有害的激光;因此,需要根据国家的具体要求进行人员培训。 - 共聚焦图像采集后,检查使用图像处理包(如开源软件 Fiji)获得的原始图像文件。
- 在斐济,使用菜单图像和子菜单颜色中的命令分割通道来获取单通道图像(总 ERK:通道 = 0,C = 0;pERK:通道 = 1,C = 1),并通过单击图像 |堆栈 |Z 项目。
- 如前所述重复 ROI 强度测量过程,并将数据提取到工作表中。
- 为了推断实验组之间所需 ROI 中的 p-ERK 信号强度变化,通过将 p-ERK 染色的原始积分密度值除以 t-ERK 信号的原始积分密度来计算 p-ERK/t-ERK 比率。继续进行第 2.4 步中的统计显着性评估。
注意:成像参数的设置可以根据具体需要进行修改,并考虑每个样品的持续时间、所需的图像质量以及要采集的平面数。
- 11 个 hpf 胚胎的轴测量(第 4 天用于胚胎固定,第 12 天用于数据采集和分析)(图 4A-D)
- 在原肠胚形成结束时 (11 hpf),在 RT 下用 4% PFA 的 1x PBS 溶液固定胚胎 20 分钟,在 1x PBS 中洗涤数次,并在 4 °C 下储存直至图像采集。
- 使用巴斯德移液管在含有新鲜 1x PBS 的 12 孔板的单个孔中横向定位胚胎。
- 为了评估椭圆形(Y/X 胚胎轴比> 1)、斑马鱼特征性 Rasopathy 表型的存在以及由于治疗效果而对胚胎轴比率的形态学拯救,使用具有 3.4 倍放大倍率物镜(0.63 倍扫描物镜 x 8.60 缩放因子)的立体显微镜获取整个胚胎的图像,只需在 明场模式下捕获图像。
- 将图像文件导入到图像分析包中,例如开源 Fiji。
- 通过从工具栏中选择 直线工具 并单击 Analyze |测量。执行选定的测量后,将它们添加到 ROI 管理器列表中,并按照上述 FRET 成像分析的说明保存 ROI 文件。
注意:对每个胚胎图像重复这些步骤。
- 通过从工具栏中选择 直线工具 并单击 Analyze |测量。执行选定的测量后,将它们添加到 ROI 管理器列表中,并按照上述 FRET 成像分析的说明保存 ROI 文件。
- 继续在工作表中导出数据,并通过将长轴的长度 (y) 除以短轴的长度 (x) 来计算轴比率。计算不同仿行的均值、均值的标准差或均值的标准误。
- 按照步骤 2.4 进行统计数据分析。
结果
该协议展示了一个简单的工作流程,可以在斑马鱼胚胎中快速生成瞬时 RASopathy 模型,并使用应用于最近建立的 ERK 斑马鱼传感器的标准活 FRET 成像方法评估早期突变体中的 ERK 波动 6,9。正如最近显示的 6,7 在同一实验工作流程中,FRET 结果可以通过标准 IHC 对全胚胎的磷酸化和总 ERK 进行交叉验证。即使在用于 FRET7 的相同胚胎中,也可以在后期跟踪与 ERK 激活增加相关的体轴形成损伤。这里显示了 FRET 记录的早期原肠中的典型 ERK 波动,这与引起 NS 的 Shp2D61G 的表达有关。还从突变体中获取数据,其中信号被 MEKi 低剂量处理负调控,抑制 RAS/MAPK 信号级联反应。
为了生成 NS 模型,我们首先通过 体外 转录来自含有 shp2 全长 CDS 的合适线性化质粒,从而产生编码 Shp2(野生型和突变型)的高质量加帽和多聚腺苷酸化 mRNA。如图 1A 所示,当大部分质粒成功线性化(“切割”)时,可以观察到在标准的 1-1.5% 琼脂糖凝胶中运行的尖锐条带(此处为 7,500 bp 的大小),而“未切割”的 DNA,此处用作未消化质粒的对照,显示出不同的可能构象,这是未消化的环状 DNA 的典型特征。然后可以在体外产生加帽和多聚腺苷酸化的 mRNA 。 在含有甲酰胺的琼脂糖凝胶上,完整的 RNA 应该看起来像预期大小周围的一条明显条带(图 1A,右),没有明显的拖尾(表明 mRNA 降解)或存在较小的片段。如果获得片段化或降解的 RNA,建议不要继续进行。故障排除后应重复准备。如图 1B 的示意图所示,编码所需 RASopathy 等位基因和 WT 对照(在我们的例子中为 Shp2D61G 和 Shp2WT 作为对照)的高质量加帽和多聚腺苷酸化 mRNA 可以注射到表达 Teen 报告基因的单细胞期斑马鱼胚胎中。然后将胚胎培养到所需的阶段(这里是原肠胚形成的早期阶段)。
图 2 说明了用于在我们的体内 RASopathy 模型中注册 FRET 信号的工作流程的示意图和代表性结果。表达突变体 NS 等位基因 Shp2D61G 的 Teen + 原肠胚在所需阶段 (4 hpf) 升高并收集,被安装在 E3 培养基中的 1.5% 低熔点琼脂 (LMA) 中(图 2A)。图 2B 显示了我们用于从青少年胚胎的供体激发 (405 nm) 获得多光谱 FRET 成像的一般显微镜设置和 lambda (λ) 堆栈采集设置的示例。重要的是,为了确保足够的光谱收集,我们将 λ 带宽设置为 5 nm。考虑到实时采集模式(采集间隔约为 13 分钟),我们使用相对较高的步长(此处为 8 nm)在合理的时间内获得 x、y、λ、z 扫描。
图像采集后,沿整个 λ 光谱检查记录的信号强度,以分配最佳发射窗口,然后进行光谱 CFP (D) 和 Ypet (A) 解混(图 2C,左)。在这里,通过使用软件 光谱染料分离 向导中内置的基于 ROI 的方法检查胚胎动物极的边缘区域,我们专注于为两个荧光团分配最佳发射光谱窗口,避免 D 和 A 分子之间的光谱重叠。通过这种方法获得的代表性原始单通道(分别为 CFP 或 Ypet,绿色和红色)和应用 比率 功能产生的 FRET/CFP 比率图像(灰色)如图 2C 所示,右上面板。下图显示了 Teen 报告胚胎的代表性次优结果,偶尔显示信号强度不足,这在转基因鱼种群中经常观察到。这些胚胎应事先丢弃,并应小心评估分析中具有相似 Teen 表达水平的胚胎。
在动物极边缘进行信号检查后,ERK 活性在肠胚和原肠胚形成细胞运动期间集中,在斐济使用 “智能” LUT 伪着色进行图像渲染。这样可以更好地可视化生成的比率图像上的空间信号强度差异。图 2D 中得到的比率 FRET 图像已经显示,在用选定的 MEK PD0325901 i(此处为 PD)以低剂量 (0.25 μM) 处理约 13 分钟后,边缘区域的 Shp2D61G 信号强度降低的明显趋势7。数据表明,Teen 传感器和此处使用的多光谱 FRET 成像协议适用于在发育的早期阶段检测 RASopathy 模型中的实时动态 ERK 变化,以及在低剂量 MEKi 治疗后对疾病相关信号的精细调制。
同时,我们通过荧光 IHC 针对总 ERK (t-ERK) 及其磷酸化 (p-ERK) 形式验证了应用于 RASopathy 鱼模型的 FRET 方法的结果。通过在 ROI 内对获得的信号 (p-ERK/t-ERK) 进行归一化,出现具有高 ERK 水平的细胞。 图 3 显示了通过 IHC 验证 Shp2WT、Shp2D61G 和 Shp2D61G 的 ERK 活性示例,这些 PD 处理从 4 hpf 到 6 hpf(与实时 FRET 成像期间显示的 13 分钟治疗窗口相比,治疗时间更长)。使用具有 t-ERK 和 p-ERK (分别为 488 和 633 nm) 发射光谱不重叠的荧光二抗进行免疫染色。
将 6 hpf 胚胎安装在溶解在 PBS 中的 1.5% LMA 中,并设置标准共聚焦设置以获得整个胚胎体积的 x,y,z 扫描(图 3A,B)。在 400 Hz 下分辨率为 512 x 512 px 的标准共聚焦设置使我们能够检查信号定位,这对于在信号定量之前确定免疫荧光的良好结果非常重要。正如预期的那样,如代表性结果所示,对于 t-ERK(绿色),我们在边缘细胞内观察到几乎无处不在的染色,而 p-ERK(红色)信号主要局限于细胞核(图 3C)。原始图像,作为单通道和合并图像,最初通过执行 z 堆栈投影进行处理,以获得全胚胎图像。应用 p-ERK (樱桃) 的伪着色以更好地解析与 t-ERK (绿色) 的对比度 (图 3D)。与 Shp2WT 相比,在 Shp2D61G 中可以观察到边缘区域内 p-ERK + 细胞核数量的增加,这在用 0.25 μM PD 处理 4 hpf 至 6 hpf 的 Shp2D61G 胚胎中得到挽救。数据证实了 FRET 成像获得的结果,并证明了所选的低剂量 MEKi 获得的有效分子调节。与 FRET 图像类似,然后使用斐济基于 ROI 的分析在动物极边缘区域检查来自单通道 z 堆栈采集的信号,并分别测量 p-ERK 和 t-ERK 值并提取用于后续归一化 (p-ERK/t-ERK) 和统计分析(图 3E)。
最后, 图 4 提供了可以获取和测量的代表性形态测量数据,理想情况下是在来自实时 FRET 成像的相同样品上,然后从 6 提高到 11/12 hpf 或它们的兄弟姐妹。在这个胚胎阶段,短轴和长轴的测量值(长/短轴比率)的改变确实可以突出与 RASopathy 相关的原肠胚形成运动缺陷。这些数据可用于检查在致病性不确定的患者中发现的新变异的表型结果,并将表型的强度与用 FRET 测量的分子改变(ERK 激活)的强度相关联。在这里的示例中, 青少年 胚胎的兄弟姐妹(对照组 1:Shp2WT 以及第 2 组和第 3 组:Shp2D61G 和 Shp2D61G 用 4 到 6 hpf 的低剂量 PD 处理)分别提高至 11 hpf,然后固定在 4% PFA 中(图 4A)以避免进一步的胚胎发育,这可能会干扰个体之间的数据比较。使用可用于标准设置的简单明场模式获取侧向胚胎的图像。根据长轴和短轴测量值评估胚胎伸长率(图 4B、C)。结果测量(图 4D)反映并证实了通过 FRET 成像获得的数据,并证明了动物极边缘的动态 ERK 活动与原肠胚形成结果之间的相关性。总而言之,此处显示的 NS 相关等位基因 shp2D61G 有或没有处理 MEKi PD0325901的代表性数据集显示了 Tg[ef1α:ERK 生物传感器-nes] (青少年) 报告鱼中多光谱 FRET 成像的效用预测早期胚胎中 NS 的变异致病性。

图 1:生成瞬时 NS 斑马鱼模型所需的质粒和 mRNA 制备物分析。 (A) 该面板描述了在紫外透射仪上可视化的 DNA 电泳结果的示意图和代表性结果,用于评估有效的质粒线性化和高质量的 mRNA 转录。线性化质粒(“切割”)是通过用限制性内切酶(在本例中为 KpnI)消化获得的,并与未消化的对照质粒(“未切割”)进行比较。理想情况下,在质粒线性化时应观察到比“未切割”运行速度更快的单个条带。质粒大小:~ 7,500 bps:(骨架质粒 + shp 2 CDS)。请注意“未切割”的环状质粒如何显示松弛和超螺旋分子的不同 DNA 形式。将分子量片段范围为 0.5 至 10 kb (kb) 的 1 kb 分子量标准(泳道 1)上样到同一块凝胶上,以检查 DNA 片段的大小。右侧显示了新鲜转录的 mRNA 的代表性凝胶运行(在本例中,编码 Rasopathy 相关人 SPRED2 的转录 mRNA)。加载两个运行略有不同的分子量标准(DNA 分子量标准,泳道 1 和 RNA 分子量标准,泳道 2),分子量相似,分子量范围为 0.5 至 10 kb,用于 RNA 片段大小检查。(B) 示意图概述描述了使用编码 RASopathy 相关变体的转录 mRNA 通过注射到单细胞期斑马鱼胚胎中来生成瞬时疾病模型。编码目标蛋白质的野生型 mRNA 作为对照注射。mRNA 混合物是在 Deneau 溶液中用活性染料酚红制备的。使用 6 hpf(用于 FRET 和 IHC 测定)或 11/12 hpf(用于体轴)的显微镜饲养和评估胚胎。缩写: NS = Noonan 综合征;CDS = 编码序列;FRET = 荧光共振能量转移 ;IHC = 免疫组化 ;hpf = 受精后小时数。 请单击此处查看此图的较大版本。

图 2:MEKi 治疗前后早期 Teen Shp2D61G 胚胎实时多光谱 FRET 成像的工作流程和代表性结果。 (A) 对斑马鱼样品进行实时光谱 FRET 成像所需步骤的概述。在 E3 培养基中饲养和暂存的胚胎安装在 1.5% LMA 的玻璃底培养皿中,用于实时光谱 FRET 采集。在低剂量 PD0325901 给药前后进行 FRET 成像。显示了 Sari 等人开发的 Teen 报告基因系统的示意图9。比率图像 (FRET/CFP) 是在后处理中获得的。(B) LAS X 软件中两种荧光团(CFP、D;Ypet, A)。(C) 获得应用于 Shp2D61GTeen 原肠的光谱染料分离和比率图像的命令和方法。在左侧,使用 ROI 选择工具选择来自动物极边缘的强信号进行光谱分离。在右上角,显示了 D 和 A 通道的结果图像的设置和代表性结果,作为来自单个鱼的最大强度 z 投影,以及用于获得比率图像和代表性结果的设置。表示具有高 FRET 信号的胚胎动物极的边缘区域(黄色虚线)。(D) 左图:来自原始比率图像的边缘(黄色虚线)上的 ROI 选择示意图,用于斐济的数据分析。通过斐济的“智能”LUT 插件生成的代表性 FRET/CFP 图像显示,与 Shp2WT(中图)相比,表达 Shp2D61G 的胚胎中 ERK 激活的变化(中图)或相同的 Shp2D61G 胚胎在 PD 处理前后(右图)。对于此实验,显示了所选 ROI 的原始强度密度值。标明比例尺。缩写:FRET = 荧光共振能量转移;MEKi = 丝裂原活化蛋白激酶抑制剂;LMA = 低熔点琼脂糖;CFP = 青色荧光蛋白 ;Ypet = 黄色荧光蛋白;D = 供体;A = 受体;ROI = 感兴趣区域;ERK = 细胞外信号调节激酶。请单击此处查看此图的较大版本。

图 3:IHC 在有或没有 MEKi 处理的情况下对 Shp2D61G 早期胚胎中 t-ERK 和 p-ERK 的工作流程和代表性结果。 (A) 示意图说明了对 t-ERK (488) 和 p-ERK (633) 进行免疫染色并安装在 1.5% LMA/PBS 中用于共聚焦 z 堆栈采集的斑马鱼样品的收集。(B) 两条激光线(488、633 nm)的共聚焦显微镜设置,用于按顺序捕获来自荧光偶联二抗的荧光信号。插图说明了用于采集具有可接受分辨率的多堆栈 Raw 图像的 Z 堆栈参数。(C) 在 6 hpf 下正确染色的斑马鱼原浆的示意图(左图)和代表性原始共聚焦图像(右图),分别显示 t-ERK(绿色)和 p-ERK(红色)在动物极边缘普遍存在且大部分是核定位。(D) 用 4 至 6 hpf 之间的 0.25 μM PD0325901处理后,表达 Shp2WT (对照)、Shp2D61G 以及 Shp2D61G 的 6 hpf 胚胎共聚焦堆栈的代表性最大强度 z 投影。图像显示为单个 633 nm 通道(此处为 p-ERK,樱桃色伪彩)和组合(樱桃色为 p-ERK,绿色为 t-ERK)。(E) 在用于 斐济 数据分析的原始 z 堆栈图像中边缘区域(黄色虚线)的 ROI 选择的小插图中显示了。包括显示边缘区域的 z 堆栈图像的缩放,以及检索和评估的原始强度密度测量,以推断表达 Shp2WT 或 Shp2D61G 的兄弟姐妹在 ROI 中的 ERK 激活,有或没有 0.25 μM PD0325901处理。比例尺显示在图像面板中。缩写:IHC = 免疫组织化学;ERK = 细胞外信号调节激酶;t-ERK = 总细胞外信号调节激酶;p-ERK = 磷酸化细胞外信号调节激酶;FRET = 荧光共振能量转移;MEKi = 丝裂原活化蛋白激酶抑制剂;LMA = 低熔点琼脂糖;PBS = 磷酸酶缓冲盐水;hpf = 受精后小时数;ROI = 感兴趣区域。 请单击此处查看此图的较大版本。
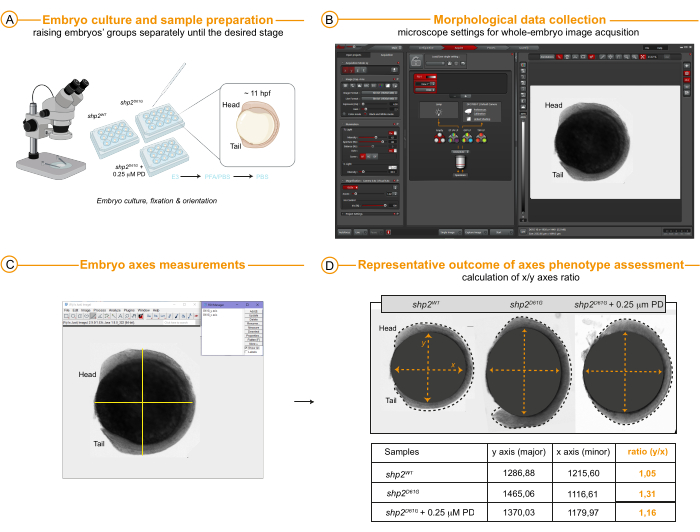
图 4:11 hpf 的形态学分析。 (A) 胚胎在 E3 培养基中培养至所需的发育阶段,此处为 11 hpf,然后固定在 4% PFA 中,保存在 1x PBS 中,并横向排列在孔中用于显微镜图像采集和轴评估。(B) 标准立体显微镜中的图像采集设置以及显示用明场模式评估的整个胚胎(此处为 Shp2WT)的结果图像的一个示例。(C,D)用 4 至 6 hpf 的 0.25 μM PD0325901处理后,Shp2WT (对照)、Shp2D61G 和 Shp2D61G 的代表性结果和轴测量结果。胚胎轮廓由黑色虚线表示。比例尺显示在图像面板中。缩写:hpf = 受精后小时数;PFA = 多聚甲醛;PBS = 磷酸酶缓冲盐水。 请单击此处查看此图的较大版本。
讨论
尽管经过数十年的研究和无数突变导致现在绘制了高度异质性的 RASopathies,但对未确诊患者的测序工作中继续出现意义未知的遗传变异。事实上,在许多情况下,仅基于临床特征的诊断可能具有挑战性,验证测序结果的功能性基因组方法仍然至关重要。此外,尽管一些可用的抗癌分子(即 MEK 抑制剂)被提议用于治疗 RASopathies 的一个子集,并且一些成功案例开始出现,但存在的共识有限。这是由于大多数可用药物的临床前证据不足造成的,当涉及到强效抗癌药物的有效剂量和儿科患者的治疗窗口时也是如此。
动物模型中的功能分析是疾病亚分类、患者分层和初始药物评估的重要步骤。斑马鱼可以是一种有效的 体内 模型,用于对导致儿科疾病(包括 RASopathies)的潜在致病性变异进行功能验证14。斑马鱼 RASopathy 模型存在关于 RASopathy 相关变异影响的最新表型评估,主要基于形态学读数——胚胎“椭圆测试”,其中体轴是在原肠胚形成结束时测量的。然而,与 ERK 激活的相关性通常主要通过标准的固定后方法 -- 免疫印迹/IHC 进行。
我们建立的管道旨在实时评估 ERK 波动,从而可以在原肠胚形成开始时快速测试可用药物的潜在疗效,并预期分析由此产生的形态测量变化。这里介绍的方案首先通过将感兴趣的 GoF 等位基因作为 mRNA 过表达到 ERK 体内报告基因 (Tg[ef1a:ERK biosensor-nes] Teen) 的单细胞阶段来生成所需的瞬时斑马鱼 RASopathy 模型6。在这种 EKAR 型 FRET 传感器中,多光谱 FRET 成像是一种非侵入性、非破坏性的方法,可用于准确检测活胚胎在空间和时间上的 ERK 信号波动,这些胚胎在发育过程中是生理性的,在 RASopathy 模型中是异常的,并通过药理学信号调制进行校正 6,7。
应考虑所提出管道的不同关键步骤,以便从胚胎样本中获得信息丰富的结果。鉴于已知的 FRET 传感器15 的低灵敏度和影响 ERK 信号传导的突变的可能可变影响(特别是对于以前未通过标准方法验证的突变),在设置实验之前,建议决定实验设计的类型(即,组和条件的数量),从而估计所需的胚胎数量(样本量、 n) 对于预期的效应量以及 I 型和 II 型误差的给定标准值。进行中试实验以估计观察 WT 和突变蛋白之间相关差异所需的实际最小 n 也很重要。使用替代和互补方法(例如 IF 或形态学测定(如此处所示))对 FRET 结果进行交叉验证也是必不可少的。
一般来说,n = 30 的标准样本量可以适合检测正态分布值16 的大效应。详细地说,对于样本量的先验分析,可以使用免费提供的程序,例如“G-power”17,设置以下标准参数:显着性水平 (α):通常设置为 0.05;置信水平 (1 - β):通常设置为 95%;假设检验的功效:通常设置为 80%(1 - β,其中 β 是犯 II 类错误的概率);根据 Cohen18,效应量 d(实验组之间预期差异的大小)可能具有不同的值,具体取决于是大、中还是小;统计变化(频率分布中的色散)。
在提供的具体示例中,Shp2D61G 突变体的众所周知的巨大效应也先前在斑马鱼中使用形态学读数和试点活体 FRET 实验进行了验证,包括互补测定,例如对固定样品的 FRET 作为 IF 和形态学读数来验证观察到的效果(参见 Fasano 等人 7)。
此外,高质量的 mRNA 是生成合适的短暂疾病模型的关键起始因素。事实上,虽然使用转基因模型来概括患者的杂合性是理想的,但这些模型的生成与快速测试新出现的变异的要求不相容,因为它需要提高品系。仅在胚胎发生过程中生成和评估的瞬时模型是大型筛选的首选。
然而,为了确保结果的信息性和可重复性,在评估 RNA 的质量时应特别小心。除了经典的甲酰胺凝胶外,还可以使用生物分析仪等仪器检查 RNA,这些仪器提供直接定量和视觉电泳图以进行质量检查。高质量的 RNA 制备物看起来像一个所需大小的尖峰。如果 RNA 明显降解,建议不要进行显微注射。重要的是,当涉及到显微注射时,对于新合成的 mRNA 批次,必须进行初始实验以校准正确的注射剂量。在此理想剂量下,来自同一批次的兄弟姐妹中目标 mRNA 的 WT 形式的表达不应引起可见的表型。
作为一般建议,在准备要注射的胚胎时,最好从交配的单对(1 只雌性 + 1 只雄性)中获取、收集和评估胚胎,以确保最大限度地减少批次差异。然而,为了提高胚胎产量,可以从具有多个雄性和雌性的群体杂交开始产鱼。在这种情况下,收集的胚胎可能来自水箱内发生的更多受精事件,但略有延迟,因此,通过在收集后的前 2 小时内多次检查胚胎来准确选择处于同一发育阶段(早期原肠胚形成)的个体非常重要。为了在娇嫩的初始阶段让胚胎良好生长,还应特别注意使用所有新鲜制备的溶液。此外,鉴于可能存在交配事件产生的粪便和碎屑,如果 E3 培养基中的胚胎在收集后未立即开始清洗和清洁,则胚胎批次可能会受到真菌和细菌的污染。应在实验前、实验中和实验后监测胚胎批次的活力。如果死亡率高于标准率(通常为 20-30%),则应停止实验。
关于药物治疗,至少对于这里测试的 MEKi 类别,最好避免在 4 hpf 之前进行治疗,因为这些可能会不可逆转地影响胚胎发育(毒性),如前所述19。实验可靠性的另一个关键步骤是在所有实验条件下使用相同浓度的药物载体(在这种情况下是 DMSO),并避免在处理过程中每孔胚胎过度拥挤,以保持良好的氧合水平(最多 20 个胚胎应保存在 6 孔板中)。
成像参数的优化对于管道的成功也极为重要,该管道尤其包括多光谱 FRET 成像以及 IHC 标本的共聚焦成像。首先,鉴于转基因表达的可变性,一个决定性的方面是准确选择 青少年 胚胎并丢弃那些表达非常低的胚胎,如果 FRET 传感器的动态范围低,这可能会阻碍足够的信号检测和定量(参见示例 图 2)。注射后 ~2 小时,在带有荧光灯和适当滤光轮的标准立体显微镜下可以看到转基因表达。
根据我们对 Teen 传感器鱼进行多光谱数据采集的经验,激光设置和光谱染料清晰度采集模式参数(x、 y、 λ、 z)是显微镜和硬件配置的关键初始步骤,应根据具体需求进行优化。原则上,应设置参数,以便在信号采集和采集速度之间取得良好的折衷。这对于对几乎完整的胚胎进行实时配准尤其重要,如下所示。采集速度为 400-600 Hz,步长在 8 μm 和 10 μm 之间,并设置每个 z 平面进行一次扫描可能无法提供细胞分辨率,但可能足以捕获胚胎组织中的动态 ERK 活性变化。原则上,可以使用 专用 显微镜设置获得具有近细胞分辨率的图像,但以牺牲速度和 3D 采样为代价。如果在后期阶段也只研究胚胎中的特定细胞群,这可能会很有趣6。
光谱染料分离可以使用与此处所示不同的算法进行。无论如何,为 CFP 和 YFP 分配最佳发射光谱所需的参考区域的选择至关重要。为此,建议通过选择和平均不同的 ROI 来检查所获得结果的一致性,其中组织/细胞信号清晰可见。在光谱采集结束时,一旦获得染料光谱分离,也可以从原始 CFP 和 YFP 扫描以及斐济免费提供的比率函数获得比率图像。尽管如此,为了在空间上可视化和突出 FRET 信号水平的差异,可能建议重新缩放图像。在我们手中,使用免费的 Fiji 软件中编码的“智能”查找表 (LUT) 进行伪着色可以很好地显示 ERK 激活水平。可以根据用户的喜好选择其他 LUT 和其他音阶。
应该强调的是,此处介绍的实验管道仅限于携带 CFP 作为供体 (D) 和 Ypet(类似于 YFP)作为受体 (A) 的青少年传感器。通常,在决定 FRET 报告器时,应考虑传感器的动态范围(检测微小但显着变化的能力)和 FRET 效率 (E),受传感器内 D-A 距离和方向以及 D 发射和 A 吸收之间的光谱重叠的影响。Teen 是一种 EKAREV 传感器,通过优化的结构设计,与以前的版本相比,它提供了更高的动态范围和灵敏度 (E)。然而,相对较低的动态范围,通常在体内较差,可以被认为是这种方法的主要限制。尽管如此,Sari 等人和 Wong 等人表明,发育过程中生理上发生的动态 ERK 变化在青少年胚胎中仍然是可见和可测量的,我们在药理学治疗的 NS 鱼模型中观察到信号波动 6,9。但是,我们预计使用此处显示的方法可能不容易评估极低的 ERK 信号波动。使用未来可能提供的改进的 ERK 生物传感器来测试我们管道的性能非常重要。
为了使用 IHC 对结果进行交叉验证,一个关键步骤是组织固定的质量。6 hpf 的胚胎组织非常脆弱和薄,因此对固定不良和过度固定敏感。鉴于固定液和抗体的批次间质量和性能差异,应在评估实验样品前不久在试点实验中评估固定时间和整个 IHC 方案的成功。始终建议使用新鲜制备的无菌固定剂。
总之,此处在方便的斑马鱼模型中显示的实验方案代表了一个强大且相对快速的管道,用于评估选定的 NS 等位基因对早期胚胎包浆细胞中 ERK 活化的影响。该方法涉及新开发的 Teen 传感器鱼中的多光谱 FRET 成像,以检测活分子波动,超越了经典的 IHC。尽管如此,IHC 可以用作验证所获得结果的补充方法。该方法预期经典的表型读数,即长/短轴比(“椭圆形胚胎”测试),这是 RASopathy 鱼类模型的黄金标准,但只能在原肠胚形成结束时进行测量。该协议还可用于测试拟议的 MEKi 纠正胚胎信号和轴改变的能力。
考虑到我们只测试了 NS 相关 shp2D61G 等位基因和一种药物,该测定的进一步发展应包括评估对 ERK 激活和其他拟议药物、剂量和治疗窗口具有不同影响的其他 RASopathy 相关突变的性能。评估这种多级方法对影响 RAS-MAPK 信号级联不同水平分子的其他新兴变体的敏感性将很有趣。最后,未来需要在专用的高内涵分析系统中对用于比率式 FRET 成像和定量的专用高通量方法进行标准化,以促进变异检测。
致谢
我们感谢 Jeroen den Hertog 博士(荷兰乌得勒支 Hubrecht 研究所)慷慨地提供 pCS2 + _eGFP-2a-Shp2a,从中提取 shp 2 全长 CDS 以生成我们使用的质粒模板7。我们感谢奈良科学技术研究所 (Takaaki Matsui)、国家遗传学研究所 (NIG/ROIS) (Koichi Kawakami) 提供转基因 青少年 报告基因系。这项工作得到了意大利卫生部 - 2021 年当前研究基金和 2024 年当前研究基金以及 Ricerca Finalizzata Giovani Ricercatori GR-2019-12368907 到 AL 的支持;当前研究基金 2019, PNRRMR1-2022-12376811, 5x1000 2019, AIRC (IG-21614 和 IG-28768) 和 LazioInnova (A0375-2020-36719) 至 MT。
材料
| Name | Company | Catalog Number | Comments |
| Plasticwares | |||
| 1.7 L Breeding Tank - Beach style Design | Tecniplast | 1.7L SLOPED | Breeding tank |
| Capillaries GC100F-10 | Harvard apparatus | 30-0019 | One-cell stage embryo microinjection |
| Cell and Tissue Culture Plates - 12 well | BIOFIL | TCP011012 | Embryo collection and treatment |
| Cell and Tissue Culture Plates - 6 well | BIOFIL | TCP011006 | Embryo collection and treatment |
| Cell Culture Dish | SPL Life Sciences | 20100 | Embryo collection |
| Nunc Glass Dishes 12mm | Thermo Fisher | 150680 | Embryo FRET spectral imaging |
| Pipette Pasteur | Corning | 357524 | Embryo transfer |
| Protein Lobind Tubes 2ml | Eppendorf | 30108450 | IHC assay |
| Reagents and others | |||
| Caviar 500-800 µm | Rettenmaier Italia | BE2269 (500-800) | Dry fish food |
| Great Salt Lake Blue Artemia Cysts | Sanders | 00004727 | Live fish food |
| Instant Ocean salt | Tecniplast | XPSIO25R | Dehydrated sea salt for live food preparation |
| Tg(EF1a:ERK Biosensor-nes) (Teen) | Contacts for ordering*: National BioResource Project Zebrafish, Support Unit for Animal Resources Development, RRD, RIKEN Center for Brain Science, Japan. https://shigen.nig.ac.jp/zebra/index_en.html *upon MTA signature. | - | Supplier of ERK Reporter zebrafish line. Fish embryos can be obtained upon MTA signature from National BioResource Project of Japan for Zebrafish (RIKEN, Japan). The zebrafish line is deposited by Nara Institute of Science and Technology (Takaaki Matsui) and the National Institute of Genetics (NIG/ROIS) (Koichi Kawakami, patent for Tol2 system) (Wong et al., 2018, Urasaki et al., 2006, Okamoto and Ishioka, 2010). |
| 6x loading dye | Cell Signaling | B7024S | Gel Elecrophoresis |
| 100 bp DNA ladder | NEB | N3231S | Gel Elecrophoresis |
| Agarose | Sigma-Aldrich | 1,01,236 | Gel Elecrophoresis |
| Agarose, low gelling temperature | Sigma-Aldrich | A9414-10G | Embryo mounting for FRET spectral imaging and IHC assay |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A8022 | IHC assay |
| Calcium chloride | Sigma-Aldrich | 223506 | E3 medium component |
| Calcium nitrate | Sigma-Aldrich | 237124 | Danieau stock solution component |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D8418-100ML | IHC assay |
| EDTA | Sigma-Aldrich | E9884 | TBE buffer component for gel preparation |
| Ethanol 99%+ | Fisher Scientific | 10048291 | In vitro RNA purification |
| Formaldeide 16% | Thermo Fisher | 28908 | Embryo fixation |
| Formamide | Sigma-Aldrich | F9037 | Gel Elecrophoresis |
| Gel Loading Buffer II (Denaturing PAGE) | Thermo Fisher | AM8546G | In vitro RNA transcription |
| Glacial Acetic Acid | Sigma-Aldrich | 695092 | TBE buffer component for gel preparation |
| Glycerol | Sigma-Aldrich | G6279-1L | IHC assay |
| Goat anti-mouse Alexa Fluor 488 | Thermo Fisher | A11001 | IHC assay |
| Goat anti-rabbit Alexa Fluor 633 | Thermo Fisher | A21070 | IHC assay |
| HEPES | Sigma-Aldrich | H3375 | Danieau stock solution component |
| KpnI - HF (Enzyme + rCutSmart Buffer) | NEB | R3142 | Plasmid linearization |
| Magnesium sulfate | Sigma-Aldrich | 230391 | E3 medium component/Danieau stock solution component |
| Millennium RNA Markers | Thermo Fisher | AM7150 | Gel Elecrophoresis |
| Monarch Genomic DNA purification Kit | NEB | T3010L | Plasmid linearization |
| Mouse monoclonal p44/42 MAPK | Cell Signaling | 4696S | IHC assay |
| mMACHINE SP6 Transcription Kit | Thermo Fisher | AM1340 | In vitro RNA transcription |
| Normal Goat serum (NGS) | Sigma-Aldrich | G9023 | IHC assay |
| Nuclease-free water Ambion | Thermo Fisher | AM9937 | In vitro RNA transcription |
| PD0325901 | Sigma-Aldrich | PZ0162 | MEK inhibitor |
| Phenol Red solution | Sigma-Aldrich | P0290 | Microinjection mix component |
| Poly A Tailing Kit | Thermo Fisher | AM1350 | In vitro RNA transcription |
| Potassium chloride bioxtra | Sigma-Aldrich | P9333 | E3 medium component/Danieau stock solution component/PBS stock solution component |
| Potassium dihydrogen phosphate | Sigma-Aldrich | P0662 | PBS stock solution component |
| Proteinase K | Sigma-Aldrich | P2308 | IHC assay |
| Rabbit polyclonal phospho-p44/42 MAPK | Cell Signaling | 4695S | IHC assay |
| SYBR safe DNA gel staining | Thermo Fisher | S33102 | Gel Elecrophoresis |
| Sodium Chloride | Sigma-Aldrich | 31434-M | E3 medium component/Danieau stock solution component/PBS stock solution component |
| Sodium phosphate dibasic | Sigma-Aldrich | 71643 | PBS stock solution component |
| Trizma base | Sigma-Aldrich | T1503 | TBE buffer component for gel preparation |
| Triton X-100 | Sigma-Aldrich | T8787 | PBSTr buffer component |
| Equipment | |||
| Alliance Mini HD9 | Uvitec | - | Imaging system |
| Centrifuge 5430 R | Eppendorf | 5428000205 | Microcentrifuge |
| Eppendorf ThermoMixer C | Eppendorf | - | Embryo mounting |
| FemtoJet 4x | Eppendorf | - | Microinjection system |
| Infinite M Plex | Tecan | - | Multimode plate reader |
| Leica M205FA | Leica Microsystems | - | Fluorescence stereo microscope |
| Leica TCS-SP8X equipped with incubator (OkoLab) | Leica Microsystems | - | Confocal microscope |
| Mini-sub Cell GT Horiziontal Electrophoresis System | Bio-Rad | 1704406 | Gel Elecrophoresis |
| PC-100 Vertical puller | Narishige | - | Needle puller |
| PowerPac Universal Power Supply | Bio-Rad | 1645070 | Gel Elecrophoresis |
| Stellaris 5 | Leica Microsystems | - | Confocal microscope |
| Vortex MiniStar silverline | VWR | - | Plasmid preparation |
| Softwares | |||
| Biorender | Biorender | CC-BY 4.0 license | Cartoon elaboration for Figures |
| Excel | Microsoft Office Professional Plus 2019 | - | Data analyses |
| Fiji software | ImageJ | 15.3t | Imaging rendering and quantitative analyses (FRET signals measurements, ERK fluorescence intensity in IHC assay, embryo axes lenght) |
| GraphPad Prism | GraphPad Software LLC | v. 9 | Statistical data analyses |
| iControl spectrophotometer software | Tecan | v. 2.0 | RNA quantification |
| Illustrator | Adobe | 26.0.3 (64-bit) | Figure assembling |
| LASX software | Leica Microsystems | v. 4.5 (Stellaris 5), v. 3.0 (M205FA), v. 3.5 (TCS-SP8X) | Imaging acquisition for spectral FRET experiments and embryo imaging for axes lenght measurements |
| Q9 Mini 18.02-SN software | Uvitec | - | Gel image acquisition |
参考文献
- Iroegbu, J. D., Ijomone, O. K., Femi-Akinlosotu, O. M., Ijomone, O. M. ERK/MAPK signalling in the developing brain: Perturbations and consequences. Neurosci Biobehav Rev. 131, 792-805 (2021).
- Tartaglia, M., Aoki, Y., Gelb, B. D. The molecular genetics of RASopathies: An update on novel disease genes and new disorders. Am J Med Genet C Semin Med Genet. 190 (4), 425-439 (2022).
- Tate, J. G., et al. COSMIC: the catalogue of somatic mutations in cancer. Nucleic Acids Res. 47 (D1), D941-D947 (2019).
- Tartaglia, M., et al. Mutations in PTPN11, encoding the protein tyrosine phosphatase SHP-2, cause Noonan syndrome. Nat Genet. 29 (4), 465-468 (2001).
- Jopling, C., van Geemen, D., den Hertog, J. Shp2 knockdown and Noonan/LEOPARD mutant Shp2-induced gastrulation defects. PLoS Genet. 3 (12), e225 (2007).
- Wong, K. -. L., Akiyama, R., Bessho, Y., Matsui, T. ERK activity dynamics during zebrafish embryonic development. Int J Mol Sci. 20 (1), 109 (2019).
- Fasano, G., et al. Assessment of the FRET-based Teen sensor to monitor ERK activation changes preceding morphological defects in a RASopathy zebrafish model and phenotypic rescue by MEK inhibitor. Mol Med. 30 (1), 47 (2024).
- Zimmermann, T., Rietdorf, J., Girod, A., Georget, V., Pepperkok, R. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2-YFP FRET pair. FEBS Lett. 531 (2), 245-249 (2002).
- Sari, D. W. K., et al. Time-lapse observation of stepwise regression of Erk activity in zebrafish presomitic mesoderm. Sci Rep. 8 (1), 4335 (2018).
- Wang, H., Li, J., Xue, T., Cheng, N., Du, H. Construction of a series of pCS2+ backbone-based Gateway vectors for overexpressing various tagged proteins in vertebrates. Acta Biochim Biophys Sin (Shanghai). 48 (12), 1128-1134 (2016).
- Abdelrahman, D., Hasan, W., Da'as, S. Microinjection quality control in zebrafish model for genetic manipulations. MethodsX. 8, 101418 (2021).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. J Vis Exp. (27), e1113 (2009).
- Rossant, J., Nutter, L. M. J., Gertsenstein, M. Engineering the embryo. Proc Natl Acad Sci USA. 108 (19), 7659-7660 (2011).
- Jindal, G. A., et al. In vivo severity ranking of Ras pathway mutations associated with developmental disorders. Proc Natl Acad Sci USA. 114 (3), 510-515 (2017).
- Leavesley, S. J., Rich, T. C. Overcoming lmitations of FRET measurements. Cytometry A. 89 (4), 325-327 (2016).
- Mascha, E., Vetter, T. Significance, errors, power, and sample size: Theblocking and tackling of statistics. Anesth Analg. 126 (2), 691-698 (2018).
- Faul, F., Erdfelder, E., Lang, A. -. G., Buchner, A. G*Power 3: a flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behav Res Methods. 39 (2), 175-191 (2007).
- Cohen, J. . Statistical power analysis for the behavioral sciences. , (1988).
- Anastasaki, C., Rauen, K. A., Patton, E. E. Continual low-level MEK inhibition ameliorates cardio-facio-cutaneous phenotypes in zebrafish. Dis Model Mech. 5 (4), 546-552 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
ISSN 2578-2037
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。