Method Article
肝组织3D细胞培养模型中组蛋白翻译后修饰的全球水平定量
摘要
该协议概述了如何使用三维细胞培养系统在接近生理状态下对染色质修饰进行建模,治疗和分析。
摘要
哺乳动物细胞的平面培养是一种广泛用于了解细胞生理学 的体外 方法,但由于细胞复制不自然的快速,该系统在模拟固体组织方面受到限制。在模拟成熟染色质时,这尤其具有挑战性,因为快速复制的细胞经常参与DNA复制并且具有异质多倍体群体。下面介绍的是使用三维(3D)细胞培养系统建模,处理和分析静态染色质修饰的工作流程。使用该协议,肝细胞癌细胞系在培养箱中作为可重复的3D球体生长,提供活性营养扩散和低剪切力。用丁酸钠和琥珀酸钠治疗分别诱导组蛋白乙酰化和琥珀酰化的增加。组蛋白乙酰化和琥珀酰化水平的增加与更开放的染色质状态有关。然后收集球状体以分离细胞核,从中提取组蛋白以分析其翻译后修饰。组蛋白分析 通过 液相色谱法在线与串联质谱法相结合,然后进行内部计算管道。最后,显示了数据表示的示例,以研究组合组蛋白标记的频率和发生。
引言
自19世纪末 以来,细胞培养系统已被用作研究人体外细胞生长和发育的模型1,2。它们的使用也已扩展到研究组织和器官如何在健康和患病环境中发挥作用1,3。悬浮细胞(例如,血细胞)在培养皿或烧瓶中无缝且可互换地生长,因为它们 在体内不以三维(3D)结构组装。来自实体器官的细胞可以在二维(2D)或3D培养系统中生长。在2D培养中,细胞在粘附在平坦表面的单层中生长2,4。2D细胞培养系统的特点是指数增长和快速倍增时间,通常为24小时至几天5。3D系统中的细胞生长形成复杂的细胞 - 细胞相互作用,更紧密地模拟组织样砾岩,并且它们的特征在于它们能够达到动态平衡,其中它们的倍增时间可以达到1个月或更长时间5。
本文介绍了一种在模拟重力降低的旋转细胞培养系统中培养3D球体的创新方法6。这是NASA在1990年代推出的细胞培养系统的简化衍生物7。这种方法可以最大限度地减少现有方法(如旋转烧瓶)中发生的剪切力,并提高球体再现性6。此外,旋转生物反应器增加了活性营养物质扩散,最大限度地减少了在悬挂式滴细胞培养等系统中发生的坏死形成,其中培养基交换是不切实际的6。通过这种方式,细胞生长大多不受干扰,允许形成与组织中生长的细胞相关的结构和生理特征。以这种方式培养的C3A肝细胞(HepG2 / C3A)不仅具有超微结构细胞器,而且还产生与体内观察到的水平相当的ATP,腺苷酸激酶,尿素和胆固醇的量1,2。此外,在2D与细胞培养系统中生长.3D细胞培养系统表现出不同的基因表达模式8。作为3D球体生长的C3A肝细胞的基因表达分析表明,这些细胞表达广泛的肝脏特异性蛋白,以及参与调节肝功能的关键途径的基因8。先前的出版物证明了2D培养物中指数增长细胞的蛋白质组与3D球体培养物中动态平衡的细胞之间的差异5。这些差异包括细胞代谢,这反过来又会影响细胞5的结构,功能和生理学。在2D培养物中生长的细胞的蛋白质组在参与细胞复制的蛋白质中更富集,而3D球体的蛋白质组在肝功能中更丰富5。
作为3D球体生长的细胞的较慢复制速率更准确地模拟与染色质状态和修饰相关的特定现象(例如组蛋白剪切9)。组蛋白剪切是一种不可逆的组蛋白翻译后修饰(PTM),可导致组蛋白N端尾部部分蛋白水解裂解。虽然它的生物学功能仍在讨论10,11,12,13,但很明显,它在原代细胞和肝脏组织中的存在是由作为球状体生长的HepG2 / C3A细胞模拟的,而不是扁平细胞9。这是至关重要的,因为染色质状态和修饰主要通过调节基因的可及性来调节DNA读数,从而调节它们的表达14。组蛋白PTM要么通过影响组蛋白组装的核小体的净电荷来直接影响染色质状态,要么通过招募染色质写入者,读取器和橡皮擦间接影响染色质状态14。迄今为止,已经鉴定出数百个组蛋白PTM15,这加强了染色质具有细胞用来解释DNA16的"组蛋白代码"的假设。然而,无数PTM组合15的鉴定,以及组蛋白PTM组合通常与孤立存在的PTM具有不同的生物学功能的发现(例如Fischle等人17),强调了需要更多的工作来解密"组蛋白代码"。
目前,组蛋白 PTM 分析要么基于利用抗体(例如,蛋白质印迹、免疫荧光或染色质免疫沉淀,然后进行测序 [ChIP-seq])的技术,要么基于质谱 (MS) 的技术。基于抗体的技术具有高灵敏度,可以提供关于组蛋白标记全基因组定位的详细信息,但在研究以组合形式存在的罕见PTM或PTM时通常受到限制18,19,20。MS更适合于单一和共存蛋白质修饰的高通量和无偏倚的鉴定和定量,特别是组蛋白18,19,20。由于这些原因,该实验室和其他几个实验室已经优化了MS管道,用于分析组蛋白肽(自下而上的MS),完整的组蛋白尾巴(中下MS)和全长组蛋白(自上而下的MS)21,22,23。
下面详细介绍了用于生长HepG2 / C3A球体的工作流程, 并通过 纳米液相色谱法在线结合串联质谱(nLC-MS / MS)制备它们以进行组蛋白肽分析(自下而上的MS)。培养2D细胞培养物,收获细胞并将其转移到生物反应器中,在那里它们将开始形成球体(图1)。培养18天后,用丁酸钠或琥珀酸钠处理球状体,以增加组蛋白乙酰化和琥珀酰化相对丰度。值得注意的是,3D培养物可以用遗传毒性化合物及其扁平培养物等价物进行处理;事实上,最近的出版物强调,3D培养物中细胞的毒理学反应比2D平板培养物中的细胞更类似于原代组织24,25。然后在指定的时间点收集细胞并进行核分离。然后,根据Garcia等人首先开发的方案,在胰蛋白酶消化之前和之后提取组蛋白并用丙酸酐衍生化。该过程产生适当大小的肽,用于反相色谱(C18)的在线分离和MS检测。最后,组蛋白肽被鉴定和定量,并且生成的数据以多种方式表示,以获得更完整的生物学解释。
研究方案
1. 缓冲液和试剂的制备
- 细胞生长培养基(用于HepG2 / C3A细胞):将胎牛血清(FBS)(10%v / v),非必需氨基酸(1%v / v),L-谷氨酰胺补充剂(1%v / v)和青霉素/链霉素(0.5%v / v)添加到Dulbecco的改良鹰培养基(DMEM,含有4.5 g / L葡萄糖)中。生长培养基在4°C下储存最多2周。
- 200 mM丁酸钠(NaBut)溶液:制备10 mL,将220.18mg NaBut重悬于10 mL ddH2O中,在-20°C下储存1mL等分试样。 在细胞处理之前,使用0.45mm注射器过滤器过滤溶液,并将1 mL过滤后的溶液加入9 mL细胞生长培养基中,工作浓度为20 mM。
- 100mM琥珀酸钠(NaSuc)溶液:为了制备10mL,将162.05mg NaSuc重悬于10mL ddH2O中,在-20°C下储存1mL等分试样。 在细胞处理之前,使用0.45mm注射器过滤器过滤溶液,并将1 mL过滤溶液加入9 mL细胞生长培养基中,工作浓度为10 mM。
- 冷0.2 M H2SO4:制备1 L,加入10 mL浓缩H2SO4 至990 mL HPLC级水。储存在4°C。
- 冷丙酮+ 0.1%盐酸(HCl):向丙酮中加入浓缩的HCl(0.1%v / v)。储存在4°C。
- 100 mM NH4HCO3 溶液,pH 8.0:制备1 L,在1 L HPLC级水中重悬7.91gNH4HCO3 。在-20°C下储存50mL等分试样。
- 0.1%三氟乙酸(TFA)溶液:将浓缩的TFA(0.1%v / v)加入HPLC级水中。储存在4°C。
- 60%乙腈/0.1%TFA溶液:在HPLC级水中加入HPLC级乙腈(60%v/v)。然后,向该溶液中加入浓缩的TFA(0.1%v / v)。储存在4°C。
- 2% HPLC 级乙腈 + 0.1% 甲酸:将 HPLC 级乙腈 (2% v/v) 加入 HPLC 级水中。然后,向该溶液中加入浓缩甲酸(0.1%v / v)。
- 80% HPLC 级乙腈 + 0.1% 甲酸:将 HPLC 级乙腈 (80% v/v) 加入 HPLC 级水中。然后,向该溶液中加入浓缩甲酸(0.1%v / v)。
2. 3D培养系统的准备
注意:不同的细胞,原代或永生化,具有不同的培养特性,因此球体的形成可能因细胞类型而异。该方案已针对使用生物反应器和创新的3D细胞培养系统的HepG2 / C3A球体形成而建立。
- 使用标准生长培养基,将细胞作为单层生长,直到它们汇合80%。
- 用HBSS(5mL用于75cm2 烧瓶)洗涤细胞,并用5mL在HBSS(1:2稀释)中稀释的0.05%胰蛋白酶 - EDTA孵育细胞在37 °C下用5%CO2孵育5分钟。
- 在显微镜下检查细胞脱离,并通过添加3mL胎牛血清(FBS)或生长培养基(含有5%-10%FBS)中和胰蛋白酶。
- 计数细胞数并稀释细胞悬浮液,以获得1 x 106 个细胞,最大体积为1.5 mL。
- 通过用0.5 mL生长培养基洗涤孔来平衡超低附着24孔圆底板(每孔包含多个微孔)。将板以3,000× g 离心5分钟,以除去孔表面的气泡。
- 将细胞悬浮液转移到板中,并以120×g离心3分钟 。
- 将板在37 °C下用5%CO 2孵育24 小时以形成球体。同时,通过用25 mL无菌水填充湿度室和用9 mL生长培养基填充细胞室来平衡生物反应器。
- 将生物反应器在clinostat培养箱中旋转,在37 °C下用5%CO 2孵育24小时。
3. 生物反应器中球体的生长
注意:为了保留球体的结构,使用宽孔尖端来处理3D结构。
- 用 1 mL 宽孔吸头轻轻上下移液,将球体从超低附着板上分离,然后转移到经过组织培养处理的培养皿中。
- 用0.5mL预热的生长培养基洗涤板并转移到同一培养皿中。
- 通过显微镜评估球体的质量,并选择充分形成的球体。高质量的球体具有均匀的尺寸,紧凑性和圆度。
- 将球体转移到装有5 mL新鲜生长培养基的平衡生物反应器中。转移球体后,用新鲜的生长培养基完全填充生物反应器。
- 将生物反应器置于恒温器培养箱中,并将转速调节至10-11 rpm。
- 每2-3天更换一次生长培养基,方法是取出10 mL旧培养基并用10 mL新鲜培养基替换。
- 根据球体生长调整旋转速度,随着球体大小和数量的增加而增加。
- 培养18天后,球状体即可进行治疗和/或收集
4. 球体处理和收集
注意:在该方案中,HepG2 / C3A球体分别用丁酸钠(NaBut)和琥珀酸钠(NaSuc)处理,以评估分别含有乙酰化和琥珀酰化的组蛋白标记的水平。
- 用适当的化合物工作浓度(例如,20 mM的NaBut或10 mM NaSuc)制备生长培养基。将生物反应器中的培养基与处理过的培养基交换。
注意:要建立对照条件,请在添加处理之前收集足够的球体用于实验,或者为未处理的球体指定生物反应器。 - 在足够的治疗时间(例如,NaSuc治疗为48小时至1周或NaBut治疗为48-72小时)后,收集球状体进行蛋白质组学分析。
注意:对于使用此方案的组蛋白提取,收集了6至8个含有约1 x 106 个细胞的球体。- 通过顶部端口从生物反应器中取出3-5 mL培养基。
- 打开前端口,使用 1 mL 宽孔吸头取出球体并将其放入微量离心管中。
- 将球体以100× g 离心5分钟并丢弃培养基。
注意:可以更换生物反应器中的培养基,并且可以将生物反应器返回到培养箱中以进行额外的处理时间或恢复。 - 用200μLHBSS洗涤球体以除去FBS。以100× g 离心5分钟,除去上清液。
注意:球体可以储存在-80 °C直至处理。
5. 组蛋白提取
注意:组蛋白中存在的许多碱性氨基酸残基使它们能够与具有磷酸骨架的DNA紧密相互作用。由于组蛋白是细胞核中一些最基本的蛋白质,当它们用冰冷的硫酸(0.2 M H2SO4)提取时,污染最小。非组蛋白会在强酸中沉淀。随后使用稀释至最终浓度为33%的高浓度三氯乙酸(TCA)从硫酸中沉淀组蛋白。将所有样品、试管和试剂保存在冰上,以便整个组蛋白提取。
- 向细胞沉淀(〜10-20μL)中加入五体积(〜100μL)冷的0.2MH 2SO4 ,并上下移液以破坏沉淀并释放组蛋白。
- 在恒定旋转或在4 °C下振荡时孵育管长达4小时。
注意:对于体积大于500μL的重悬样品,2小时的孵育足以提取组蛋白(更长的孵育可能导致提取其他碱性核蛋白)。对于体积小于200μL的重悬样品,需要4小时孵育以获得更好的产量。 - 在4°C下以3,400× g 离心5分钟。 在新管中收集上清液,稍后丢弃沉淀。
- 加入冷浓缩的TCA,使其构成最终的25%-33%v / v(例如,40-60μL冷TCA:120μL上清液),并通过倒置管数次来混合。
- 在恒定旋转或在4 °C下振荡,将试管孵育至少1小时。
注意:对于较小的起始颗粒尺寸,建议进行过夜孵育。 - 在4°C下以3,400×g离心5分钟,通过移液丢弃上清液。小心地吸出上清液;不要触摸管子或颗粒的侧面。
注意:组蛋白沉积在管的两侧和底部。在管的最底部形成的白色不溶性颗粒主要含有非组蛋白和其他生物分子。 - 使用玻璃巴斯德移液器(〜500μL /管)用冷丙酮+ 0.1%HCl洗涤管(壁和沉淀)。
- 在4°C下以3,400×g离心5分钟,通过翻转管子丢弃上清液。
- 使用玻璃巴斯德移液器(~500μL/管)用100%冷丙酮洗涤管(壁和沉淀)。在4°C下以3,400×g离心5分钟。
- 通过翻转试管并移出剩余的丙酮来丢弃上清液。打开盖子,在工作台上风干样品约20分钟。
- 继续进行丙酰化或将样品储存在-80 °C直至使用。
6. 第一轮衍生化
注意:使用胰蛋白酶消化组蛋白会导致肽过小,难以使用传统蛋白质组学设置进行鉴定。因此,丙酸酐用于化学衍生化未修饰和单甲基赖氨酸残基的ɛ-氨基。这将胰蛋白酶蛋白水解限制在C端精氨酸残基。对于96孔板中的样品,建议使用多通道移液器和储液槽进行试剂拾取(图2A)。在消化后也进行衍生化以标记肽的游离N-末端,增加肽的疏水性,从而反相色谱保留。
- 将样品重悬于20μL15%-20%乙腈中100mM碳酸氢铵(pH 8.0)中。涡旋15秒,然后以1,000 x g 旋转30秒。
- 如果有八个或更多样品,则将每个重悬样品转移到96孔板中。
注意:如果样品尚未转移到96孔板中,则可以在步骤6.3-6.7,7.1-7.5和8.1-8.5中使用单通道移液器。 - 在罩下,使用多通道移液器加入2μL丙酸酐。通过上下移液5次混合。
- 使用多通道移液器快速加入10μL氢氧化铵。通过上下移液5次混合。
注意:丙酸是丙酸酐和肽中的游离胺之间反应的产物,可以降低样品pH值。pH 8可以通过以1:5(v / v /v)的比例向样品中加入氢氧化铵来重新建立。 - 使用pH试纸确保pH值为8。如果pH值<8,则通过加入1μL氢氧化铵进行调节。如果pH值>8,则通过加入1μL甲酸或乙酸来调节。当pH值>10时,可以标记具有较高pKa的其他氨基酸残基。
- 在室温下孵育10分钟。
- 重复步骤 6.3-6.6。双轮组蛋白丙酰化确保了几乎完全的反应效率。
- 在快速真空中干燥板,直到所有孔完全干燥(约9小时)。
- 继续胰蛋白酶消化或将样品储存在-80 °C直至使用。
7. 组蛋白消化
注意:组蛋白使用胰蛋白酶被消化成肽,胰蛋白酶在精氨酸和赖氨酸残基的羧基侧切割。然而,由于丙酰化修饰赖氨酸残基,只有精氨酸残基被切割(图2B)。
- 制备胰蛋白酶溶液(25ng / μL在50mM NH4HCO3中,pH 8.0)。向每个样品中加入20μL胰蛋白酶(500ng)。
- 要制备50 mM NH4HCO3 溶液,用HPLC级水以1:1 v / v稀释100 mM NH4HCO3 溶液。
- 使用pH试纸确保pH值为8。如果pH值<8,则通过加入1μL氢氧化铵进行调节。如果pH>8,则通过加入1μL甲酸或乙酸来调节。
- 在室温下消化过夜或在37 °C下孵育6-8小时。
- 如果可行,在消化约3小时后检查pH值,因为它可能已经降低。如果pH值<8,则通过加入1μL氢氧化铵进行调节。
- 再加入5μL50ng / μL胰蛋白酶溶液(250ng)并继续消化。
- 继续进行第二轮丙酰化或将样品储存在-80 °C直至使用。
8. 肽N-末端的衍生化
注意:组蛋白肽在其N端的丙酰化通过反相液相色谱(例如,组蛋白H3的氨基酸3-8)改善最短肽的保留,因为丙酰基增加了肽的疏水性。
- 在引擎盖下,使用多通道移液器加入2μL丙酸酐。通过上下移液5次混合。
- 使用多通道移液器快速加入10μL氢氧化铵。通过上下移液5次混合。
注意:丙酸是丙酸酐和肽游离胺之间反应的产物,可以降低样品pH值。pH 8可以通过以1:5(v / v /v)的比例向样品中加入氢氧化铵来重新建立。 - 使用pH试纸确保pH值为8。如果pH值<8,则通过加入1μL氢氧化铵进行调节。如果pH值>8,则通过加入1μL甲酸或乙酸来调节。当pH值>10时,可以标记具有较高pKa的其他氨基酸残基。
- 在室温下孵育10分钟。
- 重复步骤 8.1-8.4。双轮组蛋白丙酰化确保了几乎完全的反应效率。
- 在快速真空中干燥板,直到所有孔完全干燥(约9小时)。
- 继续进行脱盐步骤或将样品储存在-80 °C直至使用。
9. 脱盐和样品清理
注意:样品中存在的盐会干扰质谱分析。盐在电喷雾过程中也被电离,可以抑制来自肽的信号。盐可以在肽上形成离子加合物,这导致加合肽具有不同的质量。这降低了肽的信号强度,并阻止了正确的鉴定和定量。脱盐设置如图 2C所示。
- 开始在磁力搅拌板上混合HLB树脂(50mg / mL在100%乙腈中)。
- 确保在96孔聚丙烯滤板下方放置一个96孔收集板以收集流通。
- 每孔向过滤板中加入70μLHLB悬浮液。轻轻打开真空以防止飞溅。丢弃流经。
- 用100μL0.1%TFA洗涤树脂。轻轻打开真空以防止飞溅。丢弃流经。
- 将每个样品重悬于100μL0.1%TFA中。检查pH值;它应该是~2-3。
- 将每个样品加载到每个孔中。轻轻打开真空以防止飞溅。丢弃流经。
- 用100μL0.1%TFA洗涤。轻轻打开真空以防止飞溅。丢弃流经。
- 用新的 96 孔收集板替换收集板。
- 每孔加入60μL60%乙腈/ 0.1%TFA。轻轻打开真空以防止飞溅。收集流通液并在高速真空中干燥。
- 继续使用LC-MS / MS或将样品储存在-80 °C直至使用。
10. 通过 液相色谱结合质谱进行组蛋白肽分析
- 准备流动相以在高效液相色谱(HPLC)上运行。流动相A(MPA):2%HPLC级乙腈+ 0.1%甲酸。流动相B(MPB):80%HPLC级乙腈+ 0.1%甲酸。
- HPLC方法的编程如下:(1)4%-34%MPB超过30分钟;(2)5分钟内34%-90%MPB;和(3)等度90%MPB持续5分钟。使用以下推荐的色谱柱属性:C18 3 μm 填料,75 μm 内径,20-25 cm 长度。对于内径为75μm的纳米色谱柱,将流速设置为250-300 nL / min。
- 如果HPLC未编程为在样品上样前自动实现色谱柱平衡,则在1分钟内包括(4)90%-4%MPB和(5)在10分钟内等度4%MPB。
- 对 MS 采集方法进行编程。
- 确保仪器在每个占空比开始时执行一次完整的MS扫描。建议使用高分辨率仪器(例如,orbitrap或飞行时间分析仪),因为在信号提取过程中可以使用质量精度。然而,低分辨率仪器也可以像前面描述的那样使用27,28。
- 确保完整 MS 扫描之后是 16 个 MS/MS 扫描事件,每个事件的隔离宽度为 50 m/z,范围为 300-1100。例如,第一次扫描应隔离300-350 m/z的信号,第二次扫描应隔离350-400 m/z的信号,依此类推。如果可能,也可以获得高分辨率的MS / MS扫描,但与全MS扫描相比,较低的分辨率就足够了(由于与完整离子相比,碎片离子的质量较小)。
- HPLC方法将产生峰宽约为3-40 s的色谱信号;为确保正确的信号定量,请确保质谱仪每个色谱峰至少执行10个占空比(即占空比为3秒或更快)。
- 如果使用俘获式质量分析仪(orbitrap,离子阱),请确保将离子注入时间限制设置为<200 ms;对于其他分析仪(四极杆,飞行时间),这不是问题,因为它们的扫描时间更快。可能需要进行初步测试。
注:有关组蛋白肽分析的MS方法的更多详细信息,请参阅以下参考文献27,28,29。
- 将样品重悬于10μLMPA中,相当于约1μg/ μL的消化组蛋白样品。如果批次中的所有样品都使用相似的稀释度和体积进行上样,则确切的上样量并不重要(评估起来也不重要)。
- 将1μL样品上载到HPLC柱上。
- 运行在步骤 10.1-10.3 中编程的 LC-MS/MS 方法。
11. 数据分析
- 将 MS 原始数据文件导入旨在执行峰面积积分的软件中。
注意:EpiProfile30,31 用于当前研究,通常推荐使用,因为它针对已知组蛋白肽的可靠峰面积提取进行了优化。然而,其他免费提供的用于提取离子色谱的软件,如Skyline32,33 是合适的。 - 计算给定(未)修饰肽的相对丰度,作为单个肽的面积除以所有修饰形式的肽的总面积。EpiProfile30,31 等软件已经包含用于信号提取的肽库。否则,手动或使用常规蛋白质组学管道 通过 肽鉴定生成感兴趣的肽库。
结果
在该方案中,用20 mM NaBut和10 mM NaSuc处理HepG2 / C3A球体,两者都影响组蛋白PTM的全局水平(图3A)。然后 通过 MS / MS采集在单个残留水平上鉴定和定量组蛋白PTM(图3B)。
当样品在重复中运行时,可以进行统计分析以评估样品之间PTM的倍变富集以及观察的可重复性。显示的数据表明,用乙酰化修饰的肽在用NaBut处理的球状体中富集(图3C),而用NaSuc处理的样品具有更高的组蛋白肽相对丰度用赖氨酸琥珀酰化修饰(图3D)。这些计算是在电子表格程序中完成的,详见单独的出版物34。给定组蛋白修饰的总体增加可以在雷达图中得到更好的表示,其中观察某种修饰的较高全局丰度变得更加直观,即使保持有关所分析的修饰位点的详细信息(图3E,F)。
该方案从组蛋白H3氨基酸残基9-17中产生肽,其中包括频繁修饰的残基K9,S10和K14。显示的数据表明,用NaBut治疗会增加H3K14ac的水平,但仅限于与H3K9me2共修饰的组蛋白,而不是H3K9me3(图4A)。两个修改之间的共存频率可以更直观地表示为环形图,其中节点表示单个修改,而连接器线的厚度表示两个PTM之间的共存频率(图4B)。有时,共存频率不受影响,但表示为条形图的数据可能会产生误导。例如, 图4A 中表示的数据表明,组合H3K9me2K14ac在NaBut处理中比在对照中更丰富。这是正确的,但无论治疗如何,这种给定的组合都是最常见的。 图4B 清楚地表明,无论处理(线厚度)如何,H3K9me2K14ac和H3K9me3K14ac都是最常见的组合模式,但H3K14ac(节点)的总体水平是实验中真正发生变化的。
该方案从组蛋白H4残基4-17中生成肽,其中包括位于K5,K8,K12和K16位置的可修饰残基(主要通过乙酰化)。当比较对照和NaBut处理时,可以通过将数据表示为例如词云来观察乙酰化组合的增加(图4C)。这种表示清楚地突出了组蛋白H4的未修饰版本在对照样品中最丰富,而用NaBut处理的球体富含双倍,三重和四重乙酰化的组蛋白H4蛋白形式。但是,词云在显示精确值方面受到限制;组蛋白代码的相对丰度应该通过文本的大小来解卷积,这可能是不准确估计的。因此,维恩图或更现代的等效物,如UpSetR表示35 ,可用于显示共存组蛋白PTM的精确定量(图4D,E)。显示的数据再次强调,与对照相比,组蛋白H4上选定的乙酰化组合在NaBut处理中相对更丰富。
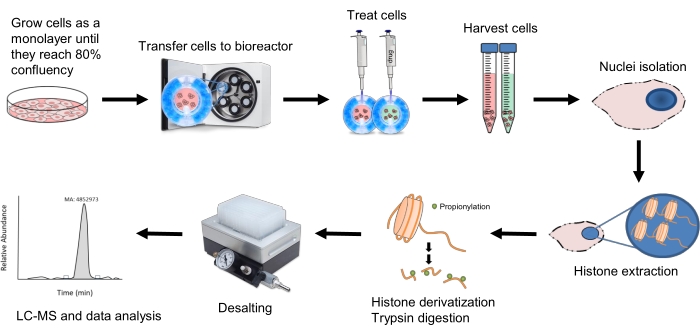
图1:3D球体组蛋白肽分析的工作流程。 HepG2 / C3A细胞首先在2D培养物中生长,直到它们达到80%汇合度。然后将细胞转移到平衡的生物反应器中,并放置在clinostat培养箱中,在那里它们将以10-11rpm旋转以形成球体。18天后,用20 mM NaBut或10 mM NaSuc处理球状体,并在相应的时间点后收获。从细胞中分离细胞核,并用0.2M H 2SO4进行组蛋白提取。然后在胰蛋白酶消化之前和之后用丙酸酐进行组蛋白衍生化,以确保通过液相色谱法保留所得的短肽。对样品进行脱盐,然后使用步骤10中提到的LC-MS / MS方法运行,并按照步骤11中所述分析结果数据。 请点击此处查看此图的大图。
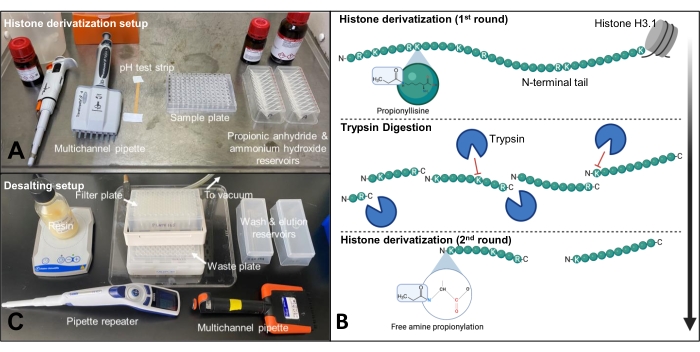
图2:丙酰化和脱盐步骤的设置。 (A)丙酰化在通风橱中进行,所有组件都布置好,以便可以快速连续地执行这些步骤。(B)组蛋白H3.1尾部第一轮丙酰化、胰蛋白酶消化、第二轮丙酰化示意图。(C)使用96孔真空歧管和96孔聚丙烯滤板在工作台上进行脱盐。 请点击此处查看此图的大图。
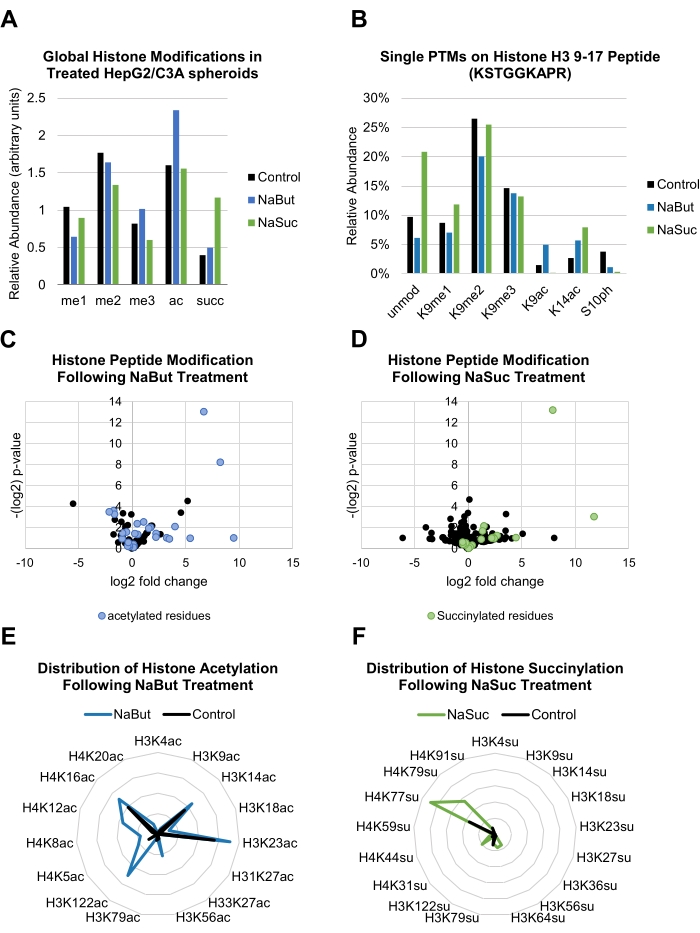
(A)条形图显示了控制和处理(20 mM NaBut或10 mM NaSuc)HepG2 / C3A球体中常见的全局组蛋白修饰的相对丰度。(B)条形图显示了组蛋白H3肽(KSTGGKAPR)残基9-17上发生的单个组蛋白PTMs在对照和处理(20 mM NaBut或10 mM NaSuc)HepG2 / C3A球体中的丰度。(C,D)火山图显示用20 mM NaBut (C)或10 mM NaSuc (D)处理后组蛋白肽PTM差异表达的折叠变化和意义。突出显示的蓝色和绿色点分别代表乙酰化和琥珀化残基。(英、华)雷达图显示,与对照相比,分别用20 mM NaBut或10 mM NaSuc处理后单组蛋白肽乙酰化(E)或琥珀酰化(F)的丰度。请点击此处查看此图的大图。

(A)条形图显示了组蛋白H3(KSTGGKAPR)残基9-17在对照和处理(20 mM NaBut或10 mM NaSuc)HepG2 / C3A球体中发生的组蛋白PTM的丰度。(B)环图显示了对照组蛋白H3(KSTGGKAPR)残基9-17上的组合组蛋白PTM与处理过的(20 mM NaBut)HepG2 / C3A球体之间的关系。节点颜色的强度对应于其治疗组中单个PTM的丰度,而线厚度对应于PTM共生的频率。(C)字云显示组蛋白PTM在控制和处理的(20 mM NaBut)HepG2 / C3A球体中组蛋白H4残基上的频率。文本的大小与指定组合 PTM 的丰度相对应。(D,E)维恩图表示对照组蛋白H4肽残基4-17和20mM NaBut处理样品上共存修饰的频率。数据使用 ShinyApp UpSetR35 显示。请点击此处查看此图的大图。
补充表1: 使用该协议检测的肽列表。 请按此下载此表格。
讨论
组蛋白PTM的分析与典型的蛋白质组学分析管道有根本的不同。大多数组蛋白PTM仍然具有神秘的生物学功能;因此,诸如基因本体论或通路数据库之类的注释不可用。存在几种资源将组蛋白修饰与负责其催化的酶或含有结合这些PTM的结构域的蛋白质(例如,HISTome36)相关联。同样,当组蛋白PTM的全球水平受到调节时,可以推测染色质的整体状态。例如,组蛋白乙酰化或其他酰化(如琥珀酰化)的总体增加通常与染色质脱缩37,38有关。
MS分析提供了有关这些修饰的更详细的信息,例如它们在氨基酸序列上的确切定位。在该协议中,MS / MS采集用于鉴定和定量组蛋白PTM,这对于生物学解释至关重要。例如,组蛋白H3(H3K4me3)赖氨酸4上的三甲基化在主动转录基因39的启动子上富集,而对赖氨酸9(H3K9me3)基准的相同修饰是组成性异染色质40。组蛋白修饰目前被用作特定疾病的生物标志物;因此,组蛋白分析除了对治疗的反应(例如,表观遗传药物)外,还可用于研究疾病病理学41,42。
与单个PTM相比,直观地表示多个PTM之间的交互更具挑战性。虽然现有的图表(如环形图)可以显示两个PTM的共存频率,但它们不能同时表示两个以上PTM之间的共存频率,因为这需要网络的三维表示。因此,当考虑三个或更多PTM时,其他表示可能更适合突出显示组蛋白代码的变化。一般来说,多样化的数据表示提供了更高的机会来观察样本之间的重大变化。该协议提供了用于显示组蛋白PTM和共存PTM法规的不同插图的示例。
虽然该方案由于胰蛋白酶消化而产生相对较小的组蛋白肽(约4-20个氨基酸),但选定的肽含有多个可修饰的残基。对这些肽的分析允许量化PTM的共存频率,这可以揭示有关在给定数据集中调节哪些组合组蛋白标记的重要信息。值得注意的是,在样品制备过程中没有进行任何组蛋白定量的步骤。这有四个原因:(1)胰蛋白酶具有广泛的活性,可以在广泛的酶与样品比例(1:10-1:200)下使用。即使提取组蛋白的实验产量与预期的不同,使用该协议也没有遇到消化问题。(2)该协议适用于微量的材料,其中组蛋白定量可能由于缺乏敏感性而难以进行。(3)通过使用恒定的胰蛋白酶浓度,无论组蛋白物质的量如何,我们都可以使用胰蛋白酶肽(作为胰蛋白酶自动解酶)来衡量色谱性能。数据分析软件(步骤11)将对样品产量的微小变化进行归一化,该软件在归一化过程中使用给定肽的所有(未)修饰信号作为分母。(4)最后,对起始材料量的急剧低估可能会产生nanoLC色谱柱过载的问题。但是,执行此协议中指示的脱盐步骤可防止此问题发生。如果原料过量(例如>100μg),脱盐树脂的容量极限将被超过,并且在装载步骤中任何多余的样品将被冲走。
重要的是要注意,并非所有通过该分析检测到的肽都在图3和图4中突出显示。同样,并非所有组蛋白修饰都可以使用这些特定的样品制备和采集方法检测到。提供补充表1以列出使用所述管道提取的所有肽信号。表中未列出一些众所周知的修饰,因为所描述的样品制备不适合其检测。值得注意的例子是来自组蛋白H2A和H2B的泛素化肽,以及组蛋白H2A的磷酸化。X(DNA损伤的一般标志物)。这是因为与这些PTM相关的肽的丙酰化导致肽过长,不适合C18色谱法和所述MS检测方法。文献中存在但补充表1中不存在的其他修饰是非常低丰度的修饰(目前只能在富集策略(例如免疫沉淀或特异性细胞处理后使用MS进行检测),例如乳糖基化43或5-羟色胺化44。也不考虑由聚合或非均相共价结合到组蛋白序列引起的具有不可预测的质量偏移的组蛋白修饰(例如,聚-ADP-核糖基化45和糖基化46)。此外,该方案使用NaSuc和NaBut来治疗HepG2 / C3A球体,但可以对其进行修改以与其他药物/表观遗传修饰剂和2D / 3D细胞培养类型一起使用。
披露声明
作者没有相互竞争的经济利益。
致谢
Sidoli实验室感谢白血病研究基金会(Hollis Brownstein新研究员研究资助),AFAR(Sagol Network GerOmics奖),Deerfield(Xseed奖),Relay Therapeutics,Merck和NIH主任办公室(1S10OD030286-01)。
材料
| Name | Company | Catalog Number | Comments |
| 0.05% trypsin-EDTA solution | Gibco | 25300054 | |
| 0.5-20 µL pipet tips | BRAND | 13-889-172 (Fisher Scientific) | |
| 1.5 mL microcentrifuge tubes | Bio-Rad | 2239480 | |
| 10 µL multi-channel pipette | BRAND | BR7059000 (Millipore Sigma) | |
| 10 mL syringe | Henke Sass Wolf | 14-817-31 (Fisher Scientific) | Luer lock tip, graduated to 12 mL |
| 10, 20, 200, and 1000 µL single-channel pipettes | Eppendorf | 14-285-904 (Fisher Scientific) | |
| 1000 µL pipet tips | Rainin | 30389164 | |
| 18 G syringe needle | Air-Tite | 14-817-100 (Fisher Scientific) | 3" length, 0.05" diameter |
| 200 µL multi-channel pipette | Corning | 4082 | |
| 2-200 µL pipet tips | BRAND | Z740118 (Millipore Sigma) | |
| 24-well ultra-low attachment microplate | Corning | 07-200-602 | |
| 75 cm2 U-shaped cell culture flask | Corning | 461464U | Untreated, with vent cap |
| 96-well skirted plate | Axygen | PCR-96-FS-C (Corning) | |
| Acetone | Fisher Scientific | A949-1 | Acetone should be used cold |
| Ammonium bicarbonate (NH4HCO3) | Sigma-Aldrich | A6141-25G | |
| Ammonium hydroxide solution | Fisher Scientific | AC423300250 | |
| Cell culture grade water | Corning | 25-055-CV | |
| ClinoReactor | CelVivo | 10004-12 | Bioreactor for 3D cell culture |
| ClinoStar | CelVivo | N/A | Clinostat CO2 incubator for 3D cell culture |
| Control unit | CelVivo | N/A | Tablet for ClinoStar settings |
| Dulbecco's Modified Eagle's Medium (DMEM) | Corning | 17-205-CV | 1X solution with 4.5 g/L glucose and sodium pyruvate, without L-glutamine and phenol red |
| Fetal bovine serum (FBS) | Corning | 35-010-CV | |
| Formic acid | Thermo Scientific | 28905 | |
| Fume hood | Mott | N/A | Model 7121000 |
| Glass Pasteur pipette | Fisher Scientific | 13-678-8B | 9", cotton-plugged, borosilicate glass, non-sterile |
| Glutagro supplement | Corning | 25-015-CI | 200 mM L-ananyl-L-glutamine |
| Hank’s Balanced Salt Solution (HBSS) | Corning | 21-022-CV | 1X solution without calcium, magnesium, and phenol red |
| HPLC grade acetonitrile | Fisher Scientific | A955-4 | |
| HPLC grade water | Fisher Scientific | W6-1 | |
| Hydrochloric acid (HCl) | Fisher Scientific | A481-212 | |
| Ice | N/A | N/A | |
| MEM non-essential amino acids | Corning | 25-025-CI | 100X solution |
| Oasis HLB resin | Waters | 186007549 | Hydrophilic-Lipophilic-Balanced (HLB) Resin with 30µm particle size |
| Orbitrap Fusion Lumos Tribrid mass spectrometer | Thermo Fisher Scientific | IQLAAEGAAPFADBMBHQ | High resolution mass spectrometer |
| Oro-Flex I polypropylene filter plate | Orochem | OF1100 | 96-well polypropylene filter plate w/ 10 µM PE frit |
| Penicillin-Streptomycin | Corning | 30-002-CI | 100X solution |
| pH paper | Hydrion | Z111848 (Sigma-Aldrich) | 0-13 pH test paper |
| Pipette gun | Eppendorf | Z666467 (Millipore Sigma) | |
| Polymicro capillary | Molex | 50-110-7740 (Fisher Scientific) | Flexible fused silica capillary tubing with polymide coating, 75 µM ID x 363 µM OD |
| Polystyrene 10 mL serological pipets, sterile | Fisher Scientific | 1367549 | |
| Propionic anhydride | Sigma-Aldrich | 240311-50G | |
| Refrigerated centrifuge | Thermo Scientific | 75-217-420 | |
| Reprosil-Pur resin | MSWIL | R13.AQ.0003 | 120 Å pore size, C18-AQ phase, 3 µM bead size |
| Rotator | Clay Adams | 25477 (American Laboratory Trading) | Nutator Mixer 1105 |
| Sequencing grade modified trypsin | Promega | V5111 | |
| Sodium butyrate | Thermo Scientific | A11079 | |
| Sodium succinate dibasic | Sigma-Aldrich | 14160-100G | |
| SpeedVac vacuum concentrator (1.5 mL microcentrifuge tubes) | Savant | 20249 (American Laboratory Trading) | |
| SpeedVac vacuum concentrator (96-well) | Thermo Scientific | 15308325 | Savant SPD1010 |
| Sterile hood | Thermo Scientific | 1375 | Class II, Type A2 |
| Sulfuric acid (H2SO4) | Fisher Scientific | 02-004-375 | Baker Analyzed ACS reagent |
| Tissue-culture treated 100 mm x 20 mm dish | Fisher Scientific | 08-772-23 | |
| Trichloroacetic acid (TCA) | Thermo Scientific | AC421451000 | Resuspend 100% w/v in HPLC grade water |
| Trifluoroacetic acid (TFA) | Fisher Scientific | PI28904 | Sequencing grade |
| Vacuum manifold 96-well | Millipore | MAVM0960R | |
| Vortex | Sigma-Aldrich | Z258415 | |
| Water bath | Fisher Scientific | FSGPD10 | |
| Wide bore pipet tips 1000 µL | Axygen | 14-222-703 (Fisher Scientific) | |
| Wide bore pipet tips 200 µL | Axygen | 14-222-730 (Fisher Scientific) |
参考文献
- Kapalczynska, M., et al. 2D and 3D cell cultures - a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5-6), 240-249 (2013).
- Kim, J. B. Three-dimensional tissue culture models in cancer biology. Seminars in Cancer Biology. 15 (5), 365-377 (2005).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology (Bethesda). 32 (4), 266-277 (2017).
- Wrzesinski, K., et al. The cultural divide: exponential growth in classical 2D and metabolic equilibrium in 3D environments. PLoS One. 9 (9), 106973 (2014).
- Wrzesinski, K., Fey, S. J. Metabolic reprogramming and the recovery of physiological functionality in 3D cultures in micro-bioreactors. Bioengineering (Basel). 5 (1), 22 (2018).
- Gonda, S. R., et al. Three-dimensional transgenic cell model to quantify genotoxic effects of space environment. Advances in Space Research. 27 (2), 421-430 (2001).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130 (4), 601-610 (2007).
- Tvardovskiy, A., et al. Top-down and middle-down protein analysis reveals that intact and clipped human histones differ in post-translational modification patterns. Molecular and Cellular Proteomics. 14 (12), 3142-3153 (2015).
- Azad, G. K., et al. Modifying chromatin by histone tail clipping. Journal of Molecular Biology. 430 (18), 3051-3067 (2018).
- Kragesteen, B. K., Amit, I. Heads or tails: histone tail clipping regulates macrophage activity. Nature Immunology. 22 (6), 678-680 (2021).
- Dhaenens, M. Histone clipping: the punctuation in the histone code. EMBO Reports. 22 (8), 53440 (2021).
- Anderson, L. C., et al. Analyses of histone proteoforms using front-end electron transfer dissociation-enabled orbitrap instruments. Molecular and Cellular Proteomics. 15 (3), 975-988 (2016).
- Morgan, M. A. J., Shilatifard, A. Reevaluating the roles of histone-modifying enzymes and their associated chromatin modifications in transcriptional regulation. Nature Genetics. 52 (12), 1271-1281 (2020).
- Chan, J. C., Maze, I. Nothing is yet set in (hi)stone: novel post-translational modifications regulating chromatin function. Trends in Biochemical Sciences. 45 (10), 829-844 (2020).
- Jenuwein, T., Allis, C. D. Translating the histone code. Science. 293 (5532), 1074-1080 (2001).
- Fischle, W., et al. Molecular basis for the discrimination of repressive methyl-lysine marks in histone H3 by Polycomb and HP1 chromodomains. Genes and Development. 17 (15), 1870-1881 (2003).
- Onder, O., et al. Progress in epigenetic histone modification analysis by mass spectrometry for clinical investigations. Expert Review of Proteomics. 12 (5), 499-517 (2015).
- Sidoli, S., Cheng, L., Jensen, O. N. Proteomics in chromatin biology and epigenetics: Elucidation of post-translational modifications of histone proteins by mass spectrometry. Journal of Proteomics. 75 (12), 3419-3433 (2012).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nature Structural and Molecular Biology. 18 (1), 91-93 (2011).
- Moradian, A., et al. The top-down, middle-down, and bottom-up mass spectrometry approaches for characterization of histone variants and their post-translational modifications. Proteomics. 14 (4-5), 489-497 (2014).
- Zheng, Y., Huang, X., Kelleher, N. L. Epiproteomics: quantitative analysis of histone marks and codes by mass spectrometry. Current Opinion in Chemical Biology. 33, 142-150 (2016).
- Sidoli, S., Garcia, B. A. Middle-down proteomics: a still unexploited resource for chromatin biology. Expert Review of Proteomics. 14 (7), 617-626 (2017).
- Stampar, M., et al. Hepatocellular carcinoma (HepG2/C3A) cell-based 3D model for genotoxicity testing of chemicals. Science of the Total Environment. 755, 143255 (2021).
- Calitz, C., et al. Toxicity and anti-prolific properties of Xysmalobium undulatum water extract during short-term exposure to two-dimensional and three-dimensional spheroid cell cultures. Toxicology Mechanisms and Methods. 28 (9), 641-652 (2018).
- Garcia, B. A., et al. Chemical derivatization of histones for facilitated analysis by mass spectrometry. Nature Protocols. 2 (4), 933-938 (2007).
- Sidoli, S., et al. Sequential window acquisition of all theoretical mass spectra (SWATH) analysis for characterization and quantification of histone post-translational modifications. Molecular and Cellular Proteomics. 14 (9), 2420-2428 (2015).
- Sidoli, S., et al. Low resolution data-independent acquisition in an LTQ-orbitrap allows for simplified and fully untargeted analysis of histone modifications. Analytical Chemistry. 87 (22), 11448-11454 (2015).
- Karch, K. R., Sidoli, S., Garcia, B. A. Identification and quantification of histone PTMs using high-resolution mass spectrometry. Methods in Enzymology. 574, 3-29 (2016).
- Yuan, Z. F., et al. EpiProfile quantifies histone peptides with modifications by extracting retention time and intensity in high-resolution mass spectra. Molecular and Cellular Proteomics. 14 (6), 1696-1707 (2015).
- Yuan, Z. F., et al. EpiProfile 2.0: a computational platform for processing epi-proteomics mass spectrometry data. Journal of Proteome Research. 17 (7), 2533-2541 (2018).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26 (7), 966-968 (2010).
- Pino, L. K., et al. The Skyline ecosystem: Informatics for quantitative mass spectrometry proteomics. Mass Spectrometry Reviews. 39 (3), 229-244 (2020).
- Aguilan, J. T., Kulej, K., Sidoli, S. Guide for protein fold change and p-value calculation for non-experts in proteomics. Molecular Omics. 16 (6), 573-582 (2020).
- Lex, A., et al. UpSet: Visualization of intersecting sets. IEEE Transactions on Visualization and Computer Graphics. 20 (12), 1983-1992 (2014).
- Shah, S. G., et al. HISTome2: a database of histone proteins, modifiers for multiple organisms and epidrugs. Epigenetics and Chromatin. 13 (1), 31 (2020).
- Xie, Z., et al. Lysine succinylation and lysine malonylation in histones. Molecular and Cellular Proteomics. 11 (5), 100-107 (2012).
- Liu, J., et al. Histone succinylation and its function on the nucleosome. Journal of Cellular and Molecular Medicine. 25 (15), 7101-7109 (2021).
- Howe, F. S., et al. Is H3K4me3 instructive for transcription activation. Bioessays. 39 (1), 1-12 (2017).
- Nicetto, D., Zaret, K. S. Role of H3K9me3 heterochromatin in cell identity establishment and maintenance. Current Opinion in Genetics and Development. 55, 1-10 (2019).
- Wojcik, J. B., et al. Histone H3K27 dimethyl loss is highly specific for malignant peripheral nerve sheath tumor and distinguishes true PRC2 loss from isolated H3K27 trimethyl loss. Modern Pathology. 32 (10), 1434-1446 (2019).
- Sellers, W. R., et al. Next-generation characterization of the cancer cell line encyclopedia. Nature. 569 (7757), 503-508 (2019).
- Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature. 574 (7779), 575-580 (2019).
- Farrelly, L. A., et al. Histone serotonylation is a permissive modification that enhances TFIID binding to H3K4me3. Nature. 567 (7749), 535-539 (2019).
- Chen, Q., et al. ADP-ribosylation of histone variant H2AX promotes base excision repair. The EMBO Journal. 40 (2), 104542 (2021).
- Zheng, Q., et al. Reversible histone glycation is associated with disease-related changes in chromatin architecture. Nature Communications. 10 (1), 1289 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。