Method Article
磷酸浓缩结合无标签定量质谱法研究前列腺癌的 Phosphoproteome
* 这些作者具有相同的贡献
摘要
本协议描述了从前列腺癌细胞系或组织中提取和丰富磷酸肽持的过程,通过质谱法蛋白质组学分析 phosphoproteome。
摘要
Phosphoproteomics 涉及对磷酸化蛋白的大规模研究。蛋白质磷酸化是许多信号转导通路的关键步骤, 是由激酶和磷酸严密调节的。因此, phosphoproteome 的特征可以为肿瘤治疗的新靶点和生物标志物的识别提供见解。质谱为全球检测和量化数以千计的独特磷酸化事件提供了一种方法。然而, 磷酸肽持的丰富程度远远低于非磷酸肽持, 使得生物化学分析更具挑战性。为了克服这种局限性, 需要在质谱分析之前丰富磷酸肽持的方法。我们描述了从组织中提取和消化蛋白质的过程, 然后用抗体基和/或二氧化钛 (2) 为基础, 对酪氨酸和 phosphoserine/苏氨酸 (pST) 肽进行浓缩。浓缩法。用液相色谱-质谱和分析软件对磷酸肽持进行了样品制备和质谱鉴定。
引言
估计有16.5万例新病例和约2.9万人死亡将于2018年发生, 原因是前列腺癌, 这是1美国男性癌症相关死亡的最常见癌症和第二个主要原因。早期前列腺癌可通过切除或放疗治疗器官受限疾病, 其中十年复发率为20% 和40% 的病人谁接受前列腺切除术, 30% 和50% 之间的病人谁接受辐射治疗2。由于前列腺癌依赖雄激素信号促进生长, 手术和化学阉割疗法也被用于高危患者。然而, 复发发生时, 癌症不再对雄激素剥夺治疗的反应证明由生物化学复发, 其中前列腺特异抗原的血清再次上升。在这一进展中, 转移也经常被检测到。这一先进的阶段, 称为转移性去势抗前列腺癌, 代表的致命形式的疾病, 其中的预后是平均生存时间少于两年3。晚期疾病中很少有治疗选择, 包括第二代 antiandrogens, 如 enzalutamide 和阿比特龙, 以及以紫杉为主的化疗, 如多西紫杉醇。尽管有可用的治疗方法, 这种疾病经常会进展。因此, 新的治疗方式的发现和发展对改善前列腺癌晚期患者的护理是必要的。
以质谱 (MS) 为基础的方法通过检测成百上千的多肽分析4, 提供了对蛋白质组的全球解析。特别是, 发现蛋白质组学, 也称为数据依赖获取 (DDA), 可以产生的鉴定和定量的数以千计的肽4,5。基于 MS 的发现蛋白质组学可以进一步界定为自上而下的蛋白质组学, 其中完整的蛋白质特征, 并自下而上 (也称为猎枪) 蛋白质组学, 其中肽分析的特点蛋白质5。因此, 在猎枪蛋白质组学中, 在 MS 分析前的样品制备过程中, 蛋白质的降解步骤是将蛋白分解成多肽。最后, 进行数据库搜索, 将多肽重新映射到蛋白质以进行识别。无标签以及几种同位素标记 [例如, 细胞培养 (SILAC) 中氨基酸的稳定同位素标记] 方法可用于定量比较6、7样品之间的肽。虽然同位素标记技术是黄金标准, 无标签的方法已经证明了类似的量化准确度8,9 , 并有可比的权衡灵敏度和特异性10。无标签定量提供了更多的覆盖率和允许比较更多的样本, 而基于标签的方法受成本和复用容量6、7、8的限制。
此外, 猎枪 MS 也可以用来审问后翻译修改 (PTMs), 如磷酸化11。由于磷酸肽持的化学计量学性质与总肽相比, 采用多种方法丰富磷酸肽持, 包括免疫沉淀抗体为基础的酪氨酸肽、二氧化钛 (2) 和固定化金属亲和层析 (IMAC)5,12。由于蛋白质磷酸化是许多细胞信号通路的关键步骤, 猎枪 phosphoproteomics 允许研究人员研究不同癌症的细胞信号变化, 包括乳房13、前列腺14、肾脏15、和卵巢,16,17 , 以更好地了解癌症生物学和确定潜在的新的治疗目标。
这个无标签猎枪 phosphoproteomic 方法是建立和完善的基础上的工作由 Graeber 组18,19,20。该协议首先描述了蛋白质和磷酸从组织到多肽的提取和消化。然后, 我们详细地利用特异的酪氨酸抗体和2。我们还描述了 phosphoserine/苏氨酸 (pST) 肽使用强阳离子交换 (SCX) 的富集, 其次是2。该协议最后将样本提交到 ms 设备, 并使用 ms 分析软件来识别和量化磷酸肽持及其相应的磷酸。这个协议的应用可以扩展到前列腺癌以外的其他癌症和肿瘤以外的领域。
研究方案
根据国立卫生研究院的指导方针, 罗格斯大学机构动物护理和使用委员会批准了使用异种肿瘤的实验。
1. 蛋白质提取
- 准备溶解缓冲液 (表 1)。(体积取决于要收割的样品数量。对于体外细胞样本, 继续步骤1.2。对于肿瘤组织, 继续步骤1.3。
-
收获细胞
- 收集的细胞在50毫升圆锥管和旋转他们在 700 x g 5 分钟在4摄氏度。扔掉上清, 把小球放在冰上。重复这一步骤, 所有的菜肴, 以收集细胞成一个颗粒。(通常, 大约有5个近汇合的15厘米的细胞是需要5毫克的蛋白质, 但这可能是依赖于细胞线, 需要由每个调查员的经验判断。
- 用30毫升的冷冻磷酸盐缓冲盐水 (pbs) 清洗颗粒, 在 700 x g 处旋转5分钟, 然后在吸光 pbs 前进行4摄氏度。添加1.5 毫升的裂解缓冲液, 每5毫克的蛋白质用于细胞颗粒。吸管了几次。跳到步骤1.4。
-
收获组织
- 在试管中, 每100毫克的组织中都要加2毫升的冰冷裂解缓冲液来称量肿瘤。(通常需要50到150毫克的组织湿重。
- 融汇使用手持或台式均质机 (脉冲2x 十五年代) 进行裂解。在第一样品前和样品之间用10% 漂白剂、70% 乙醇和去离子水连续清洗匀质机。
- 为了减少和烷基化, 将匀质样品加热95摄氏度, 5 分钟。然后在冰上冷却15分钟。在冰, 油脂实验裂解 3x (即, 脉冲三十年代与六十年代暂停在脉冲之间)。样品不应该是粘性或块状在这一点上。将裂解液加热95摄氏度, 5 分钟21。
- 用摆动斗转子在 3500 x g 处用15°c 将裂解液离心在同一超声波管中, 15 分钟. 收集上清液并丢弃颗粒。
- 通过执行布拉德福德化验22确定蛋白质浓度。如有必要, 可将裂解液稀释至5毫克/毫升, 溶解缓冲。储存在-20 摄氏度。
注意: 实验可以在这里暂停。将样品冷冻-80 摄氏度, 以后再继续。
2. 裂解消化
- 用100毫米 (pH = 8.5) 稀释样品12倍, 以减少胍的用量。将所有样品稀释到同一体积, 以尽量减少不均匀消化的影响。保存12.5 µg 的未消化的裂解剂, 以确认它在考马斯染色的凝胶23。
- 对5毫克蛋白质, 加入10µg 赖氨酰内肽酶 (赖氨酸 C), 并在室温下孵化 5-6 h. 通过添加8.0 米 untitrated 三 (ph ~ 1) 调整 pH 值为11。
- 准备1毫克/毫升的 L-1-tosylamido-2-phenylethyl 氯甲基酮 (TPCK) 处理胰蛋白酶在1毫米 HCl (20 毫米 CaCl2)。加入胰蛋白酶在1:100 胰蛋白酶: 蛋白质比率和孵化它在37°c 3 小时。
- 添加与步骤2.3 中相同数量的新鲜胰蛋白酶。孵化它在37°c 过夜。
- 保存12.5 µg 的消化裂解剂, 以确认完全消化考马斯染色凝胶23。
3. 反相萃取
- 记录裂解量。使用15毫升 10 kDa 截止过滤器筛选样品。离心样品在 3500 x g 使用摇摆斗转子 (或 3500 x g 在一个固定的角度转子) 在15°c, 直到 retentate 容量小于250µL (这采取大约 45-60 分钟)。收集流程并丢弃 retentate。
注意: 实验可以在这里暂停。将样品冷冻-80 摄氏度, 以后再继续。 - 为了酸化样品, 添加大约20µL 的5% 三氟乙酸酸 (TFA) 每毫升的裂解液。用 ph 条将它们混合均匀, 并测量样品 ph 值。使用 5% TFA 将 pH 值调整为2.5。
- 将 C-18 列的较短端连接到真空流形。设置真空度介于17和34帕 (或根据制造商的指示)。使用玻璃吸管, 湿柱与3毫升100% 乙腈 (ACN)。不要让柱子干。
- 使用玻璃吸管, 平衡6毫升 0.1% TFA 应用于 2x 3 毫升的柱。将酸化样品加载到该列中。一次不要添加超过3毫升。将真空度调整到每秒1到2滴。
- 使用玻璃吸管, 用9毫升 0.1% TFA, 用 3x 3 毫升清洗柱。洗脱2毫升 40% ACN, 0.1% TFA 的柱。将两个2毫升的分数收集到玻璃培养管中。丢弃该列。
- 用20G 针覆盖洗脱液管和 parafilm, 在盖子上打 3-5 孔。在干冰上冷冻洗脱液至少30分钟, 直到它完全固体。
- Lyophilize 一夜之间的分数。在第二天, 确保样品在停止冻干机之前完全干燥。把管子放在50毫升圆锥管里, 用精致的湿巾在-80 摄氏度。
注意: 实验可以在这里暂停。
4. 免疫沉淀肽24的富集
- 并用重悬冻干粉与0.5 毫升冰冷免疫沉淀 (IP) 结合缓冲器在每一个分数。通过将0.5 毫升泥沙体积从第二个分数转移到第一个分数, 并保存吸管尖端, 将分数池。大力涡流 (而不是吹打上下), 以确保样品完全溶解之前, 把它转移到一个3.6 毫升螺钉帽 cryotube。
- 与步骤4.1 中一样, 在每个管中用另外0.5 毫升的 IP 绑定缓冲器 (表 1) 冲洗冻干管。使用相同的吸管尖端将溶液转移到3.6 毫升螺钉盖管, 以尽量减少样品损耗。重复冲洗 1x, 使最终泥沙体积2毫升 (5 毫克的蛋白质)。测量样品 pH 值, 以确保它大约是7.4。如果它太酸性, 迭代添加10µL 1M 三 (untitrated, pH 值 ~ 11)。如果它太基本, 迭代添加10µL 稀释 HCl (1:25 或 1:100)。
-
预洗 (5 毫克起动裂解液)
- 每个样品需要25µg 4G10 抗体和12.5 µg 27B10.4 抗体。在使用 p200 吸管和切尖将抗体转移到单独的离心管后, 用450µL 冰冷的 IP 结合缓冲器2x 清洗抗体。离心他们在 100 x g 1 分钟在4摄氏度和吸出上清。
- 用 IP 绑定缓冲器将珠子并用重悬到0.5 毫克/毫升的库存浓度。(不要旋涡珠。在 aliquoting 了必要的泥浆 (50 µL 4G10 抗体浆和25µL 27B10.4 抗体浆每样品) 入一根管子, 在 200 x g 向下转动存货离心管为1分钟在4°c。在把珠子放到冰箱里储存之前, 用上清洗壁。
- 在螺钉盖 cryotubes 中添加预洗的悬浮珠以解决样品溶液。在一夜之间在一端端的转子上孵化4摄氏度。
- 将螺钉盖 cryotubes 在50毫升离心管内, 内衬有精致的擦拭。在 100 x g 的珠子上旋转1分钟保存上清, 这将用于丰富的 pST 肽。(pST 的浓缩从步骤7开始, 并且可以并行地执行到. 肽处理)。
- 并用重悬300µL IP 绑定缓冲区的珠子。把它们转移到一个2毫升的离心管, 并将它们在 100 x g 处旋转1分钟, 在4摄氏度。
- 用200µL 的 IP 绑定缓冲器冲洗孵化管3x。每次将内容传送到同一离心管。然后把它们旋转下来。
- 用500µL 的 IP 绑定缓冲器将离心管中的珠子洗净, 并在 100 x g 处旋转1分钟。然后洗珠4x 与450µL 25 毫米 NH4HCO3, pH 7.5, 并旋转他们在 100 x g 1 分钟. 使用新鲜的25毫米 NH4HCO3解决方案从粉末每次。
- 离心的珠子在 1500 x 克为1分钟. 使用凝胶加载尖端, 通过将凝胶加载尖端的尖端浸在微珠表面下面, 完全去除上清液。
- 添加4x 的珠体积 0.1% TFA 到珠 (即, 添加300µL 0.1% TFA 75 µg 的无水珠浆)。混合好, 并孵化的混合物在一个 thermomixer 在 1000 rpm 15 分钟, 在37摄氏度。
- 将泥沙传输到0.2 µm 旋转滤镜。快速旋转洗脱管, 并将剩余体积转移到同一个旋转过滤器使用 P10 吸管。旋转过滤器在 850 x g 1 分钟转移洗脱到低蛋白结合离心管。真空浓缩洗脱液干燥隔夜在40°c 和以300分钟的热时间。
注意: 实验可以在这里暂停。将样品冷冻-80 摄氏度, 以后再继续。
5. 二氧化钛富集25肽
- 并用重悬干燥的磷酸肽持在200µL 50% ACN, 0.1% TFA。漩涡和离心机他们在 1万 x g 三十年代. 重复这 1x, 并用重悬他们好。
- 准备2珠包含的提示, 有能力为200µL 样品。
- 轻轻敲击笔尖的小尖端, 将材料移动到该端。通过添加200µL 100% ACN, 然后将尖端翻转, 然后轻轻地将液体移向瓶盖, 冲洗尖端。
- 使用剃刀刀片, 切小尖端的尖端, 并把它放在低蛋白结合管。(避免使用聚苯乙烯管, 因为 TiO2 将坚持在管的两侧。卸下瓶盖并插入微以取出剩余的 ACN。重复洗200µL 100% ACN。TiO2 珠现在位于低蛋白结合管为以下步骤。
- 先决条件2与500µL 100% ACN 2x。吸管把珠子和溶剂混合在一起。离心 100 x g 1 分钟。
- 条件2与500µL 0.2 米磷酸钠缓冲 (pH 值 7) 2x。用300µL 平衡缓冲器3x 清洗珠子。因为2的密度很大, 珠子很快就会安定下来。
- 添加400µL 50% ACN, 0.1% TFA 到低蛋白结合管, 其次是添加84µL 乳酸。将悬浮磷酸肽持转移到低蛋白结合管中, 并在室温下用端头转子孵化1小时。
- 离心的珠子在 100 x g 1 分钟, 以颗粒。用300µL 的平衡缓冲器 (表 1) 将它们洗净, 然后在 100 x g 处旋转1分钟。
- 用300µL 漂洗缓冲器2x 冲洗珠子。将它们传输到0.2 µm 旋转滤波器。旋转 1500 x g 1 分钟。
- 将过滤单元转移到清洁的1.5 毫升低蛋白结合管。洗脱内容2x 与200µL 0.9% NH3在 H2o 测量 ph 值带, 应该在10和11之间。真空浓缩洗脱液干燥一夜, 蒸发氨水。
6. 淡化多肽用于 MS 分析
- 用涡流的15µL TFA 重建磷酸肽持, 在三十年代离心 1万 x g 并用重悬。重复这 1x, 以并用重悬他们好。不要把吸管向上和向下。
- 使用具有5µg 绑定容量的 C-18 尖端清洁样品, 并按照制造商的协议进行。
- 用真空浓度完全干燥洗脱量。这需要 1-2 小时并用重悬磷酸肽持在12.5 µL 的质谱溶液中 (见表 1) (或如研究者的 MS 蛋白质组核心设施所推荐)。涡旋, 并简要地旋转的解决方案在 1万 x g 三十年代. 重复这 2x, 以并用重悬他们好。样品已准备好提交到质谱设备 (步骤 11)。
注意: 以下步骤仅与 pST 肽浓缩有关。
7. pST 多肽的反相萃取
- 通过执行肽测定, 测量从步骤4.6 获得的上清液的肽浓度。一个足够的数量为 pST 质谱是2.5 毫克。
- 将 pH 值调整为 3.5, 用 5% TFA。
- 将 C-18 列的较短端连接到真空流形。设置真空度介于17和34帕 (或根据制造商的指示)。用3毫升 100% ACN 的柱湿。不要让柱子干。
- 平衡6毫升 0.1% TFA 的柱, 应用 2x 3 毫升。将酸化样品加载到该列中。一次不要添加超过3毫升。将真空度调整为目标每秒 1-2 滴。
- 用9毫升 0.1% TFA, 用 3x 3 毫升清洗柱。洗脱2毫升 40% ACN, 0.1% TFA 的柱。将两个2毫升的分数收集到玻璃培养管中。丢弃该列。
- 用20G 针覆盖洗脱液管和 parafilm, 在盖子上打 3-5 孔。在干冰上冷冻洗脱液至少30分钟, 直到它完全固体。
- Lyophilize 一夜之间选定的分数。在第二天, 确保样品在停止冻干机之前完全干燥。把管子放在50毫升圆锥管里, 用精致的湿巾在-80 摄氏度。
注意: 实验可以在这里暂停。
8. pST 肽的强阳离子交换 (SCX)
- 并用重悬2毫升的冻干肽 (表 1)。为每个示例池中的分数。(解决方案将是多云的。
- 准备真空歧管。将 SCX 列连接至3毫升注射器, 并将柱塞移除。设置真空度介于17和34帕 (或根据制造商的指示)。
- 条件 SCX 柱与4毫升的 ACN, 其次是4毫升的缓冲 A。
- 从步骤8.1 加载2毫升的样本, 并立即收集洗脱液。负载3毫升 A: B (80.9: 19.1) 缓冲器并收集洗脱液。将每个样品的 eluates, 整除成2毫升低蛋白结合管。
- 真空浓缩所有样品直到大约30% 容量遗骸。(此步骤大约需要 2-4 小时)。将整除数成1低蛋白结合管, 用于每个样品。
- 将 C-18 列的较短端连接到真空流形。设置真空度介于17和34帕 (或根据制造商的指示)。用3毫升 100% ACN 2x 的柱湿。不要让柱子干。
- 平衡3毫升 0.1% TFA 2x 的柱。将该示例加载到该列中。一次不要添加超过3毫升。将真空度调整为目标每秒 1-2 滴。
- 用3毫升的 0.1% TFA 2x 清洗柱。洗脱4毫升 50% ACN, 0.1% TFA 的柱。
9. 二氧化钛对 pST 多肽的富集
-
准备2珠包含的提示, 有能力为200µL 样品
- 轻轻敲击笔尖的小尖端一侧, 将珠子移动到该端。取下瓶盖, 将珠子倒入聚丙烯15毫升锥形管中。
- 通过添加200µL 100% ACN, 将尖端翻转几次, 然后轻轻地将液体移向瓶盖, 冲洗尖端。使用剃刀刀片, 切断尖端的小尖端, 并把它放在聚丙烯15毫升圆锥管。卸下瓶盖并插入微以取出剩余的 ACN。重复洗200µL 100% ACN。2珠现在位于15毫升圆锥管为以下步骤。
- 先决条件2与500µL 100% ACN 2x。吸管把珠子和溶剂混合在一起。离心 100 x g 1 分钟。
- 条件2与500µL 0.2 米磷酸钠缓冲 (pH 值 7) 两次。用300µL 平衡缓冲器3x 清洗珠子。
- 将洗脱磷酸肽持转移到聚丙烯15毫升锥形管中。添加560µL 的乳酸, 并在室温下用端头转子孵化1小时。
- 离心的混合物在 100 x g 1 分钟颗粒珠。用300µL 平衡缓冲器 (表 1) 3x 清洗。在 100 x g 处旋转1分钟。
- 用300µL 漂洗缓冲器2x 冲洗珠子。将它们传输到0.2 µm 旋转滤波器。在 1500 x g 处旋转1分钟。
- 将过滤单元转移到清洁的1.5 毫升低蛋白结合管。洗脱内容2x 与200µL 0.9% NH3在 H2O。让解决方案坐在磷酸肽持2分钟, 然后再洗。测量 pH 值, 这应该介于10和11之间。
- 真空浓缩洗脱液干燥一夜, 蒸发氨水。
10. 淡化 pST 多肽用于 MS 分析
- 轻轻敲击笔尖的小尖端, 将材料移动到该端。通过添加200µL 100% ACN, 然后将尖端翻转, 然后轻轻地将液体移向瓶盖, 冲洗尖端。
- 使用剃刀刀片, 切小尖端的尖端, 并把它放在聚丙烯15毫升圆锥管.卸下瓶盖并插入微以取出剩余的 ACN。重复洗200µL 100% ACN。TiO2 珠现在位于聚丙烯15毫升圆锥管为以下步骤。
- 使用具有100µg 绑定容量的 C-18 尖端清洁样品. (按照制造商的说明操作)
- 用真空浓度完全干燥洗脱量。这需要 1-2 小时。
- 并用重悬12.5 µL 质谱溶液中的干磷酸肽持 (或研究者的 MS 蛋白质组学核心设施的推荐)。漩涡和离心机他们在 1万 x g 三十年代. 重复2x 并用重悬。(不要上下吸管。
11. 质谱分析
- 使用推荐的设置, 将样品提交到 MS 蛋白质组核心设施中, 以执行液相色谱-串联 ms (LC-ms)。示例设置如下 (请参见表 2中的摘要):
- 将样品的5µL 到陷印柱上 (2 厘米长 x 75 µm 直径), 并用 0.1% TFA 将其清洗为5分钟, 流速为5µL/分钟。
- 将该陷阱与一个纳米分析柱 (20 厘米 x 75 µm) 配合使用, 其流速为 300 nL/分钟。
- 分段线性梯度 (百分比0.16% 甲酸, 80% ACN 0.2% 甲酸) 是不同的在和 pST 样品:
- 对于洗脱样本, 它们使用 4-15% 的渐变, 5 分钟, 15-50%, 40 分钟, 50-90% 在5分钟内。
- 对于 pST 示例, 洗脱使用 4-15% 的渐变, 30 分钟, 15-25%, 40 分钟, 25-50%, 44 分钟, 50-90% 在11分钟内。
- 获取与数据相关的采集模式中的 MS 数据, 该循环系列完全扫描的分辨率为 12万, 后跟 ms/毫秒 (HCD, 相对碰撞能量 27%) 的20最强离子和动态排除期间二十年代。
- ms 运行完成后, 将 ms 原始文件导入 ms 分析软件程序, 以识别和量化磷酸肽持。(MaxQuant 软件8,26,27被使用在这个实验中。除非在表 3中指定, 否则使用了默认设置。
结果
本协议详细描述了蛋白质提取和消化的方法, 其次是磷酸浓缩和随后的 MS 分析 (图 1)。表 1列出了本协议中使用的所有缓冲区和解决方案的组成。赖氨酸 C 和胰蛋白酶的顺序使用提供了有效的消化。考马斯染色凝胶的预消化裂解剂证实了蛋白质的存在, 而染色后消化的裂解酶证实完全消化 (图 2A)。对于完全消化, 不应出现 15 kDa 以上的带, 除了 30 kDa 和 23.3 kDa 带为赖氨酸 C 和胰蛋白酶, 分别。添加赖氨酸 C 也减少了错过分裂的数量 (图 2B)。由于 phosphoproteome 肽仅占免疫沉淀的 2%,因此, 使用一项特定的抗体, 对该肽进行了多肽富集的第一步。结果上清液成为 pST 肽富集的输入。免疫沉淀有效地分离了从 pst 多肽的磷酸肽持肽, 其中平均85% 的99% 确定从从上到上的准备是的 (图 3A), 并从 pST 制剂中确定的磷酸肽持中, 已有超过是pST (图 3B)。在两种制剂中, 二氧化钛被用来丰富磷酸肽持。正在磷酸化的 MS 准备中的肽的预期百分比在 30-50% 之间 (图 4A)。磷酸富集率的变异性可能会更大, 因为有许多比 pST 多肽更少的。就磷酸物种而言, 检测到的大多数磷酸肽持都有一个或双磷组 (图 4B)。
在进行质谱分析后, ms 原始文件被加载到 ms 解析软件中。实验中使用的参数设置列在表 3中, 但从软件到软件的不同, 可能会因版本而异。未列出的参数被保留为默认值, 包括罗斯福截止1% 的肽谱匹配 (PSM), 最小的仙女座评分为 40, 用于鉴定改性肽27。设置一个大于0.75 的本地化概率截止率, 分别筛选出大约5% 的内、15% 和34% 的 pS 和 pT 多肽 (图 5A)。应用这些过滤器后, 在 MS 分析结束时, 预期的磷酸识别数约为300的无尾肽 (起始蛋白的5毫克) 和约 7500 pS 肽和 640 pT 肽 (起始肽的2.5 毫克数量) 从各自的浓缩准备 (图 5B)。复制的数量和磷酸信号强度的可变性决定了统计比较的足够电源。在四个单独的实验中, 含有生物重复或 triplicates 的基团, 计算了检测磷酸肽持的变异系数 (%CV)。低变异性分布 (如图 5C中的 pST 组 1-5) 表明, 样品的收集、制备和质谱检测是一致的。另一方面, 更高可变性的分布 (例如图 5C中的 pST 6 组) 表明了需要较大的折变来检测下游差异分析中的显著差异的嘈杂数据。
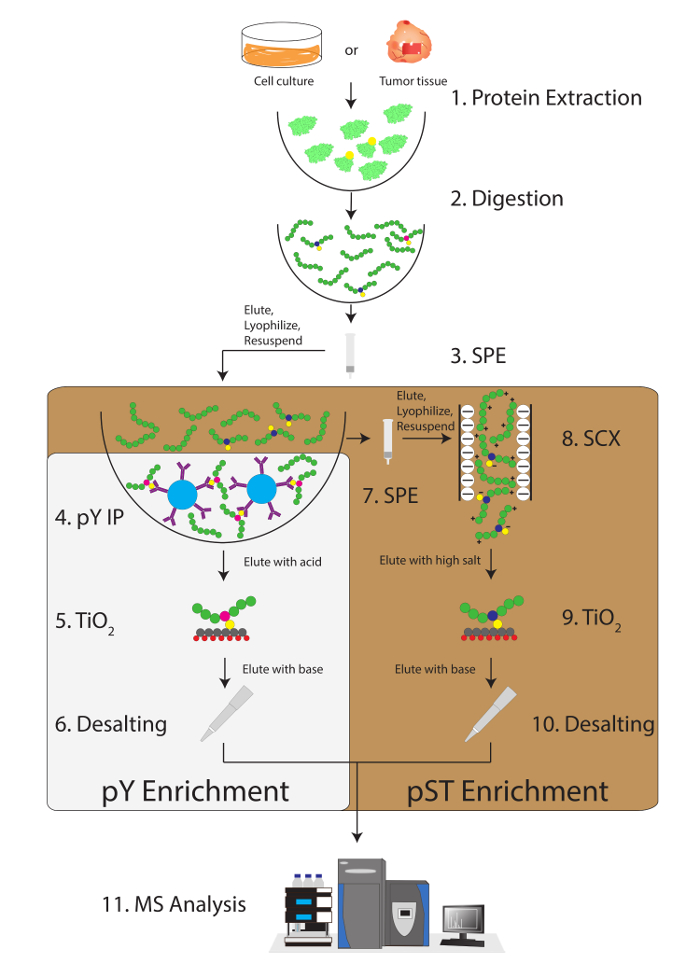
图 1: 工作流关系图.提取和消化样品中的蛋白质。用固相萃取 (SPE) 提取多肽, 并 immunoprecipitated 酪氨酸肽。同时, phosphoserine/苏氨酸 (pST) 肽从上清在免疫沉淀步骤中丰富。在上清上进行强阳离子交换 (SCX), 去除高电荷的肽, 以减少离子抑制12。两种制剂均通过二氧化钛 (2) 进行磷酸浓缩。在样品清除后, 进行液相色谱-串联质谱 (LC-ms) 测定磷酸丰度。然后将原始数据加载到 MS 分析软件中以识别磷酸肽持。请单击此处查看此图的较大版本.
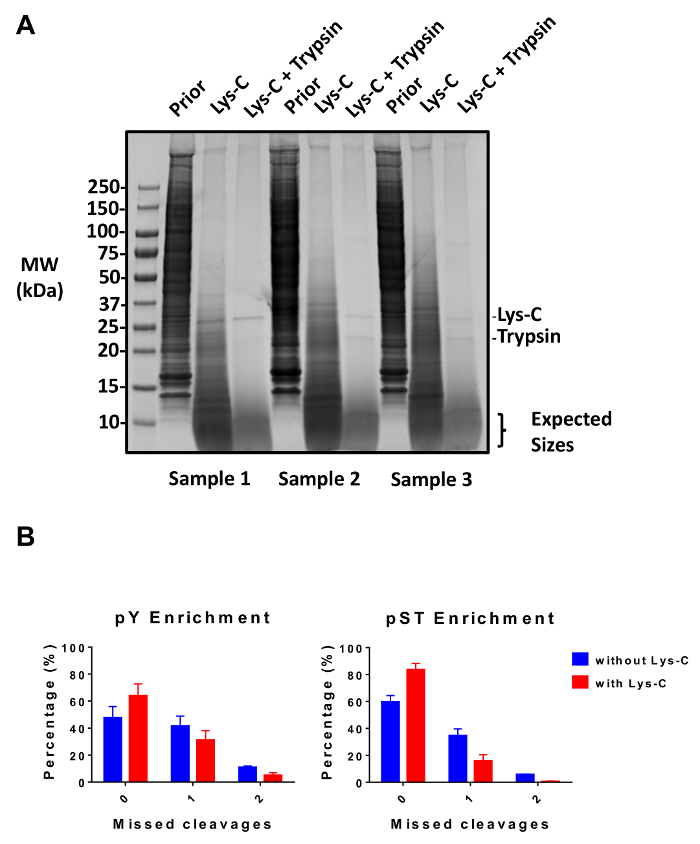
图 2: 消化的评估.(A) 三例, 12.5 µg 的裂解前消化, 后赖氨酸 C 消化, 和后胰蛋白酶消化显示。考马斯凝胶染色试验表明, 在连续使用赖氨酸 C 和胰蛋白酶后, 可以进行清洁消化。分子量 (兆瓦) 大小标记在 kilodaltons (kDa)。(B)在添加了赖氨酸 C 后, 观察到分裂的减少。磷酸肽持不漏分裂的百分比从48% 增加到 64%, 平均为60% 至 84%, 分别为去和 pST 浓缩制剂。图中总结了两项实验所得的数据, 不带赖氨酸 c 和五实验进行。误差线是标准偏差, 代表38和 38 pST 样本从2个独立实验 (不带赖氨酸 c) 和62和 60 pST 样本从5个单独的实验 (与赖氨酸 c)。请单击此处查看此图的较大版本.
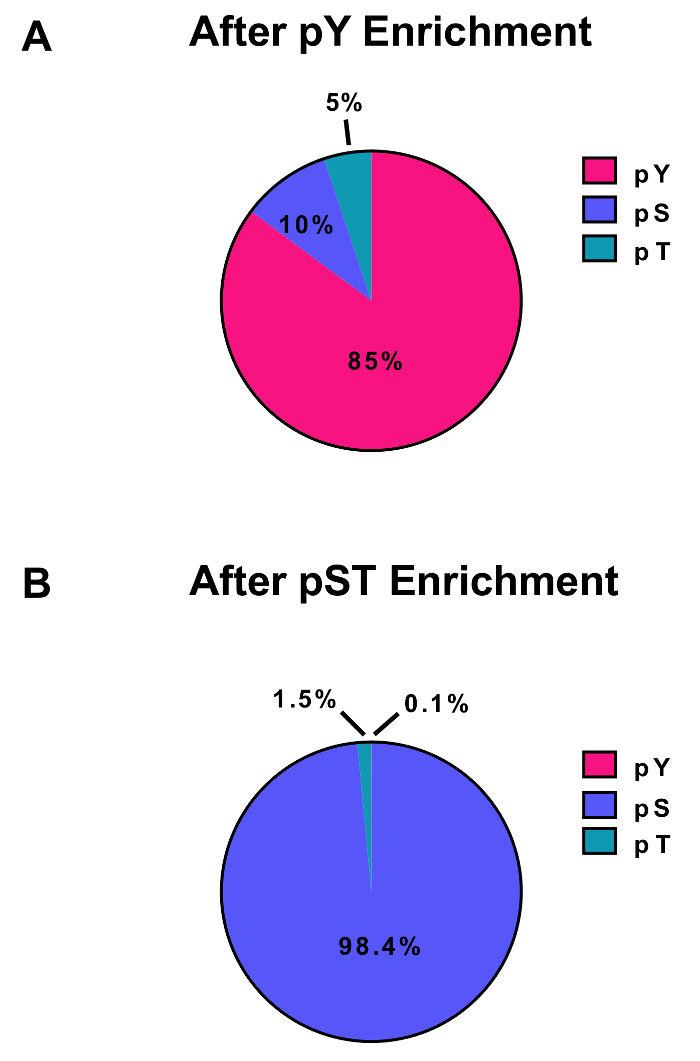
图 3: 磷酸肽持和 pST 的富集.这些面板显示 pSTY 磷酸肽持的百分比 (A) 或 (B) pST 浓缩准备。免疫沉淀和二氧化钛对磷酸肽持的富集产生了85% 的磷酸肽持, 而在 pST 富集中, 只有0.1% 是对的。这些值是从检查磷 (猪圈) 站点的一个代表性实验中提取的, 在过滤掉污染物、反转序列和磷酸肽持时, 其定位概率小于0.75。请单击此处查看此图的较大版本.

图 4: 用二氧化钛磷酸富集.(A) 四项单独试验中检测到的磷酸肽持 (相对于总肽) 的百分比。(B) 本小组在四项单独实验中显示单、双和多磷酸化肽的平均组成。面板A中的误差条是标准偏差。请单击此处查看此图的较大版本.

图 5: 预期的 phosphoresidue 标识.(A) 本小组显示了 IDs 的磷酸化定位概率 (左) 和 pST 富集 (右)。符合 > 0.75 概率截止率的 IDs 的平均百分比分别为93%、75% 和52%。(B) 具有 > 0.75 定位概率的 IDs 的平均数量为 300, 7500 为 pS, 640 为 pT。(C) 这个小组显示了磷酸肽持的变化系数 (%CV) 的小提琴图。只有在每个生物复制或三个组中检测到信号强度值时, 才会对%CV 进行评估。数据取自四项独立实验。面板 A 和B中的误差线是来自 4个独立实验的34和 34 pST 样本的标准偏差。请单击此处查看此图的较大版本.
| 缓冲区 | 体积 | 组成 | |
| 6米胍氯裂解缓冲液 | 50毫升 | 6米胍氯, 100 毫米三 pH 8.5, 10 毫米三 (2-羧乙基) 膦, 40 毫米氯乙酰胺, 2 毫米钠原钒酸, 2.5 毫米焦磷酸钠, 1 毫米β甘油, 500 毫克正辛苷, 超纯水到体积 | |
| 100毫米焦磷酸钠 | 50毫升 | 2.23 克焦磷酸钠碳酸钠, 超纯水容积 | |
| 1M β甘油 | 50毫升 | 15.31 克β甘油, 超纯净水容量 | |
| 5% 三氟乙酸酸 | 20毫升 | 将1毫升100% 三氟乙酸酸加入19毫升超纯水中 | |
| 0.1% 三氟乙酸酸 | 250毫升 | 添加5毫升5% 三氟乙酸酸到245毫升超纯水 | |
| 洗脱缓冲液 | 250毫升 | 0.1% 三氟乙酸酸, 40% 乙腈, 超纯水容积 | |
| pST 洗脱缓冲 | 250毫升 | 0.1% 三氟乙酸酸, 50% 乙腈, 超纯水容积 | |
| IP 绑定缓冲区 | 200毫升 | 50毫米三 pH 7.4, 50 毫米氯化钠, 超纯水到容积 | |
| 25毫米碳酸氢铵, pH 值7。5 | 10毫升 | 溶解19.7 毫克到10毫升无菌的超纯净水, pH 值7.5 与 1 N 盐酸 (~ 10-15 µL/10 毫升溶液), 使新鲜 | |
| 1M 磷酸酯缓冲液, pH 值7 | 1000毫升 | 423毫升1米磷酸二氢钠, 577 毫升1米磷酸氢钠 | |
| 平衡缓冲器 | 14毫升 | 6.3 毫升乙腈, 280 µL 5% 三氟乙酸酸, 1740 µL 乳酸, 5.68 毫升超纯净水 | |
| 冲洗缓冲器 | 20毫升 | 9毫升乙腈, 400 µL 5% 三氟乙酸酸, 10.6 毫升超纯净水 | |
| 质谱溶液 | 10毫升 | 500µL 乙腈, 200 µL 5% 三氟乙酸酸, 9.3 毫升超纯水 | |
| 缓冲区 A | 250毫升 | 5毫米钾盐磷酸盐 (pH 2.65), 30% 乙腈, 5 毫米氯化钾, 超纯水容积 | |
| 缓冲 B | 250毫升 | 5毫米钾盐磷酸盐 (pH 2.65), 30% 乙腈, 350 毫米氯化钾, 超纯水容积 | |
| 0.9% 氢氧化铵 | 10毫升 | 300 ul 29.42% 氢氧化铵, 9.7 毫升超纯净水 | |
表 1: 缓冲区和解决方案.下表显示了此协议中使用的缓冲区和解决方案的组成。
| LC/ms 设置 | ||
| 参数 | 设置 | pST 设置 |
| 样品装载 (µL) | 5 | |
| 加载流量 (µL/分钟) | 5 | |
| 梯度流速 (nL/分钟) | 300 | |
| 线性梯度 (百分比0.16% 甲酸, 80% ACN 在0.2% 甲酸) | 4-15% 5 分钟 | 4-15% 30 分钟 |
| 15-50% 40 分钟 | 15-25% 40 分钟 | |
| 50-90% 5 分钟 | 25-50% 44 分钟 | |
| 50-90% 11 分钟 | ||
| 完全扫描分辨率 | 12万 | |
| 选择的最强烈的离子的数量 | 20 | |
| 相对碰撞能量 (%)HCD | 27 | |
| 动态排除 (s) | 20 | |
表 2: LC MS 设置.这是一个典型的猎枪 phosphoproteomic 实验中 LC MS 设置的例子。示例加载到陷印列。这个陷阱被带入一个分析柱的线。这些设置为使用材料和试剂表中列出的 LC MS 系统进行了优化。这些设置需要对其他 LC MS 系统进行调整。
| MaxQuant 参数设置 | ||
| 设置 | 行动 | |
| 组特定参数 | ||
| 类型 | 类型 | 选择标准 |
| 多样性 | 设置为1 | |
| 消化方式 | 酶 | 选择胰蛋白酶/P |
| 麦克斯。错过分裂 | 设置为2 | |
| 修改 | 变量修改 | 添加磷 (猪圈) |
| 无标签量化 | 无标签量化 | 选择 LFQ |
| LFQ 最小比率计数 | 设置为1 | |
| 快速 LFQ | 退房 | |
| 杂项 | 重新量化 | 退房 |
| 全局参数 | ||
| 序列 | FASTA 文件 | 选择从 UniProt 下载的 fasta 文件 |
| 修正修改 | 添加 Carbamidomethyl (C) | |
| 标识 | 在运行之间匹配 | 退房 |
| "匹配时间" 窗口 | 设置为5分钟 | |
| 对齐时间窗口 | 设置为20分钟 | |
| 匹配未识别的功能 | 退房 | |
| 蛋白质量化 | 最小比率计数 | 设置为1 |
| 文件夹位置 | 相应地修改 | |
表 3: MS 分析软件设置.在 MaxQuant 中, 选择或调整此表中的组特定和全局参数。所有其他参数仍处于默认状态。这些实验是使用1.5.3.30 版本进行的。这些参数可能会因版本和软件而异。
讨论
在使用此协议来丰富磷酸肽持之前, 仔细考虑实验设计是至关重要的。使用生物复制比技术复制更符合成本效益地使用质谱资源。必要的复制数将部分取决于数据的可变性。最近的一项研究表明, 虽然增加三以外的复制数量只会略微增加身份证明的数量, 但各组之间的显著标识数量则随着更多的复制10而增加。
由于细胞中磷酸的丰度较低, 在发现模式下, 从前列腺癌样品中获得一个全球 phosphoproteome 需要足够的起始蛋白质量。在这些实验中, 使用了5毫克的蛋白质。大约五个接近汇合的 15 cm 细胞提供足够的蛋白质作为输入到这个协议, 虽然这将是细胞线依赖性。至于肿瘤组织, 蛋白质的预期产量约为组织重量的 6-8%。在体外设置中, 要考虑的阳性对照样品是在收获细胞前加1毫米钒酸盐30分钟。钒酸是一种具有竞争性的蛋白质 phosphotyrosyl 磷酸酶抑制剂, 它将保持酪氨酸磷酸化, 从而增加了肽鉴定的数量29。
清洁消化是最大限度磷酸识别的关键步骤。除了考马斯染色试验, 数据中遗漏的分裂的百分比可以用来评估消化效率 (图 2)。质量控制软件可用来分析遗漏的分裂和其他指标, 以评估 MS 数据质量30。虽然胰蛋白酶是最常见的, 可供选择的蛋白酶5 , 以解决覆盖范围的差距, 在蛋白质组的最佳胰蛋白酶肽不能生成31。然后需要对 MS 分析软件的设置进行相应的修改, 以调整蛋白酶的变化。
该协议采用免疫沉淀 (为无菌富集) 以及二氧化钛 (2), 以丰富磷酸肽持。丰富的多肽的替代方法包括固定化金属亲和层析 (IMAC), 其他金属氧化物的金属氧化物亲和层析 (MOAC), 如氢氧化铝, 和聚合物为基础的金属离子亲和捕获 (PolyMAC)5,12。以往的研究表明, 不同的浓缩方法丰富的不同人群的磷酸肽持32。例如, IMAC 丰富了更多的多磷酸化肽, 而 MOAC 优选地丰富单磷酸化肽33。本议定书的代表性结果反映了这一看法 (图 4B)。最近的一份出版物表明, 结合 IMAC 和 MOAC 使用混合材料可能会提供更多的覆盖磷酸物种34。因此, 可以对该议定书进行修改, 以便同时利用其他浓缩方法, 以便进行更全面的 phosphoproteomic 分析。
MaxQuant26软件套件用于分析此协议中的 MS 数据, 但商业应用35也可用于磷酸识别和量化。对于磷酸识别, 应用定位概率截止。在 phosphoresidue 标识10、28中, 执行此筛选以选择磷酸肽持 (即大于 0.75) 的高可信度。换言之, 可能包含磷组的所有其他残留物的总概率小于0.25。这可以提高磷酸选择的严格性。在鉴定数量方面, 预期的多肽的数量在成百上千, 而预期的 pST 多肽的数量则在高数以千计。这些值反映了先前观察到的 phosphoproteome 分布, 其中约2%、12% 和86% 的 phosphosites 分别为.
如果并行执行了该方法和 pST 浓缩步骤, 则协议中的样本准备步骤可以在六天内完成。通过与 MS 的强大工具配对, 磷酸浓缩协议为科学家收集数据以分析其各自研究领域中的 phosphoproteome 提供了一种全球性的方法。
披露声明
作者没有什么可透露的。
致谢
我们感谢德雷克实验室的成员提供的意见和输入的手稿。我们还感谢罗伯特伍德约翰逊医学院和新泽西州立大学罗格斯分校生物质谱设施的成员提供建议, 并在我们的样品上进行质谱分析。拉里 c. 程由国立卫生研究院国家医学科学院 (T32 GM008339 奖) 资助。托马斯 g. Graeber 得到了 P50 (前列腺癌 CA092131 孢子) 的支持。P01 CA168585) 和美国癌症协会研究学者奖 (RSG-12-257-01-TBE)。贾斯汀 m. 德雷克由国防部前列腺癌研究计划 W81XWH-15-1-0236、前列腺癌基金会青年调查员奖、新泽西州健康基金会和罗格斯大学的精准医学倡议试点奖支持。新泽西州癌症研究所。
材料
| Name | Company | Catalog Number | Comments |
| Ultra-Low Temperature Freezer | Panasonic | MDF-U76V | |
| Freezer -20 °C | VWR | scpmf-2020 | |
| Swing rotor bucket | ThermoFisher Scientific | 75004377 | |
| Vacuum manifold | Restek | 26080 | |
| Lyophilizer | Labconco | 7420020 | |
| CentriVap Benchtop Vacuum Concentrator | Labconco | 7810010 | |
| End-over-end rotator | ThermoFisher Scientific | 415110Q | |
| Razor blade | Fisher Scientific | 620177 | |
| Amicon Ultra-15 Centrifugal Filter Units | Millipore Sigma | UFC901024 | |
| Glass culture tubes | Fisher Scientific | 14-961-26 | |
| Parafilm | Fisher Scientific | 13-374-12 | |
| 20G needle | BD | B305175 | |
| Kimwipes | Fisher Scientific | 06-666A | |
| Screw cap cryotube | ThermoFisher Scientific | 379189 | |
| Nunc 15 mL conical tubes | ThermoFisher Scientific | 12-565-268 | |
| Gel loading tips | Fisher Scientific | 02-707-181 | |
| Millipore 0.2 µm spin filter | Millipore Sigma | UFC30GVNB | |
| Low protein-binding Eppendorf tubes | Eppendorf | 22431081 | |
| anti-Phosphotyrosine, Agarose, Clone: 4G10 | Millipore Sigma | 16101 | |
| 27B10.4 antibody | Cytoskeleton | APY03-beads | |
| Peptide assay kit | Thermo Scientific | 23275 | Step 7 |
| TopTip | PolyLC Inc | TT200TIO.96 | Steps 5 and 9 |
| SCX columns (PolySULFOETHYL A) | PolyLC Inc | SPESE1203 | |
| 3 mL syringe | BD | 309657 | |
| Trifluoracetic Acid (TFA) | Fisher Scientific | PI-28904 | |
| Acetonitrile (ACN) | Fisher Scientific | A21-1 | |
| Lactic acid | Sigma-Aldrich | 69785-250ML | |
| Ammonium Hydroxide | Fisher Scientific | A669S-500 | |
| Potassium Phosphate Monobasic | Fisher Scientific | BP362-500 | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Calcium Chloride Dihydrate | Fisher Scientific | BP510-500 | |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypsin, TPCK Treated | Worthington Biochemicals | LS003740 | |
| Lysyl Endopeptidase | Wako Pure Chemical Industries, Ltd. | 125-05061 | |
| MonoTip | PolyLC Inc | TT200TIO.96 | Step 10 |
| ZipTip | MilliporeSigma | ZTC18S096 | Step 6 |
| nanoEase, MZ peptide BEH C18, 130A, 1.7 μm, 75 μm x 20 cm | Waters | 186008794 | Step 11: analytical column |
| Acclaim PepMap 100 C18 LC Columns | ThermoFisher Scientific | 164535 | Step 11: trap column |
| Ultimate 3000 RLSCnano System | Dionex | ULTIM3000RSLCNANO | Step 11 |
| Q Exactive HF | ThermoFisher Scientific | IQLAAEGAAPFALGMBFZ | Step 11 |
| MilliQ water | deionized water used to prepare all solutions and bufferes | ||
| Sonic Dismembrator | Fisher Scientific | FB-120 | sonicator |
| Polytron System PT | Kinematica AG | PT 10-35 GT | homogenizer |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Paller, C. J., Antonarakis, E. S. Management of biochemically recurrent prostate cancer after local therapy: evolving standards of care and new directions. Clinical Advances in Hematology & Oncology. 11 (1), 14-23 (2013).
- Lowrance, W. T., Roth, B. J., Kirkby, E., Murad, M. H., Cookson, M. S. Castration-resistant prostate cancer: AUA guideline amendment 2015. The Journal of Urology. 195 (5), 1444-1452 (2016).
- Domon, B., Aebersold, R. Options and considerations when selecting a quantitative proteomics strategy. Nature Biotechnology. 28 (7), 710-721 (2010).
- Zhang, Y. Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. Protein analysis by shotgun/bottom-up proteomics. Chemical Reviews. 113 (4), 2343-2394 (2013).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- Bantscheff, M., Lemeer, S., Savitski, M. M., Kuster, B. Quantitative mass spectrometry in proteomics: critical review update from 2007 to the present. Analytical and Bioanalytical Chemistry. 404 (4), 939-965 (2012).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513-2526 (2014).
- Rubbi, L., et al. Global phosphoproteomics reveals crosstalk between Bcr-Abl and negative feedback mechanisms controlling Src signaling. Science Signaling. 4 (166), ra18 (2011).
- Hogrebe, A., et al. Benchmarking common quantification strategies for large-scale phosphoproteomics. Nature Communications. 9 (1), 1045 (2018).
- Rush, J., et al. Immunoaffinity profiling of tyrosine phosphorylation in cancer cells. Nature Biotechnology. 23 (1), 94-101 (2005).
- Fila, J., Honys, D. Enrichment techniques employed in phosphoproteomics. Amino Acids. 43 (3), 1025-1047 (2012).
- Mertins, P., et al. Proteogenomics connects somatic mutations to signalling in breast cancer. Nature. 534 (7605), 55-62 (2016).
- Drake, J. M., et al. Phosphoproteome integration reveals patient-specific networks in prostate cancer. Cell. 166 (4), 1041-1054 (2016).
- Lue, H. W., et al. Metabolic reprogramming ensures cancer cell survival despite oncogenic signaling blockade. Genes & Development. 31 (20), 2067-2084 (2017).
- Francavilla, C., et al. Phosphoproteomics of primary cells reveals druggable kinase signatures in ovarian cancer. Cell Reports. 18 (13), 3242-3256 (2017).
- Zhang, H., et al. Integrated proteogenomic characterization of human high-grade serous ovarian cancer. Cell. 166 (3), 755-765 (2016).
- Skaggs, B. J., et al. Phosphorylation of the ATP-binding loop directs oncogenicity of drug-resistant BCR-ABL mutants. Proceedings of the National Academy of Sciences of the United States of America. 103 (51), 19466-19471 (2006).
- Zimman, A., et al. Activation of aortic endothelial cells by oxidized phospholipids: a phosphoproteomic analysis. Journal of Proteome Research. 9 (6), 2812-2824 (2010).
- Zimman, A., Berliner, J. A., Graeber, T. G. Phosphoproteomic analysis of aortic endothelial cells activated by oxidized phospholipids. Methods in Molecular Biology. , 53-69 (2013).
- Humphrey, S. J., Azimifar, S. B., Mann, M. High-throughput phosphoproteomics reveals in vivo insulin signaling dynamics. Nature Biotechnology. 33 (9), 990-995 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Meyer, T. S., Lamberts, B. L. Use of coomassie brilliant blue R250 for the electrophoresis of microgram quantities of parotid saliva proteins on acrylamide-gel strips. Biochimica el Biophysica Acta. 107 (1), 144-145 (1965).
- Bergstrom Lind, S., et al. Immunoaffinity enrichments followed by mass spectrometric detection for studying global protein tyrosine phosphorylation. Journal of Proteome Research. 7 (7), 2897-2910 (2008).
- Pinkse, M. W., Uitto, P. M., Hilhorst, M. J., Ooms, B., Heck, A. J. Selective isolation at the femtomole level of phosphopeptides from proteolytic digests using 2D-NanoLC-ESI-MS/MS and titanium oxide precolumns. Analytical Chemistry. 76 (14), 3935-3943 (2004).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nature Biotechnology. 26 (12), 1367-1372 (2008).
- Cox, J., et al. Andromeda: a peptide search engine integrated into the MaxQuant environment. Journal of Proteome Research. 10 (4), 1794-1805 (2011).
- Olsen, J. V., et al. Global, in vivo, and site-specific phosphorylation dynamics in signaling networks. Cell. 127 (3), 635-648 (2006).
- Huyer, G., et al. Mechanism of inhibition of protein-tyrosine phosphatases by vanadate and pervanadate. The Journal of Biological Chemistry. 272 (2), 843-851 (1997).
- Bielow, C., Mastrobuoni, G., Kempa, S. Proteomics quality control: quality control software for MaxQuant results. Journal of Proteome Research. 15 (3), 777-787 (2016).
- Swaney, D. L., Wenger, C. D., Coon, J. J. Value of using multiple proteases for large-scale mass spectrometry-based proteomics. Journal of Proteome Research. 9 (3), 1323-1329 (2010).
- Bodenmiller, B., Mueller, L. N., Mueller, M., Domon, B., Aebersold, R. Reproducible isolation of distinct, overlapping segments of the phosphoproteome. Nature Methods. 4 (3), 231-237 (2007).
- Leitner, A., Sturm, M., Lindner, W. Tools for analyzing the phosphoproteome and other phosphorylated biomolecules: a review. Analytica Chimica Acta. 703 (1), 19-30 (2011).
- Yang, D. S., et al. Design and synthesis of an immobilized metal affinity chromatography and metal oxide affinity chromatography hybrid material for improved phosphopeptide enrichment. Journal of Chromatography A. 1505, 56-62 (2017).
- Al Shweiki, M. R., et al. Assessment of label-free quantification in discovery proteomics and impact of technological factors and natural variability of protein abundance. Journal of Proteome Research. 16 (4), 1410-1424 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。