Method Article
Phosphopeptide обогащения, в сочетании с Label бесплатно количественного масс-спектрометрии для расследования Phosphoproteome рака простаты
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает процедуру для извлечения и обогатить phosphopeptides от линий клеток рака простаты или тканей для анализа phosphoproteome через массы на основе спектрометрии протеомики.
Аннотация
Phosphoproteomics включает в себя широкомасштабные исследования фосфорилированных белков. Фосфорилирование белков является важнейшим шагом для многих сигнальных путей и жестко регулируется киназы и фосфатаз. Таким образом характеризующих phosphoproteome может обеспечить понимание определения новых целей и биомаркеров для онкологической терапии. Масс-спектрометрия предоставляет способ для глобально, выявлению и количественной оценке тысячи уникальных фосфорилирование событий. Однако phosphopeptides гораздо менее обильные, чем не phosphopeptides, делая биохимический анализ более сложной. Чтобы преодолеть это ограничение, требуются методы для обогащения phosphopeptides до анализа масс-спектрометрии. Мы описываем процедуры извлечения и переваривать белки из ткани приносить пептиды, следуют обогащение phosphotyrosine (pY) и пептиды phosphoserine/треонин (pST) с использованием антител основе и/или диоксид титана (TiO2)-на основе метод обогащения. После подготовки проб и масс-спектрометрии мы впоследствии определить и количественно phosphopeptides с использованием жидкого хроматография масс-спектрометрия и анализа программного обеспечения.
Введение
Около 165 000 новых случаев и примерно 29 000 смертей будет происходить в 2018 году из-за рака простаты, представляющие наиболее распространенной формой рака и второй ведущей причиной связанных с раком смерти мужчин в Соединенных Штатах1. Ранних стадиях рака простаты поддаются лечению с резекцией или лучевой терапии ограничены орган болезни, где частота рецидивов десять лет между 20% и 40% для пациентов, которые проходят простатэктомии, так и между 30% и 50% для пациентов, получающих излучения терапии2. Потому что рак простаты зависит от андрогенов, сигнализации для роста, хирургические и химическая кастрация терапии также работают для высокого риска пациентов. Однако рецидив происходит, когда рак больше не реагирует на лишение терапии андрогена, что подтверждается биохимическими повторения, где снова поднимается простат специфического антигена в сыворотке. На данный момент в прогрессии, метастазы часто обнаруживаются также. Этот продвинутый этап, называется метастатическим кастрация стойкие рака простаты, представляет смертельной формой заболевания, где прогноз является медиана выживаемости время менее чем два года3. В поздней стадии заболевания, в том числе второго поколения антиандрогены, таких как enzalutamide и abiraterone, а также на основе taxane химиотерапии как Доцетаксел доступны несколько вариантов лечения. Несмотря на имеющиеся лечения болезнь часто прогрессирует. Таким образом открытие и разработка методов Роман лечения необходимы для улучшения ухода за больных раком простаты с заболевания.
Масс-спектрометрия (МС)-основанные подходы обеспечивают глобальный анализ протеома через обнаружение сотен до тысяч пептид аналитов4. В частности открытие протеомики, также известный как приобретение зависящих от данных (ДВР), может принести идентификации и количественный тысяч пептиды4,5. Обнаружение на основе MS протеомики, можно далее разделенное в протеомике сверху вниз, где характеризуются интакт белками, и снизу вверх (также известный как дробовик) протеомики, где пептиды анализируются характеризовать белки5. Таким образом в ружье протеомики, протеолиза шаг занимает место в пробоподготовки предшествующий анализ MS к расщеплять белки в пептиды. В конце Поиск базы данных выполняется для сопоставления пептиды белков для идентификации. Этикетка бесплатно также, как несколько изотопов маркировки [например, стабильный изотоп, маркировки, аминокислоты в культуре клеток (SILAC)] методы может использоваться количественно сравнивать пептиды между образцы6,7. Хотя изотопной метки являются золотым стандартом, этикетка бесплатные методы продемонстрировали аналогичные количественной оценки точности8,9 и имеют сопоставимые компромиссы между чувствительность и специфичность10. Этикетка свободный количественный обеспечивает более широкий охват и допускает сравнений между много больше образцов, тогда как методы, основанные на метки ограничены расходы и мультиплексирования мощности6,,7-8.
Кроме того дробовик MS может использоваться также допросить столб-поступательные изменения (PTMs) например фосфорилирование11. Из-за нижней стехиометрическим характер phosphopeptides, по сравнению с общей пептиды несколько методов для обогащения для phosphopeptides, в том числе на основе антитело иммунопреципитации phosphotyrosine (pY) пептидов, диоксид титана (Тио2 ) и иммобилизованные метал близость хроматографии (ИАЦ)5,12. Потому что фосфорилирование белков является ключевым шагом в многих клеток, сигнальные пути, ружье phosphoproteomics позволяет исследователям расследовать клеток сигнализации изменения в другой раках, включая13груди, простаты14, почечной15, и яичников,16,17 лучше понять биологии рака и выявления потенциальных новых целей для терапии.
Этот лейбл бесплатно Ружье phosphoproteomic метод был построен и изысканный на основе предыдущей работы19,18,Graeber группы20. Этот протокол начинается с описания добыча и переваривание белков и фосфолипопротеиновый из ткани в пептиды. Затем мы подробно обогащения pY пептиды с использованием конкретных phosphotyrosine антител и TiO2. Мы также обсудим на обогащение пептиды phosphoserine/треонин (pST), используя сильные катионного обмена (SCX) следуют TiO2. Этот протокол заключает с представлением образцов в объекте MS и использования программного обеспечения MS анализа для выявления и количественной оценки phosphopeptides и их соответствующие фосфолипопротеиновый. Применение настоящего Протокола можно расширить за пределы предстательной железы в другие поля за пределами онкологии и рака.
протокол
Эксперименты с использованием ксенотрансплантата опухоли были утверждены Ратгерский университет институциональных животное уход и использование Комитетом как вперед под руководящими принципами национальных институтов здоровья.
1. белки добыча
- Подготовка буфера lysis (Таблица 1). (Объем зависит количество выборок, собирать урожай). В пробирке клеток образцы перейдите к шаг 1.2. За опухолевой ткани переходите к шагу 1.3.
-
Клетки для сбора урожая
- Собрать клетки в 50 мл Конические трубки и спина их на 700 g x 5 мин при 4 ° C. Отменить супернатант и держите лепешки на льду. Повторите этот шаг для всех блюд для сбора клеток в одном Пелле. (Как правило, около 5 почти вырожденная 15-см блюда клеток необходимы для 5 мг белка, но это может быть зависимым от линии клетки и необходимо определить эмпирически каждый следователь.)
- Помыть лепешка с 30 мл охлажденного фосфат амортизированное saline (PBS) и спина на 700 g x 5 минут при температуре 4 ° C до аспирационных PBS. Добавьте 1,5 мл буфера lysis на 5 мг белка используется для ячейки Пелле. Накапайте вверх и вниз несколько раз. Перейдите к шагу 1.4.
-
Заготовка тканей
- Весят опухоли и добавить 2 мл ледяной литического буфера на каждые 100 мг ткани в пробирке культуры. (Как правило, 50-150 мг тканей живого веса требуется.)
- Однородный lysate с помощью ручных или benchtop гомогенизатора (импульса 2 x 15 s.) Очистите гомогенизатор до первого образца и между образцами с помощью Блич 10%, 70% этанол и обессоленной воды в порядке правопреемства.
- Чтобы уменьшить и алкилата, тепло гомогенизированных образцов при 95 ° C за 5 мин. Затем охладьте их на льду за 15 мин. На льду, sonicate lysate 3 x (т.е., пульс для 30 s с 60 s паузы между импульсами). Образца не должно быть вязкой или КРУПНОКУСКОВЫХ на данный момент. Тепла lysate на 95 ° C за 5 мин21.
- Центрифуги, lysate в том же sonication трубки с помощью ротора ведро качели в 3500 x g, при 15 ° C на 15 мин собирать супернатант и отбросить гранулы.
- Определите концентрацию белка, выполняя assay Брадфорд22. При необходимости разбавьте lysate до 5 мг/мл с буфера lysis. Хранить при температуре от-20 ° C.
Примечание: Эксперимент может быть приостановлена здесь. Замораживание образцов-80 ° C и продолжить на более поздний срок.
2. lysate пищеварение
- Развести образцы 12-fold с помощью 100 мм трис (рН = 8.5) для уменьшения количества Гуанидиновые. Разбавьте все образцы на том же свести к минимуму последствия неравных пищеварение. Сохраните 12,5 мкг непереваренных lysate для подтверждения его на окрашенные Кумасси гель23.
- 5 мг белка, добавить 10 мкг лизил эндопептидазы (Lys-C) и проинкубируйте его при комнатной температуре для 5-6 ч. Регулировка рН 8.0 путем добавления 1 М untitrated трис (рН ~ 11).
- Подготовка 1 мг/мл L-1-tosylamido-2-phenylethyl хлорметил кетон (TPCK)-лечение трипсина в 1 мм HCl (с 20 мм CaCl2). Добавьте трипсина в соотношении 1: 100 трипсина: белок и инкубировать при 37 ° C в течение 3 ч.
- Добавьте такое же количество свежих трипсина в шаге 2.3. Проинкубируйте ее при 37 ° C на ночь.
- Сохраните 12,5 мкг переваривается lysate для подтверждения полного переваривания Кумасси окрашенных гель23.
3. обратный этапа добычи
- Запись lysate тома. Фильтр образца с помощью фильтра отсечки 15 мл 10 кДа. Центрифуга образца на 3500 x g с помощью ротора ведро качели (или 3500 x g в фиксированный угол ротора) при 15 ° C до тех пор, пока объем концентрируются составляет менее 250 мкл, (это занимает около 45-60 мин). Собирать потока через и отбросить концентрируются.
Примечание: Эксперимент может быть приостановлена здесь. Замораживание образцов-80 ° C и продолжить на более поздний срок. - Для подкислять образца, добавьте 5% trifluoroacetic кислоты (ТФК) на мл lysate приблизительно 20 мкл. Хорошо перемешайте и измерить pH образца с помощью РН полоски. Отрегулируйте пэ-аш до 2,5, используя 5% TFA.
- Подключите короче конец столбца C-18 для вакуумного коллектора. Установите пылесос от 17 до 34 кПа (или согласно инструкции производителя). С помощью пипетки стеклянные , влажные столбец с 3 мл 100% Ацетонитрил (АКС). Не позволяйте столбце сухой.
- С помощью пипетки стеклянные , сбалансировать столбец с 6 мл 0,1%, применяемые TFA как 2 x 3 мл. Загрузите подкисленных образца в столбце. Не добавляйте более чем 3 мл за один раз. Отрегулируйте вакуум целевой около 1-2 капли в секунду.
- С помощью пипетки стеклянные , промойте колонку с 9 мл 0,1%, применяемые TFA как 3 x 3 мл. Элюировать столбец с 2 мл 40% ACN, 0.1% TFA. Соберите две фракции 2 мл в стеклянных трубок культуры. Удалить столбец.
- Обложка элюата трубки с парафина и 3-5 отверстий на крышке с помощью иглы 20G. Заморозить элюата на сухой лед для по крайней мере 30 минут до тех пор, пока он полностью сплошной.
- Lyophilize фракций на ночь. На следующий день убедитесь, что образцы полностью сухой перед остановкой лиофилизатор. Хранить трубы в 50 мл Конические трубки с деликатной салфетки-80 ° c.
Примечание: Эксперимент может быть приостановлена здесь.
4. иммунопреципитации и обогащение pY пептиды24
- Ресуспензируйте лиофилизированный порошок с 0,5 мл ледяной иммунопреципитации (IP) привязки буфера в каждой фракции. Бассейн фракций путем передачи объем 0,5 мл ресуспендирования из вторая фракция первой фракцией и спасти кончика пипетки. Энергично вихря (вместо закупорить вверх и вниз) чтобы убедиться, что образец полностью растворяется перед передачей его на cryotube колпачок 3,6 мл.
- Как шаг 4.1., промойте трубы лиофилизации с другой 0,5 мл буфера привязки IP (Таблица 1) в каждой тюбике. Решение передать 3,6 мл колпачок, используя же наконечник пипетки для сведения к минимуму любые потери образца. Повторите полоскание 1 x больше, делая окончательный ресуспендирования объемом 2 мл (по 5 мг белка). Измеряют рН образец, чтобы убедиться, что это примерно 7,4. Если это слишком кислой, многократно мкл 10 1 М трис (untitrated, рН ~ 11). Если это слишком basic, последовательно добавьте 10 мкл разбавленного HCl (1:25 или 1: 100).
-
Предварительно вымыть pY бусины (для 5 мг начиная lysate)
- 25 мкг 4 g 10 антител и 12,5 мкг 27B10.4 антитела необходимы на сэмпл. После использования Р200 Пипетка с вырежьте наконечником для передачи антител в отдельные microcentrifuge трубы, мыть антител с 450 мкл ледяной буфера привязки IP 2 x. Центрифуга для них на 100 x g 1 мин на 4 ° C и аспирата из супернатант.
- Ресуспензируйте бусины запасов концентрации 0.5 мг/мл, используя буфер привязки IP. (Сделать не вихревой бисер). После aliquoting необходимые пульпы (50 мкл суспензии 4 g 10 антитела и 25 мкл 27B10.4 антитела навозной жижи на сэмпл) в одну трубу спина вниз акций пробирок на 200 x г за 1 мин при 4 ° C. Вымойте боковинами с супернатант перед возвращением бисер для хранения в холодильнике.
- Добавьте предварительно выстиранные pY бусы ресуспензированы пример решения в cryotubes колпачок. Инкубируйте их на 4 ° C на вращателе конца за ночь.
- Поместите колпачок cryotubes в 50 мл пластиковых пробирок, выстроились с деликатной очистки. Спин вниз бусы на 100 g x 1 мин сохранить супернатанта, который будет использоваться для обогащения для pST пептидов. (Обогащения для pST начинается в шаге 7 и могут выполняться параллельно на обработку пептид pY).
- Ресуспензируйте бусины с 300 мкл буфера привязки IP. Перенести их в 2-мл пробирку microcentrifuge и спина их вниз на 100 g x 1 мин при 4 ° C.
- Промыть инкубации трубки 3 x с 200 мкл буфера привязки IP. Передача содержимого в том же пробки Microcentrifuge каждый раз. Затем вращайте их вниз.
- Вымойте бусины в microcentrifuge трубки 3 x с 500 мкл буфера привязки IP и спина их вниз на 100 x г за 1 мин. Затем вымойте Бусины 4 x с 450 мкл 25 мм NH4HCO3, pH 7.5 и спина их вниз на 100 x g 1 мин Используйте свежие 25 мм NH4HCO3 решения от порошка каждый раз.
- Центрифуга бусы на 1500 x g за 1 мин использовать гель загрузки чаевые, чтобы полностью удалить супернатант окунания кончик кончик гель загрузки немного ниже поверхности бусы.
- Добавить 4 x шарик объем 0.1% TFA корда (т.е., 300 мкл 0,1% TFA для 75 мкг pY шарик навоза). Хорошо перемешайте и инкубировать смесь в thermomixer на 1000 об/мин, 15 мин при температуре 37 ° C.
- Передать ресуспендирования 0.2 мкм фильтром спина. Быстро spin элюции трубку и передать же спин фильтра с помощью пипетки P10 остаточный объем. Спин вниз спин фильтр на 850 x g 1 мин передачи элюции пробки microcentrifuge низкой связывания белков . Вакуумные сконцентрировать элюата досуха на ночь при 40 ° C и с временем тепла 300 мин.
Примечание: Эксперимент может быть приостановлена здесь. Замораживание образцов-80 ° C и продолжить на более поздний срок.
5. диоксид титана обогащения25 pY пептиды
- Ресуспензируйте высохший вниз phosphopeptides в 200 мкл 50% ACN, 0.1% TFA. Вортекс и центрифуги их на 10000 x g 30 s. повторить этот 1 x Ресуспензируйте их хорошо.
- Подготовка TiO2 бусины, содержащийся в советы, которые имеют потенциал для 200 мкл образцов.
- Осторожно нажмите на кончик стороне небольшой подсказки для перемещения материала с этой целью. Промойте кончик, добавив 200 мкл, 100% ACN, следуют инвертирование кончик и стряхивая маленький конец для перемещения жидкости к крышке.
- С помощью лезвия бритвы, отрезать кончик небольшой кончик и поместите его низкой связывания белков трубки. (Избегайте использования полистирола трубы как TiO2 будет придерживаться стороны трубки.) Снимите крышку и вставьте микропипеткой окунуться из оставшихся АКС. Повторите мыть с 200 мкл, 100% АКС. TiO2 бусины теперь находятся в низких связывания белков трубки для следующих шагов.
- Предпосылкой TiO2 с 500 мкл 100% ACN 2 x. Накапайте его смешивать бисер с растворителем. Центрифуга для них на 100 x г за 1 мин.
- Условие TiO2 с 500 мкл буфера фосфат натрия 0,2 М (рН ~ 7) 2 x. Вымойте бусины с 300 мкл уравновешивания буфер 3 x. Потому что TiO2 является очень плотным, бисер будет быстро урегулировать.
- 400 мкл 50% ACN, 0.1% TFA трубу низкой связывания белков, следуют Добавление 84 мкл молочной кислоты. Передача ресуспензированы phosphopeptides трубу низкий связывание с белками и проинкубируйте 1 ч при комнатной температуре с помощью сквозной над ротатор.
- Центрифуга бусы на 100 g x 1 мин, чтобы pellet они. Мыть их с 300 мкл буфера уравновешивания (Таблица 1) 2 x и крутить их вниз на 100 x г за 1 мин.
- Промойте бусины с 300 мкл полоскания буфера 2 x. Перевести их на 0,2 мкм фильтром спина. Вращать их в 1500 x г за 1 мин.
- Передать фильтр чистый 1,5 мл трубки низкого связывания белков. Элюировать содержание 2 x с 200 мкл 0,9% NH3 H2O. измерения pH с рН полоски, которая должна быть между 10 и 11. Вакуумные сконцентрировать элюата досуха на ночь для испарения аммиака.
6. обессоливания pY пептиды для анализа MS
- Восстановить phosphopeptides с 15 мкл 0,1% TFA vortexing и центрифугирование их на 10000 x g 30 s Ресуспензируйте их. Повторите этот 1 x Ресуспензируйте их хорошо. Не Пипетка вверх и вниз.
- Очистить образца с помощью C-18 наконечник с привязки мощностью 5 мкг и следовать протокол изготовителя.
- Полностью высушите элюции тома на вакуумное концентрирование. Это занимает 1-2 ч. Ресуспензируйте сушеные phosphopeptides в 12,5 мкл раствора масс-спектрометрия (см. таблицу 1) (или как рекомендованный MS исследователь протеомики основных объекта). Вортекс и кратко спина решение вниз на 10 000 x g за 30 с. повтор 2 x чтобы Ресуспензируйте их хорошо. Образцы будут готовы для представления объекта масс-спектрометрия (шаг 11).
Примечание: Следующие шаги ниже, связаны с pST пептида обогащения только.
7. обратный этапа добычи pST пептидов
- Измерьте пептид концентрация супернатанта, приобрел от шага 4.6, выполняя пептид пробирного. Достаточный объем для pST масс-спектрометрии-2,5 мг.
- Отрегулируйте пэ-аш до 3,5 с 5% TFA.
- Подключите короче конец столбца C-18 для вакуумного коллектора. Установите пылесос от 17 до 34 кПа (или согласно инструкции производителя). Мокрые столбец с 3 мл 100% АКС. Не позволяйте столбце сухой.
- Сбалансировать столбец с 6 мл 0,1%, применяемые TFA как 2 x 3 мл. Загрузите подкисленных образца в столбце. Не добавляйте более чем 3 мл за один раз. Отрегулируйте вакуум целевой около 1-2 капли в секунду.
- Промойте колонку с 9 мл 0,1%, применяемые TFA как 3 x 3 мл. Элюировать столбец с 2 мл 40% ACN, 0.1% TFA. Соберите две фракции 2 мл в стеклянных трубок культуры. Удалить столбец.
- Обложка элюата трубки с парафина и 3-5 отверстий на крышке с помощью иглы 20G. Заморозить элюата на сухой лед для по крайней мере 30 минут до тех пор, пока он полностью сплошной.
- Lyophilize отдельных фракций на ночь. На следующий день убедитесь, что образцы полностью сухой перед остановкой лиофилизатор. Хранить трубы в 50 мл Конические трубки с деликатной салфетки-80 ° c.
Примечание: Эксперимент может быть приостановлена здесь.
8. сильные катионного обмена (SCX) pST пептидов
- Ресуспензируйте лиофилизированный пептидов в 2 мл буфера A (Таблица 1). Бильярд дроби для каждого образца. (Решение будет облачно).
- Подготовьте вакуумный коллектор. Соединить столбец SCX шприц 3 мл с поршень удалены. Установите пылесос от 17 до 34 кПа (или согласно инструкции производителя).
- Условие в столбце SCX с 4 мл ACN, следуют 4 мл буфера а.
- Загрузить по 2 мл образца из шага 8.1 и собирать элюата немедленно. Загрузка 3 мл буфера: b (80.9:19.1) и собирать элюата. Бильярд элюаты каждого образца и аликвота их в 2 мл низкой связывания белков трубы.
- Вакуумные сконцентрировать все образцы до тех пор, пока остается около 30% от объема. (Этот шаг занимает приблизительно 2-4 ч.) Бильярд аликвоты в 1 низкий связывание с белками трубку для каждого образца.
- Подключите короче конец столбца C-18 для вакуумного коллектора. Установите пылесос от 17 до 34 кПа (или согласно инструкции производителя). Мокрые столбец с 3 мл 100% ACN 2 x. Делать не пусть столбце сухой.
- Сбалансировать столбец с 3 мл 0,1% TFA 2 x. Загрузите образец в столбце. Не добавляйте более чем 3 мл за один раз. Отрегулируйте вакуум целевой около 1-2 капли в секунду.
- Промойте колонку с 3 мл 0,1% TFA 2 x. Элюировать столбец с 4 мл 50% ACN, 0.1% TFA.
9. диоксид титана обогащение pST пептиды
-
Подготовка TiO2 бусины, содержащийся в советы, которые имеют потенциал для 200 мкл образцов
- Осторожно нажмите на стороне Малая подсказка подсказка для перемещения бисер с этой целью. Снимите крышку и вылить бисер в полипропиленовые 15 мл Конические трубки.
- Промойте кончик, добавив 200 мкл, 100% ACN, инвертирование кончик пару раз и стряхивая маленький конец для перемещения жидкости к крышке. С помощью лезвия бритвы, отрезать кончик небольшой кончик и поместите его над конические Трубы полипропиленовые 15 мл. Снимите крышку и вставьте микропипеткой окунуться из оставшихся АКС. Повторите мыть с 200 мкл, 100% АКС. TiO2 бусины теперь расположены в 15 мл Конические трубки для следующих шагов.
- Предпосылкой TiO2 с 500 мкл 100% ACN 2 x. Накапайте его смешивать бисер с растворителем. Центрифуга для них на 100 x г за 1 мин.
- Условие TiO2 с 500 мкл буфера фосфат натрия 0,2 М (рН ~ 7) дважды. Вымойте бусины с 300 мкл уравновешивания буфер 3 x.
- Перевести eluted phosphopeptides в конические Трубы полипропиленовые 15 мл. 560 мкл молочной кислоты и проинкубируйте 1 ч при комнатной температуре с помощью сквозной над ротатор.
- Центрифуга смеси на 100 g x 1 мин для пеллет бисер. Мыть их с 300 мкл буфера уравновешивания (Таблица 1) 3 x. Спина их вниз на 100 x г за 1 мин.
- Промойте бусины с 300 мкл полоскания буфера 2 x. Перевести их на 0,2 мкм фильтром спина. Спина их вниз на 1500 x г за 1 мин.
- Передать фильтр чистый 1,5 мл трубки низкого связывания белков. Элюировать содержание 2 x с 200 мкл 0,9% NH3 H2O. Пусть сидят на phosphopeptides за 2 мин до элюирующие их решение. Измерение pH, которая должна быть между 10 и 11.
- Вакуумные сконцентрировать элюата досуха на ночь для испарения аммиака.
10. обессоливания pST пептиды для анализа MS
- Осторожно нажмите на кончик стороне небольшой подсказки для перемещения материала с этой целью. Промойте кончик, добавив 200 мкл, 100% ACN, следуют инвертирование кончик и стряхивая маленький конец для перемещения жидкости к крышке.
- С помощью лезвия бритвы, отрезать кончик небольшой кончик и поместите его полипропиленовые 15 мл Конические трубки. Снимите крышку и вставьте микропипеткой окунуться из оставшихся АКС. Повторите мыть с 200 мкл, 100% АКС. TiO2 бусины теперь расположены в полипропиленовые 15 мл Конические трубки для следующих шагов.
- Очистить образца с помощью C-18 наконечник с привязки мощностью 100 мкг. (следуйте инструкциям производителя).
- Полностью высушите элюции тома на вакуумное концентрирование. Это занимает 1-2 ч.
- Ресуспензируйте сушеные phosphopeptides в 12,5 мкл раствора масс-спектрометрия (или как рекомендованный исследователя MS протеомики основного фонда). Вортекс и центрифуги их на 10000 x g 30 s. повторить 2 x Ресуспензируйте их хорошо. (Не Пипетка вверх и вниз.)
11. масс-спектрометрии анализ
- Представить образцы на MS протеомики основной объект для выполнения жидкого хроматографии тандем MS (LC-MS/MS), используя их Рекомендуемые параметры. Пример используются следующие параметры (см. таблицу 2 для резюме):
- Загрузить 5 мкл образцов на столбец ловушки (2 см Длина х диаметр 75 мкм) и мыть их с 0.1% TFA 5 мин с расходом 5 мкл/мин.
- Принесите ловушку аналитической колонки нано (20 cm x 75 мкм) с расходом 300 нл/мин.
- Сегментированный линейных градиентов (доля муравьиной кислоты 0,16%, 80% АКС в 0,2% муравьиной кислоты) отличаются между образцами pY и pST:
- Для образцов pY элюировать их с помощью градиента 4-15% в 5 мин, 15-50% в 40 мин и 50-90% в 5 мин.
- Для pST образцов элюировать их с помощью градиента 4-15% через 30 мин, 15-25% в 40 мин, 25-50% в 44 мин и 50-90% за 11 минут.
- Приобретение данных MS в режиме приобретения зависящих от данных с циклическим серии полное сканирование с разрешением 120000 МС/МС (HCD, относительной столкновения энергию 27%), следуют 20 самых интенсивных ионов и динамического исключения, продолжительностью 20 s.
- После завершения запуска MS импортируйте MS raw файлов в программу MS программное обеспечение анализа для выявления и количественной оценки phosphopeptides. (MaxQuant-программное обеспечение-8,-26,-27 был использован в этом эксперименте. Если не указано в таблице 3, параметры по умолчанию были использованы.)
Результаты
Подробно этот протокол описывает метод для извлечения белков и пищеварение, следуют phosphopeptide обогащения и последующего анализа MS (рис. 1). Составы всех буферов и решения, используемые в настоящем Протоколе, перечислены в таблице 1. Последовательное использование Lys-C и трипсина обеспечивает эффективное пищеварение. Кумасси окрашенных гель предварительно переваривается lysate подтверждает наличие белков, хотя окрашивание после переваривается lysate подтверждает полное переваривание (рисунок 2A). Для полного переваривания без полос должен появиться выше 15 кДа, за исключением 30 кДа и 23.3 кДа полос для Lys-C и трипсина, соответственно. Добавление Lys-C также уменьшает количество пропущенных расщепления (рис. 2B). Потому что pY пептиды представляют собой всего лишь 2% phosphoproteome28, иммунопреципитация pY пептидов, используя pY специфические антитела является первым шагом pY пептид обогащения. Результате супернатант становится ввода для pST пептида обогащения. Иммунопреципитация pY эффективно отделяет пептиды pY от pST пептиды, где в среднем 85% выявленных от подготовки pY phosphopeptides pY (Рисунок 3А) и более 99% phosphopeptides, определены от подготовки pST pST (рис. 3B). Диоксида титана используется для обогащения для phosphopeptides в обоих препаратов. Ожидаемый процент пептидов в подготовке MS-готовы, которые являются фосфорилированных составляет 30-50% (рис. 4A). Изменчивость в phosphopeptide обогащения процент может быть больше в подготовке pY результате там быть много меньше pY пептиды чем pST пептиды. С точки зрения видов phosphopeptide большинство phosphopeptides обнаружены иметь одинарной или двойной фосфорила группу (рис. 4B).
После выполнения масс-спектрометрии, MS raw файлов загружаются в MS анализа программного обеспечения. Настройки параметров, используемые в эксперименте, перечислены в таблице 3 , но будет варьироваться от программное обеспечение программное обеспечение и может меняться от версии к версии. Параметры, которые не перечислены были оставлены по умолчанию, включая ФДР среза 1% для пептид спектра подходящих (PSM) с минимальным счетом Андромеды 40 для определения измененных пептиды27. Настройка вероятности отсечки локализации более 0,75 отфильтровывает около 5% pY пептидов и 15% и 34% pS и pT пептиды, соответственно (Рисунок 5A). После применения этих фильтров, ожидаемое количество phosphopeptide идентификации в конце анализа MS составляет примерно 300 pY пептидов (по 5 мг начиная белка) и около 7500 Л.с пептидов и пептиды 640 pT (по 2,5 мг начиная пептида сумма) от соответствующих обогащения препараты (Рисунок 5B). Количество повторных измерений и изменчивости интенсивности сигнала phosphopeptide определяет, адекватного питания для статистических сравнений. В четырех отдельных экспериментов с группами, содержащие биологические дубликаты или triplicates были рассчитаны процентные коэффициенты вариации (% CV) для обнаруженных phosphopeptides. Дистрибутивы нижней изменчивость (например, pST группы 1-5 на рис. 5 c) указывают, что сбор образцов, подготовка и масс-спектрометрии бежит согласуются. С другой стороны дистрибутивы выше изменчивость (например, Группа 6 pST в рис. 5 c) показывает шумнее данные, которые потребуются большие складки изменения обнаружить существенные различия в нижнем дифференциального анализа.
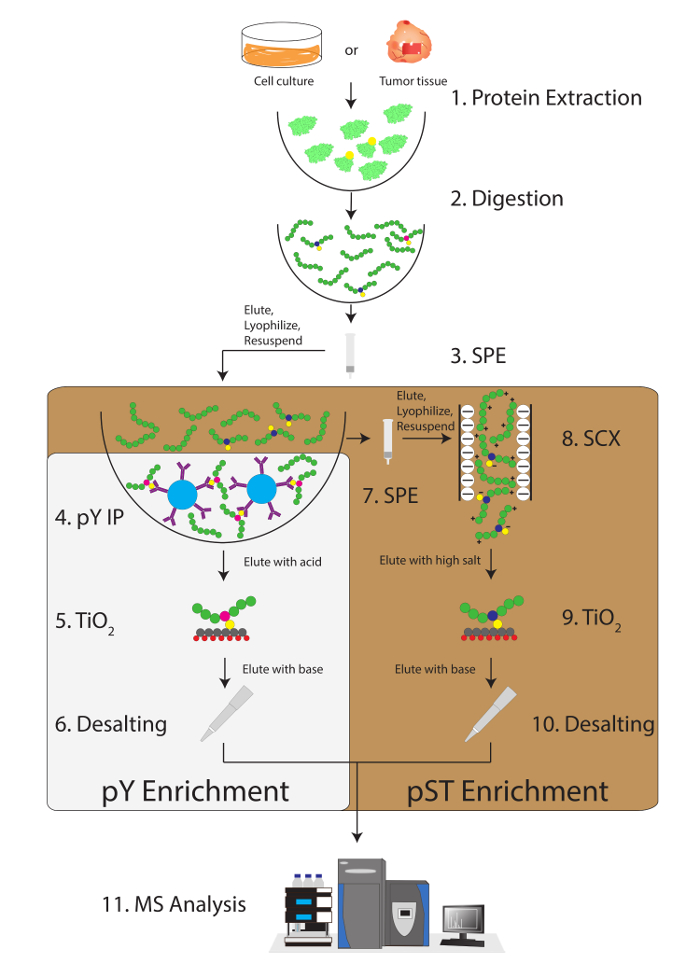
Рис 1: Диаграмма рабочего процесса. Белки от образцы извлекаются и переваривается. Пептиды извлекаются путем экстракции твердой фазы (SPE) и phosphotyrosine (pY) пептиды являются immunoprecipitated. Параллельно от супернатант в шаге иммунопреципитации pY обогащены пептиды phosphoserine/треонин (pST). Сильный катионного обмена (SCX) осуществляется на супернатант удалить высоко заряженных пептиды для уменьшения Ион подавления12. Обе препараты проходят phosphopeptide обогащения через диоксида титана (TiO2). После очистки образца жидкостной хроматографии тандем масс-спектрометрии (LC-MS/MS) выполняется для измерения phosphopeptide изобилия. Необработанные данные затем загружается в MS анализ программного обеспечения для идентификации phosphopeptides. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
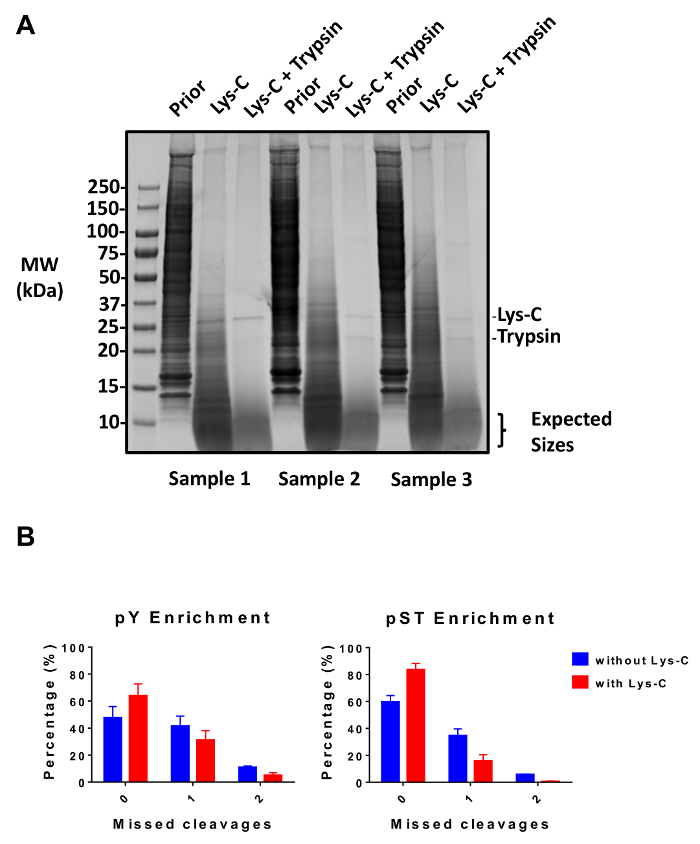
Рисунок 2: Оценка пищеварения. (A) три образцы с 12,5 мкг lysate предварительно пищеварение, Lys C пищеварения, и показываются Пищеварение трипсина пост. Кумасси гель пятно тест показывает чистый пищеварения после последовательного использования Lys-C и трипсина. Молекулярный вес (МВт) размер маркеров находятся в кДа (кДа). (B) A сокращение упущенных разобщенность наблюдается после Lys-C был добавлен к протоколу. Доля phosphopeptides без пропущенных разобщенность увеличилась с 48% до 64% и от 60% до 84% в среднем для pY и pST обогащения подготовки, соответственно. Графики суммировать данные, полученные из двух эксперименты, проведенные без Lys-C и пять эксперименты, проведенные с Lys-C. Планки погрешностей, стандартных отклонений, представляющие 38 pY и 38 pST образцов из 2 отдельных экспериментов (без Lys-C) и 62 pY и 60 образцов pST 5 отдельных экспериментов (с Lys-C). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
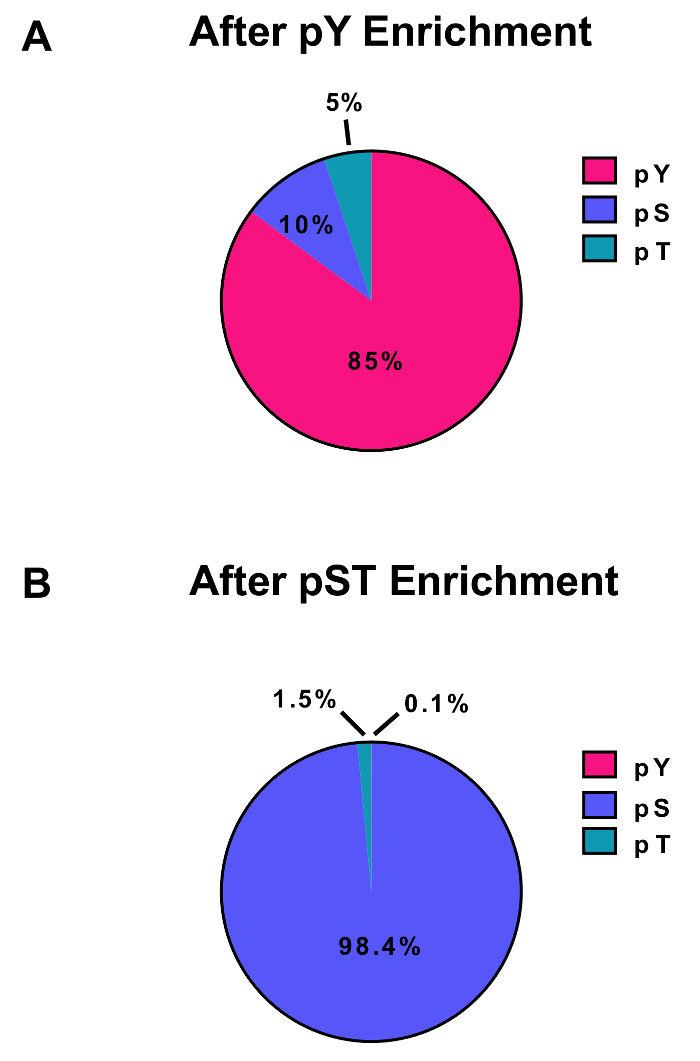
Рисунок 3: обогащение pY и pST phosphopeptides. Эти панели показывают процент pSTY phosphopeptides от либо (A) pY или (B) подготовка обогащения pST. PY обогащения pY иммунопреципитации и диоксид титана привели к 85% phosphopeptides, будучи для pY пептиды, в то время как лишь 0,1% phosphopeptides в pST обогащения являются pY. Эти значения были взяты из изучения фосфористой (STY)Sites.txt файл один представитель эксперимента после фильтрации загрязнений, обратной последовательности и phosphopeptides с вероятностью локализации менее 0,75. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: обогащение Phosphopeptide с диоксидом титана. (A) показан процент выявленных phosphopeptides от образцов в четырех отдельных экспериментов (относительно общего пептидов). (B) Эта группа показывает средний состав моно-, двух- и мульти фосфорилированных пептидов в четырех отдельных экспериментов. Планки погрешностей в группе A являются стандартных отклонений. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: ожидается отождествления phosphoresidue. (A) Эта группа показывает вероятности фосфорилирование локализации идентификаторы от pY обогащения (слева) и pST обогащения (справа). Средний процент идентификаторов, удовлетворяющие отсечки вероятность > 0,75 — 93%, 75% и 52% для pY, pS и pT, соответственно. (B) среднее количество идентификаторов с > 0,75 локализации вероятность составляет 300 для pY, 7500 для pS и 640 для pT. (C) Эта группа показывает скрипка участков процента коэффициент вариации (% CV) phosphopeptides. Оценку % CV было выполнено только если значение интенсивности сигнала был обнаружен в каждом биологических репликации или тройные группы. Данные были взяты из четырех отдельных экспериментов. Планки погрешностей в панели A и B являются стандартных отклонений от 34 pY и 34 pST образцы из 4 отдельных экспериментов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Буфер | Объем | Состав | |
| Буфер lysis хлорид Гуанидиновые 6 М | 50 мл | 6 M Гуанидиновые хлорид, 100 мм трис рН 8,5, фосфина трис (2-carboxyethyl) 10 мм, 40 мм chloroacetamide, 2 мм натрия Ортованадат, Пирофосфат натрия 2,5 мм, 1 мм β-метронидазол 500 мг n октиловый гликозид, ультра-чистой водой до объема | |
| Пирофосфат натрия 100 мм | 50 мл | 2.23 g натрий пирофосфорнокислый препарат, ультра-чистой водой до объема | |
| 1M β-Глицерофосфат | 50 мл | 15.31 g β-метронидазол, ультра-чистой водой до объема | |
| 5% trifluoroacetic кислота | 20 мл | Добавьте 1 mL 100% trifluoroacetic кислоты в 19 мл ультра-чистой воды | |
| 0,1 trifluoroacetic кислота % | 250 мл | Добавить 5 мл 5% trifluoroacetic кислоты в 245 мл ультра-чистой воды | |
| Элюирующий буфер pY | 250 мл | 0,1% trifluoroacetic кислоты, 40% ацетонитриле, ультра-чистой водой до объема | |
| Элюирующий буфер pST | 250 мл | 0,1% trifluoroacetic кислоты, 50% ацетонитриле, ультра-чистой водой до объема | |
| IP привязка буфер | 200 мл | 50 мм трис рН 7,4, хлорид натрия 50 мм, ультра-чистой водой до объема | |
| Бикарбонат аммония 25 мм, pH 7.5 | 10 мл | Растворите 19.7 мг в 10 мл стерильной ультра-чистой воды, рН 7,5 с 1 N соляной кислоты (~ 10-15 мкл/10 мл раствора), сделать свежий | |
| 1M фосфатного буфера, рН 7 | 1000 мл | 423 мл 1 M натрия дигидрогенфосфат, 577 мл 1 M натрия гидрогенфосфат | |
| Уравновешивания буфер | 14 мл | 6.3 мл ацетонитриле, 280 мкл 5% trifluoroacetic кислоты, 1740 мкл молочная кислота, 5.68 мл ультра-чистой воды | |
| Ополаскивание буфера | 20 мл | 9 мл ацетонитриле, 400 мкл 5% trifluoroacetic кислота, 10,6 мл ультра-чистой воды | |
| Масс-спектрометрия решение | 10 мл | 500 мкл ацетонитриле, 200 мкл 5%, trifluoroacetic кислота, 9.3 мл ультра-чистой воды | |
| Буфер A | 250 мл | Дигидрофосфат калия 5 мм (рН 2,65), Ацетонитрил 30%, калия хлорида 5 мм, ультра чистой водой до объема | |
| Буфера B | 250 мл | Дигидрофосфат калия 5 мм (рН 2,65), Ацетонитрил 30%, калия хлорида 350 мм, ультра-чистой водой до объема | |
| 0,9 Гидроксид аммония % | 10 мл | Гидроксид аммония 29.42% 300 мкл, 9,7 мл ультра-чистой воды | |
Таблица 1: решения и буферов. Эта таблица показывает композиции из буферов и решения, используемые в настоящем Протоколе.
| Параметры LC-MS/MS | ||
| Параметр | pY параметр | pST параметр |
| Пример загрузки (мкл) | 5 | |
| Скорость загрузки потока (мкл/мин) | 5 | |
| Скорость потока градиента (НЛ/мин) | 300 | |
| Линейный градиент (процент 0,16% муравьиной кислоты, 80% АКС в 0,2% муравьиной кислоты) | 4 - 15% за 5 мин | 4 - 15% для 30 мин |
| 15 - 50% на 40 мин | 15 - 25% на 40 мин | |
| 50 - 90% за 5 мин | 25 - 50% на 44 мин | |
| 50 - 90% за 11 мин | ||
| Разрешение полного сканирования | 120000 | |
| Количество самых интенсивных ионов выбран | 20 | |
| Относительный столкновения энергии (%) (HCD) | 27 | |
| Динамический изоляции (s) | 20 | |
Таблица 2: LC-MS параметры. Это пример настройки LC-MS в типичной ружье phosphoproteomic эксперименте. Образцы были загружены на столбец ловушку. Ловушка был доставлен в соответствии с аналитической колонки. Эти параметры были оптимизированы для использования системы LC-MS, перечисленные в таблице материалы и реагенты. Эти параметры должны быть скорректированы для других систем LC-MS.
| MaxQuant параметров | ||
| Настройка | Действия | |
| Группа специфические параметры | ||
| Тип | Тип | Выберите стандарт |
| Кратность | Значение 1 | |
| Пищеварение режим | Фермент | Выберите трипсина/P |
| Макс. пропущенные разобщенности | Значение 2 | |
| Изменения | Переменной изменения | Добавить фосфористой (пла) |
| Количественная оценка метки бесплатно | Количественная оценка метки бесплатно | Выбрать LFQ |
| LFQ мин соотношение количество | Значение 1 | |
| Быстрый LFQ | Отметьте | |
| Прочее | Повторно количественно | Отметьте |
| Глобальные параметры | ||
| Последовательности | FASTA файлов | Выберите fasta загружанный от UniProt |
| Фиксированный изменения | Добавить Carbamidomethyl (C) | |
| Идентификация нареч. | Матч между запусками | Отметьте |
| Окно времени матча | Набор 5 мин | |
| Окно времени выравнивания | Значение 20 мин | |
| Матч неопознанных функций | Отметьте | |
| Количественное определение белка | Соотношение количество мин. | Значение 1 |
| Местоположения папок | Соответствующим образом изменить | |
Таблица 3: параметры анализа программного обеспечения MS. В MaxQuant конкретной группе и глобальные параметры в этой таблице были отобраны или скорректированы. Все остальные параметры остаются по умолчанию. Эти эксперименты были проведены с использованием версии 1.5.3.30. Параметры могут изменяться от версии к версии и программное обеспечение программное обеспечение.
Обсуждение
Прежде чем использовать этот протокол для обогащения для phosphopeptides, тщательного рассмотрения экспериментального дизайна имеет решающее значение. Использование биологических реплицирует является более эффективное использование ресурсов масс-спектрометрии чем технические реплицирует. Количество повторных измерений, которые необходимы будут зависеть отчасти от изменчивости данных. Недавнее исследование показало, что, хотя увеличение числа реплицирует за три лишь незначительно увеличивает количество идентификаций, количество значительных идентификации между группами увеличивается с более реплицирует10.
Из-за нижней обилие фосфолипопротеиновый в клетке начиная в достаточном количестве белка необходимо получить глобальный phosphoproteome от рака простаты образцов в режиме обнаружения. В этих экспериментах был использован 5 мг белка. Примерно пять почти вырожденная 15-см блюда клеток обеспечивают достаточное количество белка в качестве вклада в этот протокол, хотя это будет линия зависимой ячейки. Что касается опухолевой ткани ожидаемой доходности белка — около 6-8% массы ткани. В параметре в пробирке , положительный контроль образец для рассмотрения является добавление ванадата 1 мм за 30 мин до уборки клетки. Ванадат, ингибитор фосфатазы конкурентных белка phosphotyrosyl, сохранит фосфорилирования тирозина, тем самым увеличивая количество pY пептид идентификаций29.
Чистой пищеварения является ключевым шагом для максимального phosphopeptide идентификации. Помимо испытания пятно Кумасси процент пропущенных разобщенность в данных может использоваться для оценки эффективности пищеварения (рис. 2). Контроль качества программного обеспечения доступен, анализирует пропущенных разобщенности и других метрик для оценки качества данных MS30. Хотя трипсина является наиболее распространенным, альтернативные протеаз доступны5 адрес покрытие пробелов в протеома где оптимальной tryptic пептиды не может быть создан31. Параметры анализа программного обеспечения MS затем необходимо будет соответственно изменяться с учетом изменений в протеаз.
Протокол использует иммунопреципитации (для обогащения pY) а также диоксида титана (TiO2) для обогащения для phosphopeptides. Альтернативные подходы к обогащению для пептидов включать иммобилизованными металла аффинной хроматографии (ИАЦ), другие оксиды металлов для окиси металла аффинной хроматографии (МСХК) например, гидроксид алюминия и захват сродства иона металла на полимерной основе (PolyMAC) 5,12. Предыдущие исследования показали, что различные обогащения методы обогащения для различных групп населения phosphopeptides32. К примеру IMAC обогащает более multi фосфорилированных пептидов при МСХК предпочтительно обогащает для моно фосфорилированных пептиды33. Представитель результаты настоящего Протокола отразить это замечание (рис. 4В). Недавнее издание продемонстрировал, что сочетание IMAC и МСХК, с использованием гибридного материала потенциально может обеспечить больший охват видов phosphopeptide34. Таким образом этот протокол может быть изменен для использования других методов обогащения параллельно для проведения более всеобъемлющего анализа phosphoproteomic.
Набор программного обеспечения26 MaxQuant используется для анализа данных MS в настоящем Протоколе, но35 коммерческих приложений также доступны для phosphopeptide идентификации и количественной оценки. Для phosphopeptide идентификации применяется вероятностью локализации отсечки. Этот фильтр выполняется для выбора для phosphopeptides с высокой степенью уверенности (то есть, больше, чем 0,75), в phosphoresidue идентификации10,28. Другими словами, суммируются вероятность всех других остатков, которые могут потенциально содержать фосфо группа меньше 0,25. Этот среза могут подниматься для увеличения жесткости phosphopeptide отбора. В отношении числа идентификаций ожидаемое количество pY пептиды находится в сотни, а ожидаемое количество pST пептиды находится в высокой тысячи. Эти значения отражают распределение отмечалось ранее phosphoproteome, где около 2%, 12% и 86% phosphosites являются pY, pT и pS, соответственно28.
Если pY и pST обогащения шаги выполняются параллельно, шаги подготовки образца в протоколе можно выполнить в течение шести дней. Сопряжения с мощным инструментом МС, phosphopeptide обогащения протоколы, такие как это предоставить глобальный подход для ученых, для сбора данных для анализа phosphoproteome в их соответствующих научно-исследовательских областях.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим членов Дрейк лаборатории для предоставления консультаций и ввод на рукопись. Мы также благодарим членов биологических масс спектрометрии объекта из школы Роберта Вуда Джонсона медицинской и Rutgers, государственного университета Нью-Джерси, для предоставления консультаций и проведения масс-спектрометрии на наших образцов. Ларри C. Cheng поддерживается путем национального института Генеральной медицинских наук национальных институтов здоровья под номером T32 GM008339 премии. Томас Graeber G. поддерживается NCI/низ (спор в CA092131 P50 рака простаты; P01 CA168585) и Американского онкологического общества исследования ученый награду (RSG-12-257-01-КЭ). М. Джастин Дрейк поддерживается Департаментом по обороны простаты рак исследований программы W81XWH-15-1-0236, простаты рак Фонда молодой следователь премии, фонд здравоохранения Нью-Джерси и точности медицины инициатива пилот награду от Рутгерса Институт рака Нью-Джерси.
Материалы
| Name | Company | Catalog Number | Comments |
| Ultra-Low Temperature Freezer | Panasonic | MDF-U76V | |
| Freezer -20 °C | VWR | scpmf-2020 | |
| Swing rotor bucket | ThermoFisher Scientific | 75004377 | |
| Vacuum manifold | Restek | 26080 | |
| Lyophilizer | Labconco | 7420020 | |
| CentriVap Benchtop Vacuum Concentrator | Labconco | 7810010 | |
| End-over-end rotator | ThermoFisher Scientific | 415110Q | |
| Razor blade | Fisher Scientific | 620177 | |
| Amicon Ultra-15 Centrifugal Filter Units | Millipore Sigma | UFC901024 | |
| Glass culture tubes | Fisher Scientific | 14-961-26 | |
| Parafilm | Fisher Scientific | 13-374-12 | |
| 20G needle | BD | B305175 | |
| Kimwipes | Fisher Scientific | 06-666A | |
| Screw cap cryotube | ThermoFisher Scientific | 379189 | |
| Nunc 15 mL conical tubes | ThermoFisher Scientific | 12-565-268 | |
| Gel loading tips | Fisher Scientific | 02-707-181 | |
| Millipore 0.2 µm spin filter | Millipore Sigma | UFC30GVNB | |
| Low protein-binding Eppendorf tubes | Eppendorf | 22431081 | |
| anti-Phosphotyrosine, Agarose, Clone: 4G10 | Millipore Sigma | 16101 | |
| 27B10.4 antibody | Cytoskeleton | APY03-beads | |
| Peptide assay kit | Thermo Scientific | 23275 | Step 7 |
| TopTip | PolyLC Inc | TT200TIO.96 | Steps 5 and 9 |
| SCX columns (PolySULFOETHYL A) | PolyLC Inc | SPESE1203 | |
| 3 mL syringe | BD | 309657 | |
| Trifluoracetic Acid (TFA) | Fisher Scientific | PI-28904 | |
| Acetonitrile (ACN) | Fisher Scientific | A21-1 | |
| Lactic acid | Sigma-Aldrich | 69785-250ML | |
| Ammonium Hydroxide | Fisher Scientific | A669S-500 | |
| Potassium Phosphate Monobasic | Fisher Scientific | BP362-500 | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Calcium Chloride Dihydrate | Fisher Scientific | BP510-500 | |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypsin, TPCK Treated | Worthington Biochemicals | LS003740 | |
| Lysyl Endopeptidase | Wako Pure Chemical Industries, Ltd. | 125-05061 | |
| MonoTip | PolyLC Inc | TT200TIO.96 | Step 10 |
| ZipTip | MilliporeSigma | ZTC18S096 | Step 6 |
| nanoEase, MZ peptide BEH C18, 130A, 1.7 μm, 75 μm x 20 cm | Waters | 186008794 | Step 11: analytical column |
| Acclaim PepMap 100 C18 LC Columns | ThermoFisher Scientific | 164535 | Step 11: trap column |
| Ultimate 3000 RLSCnano System | Dionex | ULTIM3000RSLCNANO | Step 11 |
| Q Exactive HF | ThermoFisher Scientific | IQLAAEGAAPFALGMBFZ | Step 11 |
| MilliQ water | deionized water used to prepare all solutions and bufferes | ||
| Sonic Dismembrator | Fisher Scientific | FB-120 | sonicator |
| Polytron System PT | Kinematica AG | PT 10-35 GT | homogenizer |
Ссылки
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Paller, C. J., Antonarakis, E. S. Management of biochemically recurrent prostate cancer after local therapy: evolving standards of care and new directions. Clinical Advances in Hematology & Oncology. 11 (1), 14-23 (2013).
- Lowrance, W. T., Roth, B. J., Kirkby, E., Murad, M. H., Cookson, M. S. Castration-resistant prostate cancer: AUA guideline amendment 2015. The Journal of Urology. 195 (5), 1444-1452 (2016).
- Domon, B., Aebersold, R. Options and considerations when selecting a quantitative proteomics strategy. Nature Biotechnology. 28 (7), 710-721 (2010).
- Zhang, Y. Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. Protein analysis by shotgun/bottom-up proteomics. Chemical Reviews. 113 (4), 2343-2394 (2013).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- Bantscheff, M., Lemeer, S., Savitski, M. M., Kuster, B. Quantitative mass spectrometry in proteomics: critical review update from 2007 to the present. Analytical and Bioanalytical Chemistry. 404 (4), 939-965 (2012).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513-2526 (2014).
- Rubbi, L., et al. Global phosphoproteomics reveals crosstalk between Bcr-Abl and negative feedback mechanisms controlling Src signaling. Science Signaling. 4 (166), ra18 (2011).
- Hogrebe, A., et al. Benchmarking common quantification strategies for large-scale phosphoproteomics. Nature Communications. 9 (1), 1045 (2018).
- Rush, J., et al. Immunoaffinity profiling of tyrosine phosphorylation in cancer cells. Nature Biotechnology. 23 (1), 94-101 (2005).
- Fila, J., Honys, D. Enrichment techniques employed in phosphoproteomics. Amino Acids. 43 (3), 1025-1047 (2012).
- Mertins, P., et al. Proteogenomics connects somatic mutations to signalling in breast cancer. Nature. 534 (7605), 55-62 (2016).
- Drake, J. M., et al. Phosphoproteome integration reveals patient-specific networks in prostate cancer. Cell. 166 (4), 1041-1054 (2016).
- Lue, H. W., et al. Metabolic reprogramming ensures cancer cell survival despite oncogenic signaling blockade. Genes & Development. 31 (20), 2067-2084 (2017).
- Francavilla, C., et al. Phosphoproteomics of primary cells reveals druggable kinase signatures in ovarian cancer. Cell Reports. 18 (13), 3242-3256 (2017).
- Zhang, H., et al. Integrated proteogenomic characterization of human high-grade serous ovarian cancer. Cell. 166 (3), 755-765 (2016).
- Skaggs, B. J., et al. Phosphorylation of the ATP-binding loop directs oncogenicity of drug-resistant BCR-ABL mutants. Proceedings of the National Academy of Sciences of the United States of America. 103 (51), 19466-19471 (2006).
- Zimman, A., et al. Activation of aortic endothelial cells by oxidized phospholipids: a phosphoproteomic analysis. Journal of Proteome Research. 9 (6), 2812-2824 (2010).
- Zimman, A., Berliner, J. A., Graeber, T. G. Phosphoproteomic analysis of aortic endothelial cells activated by oxidized phospholipids. Methods in Molecular Biology. , 53-69 (2013).
- Humphrey, S. J., Azimifar, S. B., Mann, M. High-throughput phosphoproteomics reveals in vivo insulin signaling dynamics. Nature Biotechnology. 33 (9), 990-995 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Meyer, T. S., Lamberts, B. L. Use of coomassie brilliant blue R250 for the electrophoresis of microgram quantities of parotid saliva proteins on acrylamide-gel strips. Biochimica el Biophysica Acta. 107 (1), 144-145 (1965).
- Bergstrom Lind, S., et al. Immunoaffinity enrichments followed by mass spectrometric detection for studying global protein tyrosine phosphorylation. Journal of Proteome Research. 7 (7), 2897-2910 (2008).
- Pinkse, M. W., Uitto, P. M., Hilhorst, M. J., Ooms, B., Heck, A. J. Selective isolation at the femtomole level of phosphopeptides from proteolytic digests using 2D-NanoLC-ESI-MS/MS and titanium oxide precolumns. Analytical Chemistry. 76 (14), 3935-3943 (2004).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nature Biotechnology. 26 (12), 1367-1372 (2008).
- Cox, J., et al. Andromeda: a peptide search engine integrated into the MaxQuant environment. Journal of Proteome Research. 10 (4), 1794-1805 (2011).
- Olsen, J. V., et al. Global, in vivo, and site-specific phosphorylation dynamics in signaling networks. Cell. 127 (3), 635-648 (2006).
- Huyer, G., et al. Mechanism of inhibition of protein-tyrosine phosphatases by vanadate and pervanadate. The Journal of Biological Chemistry. 272 (2), 843-851 (1997).
- Bielow, C., Mastrobuoni, G., Kempa, S. Proteomics quality control: quality control software for MaxQuant results. Journal of Proteome Research. 15 (3), 777-787 (2016).
- Swaney, D. L., Wenger, C. D., Coon, J. J. Value of using multiple proteases for large-scale mass spectrometry-based proteomics. Journal of Proteome Research. 9 (3), 1323-1329 (2010).
- Bodenmiller, B., Mueller, L. N., Mueller, M., Domon, B., Aebersold, R. Reproducible isolation of distinct, overlapping segments of the phosphoproteome. Nature Methods. 4 (3), 231-237 (2007).
- Leitner, A., Sturm, M., Lindner, W. Tools for analyzing the phosphoproteome and other phosphorylated biomolecules: a review. Analytica Chimica Acta. 703 (1), 19-30 (2011).
- Yang, D. S., et al. Design and synthesis of an immobilized metal affinity chromatography and metal oxide affinity chromatography hybrid material for improved phosphopeptide enrichment. Journal of Chromatography A. 1505, 56-62 (2017).
- Al Shweiki, M. R., et al. Assessment of label-free quantification in discovery proteomics and impact of technological factors and natural variability of protein abundance. Journal of Proteome Research. 16 (4), 1410-1424 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены