Method Article
用活细胞显微镜研究低压等离子体灭菌对枯草芽孢杆菌孢子存活的不利影响
摘要
这项协议说明了评估在用低压等离子体处理后恢复枯草芽孢杆菌孢子后, 监测活力参数和 DNA 修复过程的相关性所需的重要连续步骤。荧光标记的 DNA 修复蛋白质通过时间分辨共焦显微镜和扫描电子显微镜。
摘要
等离子体灭菌是一种有前途的替代传统的杀菌方法的工业, 临床和航天的目的。低压等离子体 (LPP) 放电含有广泛的活性物种, 导致快速的微生物失活。为了研究 LPP 杀菌的效率和机制, 我们使用试验生物体的孢子枯草芽孢杆菌, 因为它们对常规灭菌程序的抵抗力非常高。我们描述了枯草芽孢杆菌的生产孢子单分子膜, 低压等离子体在双电感耦合等离子体反应器中的杀菌过程, 用扫描电子显微镜 (SEM) 表征孢子形态, 以及用活细胞显微镜分析孢子的萌发和生长。血浆物种的一个主要目标是基因组材料 (dna) 和修复的等离子体诱导 DNA 损伤孢子复活是至关重要的生存的有机体。在这里, 我们研究了孢子萌发能力和 dna 修复在孢子萌发和生长后 LPP 的作用, 通过跟踪荧光标记的 dna 修复蛋白 (RecA) 与时间分辨共聚焦荧光显微镜。经过治疗和未经处理的孢子单膜激活发芽和可视化的倒置共聚焦活细胞显微镜随时间的反应, 个别孢子。我们的观察表明, 萌发和超过孢子的分数取决于 LPP 的持续时间, 在120s 后达到最低限度. RecA-YFP (黄色荧光蛋白) 荧光检测仅在少数孢子和发展在所有超过细胞, LPP 处理孢子略有升高。此外, 从 LPP 处理的孢子中获得的一些植物性细菌在细胞质中呈上升趋势, 并趋于溶解。所描述的个体孢子分析方法可以作为研究孢子萌发和生长其他方面的典范。
引言
太空探索的一个主要目标是在太阳系的其他行星体和卫星上寻找生命形式和生物分子的特征。将地球起源的微生物或生物分子转移到重要的勘探领域, 对火星和欧罗巴1等行星机构的生命探测任务的发展和完整性产生了特别的影响。1967年由空间研究委员会设立的《行星保护国际准则》对载人和机器人任务向其他行星、卫星、小行星和其他天体实施了严格的管制, 并对在发射前对航天器和关键硬件部件进行清洗和灭菌, 以消除对陆地微生物的污染, 防止天体的交叉污染2。在过去的十年中, 非热等离子体的应用在生物医学和营养学研究以及航天应用中得到了广泛的关注,3,4,5。等离子体灭菌是一种有前途的替代传统的杀菌方法, 因为它提供了快速和有效的微生物失活6, 同时对敏感和热不稳定材料温和。等离子体放电含有活性剂的混合物, 如自由基、带电粒子、中性/激发原子、紫外线 (UV) 中的光子和真空紫外 (真空) 谱, 导致快速的微生物失活3。本研究采用双电感耦合低压等离子体产生的低压等离子体 (DICP) 源7,8灭活枯草芽孢杆菌孢子在玻璃测试表面上分布。
家庭的革兰氏阳性菌Bacillaceae广泛分布在土壤、沉积物和空气的自然栖息地以及在不寻常的环境中, 如洁净室设施和国际空间站9,10 ,11。最明显的特点,芽孢杆菌是能力形成高抗性休眠孢子 (以下简称孢子) 生存不利的条件, 如养分枯竭12。孢子通常比它们的营养细胞相对于各种处理和环境压力更具抵抗力, 包括热、紫外线、γ辐照、脱水、机械破坏和有毒化学物质, 如强氧化剂或pH 变化的试剂 (在参考文献13,14), 因此是测试微生物失活方法效率的理想对象。由于基因组 DNA 是细菌的等离子体治疗的主要目标15,16, 修复的血浆诱导的 dna 损伤 (如 dna 双链断裂) 孢子复活是至关重要的生存细菌13, 17。
因此, 我们研究了孢子萌发能力和 dna 修复在孢子萌发和生长过程中的作用, 处理后的孢子与低压力氩等离子体的个别孢子和它们的表达荧光标记 dna 修复蛋白质 RecA 与时间分辨共焦荧光显微镜。我们给出了在单分子膜中制备枯草芽孢杆菌孢子的步骤说明, 以实现重现性试验结果, 用低压等离子体处理芽孢膜灭菌, 制备等离子体处理的孢子超微结构评价使用扫描电子显微镜 (SEM) 和现场细胞显微镜分析的个人孢子的水平与监测的活性 DNA 修复过程中发生的细胞内反应等离子体治疗。
研究方案
1.枯草芽孢杆菌孢子的生产和纯化
- 为孢子生产, 转移各自的B. 枯草芽孢杆菌菌株的5毫升隔夜文化, 补充适当的抗生素, 到200毫升双强度液体谢弗产培养基 (每公升 16 g 营养素肉汤, 氯化钾 2 g, 0.5 g MgSO4* 7 H2O, 2 mL 1 M Ca (不3)2, 2 毫升 0.1 M MnCl2 * 4 h2O, 2 ml 1 mM FeSO4, 2 ml 50% (w/v) 葡萄糖18), 并培养它与蓬勃发展的曝气在37° c 72 H 或直到 > 95% 的文化有孢子。使用以下菌株的孢子:枯草芽孢杆菌PY79 (野生类型) b. 枯草芽孢杆菌 PY79ΔrecA:: 新 (缺乏 DNA 修复蛋白 recA) B. 枯草杆菌PY79 recA -yfp:: 猫 (recA 与黄融合荧光蛋白 [YFP]19)。
- 在50毫升的试管中用离心法收获孢子15分钟 3000 x g, 通过反复洗涤步骤 (最多15次) 净化样品, 使用无菌蒸馏的 H2O, 并通过相衬显微镜检查纯度和发芽状态。确保孢子悬浮物由相明亮的孢子 ( & gt ; 99% ) 组成 , 没有营养细胞 ( 棒 ) , 发芽孢子 ( 黑色 / 灰色外观 ) 和细胞碎片 , 否则进一步的显微实验可以扰。清洗样品, 直到达到预期纯度。
- 通过在 LB 琼脂上镀出50µL 的10倍稀释 (即: 使用30µL 样品 + 270 µL 无菌水进行1:10 稀释, 确定孢子滴度。采取30µL 从特别稀释到270µL H2O 为1:100 稀释等等) 计算 CFU (殖民地形成单位) 和孵育板材在37° c 隔夜。CFU 测定后, 通过浓缩或稀释无菌水, 将样品调整到每毫升 109孢子。
2. 气溶胶沉积的枯草芽孢杆菌孢子的样品制备
注意: 孢子的堆积和重叠可能导致在治疗过程中产生遮蔽效应, 最终导致假失活动力学。为了尽量减少这个问题, 用气溶胶沉积技术准备孢子样品20。简要地, 控制高精确度二物质喷管与电子定时器调控液体吞吐量与压力的载体气体的流动 (这里 N2)。使用氮气流量将注入的液体样品通过喷嘴出口分散。
- 将样品载体以灭菌的显微幻灯片 (用于生存动力学) 或圆形25毫米片 (用于荧光跟踪 DNA 修复过程/cLSM; 共聚焦激光扫描显微镜) 置于电控气溶胶喷涂单元内与喷嘴对准。所用的孢子浓度需要达到百倍的最终浓度。
- 将孢子培养的1毫升转移到喷嘴流体入口, 并在1.3 巴压力下启动 0.1 s 的喷涂过程。喷洒的孢子悬浮 (1 x 107) 形成一层薄薄的薄膜, 在几秒钟内迅速干燥, 形成均匀分布的孢子单层。在室温下将处理过的样品载体储存在无菌容器中。
3. 低压等离子处理
- 制备生物样品的等离子体处理系统, 在 5 Pa 用氩等离子体在 500 W 处操作系统, 5 分钟。这样, 系统中的所有曲面都将被清洗和预热。这减少了分子的黏附从环境空气, 即氮气, 氧气和水, 当排泄系统。在对系统进行预处理后, 在玻璃货架的帮助下, 将样品放在反应堆容器的中心, 并将其仔细地放在反应器内。
- 使用至少三生物复制。关闭会议厅并在 2 Pa. 后疏散, 将过程气体填入会议厅。调节系统压力至 5 Pa。
- 经过规定的工艺时间, 关闭电源和供气, 并仔细排气系统, 以防止从样品持有人吹样品。通风后, 取出样品并将样品放置在系统中的下一个参数中。对于非等离子处理的控制暴露样品到真空仅 (5 Pa) 在过程气体的存在等效于最长的应用的血浆时间。
4. 孢子存活的恢复和评价
- 准备一份蒸压10% 聚乙烯醇 (PVA) 的溶液, 用大约500的µL 仔细地盖住样品托架, 并让它们风干 4 h. 用无菌钳将干燥的 PVA 层 (现在含有孢子样本) 剥离, 并将其转移到2毫升反应管。将1毫升无菌水加入试管, 通过涡流溶解 PVA 层。此过程导致孢子的 > 95% 的恢复, 不影响其萌发能力21。
- 在96井板 (即270µL 无菌 H2O + 30 µL 样品/前稀释) 中, 连续地稀释1:10 的无菌水中的样品。在性汤营养琼脂 (LB) 上每稀释50µL, 在夜间孵育37° c 的盘子, 并列举生长的菌落数量 (CFU)。
5. 活体细胞显微镜和 DNA 修复过程在萌发孢子中的追踪
- 对于发芽实验, 准备一个1毫米厚的1.5% 磅琼脂垫, 煮沸700µL 培养基和吸管它成一个无菌显微镜培养皿。10分钟后, 切出一个8毫米 x 8 毫米 x 1 毫米磅琼脂垫与无菌手术刀和转移琼脂仔细在顶部的孢子单分子是休息在25毫米玻璃片。
注意: 这一步对于个体孢子的可视化是至关重要的, 并允许跟随它们的反应, 对营养琼脂诱导的发芽激活。因此, LB 琼脂服务两个目的, (1) 固定的孢子在表面上, 避免孵育沿表面和光学焦点, 和 (2) 激活孢子发芽。 - 用琼脂覆盖样品后, 用 63 x/1.3 平面物镜油浸泡物镜, 将玻璃片迅速转移到成像室, 并通过自动共焦激光扫描显微镜与倒置光学显微镜对样品进行显微观察。
-
执行荧光成像 (YFP) 与激发波长 514 nm 和发射可以检测到520和 560 nm。
- 使用照片乘数 (透射光路) 之一在扫描模式下记录明亮的图像。
- 记录时间序列与激光功率为 2.6%, 并设置共焦孔径为5通风单位和在采样频率1帧每三十年代从 0 h 到 5 h, 根据实验。特别值得注意的是, 高剂量的单色激光照射在 514 nm 完全抑制发芽 (图 1A, B)。
- 在整个成像过程中, 在加热阶段保持样品在37° c (环境空气湿度)。每个条件至少使用三生物复制。在孢子聚集的情况下, 多层孢子分布或尘埃粒子污染, 堵塞等离子体处理 ("阴影") 可能发生, 并使阴影孢子发芽 (图 1C, D)。
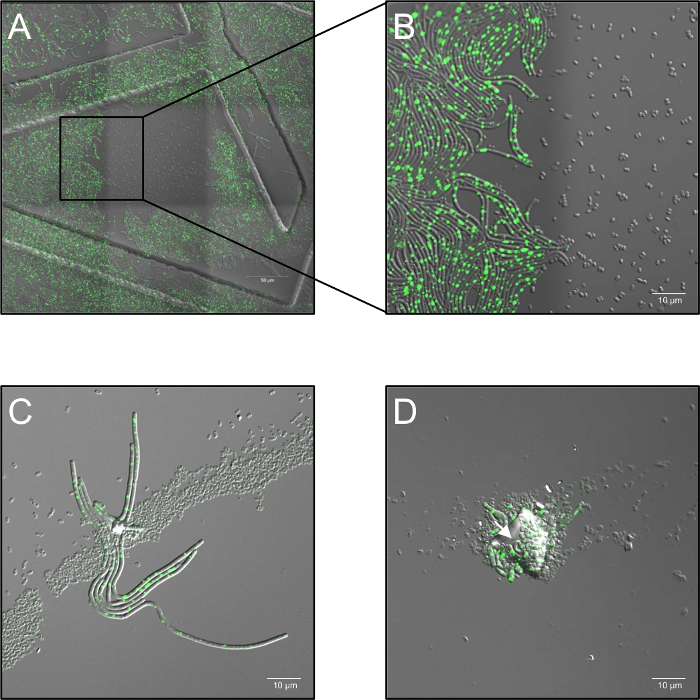
图 1: 等离子体处理的孢子共焦活细胞荧光显微镜观察到的潜在问题(A, B)高剂量单色 (514 nm) 激光照射对孢子萌发的抑制作用。(A) 概述 (3 x 3 缝合框架) 的枯草芽孢杆菌(LAS72, RecA-YFP) 孢子萌发后180分钟。中间的框架被暴露在三十年代间隔时间到高剂量的激光 (514 nm, 70% 激光功率), 而周围地区 (= 帧) 没有照亮 (光明场通道合并图像和 RecA YFP 荧光; 有序结构由使用35毫米成像盘子与印有500µm 网格).(B) 演示了一个4X 的放大视图, 它显示了光照和非光照区域之间的边界, 表明孢子暴露在高剂量的单色激光照射下没有发芽和生长, 而孢子非光照区域完全恢复到表达明亮 RecA-YFP 荧光 (绿色信号) 的植物细菌。(C, D)被污染的微粒或多层孢子 (箭头) 覆盖的孢子似乎可以通过等离子体处理来保护底层孢子免遭失活, 并允许它们的萌发和生长 ("遮蔽效应")。(C) 孢子在六十年代被等离子体处理, 在萌发后180分钟或在 (D) 中成像, 120s 和成像后240分钟.请单击此处查看此图的较大版本.
6. 扫描电子显微镜 (SEM)
- 使用扫描电子显微镜, 提供有关等离子体处理孢子的表面形貌的超微结构信息, 与未经治疗的对照相比。用溅射涂布机在片上用金钯 (3 nm) 将干燥的孢子单层膜涂上。使用场发射扫描电子显微镜对样品进行成像, 在5伏加速度电压下操作, 包括镜头内二次电子探测器, 以揭示地形对比。
7. 数据分析
- 确定孢子生存从商数 n/n0, 其中 n 是平均 CFU 的处理样本和 n0是平均 CFU 的未经治疗的真空控制。用氩等离子体处理孢子失活的时间函数 (秒)。将所有数据表示为平均值和标准偏差 (n = 3)。
- 使用成像软件分析活细胞成像获得的图像。在实验开始时以及在4小时后, 对孢子萌发和超过在等离子体处理后的比例进行量化, 在代表性的框架中计数孢子。为了在孢子存活测定中的意义确定, 使用统计软件对方差分析进行单因素方差检验。P值 < 0.05 被视为具有统计学意义。
结果
等离子体处理的枯草芽孢杆菌孢子的存活
等离子体处理的枯草芽孢杆菌在本研究中使用的孢子显示, 随着等离子体处理时间的延长, 存活率下降 (图 2)。表达recA-基因的菌株的孢子 YFP 显示了类似于野生型菌株孢子的存活曲线, 表明基因修饰对细菌活力没有显著影响。与野生型菌株的孢子相比, RecA 缺陷菌株的孢子具有更高的等离子体处理灵敏度, 表明 RecA 基因的存在降低了血浆引起的活力丧失。特别是短的血浆治疗十五年代 (p <0.003) 和三十年代 (p < 0.004) 导致 RecA 缺乏菌株的活力显著下降与野生型和 RecA YFP 菌株的比较。在九十年代的等离子治疗后, 所有菌株的活力都被约三级的数量减少。

图 2: 低压氩等离子体处理后不同菌株的枯草芽孢杆菌孢子的存活.生存 (平均 CFU 等离子体处理的孢子/平均 CFU 的真空处理孢子; 误差线表示标准偏差) 是针对等离子体处理的持续时间绘制的。PY79 (狂放的类型; 闭合的圈子), LAS72 (RecA-YFP; 灰色圈子) 和 LAS24 (ΔRecA; 开放圈子)。统计分析表明, PY79 (未修饰 RecA) 与 LAS72 (RecA-YFP-融合) 孢子存活性无显著差异。
等离子体处理的孢子超微结构的扫描电镜分析
为了了解等离子体处理对孢子的形态学影响, 用扫描电镜 (SEM) 分析了血浆处理后孢子的表面形貌, 并与真空处理的孢子 (控制) 进行了比较。枯草芽孢杆菌的外表面显示出特征性的纵脊状结构, 在所有处理过的和未经治疗的孢子中都是可见的 (图 3)。血浆治疗由三十年代导致孢子表面形态学的没有重大变动与控制比较 (图 3A-c)。增加等离子体处理的持续时间 (60-240s) 会导致更粒度的孢子表面 (图 3D-F), 在120或240s 的孢子中可以观察到小的裂缝和裂隙。此外, 小小球出现孢子表面 (120s 和240s 处理,图 3E, F), 这是由从大衣, 皮质或内部核心22的释放材料造成的。这些小球覆盖整个孢子, 可以发现在脉状结构以及中间表面。

图 3: 低压等离子体处理后在玻璃片上喷洒的枯草芽孢杆菌(LAS72, RecA-YFP) 孢子的扫描电镜.在(A)中显示了只暴露于真空中而不受等离子体 (控制) 的孢子。(B-F)孢子的等离子体处理时间延长 (15, 30, 60, 120 和 240s)。孢子是等离子体处理的六十年代或更长的表面比控制孢子或孢子, 是等离子体处理15和三十年代. 在孢子等离子体表面可见裂纹和裂隙 (白色箭头), 治疗120或 240s. 请单击此处查看此图的较大版本.
等离子体处理的枯草芽孢杆菌的活细胞显微镜孢子
活细胞显微镜的复活孢子从枯草菌株表达荧光标记修复蛋白 RecA (RecA-YFP) 进行, 以分析种子的发芽能力和表达 RecA-YFP 的个体孢子对等离子体处理的反应。在这里, 我们使用时间分辨共焦激光扫描显微镜, 以跟踪发芽, 生长, 并发展到植物状态的等离子体处理的孢子 (图 4), 就潜在的已知问题, 如阴影效果或高剂量单色激光照射对发芽的抑制作用 (图 1)。只暴露在真空中的孢子 (控制,图 4A-c), 在孢子复活的早期状态 (0-65 min, 未显示) 中展示了少量的荧光信号。荧光强度的增加, 很可能是由于 RecA-YFP 的积累, 在≥65分钟, 当营养细胞形成, 第一个细胞开始分裂。所有这些细胞都有一个荧光信号, 它们聚集在每个细胞的至少一个位置内。几乎所有的孢子 (98 ± 2%; 589 ± 14, n = 4) 以真空作为控制发芽, 并发展成杆状细胞形态, 单个细胞的长度相当一致 (图 4B-C)。与真空控制中的孢子相比, 十五年代用等离子体处理的孢子已经显示出低于75± 4% (197 ±8孢子, n = 3,图 4d-F) 的发芽率, 这表明等离子体处理会导致休眠孢子的损伤,防止发芽。此外, 超过细胞的形态学不同于细胞在控制中的形态。细胞成长为广泛的长棒 (比控制长) 或保持小, 并坚持孢子大衣 (图 4G I)。此外, 大多数拉长的细胞溶解增加细胞大小 (白色箭头头,图 4F)。与控制单元 (图 4C, F) 中的信号相比, 细胞内 RecA-YFP 的荧光信号似乎略有增加, 但不能观察到显著的差异 (未显示)。等离子体处理的孢子在三十年代发芽25± 6% (99 ±4孢子, n = 3) 和营养细胞明显延迟生长, 相比之下, 在十五年代等离子体治疗后控制孢子和孢子。营养细胞是相当小的和杆状的, 但长度变化 (图 4G I)。然而, 所有大小的细胞可能溶解在更长的潜伏期期间, 在十五年代以后血浆治疗被看见为样品。六十年代以后血浆治疗少于2± 2% (8 ±8孢子, n = 3) 孢子能形成营养细胞 (图 4J L)。对90、120或240s 的等离子体处理的孢子可以进行分析, 但它们没有任何突起或 RecA-YFP (不显示) 的荧光水平的任何变化。
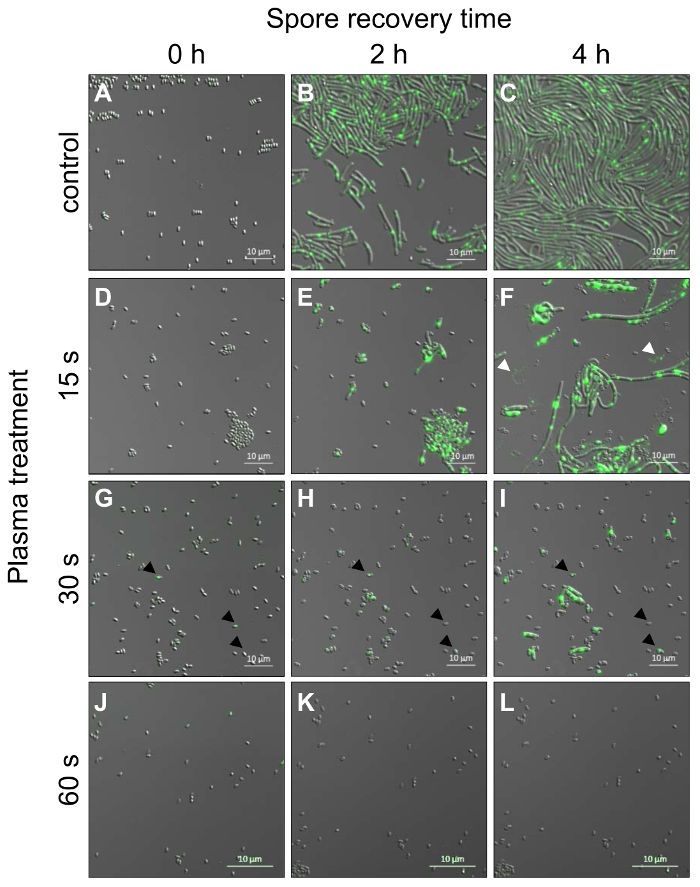
图 4: 等离子体处理和萌发开始后, 由表达 RecA-YFP 的菌株的共焦激光扫描活细胞显微镜枯草杆菌孢子.孢子是随时间推移 (一个图像每三十年代) 和图像的时间点 0, 2 和4小时显示。(A-c)仅用真空处理的孢子, 不与等离子体 (控制) 发芽并生长到营养细胞 (B) 并进入指数增长阶段 (C)。(d-L)用低压氩等离子体处理不同时间的孢子在其生长过程中与对照孢子相比有显著差异 (详见文本)。(D-F) 十五年代治疗 (白色箭头头代表营养细胞, 最近裂解), (G I) 三十年代治疗 (黑箭头头形象化营养细胞, 是小和黏附在孢子外套) 和 (J L) 六十年代治疗经过0小时、2小时和4小时孢子恢复时间。请单击此处查看此图的较大版本.
讨论
使用低温、低压等离子体进行表面灭菌是一种很有前途的替代品, 例如用电离辐射、化学药品 (例如,2O2之类的气体进行处理) 和传统的灭菌程序环氧乙烷) 或干燥和潮湿的热量23。一般的杀菌方法主要是提供有效的灭菌, 但已知会影响处理过的材料, 并对操作者构成潜在的风险。低压等离子体提供了一个快速和均匀的生物失活, 使用的成分, 如紫外线光子, 自由电子, 离子和退出的原子或分子 (例如ROS)。因此, LPP 可用于热腐蚀敏感材料, 如用于植入物的热塑性聚合物、电子仪器或复杂的 3 d 结构。在本论文中, 我们演示了这种测试系统的应用, 其中喷射枯草芽孢杆菌孢子20在一个特殊的低压等离子体反应器中被处理, 这是最近详细介绍的7。对等离子体处理后的孢子进行显微亮场检查, 可以获得对灭菌效率的总体估计。然而, 我们有兴趣的目标的基础机制的低压等离子体及其影响孢子失活的分子水平。结合荧光跟踪显微镜, 它使我们能够揭示这个特定的分子反应在等离子体处理的孢子的细节, 并有可能让我们深入了解低压等离子体的基本失活机制。
在这里, 我们的重点是分析等离子体处理效率和效果, 使用活体细胞显微镜, 这允许后续的个体孢子萌发后萌生。值得注意的是, 这一特殊的方法揭示了一些新的结果, 不能通过测定细胞数或 CFU 来测量整个孢子的活力来提供。首先, 等离子体处理孢子不仅影响了生长的能力的剂量依赖性的方式, 预期从测量生存的 CFUs, 但也形态学的营养细胞, 往往发展大棒不能根据适当的细胞分裂和小细胞黏附在孢子 (十五年代血浆治疗) 或细胞在减少的长度 (三十年代血浆治疗) 形成间隔。观察的长度减少的细胞显示没有恢复正常细胞长度在以后的时间点。此外, 活细胞成像显示, 大多数形态学改变的细胞溶解在后期的观察阶段。这意味着, 孢子在等离子体处理过程中所获得的损害只有在孢子恢复的后期才有效, 推测是由于 DNA 损伤, 而用于发芽和生长的机械对等离子灭菌的鲁棒性比植物生长所需的机械。显着, DNA 修复 RecA 蛋白的表达似乎是低的, 几乎没有在孢子和发展期间生长和营养阶段, 表明 RecA-YFP 荧光17的增加。然而, 即使在超过等离子体处理过的孢子中稍有增加的 RecA 表达, 与控制孢子相比, 也无助于定量地抢救细胞活力, 因为大多数细胞在生长后溶解或爆裂, 特别是在超过3小时后孵化.这种效果可以用活细胞电影从发芽孢子的时间推移图像中进行可视化。我们不能排除, 这种效果是过分强调的特殊培养条件, 细胞是被迫在单层使用薄薄的琼脂覆盖。
活体细胞显微镜分析的另一个结果是, 孢子单层表面的微粒污染 (如灰尘颗粒、其他孢子) 可以保护底层孢子免受等离子体的破坏性影响。在这种情况下, 更长的等离子处理似乎效率低下。由于这种污染是难以完全避免的, 可替代的等离子体治疗策略应进行测试, 如在等离子体处理期间使用行星旋转结合延长治疗时间。通过扫描电镜分析表明, 孢子涂层穿孔的等离子体处理时间增加, 这是符合等离子体介导的作用理论的物质22,24。延长曝光时间 (> 240s) 的等离子体可能甚至穿孔污染的微粒, 从而可能损害和灭活的基础孢子。
所提出的孢子萌发和生长的活细胞显微镜协议也适用于其他研究。用薄薄的一层琼脂覆盖孢子, 使孢子在不同的光学平面上, 并限制侧向运动。这两种效果都保证孢子和超过细胞停留在所选的成像框架内。在25之前已经描述过类似的方法, 但比这里所描述的方法具有更大的灵活性, 它允许选择几乎任何示例载体 (例如, 玻璃滑动、片或培养皿)。在我们的手中, 其他的植物细菌可以用琼脂覆盖法的活细胞显微镜进行分析。在任何情况下, 应该进行仔细的控制实验, 以评估在活细胞成像过程中照片损伤的可能效果, 因为我们观察到高剂量的单色激光完全抑制孢子萌发。除了缩短光照时间,即通过增加观察间隔, 可以通过降低激光强度和/或开共焦孔径 (针孔) 来防止这种现象。
总之, 在研究等离子体处理的效率的方法中, 在喷洒的枯草芽孢杆菌孢子单分子膜, 活细胞显微镜提供了独特的洞察力细胞事件在孢子复活期间, 并提供了可能性分析荧光标记蛋白的动态变化。此外, 特定的样品制备,即覆盖一层薄薄的琼脂的孢子, 可以通过活细胞显微镜对其他微生物的成像进行聚合。
披露声明
未声明任何利益冲突。
致谢
作者感谢安德莉亚在这项工作的部分和 Nikea 在视频拍摄期间对她的帮助的出色的技术援助。我们还要感谢莱尔对她慷慨捐赠的枯草芽孢杆菌菌株: LAS72 和 LAS24。这项工作得到了部分支持, 从德国研究基金会 (DFG) Paketantrag (PlasmaDecon 柏 728) 到 PA (AW 7/3-1) 和 RM (MO 2023/2-1) 和 dlr 赠款 dlr-FuW-Projekt ISS 生活, 射频 FuW, Teilprogramm 475 (f.m F, 大副和 rm)。F.M.F. 由亥姆霍兹空间生命科学研究学校 (SpaceLife) 的博士奖学金在德国的科隆, 德国航空航天中心 (DLR) 支持, 由亥姆霍兹协会 (亥姆霍兹-礼俗) 提供经费在六年期间 (格兰特 No。VH-KO-300) 并获得了 DLR 的额外资金, 包括航空航天执行委员会和航空航天医学研究所。这项研究的结果将被包括在博士论文的费利克斯 m。
材料
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
参考文献
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。