Method Article
Расследование пагубные последствия низкого давления плазмы стерилизации на выживание Bacillus subtilis споры с помощью Live клеток микроскопии
В этой статье
Резюме
Этот протокол иллюстрирует важный подряд шаги, необходимые для оценки релевантности мониторинга жизнеспособность параметров и процессов репарации ДНК в оживлении спор Bacillus subtilis после лечения с плазмой низкого давления путем отслеживания помечены флуоресцентным ДНК ремонт белков через время решена confocal микроскопии и растровая электронная микроскопия.
Аннотация
Плазменная стерилизация является перспективной альтернативой обычной стерилизации методов для целей космических полетов и промышленной, клинической. Низкого давления плазмы (LPP) выбросы содержат широкий спектр активных видов, которые приводят к быстрой микробной инактивации. Для изучения эффективности и механизмы стерилизации в ЗПС, мы используем споры тест организма Сенная палочка из-за их чрезвычайные сопротивления против обычных стерилизацию. Мы описываем производства B. subtilis споро монослои, процесс стерилизации, плазмы низкого давления в двойной реактор индуктивно связанной плазмы, характеристика споро морфологии, используя растровая электронная микроскопия (SEM) и анализ всхожесть и нарост споры по микроскопии живой клетки. Одной из основных целей видов плазмы – геномный материал (ДНК) и ремонт плазмы индуцированные поражения ДНК после возрождения споро имеет решающее значение для выживания организма. Здесь мы изучаем возможности прорастание спор и роль ДНК ремонта во время прорастания спор и нарост после лечения с ЗПС отслеживая дневно помечены ДНК ремонт белки (RecA) с раз решить конфокальный флуоресцентной микроскопии. Лечение и неочищенных споро монослои активирована для проращивания и визуализируется с помощью микроскопа Перевернутый конфокальный живой клетки с течением времени следить за реакцией отдельных споры. Наши наблюдения показывают, что часть прорастать и перерастает споры зависит продолжительность ЗПС лечения, достигая минимума после 120 s. RecA-рекламы ЯФП флуоресценции (желтый флуоресценции белков) был обнаружен только в немногих споры и развитым во всех перерастает клетки с небольшой высоты в ЗПС рассматривать споры. Кроме того некоторые из вегетативных бактерий производным от ЗПС рассматривать споры, показало увеличение в цитоплазме и склонны лизируют. Описаны методы для анализа индивидуальных спор может быть образцовым для изучения других аспектов прорастание спор и развитие.
Введение
Основная цель исследования космического пространства является поиск для подписи форм жизни и биомолекул на других планетных тел и Луны в нашей солнечной системе. Передачи микроорганизмов или биомолекулами наземного происхождения в критических областях разведки — особого риска для воздействия развития и целостность жизни обнаружение миссий на планетных тел, например, Марс и Европа1. Международные руководящие принципы по планетарной защиты, созданная в Комитет по космическим исследованиям (КОСПАР) в 1967 году, налагать строгие правила о пилотируемых и робототехнические миссий в других планет, их спутников, астероидов и других небесных телах и регулировать Очистка и стерилизация космических аппаратов и критических аппаратных компонентов предварительного запуска для ликвидации загрязнения земной микроорганизмов и предотвращения перекрестного загрязнения небесных тел2. За последнее десятилетие применения плазм-тепловой получила широкое внимание в исследовании биомедицинских и питания, а также в космонавтике приложений3,4,5. Плазменная стерилизация является перспективной альтернативой обычной стерилизации методы, как она предлагает быстрое и эффективное микробной инактивации6, будучи нежный для чувствительной и лабильных материалы. Плазмы сбросов содержат смесь реактивных агентов, таких как свободные радикалы, заряженные частицы, нейтральный/возбужденных атомов, Фотоны ультрафиолетового (УФ) и вакуумного ультрафиолетового (VUV) спектра, которые приводят к быстрой микробной инактивации3. В этом исследовании мы используем низкого давления плазмы, порожденные двойной индуктивно связанной плазмы низкого давления (DICP) источник7,-8 для инактивации спор Bacillus subtilis , распределенных на испытательной поверхности стекла.
Грам-положительных бактерий семейства Bacillaceae широко распространены в естественной среде обитания, почвы, отложений, и воздух, как хорошо необычных средах, таких как чистых помещений и международной космической станции9,10 ,11. Наиболее отличительной чертой рода Bacillus является способность образовывать высокой устойчивостью спящие спор (именуемый далее "споры") чтобы выжить неблагоприятные условия, такие как истощение питательных веществ12. Споры обычно гораздо более устойчивы, чем их коллеги вегетативная клетка для различных процедур и экологическим стрессам, в том числе тепла, УФ, гамма-облучения, сушка, механические нарушения и токсичных химических веществ, таких как сильные окислители или изменение рН агентов (обзор в ссылки на13,14) и поэтому идеальные объекты для тестирования эффективности методов инактивации микроорганизмов. Так как геномной ДНК является одной из основных целей плазменной обработки бактерий15,16, ремонт плазмы индуцированных повреждений ДНК (например ломает двойной нити ДНК) после споро возрождения имеет решающее значение для выживания бактерий13, 17.
Таким образом мы изучаем всхожести споры и роль ДНК ремонта во время прорастания спор и нарост после лечения споры с аргоном плазмы низкого давления, следующие отдельные споры и их выражение помечены флуоресцентным ДНК ремонт белок RecA с раз решить конфокальный флуоресцентной микроскопии. Мы предоставляем шаг за шагом инструкции подготовки B. subtilis споры в монослои для достижения воспроизводимые результаты, лечение монослои спор с плазмой низкого давления для стерилизации, подготовка плазмы рассматривать споры для Ультраструктурные оценки с использованием растровая электронная микроскопия (SEM) и анализа микроскопии живых клеток на уровне отдельных споры в концерте с мониторинг активных ДНК ремонт процессов, происходящих внутри клетки в ответ на плазменной обработки.
протокол
1. производство спор bacillus subtilis и очистки
- Для производства споро, передачи 5 мл на ночь культуры соответствующих B. subtilis штамма, дополнить соответствующие антибиотики, 200 мл двойной прочность жидких Шеффер заспорение средний (за литр 16 g питательный бульон, KCl 2 g, 0,5 г MgSO 4* 7 H2O, 2 мл 1 М Ca (№3)2, 2 мл 0,1 М НКД2 * • 4 H2O, 2 мл 1 мм FeSO4, 2 мл 50% (w/v) глюкозы18) и развивать его с энергичной аэрации при 37 ° C за 72 ч или до > 95% культуры sporulated. Споры следующие штаммы используются: B. subtilis PY79 (дикий тип) B. subtilis PY79ΔrecA:: нео (дефицит белка ремонта ДНК RecA) B. subtilis PY79 recA-рекламы ЯФП:: кошки (RecA сливается с желтым флуоресцентный белок [рекламы ЯФП]19).
- Урожай споры центрифугированием 15 мин на 3000 x g в 50 мл трубки и очистить образцы многократную стирку шаги (до 15 раз), с помощью стерильной дистиллированной H2O и проверка статуса чистоты и всхожести, фазово контрастной микроскопии. Убедитесь, что суспензий спор состоят из фазы яркий спор (> 99%) и свободны от растительных клеток (палочки), проросшие споры (черный / серый вид) и клеток мусора, в противном случае дальнейших экспериментов микроскопии может быть нарушена. Помойте образец до достижения требуемой чистоты.
- Детерминантный споро титр, обшивка из 50 мкл десятикратного серийных разведений на LB-агар (например: использование 30 мкл пример + 270 мкл стерильной водой 1:10 разрежения. Возьмите 30 мкл от конкретного разбавления до 270 мкл H2O для разбавления 1: 100 и так далее) для вычисления кое (колонии, образуя единиц) и инкубировать пластины при 37 ° C на ночь. После определения кое настройте образец 10 споры9 мл концентрации или разбавления стерильной водой.
2. Подготовка на хранение аэрозольных Bacillus subtilis споры
Примечание: Накопление и перекрывающихся спор может привести к затенение эффектов во время лечения, в конечном счете в результате фальсифицированных инактивации кинетики. Для минимизации этой проблемы, подготовьте образцы споро, аэрозольного осаждения техники20. Вкратце сопла двух вещество контроля высокой точности с электрическим таймер, который регулирует жидкого пропускную способность в концерте с потоком сжатого газа-носителя (здесь N2). Разогнать вводят жидкий образец через отверстие насадки, с помощью потока газа азота.
- Поместите держатель образца в форме стерилизованные микроскопических слайдов (для выживания кинетика) или круглой coverslips 25 мм (для флуоресцентных отслеживания репарации ДНК процессов/cLSM; Конфокальная лазерная сканирующая микроскопия) внутри электроприводом аэрозольного распыления подразделение в соответствие с соплом. Концентрация используется спор необходимо соответствовать сторицей желаемой конечной концентрации.
- Передача 1 мл культуры споро сопла жидкости входе и инициировать процесс распыления 0,1 s при давлении 1,3 бар. Распыляется споро подвеска (1 x 10-7) образует тонкую пленку на микроскопический слайд, который быстро высыхает в течение нескольких секунд для равномерно распределенных споро монослоя. Магазин образец с обработанной перевозчиков в стерильный контейнер при комнатной температуре.
3. низкого давления Плазменная обработка
- Подготовить плазменной системы для лечения биологических образцов и эксплуатации системы в 5 Па с плазмы аргона в 500 Вт на 5 мин. При этом все поверхности в системе очищены и подогреть. Это уменьшает налипание молекул из окружающего воздуха, а именно: азота, кислорода и воды, при вентиляции системы. После предварительной обработки системы вентиляционные камеры и образцы тщательно в центре реактора с помощью стеклянных стеллажей.
- Используйте по крайней мере три биологических реплицирует. Закрыть камеру и эвакуировать ниже 2 ПА после этого, заполните технологического газа в камеру. Регулирование давления в системе до 5 Па.
- После определенного времени процесса отключите подачу электроэнергии и газа и тщательно вентиляционные системы для предотвращения дует образцы из держателя образца. После вентиляции удалить образцы и образцы для следующего параметра в системе. Для плазмы пропитанная элементы управления предоставляют образцы пылесоса только (5 Па) в присутствии технологического газа эквивалентно время длинный прикладной плазмы.
4. восстановление и оценки Spore выживания
- Подготовить раствор ячеистого 10% поливинилацетатные (ПВА) и охватывают прободержатели тщательно с примерно 500 мкл и пусть воздушно-сухой для 4 h. полосы сушеные слой ПВА (теперь содержит образец споро) с использованием стерильный пинцет и перенести его на 2 мл реакция трубки. Добавить 1 мл стерильной воды в трубе и распустить ПВА слоя через vortexing. Эта процедура приводит к > 95% восстановления спор и не влияет на возможности их всхожесть21.
- Серийно разбавления образца в 1:10 в стерильной воде в 96-луночных пластине (т.е. 270 мкл стерильные H2O + 30 мкл пример/бывший разрежения). Пластина из 50 мкл каждого разведения на Lysogeny бульон питательный агар (LB), инкубировать пластины при 37 ° C ночь и перечислять количество выращенных колоний (CFU).
5. живые клетки микроскопии и отслеживания процессов репарации ДНК в прорастания спор
- Для прорастания экспериментов, подготовить площадку 1 мм толщиной 1,5% LB-агар путем кипячения 700 мкл среднего и накапайте его в чашку Петри стерильные микроскопии. После 10 минут вырезать из 8 x 8 мм x 1 мм LB-агар pad с стерильным скальпель и передачи агар тщательно поверх монослои споро, которые покоятся на 25 мм стекла coverslips.
Примечание: Этот шаг имеет решающее значение для визуализации отдельных споры и позволяют следующие их реакции, к активации всхожесть индуцированных питательный агар. Таким образом LB-агар служит двум целям, (1) для исправления споры на поверхности, что позволяет избежать relocalization вдоль поверхности и оптический фокус и (2) для того чтобы активировать spore для проращивания. - После покрытия образца с агар, стекла coverslip быстро передавать в тепловизионной камеры и Микроскоп образцы с автоматизированной конфокального микроскопа, лазерное сканирование с Перевернутый оптика с использованием 63 X / 1.3 самолет apochromatic цель погружения нефти.
-
Выполнение визуализации флуоресценции (рекламы ЯФП) с возбуждением волны 514 Нм и выбросов могут быть обнаружены от 520 до 560 Нм.
- Записи светлые области изображения в этом режиме, используя один из множителей фото (переданы свет путь).
- Запись покадровой серии лазера мощностью 2,6% и конфокальный диафрагмы до 5 просторных единиц и с частотой выборки 1 кадра в 30 s от 0 h до 5 ч, в зависимости от эксперимента. Это особо следует отметить, что высокие дозы монохромные лазерные освещения на 514 Нм полностью тормозят прорастание (рис. 1A, B).
- Держите образцов при 37 ° C (влажность окружающего воздуха) в стадии Отопление в течение всего процесса обработки изображений. Используйте по крайней мере три биологических репликация для каждого условия. В случае агрегирования споро, многослойных споро распределения или загрязнение частицами пыли блокирование плазменной обработки («слежка») может произойти и включить прорастание затененный споры (рис. 1C, D).
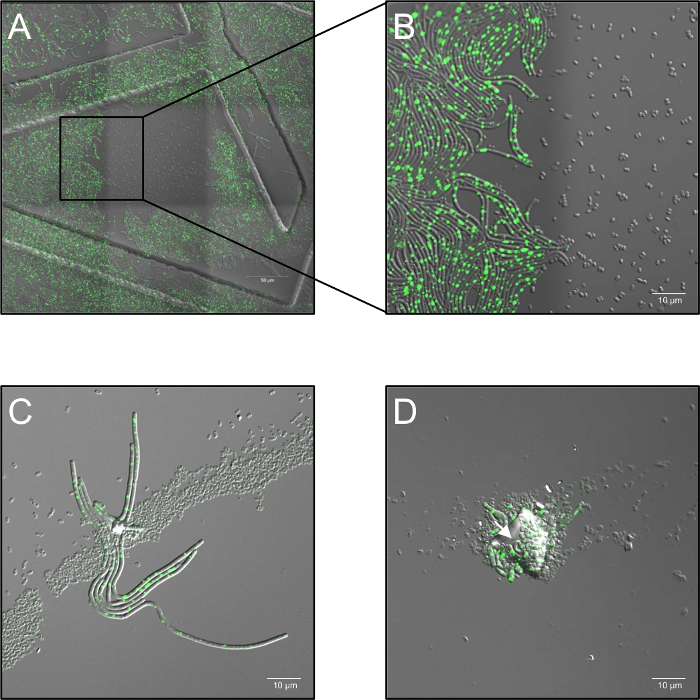
Рисунок 1: потенциальные проблемы наблюдается при микроскопии флуоресцирования конфокальный живой клетки плазмы рассматривать спор. (A, B) Ингибирование прорастания спор высокими дозами монохромные (514 Нм) лазерной подсветки. (A) Обзор (3 x 3 сшитые кадров) B. subtilis (LAS72, RecA-рекламы ЯФП) споры 180 мин после начала прорастания. Кадр в середине был разоблачен интервалом 30 s при приеме высоких доз лазерного света (514 Нм, мощность лазера 70%), в то время как окружающие регионы (= кадры) не были освещены (объединенное изображение ярко поле канала и RecA-рекламы ЯФП флуоресценции; приказал структуры были вызванные использованием 35 мм изображений блюда с сеткой тисненой 500 мкм). (B) демонстрирует 4 X увеличенное изображение границы между освещенной и неподсвеченные региона, показаны, что споры, которые подвергаются воздействию высоких доз монохромные лазерные освещения не прорастают и расти, тогда как споры в неподсвеченные регионах полностью восстановить растительный бактерий, выражая яркие RecA-рекламы ЯФП флуоресцирования (зеленый сигнал). (C, D) Споры охватываемых загрязняющих частиц или несколько слоев споро (стрелки), кажется, защищать основные споры от инактивации плазменной обработки и разрешить их прорастания и нарост («затенение эффект»). (C) споры были плазмы лечение 60 s и фотосъемка 180 мин после начала прорастания или в (D) для 120 s и отображаемого после 240 мин пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
6. растровая электронная микроскопия (SEM)
- Сканирующая электронная микроскопия предоставлять ультраструктурных информацию о поверхности морфологии плазмы рассматривать споры по сравнению с необработанными контроля использования. Слой сушеные споро монослои на coverslips с золото Палладий (3 Нм) с помощью распыления нанесения покрытий. Используйте поле выбросов сканирующий электронный микроскоп для изображений образцов, действовали на 5 кв ускорение напряжения, включая детектор электронов в объектив средних раскрыть топографией контраст.
7. анализ данных
- Определите споро выживания от коэффициент N/N0, где N — это средний показатель CFU обработанных образцов и N0 представляет собой среднее CFU необработанных вакуумного контроля. Участок споро инактивации лечения плазмы аргона как функцию времени (в секундах). Выразить все данные как средние и стандартных отклонений (n = 3).
- Анализ изображений, получаемых изображений живых клеток с помощью визуализации программного обеспечения. Количественной оценки доли прорастание спор и перерастает после плазменной обработки, Фото споры в представитель кадры в начале эксперимента, а также после 4 ч. Для определения значения в споро выживания анализов используйте односторонний дисперсионный анализ тесты (дисперсионный анализ) с статистическое программное обеспечение). P значений < 0,05 считаются как статистически значимой.
Результаты
Выживание плазмы лечение B. subtilis споры
Плазменная обработка спор B. subtilis используемых в этом шоу исследования снижение выживаемости с увеличением продолжительности лечения плазмы (рис. 2). Спор штамма, выражая recA-гена, сливается с рекламы ЯФП показал кривых выживания похож на спор штамма дикого типа, указывающее, что генетическая модификация имеет статистически значимого влияния на бактериальных жизнеспособности. Спор штамма RecA недостаточным обладают более высокой чувствительности к плазменной обработки по сравнению с спор штамма дикого типа, демонстрируя, что наличие гена RecA снижается плазмы индуцированная потеря жизнеспособности. Особенно короткие Плазменная обработка 15 s (P <0,003) и 30 s (P < 0,004) вызывает значительное снижение жизнеспособности в штаммов RecA недостаточным по сравнению с дикого типа и RecA-рекламы ЯФП штаммов. После 90 s Плазменная обработка, жизнеспособность всех штаммов уменьшается примерно на три порядка.

Рисунок 2: Выживание B. subtilis споры из различных штаммов после лечения с плазмой низкого давления аргон. Выживание (средняя CFU плазмы рассматривать споры/среднее CFU вакуумной обработки споры; погрешностей представляют собой стандартное отклонение) заговор против продолжительность лечения плазмы. PY79 (дикого типа; закрытых кругах), LAS72 (RecA-рекламы ЯФП; серые круги) и LAS24 (ΔrecA; открыть круги). Статистический анализ показал статистически значимых различий живучести спор между PY79 (неизмененном RecA) и LAS72 (RecA-рекламы ЯФП фьюжн).
Ультраструктурные анализ плазмы рассматривать споры по SEM
Чтобы получить представление о морфологических последствий плазмы лечения на споры, растровая электронная микроскопия (SEM) был использован для анализа поверхности морфологии плазмы рассматривать споры по сравнению с вакуумированной споры (управления). Внешняя поверхность спор B. subtilis выявить характерные продольной хребет как структуры, которые постоянно отображаются на всех обработанных и необработанных споры (рис. 3). Плазменная обработка до 30 s побуждает никаких существенных изменений споро морфологии поверхности по сравнению с контролем (рис. 3A-C). Увеличение продолжительности лечения плазмы (60-240 s) приводит к более детальном споро поверхности (рис. 3D-F) и небольшие трещины и трещины могут наблюдаться в споры рассматриваются на 120 и 240 s. Кроме того, небольшие шарики возникают на поверхности споро (120 s и 240 s процедуры, Рисунок 3E, F), которая вызвана выпустила материал из пальто, коры или от внутреннего сердечника22. Эти шарики охватывают весь спор и могут быть найдены на ключе образной структуры, а также на промежуточных поверхностей.

Рисунок 3: SEM спор B. subtilis (LAS72, RecA-рекламы ЯФП) наносится на стекло coverslips после лечения низкого давления плазмы. Споры подвергается только вакуумные и чтобы плазмы (управления) не отображаются в (A). (B-F) Споры, которые были лечение плазмы с увеличением продолжительности (15, 30, 60, 120 и 240 s). Споры, которые были лечение плазмы 60 s или больше появляться более детальном на их поверхности, чем управления споры или споры, которые были плазмы лечение 15 и 30 s. трещины и трещины (белые стрелки) видны на поверхности споры рассматриваются плазмы для 120 или 240 s. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Live микроскопии клетки плазмы лечение B. subtilis споры
Микроскопия живой клетки возрождения споры из штаммов B. subtilis , выражая белка флюоресценции, меченного ремонт RecA (RecA-рекламы ЯФП) осуществляется с целью проанализировать всхожести и выражение RecA-рекламы ЯФП индивидуальных спор в ответ для плазменной обработки. Здесь, мы используем время решена confocal микроскопии лазерное сканирование следовать за прорастание, нарост и прогрессии в вегетативное состояние плазмы рассматривать споры (рис. 4) в отношении потенциально известных проблем, например затенение эффекты или Ингибирование прорастания высокими дозами подсветки монохромные лазерные (рис. 1). Споры, подвергаются только (контроль вакуума, Рисунок 4A-C), демонстрируют несколько флуоресцентный сигналов во время раннего возрождения споро (0 - 65 мин., не показано). Когда формируются растительные клетки и первые клетки начинают разделить на ≥ 65 мин наблюдается увеличение интенсивности флуоресценции, наиболее вероятно из-за накопления RecA-рекламы ЯФП. Все эти клетки гавани флуоресценции сигнала, накопленных в по крайней мере одну позицию внутри каждой ячейки. Почти все споры (98 ± 2%; 589 ± 14, n = 4) лечение с вакуумом, как элемент управления прорастают и развивать словотолкование клетки палочковидные с довольно одинаковую длину отдельных клеток (рис. 4B-C). В отличие от спор в вакуумные элементы управления, споры рассматриваются для 15 s с плазмой уже показывают снижение всхожести менее 75 ± 4% (197 ± 8 споры, n = 3, рис 4D-F), указав, что Плазменная обработка индуцирует повреждение в неактивные споры, что препятствует прорастанию. Кроме того морфология перерастает клетки отличается от морфологии клеток в элементах управления. Клетки растут либо в широко длинные стержни (больше, чем по сравнению с контролем) или оставаться небольшой и придерживаться в споро пальто (рис. 4G-я). Кроме того с увеличением размера клеток (белая стрелка головки, Рисунок 4F) лизируют самые удлиненные клетки. Флуоресценции сигналов RecA-рекламы ЯФП внутри клетки, как представляется, несколько увеличилась по сравнению с сигналов управления клеток (рис. 4C, F), но никакие существенные различия могут наблюдаться (не показано). Споры, которые были плазмы лечение 30 s прорасти до 25 ± 6% (99 ± 4 споры, n = 3) и растительной клетки особенно задержки в росте по сравнению с контролем споры и споры после 15 s плазмы-лечения. Растительных клеток довольно малы и палочковидные, но различаются по длине (рис. 4G-я). Однако, могут лизировать клетки всех размеров во время инкубации как видно для образцов после 15 s плазмы-лечения. После 60 s плазмы лечения меньше, чем 2 ± 2% (8 ± 8 споры, n = 3) споры способны сформировать растительных клеток (рис. 4J-L). Споры, которые являются плазмы-90, 120 или 240 s могут быть проанализированы, но они показывают не нарост или каких-либо изменений в уровнях флуоресценции RecA-рекламы ЯФП (не показан).
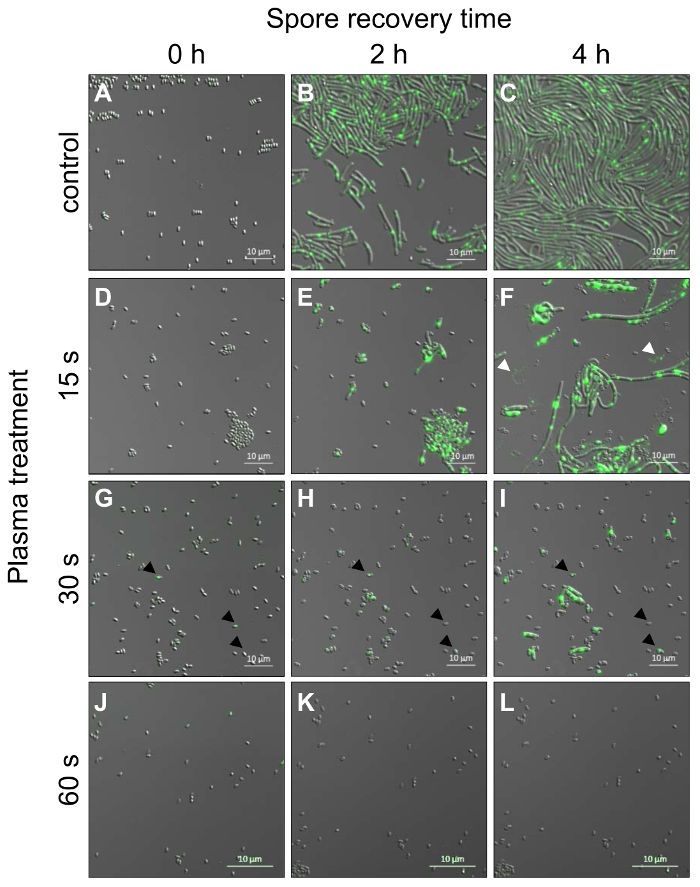
Рисунок 4: Конфокальная лазерная сканирование живой клетки микроскопии спор B. subtilis от напряжения, выражая RecA-рекламы ЯФП после плазменной обработки и начала прорастания. Споры были проведены со временем (одно изображение на 30 s) и показываются изображения для моментов времени 0, 2 и 4 ч. (A-C) Споры с вакуум только и не с плазмой (управления) прорастают и растут из растительной клетки (B) и введите фазы экспоненциального роста (C). (D-Л) Лечение для различной продолжительности с плазмой низкого давления аргон споры показывают существенные различия в их следствием по сравнению с споры управления (см. текст для подробной информации). (D-F) 15 s лечение (белая стрелка головки представляют растительных клеток, которые недавно лизированы), (G-я) 30 s (черный стрел визуализировать растительной клетки, которые были небольшими и придерживаться в споро пальто) и (J-L) 60 s лечение после 0 h, 2 h и 4 h время восстановления споро. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Стерилизации поверхностей с использованием низкотемпературной плазмы низкого давления является перспективной альтернативой довольно обычной стерилизации процедуры, такие как лечение с ионизирующим излучением, химических веществ (например газов как H2O2 или окись этилена) или сухого и влажного тепла23. Обычной стерилизации методы основном предоставляют эффективной стерилизации, но они известны влиять обработанного материала и представляют собой потенциальную опасность для оператора. Низкого давления плазмы предлагает быстрое и однородной биологических инактивации, используя состав нескольких компонентов, таких как УФ фотоны, свободные электроны, ионы и вышел из атомов или молекул (например ROS). Таким образом LPP может применяться для тепло - и коррозии чувствительных материалов, таких как термопластичных полимеров для имплантатов, электронные инструменты или сложные 3D-структуры. В настоящем документе мы продемонстрировать применение такой тест-системы, в которой монослои распыляется B. subtilis споры20 лечатся в частности плазмы низкого давления реактора, которая была недавно описана в деталях7. Микроскопическое исследование плазмы рассматривать споры ярко поле может быть достаточно для получения общей оценки эффективности стерилизации. Однако мы заинтересованы в интересах основных механизмов плазмы низкого давления и его влияние на спор инактивации на молекулярном уровне. В сочетании с флуоресцировать отслеживания микроскопии позволяет нам пролить свет на детали этой конкретной молекулярной реакции в плазме лечение споры и потенциально дать нам понимание фундаментальных инактивации механизм плазмы низкого давления.
Здесь мы ориентируемся на анализ эффективности лечения плазмы и эффекты с помощью микроскопии живой клетки, что позволяет следующие отдельные споры после начала прорастания. Удивительно этот подход показывает пару новых результатов, которые не могут быть предоставлены путем измерения активизации населения всей споро, используя определение количества клеток или кое. Во-первых плазмы лечение споры не только влияет на способности нарост в зависимости от дозы, как ожидалось от измерения выживания определение CFUs, но и морфология вегетативных клеток, которые часто развиваются большие стержней для формы септы согласно правильное деление клеток вместе с небольшой клетки, вставляя в spore (15 s плазменной обработки) или клетки на уменьшение длины (30 s плазмы лечение). Клеток с ограниченной длиной показали, восстановление нормальной клетки длины не позднее момента времени. Кроме того живой клетки изображений показывает, что большинство клеток морфологически измененных лизируют на более поздних этапах наблюдения. Это означает, что ущерб, приобретена споры во время плазмы лечения эффективен только на более поздних стадиях активизации споро, предположительно из-за повреждения ДНК и что машины, используемые для прорастания семян и нарост более надежной к плазменной стерилизации чем оборудование, необходимое для вегетативного роста. Удивительно экспрессия белка ДНК ремонт RecA кажется низкой и практически отсутствует в споры и развивается во время нарост и вегетативной фазе как отмечалось увеличение RecA-рекламы ЯФП флуоресценции17. Однако даже слегка увеличивать RecA выражение в перерастает плазмы рассматривать споры, по сравнению с контролем споры, не поможет спасти жизнеспособность клеток количественно, поскольку большинство клеток лизируют или взрыв после нарост, особенно после более чем 3 h инкубации. Этот эффект могут быть визуализированы с помощью живых клеток фильмы от изображения промежуток времени проросшие спор. Мы не можем исключить, что этот эффект недооценивать состояние конкретной выращивания, где клетки вынуждены в монослое, используя наложение тонкие агар.
Еще одним результатом анализа микроскопия живой клетки является, что твердых загрязнений (например, частицы пыли, другие споры) на поверхности монослоя спор может защитить основной спор от повреждающего действия плазмы. В таких случаях даже больше плазмы лечение представляется неэффективным. Поскольку трудно полностью избежать таких загрязнений, стратегии альтернативного плазмы лечения должны быть протестированы, например с помощью планетарных вращение во время лечения плазмы в сочетании с расширенной продолжительности лечения. Анализ по SEM указывает, что spore пальто перфорированный с увеличение продолжительности плазмы-лечения, который соответствует теории плазмы опосредованное воздействие на вопрос22,24. Время длительного воздействия (> 240 s) плазмы может даже перфорировать загрязняющих частиц и таким образом может повредить и инактивировать основной спор.
Представленные протокол для микроскопии живой клетки прорастание спор и развитие может быть для других исследований. Споры с тонким слоем агар сил споры в различных оптических плоскости и ограничивает боковое движение. Оба эффекта гарантируют, что споры и перерастает клетки остаются в пределах выбранного кадра изображения. Аналогичные подходы были описаны до25 , но предоставляют меньше гибкости, чем метод описанный здесь, который позволяет выбрать практически любой держатель образца (например на стеклянное скольжение, coverslip или Петри). В наших руках других растительных бактерии могут быть проанализированы микроскопия живой клетки, с помощью метода агар покрытие). В любом случае тщательного управления должно быть эксперименты оценить возможные эффекты фото повреждения во время живой клетки изображений, потому что мы наблюдали, что высокие дозы монохроматического лазерного света полностью тормозят прорастание спор. Помимо сокращения времени освещения, т.е. путем увеличения интервалов наблюдения, это явление можно предотвратить путем снижения интенсивности лазера и/или открытием конфокальный отверстие (отверстие).
В целом, среди методов, используемых для изучения эффективности плазмы лечения в модели распыляется B. subtilis споро монослои, микроскопия живой клетки предоставляет уникальные идеи в клеточных события во время возрождения споро и возможность для анализа динамики меченного флуоресценции белков. Кроме того подготовка конкретного образца, т.е. покрытие споры с тонким слоем агар, может быть парадигматическая для отображения других микроорганизмов, микроскопия живой клетки.
Раскрытие информации
Отсутствие конфликта интересов объявил.
Благодарности
Авторы благодарят Андреа Schröder за ее прекрасную техническую помощь во время части этой работы и Nikea J. Ulrich за ее помощь во время съемок. Мы также хотели бы поблагодарить за его щедрое пожертвование штаммы Bacillus subtilis Lyle а. Симмонс: LAS72 и LAS24. Эта работа была поддержана в части субсидий от немецкого фонда научных исследований (DFG) Paketantrag (PlasmaDecon Пак 728) Па (AW 7/3-1) и RM (MO 2023/2-1) и DLR предоставить DLR-FuW-Projekt МКС жизни, программа RF-FuW, Teilprogramm 475 (F.M.F, м.р. и р.м.). F.M.F. была поддержана стипендии PhD Гельмгольца космических наук о жизни научной школы (SpaceLife) на Германский аэрокосмический центр (ДЛР) в Кёльне, Германия, которая финансировалась Гельмгольца (Гельмгольц-объединением) в течение шести лет) Грант № VH-Ko-300) и получил дополнительные средства от DLR, включая Исполнительный совет аэрокосмической и института аэрокосмической медицины. Результаты этого исследования будут включены в кандидатской диссертации Феликс м. Фукс.
Материалы
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
Ссылки
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены