Method Article
通过计算机跟踪检测大鼠嗅觉行为
摘要
We describe here a behavioral setup and data analysis method for assaying olfactory responses of up to 100 vinegar flies (Drosophila melanogaster). This system may be used with single or multiple olfactory stimuli, and adaptable for optogenetic activation or silencing of neuronal subsets.
摘要
神经生物学的一个主要挑战是要了解如何电路的神经,由于其复杂的行为,强大的基因技术,紧凑的神经系统功能,引导适当的动物行为, 果蝇是这种调查的一个极好的模型系统。实验室行为分析已经长期用于与果蝇模拟自然环境性质和研究下面的相应的行为的神经机制( 例如趋光性,趋化性,感官学习和记忆)1-3。随着最近的那个标签特定的神经元亚群的转基因果蝇线大集合的可用性,行为检测已采取了突出的作用与行为4-11链接神经元。多功能和可重复的模式,以数据分析的基本计算程序一起,是各种genotyp候选飞线的快速检测不可缺少的上课。特别有用的是设置了在试验动物,实验持续时间和呈现刺激性质的数目灵活。选择的测定法也应生成可再生的数据,很容易获取和分析。在这里,我们提出了测定果蝇的行为反应的系统和协议的详细说明,在一个大的四场舞台上飞起来。设置在这里用来测定苍蝇单个嗅觉刺激的反应;然而,相同的设置可以被修改以测试多个嗅觉,视觉或光遗传学刺激,或这些的组合。嗅觉设置记录蝇种群响应气味的活性,并计算分析方法被应用到量化苍蝇的行为。所收集的数据进行分析,以得到一个快速读出一个实验运行,这是有效的数据收集和实验条件的优化必不可少的。
引言
适应并响应外部环境的能力,对于所有动物的生存至关重要。动物需要避免危险,寻找食物和寻找配偶,并从以前的经验中学习。感觉系统功能,以接收各种刺激,如视觉,化学和mechanosensory的,和发送这些信号到中枢神经系统来解释和解码。大脑然后指示基于感知环境适宜的运动行为,如觅食或捕食逃逸。了解感觉系统如何检测外部世界,大脑如何解码并指导决策,是神经生物学的一个重大挑战。
果蝇是研究如何神经回路引导行为的强大模型系统。除了 是简单和廉价的维护, 果蝇表现出许多不同的和复杂的刻板行为,但用COMPAC这样做ŧ约10万神经元的神经系统。强大遗传技术用于操纵果蝇基因组的存在,以及数以千计的转基因品系已生成的选择性和可重复性地标记的神经元10-13的相同的子集。这些转基因品系可以用来选择性地操纵标记神经元(激活或抑制)的活性,并且这些操作可以被用来研究如何神经功能导向的行为。
多种行为检测已制定了各种研究果蝇的行为。 果蝇 ,像许多动物,用他们的指导许多行为选择,比如寻找食物,寻找配偶,避免危险的嗅觉。因此嗅觉是研究外部刺激是如何检测和动物的神经系统解释,引导适当的选择一个良好的感觉系统。这样,一些试验中已经开发了用于investiga婷幼虫和成虫嗅觉行为。传统上,在果蝇嗅觉行为是由两选择T-迷宫范例,它可用于测定先天和了解到嗅觉行为3测定。在该试验中,约50苍蝇给出了两种管之间:一个管包含有问题的气味和其它含有一个控制气味(通常是气味溶剂)。苍蝇给出的设定时间做出选择,然后是在不同的腔室蝇的数目进行计数。尽管T-迷宫是许多实验的简单测定中,也有一些限制。例如,嗅觉行为仅在一个时间点测量的,并且该时间点之前进行不同的选择将被丢弃。同样,人口内苍蝇的个体行为被忽略。另外,T型迷宫要求苍蝇人工计数,这可能会引入错误。最后,因为只有两种测量的选择,这减少经常需要察觉的细微的行为变化的统计力量。到两选择T-迷宫一个替代方案是一个四象限(四场)嗅觉14-18。在该试验中,动物探究在其中每个竞技场的四个角的填充有加臭空气的潜在来源的舞台。竞技场有皱褶星形最大化四个实验确定的气味象限的形成。如果气味在随后的一个角供给它包含只在那一个象限。动物的行为可以相比,其在三个控制象限行为,因为他们进入和离开气味象限被跟踪,和容易。因此四象限嗅觉试验记录到刺激气味在大的试验舞台空间和时间的行为反应。
四象限嗅觉首先由彼得森等人的 15和兽医等人开发的。17,调查醇个别寄生蜂的工厂行为反应。福彻等 18 Semmelhack和王16改编设置监视单个果蝇的嗅觉反应。四象限嗅觉是吸引和排斥反应同样敏感,允许广泛的测试增味剂和条件。自定义编写飞跟踪软件,由Alex Katsov 19开发,目前由儒略布朗(在材料详述)保持,引入额外的优点,以更近的四象限嗅觉14,20-23的实现。现在有可能以测定到在高空间同时100蝇(27.5像素/厘米)和分辨率,它允许提取的各种参数,如在任何时间点的位置,速度和苍蝇的加速度随时间(每秒30帧)。这使得调查果蝇的行为反应的动力学气味20 。然而,应该指出的是,在人口中的各个蝇在整个跟踪期间的身份不能保持。相反,每个飞行轨道被记录为只要两个飞轨道不相交。在这一点,苍蝇发散后新的轨道进行分配。通过将其它视频俘获软件(在材料表详述),相同的配置允许灵活的跟踪时段,并且可以使用通过以较低的帧速率拍摄图像来跟踪苍蝇长达24小时。此选项被用来研究果蝇产卵行为和喜好产卵14比较他们的身体姿势。四字段嗅觉也可用于研究的反应在多峰( 例如嗅觉和视觉)刺激,或以光遗传学9或thermogenetic 21刺激感官刺激的演示相结合。此外,高时间分辨率允许轨迹的FO提取R IN乐团数据集的每一个人飞。因此,该方法允许调查嗅觉引导人口行为和也从个人的社交互动。通过该测定所产生的数据是健壮和高度可再现的,允许使用的四场嗅觉用于行为屏幕。
在这里,我们描述了一个四象限嗅觉安装组件。我们进一步展示其在应对苹果醋和排斥响应高度集中丙酸乙酯测定嗅觉吸引力的使用。最后,我们描述和用于记录飞跟踪数据的分析提供了示例代码。
研究方案
1.安装装配
- 根据提供的图纸(补充材料,SupplementalSketch_StarShapedArena.pdf)制造星形舞台(19.5厘米19.5厘米0.7厘米)出聚四氟乙烯(PTFE)的。竞技场可以由商业或定制设施来制造。
- 获得两个玻璃板(20.25厘米20.25厘米2毫米厚),和钻一个孔(〜直径0.7厘米)恰恰在使用金刚石涂层钻头玻璃板之一的中心。
- 制造的行为舞台上不透光的行为框。还根据所提供的附图(补充材料,SupplementalSketch_LightTightBox.pdf)制造的不透光照相机箱的红外线CCD视频摄像机。盒子可以由商业或定制设施来制造。
- 安装在后壁和行为箱的侧壁上的LED阵列的空调单元。放置温度探头在通过即时温度反馈和调整的侧孔的行为框(参见图1和2的详细信息)。
- 红外过滤器和圆偏振器安装到相机,并安装组件插入相机框。行为箱和照相机箱由一个玻璃窗口的行为框的更好的温度控制( 见图1和2的详细信息)分隔。
- 红外CCD相机连接到摄像机适配器。摄像机适配器连接到USB转换器。将USB转换器连接到USB端口的计算机进行数据采集上。
- 根据制造商的说明在计算机上安装的视频转换器的驱动程序。任选地,安装由USB视频转换器的制造商提供的访问范围更广的照相机设置和采集参数的图像处理软件。
- 空调机(器通过"输出"温度控制器背面)和温度探头(通过"关于温控器的背面)的温度控制器热电偶"。将探头插入行为框。
注意:在我们的布局的温度控制系统能够保持18℃和30℃之间的框的温度。较高或较低的环境温度可能是thermogenetic(dTrpA1,TRPM8或shibire TS)是有用的实验来操纵神经元的活动或抑制突触传递。对于大多数实验中,温度保持在25℃。 - 组装气味输送系统在下面的步骤(请参阅图1B的详细示意图和连接件):
- 使用空气压力调节器,以控制从中央空气系统中的空气输入端。碳的空气过滤器(填充有木炭)连接到压力调节器,以从中央一净化空气IR系统。
- 组装包含由高分辨率的流量计管调节多个通道的流动控制系统。
- 经由歧管从碳空气过滤器到流量计管的输出连接, 如图1B和2F。直接通过电子控制的三路电磁阀,流量计管的输出,如果清洁空气离开流量计排出进入房间或进入定做气味室24来调节。
- 根据制造商的手册安装电磁阀控制器。
- 通过将其连接到一个数据采集设备(DAQ),并根据制造商的手册的电源安装电子空气流量计。安装数据采集接口软件,以验证每一个实验前的舞台上的每个象限等于流量。
2.嗅觉刺激准备
- 准备5气味即由一个塑料外容器的蚂蚁腔室24中 ,玻璃内部容器,一个特制的聚四氟乙烯盖插入,原来的容器盖与中央部分除去,两个单向阀。
注意:围绕聚四氟乙烯盖O形环可用于防止气味灌注过程中从气味室空气泄漏。参见图1原理图和图2的分庭的照片。 - 使用溶剂能够控制四个气味室,并为测试气味一个腔室。装满1000微升溶剂或气味稀释的玻璃容器(测试增味剂+适当的溶剂中,实验前调匀),将对应的塑料室内的玻璃容器(不要溅出液体到塑料室),并拧紧盖子。确保始终用干净室测试气味和溶剂的控制。
注:嗅觉的吸引力可以通过1/16稀释使用w苹果醋(5%酸度)的触发亚特。与此相反,嗅觉斥力行为可以通过在矿物油中使用丙酸乙酯的10%的稀释度进行研究。在这些情况下控制刺激气味都与商会纯矿物油。
3.粉煤灰制备
- 后苍蝇标准玉米面介质上。将30名男性和一个标准瓶30母本苍蝇,并让他们在25°C或室温产卵5天。
- 对于每个实验,收集新eclosed(<1日龄),男25例,女25例短暂的二氧化碳麻醉下飞行。
- 防止苍蝇与2-4天标飞介质的小瓶。
- 实验前40-42小时,转移苍蝇不二氧化碳麻醉 用约10毫升1-%琼脂糖凝胶的小瓶。这将让没有食物,这有助于增加他们的自发活动加湿苍蝇。
注:90%以上的苍蝇应该生存的饥饿。一些基因型愈合少你不得通过40小时饥饿做到这一点。在这些情况下,更短的时间,如24-28小时是可接受的,但应保持所有实验条件并重复相同的。
4.行为反应吸引力和驱避剂加味剂
- 切换温度控制器上,并设置为25℃。
- 通过油管插入到加臭剂室的出口和连接气味室(对照和测试气味物质)推到连接上的行为框接头。
- 通过使用气流计,以确保控制和气味气流是等于100毫升/分钟检查每个象限的流速。
- 清洁聚四氟乙烯飞舞台和用70%乙醇2-3次玻璃板并且允许它们完全空气干燥(〜3-4分钟)。
- 加盖玻璃板用夹子竞技场。
- 转印蝇无CO 2麻醉成通过在玻璃板之一的孔竞技场。前前后后呃转移,放置一个圆形网状的孔,防止苍蝇逃跑。
注:CO 2麻醉已被证明影响果蝇行为25和不应该被一个行为实验中的24小时内使用。 - 将苍蝇放入不透光室的舞台上,通过连接连接到管路连接四个控制气流推到连接上的行为框竞技场角件,关闭房间的门,等待10 15分钟让果蝇适应新的环境。如果可能的话,开关灯灭在执行试验室内,以避免可能的最小的漏光那可就偏见实验结果。
- 运行5-10分钟的对照实验,其中苍蝇暴露于4个控制空气流。
- 立即分析数据(见下面的数据分析一节),以确保苍蝇在赛场上均匀分布,并且吸引指数接近为0,这一步是必不可少的,因为它验证有在舞台上的偏好或规避无失控来源( 例如来自外部的光,温度分布不均匀,凹凸不平的舞台,气味污染,泄漏等 )。如果苍蝇分配不公或的自发活动低,丢弃苍蝇,再次清洁竞技场(步骤4.4),并使用新一批果蝇重复实验。
- 通过在3路阀或重新插入所述连接器管切换连接测试加臭剂室向设置。
- 5-10分钟跑的测试实验,如下面的第5节讨论的分析数据(见参考文献14和图3)。记录超过20分钟延长可导致数据文件可能难以计算过程。如果再实验录音需要,迅速停止和重新启动跟踪程序。这导致实验记录之间一〜10秒的差距。
- 抛弃它ð苍蝇。
- 用70%乙醇清洁舞台和玻璃板(步骤4.4),并更换透光外壳内的连接器的管。为了加快实验中,新的清洁竞技场可以使用,并且在执行实验运行脏竞技场清洗。
- 用新一批的苍蝇运行另一个实验中,如果需要的话。如果几个实验在同一天运行,需要格外小心,确保没有加臭剂在系统中留下从以前的测试运行。这通常是不与低浓度的增味剂的 CO 2或一个问题,但可能需要高度浓缩的刺激高达实验运行之间的24小时间隙。此外,流管毕竟管道可以如果加臭剂污染在对照实验怀疑被替换。要始终保持干燥的空气对实验之间不断冲洗系统
5.数据分析
注:建议跟踪飞收购softwarE(在材料的详细),采集过程中实时跟踪苍蝇,节省了时间标记,并在* .dat文件格式,所有检测到的苍蝇的坐标。我们已经开发出一种定制的Matlab的例程来将数据转换成一个Matlab格式,并分析数据。在补充的材料被提供的代码的例子,但实现的细节将取决于用于数据采集的软件。
- 加载的原始数据。创建跟随舞台的轮廓空间mask和掩码应用到的原始数据删除落在领域之外,因为它们代表噪声( 图4A, 补码 MaskSpatialFiltering.m,Score.m,DrawCircularMask所有数据点。米)。
- 删除移动的速度低于0.163厘米/ s的超过3秒,因为这样的数据很可能是噪声或由非移动蝇( 图4B,补充代码TemporalFiltering.m)生成的所有数据点。
- 剩下的可视化数据通过一次全部绘制它们,或单点的轨迹( 图3, 补码 SingleTrajectoryViewer.m)。
注意:气味边界在四场的位置可能取决于许多因素,如每个加臭剂的特性和气流速率被使用。例如,极易挥发气味物质可能会更充分地填补了气味象限比不易挥发气味物质。因此它很可能是每个加臭剂可以表现出略微不同的气味边界。因为它使用真空以从特定点采样空气,因此破坏在该点的加臭剂浓度使用光离子化检测的测量气味的边界可能会产生问题。尽管如此,气味边界可以迅速根据实时行为数据估算。例如,根据累计飞行轨迹响应于不同的气味的气味边界可以清楚地在图3C和3D观察。 - 卡尔culate吸引力索引来确定对照实验是否产生没有偏好响应,并且还获得了加臭剂(或光遗传学9)刺激的反应。要计算的吸引力指数(AI),使用最后5分钟的控制或测试记录。为了获得吸引力的措施,+1(绝对的吸引力)和-1(绝对排斥)介于下列公式用于计算AI:
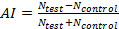
其中N 测试数据点的在测试象限的数目,N 控制为数据点中的三个控制象限的平均数目。这项措施是直观没有偏好会接近零值来表示。然而,它不能正确地表示,它们位于所述的加臭剂象限蝇的总数的比例。为了得到该措施,一个百分比指数(PI)可用于:
其中N 测试数据点的在测试象限的数目,并且N 总是数据点的所有四个象限的总数。此公式提供了0和1之间落下,与对应于没有行为偏好( 图3E和图4C, 补充代码 AttractionIndex.m)0.25的量度。 - 运行的每个实验条件下重复5-10,使用苍蝇每个重复的新组。通过使用洛夫-斯米尔诺夫非参数检验( 图3F,在Matlab kstest2功能)比较条件控制之间或针对吸引力索引。
结果
四象限嗅觉检测记录并分析在一个大的行为空间许多苍蝇的行走活动。添味剂可以被引入到该输入一个,两个,三个或全部四个象限的空气流。在没有气味,苍蝇就会随意四个象限之间移动。此行为是观察关键,因为它表明未故意偏差没有被引入化验。这些偏差可以包括光,温度波动,在空气流的差异,或气味的污染物。 图3B示出在25个男性的四象限嗅觉的行为反应和25雌蝇干燥空气。从收集到的数据单飞轨道也强调了图3B,并表明这苍蝇探索整个行为的舞台。吸引力指数得分(AI),用于在5分钟测试期间所有被分析的轨迹接近0,indicati纳克缺乏吸引力的气味象限。同样地,在实验的百分比指数(PI)为0.24,这表明苍蝇相当甚至在所有四个象限中的5分钟的测试期间分发。
到一个有吸引力的加臭剂的四场行为反应示于图3C。苹果醋引入的气流 通过将苹果醋的6.25%稀释到测试气味室左上象限异味的空气流。以灰色显示收集到的苍蝇的轨道表明,大多数苍蝇在这种气味象限收集,并且不再探讨所有四个象限。单一颜色的飞行轨迹表明,一旦苍蝇进入苹果醋的气味象限,它往往留在迷人的气味象限。 0.94用于实验的AI接近1表明强烈的吸引力这个气味。 0.92的PI表明,果蝇的92%R在分析期间emained在气味象限。
到一个防护剂气味四场行为反应示图3D英寸臭气物质丙酸乙酯置于气味室的10%的稀释液用作气味的来源为左上空气流。在分析实验的集结飞翔轨迹表明气味象限回避,暗示气味引导的排斥。单一颜色的飞行轨迹表明,飞,当它进入气味象限,迅速转向,以避免异味象限。的-0.68的AI小于0,表示排斥,并靠近-1,表示强烈的排斥反应气味的。 0.06用于实验的PI表明,只有6跟踪苍蝇的数据点的百分比(相对于在中性气味实验〜25%)中的气味象限在实验的过程中被发现。
一种吸着指数是用于分析嗅觉数据最广泛使用的度量,因为它允许得分大于0,以指示吸引力(正)和分数小于0,以指示斥力(负)。越接近得分是分别+1或-1时,吸引或排斥的强到该气味。如上所述,这个度量可以不明确表明在实验的过程中跟踪到气味象限的百分比或苍蝇的比例。在这种情况下,一个百分比指数可能会更丰富。 图3E图AI和PI分数之间的关系,以及这些数字如何与吸引力或令人反感的行为。
四场分析结果在强大的和可重复的嗅觉行为。这允许控制和实验条件之间的定量比较, 如图3F中 ,并且还能够细微olfactor的识别Y对从中立偏离。
此外,由于数据以高空间和时间分辨率得到,有可能研究的行为反应许多因素,如单苍蝇轨迹( 见图3),以及表征蝇不同活性动力学在气味字段( 例如 ,在方向和速度19,20的变化)。
它往往可能难以定位的四场舞台在每个实验完全相同的位置,特别是因为需要在舞台的频繁清洗。所提供的分析脚本由如图4A第一拟合数据补偿这些轻微的变化。在这种情况下,四场竞技场的形状被计算,并且位于该空间之外的数据点被移除。这些跟踪的对象往往代表的debRIS或错误地跟踪反射。因为它们不竞技场内位于,因此代表噪声,重要的是除去这些数据点,以防止错误的数据进行分析。同样,它也是重要的去除可能代表噪声或不移动的竞技场内蝇跟踪的数据点。要做到这一点,一个分析脚本利用(和这里提供的),消除,基本上不移动(如在图4B中示出)的数据点。这些数据点通常是少数,但其保留,会导致错误的分析。
吸引力指数和偏好指数分数可以在设定的时间周期之后计算( 例如 ,在5分钟实验结束, 如图3)。然而,应该指出的是,由于苍蝇与高空间和时间分辨率跟踪,类似的分析可以在整个实验进行。这是图4C示出了其中的吸引力索引和百分比索引分数在连续10秒箱一段时间内计算出来的。这种分析可以在整个实验时可能发生的嗅觉的变化,如习惯到加臭剂更好地理解。
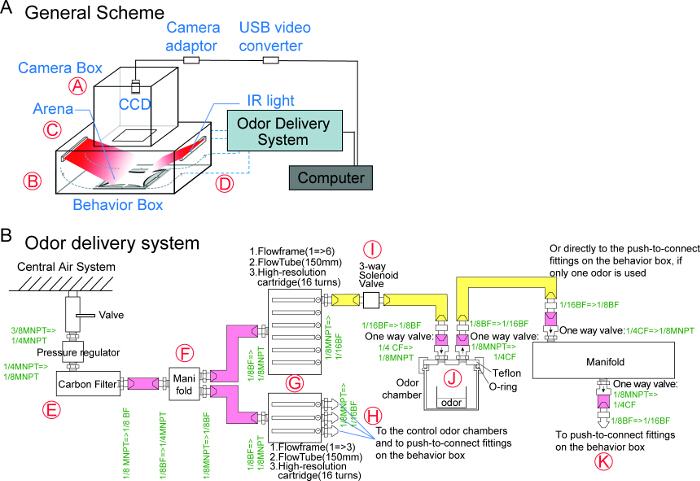
图 1: 示意图四象限嗅觉计 ( 一 )行为的设置是由气味输送系统,温度控制系统(未图示),图像采集系统(IR LED连接到电脑灯和红外CCD摄像机)四象限的舞台和不透光的行为和竞技场盒。红色圆圈标明在图2(B)中所示的相应部件的气味递送系统的详细设计。绿色字符代表f的连接/转换尺寸ittings。 1/16 ID和1/8 OD的管被标记为黄色,而这些ID的1/8和1/4 OD的被标记为粉红色。缩写:红外,红外; CF,压缩配件; BF,倒钩接头,MNPT,男国家管螺纹。 请点击此处查看该图的放大版本。

图 2: 嗅觉实验设置的照片 (A)相机盒和行为框的宽视场。行为箱内(B)查看。温度探头,连接器管和红外LED阵列被标记。 (C)四个象限的舞台。 (D),连接到行为框气味输送系统的宽视场图。相机盒已被移除,露出CCD摄像机。 (E )中央空气首先通过一个压力调节器,然后通过一个碳过滤器。连接到歧管的气味管(F)的实施例。 (G)的高分辨率流管调节气流。 (H)的气味递送管道和接头的流量管调节器的下游。如果清洁空气通过气味室通过或排出到室(Ⅰ)的电磁阀调节。 (J)的气味室都连接到单向阀,和包含加臭剂的内玻璃容器中。 (K)的行为框包含连接到气味输送管道外推到连接管件。 请点击此处查看该图的放大版本。

图3: 示例数据使用的是四场嗅觉测定生成 (A)的四场主场示意图。当所有四个象限只包含干燥的空气灌注(B)中性反应观察。 (C)景点应对苹果醋的6.25%摊薄左上腹灌注。 (D)的斥力行为由丙10%乙酸乙酯触发。在图2B-2D中,从所采集的数据的单个轨迹绘出。一个颜色渐变用来表示录制时过程中,蓝色和红色是录音的开始和结束,分别为。 (E)的吸引力指数(AI)和百分比指数(PI)的比较。 (F)的3- 6个实验,没有异味(控制)平均AI的,苹果醋(ACV)和10%丙酸乙酯(EP)。误差棒表示SEM。统计差异的柯尔莫哥洛夫 - 斯米尔诺夫TE评估ST。 请点击此处查看该图的放大版本。
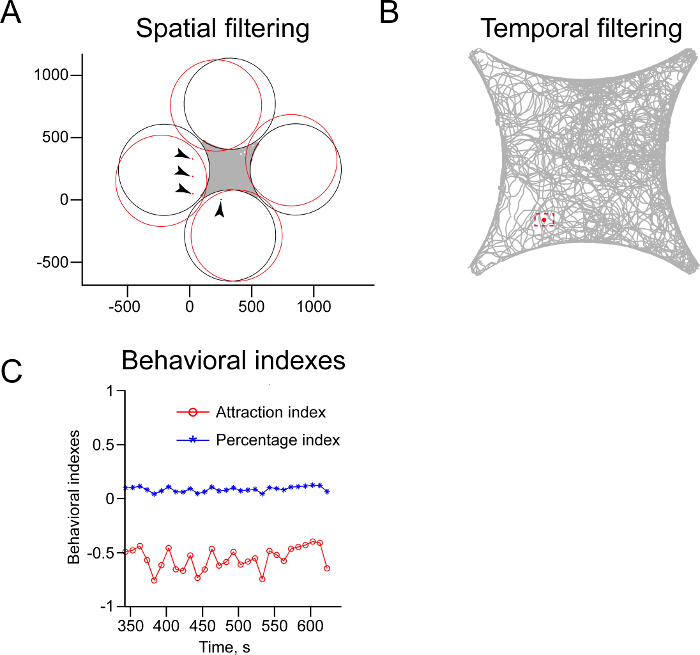
图4:示例数据由数据分析步骤产生 (A)的数据,截至MaskSpatialFiltering.m进行空间滤波,从而清除落在舞台之外的数据点。红色圆圈显示,用于定义竞技场的边界圆的初始位置。黑色圆圈是最终位置,通过拟合圆收购概述了数据(灰色四场里面的阴影区域)。红点和黑色箭头指示,将来自该过滤工序后的数据集中去除数据点。 (B)的数据的时空滤波,由TemporalFiltering.m进行。这个过滤步骤删除移动非常SLO数据点WLY或根本没有,因为它们很可能由非移动苍蝇或通过从竞技场污垢/反射产生。红点用红色虚线盒子包围指示将由该过滤步骤中去除同一坐标〜6000数据点的位置。 (℃)景点指数(AI)和百分比指数(PI),在10秒箱在过去5分钟通过AttractionIndex.m的实验计算。这些指标的时间分布包含有关的行为反应的动态信息,并可以用于行为的详细分析。 请点击此处查看该图的放大版本。
讨论
这里所描述的四场嗅觉是研究大量人口的野生型和突变体果 蝇苍蝇的嗅觉反应一个通用行为系统。每个实验以〜1小时(包括设置,实验运行和清洁),并且4-6实验每天可常规进行。用40-50苍蝇5分钟的典型试验产生大约45万跟踪的数据点进行分析。所描述的结构也可使用,以小的修改,并监控其他昆虫或昆虫幼虫的运动响应于嗅觉或其它感觉刺激在一段时间内,从最小到几天。四象限检测是既吸引力和排斥力的刺激的影响敏感。最气味物质生成-0.9和+0.9(等式1)之间的吸引力指数(AI)。在+0.5至+1范围内的AI表示苍蝇的刺激很强的吸引力行为,而AI在-0.5至-1的范围强驱虫剂引发的。一般来说,通过控制气味中性反应(干燥空气,加湿空气,矿物油)应该+0.1 -0.1和之间。人工智能经常改变整个测试实验的过程中,反射苍蝇要求走入气味羽状,最初的吸引力和运动活性的朝向新颖的刺激增加,并且响应于所述刺激的最终脱敏的时间。预测试运行控制是必不可少的,因此必须谨慎执行,以确保苍蝇均匀地在竞技场中没有所需的刺激分布。
在舞台上的苍蝇空间偏差的最常见的原因有:参差不齐的空气流,可能是由于断开的管道或星形舞台上充分夹住玻璃板(以我们的经验,苍蝇能够探测到尽可能少的气流差异为15ml /分钟);横跨竞技场温度分布不均匀,这可能通过设置可以改善空调单元以产生较弱的和更分散的空气流和/或更长的采集前的时期(约20分钟),以确保即使在舞台的温度;通过温度探头开口,可以通过密封用黑胶带开幕减少最小的漏光;残留气味在竞技场或在空气输送系统,在这种情况下,设置程序(竞技场,流管,所述不透光封罩等的接头)都需要进行彻底的清洗,并使其干燥数天或更换,其中可能的。
嗅觉设备的维护是可靠和一致的结果很重要。推到连接上的行为箱和空气入口和竞技场的内壁件应用乙醇每个实验后进行清洗,如果使用强烈的气味,并使其充分干燥。玻璃板应该以70%的乙醇,这通常足以从板除去残余的气味和灰尘被洗涤三次,但己烷是有用在消除苍蝇沉积有机化合物( 例如,信息素由长烃链)。一般不建议香皂,因为它通常含有芳香成分,这会影响嗅觉行为。行为箱应保持连接到实验之间的干燥空气入口( 例如过夜),以促进除去从系统中残留的气味。
如果苍蝇的活动能力低下,他们可能会产生数据点过少,其结果往往是在嘈杂的和可变的吸引力指数。不再饥饿和录制时间可能有助于解决这个问题。相反,如果苍蝇生病,饥饿24-28小时通常将是足够的,只要它是在整个实验一致增强运动活动。有保持苍蝇健康状态,提高运动之间的平衡。 40小时饥饿可以用作起点,后来修改为根据实验结果,需要的。景点索引将被饿死的持续时间有所影响,因此有必要挨饿实验动物为同一时间段内,以避免饥饿时间混杂影响。饥饿较长时间通常做出回应排斥较弱(接近于0),和有吸引力的反应更强。干燥空气控制气流倾向于变干的苍蝇,并且不应当用于长于40分钟。
四象限嗅觉可用于研究单个16,18或多个苍蝇响应于单个刺激或研究刺激之间选择偏好。例如,不同的气味可以在四个象限中使用。这也可以用于通过检查臭味象限的边界来确定要气味的混合物的反应。应当指出的是,即使跟踪系统允许各个轨道从收集的数据中分离出来,它是可能个别苍蝇的行为可能不同,当为比当他们被单独测试组的一部分进行检测。例如,苍蝇群表现出提高的气味引导排斥由于苍蝇26之间的物理相互作用。跟踪系统和布局也可以适用于在非嗅觉试验使用。该分析框架可以很容易地适应光遗传学刺激,或thermogenetics热板27的LED阵列9。该系统还可以适于研究许多小时的时间尺度的行为选择,例如,研究产蛋行为14。在这种情况下,探测帧速率需要进行调整,以避免大的数据文件的生成,湿度和底物(1%琼脂糖凝胶)的源极需为产蛋衬底被提供。
这种设置的限制是苍蝇跟踪作为红外反射在与arena-下面对象如果光遗传学的任何元素或thermogenetic实验反映红外光谱,所述不相关的数据点需要后处理过程中被除去。目前还不可能在一个空间分辨率,它允许不同的苍蝇是连续区分拍摄苍蝇,但是这可能会在将来通过使用更先进的摄像机得到改善。当前系统的另一个限制是,苍蝇的运动被约束为两维推进步行行为,将防止嗅觉诱导飞行反应。
应当注意的是,附加的自动检测也已经开发研究的单苍蝇的嗅觉行为或组。最相似的设计,以此处描述的测定是通过Beshel和钟28开发了一种方法。在该测定中,〜30苍蝇的答复在一个小圆形舞台监测,其中气味从1 4的气味端口沿竞技场は递送(四场竞技场的大约四分之一的面积)LL,并通过在圆形竞技场的中心有一个孔取出。除了较小的舞台上,其它设计上的差异包括光条件下所执行的行为,和气味物质主要集中靠近气味端口(而不是在整个中所指示的四个字段竞技场的皱壁臭气物质象限)。然而,圆形竞技场是用于筛选苍蝇嗅觉反应的合适的方法,并且可适于这里所描述的动态跟踪设计。
另一种方法是同时监测响应于气味许多单个蝇的活性。在Flywalk测定中,单独的蝇被放置在小管中,并且当气味物质通过管29,30灌注跟踪他们的答复。在正向或反向方向的变化,或在速度的变化,可用来测量,如果一个加臭剂通常是有吸引力或排斥力。此法,如四场检测,自动跟踪飞米ovements,因此可以被用于快速测量到的气味的宽范围的嗅觉响应。然而,与四场,复杂的运动动力学,如轨迹转轮角和潜在的社会相互作用,也许错过了在Flywalk测定记录。
单行走苍蝇的自动跟踪也已经适应了一个T型迷宫实验31,32。在该测定中,苍蝇被放置在其中的气味从该腔室的任一端,并且出口经由端口在腔室的中间灌注小室。苍蝇的位置也将自动跟踪。这种模仿,在一个飞行的规模,T型迷宫的框架。在与光遗传学组合,该测定已特别适合用于测定神经回路中介嗅觉学习和记忆,并且也可以用于评估单一苍蝇的嗅觉偏好。类似Flywalk,它不能监视可能在更大的空间区域会发生复杂的活动动态诸如那些在食品求14,或仅在蝇人群中发生的行为发生。
披露声明
The authors declare that they have no competing financial interests.
致谢
We thank Terry Shelley for manufacturing the fly arena and the light-tight enclosure, Liz Marr for help with fly stock maintenance, and Xiaojing Gao and Junjie Luo for help with the Matlab code used for data analysis. We thank Johan Lundström at the Monell Chemical Senses Center for demonstrating his odor delivery setup. This work was supported by grants from the Whitehall Foundation (CJP) and NIH NIDCD (R01DC013070, CJP).
材料
| Name | Company | Catalog Number | Comments |
| Air delivery system | (Quantity needed) | ||
| Tubing and connectors | |||
| Thermoplastic NPT(F) Manifolds | Cole-Parmer, IL, USA | R-31522-31 | 1 |
| Hex reducing nipple (1/4MNPT->1/8MNPT) | McMaster-Carr, IL, USA | 5232T314 | 1 |
| Tubing (ID:1/8) | McMaster-Carr, IL, USA | 5108K43 | 50 Ft |
| Tubing (ID:1/16) | McMaster-Carr, IL, USA | 52355K41 | 100 Ft |
| Barbed tube fittings | McMaster-Carr, IL, USA | 5117K71 | 1 pack |
| Push-to-connect tube fittings | McMaster-Carr, IL, USA | 5779K102 | 4 |
| Barbed Tube Fittings (1/4MNPT->1/8BF) | McMaster-Carr, IL, USA | 5463K439 | 1 pack (10) |
| Barbed Tube Fittings (1/8MNPT->1/8BF) | McMaster-Carr, IL, USA | 5463K438 | 2 pack (10) |
| Barbed Tube Fittings (1/8MNPT->1/16BF) | McMaster-Carr, IL, USA | 5463K4 | 2 pack (10) |
| Barbed Tube Fittings (1/4MNPT->1/4BF) | McMaster-Carr, IL, USA | 5670K84 | 1 |
| Hex head plug | McMaster-Carr, IL, USA | 48335K152 | 1 |
| Air pressure regulator, air filter and flowmeters | (Quantity needed) | ||
| Labatory gas drying unit | W A HAMMOND DRIERITE CO LTD, OH, USA | Model: L68-NP-303; stock #26840 | 1 |
| Multitube frames for 150 mm flowtubes | Cole-Parmer, IL, USA | R03215-30 | 1 |
| Multitube frames for 150 mm flowtubes | Cole-Parmer, IL, USA | R03215-76 | 1 |
| 150 mm flowtubes | Cole-Parmer, IL, USA | R-03217-15 | 9 |
| Valve Cartridge | Cole-Parmer, IL, USA | R-03218-72 | 9 |
| Precision Air regulator | McMaster-Carr, IL, USA | 6162K13 | 1 |
| Soleniod valves | Automate Scientific, Berkeley, CA | 02-10i | 4 |
| Solenoid valve controller | ValveLink 8.2, Automate Scientific, Berkeley, CA | 01-18 | 1 |
| Electronic flow meter | Honeywell | AWM3100V | 1 |
| DAQ (NI USB-6009, National Instruments) and a | National Instruments | NI USB-6009 | 1 |
| Power supply | Extech Instruments | 382200 | 1 |
| Odor chambers | |||
| Polypropylene Wide Mouth jar 2 oz; 60 ml | Nalgene | 562118-0002 | At least 5 are required per experiment, but a separate chamber is required for each dillution of each odorant. Available at Container Store, part #635114) |
| Glass odor chamber, 0.25 oz | Sunburst Bottle | LB4B | At least 5 are required per experiment |
| "In" valve for odor chamber | Smart Products, Inc., CA, USA | 214224PB-0011S000-4074 | 1 of these parts is used per odor chamber but they need to be replaced frequently |
| "Out" valve for odor chamber | Smart Products, Inc., CA, USA | 224214PB-0011S000-4074 | 1 of these parts is used per odor chamber but they need to be replaced frequently |
| O ring | RT Dygert International, MN, USA | AS568-029 Buna-N O-R | 1 pack (100) |
| Fly arena, camera and behavior boxes | (Quantity needed) | ||
| Behavior and camera box material | Interstate plastics, CA, USA | ABS black extruded (https://www.interstateplastics.com/Abs-Black-Extruded-Sheet-ABSBE~~ST.php) | 1803 sq inch |
| Teflon for fly arena and odor chamber inserts, 3/8" thick, 12" x 12" | McMaster-Carr, IL, USA | 8545K27 | 1 |
| Glass plates, 1/8" Thick, 9" x 9" | McMaster-Carr, IL, USA | 8476K191 | 2 |
| Dual action thermoelectric controller | WAtronix Inc, CA, USA | DA12V-K-0 | 1 |
| IR LED array | Advanced Illumination, Rochester, VT, USA | AL4554-88024, PS24-TL | 2 LED arrays and one power supply |
| Air conditioner Unit | Melcor Store | MAA280T-12 | 1 |
| Imaging system | (Quantity needed) | ||
| Cosmicar/Pentax C21211TH (12.5 mm F/1.4) C-mount Lens | B AND H PHOTO AND ELECTRONICS CORP, NY, USA | PEC21211 KP | 1 |
| CCXC-12P05N Interconnect Cable | B AND H PHOTO AND ELECTRONICS CORP, NY, USA | SOCCXC12P05N | 1 |
| DC-700 Camera Adapter | B AND H PHOTO AND ELECTRONICS CORP, NY, USA | SODC700 | 1 |
| B+W 40,5 093 IR filter | B AND H PHOTO AND ELECTRONICS CORP, NY, USA | 65-072442 | 1 |
| TiFFEN 40.5 mm Circular polarizer | Amazon | 1 | |
| IR Videocamera | Industrial Vision Source, FL, USA | Sony XC-EI50 (SY-XC-E150) | 1 |
| USB video converter | The Imagingsource, NC, USA | DFG/USB2-It | 1 |
| iFlySpy2 (fly tracking software) | Julian Brown, Stanford, Calfornia: julianrbrown@gmail.com | iFlySpy2 | 1 |
| IC Capture 2.2 software | The Imagingsource, NC, USA (http://www.theimagingsource.com/en_US/products/software/iccapture/) | ||
| Miscellaneous | (Quantity needed) | ||
| Dremel rotary tool | Dremel, Racine, WI, USA | Dremel 8000-03 | 1 |
| Diamond-coated drill bits for glass cutting | Available from various suppliers; MSC industrial Supply Co, Melville, NY | 90606328 | 1 |
参考文献
- Benzer, S. Behavioral mutants of Drosophila isolated by countercurrent distribution. Proc Natl Acad Sci U S A. 58 (3), 1112-1119 (1967).
- Thorpe, W. H. Further studies on pre-imaginal olfactory conditioning in insects. Proc R Soc B. 127 (848), 424-433 (1939).
- Tully, T., Quinn, W. G. Classical conditioning and retention in normal and mutant Drosophila melanogaster. J Comp Physiol A. 157 (2), 263-277 (1985).
- Anholt, R. R., Mackay, T. F. Quantitative genetic analyses of complex behaviours in Drosophila. Nat Rev Genet. 5 (11), 838-849 (2004).
- Vosshall, L. B. Into the mind of a fly. Nature. 450 (7167), 193-197 (2007).
- Wu, M. N., Koh, K., Yue, Z., Joiner, W. J., Sehgal, A. A genetic screen for sleep and circadian mutants reveals mechanisms underlying regulation of sleep in Drosophila. Sleep. 31 (4), 465-472 (2008).
- Dankert, H., Wang, L., Hoopfer, E. D., Anderson, D. J., Perona, P. Automated monitoring and analysis of social behavior in Drosophila. Nat Methods. 6 (4), 297-303 (2009).
- Branson, K., Robie, A. A., Bender, J., Perona, P., Dickinson, M. H. High-throughput ethomics in large groups of Drosophila. Nat Methods. 6 (6), 451-457 (2009).
- Aso, Y., et al. Mushroom body output neurons encode valence and guide memory-based action selection in Drosophila. Elife. 3, e04580(2014).
- Pfeiffer, B. D., et al. Tools for neuroanatomy and neurogenetics in Drosophila. Proc Natl Acad Sci U S A. 105 (28), 9715-9720 (2008).
- Pfeiffer, B. D., et al. Refinement of tools for targeted gene expression in Drosophila. Genetics. 186 (2), 735-755 (2010).
- Venken, K. J., et al. Genome engineering: Drosophila melanogaster and beyond. Wiley Interdiscip Rev Dev Biol. , (2015).
- Diao, F., et al. Plug-and-play genetic access to drosophila cell types using exchangeable exon cassettes. Cell Rep. 10 (8), 1410-1421 (2015).
- Lin, C. C., Prokop-Prigge, K. A., Preti, G., Potter, C. J. Food odors trigger Drosophila males to deposit a pheromone that guides aggregation and female oviposition decisions. Elife. 4, (2015).
- Pettersson, J. An aphid sex attractant. Insect Systematics & Evolution. 1 (1), 63-73 (1970).
- Semmelhack, J. L., Wang, J. W. Select Drosophila glomeruli mediate innate olfactory attraction and aversion. Nature. 459 (7244), 218-223 (2009).
- Vet, L. E. M., Lenteren, J. C. V., Heymans, M., Meelis, E. An airflow olfactometer for measuring olfactory responses of hymenopterous parasitoids and other small insects. Physiological Entomology. 8 (1), 97-106 (1983).
- Faucher, C., Forstreuter, M., Hilker, M., de Bruyne, M. Behavioral responses of Drosophila to biogenic levels of carbon dioxide depend on life-stage, sex and olfactory context. J Exp Biol. 209 (Pt 14), 2739-2748 (2006).
- Katsov, A. Y., Clandinin, T. R. Motion processing streams in Drosophila are behaviorally specialized. Neuron. 59 (2), 322-335 (2008).
- Gao, X. J., et al. Specific kinematics and motor-related neurons for aversive chemotaxis in Drosophila. Curr Biol. 23 (13), 1163-1172 (2013).
- Gao, X. J., Clandinin, T. R., Luo, L. Extremely sparse olfactory inputs are sufficient to mediate innate aversion in Drosophila. PLoS One. 10 (4), e0125986(2015).
- Ronderos, D. S., Lin, C. C., Potter, C. J., Smith, D. P. Farnesol-detecting olfactory neurons in Drosophila. J Neurosci. 34 (11), 3959-3968 (2014).
- Riabinina, O., et al. Improved and expanded Q-system reagents for genetic manipulations. Nat Methods. 12 (3), 219-222 (2015).
- Lundstrom, J. N., Gordon, A. R., Alden, E. C., Boesveldt, S., Albrecht, J. Methods for building an inexpensive computer-controlled olfactometer for temporally-precise experiments. Int J Psychophysiol. 78 (2), 179-189 (2010).
- Colinet, H., Renault, D. Metabolic effects of CO2 anaesthesia in Drosophila melanogaster. Biology Letters. 8 (6), 1050-1054 (2012).
- Ramdya, P., et al. Mechanosensory interactions drive collective behaviour in Drosophila. Nature. 519 (7542), 233-236 (2015).
- Ofstad, T. A., Zuker, C. S., Reiser, M. B. Visual place learning in Drosophila melanogaster. Nature. 474 (7350), 204-207 (2011).
- Beshel, J., Zhong, Y. Graded encoding of food odor value in the Drosophila brain. J Neurosci. 33 (40), 15693-15704 (2013).
- Steck, K., et al. A high-throughput behavioral paradigm for Drosophila olfaction - The Flywalk. Sci Rep. 2, 361(2012).
- Thoma, M., Hansson, B. S., Knaden, M. High-resolution Quantification of Odor-guided Behavior in Drosophila melanogaster Using the Flywalk Paradigm. J. Vis. Exp. (106), (2015).
- Claridge-Chang, A., et al. Writing memories with light-addressable reinforcement circuitry. Cell. 139 (2), 405-415 (2009).
- Parnas, M., Lin, A. C., Huetteroth, W., Miesenbock, G. Odor discrimination in Drosophila: from neural population codes to behavior. Neuron. 79 (5), 932-944 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。