Method Article
تنقية تقارب بروتين 6X-his-tagged باستخدام نظام كروماتوغرافيا سائل سريع البروتين
In This Article
Summary
توفر هذه المقالة إجراء لتنقية تقارب بروتين بشري مؤتلف ، رفرف نوكلياز 1 (FEN1) ، والذي تم تصنيفه بعلامة 6X-histidine . يتضمن البروتوكول استخدام عمودين أيونات معدنية متميزين لتنقية البروتين الموسوم.
Abstract
يتطلب التوصيف الوظيفي للبروتينات التعبير عنها وتنقيتها بكميات كبيرة بنقاوة عالية لإجراء فحوصات كيميائية حيوية. يسمح نظام كروماتوغرافيا البروتين السائل السريع (FPLC) بفصل عالي الدقة لمخاليط البروتين المعقدة. من خلال ضبط المعلمات المختلفة في FPLC ، مثل اختيار مصفوفة التنقية المناسبة ، وتنظيم درجة حرارة عينة البروتين ، وإدارة معدل تدفق العينة على المصفوفة ومعدل الشطف ، من الممكن ضمان استقرار البروتين ووظائفه. في هذا البروتوكول ، سنوضح تعدد استخدامات نظام FPLC لتنقية بروتين 6X-His-His-Taged endonuclease 1 (FEN1) ، المنتج في المزارع البكتيرية. لتحسين كفاءة تنقية البروتين ، سنركز على اعتبارات متعددة ، بما في ذلك تعبئة العمود وإعداده بشكل صحيح ، وحقن العينة باستخدام حلقة عينة ، ومعدل تدفق تطبيق العينة على العمود ، ومعلمات شطف العينة. أخيرا ، سيتم تحليل الكروماتوجرام لتحديد الكسور التي تحتوي على غلات عالية من البروتين واعتبارات التخزين المناسب للبروتين المؤتلف على المدى الطويل. يعد تحسين طرق تنقية البروتين أمرا بالغ الأهمية لتحسين دقة وموثوقية تحليل البروتين.
Introduction
تتوفر العديد من الاستراتيجيات لفهم البيولوجيا الخلوية. يتضمن أحد الأساليب استراتيجية من أعلى إلى أسفل ، حيث يتم إدخال طفرات جينية في الجين ، يليها تقييم التغيرات المظهرية الناتجة في كائن حي نموذجي. على العكس من ذلك ، يستلزم النهج الاختزالي التوضيح الأولي للآليات الجزيئية والوظائف الأنزيمية لبروتين معين ، مصحوبا بتوصيف تفاعلاته مع المكونات الخلوية الأخرى. بعد ذلك ، يتم تقييم تأثير هذا البروتين على المسار البيولوجي. على الرغم من أن كل نهج بحثي يمتلك مزاياه وقيوده المتأصلة ، إلا أن تحقيق فهم شامل للمسار البيولوجي يتطلب تحقيقات متعددة التخصصات.
نظرا لأن الحمض النووي هو المخطط الجيني للحياة ، فإن فهم آليات تكرار الحمض النووي وصيانة الجينوم كان مجالا ذا اهتمام نشط لأكثر من سبعة عقود. أسفرت الدراسات في مجال تكرار الحمض النووي عن بيانات وفيرة تتعلق بالهياكل الفردية ووظائف العديد من بروتينات النسخ المتماثل. هذه الاستفسارات ، التي تشمل الجوانب الميكانيكية وفحوصات النشاط الكيميائي الحيوي ، أصبحت ممكنة من خلال تنقية هذه البروتينات ، مما مكن من فحصها الدقيق في بيئة في المختبر . وبالتالي ، تظهر تنقية البروتين كتقنية لا غنى عنها وفي كل مكان في غالبية المساعي البحثية الموجهة نحو كشف الرؤى الميكانيكية في تكرار الحمض النووي.
تقدم هذه المقالة منهجية لعزل بروتين تكرار الحمض النووي الموسوم ب 6X-histidine ، والذي تم التعبير عنه بشكل مفرط في الخلايا البكتيرية. البروتين محل الاهتمام هو endonuclease endonuclease 1 (FEN1) ، وهو نوكلياز خاص بالبنية يلعب دورا محوريا في تكرار الشريط المتأخر وهو أيضا مشارك مهم في مسارات إصلاح الحمض النووي مثل إصلاح استئصال القاعدة (BER) 1،2،3. تتمثل الوظيفة الأساسية ل FEN1 في الالتصاق بقاعدة بنية رفرف نازحة 5 بوصات ، وهو وسيط ينشأ أثناء تكرار الحمض النووي أو BER. في البداية ، اقترحت التحقيقات الكيميائية الحيوية التي تقيم النشاط الأنزيمي ل FEN1 آلية "تتبع" ، حيث يتعرف النيوكلياز على الطرف الحر 5'-فوسفات لهيكل السديلة ثم يتبع على طول السديلة إلى قاعدتها قبل شقها4. كشفت الأبحاث اللاحقة أن FEN1 يعمل عبر آلية "خيوط" ، حيث يرتبط أولا بقاعدة السديلة ثم يخيط الطرف الحر 5 بوصات من خلال موقعه النشط قبل الانقسام (الشكل 1) 5. وقد سهلت القدرة على الإفراط في التعبير عن FEN1 المؤتلف وعزله هذه الاختراقات ، مما مكن الباحثين من توظيفه في التحقيقات البيوكيميائية والهيكلية.
كروماتوغرافيا التقارب هي طريقة فصل شائعة الاستخدام لتنقية الحمض النووي. تستخدم هذه التقنية تقارب الارتباط العكسي للبروتينات المستهدفة نحو الروابط المثبتة على الراتنج لحبس البروتين محل الاهتمام على وجه التحديد. واحدة من أكثر الصلات الحيوية استخداما هي التفاعل القوي بين الأحماض الأمينية والهيستيدين وأيونات المعادن مثل النيكل والكوبالت ، وبالتالي ، يمكن التقاطها على راتنج مشحون ب Ni2+ أو Co2+.
غالبا ما يتم دمج تسلسل الحمض النووي الذي يشفر سلسلة من 6-9 بقايا هستيدين (His) في بنية البلازميد التي تشفر البروتين محل الاهتمام (إما في N-terminus أو C-terminus) ، مع تمييز البروتين بعلامة 6X-His-أو علامة poly-His . يمكن بعد ذلك تنقية البروتين الموسوم His-Magazine بسهولة عن طريق كروماتوغرافيا التقارب المعدني المجمدة (IMAC) ، وهو نوع فرعي من كروماتوغرافيا التقارب حيث تلتقط أيونات المعادن الموجودة على الراتنج البروتينات بعلامة تقارب ، والتي يمكن استخلاصها لاحقا باستخدام عوامل الشطف المناسبة. يمكن تجميد أيونات الفلزات الانتقالية مثل Ni2+ و Co2+ على مصفوفات هلام الأغاروز أو السيليكا المشتقة من مجموعات N و N و N'-tris- (كربوكسي ميثيل) - إيثيلين ديامين أو حمض النيتريلوتريسيتيك (NTA)6.
من المعروف أن الروابط المعدنية قوية ضد التدهور بسبب العوامل الفيزيائية والكيميائية والبيولوجية وتحتفظ بهذه الميزة على الأنواع الأخرى من الروابط 6,7. بالإضافة إلى ذلك ، فإن علامة His-tag هي علامة صغيرة نسبيا ولا تؤثر بشكل كبير على بنية البروتين أو وظيفته7. ومع ذلك ، في نظام التعبير البكتيري ، يكون للعديد من البروتينات المعبر عنها كروموسوميا ميل نحو أيونات المعادن وقد تتكاثر مع البروتين المستهدف. النيكل والكوبالت هما أيونات الفلزات النموذجية المستخدمة في مصفوفات IMAC. يشيع استخدام راتنج Ni-NTA والراتنج القائم على الكوبالت TALON لتنقية البروتينات الموسومة به.
ني-NTA مقابل تالون
يتم تجميد أيونات المعادن الخاصة بكل من Ni-NTA و TALON على الراتنج من خلال روابط NTA. يعتقد أن Ni-NTA تتمتع بقدرة ربط أعلى ، حيث تربط ما يصل إلى 100 مجم / مل من البروتين. يمكن أن يؤدي ذلك إلى زيادة إنتاج البروتين ، مع التحذير من أن البروتينات الملوثة قد يتم تنقيتها بشكل مشترك. في المقابل ، يتمتع الراتنج بخصوصية ربط أعلى تجاه البروتينات الموسومة به وقد يكون قادرا على إنتاج أجزاء من درجة نقاء أعلى. في هذه الدراسة ، نهدف إلى مقارنة كفاءة تنقية كلا الراتنجين باستخدام نظام كروماتوغرافيا سائل البروتين السريع الآلي المشار إليه ، ونظام NGC (انظر جدول المواد).
المخازن المؤقتة والتوافق
المخازن المؤقتة مطلوبة أثناء تنقية البروتين لتحلل الخلايا ، وإعداد العينات ، وتوازن الراتنج ، وشطف البروتين الذي تم التقاطه من الراتنج. المخازن المؤقتة Tris و MOPS و HEPES حتى تركيز 100 مللي متر هي المخازن المؤقتة المتوافقة المعروفة لراتنج Ni-NTA. غالبا ما تشتمل المخازن المؤقتة على عوامل اختزال لمنع أكسدة البروتين وتراكم البروتين. ومع ذلك ، فوق حد العتبة ، يمكن أن تؤدي عوامل الاختزال إلى تجريد راتنج أيونات المعادن. التركيز الموصى به لعوامل الاختزال مثل بيتا ميركابتوإيثانول (BME) أو ديثيوثريتول (DTT) أقل من 1 mM للراتنجات القائمة على النيكل والكوبالت المذكورة أعلاه.
المخازن المؤقتة لتنقية hFEN1 هي مخازن Tris التي تحتوي على كلوريد الصوديوم ، BME ، فلوريد فينيل ميثيل سلفونيل (PMSF) ، EDTA ، والجلسرين. يحافظ كلوريد الصوديوم على البروتين في شكل قابل للذوبان ويعطل التفاعلات الجزيئية مثل ارتباط الحمض النووي. يقلل BME من البروتينات المؤكسدة وبالتالي يمنع تراكم البروتين. PMSF) هو مثبط للبروتياز يمنع تدهور البروتين المستهدف بوساطة البروتياز. يزيل EDTA الكاتيونات ثنائية التكافؤ من العينة ، مما يمنع وصولها إلى النيوكليازات والبروتياز. الجلسرين يعزز استقرار البروتين في شكل مائي. بالإضافة إلى ذلك ، يحتوي المخزن المؤقت للتحلل على أقراص مثبطة كاملة للبروتياز لضمان أقصى حماية للبروتين المستهدف من تحلل البروتياز أثناء تحلل الخلية. تحتوي مخازن التوازن والشطف على إيميدازول ، حيث يحتوي محلول الشطف على كميات أعلى للإيميدازول لإزاحة البروتين المرتبط من الراتنج أثناء الشطف.
نظام كروماتوغرافيا الجيل التالي (NGC)
يستخدم نظام كروماتوغرافيا الضغط المتوسط الآلي هذا المصمم لكروماتوغرافيا البروتين السائل سريع التدفق (FPLC) مضختين لضخ مخزنين مؤقتين مختلفين في وقت واحد وهو قادر على حقن مجموعة واسعة من أحجام العينات من 250 ميكرولتر إلى 100 مل. حلقة العينة (المعروفة باسم Dynaloop في هذا النظام) ، تجعل من الممكن حقن أحجام عينات أكبر. يمكن تشغيل النظام باستخدام برنامج Chromlab ، مما يسهل إنشاء طريقة مخصصة ، والتلاعب في عمليات التنقية ، وتحليل قمم الأشعة فوق البنفسجية وكسور البروتين.
Protocol
1. إعداد العينة
- لتنقية FEN1 المؤتلف ، عبر عن البنية (pET-FCH-FEN1) في خلايا BL21 (DE3) كما هو موضح سابقا بواسطة Ononye et al.8.
- تلقيح وسائط LB (الجدول 1) بزراعة 1٪ بين عشية وضحاها وتنمو الخلايا عند 37 درجة مئوية حتى يصل OD إلى 0.6.
- الحث باستخدام 0.4 متر إيزوبروبيل بيتا دي ثيوجالاكتوسيد (IPTG) وتنمية الثقافة لمدة 3 ساعات إضافية.
- حصاد الخلايا عن طريق الطرد المركزي للمزرعة عند 5000 × جم لمدة 15 دقيقة عند 4 درجات مئوية. قم بتخزين الحبيبات في فريزر -80 درجة مئوية.
- في يوم التنقية ، قم بإزالة حبيبات الخلية من الفريزر -80 درجة مئوية ، واتركها تذوب على الجليد ، وأعد تعليق الحبيبات في 100 مل من محلول التحلل (الجدول 1).
ملاحظة: يجب دائما وضع محللة الخلية على الثلج أثناء المناولة لمنع تحلل البروتينات. بمجرد الذوبان ، يجب إكمال عملية التنقية بأكملها في نفس اليوم. لا ينبغي تخزين خلية المحللة في الثلاجة بين عشية وضحاها.
- انقل التعليق إلى دورق سعة 250 مل وصوتنة على الجليد مع 30 ثانية ON و 30 ثانية OFF بسعة 35٪ لمدة 15 دقيقة.
ملاحظة: راجع إعدادات الشركة المصنعة لتحديد السعة. - انقل العينة الصوتية إلى أنبوب طرد مركزي وقم بتدويرها عند 27000 × جم لمدة 30 دقيقة عند 4 درجات مئوية للحصول على محللة واضحة. ضع الخلية المحللة على الثلج في الثلاجة على حرارة 4 درجات مئوية حتى حقن العينة.
2. إعداد أعمدة التقارب
- قم بتركيب الأعمدة (واحدة لراتنج Ni-NTA والأخرى للراتنج القائم على الكوبالت) على حامل مشبك بحيث يتم تثبيت الأعمدة بشكل مستقيم قدر الإمكان ، وتجنب أي ميل للأعمدة. تأكد من توصيل الجزء السفلي من الأعمدة بسدادة وإضافة 1-2 مل من المخزن المؤقت لبدء التشغيل إلى أسفل كل عمود لمنع فقاعات الهواء أثناء تعبئة العمود.
- رج زجاجات الراتنج برفق حتى يتم إعادة امتصاص الراتنج بالكامل. افتح الجزء العلوي من الأعمدة واسكب 10 مل من كل ملاط بطريقة مستمرة لتجنب إدراج فقاعات الهواء. صب الراتنج على ملعقة معدنية أو قضيب زجاجي مثبت على حافة العمود لتجنب فقاعات الهواء في العمود.
3. تعبئة العمود باستخدام محول التدفق
- افصل السدادة من العمود وقم بتوصيل الجزء السفلي بأحد طرفي الأنبوب. قم بتوصيل الطرف الآخر من الأنبوب بمنفذ الأشعة فوق البنفسجية لنظام FPLC.
- تأكد من سحب مبيت دعم السرير إلى جسم محول التدفق وحرك جسم محول التدفق أعلى العمود (الشكل 2 أ). مع وجود مزلاج الكامة في الموضع 1 ، قم بخفض محول التدفق مع الحرص على عدم إدخاله في المخزن المؤقت (الشكل 2 ب). قم بتبديل مزلاج الكاميرا إلى الموضع 2 (الشكل 2 ب). قم بتوصيل الأنبوب بالنظام وابدأ تدفق المخزن المؤقت لبدء التشغيل لمدة 1-2 دقيقة لتخليص أنبوب الهواء ومنع فقاعات الهواء أثناء التعبئة.
- قم بتبديل المزلاج مرة أخرى إلى الموضع 1 وقم بخفض محول التدفق في المخزن المؤقت بحركة واحدة سلسة ، وتجنب تضمين فقاعات الهواء ، وقم بتبديل المزلاج مرة أخرى إلى الموضع 2. هذا يسمح لبعض المخزن المؤقت بالدخول إلى محول التدفق ويزيل أي فقاعات متبقية.
- قم بتبديل المزلاج إلى الموضع 3 وشد قاعدة الكاميرا وحلقة القفل (الشكل 2 ب).
- ابدأ تدفق المخزن المؤقت عند 10 مل / دقيقة لتعبئة العمود. استمر في هذه الخطوة لمدة 3 دقائق أو حتى يتم تعبئة الراتنج جيدا.
4. فتيلة حلقة العينة لنظام FPLC
- قم بتوصيل الأنبوب من أعلى حلقة العينة بالحلقة E على نظام FPLC (الشكل 3).
- قم بتوصيل الأنبوب من أسفل حلقة العينة بالنفايات 2 على نظام FPLC.
- أدخل أحد طرفي الأنبوب في منفذ العمود لنظام FPLC وضع الطرف الآخر في زجاجة النفايات.
- أدخل الأنبوب من المضخة A في الماء المقطر المزدوج المصفى (ddH2O).
- انقر نقرا مزدوجا فوق إعدادات المضخة باستخدام البرنامج (الشكل 4A ، المسمى 2) وحدد حلقة حقن مضخة النظام (الشكل 4C).
- انقر فوق إعدادات معدل التدفق (الشكل 4 أ ، المسمى 1) وقم بتغيير معدل التدفق إلى 10 مل / دقيقة. أدخل 0٪ في مربع ٪B (الشكل 4B).
- ابدأ التدفق لغسل حلقة العينة بالماء ، مما سيدفع الختم المنزلق لأسفل.
- بمجرد وصول الختم المنزلق إلى الجزء السفلي من حلقة العينة ، أوقف التدفق. قم بتبديل المضخة A من ddH2O إلى مخزن البداية. قم بتوصيل الأنبوب من أعلى حلقة العينة ب Waste 2 ومن الأسفل بالحلقة E. اترك الأنبوب من منفذ العمود في النفايات.
- ابدأ التدفق عند 10 مل / دقيقة. بمجرد أن يصل الختم المنزلق الذي يتم دفعه لأعلى بواسطة المخزن المؤقت لبدء التشغيل الوارد إلى أعلى حلقة العينة ، أوقف التدفق. حلقة العينة جاهزة الآن لحقن العينة.
5. حقن العينة
- انقر نقرا مزدوجا فوق إعدادات المضخة وحدد حلقة التحميل اليدوي (الشكل 4C).
- قم بفك الأنبوب من Loop E وضعه في حاوية النفايات.
- قم بتوصيل الأنبوب من منفذ العمود بالأنبوب الموجود أعلى محول التدفق.
- ارسم العينة باستخدام حقنة 30 مل ؛ ثم قم بتوصيل المحقنة بمحول منفذ الحقن.
- قم بربط المحقنة في منفذ الحقن وحقن العينة ، مع التأكد من حقنها بشكل واضح في حلقة العينة. قم بتخزين 100 ميكرولتر من العينة ( تحلل إدخال الملصق) في أنبوب طرد مركزي دقيق عند -20 درجة مئوية لتحليل SDS-PAGE
ملاحظة: اعتمادا على إجمالي حجم العينة ، قد تكون هناك حاجة إلى 2-3 حقن. - قم بتوصيل منفذ الحقن بغطاء العمود.
- قم بتوصيل الأنبوب من أسفل حلقة العينة مرة أخرى بمنفذ الحلقة E.
- ضع الأنبوب من المضخة B في المخزن المؤقت للشطف.
6. إنشاء الطريقة وتحليلها باستخدام البرنامج المرتبط بنظام FPLC
- انتقل إلى علامة التبويب الصفحة الرئيسية وحدد طريقة جديدة.
- حدد علامة التبويب إعدادات الطريقة في العمود الأيسر ، وانتقل إلى القائمة المنسدلة نوع العمود ، وحدد مخصص (الشكل 5).
- أدخل حجم العمود (5 مل).
- أدخل معدل التدفق المطلوب للتشغيل (1 مل / دقيقة).
- انتقل إلى تحديد الوحدة وحدد السيرة الذاتية (وحدات تخزين الأعمدة) كوحدة أساسية للطريقة.
- تأكد من تعيين المدخل A على المخزن المؤقت A وتعيين المدخل B على المخزن المؤقت B (الإعداد الافتراضي).
- حدد علامة التبويب مخطط الطريقة في القائمة الموجودة على الجانب الأيسر. أضف خطوات التنقية بالترتيب التالي: التوازن، وتطبيق العينة، وغسل العمود، والشطف.
- ضمن التوازن، اضبط حجم الاتزان على 10 CV. تأكد من الاحتفاظ بإعداد المخزن المؤقت عند 0٪ B.
- ضمن علامة تبويب نموذج التطبيق ، قم بتعيين حجم العينة من خلال مراقبة حلقة العينة. يشير موضع الختم المنزلق إلى حجم العينة.
- تحت غسل العمود ، اضبط مستوى صوت الغسيل على 5 CV. تعطيل جمع الكسور لهذه الخطوة ؛ اجمع الغسيل ككل في دورق أثناء الجري ، بدلا من جمعه ككسور.
- للشطف ، اضبط حجم التدرج على 14 CV بدءا من 0٪ Buffer B إلى 100٪ Buffer B.
- احفظ الطريقة وابدأ التشغيل.
- تأكد من أن جامع الكسر يبدأ في موضع الكسر الأول.
- أدخل اسم التشغيل وانقر فوق ابدأ.
- أثناء مرحلة التوازن ، راقب منحنى الأشعة فوق البنفسجية في الوقت الفعلي. تأكد من أن جميع التوصيلات آمنة مع عدم وجود تسرب ؛ تأكد من الدائرة الكاملة من خلال البحث عن المخزن المؤقت المتدفق إلى حاوية النفايات. إذا لم يستقر منحنى الأشعة فوق البنفسجية خلال الدقائق الأخيرة من التوازن ، فقم بتمديد خطوة التوازن حتى يتحقق الاستقرار (الشكل 6) .
- في وقت تطبيق العينة، بدل الأنابيب الداخلة إلى حاوية النفايات إلى دورق نظيف. خلال هذه الخطوة ، اجمع البروتينات غير المنضمة التي تتدفق من أنابيب النفايات كتدفق (التسمية ك FT).
- ابحث عن زيادة حادة في منحنى الأشعة فوق البنفسجية التي من المحتمل أن تصل إلى أقصى قراءة ممكنة تبلغ 3000 مللي أمبير (الشكل 6).
ملاحظة: هضبة منحنى نموذجية عند 3000 مللي أمبير في معظم خطوات تطبيق العينة. - أثناء غسل العمود ، حيث يتم غسل البروتينات المتبقية غير المنضمة مع بقاء البروتينات المرتبطة فقط على الراتنج ، ابحث عن انخفاض حاد في منحنى الأشعة فوق البنفسجية (الشكل 6). إذا لم ينخفض منحنى الأشعة فوق البنفسجية بنهاية خطوة الغسيل ، فقم بتمديد الخطوة بالنقر فوق خطوة الانتظار حتى تنخفض الأشعة فوق البنفسجية بشكل كاف. في بداية هذه الخطوة ، انقل أنابيب النفايات من دورق FT إلى دورق نظيف آخر يسمى Wash.
- عندما تبدأ خطوة الشطف ، تأكد من أن جامع الكسور يتحرك في موضعه ويبدأ في جمع الكسور. تصور شطف البروتين من خلال البحث عن قمم في منحنى الأشعة فوق البنفسجية (الشكل 6).
- بعد اكتمال التشغيل ، انتقل إلى علامة التبويب الصفحة الرئيسية وحدد فتح تشغيل. افتح الجري لعرض مخطط الكروماتوجرام وحدد تكامل الذروة في القائمة العلوية لتمييز القمم التي تم الحصول عليها أثناء التشغيل.
- حدد علامة التبويب الكسور لتصور الكسور التي تحتوي على بروتين مستخلص.
7. تحليل صفحة SDS
- امزج 15 ميكرولتر من كل جزء يحتوي على بروتين مع 5 ميكرولتر من المخزن المؤقت لتحميل عينة SDS (الجدول 1). سخني العينات على حرارة 95 درجة مئوية لمدة 5 دقائق.
- قم بتحميل العينات في المواد الهلامية مسبقة الصب وقم بتشغيلها عند 160 فولت لمدة 45 دقيقة مع علامة البروتين الملطخة مسبقا.
- قم بتلطيخ المواد الهلامية في محلول تلطيخ Coomassie الأزرق اللامع لمدة 30 دقيقة (الجدول 1).
- اغسل الجل في ddH2O (كرر 3x).
- قم بإزالة الجل في محلول إزالة البقع لمدة ساعة واحدة (الجدول 1).
- مراقبة عصابات البروتين. كشف FEN1 عند علامة 42 كيلو دالتون.
- تجمع الكسور التي تحتوي على FEN1 وتركيز حمام السباحة باستخدام مرشح الطرد المركزي 10 كيلو دالتون. القسمة وتخزينها في الفريزر -80 درجة مئوية.
النتائج
تم تمرير محللات خلية BL21 (DE3) التي تعبر عن hFEN1 من خلال راتنجات Ni-NTA و TALON المتوازنة. راتنج Ni-NTA مشحون بأيونات Ni2+ وله قدرة ربط عالية. تظهر النتائج أن راتنج Ni-NTA ينتج كمية أعلى من FEN1 مقارنة براتنج TALON (الشكل 7). من المعروف أيضا أن راتنج Ni-NTA يرتبط بشكل غير محدد بالبروتينات الأخرى المعبر عنها بالكروموسومات. مرت خلية المحللة عبر الراتنج القائم على الكوبالت ، وتم تنقيتها بنقاوة عالية ولكن بعائد أقل ، مقارنة ب Ni-NTA. مثل العديد من البروتينات الأخرى المرتبطة بالحمض النووي ، تم تمرير FEN1 من خلال راتنج استبعاد الحجم لإزالة الشوائب. يمكن تحديد hFEN1 عند علامة 43 كيلو دالتون.
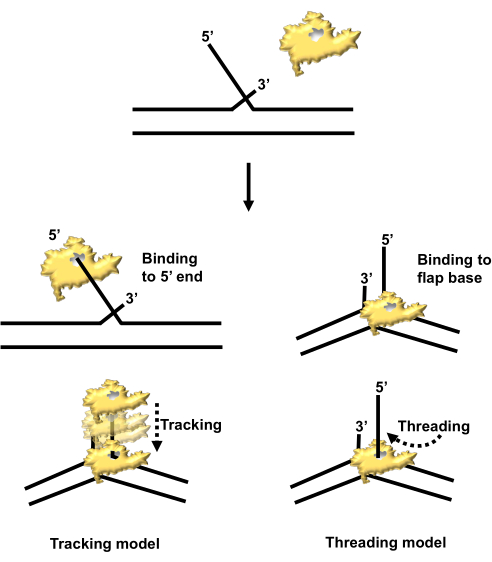
الشكل 1: آلية انقسام السديلة بواسطة hFEN1: التتبع مقابل الخيوط. كان يعتقد في البداية أن FEN1 (المصور باللون الأصفر) يرتبط بنهاية 5 بوصات من هيكل الغطاء ويتتبع من خلاله إلى قاعدة الغطاء (يسار). كشفت الدراسات اللاحقة أن FEN1 يرتبط أولا بقاعدة الغطاء ويخيط الغطاء مقاس 5 بوصات عبر موقعه النشط (يمين). اختصار: hFEN1 = نوكلياز رفرف الإنسان 1. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: محول التدفق. (أ) مكونات محول التدفق المستخدم في تعبئة الأعمدة وعملية تنقيتها؛ ( ب) المواضع الثلاثة لمزلاج الكامة المستخدمة لشد / فك الحلقة O وتثبيت المحول في مكانه. تظهر الصورة المكبرة حالة الحلقة O (فضفاضة / ضيقة) في المواضع 1,2 و 3 من أعلى إلى أسفل. تم التقاط الصور بإذن من 9. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: وحدة الحقن لنظام كروماتوغرافيا البروتين السائل السريع. تربط المنافذ المختلفة لوحدة الحقن نظام كروماتوغرافيا سائل البروتين السريع بالعمود وحلقة العينة والنفايات. تم التقاط الصورة بإذن من 10. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التحكم في النظام. (أ) علامة تبويب التحكم في النظام التي يمكن فيها معالجة إعدادات التدفق ورؤية مسار التدفق ؛ (B) نافذة إعدادات معدل التدفق؛ ( C) نافذة إعدادات المضخة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 5: نافذة إعدادات الطريقة. نافذة لإدخال تفاصيل التنقية مثل نوع العمود وحجم العمود والوحدة الأساسية للطريقة ومعدل التدفق للتشغيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: رسم تخطيطي لمنحنى الأشعة فوق البنفسجية أثناء FPLC: يرتفع منحنى الأشعة فوق البنفسجية وينخفض وفقا لمرحلة التنقية. في بداية التوازن ، يمكن أن يتشوه منحنى الأشعة فوق البنفسجية بسبب وجود فقاعات هواء أو ملوثات في الأنبوب. مع استمرار التوازن ، يجب أن يستقر المنحنى كخط مسطح ؛ أثناء حقن العينة ، عندما تتدفق البروتينات غير المرتبطة بالراتنج ، يرتفع منحنى الأشعة فوق البنفسجية حتى يتم الوصول إلى الحد الأقصى. تظهر خطوة الغسيل ، التي تطرد البروتينات المتبقية غير المنضمة ، انخفاضا تدريجيا في قياسات الأشعة فوق البنفسجية. أخيرا ، خلال مرحلة الشطف ، عندما يتم التخلص من البروتين المستهدف ، تظهر ذروة في منحنى الأشعة فوق البنفسجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: صورة هلام SDS PAGE. حارة 1-علامة الوزن الجزيئي ؛ لين 2-1٪ مدخلات Ni-NTA (خلية محللة) ؛ حارة 3-1٪ تدفق من راتنج Ni-NTA ؛ لين 4-hFEN1 المنقى من راتنج Ni-NTA ؛ لين 5-1٪ المدخلات (خلية محللة) ؛ حارة 6-1 ٪ التدفق من الراتنج القائم على الكوبالت ؛ لين 7-hFEN1 المنقى من الراتنج القائم على الكوبالت ؛ يمثل السهم الأسود FEN1 عند 42.5 كيلو دالتون. الاختصارات: SDS-PAGE = كبريتات دوديسيل الصوديوم. MW = الوزن الجزيئي ؛ hFEN1 = رفرف الإنسان endonuclease 1 ؛ NTA = حمض النيتريلوتريس أسيتيك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| المخازن المؤقتة والحلول | مكونات |
| التحلل العازلة | 50 مللي متر تريس - حمض الهيدروكلوريك [درجة الحموضة 8.0] |
| 500 مللي متر كلوريد الصوديوم | |
| 1 مللي متر بيتا ميركابتوإيثانول (BME) | |
| 1 مللي متر فلوريد فينيل ميثيل سلفونيل (PMSF) | |
| 1 مللي متر EDTA | |
| 1 قرص كامل مثبطات الأنزيم البروتيني | |
| 10 مللي متر إيميدازول | |
| 10٪ جلسرين | |
| التوازن / غسل العازلة | 50 مللي متر تريس - حمض الهيدروكلوريك [درجة الحموضة 8.0] |
| 500 مللي متر كلوريد الصوديوم | |
| 1 مللي متر BME | |
| 1 مللي متر PMSF | |
| 10 مللي متر إيميدازول | |
| 10٪ جلسرين | |
| العازلة للشطف | 50 مللي متر تريس - حمض الهيدروكلوريك [درجة الحموضة 8.0] |
| 500 مللي متر كلوريد الصوديوم | |
| 1 مللي متر BME | |
| 1 مللي متر PMSF | |
| 1 م إيميدازول | |
| 10٪ جلسرين | |
| المخزن المؤقت لتحميل عينة SDS | 900 ميكرولتر 4x Laemmli عينة عازلة |
| 100 ميكرولتر BME | |
| حل تلطيخ أزرق رائع Coomassie | 50٪ ddH2O |
| 40٪ ميثانول | |
| 10٪ حمض الخليك | |
| 0.1٪ كوماسي الأزرق اللامع R-250 | |
| حل إزالة البقع | 50٪ ddH2O |
| 40٪ ميثانول | |
| 10٪ حمض الخليك |
الجدول 1: تكوين المخزن المؤقت.
Discussion
كروماتوغرافيا التقارب هي تقنية مستخدمة على نطاق واسع لتنقية البروتينات المرتبطة بالحمض النووي. كروماتوغرافيا التقارب المعدني المجمدة (IMAC) هي نوع معين من كروماتوغرافيا التقارب التي تستخدم أيونات المعادن لالتقاط بقايا الهستيدين لتسلسل الببتيد. هذا هو السبب في أن "علامة 6X-His " أو "علامة poly-His " مرتبطة بالمحطة N أو المحطة C للبروتينات المراد تنقيتها. النيكل والكوبالت هما أيونات المعادن الأكثر استخداما ويختلفان في توافقهما مع الكواشف مثل BME و DTT المستخدمة عادة في التنقية. على الرغم من إجراء عمليات التنقية بتركيزات 1 mM BME أو DTT ، إلا أن استخدام هذه الكواشف لا يزال غير موثوق. يمكن ملاحظة عدم التوافق أثناء التوازن. إذا ظهر المخزن المؤقت الذي يتدفق عبر الراتنج بني اللون ، فهذا يشير إلى أكسدة أيونات المعادن وقد يجرد أيونات المعدن من الراتنج. هذا يمكن أن يقلل بشكل كبير من قدرة ربط الراتنج.
لضمان نقاء عالي وإنتاجية البروتين ، يجب تفضيل تفاعلات التقارب بين أيونات المعادن وعلامة His-tag على التفاعلات الأخرى المحتملة القائمة على الشحنة. سيضمن ذلك استخلاص كل البروتين مرة واحدة بدلا من الاستلهام على مراحل مختلفة من الشطف. لتحقيق ذلك ، يجب أن يحمل البروتين شحنة منخفضة جدا أثناء التنقية. إذا كانت قيم الأس الهيدروجيني للمخازن المؤقتة أقرب إلى نقطة تساوي الكهربية للبروتين المستهدف ، فيمكن إبقاء شحنة البروتين منخفضة. نظرا لأن نقطة تساوي الكهربية ل FEN1 تبلغ حوالي 8.8 ، يتم الحفاظ على المخازن المؤقتة لدينا عند الرقم الهيدروجيني 8.
يعتقد أن راتنج Ni-NTA ، المشحون بأيونات النيكل ، يتمتع بقدرة أكبر على ربط البروتين ومن المتوقع أن ينتج كمية أعلى من البروتين مقارنة بالراتنج القائم على الكوبالت TALON. هذا يعني أيضا أن هناك إمكانية أكبر لربط البروتينات غير المحددة وبالتالي انخفاض النقاء. وتستكمل قدرة الربط المنخفضة ل TALON بربط نوعي أعلى وإنتاجية بروتين عالي النقاء. هذا يتوافق مع نتائجنا التي تظهر إنتاجية أعلى من البروتين المنقى من Ni-NTA مقارنة ب TALON.
بغض النظر عن الراتنج ، تتأثر النقاء والعائد بشكل كبير بتعبئة العمود. يمكن تحقيق التعبئة الفعالة باستخدام محول التدفق المتصل بنظام الكروماتوغرافيا الآلي NGC9. عند معدلات التدفق العالية بما فيه الكفاية ، يمكن لمحول التدفق تعبئة الراتنج بشكل فعال ومنع تراكم المخزن المؤقت في العمود. يسمح محول التدفق جنبا إلى جنب مع NGC بإجراء مقارنة دقيقة لكل من الراتنجات بسبب تنظيم معدل التدفق والضغط وتدرج الشطف ، فضلا عن الجمع الفعال لكسور البروتين.
من خلال برنامج Chromlab ، يمكن مراقبة ظروف التشغيل في الوقت الفعلي10. يمكن تغيير معدل التدفق في أي وقت طوال فترة التشغيل. أثناء تطبيق العينة، قد يتجاوز ضغط النظام العتبة (600 رطل / بوصة مربعة). في هذه الحالة ، يمكن أن يؤدي خفض معدل التدفق أثناء خطوة تطبيق العينة إلى تقليل الضغط. يتميز البرنامج أيضا بوظيفة Hold step التي يمكن من خلالها تمديد أي خطوة حسب الحاجة. هذه الوظيفة مفيدة بشكل خاص أثناء غسل العمود وخطوات الشطف. أثناء غسل العمود ، من المتوقع أن ينخفض الرسم البياني للأشعة فوق البنفسجية ويصل تقريبا إلى 0 - وهذا يدل على أن معظم البروتينات غير المنضمة قد تم غسلها من الراتنج. في حالة استمرار ارتفاع خط الأشعة فوق البنفسجية أو فشله في الانخفاض ، يمكن تمديد خطوة الغسيل حتى يتم رؤية الرسم البياني المتوقع. وبالمثل ، أثناء الشطف ، يمكن تصور شطف البروتين المستهدف من خلال القمم في الرسم البياني للأشعة فوق البنفسجية. إذا لم تكن هناك قمم مرئية بشكل غير متوقع ، فيمكن تمديد خطوة الشطف حتى يتم ملاحظة القمم المتوقعة.
نصائح وحيل
أثناء خطوة التوازن ، يجب حقن المخزن المؤقت في العمود ويجب إطلاق مخزن النفايات باستمرار في زجاجة النفايات ؛ هذا يضمن أن جميع التوصيلات محكمة ومانعة للتسرب. في حالة حدوث أي تسرب من أي موقع من مواقع NGC ، يجب فحص جميع المنافذ المحيطة بالمنطقة ، حيث قد يختلف أصل التسرب عن مكان ملاحظة التسرب. إذا بدأ التدفق ولكن لم يدخل أي مخزن مؤقت إلى العمود ، فمن المحتمل أن يكون الهواء محاصرا داخل الأنبوب. تطهير النظام قبل الاستمرار أكثر.
أثناء حقن العينة ، إذا كان الضغط الخلفي من النظام يقاوم الحقن ، فيجب فك الأنبوب من الحلقة E ووضعه في زجاجة النفايات طوال مدة الحقن. من المهم إعادته إلى Loop E قبل بدء البرنامج. في حالة تراكم المخزن المؤقت للتوازن أو العينة في العمود أثناء التشغيل ، يجب إيقاف التشغيل مؤقتا وإزالة محول التدفق. يجب فك الأنبوب من أسفل العمود والسماح للمخزن المؤقت أو العينة بالتدفق من خلاله. إذا كانت العينة تتدفق من خلالها، فتأكد من جمعها كتدفق.
إذا أظهرت الكسور التي تعمل على SDS PAGE gel مستويات عالية من البروتينات الملوثة ، فيمكن تشغيل الكسور على جانبي القمم التي تظهر في الكروماتوجرام. في كثير من الأحيان ، بالنسبة للبروتينات منخفضة التعبير ، لا تظهر الكسور النقية قمم كبيرة في الأشعة فوق البنفسجية.
إن فهم الاختلافات بين خصائص الراتنج القائم على النيكل والراتنج القائم على الكوبالت يسمح باختيار الراتنج الأنسب للتطبيقات المستقبلية للبروتين المنقى. على سبيل المثال ، من المتوقع أن تكون البروتينات المستخدمة في المقايسات البيوكيميائية في المختبر من أعلى درجة نقاء ممكنة ، وهي حالة يكون فيها الراتنج القائم على الكوبالت مناسبا. ومع ذلك ، إذا تم استخدام البروتين لإنتاج الأجسام المضادة ، فإن العائد الكبير من البروتين المنقى مطلوب لهذه العملية. يمكن أن يكون راتنج Ni-NTA بمثابة خيار أفضل في هذه الحالة. تهدف هذه المقالة إلى إبراز الاختلافات في هذه الراتنجات من خلال تنقية FEN1.
Disclosures
ليس للمؤلفين مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
تم تمويل هذا العمل من خلال منح من المؤسسة الوطنية للعلوم (1929346) وجمعية السرطان الأمريكية (RSG-21-028-01). ونود أيضا أن نشكر أعضاء مختبر بالاكريشنان على المناقشات المفيدة.
Materials
| Name | Company | Catalog Number | Comments |
| 4x Laemmli sample buffer | BioRad | 1610747 | |
| Acetic acid | Merck | UN2789 | |
| Beta-mercaptoethanol (BME) | Sigma | M-6250 | |
| Chromlab software version 6.1.27.0 | BioRad | operates the NGC system | |
| Complete MINI protease inhibitor tablet | Roche | 11836153001 | |
| Coomassie Brilliant Blue R | Sigma | B0149 | |
| Dithiothreitol (DTT) | Dot Scientific | DSD11000 | |
| Econo-Column glass | BioRad | 7371512 | |
| Ethylene diamine tetraacetic acid (EDTA) | Dot Scientific | DSE57020 | |
| Flow adaptor | BioRad | 7380014 | |
| Glycerol | Dot Scientific | DSG22020 | |
| Imidazole | Dot Scientific | DSI52000 | |
| Methanol | Fisher Scientific | A412 | |
| Mini PROTEAN TGX gels | BioRad | 4561084 | |
| NGC Chromatography System | BioRad | automated liquid chromatography system | |
| Ni-NTA Agarose | Qiagen | 1018244 | |
| Phenyl-methyl-sulfonyl fluoride | Dot Scientific | DSP20270 | |
| PreScission Plus Protein Dual Color Standards | BioRad | 1610374 | |
| Sodium chloride | Dot Scientific | DSS23020 | |
| TALON metal affinity resin | Takara | 635502 | |
| Tris Base | DST60040 |
References
- Balakrishnan, L., Bambara, R. A. Flap endonuclease 1. Annu Rev Biochem. 82, 119-138 (2013).
- Asagoshi, K. FEN1 functions in long patch base excision repair under conditions of oxidative stress in vertebrate cells. Mol Cancer Res. 8 (2), 204-215 (2010).
- Lyamichev, V., Brow, M. A., Dahlberg, J. E. Structure-specific endonucleolytic cleavage of nucleic acids by eubacterial DNA polymerases. Science. 260 (5109), 778-783 (1993).
- Bornarth, C. J., Ranalli, T. A., Henricksen, L. A., Wahl, A. F., Bambara, R. A. Effect of flap modifications on human FEN1 cleavage. Biochemistry. 38 (40), 13347-13354 (1999).
- Xu, Y., Potapova, O., Leschziner, A. E., Grindley, N. D., Joyce, C. M. Contacts between the 5' nuclease of DNA polymerase I and its DNA substrate. J Biol Chem. 276 (32), 30167-30177 (2001).
- Wen-Hui, K., Kuo, K., Chase, H. A. Exploiting the interactions between poly-histidine fusion tagsand immobilized metal ions. Biotechnol Lett. 33 (6), 1075-1084 (2011).
- Charlton, A., Zachariou, M. Immobilized metal ion affinity chromatography of native proteins. Methods Mol Biol. 421, 25-35 (2008).
- Ononye, O. E., Njeri, C. W., Balakrishnan, L. Analysis of DNA processing enzyme FEN1 and its regulation by protein lysine acetylation. Methods Mol Biol. 1983, 207-224 (2019).
- Econo-column flow adaptor instruction manual. Bio-Rad Available from: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/M7380014.pdf (2015)
- NGC Chromatography systems and ChromLab software instrument guide version 3.3. Bio-Rad Available from: https://www.bio-rad.com/webroot/web/pdf/lsr/literature/10026252.pdf (2015)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved