Method Article
اختبار محسن للسحب أحادي الجزيء لتحديد كمية فسفرة البروتين
In This Article
Summary
يصف هذا البروتوكول إعداد العينات وتحليل البيانات لتحديد كمية فسفرة البروتين باستخدام فحص محسن للسحب أحادي الجزيء (SiMPull).
Abstract
الفسفرة هي تعديل ضروري بعد الترجمة ينظم وظيفة البروتين ويوجه نتائج إشارات الخلايا. لا يمكن للطرق الحالية لقياس فسفرة البروتين الحفاظ على عدم التجانس في الفسفرة عبر البروتينات الفردية. تم تطوير اختبار السحب أحادي الجزيء (SiMPull) للتحقيق في تكوين المجمعات الجزيئية الكبيرة عن طريق الترسيب المناعي للبروتينات على غطاء زجاجي متبوعا بتصوير جزيء واحد. التقنية الحالية هي تكيف مع SiMPull يوفر تقديرا كميا قويا لحالة الفسفرة لمستقبلات الغشاء كاملة الطول على مستوى الجزيء الواحد. يسمح تصوير الآلاف من المستقبلات الفردية بهذه الطريقة بتحديد أنماط فسفرة البروتين. يفصل البروتوكول الحالي إجراء SiMPull الأمثل ، من إعداد العينات إلى التصوير. إن تحسين إعداد الزجاج وبروتوكولات تثبيت الأجسام المضادة يزيد من تحسين جودة البيانات. يوفر البروتوكول الحالي رمزا لتحليل بيانات الجزيء الواحد الذي يحسب جزء المستقبلات المفسفرة داخل العينة. بينما يركز هذا العمل على فسفرة مستقبلات عامل نمو البشرة (EGFR) ، يمكن تعميم البروتوكول على مستقبلات الغشاء الأخرى وجزيئات الإشارات الخلوية.
Introduction
يتم ضبط الإشارات المرتبطة بالغشاء عن طريق مزيج من تنشيط مستقبلات الغشاء التي يسببها الليغاند وتوظيف البروتينات الملحقة في المصب التي تنشر الإشارة. الفسفرة من التيروزين الرئيسية في ذيول السيتوبلازم المستقبلات أمر بالغ الأهمية لبدء تشكيل مجمعات الإشارات ، أو السيلوسومات 1,2. لذلك ، فإن السؤال المهم في علم الأحياء هو كيف يتم إنشاء أنماط الفسفرة والحفاظ عليها لتجنيد شركاء الإشارات وإملاء النتائج الخلوية. ويشمل ذلك فهم عدم تجانس فسفرة المستقبلات ، سواء في الوفرة أو في أنماط الفوسفوتيروزين المحددة التي يمكن أن توفر وسيلة للتلاعب بمخرجات الإشارات عن طريق إملاء تكوين الإشارة3،4،5،6،7. ومع ذلك ، هناك قيود في الطرق الحالية لاستجواب فسفرة البروتين. تحليل اللطخة الغربية ممتاز لوصف اتجاهات فسفرة البروتين ولكنه شبه كمي8 ولا يوفر معلومات عن عدم تجانس النظام لأن الآلاف إلى الملايين من المستقبلات يتم حسابها في المتوسط معا. في حين أن البقع الغربية تسمح بفحص عينة باستخدام أجسام مضادة خاصة بالفوسفو لتيروزينات محددة ، إلا أنها لا تستطيع توفير معلومات عن أنماط الفسفرة متعددة المواقع داخل نفس البروتين. تقرير الفوسفوبروتينات الكمي عن وفرة الفوسفوتيروزين ، ولكن هناك قيود على اكتشاف الفسفرة متعددة المواقع ، حيث يجب أن تكون المخلفات ذات الأهمية موجودة داخل نفس الببتيد (عادة 7-35 من الأحماض الأمينية) التي يتم إنشاؤها بواسطة الهضم الأنزيمي9،10،11.
للتغلب على القيود المذكورة أعلاه ، تم تكييف اختبار السحب أحادي الجزيء (SiMPull) لتحديد حالات الفسفرة للمستقبلات السليمة على مستوى الجزيء الواحد. تم إثبات SiMPull لأول مرة كأداة قوية لاستجواب المجمعات الجزيئية الكبيرة بواسطة Jain et al.12,13. في SiMPull ، تم ترسيب المجمعات الجزيئية الكبيرة (IP) على أغطية زجاجية وظيفية للأجسام المضادة ثم تم تحليلها من خلال الفحص المجهري أحادي الجزيء لعدد الوحدات الفرعية للبروتين و IP المشترك مع المكونات المعقدة12. كان التعديل الذي أجراه كيم وآخرون 14 ، والذي أطلق عليه اسم SiMBlot ، أول من استخدم اختلافا في SiMPull لتحليل فسفرة البروتينات المشوهة. يعتمد بروتوكول SiMBlot على التقاط بروتينات سطح الخلايا البيوتينيل باستخدام أغطية مغلفة ب NeutrAvidin، والتي يتم فحصها بعد ذلك للفسفرة باستخدام وضع العلامات على الأجسام المضادة الخاصة بالفوسفو14. وعلى الرغم من هذه التطورات، كانت هناك حاجة إلى تحسينات لجعل القياس الكمي للتعديل بعد الترجمة أكثر قوة وقابلية للتطبيق على مجموعة أوسع من البروتينات.
يصف هذا البروتوكول نهج SiMPull الأمثل الذي تم استخدامه لتحديد أنماط الفسفرة لمستقبلات عامل نمو البشرة السليمة (EGFR) استجابة لمجموعة من ظروف الرباط والطفرات الورمية15. بينما يركز هذا العمل على EGFR ، يمكن تطبيق هذا النهج على أي مستقبلات غشائية وبروتينات خلوية ذات أهمية (POI) ، والتي تتوفر لها أجسام مضادة عالية الجودة. يتضمن البروتوكول خطوات لتقليل التألق الذاتي للعينات ، وتصميم صفيف العينات الذي يتطلب الحد الأدنى من حجم العينة مع التحضير المتزامن لما يصل إلى 20 عينة ، وتحسين ظروف وضع العلامات على الأجسام المضادة وتثبيتها. تم تطوير خوارزميات تحليل البيانات للكشف عن جزيء واحد وتحديد كمية البروتينات المفسفرة.
Protocol
1. إعداد غطاء
ملاحظة: في هذه الخطوة ، يحتاج المرء إلى ارتداء معدات الحماية الشخصية (PPE) ، والتي تشمل طبقة مزدوجة من قفازات النتريل ، ونظارات السلامة أو درع الوجه ، ومعطف المختبر.
- أداء حفر البيرانا لإزالة الحطام العضوي من الزجاج.
تحذير: محلول البيرانا هو عامل مؤكسد قوي قابل للتآكل وشديد التفاعل عند ملامسته للمواد العضوية. التفاعل مع الحطام العضوي طارد للحرارة ويحتمل أن يكون متفجرا. وبالتالي ، يجب تنفيذ الإجراء في غطاء دخان كيميائي مع خفض الوشاح. مطلوب الأواني الزجاجية Pyrex للتعامل مع محلول البيرانا.- قم بإعداد مساحة العمل داخل غطاء الدخان الكيميائي. رتب الأغطية دون تداخل في الجزء السفلي من كوب زجاجي سعة 4 لتر ، وهو دورق "التفاعل" ، وضع كوب التفاعل على صفيحة ساخنة بحرارة لطيفة. اترك الأواني الزجاجية تسخن لمدة 10 دقائق. ضع دورق زجاجي "نفايات" سعة 1 لتر مع 500 مل من ddH2O بالقرب من كوب التفاعل.
- أضف 49 مل من حمض الكبريتيك 12 N (H2SO4) ببطء إلى كوب التفاعل باستخدام ماصة مصلية زجاجية. شطف ماصة في كوب النفايات قبل التخلص منها.
- أضف 21 مل من بيروكسيد الهيدروجين بنسبة 30٪ (H 2 O2) بقطرة مع ماصة مصلية زجاجية إلى كوب التفاعل. قم بتوزيع قطرات H 2O2 ببطء بالتساوي عبر الجزء السفلي من قارورة التفاعل لمنع التبريد الموضعي لتفاعل حفر البيرانا. شطف ماصة في كوب النفايات قبل التخلص منها.
تنبيه: أضف دائما H 2 O2 إلى H2 SO4 ، ولا العكس بالعكس أبدا. - البيرانا حفر الأغطية لمدة 30 دقيقة. حرك بلطف محتويات كوب التفاعل كل 5 دقائق.
- قم بإخماد محلول البيرانا عن طريق صب محتويات كوب النفايات في كوب التفاعل. انقل السائل ببطء إلى أسفل جدار كوب التفاعل لتقليل الرذاذ. قم بإزالة كوب التفاعل من السخان.
- عندما يتم إخماد التفاعل وتبريده ، صب محلول البيرانا مرة أخرى في كوب النفايات لتحييده دون إزالة الأغطية المحفورة من وعاء التفاعل.
- تحييد حل البيرانا مع إضافة تدريجية لقاعدة ضعيفة. على سبيل المثال ، استخدم كتلة مفرطة 20 جم من بيكربونات الصوديوم (NaHCO3) / محلول بيرانا 100 مل.
تنبيه: لا تقم بتخزين محاليل البيرانا في حاويات نفايات مغلقة. يجب دائما تحييد الحل قبل التخلص منه. ينتج تفاعل التحييد فقاعات قوية وقد يكون متفجرا إذا لم يتم التحكم فيه عن طريق الإضافة التدريجية للقاعدة الضعيفة. - حرك المحلول المحايد بقضيب تحريك زجاجي واتركه يتفاعل لمدة 2 ساعة. ارفع الرقم الهيدروجيني إلى >4 وتخلص من المحلول.
- بين إضافات القاعدة الضعيفة إلى محلول البيرانا ، انقل الأغطية المحفورة من كوب التفاعل إلى قمع Buchner بقضيب تحريك زجاجي وشطفه لمدة 5 دقائق في تشغيل ddH2O.
ملاحظة: انتقل على الفور إلى الخطوة التالية أو قم بتخزين أغطية سمك البيرانا المحفورة لمدة تصل إلى أسبوعين في ddH2O في وعاء زجاجي مغلق أو طبق بتري (لف بفيلم مانع للتسرب ، انظر جدول المواد).
- قم بتسمير الأغطية في المذيبات العضوية باتباع الخطوات أدناه.
- ضع الأغطية في جرة كوبلن زجاجية (انظر جدول المواد) وقم بتغطيتها بالميثانول (CH3OH). أغلق الغطاء على الجرة بفيلم مانع للتسرب وسونيكات الحمام لمدة 10 دقائق. صب الميثانول بعناية من جرة كوبلن في زجاجة تخزين زجاجية.
- املأ جرة كوبلن بالأسيتون (C3H6O) ، وأغلق الغطاء ، واستحم سونيكات لمدة 10 دقائق. صب الأسيتون بعناية من جرة كوبلن في زجاجة تخزين زجاجية.
تحذير: الميثانول قابل للاشتعال وسام بشكل حاد. استخدم في غطاء الدخان الكيميائي. الأسيتون قابل للاشتعال ومهيج. لذلك ، تعامل معه وخزنه في الزجاج ، واستخدمه في غطاء الدخان الكيميائي. التخلص من النفايات الخطرة وفقا للوائح والمبادئ التوجيهية المحلية.
ملاحظة: يمكن إعادة استخدام الميثانول والأسيتون حتى خمس مرات لكل منهما.
- قم بتنشيط سطح الغطاء لإضفاء الطابع الوظيفي على السيلان.
- حمام سونيكات مع 1 م هيدروكسيد البوتاسيوم (KOH) لمدة 20 دقيقة. صب بعناية KOH من جرة كوبلن في أنبوب مخروطي 50 مل لإعادة استخدامه.
تحذير: KOH هو تآكل ومهيج. استخدم في غطاء الدخان الكيميائي ولا تخزنه في الزجاج. تخزينها في أنابيب البولي بروبلين. التخلص من النفايات الخطرة وفقا للوائح والمبادئ التوجيهية المحلية.
ملاحظة: يمكن إعادة استخدام KOH حتى خمس مرات. - اشطف مرتين باستخدام ddH 2 O. صفي ddH2O من الأغطية ، ثم سخني كل غطاء عن طريق التلويح عبر لهب موقد بنسن لطرد كل رطوبة السطح. ضع الأغطية في وعاء كوبلن جاف.
- حمام سونيكات مع 1 م هيدروكسيد البوتاسيوم (KOH) لمدة 20 دقيقة. صب بعناية KOH من جرة كوبلن في أنبوب مخروطي 50 مل لإعادة استخدامه.
- أداء أمينوسيلان الغطاء.
- تحضير محلول أمينوسيلان عن طريق خلط 69.4 مل من الميثانول مع 3.6 مل من حمض الخليك (CH3COOH) في قارورة مخروطية. أضف 720 ميكرولتر من N-(2-aminoethyl)-3-aminopropyltrimethoxysilane (aminosilane) واخلطها جيدا (انظر جدول المواد).
تحذير: حمض الخليك قابل للاشتعال والتآكل. التعامل مع الماصات الزجاجية وتخزينها في الزجاج. العمل مع حمض الخليك في غطاء الدخان الكيميائي. الأمينوسيلان هو خطر استنشاق سام بشكل حاد ، ومحسس ، ومهيج. إنه ضار بالحياة المائية. استخدم في غطاء الدخان الكيميائي. التخلص من المواد الكيميائية كنفايات خطرة وفقا للوائح والمبادئ التوجيهية المحلية.
ملاحظة: أمينوسيلان حساس للضوء ويتحلل بسرعة في الماء. يجب تنفيذ جميع الخطوات باستخدام هذا الكاشف في ظل الحد الأدنى من ظروف الإضاءة للحفاظ على النشاط. قم بتطهير الزجاجة بغاز النيتروجين وقم بتطبيق فيلم مانع للتسرب قبل التخزين في مجفف داكن. استبدل كل 6-9 أشهر. - أضف على الفور محلول أمينوسيلان إلى جرة كوبلين. قم بتغطية وتطبيق فيلم الختم ، مع الاستمرار في الحماية من الضوء.
- احتضن الأغطية في محلول أمينوسيلان لمدة 10 دقائق في الظلام في درجة حرارة الغرفة (RT). حمام سونيكات لمدة 1 دقيقة ثم احتضان لمدة 10 دقائق أخرى. صب محلول الأمينوسيلان بعناية في حاوية نفايات مخصصة ل CH 3 OH مع تتبعأمينوسيلان و CH3COOH.
- شطف أغطية مع الميثانول وصب الحل في حاوية النفايات المخصصة للميثانول.
- اشطف الأغطية ثلاث مرات لمدة دقيقتين لكل منها باستخدام ddH2O. صفي الأغطية ، وخففي الرطوبة الزائدة ، وجففيها في الهواء تماما لمدة 10 دقائق.
- تحضير محلول أمينوسيلان عن طريق خلط 69.4 مل من الميثانول مع 3.6 مل من حمض الخليك (CH3COOH) في قارورة مخروطية. أضف 720 ميكرولتر من N-(2-aminoethyl)-3-aminopropyltrimethoxysilane (aminosilane) واخلطها جيدا (انظر جدول المواد).
- أداء إعداد الصفيف / البيوتين-PEG وظيفية من الأغطية.
- تحضير 1 M NaHCO 3 (الرقم الهيدروجيني 8.5) مخزون العمل عن طريق إذابة 84.5 ملغ من NaHCO3 في 1 مل من ddH2O. للتركيز النهائي ل 10 mM NaHCO 3 ، قم بتخفيف 1 M NaHCO3 إلى ddH2O (1:100).
- ارسم صفيفا شبكيا على الأغطية الأمينوسيلانية الجافة باستخدام قلم حاجز كاره للماء (انظر جدول المواد) وانتظر حتى يجف الحبر. اكتب معرفا على الغطاء لتحديد الاتجاه الصحيح. ضع الأغطية في غرفة رطبة.
ملاحظة: يجب أن يتكون الصفيف من 16-20 مربعا، بحجم 4 مم × 4 مم تقريبا. - لجعل محلول بيوتين-بيغ سكسينيميديل فاليرات (بيوتين-بيغ)/مبيغ سكسينيميديل فاليرات (mPEG)، أولا، قم بإزالة mPEG وبيوتين-بيغ (انظر جدول المواد) من الفريزر والتوازن إلى RT. أضف 153 ملغ من mPEG و 3.9 ملغ من البيوتين-بيغ (~ 1:39 البيوتين-PEG:mPEG) إلى أنبوب طرد مركزي دقيق 1.5 مل، وأعد التعليق في 609 ميكرولتر من 10 مللي متر ناهكو3 عن طريق السحب اللطيف. جهاز طرد مركزي عند 10000 × g لمدة دقيقة واحدة في RT لإزالة الفقاعات.
ملاحظة: عمر النصف للتحلل المائي لفالات سكسينيميديل في المخزن المؤقت للدرجة الهيدروجينية 8.5 هو ~ 30 دقيقة. بعد إضافة المخزن المؤقت إلى mPEG، تابع الخطوات التالية في أسرع وقت ممكن. هذه الخطوة حاسمة. - قم بتطبيق محلول البيوتين-PEG / mPEG لتغطية كل مربع بالكامل في صفائف الغطاء ، وعادة ما يكون 10-15 ميكرولتر لكل مربع. لا تسمح للسائل بتجاوز المساحة المحددة. قم بتخزين الأغطية في غرفة الرطوبة في الظلام لمدة 3-4 ساعات في RT.
- اغسل الأغطية بكميات وفيرة من الماء عن طريق غمسها بالتتابع في أكواب زجاجية 3 × 250 مل مملوءة ب ddH2O لمدة 10 ثوان لكل منها.
- اطرد كل الرطوبة من الأغطية بغاز النيتروجين. قم بتخزين الأغطية من الخلف إلى الخلف في أنبوب مخروطي مملوء بالنيتروجين بسعة 50 مل ملفوف بفيلم مانع للتسرب عند -20 درجة مئوية.
ملاحظة: انتقل فورا إلى الخطوة 2 أو قم بتخزين الأغطية عند -20 درجة مئوية لمدة تصل إلى أسبوع واحد قبل الاستخدام.
2. إعداد SiMPull lysate
تنبيه: معدات الوقاية الشخصية المطلوبة للخطوات المتبقية من البروتوكول هي قفازات النتريل ونظارات السلامة ومعاطف المختبر.
ملاحظة: تم تحضير الليزات من خلايا CHO الملتصقة التي تعبر عن EGFR-GFP. تم طلاء الخلايا في طبق زراعة الأنسجة 60 ملم (TC60) بين عشية وضحاها12,13. تم استزراع خلايا CHO في DMEM مع استكمال 10 ٪ من مصل البقر الجنيني ، و 1 ٪ L-الجلوتامين ، و 1 ٪ البنسلين الستربتومايسين ، و 500 نانوغرام / مل من geneticin (انظر جدول المواد). يمكن أيضا استخدام خطوط الخلايا الملتصقة الأخرى أو خلايا التعليق.
- قم بلوحة الخلايا باتباع الخطوات أدناه.
- اغسل طبق الثقافة (الذي يحتوي على الخلايا) ب 1 مل من 1x PBS. أضف 1 مل من 1x Trypsin واحتضنها لمدة 5 دقائق عند 37 درجة مئوية لفصل الخلايا. باستخدام ماصة ، انقل الخلايا المنفصلة من الطبق إلى أنبوب طرد مركزي سعة 1.5 مل.
- خذ 10 ميكرولتر من التربان الأزرق واخلطها مع 10 ميكرولتر من تعليق الخلايا في أنبوب طرد مركزي منفصل. عد الخلايا باستخدام 10 ميكرولتر من خليط الخلايا في عداد خلية أوتوماتيكي ، وفقا لتعليمات الشركة المصنعة (انظر جدول المواد).
- طبق 8 × 105 خلايا بين عشية وضحاها في طبق بتري TC60. طبق طبق واحد لكل حالة.
ملاحظة: بالنسبة لهذه الدراسة، كانت الخلايا إما غير معالجة أو عولجت بالبيرفاناديت وEGF كما هو موضح في الخطوة 2.4.1.
- قم بإعداد الحلول التالية لإعداد الخلية المحللة.
- تحضير الثلج البارد 1x PBS (الرقم الهيدروجيني 7.4).
- قم بإعداد مخزن مؤقت للتحلل ، وهو محلول مكون من منظف غير أيوني وغير متحلل بنسبة 1٪ (انظر جدول المواد) في 50 mM Tris-HCl (الرقم الهيدروجيني 7.2) و 150 mM NaCl مع مثبط البروتياز / الفوسفاتيز (PPI) (1:100 من المخزون). ضع الأنبوب على المغذيات واترك المخزن المؤقت يختلط لمدة 15 دقيقة. احتفظ بالمحلول المعد على الجليد.
- قم بإعداد المخزن المؤقت ل Tyrode للحصول على تركيز نهائي يبلغ 135 mM NaCl و 10 mM KCl و 0.4 mM MgCl 2 و 1 mM CaCl 2 و 10 mM HEPES (الرقم الهيدروجيني7.2) و 20 mM glucose و 0.1٪ Bovine Serum Albumin (BSA) (انظر جدول المواد). تسخين الحل إلى 37 درجة مئوية.
- إعداد السيطرة الإيجابية للفسفرة - 1 مللي متر علاج pervanadate.
ملاحظة: هذه الخطوة اختيارية. Pervandate هو شكل بيروكسيد من vanadate - مثبط بروتين التيروزين فوسفاتيز16. يؤدي منع إزالة الفسفرة من البروتين عن طريق تثبيط نشاط الفوسفاتيز إلى عينة عالية الفسفرة.- قم بإعداد مخزون 200 mM من أورثوفانادات الصوديوم المنشط (Na3VO4).
- لتحضير محلول 100 مل ، أضف 3.89 جم من Na3VO4 (انظر جدول المواد) إلى 90 مل من ddH2O وتذوب أثناء التحريك. اضبط الرقم الهيدروجيني إلى 10 عن طريق إضافة HCl أو NaOH قطرة. إضافة HCl سيحول المحلول إلى اللون الأصفر.
- ارفع الحجم إلى 100 مل مع ddH2O. قم بغلي المحلول عن طريق تسخينه في الميكروويف. بعد الغليان ، سيكون المحلول عديم اللون.
- قم بتبريد الحل إلى RT وأعد ضبط الرقم الهيدروجيني إلى 10. كرر الغليان والتبريد وضبط الرقم الهيدروجيني مرتين إلى أربع مرات أخرى ، حتى يستقر الرقم الهيدروجيني عند 10. Aliquot وتخزينها في -20 درجة مئوية.
- قم بإعداد مخزون من 30 mM pervanadate (PV) عن طريق خلط 20.4 ميكرولتر من 3٪ H 2 O 2 مع 100 ميكرولتر من 200 mM Na 3 VO 4 و 546.8 ميكرولتر من ddH 2 O (تركيزات متساوية المولات من H 2 O 2 وتنشيط Na3VO4). احتضن في الظلام في RT لمدة 15 دقيقة.
- قم بإعداد 1 mM PV في المخزن المؤقت ل Tyrode. بالنسبة لمحلول 10 مل ، أضف 0.33 مل من مخزون 30 mM PV إلى 9.67 مل من المخزن المؤقت ل Tyrode 37 درجة مئوية. علاج الخلايا على الفور.
- اغسل الخلايا مرة واحدة باستخدام 3 مل من المخزن المؤقت ل Tyrode. أضف 3 مل من 1 mM PV في المخزن المؤقت ل Tyrode إلى الخلايا واحتضنها لمدة 15 دقيقة عند 37 درجة مئوية.
- قم بإعداد مخزون 200 mM من أورثوفانادات الصوديوم المنشط (Na3VO4).
- إجراء تحفيز الرباط.
- تحفيز الخلايا مع الرباط من الاهتمام باستخدام التركيز المناسب، والوقت، ودرجة الحرارة. للحصول على أقصى قدر من تحفيز EGFR ، احتضن مع 1 مل من عامل نمو البشرة 50 نانومتر (EGF ، انظر جدول المواد) + 1 mM من PV في مخزن Tyrode المؤقت لمدة 5 دقائق عند 37 درجة مئوية.
- إجراء تحلل الخلايا.
- بعد العلاج الخلوي المطلوب ، ضع الطبق على الثلج واغسله بالثلج البارد 1x PBS. قم بإزالة الحجم الكامل ل PBS بالكامل باستخدام ماصة.
- أضف 180 ميكرولتر من المخزن المؤقت للتحلل (الخطوة 2.2.2) إلى اللوحة. استخدم مكشطة الخلايا لسحب المخزن المؤقت حول اللوحة لتغطية الخلايا بالكامل. ضع ضغطا ثابتا وثابتا مع مكشطة الخلايا عبر السطح المستزرع بأكمله لتحليل الخلايا بالكامل.
ملاحظة: يجب الحفاظ على حجم المخزن المؤقت للتحلل عند الحد الأدنى لضمان تركيز عال من البروتين. - ماصة الخلايا المحللة ونقلها إلى أنبوب 1.5 مل. احتفظ بالأنبوب على الجليد لمدة 30 دقيقة. دوامة الليزات كل 5 دقائق.
ملاحظة: إذا كان POI يتكون من وحدات فرعية متعددة أو كان حساسا للانفصال، فلا تقم بتدوير الليزات. - قم بالطرد المركزي للخلايا المحللة عند 16000 × g لمدة 20 دقيقة عند 4 درجات مئوية. انقل السوبرناتانت إلى أنبوب جديد سعة 1.5 مل باستخدام ماصة. هذا يحتوي على البروتين الكلي lysate.
- احتفظ ب 10 ميكرولتر من الليزات وقم بتخفيفه إلى 90 ميكرولتر من المخزن المؤقت للتحلل لتحليل المقايسة اللونية ثنائية التشينكونين (BCA)17. تخزين البروتين الكلي المتبقي تحلل في -80 درجة مئوية.
- تحديد تركيز البروتين الكلي للليزات باستخدام تحليل BCA (انظر جدول المواد).
ملاحظة: يمكن تحضير إجمالي محللات البروتين في يوم التجربة واستخدامها طازجة أو تخزينها كأليكوتات تستخدم لمرة واحدة عند -80 درجة مئوية لمدة تصل إلى 12 أسبوعا. لا تجمد / تذوب.
3. تفعيل المصفوفة مع الجسم المضاد البيوتينيل
- قم بإعداد الحلول التالية.
- T50 المخزن المؤقت ، وهو محلول من 10 mM Tris-HCl (الرقم الهيدروجيني 8.0) و 50 mM NaCl. الحل مستقر لمدة 1 شهر في RT.
- T50-BSA عن طريق استكمال المخزن المؤقت T50 مع 0.1 ملغ / مل من BSA. احتفظ بالمحلول المعد على الجليد.
- 10 ملغ / مل من بوروهيدريد الصوديوم (NaBH4) في 1x PBS. تحضير هذا مباشرة قبل الاستخدام.
- 0.2 ملغم/مل من نيوترافيدين (انظر جدول المواد) في المخزن المؤقت T50.
تنبيه: NaBH4 هو عامل اختزال وقابل للاشتعال. قم دائما بتطهير الحاوية بغاز النيتروجين بعد الاستخدام وتخزينها في مجفف.
- قم بتفعيل المصفوفة باستخدام الجسم المضاد البيوتينيل.
- قم بإزالة صفائف PEG-biotin الوظيفية من الفريزر وقم بموازنة الأنبوب المخروطي مع RT قبل الفتح. ضع الغطاء مع توجيه الصفيف لأعلى على طبق من زراعة الأنسجة (TC100) مبطن بطبقة مانعة للتسرب (TC100).
ملاحظة: تقليل الإضاءة العلوية. يجب أن "تبرز" جميع الحلول على المربعات التي تحددها الصفيف الكارهة للماء. أضف حجما مناسبا من المحلول لتغطية كل مربع بالكامل (عادة 10-15 ميكرولتر) ولا تسمح للسائل بتجاوز المساحة المحددة. لإزالة السوائل بسرعة، استخدم خط فراغ داخلي متصل بقارورة فراغ لالتقاط النفايات. اسمح ل NaBH4 بتفريغ الغاز لمدة 1 ساعة قبل التخلص منه عن طريق ترك الأنبوب مفتوحا في غطاء الدخان الكيميائي. يعد علاج NaBH4 ضروريا لتقليل التألق الذاتي في الخلفية ، وبالتالي تقليل اكتشافات الجزيء الواحد الإيجابية الكاذبة. - عالج كل مربع من الصفيف ب 10 ملغم / مل من NaBH 4 في 1x PBS لمدة4 دقائق في RT. اغسل ثلاث مرات باستخدام PBS.
- احتضن كل مربع لمدة 5 دقائق مع 0.2 ملغ / مل من نيوترافيدين في T50. يغسل ثلاث مرات مع T50-BSA.
ملاحظة: يرتبط NeutrAvidin ب PEG-biotin ويوفر موقعا ملزما للأجسام المضادة البيوتينيل12،13،15. - احتضان كل مربع لمدة 10 دقائق مع 2 ميكروغرام / مل من الأجسام المضادة الخاصة ب POI البيوتينيل في T50-BSA ؛ يغسل ثلاث مرات مع T50-BSA.
ملاحظة: يستخدم البروتوكول الحالي البيوتينيل المضاد ل EGFR IgG (انظر جدول المواد) لالتقاط EGFR-GFP.
- قم بإزالة صفائف PEG-biotin الوظيفية من الفريزر وقم بموازنة الأنبوب المخروطي مع RT قبل الفتح. ضع الغطاء مع توجيه الصفيف لأعلى على طبق من زراعة الأنسجة (TC100) مبطن بطبقة مانعة للتسرب (TC100).
4. SiMPull من POI من محللات الخلية بأكملها
ملاحظة: ضع طبق TC100 من صفائف SiMPull الوظيفية على الجليد لبقية إعداد Simpoll. هذه الخطوة هي سحب POI من إجمالي تحلل البروتين. يجب عدم إعادة استخدام الليزات بعد الذوبان.
- قم بإعداد الحلول التالية.
- تحضير 4٪ بارافورمالديهايد (PFA) / 0.1٪ غلوتارالدهيد (GA) في 1x PBS.
تحذير: PFA و GA هي مثبتات كيميائية سامة ومواد مسرطنة محتملة. ارتداء معدات الوقاية الشخصية. التخلص من المواد الكيميائية كنفايات خطرة وفقا للوائح والمبادئ التوجيهية المحلية. - تحضير 10 mM Tris-HCl ، درجة الحموضة 7.4.
- تحضير 4٪ بارافورمالديهايد (PFA) / 0.1٪ غلوتارالدهيد (GA) في 1x PBS.
- قم بإذابة وخلط الليزات عن طريق السحب بلطف لأعلى ولأسفل. حافظ على الجليد.
- تمييع 1 ميكرولتر من الليزات إلى 100 ميكرولتر بارد مثلج T50-BSA / PPI.
ملاحظة: إذا لزم الأمر، حدد عامل التخفيف المناسب لإجمالي تحلل البروتين عن طريق تطبيق مجموعة من التخفيفات على الصفيف. الكثافة المثلى لمستقبلات SiMPull لكل منطقة صفيف هي 0.04-0.08 / ميكرومتر2. يمكن تقييم تخفيفات Lysate في الخطوة 6 (تحليل البيانات). - احتضان الليزات على الصفيف لمدة 10 دقائق ؛ ثم يغسل أربع مرات مع T50-BSA / PPI الباردة المثلجة.
- قم بتخفيف الأجسام المضادة المضادة للفوسفوتيروزين المترافقة AF647 (انظر جدول المواد) في T50-BSA/PPI الباردة على الجليد واحتضنها على الصفيف لمدة 1 ساعة.
ملاحظة: في هذا البروتوكول ، يتم استخدام عموم مضاد ل pTyr (PY99)-AF647 IgG لتحديد السكان المفسفرين من EGFR-GFP. إن استخدام الأجسام المضادة ذات العلامات المباشرة يزيل الحاجة إلى الأجسام المضادة الثانوية ، مما يزيد من خيارات وضع العلامات ويحسن اتساق النتائج. يمكن الحصول على الأجسام المضادة ذات العلامات الفلورية من مصادر تجارية. إذا لم تكن متاحة تجاريا ، يمكن تصنيف الأجسام المضادة حسب الطلب باستخدام تقنيات الاقتران البيولوجي القياسية ، وتتوفر مجموعات الاقتران الحيوي التجارية. يجب اختبار كل دفعة من الأجسام المضادة الموسومة بالفلورسنت لظروف وضع العلامات المثلى من خلال إجراء SiMPull لقياس منحنى الجرعة وإيجاد نقطة التشبع. - يغسل ست مرات باستخدام T50-BSA المثلج لمدة 6-8 دقائق.
- يغسل مرتين مع الثلج البارد 1x PBS.
- احتضن المصفوفة بمحلول PFA 4٪ / 0.1٪ GA لمدة 10 دقائق لمنع تفكك الأجسام المضادة.
- يغسل مرتين لمدة 5 دقائق لكل منهما باستخدام 10 ملليمتر Tris-HCl ، درجة الحموضة 7.4 / PBS لتعطيل المثبتات.
ملاحظة: بالنسبة للتجارب التي تستخدم أكثر من جسم مضاد واحد، (على سبيل المثال، الكشف عن مواقع فوسفوتيروزين متعددة)، كرر الخطوات 4.5-4.9. انظر الخطوة 6.2.9 للحصول على معلومات حول تحديد العائق الستيري بين اثنين من الأجسام المضادة.
5. الحصول على الصور
ملاحظة: يتم الحصول على صورة أحادية الجزيء باستخدام هدف TIRF 150x وفاصل صور يلتقط كل قناة طيفية في ربع معين من كاميرا emCCD (انظر جدول المواد). يتم الحصول على صور المعايرة لأول مرة للسماح بتسجيل القناة ومعايرة اكتساب الكاميرا باستخدام شبكة محاذاة قناة نانوية (nanogrid) تحتوي على 20 × 20 صفائف من 200 ± 50 نانومتر ثقوب على مسافة داخل الثقب تبلغ 3 ± 1 ميكرومتر (الحجم الإجمالي ~ 60 ميكرومتر × 60 ميكرومتر).
- قم بإجراء تسجيل القناة باتباع الخطوات أدناه.
ملاحظة: هناك حاجة إلى تسجيل دقيق للقناة لحساب التوطين المشترك للبواعث بشكل صحيح. هذه الخطوة حاسمة.- تنظيف هدف النفط وإيداع قطرة من النفط على الهدف. ضع الشبكة النانوية على المسرح للتصوير. باستخدام الضوء الأبيض المرسل ، ركز على نمط الشبكة.
ملاحظة: يتم الحصول على الصور ذات الشبكة النانوية باستخدام الضوء المرسل ، الذي يمر عبر الشبكة النانوية ويتم اكتشافه في جميع القنوات الطيفية. بدلا من ذلك ، يمكن للمرء استخدام الخرز متعدد الفلورسنت الذي ينبعث منه التألق المكتشف في كل قناة. ستحتاج عملية الحصول على الصور إلى التحسين وفقا لكل إعداد مجهري. - احصل على سلسلة من 20 صورة للشبكة. تأكد من أن وحدات البكسل غير مشبعة. احفظ سلسلة الصور ك "Fiducial".
- قم بإلغاء تركيز الشبكة النانوية لإنشاء نمط متجدد الهواء18. احصل على سلسلة من 20 صورة لإجراء معايرات الكسب. احفظ الصورة باسم "كسب".
- احصل على سلسلة من 20 صورة لتعويض الكاميرا عن طريق منع كل الضوء من الذهاب إلى الكاميرا. احفظ الصورة ك "خلفية".
- تنظيف هدف النفط وإيداع قطرة من النفط على الهدف. ضع الشبكة النانوية على المسرح للتصوير. باستخدام الضوء الأبيض المرسل ، ركز على نمط الشبكة.
- الحصول على صور Simpoll.
ملاحظة: قبل تصوير صفيف الانزلاق الغطائي، استبدل حل Tris ب T50-BSA وقم بموازنة الصفيف إلى RT.- تنظيف هدف النفط وإيداع زيت إضافي على الهدف. قم بتأمين صفيف الغطاء على مرحلة المجهر.
- قم بتحسين قوة الإثارة لكل فلوروفور وزاوية TIRF ووقت تكامل الكاميرا. الهدف هو تحقيق أعلى إشارة إلى ضوضاء مع تقليل التبييض الضوئي للعينة. سجل طاقة الليزر للتأكد من اتساقها في القياسات المستقبلية.
ملاحظة: استخدمت الدراسة الحالية وقت التعرض 300 مللي ثانية للقناة الحمراء البعيدة و 1 ثانية للقناة الخضراء. تم استخدام ليزر 642 نانومتر في حوالي 500 ميكروواط من طاقة الليزر ، في حين تم استخدام ليزر 488 نانومتر عند 860 ميكروواط ، تم قياسه قبل عدسة الأنبوب. - احصل على صور لكل عينة. قم بتصوير القناة الحمراء البعيدة أولا ، متبوعة بكل فلوروفور منخفض الطول الموجي لتقليل التبييض الضوئي. نظرا لانخفاض الحجم المستخدم لكل عينة، تحقق من مستوى المخزن المؤقت كل 30-45 دقيقة وقم بتجديده حسب الحاجة.
6. تحليل البيانات
- قم بتنزيل الرموز التجريبية.
ملاحظة: توضح التعليمات البرمجية التجريبية المقدمة ومجموعات البيانات النموذجية سير عمل تحليل البيانات الكامل (ملفات الترميز التكميلية 1-4). تم العثور على متطلبات النظام المدرجة في SiMPullMain.m في ملف الترميز التكميلي 1.-
قم بفك ضغط وحفظ في دليل المستندات الشخصية / MATLAB (MacOS / Linux) أو المستندات \ MATLAB (Windows).
ملاحظة: يؤدي هذا إلى إنشاء أربعة مجلدات جديدة: SiMPull_class و smite و "بيانات العينة" و "مخرجات تحليل العينة". - افتح الملف "ReadMe_Setup.txt" الموجود في المجلد SiMPull_class.
- قم بتثبيت مربعات أدوات MATLAB و MATLAB: صندوق أدوات تركيب المنحنى ، وصندوق أدوات الحوسبة المتوازية ، وصندوق أدوات الإحصاء والتعلم الآلي.
- قم بتثبيت DipImage19 وفقا لتعليمات التنزيل.
- قم بتثبيت حزمة تحليل الجزيء الواحد "smite" كما هو موضح في ReadMe_setup.txt.
ملاحظة: يتوفر "smite" على مستودع GitHub (انظر جدول المواد). - افتح SiMPullMain.m، الموجود في المجلد SiMPull_class، عن طريق سحب الملف إلى نافذة MATLAB.
- قم بتغيير الدليل إلى ...\MATLAB\Sample Data\ بالنقر فوق أيقونة استعراض بحثا عن مجلد وتحديد المجلد.
-
قم بفك ضغط وحفظ في دليل المستندات الشخصية / MATLAB (MacOS / Linux) أو المستندات \ MATLAB (Windows).
- نظرة عامة على خطوات معالجة البيانات
- قم بتشغيل SiMPullMain.m - باتباع التعليمات لكل قسم. قم بتنفيذ كل قسم على حدة عن طريق وضع المؤشر في هذا القسم والنقر فوق أيقونة تشغيل القسم.
ملاحظة: يتم وصف الخطوات العامة لتحليل البيانات في هذا القسم. تم العثور على تعليمات مفصلة في رمز SiMPullMain.m المصاحب. - قم بتشغيل قسم "التهيئة" لتعيين المسار لتحديد القنوات الطيفية وحجم الصورة.
- قم بتشغيل قسم "البحث عن كسب الكاميرا وإزاحتها" لتحويل كسب الكاميرا إلى فوتونات باستخدام مجموعات بيانات الكسب والخلفية.
- قم بتشغيل قسم "تسجيل القناة" لحساب متوسط التحويل المرجح المحلي المستخدم لتسجيل الصور.
- تنسيق البيانات وتنظيمها. قم بتشغيل قسم "الانضمام إلى القنوات المتسلسلة في صورة رباعية". قم بتشغيل "إزالة الإطارات السيئة".
- قم بتشغيل قسم "تناسب الجزيئات المفردة وابحث عن الجزيئات المتداخلة".
ملاحظة: ينفذ هذا القسم وظائف متعددة لتوطين جزيئات مفردة في كل قناة وتحديد أحداث التوطين المشترك بين القنوات الطيفية. - لتحديد الحد الأدنى لعدد الفوتونات لكل تناسب GFP حقيقي ، قم بتشغيل "تحسين الحد الأدنى لعتبة الفوتون". هذه عملية تكرارية.
- أولا ، قم بتعيين smf. Thresholding_MinPhotons = [0، 0، 0] وقم بتشغيل القسم. حدد ملفات "بيانات فارغة" عند مطالبتك بذلك. كرر ذلك مع ملفات "CHO-EGFR-GFP".
- حدد قيمة عتبة دنيا مناسبة عن طريق مقارنة المدرجين التكراريين. تعيين smf. Thresholding_MinPhotons = [475، 0، 0] وقم بتشغيل القسم مرة أخرى.
- قم بتشغيل القسم "حساب النسبة المئوية ل GFP يناسب موجب لإشارة FR" لتصحيح تعريبات الخلفية وحساب القيم النهائية.
- نفذ الخيار 1 (الخطوة 6.2.10) أو الخيار 2 (الخطوة 6.2.11) حسب الحاجة التجريبية.
- الخيار 1: صحيح لعدد المستقبلات المتاحة في الغشاء البلازمي لربط الليغاند، كما هو موضح في المرجع15.
- أولا ، مستقبلات سطح التسمية ذات المستويات المشبعة من صبغة NHS Ester الفلورية (NHS-AF647 ، انظر جدول المواد). ثم قم بإجراء تجربة SiMPull لتحديد النسبة المئوية لتوطين GFP الذي يتزامن مع AF647.
ملاحظة: يوفر هذا تقديرا لجزء المستقبلات المتاحة لوضع العلامات على NHS ونسبة المستقبلات على السطح (SR). - قم بتطبيق تصحيح SR في الحساب النهائي: NGFP = (NLOC - NBG) * SR ، حيث NGFP هو العدد المصحح لتعريبات GFP ، و NBG هو رقم تعريب الخلفية ، و NLOC هو إجمالي الترجمات.
ملاحظة: في المثال الحالي ، لا يتم تطبيق هذا التصحيح لأن Pervanadate قابل للنفاذ إلى الغشاء16 ، وبالتالي ، فإن عمل تثبيط الفوسفاتيز لا يقتصر على المستقبلات السطحية.
- أولا ، مستقبلات سطح التسمية ذات المستويات المشبعة من صبغة NHS Ester الفلورية (NHS-AF647 ، انظر جدول المواد). ثم قم بإجراء تجربة SiMPull لتحديد النسبة المئوية لتوطين GFP الذي يتزامن مع AF647.
- الخيار 2: بالنسبة لقياسات الفسفرة متعددة المواقع، ضع في اعتبارك احتمال وجود عائق ستيري عند استخدام جسمين مضادين.
ملاحظة: قد يسبب عائق ستيريك انخفاضا في النسبة المئوية المرصودة من المستقبلات المفسفرة للأجسام المضادة 1 عندما تكون في وجود الأجسام المضادة 2 (P12) ، مقارنة بالأجسام المضادة 1 وحدها (P1).- استخدم SiMPull لتحديد P1 و P12 وحساب عامل التصحيح للعائق الستيري ، بعد المرجع15 المنشور سابقا.
- قم بتشغيل SiMPullMain.m - باتباع التعليمات لكل قسم. قم بتنفيذ كل قسم على حدة عن طريق وضع المؤشر في هذا القسم والنقر فوق أيقونة تشغيل القسم.
النتائج
يظهر الرسم الكاريكاتوري الذي يصور عملية SiMPull في الشكل 1A. يتم تشغيل Coverslips باستخدام NeutrAvidin كمرساة للأجسام المضادة المضادة ل EGFR البيوتينيل لالتقاط EGFR-GFP من إجمالي تحلل البروتين. بعد غسل البروتين غير المرتبط ، يتم وضع علامة على المستقبلات المفسفرة بجسم مضاد مضاد للفوسفوتيروزين (anti-PY)15. ويبين الشكل 1 باء صورة للمصفوفة الكارهة للماء، حيث يمكن إعداد عينات متعددة وتصويرها على نفس الغطاء. إحدى مزايا حامل العينة هذا هي أن الحد الأدنى من أحجام العينات ~ 10 ميكرولتر مطلوبة. يمكن تصوير الغطاء عن طريق وضعه مباشرة على مرحلة المجهر. ومع ذلك ، من المفيد تثبيت الغطاء باستخدام حامل غطاء الغطاء. تم إنشاء حامل الغطاء الموضح في الشكل 1B باستخدام طابعة ثلاثية الأبعاد ، ويتم توفير المخطط في ملف الترميز التكميلي 5. يعد التألق الذاتي للحبر الكارهة للماء دليلا مفيدا للعثور على المستوى البؤري للعينة (الشكل 1C). يظهر مثال على صورة خام متعددة القنوات في الشكل 1D. يظهر في الشكل 1E تراكب للقنوات الخضراء الخام والحمراء البعيدة.
يوضح الشكل 2 سير عمل التحليل ويوفر بيانات تمثيلية. يبدأ الحصول على البيانات أولا بالحصول على ائتمانات لتسجيل القنوات ، والتي تستخدم لتراكب بيانات القنوات الطيفية الفردية (الشكل 2A). يتم التقاط صور المجال الساطع باستخدام نمط شبكة نانوية يمر بالضوء الأبيض ويتم اكتشافه في كل قناة طيفية لفاصل الصور (غير معروض). تعمل القناة الخضراء كقناة مرجعية ، والقناة الحمراء البعيدة هي القناة المتحولة. يتم حساب متوسط التحويل المرجح المحلي باستخدام دالة fitgeotrans20 في MATLAB ويستخدم لتحويل الإحداثيات الحمراء البعيدة إلى الإطار الإحداثي للقناة الخضراء. يستخدم هذا التحويل نموذجا متعدد الحدود من الدرجة الثانية في كل نقطة تحكم. ثم يتم الحصول على بيانات متعددة القنوات من صفيف SiMpull. ويتألف سير العمل هذا من اكتساب شبه آلي، حيث تم اختيار عائد استثمار مبدئي لمربع العينة المحدد، وتم تصوير ثلاث مناطق حول هذه المنطقة، بحيث تحتوي كل مجموعة بيانات على صورة عرض رباعية كاملة من ثلاثة عائد استثمار مستقل (الشكل 1D). في كل قناة طيفية ، يتم العثور على المواقع المرشحة للباعث عن طريق تطبيق اختلاف مرشح Gaussian على الصور وتحديد الحد الأقصى المحلي. يتم رسم المناطق دون الإقليمية (المربعات ، الشكل 2 ب) حول الحد الأقصى المحلي ، ويتم تقدير عدد الفوتونات الباعثة بافتراض أن كل منطقة دون إقليمية تحتوي على باعث واحد فقط. يتم الاحتفاظ بالمناطق الفرعية التي تحتوي على مرشحات باعثة مع عدد فوتون أعلى من الحد الأدنى للقيمة للتركيب. تناسب دالة انتشار النقطة الغاوسية (PSF) كل مرشح باعث داخل مناطق فرعية صغيرة تتمحور تقريبا حول كل باعث. يتم تحديد التعريبات الناتجة بناء على عدد الفوتونات والخلفية والحد الأدنى من Cramér-Rao لإحداثيات الملاءمة وتباين PSF (أي عرض PSF) وقيمة p التي تصف مدى ملاءمة نموذج PSF. يتم إنشاء صورة غاوسية لكل قناة طيفية ، مع وضع نقاط غاوسية موحدة الكثافة عند الإحداثيات لكل تناسب جيد (الشكل 2C). يتم تصور التوطين المشترك عن طريق تراكب الصور الغاوسية من كل قناة طيفية باستخدام التحويل المحسوب من العينة الائتمانية (الشكل 2D). من المهم تسمية المستقبل بالفلورسنت لتحديد هويته لأنه لا يزال هناك ارتباط غير محدد للأجسام المضادة للفوسفوتيروزين بالسطح عند وجود تحلل الخلية. يتم استخدام EGFR-GFP (القناة الخضراء) لإنشاء قناع لمواقع المستقبلات ، ويتم حساب إشارة AF647-anti-PY (قناة حمراء بعيدة) داخل هذا القناع فقط (الشكل 2D). تعتبر الأزواج داخل 1 بكسل (حجم بكسل 106.7 نانومتر) مترجمة ومحفوظة في قائمة تحتوي على إحداثيات القناة المرجعية. يتم حساب النسبة المئوية ل AF647 المترجمة مع GFP لتحديد جزء المستقبلات المفسفرة (الشكل 2E).
هناك العديد من الخطوات الحاسمة لضمان جودة البيانات الجيدة. أحد هذه الجهود هو احتضان مصفوفة الغطاء مع NaBH4 كما هو موضح في بروتوكول إخماد التألق الذاتي في القناة الخضراء. يشير هذا التألق الذاتي إلى الإشارة غير المحددة بسبب الشوائب المحتملة على الزجاج ، والتي تحتوي على روابط π مفردة أو مترافقة21. ومن المحتمل أن تكون هذه الشوائب ناتجة عن كواشف الأمينوسيلان و PEG المستخدمة في عملية التشغيل أو الغبار من الهواء ، وتميل إلى التألق في القناة الطيفية الخضراء. على الرغم من الجهود المبذولة للحفاظ على تخزين الزجاج تحت النيتروجين ، يمكن أيضا توليد هذه الجزيئات من خلال الأكسدة التي تحدث في التخزين. كما تم استخدام NaBH4 لتقليل التألق من الشوائب على الشرائح والمصفوفات الدقيقة ، بما في ذلك تلك التي تحتوي على طلاء سيلاني16. ويبين الشكل 3 ألف الانخفاض في عدد عمليات الكشف عن الخلفية التي تحدث عندما يعالج الزجاج المحفور في أسماك البيرانا ب NaBH4. في حين أن NaBH4 يقلل من التألق في الخلفية بشكل كبير ، لا يزال يتم اكتشاف بعض الانبعاثات في القناة الخضراء. يمكن للمرء تصحيح ذلك عن طريق الحصول على صور خلفية من عينات خالية من الليزات (الشكل 3D) وطرح متوسط عدد تعريبات الخلفية من العينات المحتوية على GFP. لم يتم الكشف عن التألق من الشوائب في القناة الحمراء البعيدة. إذا كانت كثافة المستقبلات مرتفعة جدا ، فيمكن العثور على العديد من بواعث GFP داخل بقعة واحدة محدودة الحيود (البيانات غير معروضة). باستخدام التبييض الضوئي التدريجي لتحديد عدد GFPs لكل بقعة ، وجدنا أن كثافة المستقبلات بين 0.04-0.08 بروتينات / ميكرومتر2 وفرت تباعدا كافيا بين بواعث واحدة لإزالة إمكانية العثور على بواعث متعددة لكل بقعة12. يمكن تحسين كثافة المستقبلات عن طريق تغيير كمية الجسم المضاد IP المرتبط بسطح الزجاج أو كمية الليزات المضافة. من الأهمية بمكان التأكد من استخدام الجسم المضاد الذي يستهدف POI عند مستويات التشبع. يوصى بالحصول على منحنى تركيز الأجسام المضادة على العينات المفسفرة لتحديد ظروف وضع العلامات المناسبة (الشكل 3B). بالإضافة إلى ذلك ، يجب التحقق من خصوصية الفوسفو للجسم المضاد من خلال عينات الراحة و / أو العلاج بمثبطات كيناز الخاصة بالبروتين (الشكل 3B). سوف تنفصل الأجسام المضادة عن المستقبل خلال النافذة الزمنية للتصوير. معالجة العينة بمزيج من PFA و GA منع فقدان الإشارة (الشكل 3C).
أخيرا ، من المهم تحسين معلمات تركيب الجزيء الواحد. يجب أن تكون خطوة "العثور على الصندوق" الأولى التي تحدد المرشحين المحتملين للباعث (الشكل 2B) سخية للسماح للعديد من المرشحين بالخضوع ل Gaussian Fitting. وبالتالي ، يمكن أن يكون الحد الأدنى لعتبة الفوتون للعثور على الصندوق منخفضا نسبيا لالتقاط جميع الانبعاثات الحقيقية وبعض بقع الخلفية. من المهم أيضا عدم تعيين حجم الصندوق وبدل التداخل الصغير جدا. يعد الحفاظ على حجم الصندوق في حدود 5-7 بكسل والسماح بتداخل البكسل مرتين مثاليا للباعثين بالكثافة الموصى بها. بعد العثور على المربع ، يجب تحسين الحد الأدنى لعتبة الفوتونات في خطوة التركيب. تساهم معلمة الفوتونات الدنيا في تحديد أي بواعث Gaussian المجهزة تمر كملاءمة حقيقية. لتحديد الحد الأدنى المناسب لعتبة الفوتون لتناسب GFP الحقيقي ، يتضمن الرمز وظيفة رسم مدرج تكراري لفحص الفوتونات / التوطين في كل من الخلفية (بدون خلية محللة) وعينات GFP المحتوية على GFP (بالإضافة إلى تحلل الخلايا) (الشكل 3D). هذه الخطوة مهمة لأنه في حين أن NaBH4 يقلل من كمية التألق من الشوائب ، فإنه لا يزيل جميع تعريبات الخلفية. يوضح الشكل 3D الحاجة إلى تعيين عتبة فوتون دنيا لتقليل عدد الاكتشافات من الشوائب. لتحديد هذه العتبة، يتم حساب رسم بياني لكثافة باعث الخلفية من تصوير عينة غير معرضة للتحلل الخلوي (الشكل 3D، أعلى اليسار). وجد أن غالبية بواعث الخلفية لها قيم أقل من 475 فوتونا. وبالمقارنة، أظهرت العينة التي تحتوي على بواعث GFP حقيقية جزءا كبيرا من التوزيع فوق 475 (الشكل 3D، أعلى اليمين). يتم اختيار العتبة عن طريق الفحص لإزالة أكبر عدد ممكن من أعداد الخلفية مع تقليل مقدار فقدان الإشارة من عينة lysate (الشكل 3D ، الصف السفلي). يتم حساب كثافة عدد الخلفية المتبقية عند هذه العتبة في التحليل الكمي.
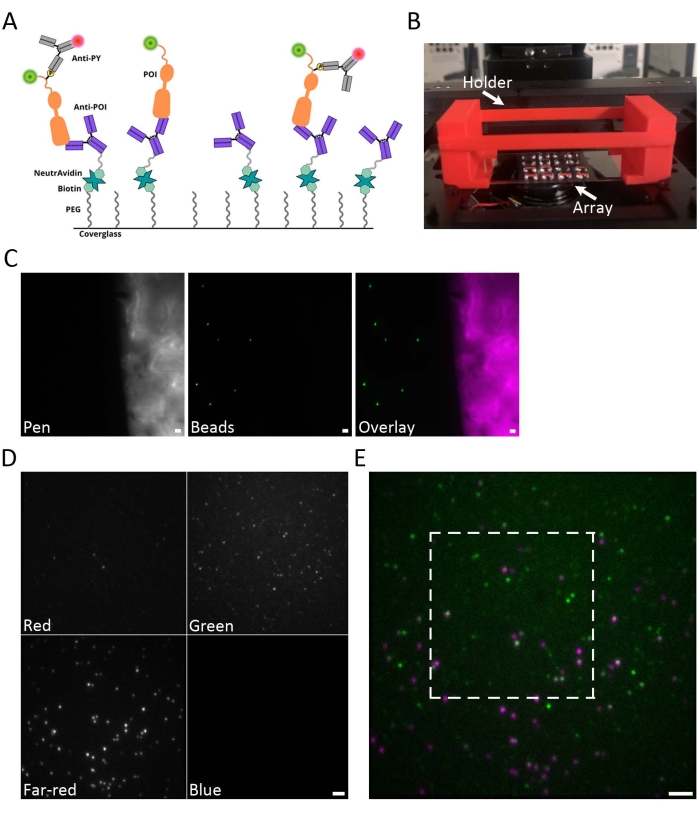
الشكل 1: نظرة عامة على إعداد العينة. (أ) رسم كاريكاتوري يصور نهج Simpoll. يتم تشغيل Coverslips مع جسم مضاد يتعرف على POI لالتقاط نقاط الاهتمام هذه من lysates خلية كاملة. يتم طلاء الزجاج أولا ب PEG و BITIN-PEG. ثم يرتبط نيوترافيدين بالبيوتين-PEG ويعمل كمرساة للجسم المضاد المضاد ل POI البيوتينيل. ثم يتم الكشف عن البروتينات المفسفرة باستخدام جسم مضاد مضاد ل PY يحمل علامة فلورسنتية. (ب) صورة فوتوغرافية لحامل الغطاء (أحمر) مع صفيف غطاء في مكانه ومثبت على مرحلة المجهر. يتم إنشاء المصفوفات متعددة العينات باستخدام الحبر الكارهة للماء لإنشاء ما يصل إلى 20 مربعا فرديا للعينات على غطاء زجاجي واحد. الغطاء هو 60 مم × 24 مم. (C) مثال على صور التألق الذاتي للحبر الكارهة للماء (أرجواني) والخرز الفلوري (الأخضر). يعد التألق الذاتي للحبر الكارهة للماء دليلا مفيدا للعثور على المستوى البؤري على سطح الغطاء. (د) مثال على صورة بيانات خام ذات قنوات طيفية مفصولة على شريحة الكاميرا بواسطة مقسم الصور رباعي العرض. تتضمن مجموعة مرشحات الرؤية الرباعية مرشحات الانبعاثات التالية: الأزرق (445/45 نانومتر)، والأخضر (525/45 نانومتر)، والأحمر (600/37 نانومتر)، والأحمر البعيد (685/40 نانومتر). (ه) تراكب خام للقنوات الخضراء والحمراء البعيدة. يشير المربع الأبيض إلى المنطقة التي تم فحصها بشكل أكبر في الشكل 2B-D. شريط المقياس (C-E) = 2 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
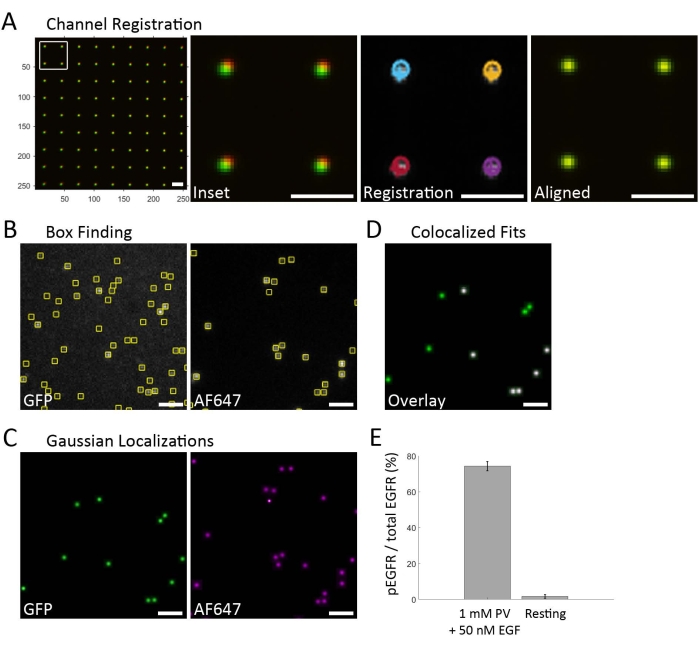
الشكل 2: سير عمل تحليل البيانات . (أ) يتم تسجيل القناة أولا على الصور التي تم الحصول عليها من الشبكة النانوية. بعد اقتصاص القناتين الطيفيتين المهمتين (هنا ، الأخضر والأحمر البعيد) ، يتم تراكب الصور الائتمانية لكل قناة (يسار). يظهر تكبير المربع في الصورة اليسرى (Inset) أن الصور لم يتم تسجيلها بشكل حقيقي بعد. تتناسب الانبعاثات في كل قناة مع نموذج غاوسي ويتم توطينها (التسجيل). يظهر توطين الباعثين كدوائر للقناة الحمراء البعيدة والصلبان للقناة الخضراء. الخطوة الأخيرة هي تطبيق تحويل متوسط مرجح محلي لتحويل إحداثيات تعريب القناة الحمراء البعيدة إلى الإطار المرجعي للقناة الخضراء (محاذاة). ثم يتم استخدام تحويل المتوسط المرجح المحلي المحسوب لتسجيل بيانات SiMPull اللاحقة. (ب) صور تمثيلية للقناة الخضراء/EGFR-GFP والقناة الحمراء البعيدة/AF647-anti-PY. يتم تحديد بواعث واحدة فوق عدد الفوتونات الخلفية ووضع علامة عليها بمربعات. (ج) يكون ملف تعريف الانبعاثات داخل كل صندوق مختار مناسبا لنموذج غاوسي، ويتم الاحتفاظ ببواعث الانبعاثات التي تناسب نموذج PSF واحد من الفلوروفور. (د) يتم إنشاء قناع من بواعث GFP لتحديد موقع EGFR-GFP (أخضر). يحدد التوطين المشترك ل EGFR-GFP و AF647-anti-PY المستقبلات المفسفرة (الأبيض). (ه) يتم حساب جزء المستقبلات المفسفرة من تناسب EGFR-GFP و AF647-anti-PY الموضعيين. يقارن الرسم البياني الشريطي معالجة PV + EGF بالخلايا المستقرة ، بمتوسط قياسات متعددة. تمثل أشرطة الخطأ خطأ قياسيا محسوبا بافتراض توزيع ذي حدين. شريط المقياس = 2 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: خطوات حاسمة لضمان جودة البيانات. (أ) من اليسار إلى اليمين ، تكون اللوحات الثلاث الأولى عبارة عن صور تمثيلية للتألق الذاتي على الزجاج في ظل الظروف المعنية: بعد حفر أسماك البيرانا ، باستخدام PEG ، ومعالجة PEG plus NaBH4 (يشار إليها ب +). بالإضافة إلى ذلك ، يتم الاحتفاظ بوظائف السطح بعد معالجة NaBH4 كما هو موضح في الحد الأدنى من ربط PY99-AF647 غير المحدد مع الاحتفاظ بربط قوي ل EGFR-GFP من المحللات. (ب) يجب الحصول على منحنى تشبع لكل دفعة من الأجسام المضادة المستخدمة لضمان وضع العلامات المثلى على الأجسام المضادة. يوضح هذا الشكل منحنى التركيز لوضع العلامات على EGFR باستخدام الجسم المضاد للفوسفوتيروزين الخاص بالموقع ، anti-EGFR-pY1173. يتم الكشف عن الحد الأدنى من الفسفرة في الخلايا غير المعالجة (الراحة ، الماس الرمادي). كعنصر تحكم في الارتباط غير المحدد ، عولجت الخلايا أيضا بمثبط كيناز EGFR ، Lapatinib ، قبل إضافة 100 نانومتر من EGF (مثلث أرجواني) ، مما يدل على الوقاية المتوقعة من فسفرة EGFR. تمثل أشرطة الخطأ خطأ قياسيا بافتراض توزيع ذي حدين. (ج) تثبيت العينة بمزيج من PFA و GA يمنع تفكك الأجسام المضادة بمرور الوقت. تمثل أشرطة الخطأ خطأ قياسيا بافتراض توزيع ذي حدين. (د) تستبعد الإيجابيات الكاذبة باختيار العتبة المناسبة للتركيب الغاوسي. تسمح مقارنة الرسم البياني لشدة الملاءمة عند عتبة منخفضة (العتبة = 0 ؛ أعلى) بين الخلفية (بدون lysate) والبيانات الحقيقية (بالإضافة إلى تحلل الخلية) باختيار القيمة المناسبة (العتبة = 475 ؛ أسفل) لإزالة النوبات من بقع autofluorescent في القناة الخضراء. يشير الخط الأرجواني الرأسي إلى عتبة فوتون 475. يتم حساب الرسوم البيانية من نفس عدد عائد الاستثمار لكل نوع عينة (n = 3). شريط المقياس = 2 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملف الترميز التكميلي 1: ملف مضغوط يحتوي على برامج نصية وأدوات مساعدة لتشغيل تحليل SiMpull. يرجى النقر هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 2: ملف مضغوط يحتوي على حزمة تحليل الجزيء الواحد smite. يرجى النقر هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 3: ملف مضغوط يحتوي على عينة البيانات. يرجى النقر هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 4: ملف مضغوط يحتوي على مخرجات تحليل بيانات عينة تمثيلية. يرجى النقر هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 5: مخطط حامل الغطاء للطباعة ثلاثية الأبعاد. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
تم تحسين البروتوكول الموصوف هنا لتمكين القياسات الكمية لفسفرة المستقبلات على مستوى البروتين الواحد. تم تطوير العديد من التعديلات المباشرة ولكنها مهمة على بروتوكول SiMPull التي حسنت موثوقية القياس للكشف عن الفوسفو التيروزين ، بما في ذلك الحد من التألق الذاتي مع علاج NaBH4 وما بعد تثبيت العينة لمنع تفكك الأجسام المضادة. إن استخدام قناع القناة الخضراء لتحديد مواقع المستقبلات لحساب التوطين المشترك مع الجسم المضاد ل PY يحسن أيضا دقة القياس عن طريق إزالة القطع الأثرية المحتملة من الارتباط غير المحدد للجسم المضاد بتحلل الخلية. تم استخدام التصوير بلونين للكشف عن جزء من المستقبلات المفسفرة. في هذا السيناريو ، تم وضع علامة وراثية على المستقبل باستخدام GFP ، وتم تصنيف الجسم المضاد مباشرة بصبغة حمراء بعيدة. ينطبق نهج SiMPull على أهداف البروتين الأخرى التي تتوفر لها أجسام مضادة محددة ، بما في ذلك البروتينات داخل الخلايا. بالإضافة إلى ذلك ، نظرا لعدم الحاجة إلى ظروف تغيير طبيعة الطبيعة ، يمكن أيضا التقاط مستقبلات / مجمعات متعددة الوحدات الفرعية. ومع ذلك ، يمكن دمج تمسخ إذا كانت PTMs ذات الأهمية موجودة في مناطق منظمة من البروتين14. في نهاية المطاف ، يمكن توسيع SiMPull بسهولة لتشمل وضع العلامات المتزامنة على التيروزين الفوسفو المميز على المستقبلات الفردية لتحديد أنماط الفسفرة متعددة المواقع15. لا يمكن تحقيق استجواب المستقبلات الكاملة الطول والسليمة بهذه الطريقة بطرق قياسية أخرى ، بما في ذلك النشاف الغربي وقياس الطيف الكتلي الفوسفو.
جنبا إلى جنب مع مزايا SiMPull ، يجب النظر في بعض القيود. كما هو الحال مع أي تقنية تعتمد على الأجسام المضادة ، فإن تقارب وخصوصية الأجسام المضادة المستخدمة أمر بالغ الأهمية لنجاح القياس. لذلك ، من المهم تحسين ظروف وضع العلامات على الأجسام المضادة وتجنب الأجسام المضادة الثانوية بشكل مثالي باستخدام الأجسام المضادة الأولية ذات العلامات المباشرة. علاوة على ذلك ، فإن الأجسام المضادة المرتبطة بالسطح ستعجل البروتينات المترجمة إلى غشاء البلازما وداخل المقصورات الخلوية. هذا يمكن أن يقلل من شأن الفسفرة لأن البروتينات الموضعية للسيتوسول لا يمكن الوصول إليها من قبل الرباط المضاف خارجيا. يجب اتخاذ خطوات إضافية لتصحيح مستويات سطح المستقبل (الخطوة 6.2.10). أظهرت الأجسام المضادة المضادة للفوسفوتيروزين بعض الارتباطات غير المحددة بمجرد وجود الليزات. لتجنب هذه القطعة الأثرية ، تم وضع علامة وراثية على EGFR باستخدام GFP لتحديد موقع المستقبلات ، مما سمح لنا باستبعاد الإشارة المضادة ل PY من المستقبل. إذا كان سيتم استجواب البروتينات الداخلية ، فإن المواجهة مع الجسم المضاد الكلي للبروتين يمكن أن توفر صورة القناع ، مع تصحيح مناسب لأي ربط غير محدد. أخيرا ، في حين أن SiMPull يوفر معلومات عن عدم التجانس على مستوى البروتين ، فإن الليزات المتولدة في هذا البروتوكول هي من آلاف الخلايا ، ويتم فقدان التباين من خلية إلى خلية. ومع ذلك ، فقد تم إحراز تقدم نحو SiMPull أحادي الخلية باستخدام غرفة تدفق تتكون من غطاء وجانب مجهر مع فجوة 10 ميكرومتر. تم طلاء البكتيريا بشكل ضئيل على الغطاء بينما تم تشغيل الشريحة بالأجسام المضادة لالتقاط البروتينات المطلوبة. عند تحلل البكتيريا ، تم التقاط البروتينات من كل خلية في منطقة محصورة على الشريحة22 المغلفة بالأجسام المضادة. قد يكون من الممكن إجراء تحليل SiMPull أحادي الخلية مماثل لخلايا الثدييات وفسفرة البروتين في المستقبل.
يحتوي بروتوكول SiMPull على العديد من الخطوات الحرجة المطلوبة لضمان بيانات عالية الجودة. على سبيل المثال ، يتضمن البروتوكول إعدادا مفصلا لزجاج الغطاء. تنظف أغطية حفر البيرانا الزجاج تماما وتزيد من مجموعات الهيدروكسيل والمحبة للماء ، وهي ضرورية لتحسين سطح الغطاء. بعد عدة غسلات بالمذيبات العضوية ، يوفر علاج KOH مجموعات هيدروكسيل إضافية للأمينوسيلان13,23 ، الذي يغطي الزجاج بمجموعات أمين لربط PEG و BITIN-PEG. التنظيف أو التشغيل غير السليم في أي من هذه الخطوات سوف يتداخل مع سحب البروتين لأسفل. يعد التحكم في النسبة المولية ل PEG: biotin-PEG ، إلى جانب تركيز الليزات ، من العوامل الرئيسية في الحصول على كثافة IP المناسبة للبروتين على ركيزة Simbul. كما هو الحال مع أي فحص بيولوجي ، هناك تباين بين مستحضرات تحلل الخلايا ، ويمكن رؤية اختلافات صغيرة بين نسب الفسفرة بين نسخ العينات. لذلك ، من المهم قياس مستويات الفسفرة لمواقع التيروزين المختلفة داخل نفس العينة. توفر غرفة العينة الموصوفة في هذا البروتوكول نظاما لجمع العديد من نقاط البيانات في جلسة تصوير واحدة وتسمح بحساب المتوسط عبر تجارب SiMPull المتعددة.
على جانب الحصول على الصورة ، من المهم الحصول على العينة الائتمانية لضمان تراكب قناة دقيق ؛ خلاف ذلك ، لن يكون التوطين المشترك دقيقا. من المهم أيضا تحسين طاقة الليزر وإعدادات الكاميرا لزيادة الإشارة إلى الضوضاء إلى أقصى حد مع تقليل التبييض الضوئي في الوقت نفسه. وأخيرا، في حين أن مصفوفة العينات تتطلب كمية صغيرة من العينات والكواشف، فإن الأحجام المنخفضة عرضة للتبخر أثناء جلسة التصوير. من المهم التحقق بشكل دوري من صفيف العينات (~ 30-45 دقيقة) وإضافة مخزن مؤقت حسب الحاجة لمنع العينات من التجفيف.
أظهر هذا البروتوكول استخدام SiMPull لتحديد حالات فسفرة مستقبلات الغشاء. بينما يركز النهج على EGFR ، يمكن تطبيقه على مستقبلات سطح الخلية الأخرى والبروتينات داخل الخلايا ومجمعات البروتين ، طالما تتوفر الأجسام المضادة المناسبة. استخدام محتمل آخر ل SiMPull هو استجواب المحتويات وحالة الفسفرة للمكثفات المنفصلة عن الطور. بالإضافة إلى ذلك ، يمكن استخدام SiMPull لقياس PTMs الأخرى ، مثل الانتشار في كل مكان. لذلك ، يوفر SiMPull أداة فريدة لعلماء الأحياء الخلوية لاستجواب PTMs على البروتينات السليمة وربط أنماط PTM بالنتائج الخلوية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة R35GM126934 و R01AI153617 و R01CA248166 إلى DSL. تم دعم هيئة إدارة الانتخابات من خلال برنامج ASERT-IRACDA (NIH K12GM088021) و JAR من قبل برنامج UNM MARC (NIH 2T34GM008751-20). نحن نقر بامتنان باستخدام المورد المشترك للفحص المجهري الفلوري لمركز السرطان الشامل بجامعة نيو مكسيكو ، بدعم من NIH P30CA118100. نود أن نعترف بالدكتورين أنكور جاين وتايكيجيب ها ، اللذين ألهم تطويرهما الأصلي ل SiMPull هذا العمل.
ES-C الكلمة الحالية: مجموعة الديناميكا المناعية ، مختبر المناعة التكاملية للسرطان ، مركز أبحاث السرطان ، المعهد الوطني للسرطان ، بيثيسدا
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | MTC Bio | C2000 | |
| 10 mM Tris-HCl pH 7.4 | |||
| 10 mM Tris-HCl pH 8.0/ 50 mM NaCl | T50 Buffer | ||
| 100 mm Tissue Culture dish | CELLTREAT | 229620 | Storage of piranha etched glass/arrays |
| 15 mL conical tube | |||
| 16% Paraformaldehyde Aqueous Solution | Electron Microscopy Sciences | 15710 | Hazardous |
| 50 mL conical tube | Functionalized Glass storage/ KOH reuse | ||
| 50 mM Tris-HCl pH 7.2/150 mM NaCl | Lysis Buffer Component | ||
| 60 mm Tissue Culture dish | Corning | 430166 | |
| 8% Glutaraldehyde Aqueous Solution | Electron Microscopy Sciences | 16020 | Hazardous |
| Acetone (C3H6O) | Millipore Sigma | 270725 | Hazardous |
| Alexa Fluor 647 NHS Ester | Thermo Fisher Scientific | A-20006 | |
| Animal-Free Recombinant Human EGF | Peprotech | AF-100-15 | |
| Anti-Human EGFR (External Domain) – Biotin | Leinco Technologies, Inc | E101 | |
| Anti-p-Tyr Antibody (PY99) Alexa Fluor 647 | Santa Cruz Biotechnology | sc-7020 AF647 | |
| Bath-sonicator | Branson | 1200 | |
| BCA Protein Assay Kit | Pierce | 23227 | |
| Biotin-PEG | Laysan Bio | Biotin-PEG-SVA, MW 5,000 | |
| Bovine serum albumin | Gold Biotechnology | A-420-1 | Tyrode's Buffer Component |
| Buchner funnel | |||
| Bunsen burner | |||
| Calcium Chloride (CaCl2) | Millipore Sigma | C4901 | Tyrode's Buffer Component |
| Cell Scraper | Bioworld | 30900017-1 | |
| Conical Filtering Flask | Fisher Scientific | S15464 | |
| Coplin Jar | WHEATON | 900470 | |
| Countess II Automated Cell Counter | Thermo Fisher Scientific | AMQAX1000 | |
| Coverslips 24 x 60 #1.5 | Electron Microscopy Sciences | 63793 | |
| DipImage | https://diplib.org/ | ||
| DMEM | Caisson Labs | DML19-500 | |
| emCCD camera | Andor iXon | ||
| Fetal Bovine Serum, Optima | Bio-Techne | S12450H | Heat Inactivated |
| Fusion 360 software | Autodesk | ||
| Geneticin G418 Disulfate | Caisson Labs | G030-5GM | |
| Glacial Acetic Acid (CH3COOH) | JT Baker | JTB-9526-01 | Hazardous |
| Glass serological pipettes | |||
| Glass Stir Rod | |||
| Glucose (D-(+)-Glucose) | Millipore Sigma | D9434 | Tyrode's Buffer Component |
| Halt Phosphotase and Protease Inhibitor Cocktail (100X) | Thermo Fisher Scientific | 78446 | Lysis Buffer Component |
| HEPES | Millipore Sigma | H3375 | Tyrode's Buffer Component |
| Hydrochloric Acid (HCl) | VWR | BDH7204-1 | Hazardous |
| Hydrogen Peroxide (H2O2) (3%) | HX0645 | ||
| Hydrogen Peroxide (H2O2) (30%) | EMD Millipore | HX0635-2 | |
| Ice | |||
| IGEPAL CA-630 (NP-40) | Sigma Aldrich | I8896 | Lysis Buffer Component |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratories | H-4000 | |
| Immersol 518F immersion oil | Zeiss | 444960-0000-000 | |
| in-house vacuum line | |||
| L-glutamine | Thermo Fisher Scientific | 25030-164 | |
| Magnessium Chloride Hexahydrate (MgCl2-6H2O) | MPBio | 2191421 | Tyrode's Buffer Component |
| Matlab | Mathworks | Curve Fitting Toolbox, Parallel Computing Toolbox, and Statistics and Machine Learning toolbox | |
| Methanol (CH3OH) | IBIS Scientific | MX0486-1 | Hazardous |
| Milli-Q water | |||
| Mix-n-Stain CF Dye Antibody Labeling Kits | Biotium | 92245 | Suggested conjugation kit |
| mPEG | Laysan Bio | mPEG-succinimidyl valerate, MW 5,000 | |
| N-(2-aminoethyl)-3-aminopropyltrimethoxysilane | UCT United Chemical | A0700 | Hazardous |
| Nanogrid | Miraloma Tech | ||
| NeutrAvidin Biotin Binding Protein | Thermo Fisher Scientific | 31000 | |
| Nitrogen (compressed gas) | |||
| NVIDIA GPU with CUDA | Look for compatibility at https://www.mathworks.com/help/parallel-computing/gpu-support-by-release.html | ||
| Olympus iX71 Microscope | Olympus | ||
| Parafilm M Sealing Film | The Lab Depot | HS234526C | |
| PBS pH 7.4 | Caisson Labs | PBL06 | |
| PC-200 Analog Hot Plate | Corning | 6795-200 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140-163 | |
| Phospho-EGF Receptor (Tyr1068) (1H12) Mouse mAb | Cell Signaling Technology | 2236BF | |
| Potassium Chloride (KCl) | Millipore Sigma | 529552 | Tyrode's Buffer Component |
| Potassium Hydroxide (KOH) | Millipore Sigma | 1050330500 | Hazardous |
| Premium PLA Filament, 1.75 mm diameter | Raise 3D | PMS:2035U/RAL:3028 | Printing temperature range: 205-235 °C |
| Pro2 3D printer | Raise 3D | ||
| Pyrex 1 L beaker | |||
| PYREX 100 mL storage bottles | Corning | 1395-100 | CH3OH/C3H6O reuse |
| Pyrex 250 mL beakers | |||
| Pyrex 4 L beaker | |||
| Quad-view Image Splitter | Photometrics | Model QV2 | |
| Refrigerated centrifuge | Eppendorf | EP-5415R | |
| RevCount Cell Counters, EVE Cell Counting Slides | VWR | 10027-446 | |
| Semrock emission filters: blue (445/45 nm), green (525/45 nm), red (600/37 nm), far-red (685/40 nm) | Semrock | LF405/488/561/635-4X4M-B-000 | |
| Serological pipette controller | |||
| Serological Pipettes | |||
| smite single molecule analysis package | https://github.com/LidkeLab/smite.git | ||
| Sodium Bicarbonate (NaHCO3) | Sigma Aldrich | S6014 | Hazardous |
| Sodium Borohydride (NaBH4) | Millipore Sigma | 452874 | Tyrode's Buffer Component |
| Sodium Chloride (NaCl) | Millipore Sigma | S9625 | Activate by successive heat and pH cycling |
| Sodium Hydroxide | VWR | BDH3247-1 | |
| Sodium Orthovanadate (Na3VO4) | Millipore Sigma | S6508 | Hazardous |
| Sulfuric Acid (H2SO4) | Millipore Sigma | 258105 | Hazardous |
| TetraSpeck Microspheres | Thermo Fisher Scientific | T7279 | multi-fluorescent beads |
| Tris (Trizma) base | Millipore Sigma | T1503 | |
| Trypan blue stain, 0.4% | Thermo Fisher Scientific | 15250061 | |
| Trypsin-EDTA 0.05% | Thermo Fisher Scientific | 25300120 |
References
- Lemmon, M. A., Schlessinger, J. Cell Signaling by Receptor Tyrosine Kinases. Cell. 141 (7), 1117-1134 (2010).
- Seet, B. T., Dikic, I., Zhou, M. M., Pawson, T. Reading protein modifications with interaction domains. Nature Reviews Molecular Cell Biology. 7 (7), 473-483 (2006).
- Coba, M. P., et al. Neurotransmitters drive combinatorial multistate postsynaptic density networks. Science Signaling. 2 (68), (2009).
- Gibson, S. K., Parkes, J. H., Liebman, P. A. Phosphorylation modulates the affinity of light-activated rhodopsin for g protein and arrestin. Biochemistry. 39 (19), 5738-5749 (2000).
- Stites, E. C., et al. Use of mechanistic models to integrate and analyze multiple proteomic datasets. Biophysical Journal. 108 (7), 1819-1829 (2015).
- Hause, R. J., et al. Comprehensive binary interaction mapping of SH2 domains via fluorescence polarization reveals novel functional diversification of ErbB receptors. PLOS ONE. 7 (9), 44471(2012).
- Lau, E. K., et al. Quantitative encoding of the effect of a partial agonist on individual opioid receptors by multisite phosphorylation and threshold detection. Science Signaling. 4 (185), (2011).
- Mishra, M., Tiwari, S., Gomes, A. V. Protein purification and analysis: next generation Western blotting techniques. Expert Review of Proteomics. 14 (11), 1037-1053 (2017).
- Brunner, A. M., et al. Benchmarking multiple fragmentation methods on an orbitrap fusion for top-down phospho-proteoform characterization. Analytical Chemistry. 87 (8), 4152-4158 (2015).
- Swaney, D. L., Wenger, C. D., Coon, J. J. Value of using multiple proteases for large-scale mass spectrometry-based proteomics. Journal of Proteome Research. 9 (3), 1323-1329 (2010).
- Curran, T. G., Zhang, Y., Ma, D. J., Sarkaria, J. N., White, F. M. MARQUIS: A multiplex method for absolute quantification of peptides and posttranslational modifications. Nature Communications. 6 (1), 1-11 (2015).
- Jain, A., et al. Probing cellular protein complexes using single-molecule pull-down. Nature. 473 (7348), 484-488 (2011).
- Jain, A., Liu, R., Xiang, Y. K., Ha, T. Single-molecule pull-down for studying protein interactions. Nature Protocols. 7 (3), 445-452 (2012).
- Kim, K. L., et al. Pairwise detection of site-specific receptor phosphorylations using single-molecule blotting. Nature Communications. 7 (1), 1-10 (2016).
- Salazar-Cavazos, E., et al. Multisite EGFR phosphorylation is regulated by adaptor protein abundances and dimer lifetimes. Molecular Biology of the Cell. 31 (7), 695(2020).
- Huyer, G., et al. Mechanism of inhibition of protein-tyrosine phosphatases by vanadate and pervanadate. Journal of Biological Chemistry. 272 (2), 843-851 (1997).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Keller, H. E. Objective lenses for confocal microscopy. Handbook of Biological Confocal Microscopy. , 145-161 (2006).
- Hendriks, C. L. L., van Vliet, L. J., Rieger, B., van Kempen, G. M. P., van Ginkel, M. Dipimage: a scientific image processing toolbox for MATLAB. , (1999).
- fitgeotrans: Fit geometric transformation to control point pairs. The MathWorks Inc. , Available from: https://www.mathworks.com/images/ref/fitgeotrans.html (2013).
- Raghavachari, N., Bao, Y. P., Li, G., Xie, X., Müller, U. R. Reduction of autofluorescence on DNA microarrays and slide surfaces by treatment with sodium borohydride. Analytical Biochemistry. 312 (2), 101-105 (2003).
- Wang, X., Park, S., Zeng, L., Jain, A., Ha, T. Toward single-cell single-molecule pull-down. Biophysical Journal. 115 (2), 283-288 (2018).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments. (86), e50549(2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved