Method Article
التداخل الحيوي طبقة لقياس حركية البروتين البروتين التفاعلات والآثار تفارغي يجند
In This Article
Summary
البروتوكولات هنا وصف المقايسات الحركية للتفاعلات البروتين البروتين مع بيو طبقة التداخل. F-نوع ATP سينسيز، التي تشارك في استقلاب الطاقة الخلوية، يمكن تحول دون الوحيدات ε في البكتيريا. تكيفنا الحيوي طبقة التداخل لدراسة التفاعلات المعقدة للالحفاز مع المثبطة-C محطة مجال ε ل.
Abstract
وصفنا استخدام بيو طبقة التداخل لدراسة التفاعلات المثبطة للالوحيدات ε مع مجمع الحفاز كولاي ATP سينسيز. البكتيرية نوع F-ATP سينسيز هو الهدف من المضادات الحيوية الجديدة، وافقت ادارة الاغذية والعقاقير لمكافحة السل المقاوم للأدوية. فهم البكتيريا محددة لصناعة السيارات في تثبيط سينسيز ATP من قبل المجال-C محطة من الوحيدات ε يمكن أن توفر وسيلة جديدة لاستهداف إنزيم لاكتشاف أدوية مضادة للجراثيم. المجال-C محطة من ε تخضع لعملية تغيير متعلق بتكوين دراماتيكية عندما التحولات انزيم بين الدول النشطة وغير النشطة، وبروابط الموقع الحفاز يمكن أن تؤثر على أي من التشكل ε هو السائد. التدابير مقايسة حركية ε في ملزمة / التفكك مع مجمع الحفاز، وبشكل غير مباشر الشرق الأوسط وأفريقياسورس التحول من ربط إنزيم ε من وإلى التشكل المثبطة يبدو nondissociable. إشارة التداخل الحيوي طبقة ليست حساسة بشكل مفرط لتكوين الحل، لذلك يمكن أن تستخدم أيضا لرصد الآثار تفارغي من موقع بروابط الحفاز على التغييرات متعلق بتكوين ε ل.
Introduction
البروتين البروتين التفاعلات مهمة لكثير من العمليات البيولوجية، واستخدمت وسائل بصرية خالية من التسمية مثل السطحية بلازمون الرنين (SPR) في المختبر لدراسة حركية ملزمة والتفكك 1. معظم طرق خالية من التسمية لشل حركة جزيء حيوي واحد على سطح أجهزة الاستشعار واستخدام الإشارات الضوئية للكشف عن شريك ملزم من الحل لأنه يربط مع جزيء حيوي يجمد 1. بينما SPR هو طريقة حساسة للغاية، هو عرضة للتدخل بسبب التغيرات في معامل الانكسار من الحل تتدفق على الاستشعار 2. وإن لم يكن حساسة مثل SPR، بيو طبقة التداخل (BLI) وأقل تأثرا بالتغيرات في تكوين العينة 1،3. يستخدم BLI أجهزة الاستشعار الألياف البصرية التي لها طلاء حيويا الملكية في الطرف. النظام المستخدم هنا (محاذية-RED96) يحتوي على ثمانية طيفي. يضخ الضوء الأبيض إلى صف تحقيقات التي تتحرك على الذراع الروبوتية. أجهزة استشعار الألياف البصرية عاختار البريد من قبل تحقيقات وانتقل الى لوحة 96 جيدا تحتوي على عينات. ويجمد واحدة من الجزيئات المستهدفة على سطح جهاز الاستشعار البيولوجي. ثم يتم نقل أجهزة الاستشعار لآبار تحتوي على الشريك ملزم في الحل. BLI تراقب جمعية الشريك ملزم مع جزيء يجمد، ثم تراقب التفكك بعد تحريك أجهزة الاستشعار لحل دون شريك ملزمة. ملزمة للجزيئات على سطح جهاز الاستشعار البيولوجي يؤدي إلى تغييرات في التدخل البصرية بين موجات الضوء التي تعكس مرة أخرى إلى طيفي من السطح الداخلي والخارجي من واجهة بين أجهزة الاستشعار والحل. هذه التغييرات في التدخل يمكن قياسها كميا، وتستخدم لتحديد معدلات الحركية للملزم والتفكك، على النحو الموجز في الرسوم المتحركة من الشكل 1.
لقد طبقنا BLI لقياس التفاعلات المعقدة بين الحفاز سينسيز ATP البكتيرية والوحيدات ε، والتي يمكن لصناعة السيارات في تثبيط الانزيم. ATP سيnthase هو nanomotor جزءا لا يتجزأ من الغشاء الدوارة التي يحفز التوليف والتحلل من ATP 4. مجمع الحفاز (F 1) يمكن أن تكون معزولة في شكل قابل للذوبان الذي يعمل بمثابة أتباز. الوحيدات ε اثنين من المجالات: المجال N-محطة (الأمراض الاستوائية المهملة) ضروري لتجميع المناسبة واقتران وظيفية للانزيم ولكن لا تتفاعل مباشرة مع مفارز الحفاز؛ المجال C-محطة (CTD) يمكن أن تمنع الانزيم من خلال التفاعل مع مفارز الحفاز متعددة 5،6. هذا التنظيم هو بوساطة ε محددة لsynthases ATP البكتيرية وليس لوحظ في نديد الميتوكوندريا. وقد برزت ATP سينسيز كهدف للأدوية المضادة للبكتيريا، كما هو مبين من قبل ادارة الاغذية والعقاقير الموافقة الأخيرة من bedaquiline لعلاج السل المقاوم للأدوية 7. وبالتالي، واستهداف دور ε في المثبطة لاكتشاف المخدرات يمكن أن يسفر عن مضادات الجراثيم التي لا تمنع ATP سينسيز الميتوكوندريا. مع مجمع الحفاز معزولة (F 1)، εيصبح سهل التفريق الوحيدات. ومع ذلك، مع ε بد أن F 1، يمكن للεCTD الخضوع لتغيير متعلق بتكوين دراماتيكية، وإدراج جزئيا في تجويف المركزي الإنزيم وتكوين دولة المثبطة التي من غير المرجح أن تنأى مباشرة 6،8. نستخدم BLI لقياس حركية F 1 / ε ملزمة والتفكك، وبشكل غير مباشر، لدراسة الآثار تفارغي من موقع الحفاز لبروابط على التشكل وε.
في نظامنا، ε تم اختياره لتجميد على سطح مستشعر منذ إشارة BLI (مثل SPR) حساس للكتلة جزيئات ملزمة على السطح. الوحيدات ε صغير (15 كيلو دالتون ~) نسبة إلى الرئيسية F 1 مجمع (347 كيلو دالتون ~). وبالتالي، فإن أكبر إشارة BLI تنجم عن ربط F 1 إلى ε يجمد. من أجل رصد F 1 التفكك، والتي يمكن أن تكون بطيئة جدا، ε يجب أن يجمد بشدة. هكذا اخترنا أن biotinylate؛ وشل على أجهزة الاستشعار streptavidin المغلفة. البروتينات يمكن المعقدة البيروكسيديز بنسبة (ط) التعديل عشوائية من سطح lysines 9، (ب) رد فعل السيستين الأصلي أو هندسيا فريدا مع البيوتين maleimide كاشف 10 أو (ج) مضيفا راثيا الببتيد البيوتين متقبل معين يتم المعقدة البيروكسيديز خلال إنزيمي في التعبير المجراة من البروتين الموسومة 11. في نظامنا، والمعقدة البيروكسيديز ε باستخدام طريقة (ج) 8. بمجرد يجمد الموسومة البيوتين ε على أجهزة استشعار streptavidin، يمكن BLI قياس ملزمة وتفكك F 1 التي تم المنضب من الوحيدات ε (F 1 (ε)). للتجارب الموصوفة هنا، قد تم القيام به المقايسات الأولية لتحديد كميات معقولة من البروتين البيروكسيديز لشل على أجهزة الاستشعار. هذا يمكن أن تختلف، اعتمادا على الوزن الجزيئي للبروتين وشريك ملزمة لها، ولكن الهدف هو تحديد كمية ضئيلة من البروتين يجمد ريوفر قبعة (ط) مقبولا الإشارة إلى الضوضاء لحركية ملزمة مع تركيز منخفض من الشريك ملزم (K تحت D) و (ب) الحد الأدنى من التشويه من حركية ملزم مع تركيز تشبع بالقرب من الشريك ملزمة. أيضا، قد تختلف العناصر المتفاعلة من biotinylation (ولكن تجنب> 1 مول البيوتين / البروتين مول)، لذلك قد تكون هناك حاجة إلى بعض الفحص الأولي لكل دفعة جديدة من البروتين البيروكسيديز للتأكد من أن إشارة BLI متسقة يمكن أن يتحقق خلال تجميد على streptavidin المغلفة أجهزة الاستشعار.
Protocol
1. برمجة صك BLI الفحص
بدوره على الصك ساعة واحدة على الأقل في وقت مبكر للسماح للمصباح في عملية الاحماء، وهذا أمر ضروري للحد من الضوضاء والانجراف في الإشارات الضوئية أثناء التجربة. ضبط درجة الحرارة المطلوبة من خلال علامة التبويب أداة لprewarm حامل لوحة العينة. ثم إعداد التصميم التجريبي في البرنامج الحصول على البيانات. حدد "جديد حركية التجربة" في علامة التبويب معالج التجربة. هذا يمثل القائمة كلفه مع جميع الخطوات التي يجب أن تكون محددة.
1.1. لوحة تعريف
تعريف الأعمدة ليتم استخدامها على لوحة عينة 96 جيدا. تعيين الأعمدة لاحتواء العازلة، البروتين يجمد أو شريك ملزمة. لكل جمعية جيدا، أدخل تركيز شريك ملزمة لاستخدامها. ملاحظة: تعريف لوحة هو مبين في الشكل 2 لديها خيارات لفحوصات متميزة.
1.2. فحص الوضوح
ontent "> تعريف جميع الخطوات اللازمة لفحص وتشمل هذه (ط) الأساس (عدة)، (ب) جاري التحميل، (ج) جمعية و (iv) التفكك لشريك ملزم، ثم كما هو موضح أدناه، ربط خطوات الفحص الفردية مع أعمدة من الآبار على لوحة عينة عن طريق تحديد الخطوة مقايسة ثم النقر المزدوج على العمود منها. هذه البرامج على أجهزة استشعار يمكن نقلها من عمود واحد من الآبار إلى أخرى أثناء الفحص.- خط الأساس
تبدأ خطوة أساسية موجزة (≥ 60 ثانية)، مع أجهزة الاستشعار في المخزن فحص (الشكل 2، العمود 1)، لإنشاء إشارات BLI الأولية في لوحة 96 جيدا. - تحميل (شل حركة البروتين البيروكسيديز على أجهزة الاستشعار)
تعيين أجهزة الاستشعار لآبار التي سوف تحتوي على البروتين البيروكسيديز (الشكل 2، العمود 2). استخدام وظيفة عتبة لتحقيق مستوى محدد سلفا من ملزمة (انظر المقدمة). تعيين الخيار عتبة حتى يتسنى لجميع أجهزة الاستشعار ستكون الخطوةد إلى العمود التالي من الآبار عند أي واحد من أجهزة الاستشعار تصل إلى العتبة. - خط الأساس
وتشمل خطوة أخرى أساسية في المخزن (الشكل 2، العمود 3؛ عادة> 5 دقائق) ليغسل البروتينات البيروكسيديز nonimmobilized من أجهزة الاستشعار وإنشاء، وإشارات خط الأساس مستقرة جديدة. لفحوصات ملزمة / التفكك الأساسية فقط (كما في الشكل 3)، وتشمل خطوة إضافية الأساس (60 ثانية) مع أجهزة الاستشعار في آبار جديدة من العازلة (الشكل 2، العمود 4) قبل الخطوة الرابطة. - جمعية (الشريك ملزمة للبروتين يجمد)
لالملزمة / تفارق مقايسة الأساسية (كما في الشكل 3)، حدد مجموعة من تركيزات شريك ملزمة لاستخدامها لمختلف أجهزة الاستشعار / الآبار (الشكل 2، العمود 5). ضبط الوقت خطوة بحيث لا يقل تركيز تشبع من الشريك ملزم ينبغي الاقتراب التوازن إشارة ملزمة. لفحص لاختبار آثار تفارغي من بروابط صغيرة على التفكك من مجمع البروتين البروتين (كما في الشكل 5)، حدد تركيز عال من شريك واحد ملزم (~ 10 أضعاف فوق يقدر K D) للاستخدام في جميع الآبار الجمعيات. - التفكك (الشريك ملزم)
لالملزمة / تفارق مقايسة الأساسية فقط (كما في الشكل 3)، تعيين أجهزة استشعار للعودة إلى العمود 4 (الشكل 2)، وهو نفس الآبار العازلة المستخدمة لخط الأساس اضافية قبل جمعية. لفحص لاختبار آثار تفارغي من بروابط صغيرة، بدلا من ذلك تعيين أجهزة استشعار للانتقال إلى العمود 6 (الشكل 2)، حيث يمكن أن تحتوي على كل بئر عازلة بالإضافة إلى بروابط تفارغي مختلفة.
1.3. استشعار الواجب
تشير إلى مواقع في علبة الاستشعار التي سوف تحتوي على أجهزة استشعار prewetted للمقايسة. تحديد أي مواقف فارغة منذ التجربة سوف FAIل إذا لم يتم اختيار أجهزة الاستشعار فوق.
1.4. تجربة الاستعراض
تصور جميع الخطوات المخطط لها للتحقق من الأخطاء والعودة الى تصحيحها.
1.5. تشغيل التجربة
أدخل التفاصيل الضرورية، بما في ذلك موقع ملفات البيانات. أدخل درجة الحرارة المطلوبة للتجربة. إذا كانت أجهزة الاستشعار لا تزال تتطلب prewetting، حدد الخيار لتأخير بدء التجربة. أخيرا، مرة واحدة كل إعداد العينات كاملة (الخطوة 2) ويتم تحميل كل من لوحة عينة وصينية الاستشعار في الصك، انقر فوق الزر انتقال لتشغيل الفحص.
2. تحضير العينة
- إعداد مقايسة العازلة المناسبة. العازلة المستخدمة في التجارب هو مبين في الأرقام 3 و 5: 20 ملي اجتماعات الأطراف (3 - (N-Morpholino) حمض propanesulfonic)، تريس (تريس (هيدروكسي) الميثان الأمينية) (المضافة لضبط درجة الحموضة إلى 8.0)، 50 ملي بوكل. وتشمل BSA (ألبومين المصل البقري، الدهنية حمض الحرة، 0.5ملغ / مل النهائي) في المخزن المؤقت لجميع خطوات الفحص وللجميع التخفيفات من البروتين البيروكسيديز أو شريك ملزمة للحد ملزمة غير محدد من البروتينات إلى أجهزة الاستشعار.
- يخفف من البروتين البيروكسيديز (ε) في المنطقة العازلة مقايسة إلى التركيز المناسب (انظر المقدمة).
- تحضير التخفيفات الشريك ملزم (F 1 (ε)) في المخزن فحص (انظر مناقشة لمجموعة من تركيزات لاستخدام).
- Prewet أجهزة الاستشعار streptavidin المغلفة لمدة 10 دقيقة على الأقل لإزالة طلاء واقية السكروز. إزالة رف المحتوية على الاستشعار من درج أجهزة الاستشعار وإدراج لوحة 96 جيدا في الجزء السفلي من الدرج، وانزلاق زاوية واحدة من لوحة إلى الشق توجيههم على الدرج. للعمود من أجهزة الاستشعار لاستخدامها، إضافة 200 ميكرولتر من العازلة الفحص لكل بئر في هذا العمود من لوحة 96 جيدا. العودة رف من أجهزة الاستشعار لعلبة في الاتجاه الصحيح (مع علامات التبويب في فتحات).
- كما تم تعيينها خلال البرمجة في الخطوة 1، وملء الآبار سو لوحة عينة مع العازلة مقايسة أو التخفيفات المناسبة من البروتين، كما في الشكل 2. تجنب إدخال فقاعات، لأنها يمكن أن تسبب الضوضاء في إشارة الضوئية. تشمل واحدة أو أكثر الآبار التي حذفت إشارة إما (ط) المعقدة البيروكسيديز البروتين أو (ب) شريك ملزمة.
- فتح باب الصك وتضاف علبة استشعار على خشبة المسرح (يسار)، مع علامات التبويب علبة لإدراجها في فتحات المرحلة. إدراج لوحة العينة في حامل لوحة (يمين)، تأكد من أن لوحة مسطحة ويجلس في الاتجاه الصحيح، كما هو مبين على حامل لوحة. يغلق الباب ويبدأ الفحص من البرنامج الحصول على البيانات (الخطوة 1.5).
3. معالجة المعلومات
- بعد تشغيل الفحص، افتح البرنامج تحليل البيانات وتحميل المجلد الذي يحتوي على البيانات. انقر على "معالجة" التبويب لرؤية قائمة تدريجي تجهيز (في اليسار) والبيانات الخام الحركية، مع كل أجهزة الاستشعار (ه) تعيين لون مختلفة (انظرالشكل 3).
- تحت عنوان "اختيار البيانات"، انقر فوق الزر "الاستشعار التحديد". على "نموذج لوحة الخريطة"، بتعيين الآبار لل1 أو 2 أجهزة استشعار مراقبة (G، H في مقايسة من الشكل 3)، والآبار المرجعية. في القائمة التحميل، حدد المربع "الطرح" وحدد "مرجع ويلز" لطرح إشارة مرجعية (واحد أو متوسط) من كل إشارة استشعار الآخر.
- محاذاة كل أثر لY = 0 باستخدام "محاذاة المحور Y" خطوة. حدد "الأساس" كخطوة المحاذاة (وهذا يجري على خط الأساس الأخيرة قبل جمعية خطوة). ل "المدى الزمني"، أدخل ثانية 10 مشاركة من هذا الأساس (أي 50-60 ثانية لخط الأساس 60 ثانية، كما في الشكل 3).
- ضع علامة في المربع "إنتر خطوة تصحيح" لتقليل نوبات إشارة بين الخطوات النقابية والتفكك. حدد محاذاة إلى خط الأساس أو التفكك.
- حدد Savitzky-غولي وظيفة التصفية في معظم الحالات، وانقر فوق "بيانات عملية!" والمضي قدما. تفقد البصرالبيانات المعالجة النهائية (أقل اللوحة اليمنى). مع المقايسات المعدة للتحليل بيانات عالمية (كما في الشكل 4)، إذا تبين آثار إشارة تحولا كبيرا بين جمعية والخطوات التفكك، تغيير التحديد من التفكك أو خط الأساس ل"تصحيح المشتركة بين خطوة" واعادة معالجة البيانات قبل الشروع في البيانات التحليل.
4. تحليل البيانات
انقر على "تحليل" التبويب في تحليل البيانات للبدء. ملاحظة: الخطوات المثال أدناه هي لأغراض التحليل العالمي للمنحنيات متعددة الملزمة / التفكك (كما في الشكل 3).
- ل"خطوة إلى تحليل"، واختيار جمعية والتفكك. ل "الموديل"، حدد 1:1. ملاحظة: هي الخيارات الأخرى المتاحة محدودة.
- ل "تركيب"، اختر العالمية (كامل). ل "المجموعة حسب" اختيار اللون (كما في الرسم البياني). حدد "R ماكس غير المرتبطة بواسطة الاستشعار" للسماح المناسب مستقلة عن R ماكس (ردا على إشارة تشبع القصوى الملزمة للتكافؤtner للبروتين يجمد). ملاحظة: نحن نفعل ذلك بالنسبة لمعظم المقايسات، وأجهزة الاستشعار تختلف قليلا في كمية البروتين يجمد (انظر الشكل 3، تحميل).
- على الطاولة هو مبين، تأكد من كل آثار استشعار ليتم تحليلها لها نفس اللون، بحيث سيتم تحليلها كمجموعة العالمية. إذا لزم الأمر، حدد جهاز استشعار واحد أو أكثر يتتبع حذف من المناسب العالمية: تحت عمود "تضمين"، انقر بزر الماوس الأيمن على جهاز استشعار الموقف المطلوب وحدد "استبعاد ويلز".
- انقر على زر "منحنيات صالح!" لبدء تحليل الانحدار غير الخطية. دراسة نتائج المناسب، والتي تشمل (ط) تراكب من منحنيات الانحدار مع آثار بيانات الاستشعار (كما في الشكل 4)، (ب) قطع من مخلفات المناسب، و (iii) جدول مع القيم المعلمة العزم (ثوابت المعدل، R كحد أقصى، K D) وإحصاءات (الأخطاء المعيارية للمعلمات، تشي التربيعية، R 2).
- تحت عنوان "تصدير البيانات"، لإنقاذ نتائج المناسب بالنقر على "تصدير الجدول إلى ملف CSV". للالعنبهينج أو مزيد من التحليل للبيانات / منحنيات تركيبها مع البرامج الأخرى، انقر فوق "تصدير نتائج تركيب" لحفظ البيانات كل أجهزة الاستشعار ومنحنى المجهزة في ملف نصي.
النتائج
في الوقت الحقيقي ملزمة ويتم عرض حركية تفارق BLI في الشكل 3. وقد تم هذه التجربة مع العازلة مقايسة في تكوين الجمعيات والتفكك. وقد بدأت هذه التجربة مع خطوة أساسية 10 دقيقة منذ أجهزة الاستشعار قد prewet فقط لفترة وجيزة. المقبل، تم تحميل ε المعقدة البيروكسيديز على أجهزة الاستشعار. وقعت لا تفارق كشفها من ε في جميع الخطوات المتبقية كما يرى من منحنى المرجعية (G) الذي كان وأضاف لا شريك ملزمة. وكان جهاز استشعار الإشارة الثانية (H) خالية من البروتين يجمد وأظهرت انخفاض غير محددة ملزمة للشريك ملزمة. واستخدمت تركيزات مختلفة من F 1 (ε) في الخطوة تكوين الجمعيات لأجهزة الاستشعار AF من أجل احتواء النتائج على الصعيد العالمي والحصول على أفضل القيم لك لذلك، ك د، وK D. تمت معالجة النتائج كما في البروتوكول، مما أسفر عن آثار البيانات (الأزرق) في الشكل 4. في هذه الحالة، تم طرح استشعار إشارة التتبع H من عينة آرارسالا ساحقا لتصحيح ملزم غير محدد من الشريك وإشارة نظام الانجراف ملزمة. في خطوة تحليل البيانات، وكانت جميع منحنيات يصلح نموذجا عالميا مع 01:01 (أ ك واحد، واحد ك د)، و "العالمية (كامل)" مناسبا يفترض تفارق الكاملة لشريك ملزم (إشارة سيعود إلى الصفر في لانهائية الوقت) (الشكل 4 والأحمر). نلاحظ أنه، لتحقيق أعلى اثنين من تركيزات F 1 (ε)، وهناك انحرافات صغيرة ولكنها كبيرة من البيانات من العالمية، 01:01 الطراز. استخدمت مستويات منخفضة من يجند يجمد (المعقدة البيروكسيديز "ε" الوحيدات)، وكان لا تحسن مناسبا بما في ذلك عن طريق عامل النقل الجماعي في النموذج (لا يظهر). ومع ذلك، F 1 (- "ε") هو كبير المعقدة (350 كيلو دالتون ~)، وتجارب أخرى (لا يظهر) تشير إلى أن هذه الانحرافات هي نتيجة لانخفاض إمكانية الوصول ملزمة لجزء من يجند يجمد؛ أي طائرة من طراز اف 1 بد أن "ε" واحد قد تعيق الوصول إلى sterically البيروكسيديز أخرى"ε" ملزمة على نفس tetramer streptavidin.
ويبين الشكل 5 تجربة المختلفة التي كان لا بد الانزيم ليجمد استشعار-ε في وجود ATP 1 ملم / EDTA، وهذا يهيئ معظم F 1 / المجمعات "ε" لتولي التشكل noninhibitory، والتي تنأى بسهولة 8. وأجهزة الاستشعار ثم انتقل إلى التفكك الآبار التي تحتوي على العازلة مقايسة مع بروابط مختلفة. هذا يدل على آثار بروابط مختلفة على التشكل من ε. على سبيل المثال، والتعرض للMgADP / بي تباطأ بشكل كبير صافي التفكك، مشيرا إلى أن تحول ε التشكل إلى بإحكام ملزمة، والدولة المثبطة. وقد لوحظت حركية تفارق تعقيدا منذ تسببت بروابط مختلفة تحولات مختلفة في جزء من F 1. المجمعات ε ε مع في نشطة (غير إجتماعي) أو المثبطة (nondissociable) التشكل. فمن الممكن أيضا أن التغيرات متعلق بتكوين كبيرة من البروتينات ملزمةتسهم بشكل مباشر للتغيرات في إشارة BLI ولكن، في دراساتنا، وهذا يبدو أن لا تذكر بالمقارنة مع إشارة للربط / تفكك الكبيرة F 1 المعقدة (انظر شاه وآخرون 8، الشكل 5D؛ الانتقال إلى منحنيات 3 و 6 المعرض سلوك مشابه جدا، على الرغم من ظروفهم صالح التشكل متميزة من جمعة المنضم 1). لم يتم تصميم البرنامج لتحليل البيانات مثل حركية تفارق المعقدة. وبالتالي، ونحن تصدير البيانات إلى ملفات نصية لتحليل الانحدار غير الخطية مع البرامج الأخرى.
الشكل 1. مبادئ بيو طبقة التداخل. يلخص الرسوم المتحركة الفيزياء الأساسية للكشف عن التفاعل الجزيئية البيولوجية من قبل BLI. وينعكس يمر الضوء من خلال تحقيقات إلى طيفي (ط) من السطح الداخلي من أجهزة الاستشعار و(ب) من الخارجية فيterface من أجهزة الاستشعار مع محلول العينة. هذه النتائج في نمط التداخل. ملزمة للجزيئات على سطح مستشعر يغير نمط التدخل. يمكن رسم هذا على أنه تحول نانومتر من الكثافة النسبية مقابل الطول الموجي. رصد هذا التحول نانومتر مع مرور الوقت يوفر حركية ملزمة والتفكك. يتم تكييفها الرسومات بإذن من FortéBio 12.

الشكل 2. تخطيطي ترتيب العينات في لوحة عينة 96 جيدا. سيتم نقل أجهزة الاستشعار بالتوازي من العمود إلى العمود ويمكن نقلها إما إلى اليمين أو اليسار حسب التعريف الوارد في بروتوكول فحص خاص. الآبار مع اللون الرمادي تمثل العازلة مقايسة بينما الأحمر والأزرق والأخضر يمثل البروتين يجمد، شريك وملزم ليغاتفاحة، على التوالي.
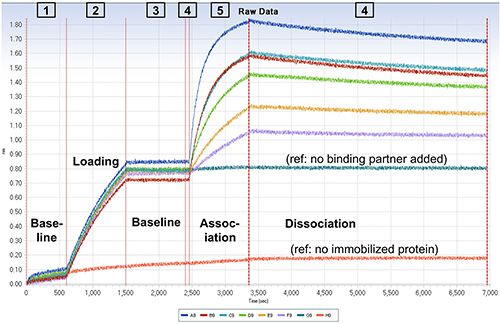
الرقم 3. القبض على الشاشة تظهر البيانات الخام من فحص BLI. خطوط حمراء عمودية تشير الحركة من أجهزة الاستشعار بين الخطوات مقايسة للبروتوكول. يتم الرمز أنواع خطوة على الصورة. مواقع العازلة وعينات وكما هو مبين في الشكل 2. كما لاحظ الأرقام على طول الجزء العلوي من الرسم البياني، تم نقل أجهزة الاستشعار streptavidin المغلفة بين أعمدة مختلفة من لوحة عينة بالترتيب التالي: 123454. أسطورة تحت الرسم البياني يشير اللون لتتبع البيانات في كل أجهزة الاستشعار. في خطوة جاري التحميل، وحضنت كل أجهزة الاستشعار باستثناء H مع 50 نانومتر المعقدة البيروكسيديز "ε" الوحيدات. في خطوة الرابطة، وحضنت أجهزة استشعار مع تركيزات نانومتر من "ε" المنضب F 1: 30 (A، H)، 20 (B)، 15 (ج) و 10 (د) و 5 (E)، 2.5 (F)، 0 نانومتر (G). اضغط هنا لمشاهدة صورة أكبر.
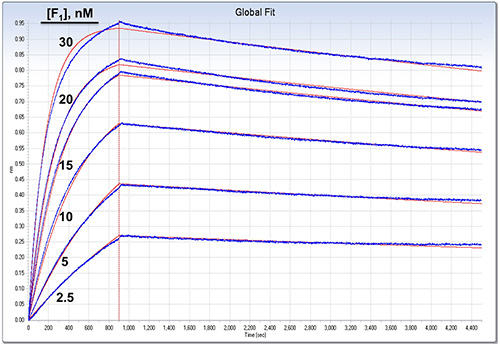
تمت معالجة الشكل 4. القبض على الشاشة من البيانات التي تم تحليلها من فحص BLI من الشكل 3. البيانات وتركيبها كما هو موضح في النص. وتظهر جمعية والتفكك سوى خطوات، مقسوما على خط أحمر العمودي. منحنيات البيانات التي تتم معالجتها هي الأزرق، والانحدار غير الخطية يناسب من 1:1 التحليل العالمي وترد في الحمراء. النتائج المناسب العالمي 8: ك أ = 2 × 10 5 م -1 ق -1 (± 0.1٪)، ك د = 4.8 × 10 -5 ق -1 ("±" 0.1٪)، مما أسفر K D = 0.24 نانومتر. صلاح صالح: R2 = 0.999054. كانت المعلمة ملزمة القصوى (R كحد أقصى) تناسب بشكل منفصل لكل الاستشعار، مع القيمة المتوسطة = 0.813 نانومتر ("±" 0.0803). اضغط هنا لمشاهدة صورة أكبر.
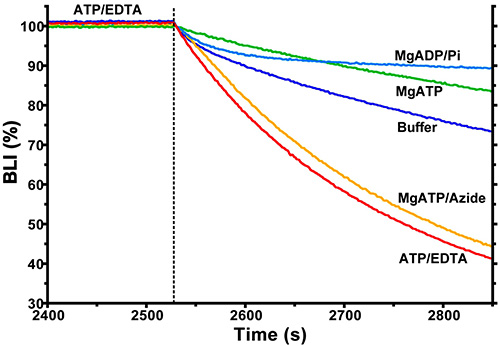
الشكل 5. نتائج من فحص BLI تظهر آثار تفارغي من بروابط على التشكل وε. كان لا بد F 1 (ε) لاستشعار يجمد ε في وجود ATP 1 ملم / EDTA. وترد في نهاية المرحلة الجمعيات وجزء من المرحلة التفكك. خلال الخطوة التفكك، أدرجت بروابط متميزة لF 1 مواقع الحفاز (المدرجة لكل التتبع) لمراقبة آثارها على تفارغي تفكك F 1 من ربط أجهزة الاستشعار ε.
Discussion
الأدوات المتاحة حاليا لBLI تسمح إنتاجية كبيرة والمرونة في المقايسات للتفاعلات الجزيئية البيولوجية. يتم الاستغناء عينات حل مختلف في الآبار لوحة microtiter الأسود، ومجموعة من أجهزة الاستشعار BLI موازية مبرمجة لتتحرك ذهابا وإيابا بين أعمدة من الآبار على طبق من ذهب. وأثار العينات التي تهز المدارية في جميع أنحاء الفحص. النظام المستخدم هنا يحتوي على 8 أجهزة الاستشعار ويستخدم لوحة عينة 96 جيدا، ولكن يستخدم نظام آخر 16 أجهزة الاستشعار وصفيحة عينة 384 جيدا. وبالتالي، والتفاعل بين جزيء حيوي يجمد أجهزة الاستشعار وشريك ملزمة لها في الحل يمكن اختبارها تحت ظروف مختلفة مع أجهزة استشعار متعددة في نفس الوقت. على سبيل المثال، في مقايسة الأولى المعروضة هنا مع الوحيدات ε المثبطة يجمد، تم قياس التفاعلات مع ستة تركيزات مختلفة من إنزيم (الشريك ملزم) في موازاة (أرقام 3 و 4). يسمح هذا التحليل الشامل لمحدداتشمال شرق زوج واحد من الثوابت معدل (ك لذلك، ك د) عن صافي ملزمة والتفكك، وبالتالي ثابت التوازن التفكك (K D = ك د / ك أ)، والتي تتفق بشكل وثيق مع ثابت المثبطة (K I) تحدد من المقايسات حل تثبيط انزيم بواسطة ε 8. تظاهر هناك نوع ثان من التجربة (الشكل 5) التي BLI يمكن أيضا رصد الآثار تفارغي من بروابط صغيرة على التفاعل بين اثنين من البروتينات؛ تمت مقارنة آثار بروابط مختلفة في نفس الوقت. هناك قيود للكشف عن آثار بروابط تفارغي، منذ إشارة BLI يعتمد على كتلة جزيء ملزمة، ويمكن الكشف عن مباشرة ملزمة للمركبات الصغيرة في ظل الظروف الأمثل 13. ومع ذلك، في مقايسة من الشكل 5، الشريك ملزم، F 1، وكان مجمع البروتين كبيرة (347 كيلو دالتون ~)، لذلك لم يتأثر إشارة BLI لفي ملزمة / التفكك بشكل كبير عن طريق الإعلانditional ربط بروابط صغيرة مثل ATP (~ 500 دا) إلى مجمع F 1. وقد أكد هذا مع المقايسات التي بروابط هذه لم تؤثر على إشارة BLI لF 1 منضم إلى النموذج اقتطاع من ε تفتقر إلى المثبطة CTD 8. وبالتالي، يجب أن المقايسات من آثار تفارغي تنظر كتلة تفارغي يجند النسبية للجماهير من البروتينات المتفاعلة، وتشمل الضوابط ويفضل لاختبار استجابة BLI مباشرة للالملزمة ليجند.
نلاحظ أن الخطوات والتعديلات معينة في بروتوكول التجريبية يمكن أن تكون حاسمة لتحقيق نتائج أفضل وتحليل أكثر دقة. على سبيل المثال، كما في بروتوكول الموصوفة هنا (انظر الخطوات 1.2.3، 1.2.5)، وهو فحص المعدة للتحليل عالمي ملزم من والثوابت معدل تفارق ينبغي أن تشمل خطوة أساسية إضافية (راجع الخطوة 1.2.3) في عمود جديد الآبار العازلة (الشكل 2، العمود 4) قبل الخطوة جمعية، وأجهزة الاستشعار وينبغي أن يكون صeturned إلى أن نفس العمود الآبار العازلة للخطوة التفكك (راجع الخطوة 1.2.5). يمكن وجود كل أجهزة الاستشعار في نفس البئر (مع نفس الخصائص البصرية) قبل وبعد خطوة جمعية تحسين التصحيح بين الخطوة (الخطوة 3.4) للجمعية الخطوات / التفكك، وهذا يسهل تركيب الحركية العالمية من آثار بيانات متعددة (كما في الشكل 4). أيضا، لفحوصات الأولية التي هي أكثر من المعروضة هنا، البرنامج لديه خيار لتقصير أو تمديد الوقت من أي خطوة خلال فحص (في حين أنه هو الخطوة النشط). هذا أمر مفيد، على سبيل المثال، إذا كان الأمثل إشارة التحميل غير معروف بالفعل، أو إذا كان هناك حاجة لمزيد من الوقت للسماح كافية لتحقيق تفارق مناسبا لمعدل التفكك.
غير محدد ملزم للشريك ملزم على سطح مستشعر يمكن أن يكون مشكلة للطرق خالية من التسمية مثل SPR وBLI. في المقايسات لدينا، وهذا تم تصغير فعال من قبل بما في ذلك جيش صرب البوسنة في المخزن المؤقت الفحص. كما هو الحال في طخة مناعيةتينغ البروتوكولات، والبروتينات الأخرى من BSA يمكن استخدامها، وتركيزات منخفضة من المنظفات قد تقلل أيضا غير محددة ملزمة (يتم استخدام Tween20 في حركية العازلة من المورد). حتى مع الحد الأدنى غير محددة ملزمة، وينبغي أن تشمل معظم المقايسات استشعار مراقبة واحدة على الأقل دون البروتين يجمد ولكن مع أعلى تركيز من شريك ملزم في خطوة جمعية (انظر الشكل 3، وأجهزة الاستشعار H)؛ الطرح من غير محدد ملزم المتبقية (واضمحلاله خلال الخطوة التفكك) يمكن أن تحسن بشكل كبير يحلل الحركية لمحددة وملزمة / التفكك التي تجري دراستها. من ناحية أخرى، المقايسات مرة الأولي تؤكد أن البروتين البيروكسيديز يبقى ثابت ملزمة بعد خطوة التحميل (انظر الشكل 3، وأجهزة الاستشعار G)، التي تحكم يمكن حذفها وأن استشعار يمكن استخدامها لشرط العينة.
لتحديد قوية من الجمعيات والتفكك الثوابت معدل استخدام BLI، تركيزات متعددة من بشريك inding ينبغي أن تستخدم وينبغي أن يكون لائقا كل آثار البيانات عن طريق التحليل العالمي، إن أمكن (كما في أرقام 3 و 4). من الناحية المثالية، ينبغي أن مجموعة من تركيزات تمتد ~ 10 أضعاف فوق وتحت K D المقدرة. في حالتنا، مع تفاعل عالية تقارب (K D = 0.25 نانومتر)، كان الضجيج إشارة إلى الفقراء لحركية ملزم مع شبه K تركيزات D. وبالتالي، استخدمت تركيزات شريك ملزم فوق K D مثل التي تم الحصول عليها تغييرات كبيرة في معدلات وحظ ومستويات ملزمة (انظر الشكل 3). أيضا، كان يستخدم خطوة تفارق طويلة لتحسين الثقة في تركيب معدل التفكك البطيء. مع التفاعلات تقارب عالية، فمن الممكن أيضا أن التفكك البطيء مبالغ فيه إعادة الربط خلال الخطوة التفكك، حيث تتم فحوصات BLI في عينة أثارت بدلا من استمرار تدفق أكثر من أجهزة الاستشعار، أما بالنسبة SPR. يمكن اختبار هذه الأداة المحتملة مع مايقول فيها تفارق العازلة يحتوي على 'بالوعة' من البروتين تنافسية الزائدة التي تربط شريك ملزمة فصلها ويمنعها من إعادة الربط إلى البروتين يجمد الاستشعار 14. في نظامنا، وقد تم ذلك من خلال مقارنة النتائج مع وبدون nonbiotinylated (> 10 أضعاف أعلاه K D) في التفكك بشكل جيد، وأكدنا أن إعادة الربط كان لا يمثل مشكلة كبيرة 8. أخيرا، إذا مجموعات من النتائج الحركية لا تناسب بشكل جيد من خلال تحليل العالمي (1:1 أو 2:01 النماذج المتاحة)، وهناك خيارات أخرى لتحليل المشاكل. على سبيل المثال، بدلا من اختيار "العالمية (كامل)" (في الخطوة 4.2)، "محلي" ويمكن اختيار لتناسب كل أثر استشعار مستقل. إذا ملزمة يلي نموذج 01:01 بسيطة، بالتآمر معدلات ملزمة لاحظ (ك OBS) مقابل تركيزات ملزمة شريك يجب أن يظهر الاعتماد الخطية، مع المنحدر يساوي الدرجة الثانية، ومعدل الربط الجوهرية. علامة التبويب تحليل البرنامج لديه "XYالرسم البياني "النافذة التي تسمح برؤية سريعة لهذه العلاقة.
القيد واحد من الأداة التي استخدمناها هو مدى درجة الحرارة المتاحة. مع مجموعة من 2 درجة مئوية فوق درجة الحرارة المحيطة إلى 40 درجة مئوية، والجزيئات فقط التي هي مستقرة في هذا النطاق يمكن استخدامها. وعلاوة على ذلك، يتم تحليل الحرارية يحد من مدى درجة حرارة ضيق. الحد جنرال آخر هو أن الحد الأقصى للوقت الاختبار هو ~ 4 ساعة، وبعد ذلك، تحدث بسبب تبخر عينات من القطع الأثرية لوحة microtiter مفتوحة.
BLI ينطوي على ترتيب بسيط نسبيا بالمقارنة مع SPR. يتم نقل أجهزة الاستشعار بين الأعمدة من الآبار مع وحدات التخزين الثابتة، بدلا من تدفق مستمر من العينة على أجهزة الاستشعار. وإن لم يكن حساسة مثل SPR، وأقل تأثرا بالتغيرات BLI في معامل الانكسار بسبب التغييرات في تركيبة العينة. عموما، هذا مع السهولة النسبية في الاستخدام والمرونة للصك في تحويل بين الظروف الفحص، BLI توفيرسا أداة متعددة الاستعمالات لفحوصات في المختبر من التفاعلات الجزيئية البيولوجية.
Disclosures
يعلن الكتاب أن لديهم أي تضارب في المصالح.
Acknowledgements
نشكر FortéBio لتقديم الرسومات المستخدمة في الشكل 1. وأيد هذا العمل من قبل المعاهد الوطنية للصحة منح GM083088 إلى TMD
Materials
| Name | Company | Catalog Number | Comments |
| Octet-RED96 | Pall/FortéBio | 30-5048 | |
| Bovine Serum Albumin | Sigma | A6003-10G | Fatty Acid free |
| Biosensor/Streptavidin | Pall/FortéBio | 18-5019 | Tray of 96 sensors |
| Microtiter plate | Greiner Bio-one | 655209 | Black, Polypropylene |
| Data Acquisition software | Pall/FortéBio | Version 6.4 | Newer versions available |
| Data Analysis software | Pall/FortéBio | Version 6.4 | Newer versions available |
References
- Nirschl, M., Reuter, F., Voros, J. Review of Transducer Principles for Label-Free Biomolecular Interaction Analysis. Biosensors. 1, 70-92 (2011).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal. Bioanal. Chem. 377, 528-539 (2003).
- Piehler, J., Brecht, A., Gauglitz, G. Affinity Detection of Low Molecular Weight Analytes. Anal. Chem. 68, 139-143 (1996).
- Duncan, T. M., Hackney, D. D., Tamanoi, F. The Enzymes. Energy Coupling and Molecular Motors Vol. XXIII, 203-275 (2004).
- Feniouk, B. A., Suzuki, T., Yoshida, M. The role of subunit ε in the catalysis and regulation of FOF1-ATP synthase. Biochim. Biophys. Acta. 1757, 326-338 (2006).
- Cingolani, G., Duncan, T. M. Structure of the ATP synthase catalytic complex (F1) from Escherichia coli in an autoinhibited conformation. Nat. Struc. Mol. Biol. 18, 701-707 (2011).
- Mirsaeidi, M. After 40 years, new medicine for combating TB. Int. J. Mycobacteriol. 2, 1-2 (2013).
- Shah, N. B., Hutcheon, M. L., Haarer, B. K., Duncan, T. M. F1-ATPase of Escherichia coli: The ϵ-inhibited state forms after ATP hydrolysis, is distinct from the ADP-inhibited state, and responds dynamically to catalytic site ligands. J. Biol. Chem. 288, 9383-9395 (2013).
- Burgess, T. L., Ross, S. L., Qian, Y. -. x., Brankow, D., Hu, S. Biosynthetic Processing of neu Differentiation Factor: glycosylation, trafficking, and regulated cleavage from the cell surface. J. Biol. Chem. 270, 19188-19196 (1995).
- Loo, T. W., Clarke, D. M. Membrane Topology of a Cysteine-less Mutant of Human P-glycoprotein. J. Biol. Chem. 270, 843-848 (1995).
- Tsao, K. -. L., DeBarbieri, B., Michel, H., Waugh, D. S. A versatile plasmid expression vector for the production of biotinylated proteins by site-specific, enzymatic modification in Escherichia coli. Gene. 169, 59-64 (1996).
- Dayne, D. BioLayer Interferometry (BLI) - How Does it Work?. FortéBio newsletter In Interactions. 5, 8-9 (2012).
- Wartchow, C., et al. Biosensor-based small molecule fragment screening with biolayer interferometry. J. Comput. Aided Mol. Des. 25, 669-676 (2011).
- Abdiche, Y., Malashock, D., Pinkerton, A., Pons, J. Determining kinetics and affinities of protein interactions using a parallel real-time label-free biosensor, the Octet. Anal. Biochem. 377, 209-217 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved