Method Article
Kantitatif Çalışmalar için Küçük Hayvan Damar Sisteminin Hızlı Tam Montajlı Yüksek Çözünürlüklü Görüntülenmesi
Bu Makalede
Özet
Bu protokol, ışık tabakası floresan mikroskobu kullanılarak kantitatif tam montajlı üç boyutlu vasküler görüntüleme için hızlı bir yöntem sunar. Yöntemin etkinliği, civciv embriyo modelinin faringeal ark arter sistemi kullanılarak, hesaplamalı akışkanlar dinamiği yoluyla ölçülen hemodinamik kuvvetler ile gösterilmiştir.
Özet
Kardiyovasküler gelişim ve hastalıkların küçük hayvan modellerinde, kan akışının konuya özgü hesaplamalı simülasyonları, deneysel olarak ölçülmesi zor olan hemodinamik metriklerin kantitatif değerlendirmelerini mümkün kılar. Hesaplamalı akışkanlar dinamiği simülasyonları, mekaniğin kardiyovasküler fonksiyon ve hastalığın ilerlemesindeki kritik rollerine ışık tutmaktadır. İlgilenilen gemilerin yüksek kaliteli hacimsel görüntülerinin elde edilmesi, morfolojik ölçüm ve akış niceliği sonuçlarının doğruluğu ve tekrarlanabilirliği için merkezi öneme sahiptir. Bu çalışma, ışık tabakası floresan mikroskobu kullanılarak küçük hayvan damar sisteminin tam montajlı yüksek çözünürlüklü görüntülenmesi için hızlı, uygun maliyetli ve erişilebilir bir yöntem önermektedir. Modifiye edilmiş iDISCO+ (solventle temizlenmiş organların immünoetiketleme özellikli üç boyutlu görüntülemesi) ışıklı tabaka numune hazırlama protokolü, (1) vaskülatürü bir floresan ajan ile etiketlemeyi, (2) numuneyi korumayı ve (3) numuneyi şeffaf hale getirmeyi içerir. İmmünohistokimyasal boyama kullanan klasik iDISCO+'dan farklı olarak, yazarlar vasküler endotelyumu, "endo-boyama" olarak adlandırılan bir işlemde, foto-ağartmaya karşı oldukça dirençli, uygun fiyatlı, spesifik olmayan bir floresan boya olan FITC etiketli poli-L-lizin ile etiketlerler. Hızlı etiketleme, numune hazırlama süresini yaklaşık dört haftadan 3 günün altına düşürür. Ayrıca, temizleme maddesi ve görüntüleme solüsyonu olarak minimum düzeyde tehlikeli çözücü etil sinnamatın (ECi) kullanılması, numunelerin işlenmesini daha güvenli ve daha geniş bir görüntüleme tesisi yelpazesiyle uyumlu hale getirir. Önerilen protokol, civciv embriyolarında 3. gün (HH18) ile 8. gün (HH34) arasında değişen kardiyovasküler sistemin yüksek oranda çözülmüş ışık tabakası floresan mikroskobu görüntü yığınlarını elde etmek için uygulanır. Bu çalışma ayrıca, bu yöntemin 5. gün (HH 26) civciv embriyosunun 3D rekonstrüksiyonu ve hesaplamalı hemodinamik modellemesi yoluyla vasküler kantitasyon için uygunluğunu göstermektedir.
Giriş
Kardiyovasküler fizyoloji ve hastalığın doğru çalışmaları için hacimsel görüntüleme gereklidir. Kantitatif görüntüleme, sağlam hacimsel boyutlara sahip yüksek çözünürlüklü görüntü yığınları üretir. Numunelerin her ikisi de in-vivo morfolojilerini ve lümen hacimlerini korumak için korunmalı ve aynı zamanda tek tip bir yüksek çözünürlük kapasitesinde görüntülenmelidir. Kullanıcı, yüksek çözünürlüklü görüntüleme yığınlarından, damar şekillerinin, yapısının ve bağlantısının eksiksiz bir şekilde görüntülenmesine olanak tanıyan yüksek kaliteli üç boyutlu vasküler işlemeler oluşturabilir1.
Kardiyovasküler yapılar, iki boyutlu, ayrık bir mercek aracılığıyla incelendiğinde doğru bir şekilde yakalanamayan karmaşık üç boyutlu anatomik özelliklere sahiptir. Stereoskop, geniş alan, morfolojik görüntüleme ve histolojik kesitler, karmaşık üç boyutlu varyasyonları yakalamada yetersizdir 1,2,3. Mikro ve nano bilgisayarlı tomografi görüntüleri, kantitatif küçük hayvan hacimsel görüntülemeiçin altın standarttır 1,4, ancak biyolojik topluluk arasında yaygın olarak erişilebilir veya benimsenmemiştir. Doku temizleme ve tüm organ/küçük hayvan mikroskobundaki son yenilikler, tüm dağı temizleme ve vasküler etiketleme tekniklerinin kantitatif uygulamalarına izin vermiştir5,6,7. Doku temizleme, doku örneklerinde ışığın saçılmasını homojenize etmek için çalışır, böylece ışık saçılımı veya absorpsiyonu olasılığını azaltarak ortam boyunca ışık yayılımındaki gecikmeleri azaltır. Yüksek şeffaflık, floresan sinyal etiketlemesinin8 antijenisitesini veya parlaklığını etkileyebilecek sıkı doku işleme gerektirir. Işık tabakası mikroskobu, biyologlar tarafından yaygın olarak benimsenen hızlı, güçlü bir görüntüleme aracı olarak ortaya çıkmıştır9 ve taramalı mikroskoplara göre birkaç kat daha büyük bir hız kazancı ve 1 cm'den büyük örnekleri görüntüleme kapasitesi sunar. Işık tabakası floresan mikroskobu (LSFM) aracılığıyla, bir lazer, konfokal mikroskopiye kıyasla daha yüksek hız ve derinlikle bir numune kesitini aydınlatır; Bu nedenle yöntem, yüksek numune şeffaflığı gerektirir.
Burada yazarlar, yöntemin erken dönemden geç kardiyovasküler gelişime kadar etkinliğini sergilemek için civciv embriyo hayvan modelinde endo-boyama10 ile birleştirerek en son iDISCO+ temizleme yöntemlerini uyarlıyorlar. iDISCO (solventle temizlenen organların immüno-etiketleme özellikli üç boyutlu görüntülemesi), sulu temizleme tabanlı yöntemlerin aksine, solvent buharlaşmasının neden olduğu görüntüleme artefaktlarına maruz kalmayan organik solvent bazlı bir temizleme yöntemidir. iDISCO, iDISCO+'dan farklıdır, çünkü birincisinin tetrahidrofuran dehidrasyon aşaması (iDISCO) daha hafif bir Metanol dehidrasyonu ve ardından bir lipid ekstraksiyon aşaması (iDISCO+) ile değiştirilir. iDISCO+ temizleme yönteminin avantajları arasında büyük yetişkin numunelerin ve embriyoların immüno-etiketlemesi, düşük doku büzülmesi ve yüksek şeffaflık yer alır 8,11. Daha da önemlisi, iDISCO+, geleneksel histolojide olduğu gibi tüm doku düzeyinde organizasyon hakkında bilgi eksikliği olan küçük bölgelerin örneklenmesiyle sınırlı kalmak yerine, büyük organ örnekleri veya tüm embriyo hakkında bilgi elde etmek için geleneksel biyoloji immünoetiketleme tekniklerini genişleterek yüksek çözünürlüklü görüntü yığınlarının oluşturulmasına olanak tanır9. iDISCO+'nın dezavantajları arasında genetik olarak kodlanmış floresan proteinlerin korunmaması yer alır11. Endo-boyamanın doku etiketleme yöntemi ilk olarak, sol ventrikül apeksinde 0.5 mg / ml FITC-poli-L-lizin ile perfüze edilen HH31-HH36 civciv embriyo kalpleri kullanılarak kardiyovasküler kusurlar için yüksek verimli bir tarama olarak tanıtıldı. Boyanın fiksasyon ve depolamadan önce 4 dakika bağlanmasına izin verildi10.
Bu çalışma, aynı FITC-poli-L-lizin konsantrasyonunun daha geniş bir embriyo yelpazesi (HH18 - HH34) için kullanılabileceğini, ancak parlak etiketli damarlar sağlamak için ideal fiksasyon süresinin (5-10 dakika arasında) değişebileceğini buldu. Mevcut endo-DISCO tekniğinin kullanıcıları, çözeltinin istenen tüm damarları etiketlemek için çok viskoz olduğu kanıtlanırsa, boya konsantrasyonunu ayarlamak (bir seferde 0.1 mg / mL azaltarak) isteyebilir, ancak önce fiksasyon süresini ayarlamaları ve boya konsantrasyonunu ayarlamadan önce sol ventrikülün kas kasılmasını optimize etmeleri teşvik edilir. Yazarlar, 0.1 mg / mL'lik bir konsantrasyonda endo-boyamaya çalıştılar ve boyanın küçük damarlardan daha kolay yayılırken, PFA perfüzyonu üzerine daha kolay yıkandığını buldular. Yazarlar, mevcut teknikle üretilen yüksek çözünürlüklü görüntüleme yığınlarının, hesaplamalı hemodinamik modelleme için yeterli kalitede olduğunu göstermektedir. Basınç ve duvar kesme gerilmesi dağılımları dahil olmak üzere kan akış yolları ve karşılık gelen hemodinamik kuvvetler, yalnızca hesaplamalı akış simülasyonları 1,12 ile çözülebilen karmaşık lokalize modellerde meydana gelir. Bu biyomekanik kuvvetler, bitişik kardiyovasküler dokuların davranışını etkiler ve vasküler adaptasyonu, büyümeyi ve yeniden şekillenmeyi tetikler13. Lokal hemodinamik kuvvet değerlerinin anlaşılması, kardiyovasküler fonksiyonun mekanik düzenleyicilerine ve hastalığın başlangıcına veya ilerlemesine kritik bir ışık tutmaktadır2.
Protokol
Laboratuvar Hayvanları Refahı Ofisi, Halk Sağlığı Hizmeti politikasını, civciv modeline ancak yumurtadan çıktıktan sonra "omurgalı hayvan" olarak uygulandığı şeklinde yorumlamaktadır. Bu embriyolar benzer şekilde Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) yargı yetkisinden muaftır. İlgili Ulusal Sağlık Enstitüleri sık sorulan sorulara şu adresten erişilebilir: http://grants.nih.gov/grants/olaw/faqs.htm#ApplicabilityofthePHSPolicy.
1. Embriyo toplama, etiketleme ve fiksasyon
- Fashion, bir microforge 1,12 kullanarak 0.75 iç çaplı cam kılcal çubukları kesilmiş mikro iğnelere çekti.
NOT: Gerekli ucun boyutu, istenen hayvan yaşına/akış hızına bağlıdır. Mikroiğne alternatif olarak mikrodiseksiyon forseps veya makas kullanılarak büyük ölçüde azaltılmış hassasiyetle kesilebilir. - Tyrode'un çözeltisini yaklaşık 38°C'ye ısıtın.
- 0.5 mg / mL'lik bir stok çözeltisi hazırlamak için FITC poli-L-lizin katısını Tyrode çözeltisi içinde çözün.
NOT: Bu konsantrasyon, civciv embriyo arterlerini etiketlemek için optimize edilmiştir. Diğer doku tipleri için optimal konsantrasyon değişebilir. Ekstra stok çözeltisi -20 °C'de saklanmalıdır. - Kuş embriyosunu (mevcut civciv kardiyak çalışması için HH18 (3. gün) ile HH34 (8. gün) arasında değişen) yumurta sarısından embriyonun etrafını kavisli uçlu makasla keserek ve embriyoyu ılık Tyrode solüsyonu ile doldurulmuş 35 mm'lik bir Petri kabına aktarmak için bir transfer pipeti veya bir spatula kullanarak inceleyin.
- Embriyoyu saran koryonik ve allantoik zarlar ile kalbin etrafındaki zar zarını ince uçlu forsepslerle dikkatlice zarlara minik (~0.1 mm) kesiler yaparak ve embriyodan çekerek çıkarın.
- Kalbin atmasını sağlamak için embriyoyu ılık Tyrode solüsyonu ile doldurulmuş yeni, temiz bir Petri kabına aktarın.
- 5 mL'lik bir plastik şırıngayı ılık Tyrode solüsyonu ile doldurun. 0-20 μL'lik plastik pipet ucunun geniş ucunu kesin ve şırınganın düz ucuna takın. Şırınga şimdi ince pipet ucu çapına kadar uzatılmıştır.
- Yeni sabitlenmiş pipet ucu şırınga aparatına 0,03 inç iç çaplı silikon borunun bir segmentini takarak bir "enjeksiyon hattı" oluşturun (adım 1.7). Borunun diğer ucuna bir cam kılcal mikro iğne takın.
- Mikroiğneyi bir mikromanipülatöre bağlı mikroenjeksiyon tutucusuna monte edin. Silikon hortumu ve mikro iğneyi hava kabarcıklarından arındırın.
- Mikromanipülatörü kullanarak, iğneyi kalbin tepesine yerleştirin ve Tyrode solüsyonunu kalbe yavaşça enjekte ederek embriyo 1,12'yiperfüze edin. Kandan büyük ölçüde temizlenene kadar embriyoyu perfüze etmeye devam edin.
- İğneyi ve enjeksiyon hattını yerleştirme yerinden geri çekmek için mikromanipülatörü kullanın ve iğneyi bir sonraki enjeksiyon hattının hazırlanması sırasında rahatsız edilmeyecek şekilde yönlendirin. Silikon boruyu iğneden ve şırıngadan çıkarın.
NOT: Bazı kullanıcılar iğneyi kalbe bağlı tutmayı en uygun bulabilir, bu durumda kullanıcı iğneyi yerinde tutarken iğne ile şırınga arasındaki silikon boruyu çıkarmalıdır. - Vasküler endotelyumu yeşil floresan ile etiketlemek için endo-boyama yapın.
- Bir mikropipet kullanarak, FITC sıvı bariyerinin önünde hava kabarcıkları oluşturmamaya dikkat ederek silikon boruya 20-40 μL FITC poli-L-lizin stok solüsyonu yükleyin.
- Tyrode solüsyonu ile doldurulmuş şırıngayı yeniden takın ve gerekirse iğneyi yeniden yerleştirerek kalbin tepesine yavaşça enjekte etmek için mikromanipülatörü kullanın. FITC poli-L-lizin dağıldıktan sonra ve kalbe herhangi bir hava kabarcığı girmeden önce iğneyi çıkarın.
- FITC poli-L-lizin'in embriyoda 5-10 dakika oturmasına izin verin.
NOT: (isteğe bağlı kalite kontrolü) Floresanı doğrulamak için floresan stereo veya makroskop ile bir resim çekin. Resim, embriyo temizleme tamamlandıktan sonra bir dehidrasyon faktörünün belirlenmesine yardımcı olmak için kullanılabilir.
- 5 mL'lik bir şırıngayı %4 paraformaldehit (PFA) ile doldurun ve üçüncü bir enjeksiyon adımı için silikon enjeksiyon tüpüne takın.
- Tüm kardiyovasküler yapılar tam hacim kapasitesine gelene ve doku daha opak hale gelmeye başlayana kadar embriyoyu 1,12% 4 PFA ile perfüze edin.
- Embriyoyu, numuneyi kaplamaya yetecek kadar% 4 PFA ile doldurulmuş 2-5 mL'lik bir şişeye yavaşça yükleyin. Embriyoyu aşırı deforme etmemeye özen gösterin.
NOT: Numunenin ezilmesini veya deforme olmasını önlemek için ilgilenilen numune için yeterince büyük bir şişe seçin. - Embriyoyu gece boyunca 4 ° C'de bir çalkalayıcı ile inkübe edin.
2. Embriyo dehidrasyonu ve temizlenmesi
- %4 PFA'yı dikkatlice pipetleyin.
NOT: Bu noktadan sonra, doku hasarını veya deformasyonunu önlemek için embriyo ile doğrudan temastan kaçının. - Embriyoyu yıkamak için, embriyoyu oda sıcaklığında 30 dakika boyunca hafifçe çalkalayarak taze fosfat tampon çözeltisinde (PBS) inkübe edin. Toplam 3 yıkama için iki kez daha tekrarlayın.
- Embriyoyu bir davlumbazda kurutmaya başlayın. PBS'yi dikkatlice pipetleyin ve embriyoyu oda sıcaklığında her biri 1 saat boyunca kademeli bir dizi 5 metanol inkübasyonunda inkübe edin: %20, %40, %60, %80 ve %100 metanol konsantrasyonu.
- Embriyoyu gece boyunca oda sıcaklığında taze% 100 metanol içinde bırakın.
NOT: (İsteğe bağlı durma noktası). Embriyolar -20 °C'de daha sonra kullanılmak üzere %100 metanol içinde 6 aya kadar saklanabilir. - Çeker ocakta, lipit giderme prosedürüne başlayın. Embriyoyu 2: 1 (hacimden hacme) DCM'de inkübe edin: metanol çözeltisi oda sıcaklığında 3 saat boyunca hafifçe çalkalayın.
DİKKAT: DCM toksiktir ve dumanlık içinde kullanılmalıdır. DCM ile çalışırken ekstra önlemler alın. Çift eldiven ekstra bir bariyer sağlamaya yardımcı olabilir. - Etil sinnamatı (ECi) 4 °C'den çıkarın ve çözülmesi için oda sıcaklığında bırakın.
- Embriyoları taze% 100 DCM'de oda sıcaklığında 15 dakika çalkalayarak yıkayın. Toplam 2 yıkama elde etmek için %100 DCM yıkamasını tekrarlayın.
- DCM'yi pipetleyin ve embriyoyu %100 ECi'de inkübe edin. Embriyoyu yaklaşık 1 saat içinde temizlenene kadar ECi'de bırakın. Gerekirse tüpü hafifçe sallayın.
- (İsteğe bağlı doğrulama adımı) Floresan stereo veya makroskop ile temizleme ve damar boyama kalitesini inceleyin. Evre / yaşa özgü dehidrasyon ölçekleme faktörünü belirlemek için embriyonun bir fotoğrafını çekin.
- Temizlenmiş embriyoyu 4 ° C'de, görüntülenmeye hazır olana kadar 6 aya kadar saklayın ve embriyoyu ışıktan koruyun.
3. Verilerin elde edilmesi
- Embriyoları görüntülemek için ışıklı bir floresan mikroskobu kullanın. Optik olarak temizlenmiş bir embriyonun başını süper yapıştırıcı jel kullanarak bir cam kılcal damara yapıştırın.
- Cam kılcal damarı numune tutucuya monte edin, görüntüleme odasını ECi ile doldurun ve embriyoyu görüntüleme odasına indirin.
- Parametreleri ayarlayın ve görüntüleme gerçekleştirin.
4. Kantitatif uygulama: 3D rekonstrüksiyon ve hesaplamalı akışkanlar dinamiği modelleme
NOT: Bu adımlarda, hafif sayfa tarafından oluşturulan yüksek çözünürlüklü görüntü yığınları, 3B anatomik rekonstrüksiyon ve hesaplamalı akışkan dinamik modelleme için açık kaynaklı yazılım SimVascular14'e yüklenir. Ayrıntılı eğitimler SimVascular web sitesinde mevcuttur (bkz. Rekonstrüksiyon, ilgilenilen kaplarda yol çizgileri oluşturmaktan, yollar boyunca 2B segmentasyonlar oluşturmaktan ve yüksek segmentasyonları bir 3B katı modelde birleştirmekten oluşur. Hesaplamalı modelleme, örgülü bir geometri hazırlamaktan, sınır koşullarını tanımlamaktan ve simülasyonları çalıştırmaktan oluşur.
- Dosya altında yeni bir SVProject oluşturun ve Görüntüler'e sağ tıklayarak ve ardından görüntü ekle/değiştir'e tıklayarak yüksek çözünürlüklü bir açık levha görüntüleme yığını yükleyin.
- Vasküler anatomileri in silico olarak yeniden yapılandırmak için yazılım eğitim adımlarını izleyin.
- Yollar'a sağ tıklayıp yol oluştur'u seçerek bir yol çizgisi oluşturun. İlgilendiğiniz bir gemi boyunca yol işaretleyicileri yerleştirin. İlgilendiğiniz her gemi için tekrarlayın.
- Oluşturulan her yol çizgisi için, Segmentasyonlar'a sağ tıklayarak ve Kontur Grubu Oluştur'u seçerek 2B damar kesitlerini izleyin. Gemi yolunu seçin ve manuel segmentasyona başlamak için Segmentasyon altındaki gemi adına çift tıklayın.
- Tüm gemiler segmentlere ayrıldıktan sonra, Modeller'e sağ tıklayarak ve ardından model oluştur'u seçerek bir model oluşturun. PolyData türünü seçin, bir model adı girin, Katı Model Oluştur'a tıklayın ve modelin parçası olması gereken tüm segmentasyonları seçin.
- SimVascular SVMesher'da yerleşik olarak bulunan Tetgen mesher'ı çalıştırarak geometriyi birleştirin. Maksimum kenar boyutu tanımlayın ve hem yüzey hem de hacim örgüsü gerçekleştirin.
NOT: Damardaki ince geometrik ayrıntıları ve lokalize hemodinamik değişkenlikleri çözebilecek bir ağ boyutu seçin. Genel ağ boyutunu tahmin et düğmesiyle başlayın. Simülasyonları sonlandırırken bir ağ yakınsama çalışması gerekli olabilir. - SimVascular Solver'ı kullanarak hesaplamalı bir kan akışı simülasyonu ayarlayın. Simülasyonlar'a sağ tıklayıp Simülasyon İşi Oluştur'u seçerek simülasyon dosyaları oluşturun. Temel parametreleri ayarlayın ve belirli sınır koşulları için giriş ve çıkış BC'lerini seçin.
- Çözücü parametrelerini ayarlayın, Dosya Oluştur ve Simülasyonu Çalıştır sekmesine gidin, ağ dosyasını seçin, Simülasyon için Veri Dosyaları Oluştur'a tıklayın.
- Yüksek performanslı bir bilgi işlem iş istasyonu veya süper bilgisayar kullanarak simülasyonu başlatın.
Sonuçlar
Burada sunulan hızlı tam montajlı yüksek çözünürlüklü görüntüleme protokolü (Şekil 1, Tablo 1), Şekil 2, Şekil 3 ve Şekil 4'te gösterildiği gibi, civciv embriyo damar sistemi endotelinin GFP floresan olduğu ve bu nedenle erken dönemden olgun kalp gelişimine kadar embriyo aşamaları boyunca yeşil renkle belirtildiği açıkça belirtilen damar lümenlerini üretir (Şekil 4). Numune damar sistemi açıkça etiketlenmiş görünmüyorsa, poli-L-lizin konsantrasyonu, boya fiksasyon süresi ve ventriküler kasılmaların kullanımının (uygun olduğunda) doğru kombinasyonunu bulmak önemlidir (embriyoların LSFM görüntülemeden önce bir floresan stereoskop veya makroskop altında nasıl görünmesi gerektiği için Şekil 2'ye bakınız.) Sıcak Tyrode solüsyonu ile atan bir kalbin korunması ve embriyonun yumurta sarısı torbasından hızlı bir şekilde diseksiyonu, solüsyonun numune / küçük hayvan modeli boyunca difüzyonuna yardımcı olur. Poli-L-lizinin viskozitesi, stok çözeltisinin konsantrasyonu ile kontrol edilebilir. Daha az viskoz bir çözelti, numune boyunca floresan penetrasyonuna yardımcı olabilir, ancak etiketlemenin sağlamlığı PFA perfüzyonu sonrası doğrulanmalıdır. Kullanıcı, enjekte edilen hacmi artırarak ve embriyoyu PFA ile sabitlemeden önce daha fazla inkübasyon süresine izin vererek daha düşük bir poli-L-lizin stok çözeltisi konsantrasyonunu telafi etmek isteyebilir.
Şekil 5 , sunulan yöntemin 3D anatomik rekonstrüksiyon ve hesaplamalı modelleme için uygunluğunu göstermektedir. Duvar kayma gerilmesi değerleri, yazarların nano bilgisayarlı tomografi rekonstrüksiyonlarına dayanan önceki çalışmaları ile uyumludur1.

Şekil 1: Embriyo etiketleme ve fiksasyon kurulumu (üstte) ve ışık tabakası mikroskobu veri toplama kurulumu (altta). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Temizleme işlemlerinden önce ve sonra embriyolar. Temsili parlak alan ve GFP kanalı, bir floresan makroskop ile görüldüğü gibi protokolün 1. (temizlemeden önce) ve 2. adımlarından (temizlemeden sonra) geçen numuneler için aydınlatılmış embriyolar. Tüm embriyonun, özellikle dış zarların çıkarıldığı kalpte, temizlenmeden önce GFP kanalında nasıl parladığına dikkat edin. İstenen tüm damar sistemi, GFP ile temizlenmiş embriyoda açıkça etiketlenir. Ölçek çubukları = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
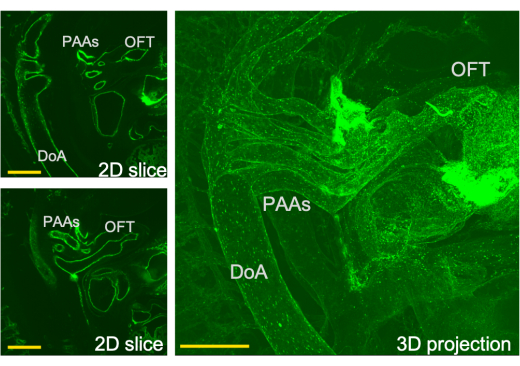
Şekil 3: LSFM tarafından elde edilen kardiyak çıkış sisteminin üç boyutlu görünümü ve bu görünümden karşılık gelen dilimler. PAA- faringeal ark arteri, OFT-çıkış yolu, DoA-dorsal aort. Ölçek çubukları = 0,5 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
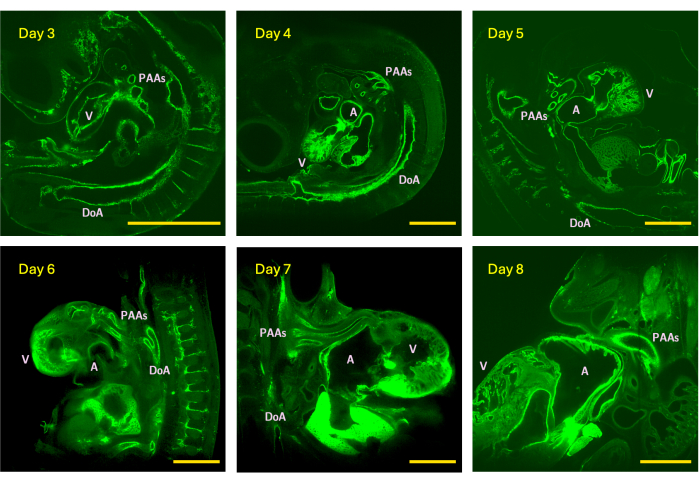
Şekil 4: 3. gün (evre HH18), 4 (HH24), 5 (HH26), 6 (HH29), 7 (HH31) ve 8 (HH34) civciv embriyolarından elde edilen LSFM görüntü yığınlarından örnek z-dilimleri. Görüntü boyutu, 5x algılama hedefi ile donatılmış dürbünün maksimum (döşeme olmadan) görüş alanını temsil eder. V - ventrikül; A - atriyum; DoA - dorsal aort; PAA'lar - faringeal ark arterleri. Ölçek çubukları = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
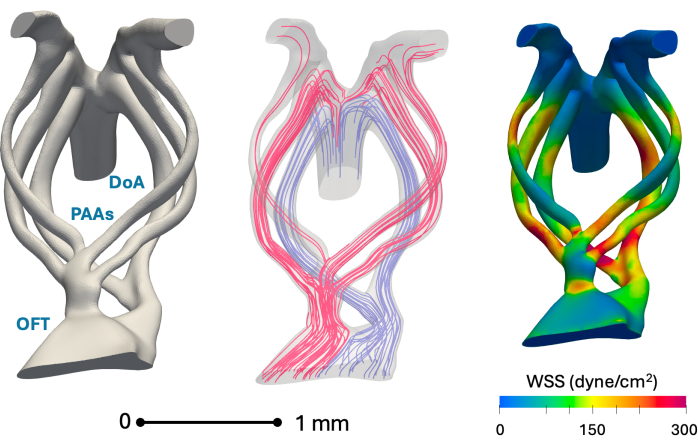
Şekil 5: 5. günün (evre HH26) aortik arkının temsili in silico anatomik rekonstrüksiyonları ve anahtar hemodinamik simülasyon sonuçları. Solda: Çıkış yolunu (OFT), faringeal ark arterlerini (PAA'lar) ve dorsal aortayı (DoA) gösteren yeniden yapılandırılmış bir vasküler anatomi modeli. Orta: Kan akışı simülasyonu kullanılarak elde edilen tepe sistolde kan akışı akış çizgileri. Kırmızı dere çizgileri büyük ölçüde kafatası bölgelerine hizmet ederken, mavi kaudal bölgelere hizmet eder. Sağ: Kan akışı simülasyonu kullanılarak elde edilen damar duvarı üzerindeki tepe sistolik duvar kesme gerilimi (WSS) dağılımı Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Gün | Adım -ları | Saat | Sıcaklık |
| 1. Gün | Embriyo hasadı | 5-10 dk/embriyo | RT (tezgah üstü) |
| FITC Endo boya | 10-30 dk / embriyo | RT (tezgah üstü) | |
| PFA perfüzyon düzeltmesi | Perfüzyon: 5-15 dk / embriyo | Perfüzyon: RT (tezgah üstü) İnkübasyon: 4 °C | |
| Kuluçka: O/N | |||
| 2. Gün | PBS yıkama | 90 dk | RT (tezgah üstü) |
| Dehidratasyon | 5 saat + O/N | RT (duman) | |
| 3. Gün | Lipid giderimi | 3,5 saat | RT (duman) |
| Temizleme | ≥1 saat | RT (tezgah üstü) |
Tablo 1: Hızlı kantitatif ışıklı levha görüntüleme için numune hazırlamaya genel bakış.
Tartışmalar
Biyolojiyi 3D olarak inceleme yeteneği, morfolojik karmaşıklığın, iç organ yapısının ve vasküler bağlantıların doğru bir şekilde anlaşılması için kritik öneme sahiptir. Doğru ve güvenilir 3D vasküler görüntüler, duvar kayma gerilmesi ve basınç dağılımı gibi temel hemodinamik parametreleri ölçmenin genellikle tek güvenilir yolu olan konuya özgü hesaplamalı hemodinamik simülasyonların da merkezinde yer alır. Burada yazarlar, LSFM kullanan küçük hayvanlarda yüksek çözünürlüklü 3D vasküler görüntüleme için hızlı ve erişilebilir bir numune hazırlama yöntemini tanıtmaktadır. Yöntem, kardiyak gelişimin kritik bir dönemini temsil eden HH18 (3. gün) ila HH34 (8. gün) civciv embriyolarının yüksek çözünürlüklü görüntü yığınlarını güvenilir bir şekilde üretir. HH24'ten (4. gün) HH34'e (8. gün), toplam embriyo boyutu ~ 30-550 mm'den3, 24 saatlik periyotta 2 kat ortalama büyüme artışı, kalp miyokard boyutu ~ 1 mm3'ten (4. gün) ~ 17 mm'yeyükselir 3 (8. gün)15. Hızlı embriyo ve kardiyovasküler büyüme nedeniyle, mevcut çalışma için görüntüler, faringeal ark arter sistemine odaklanırken 1.92-2.4 μm z adım aralığı ile HH18'de (3. gün) 0.61 μm (3. gün) ila 2.53 μm (HH34) arasında değişen düzlem içi çözünürlükle elde edildi ve tüm embriyoyu yakalarken 1.94-3.5 μm'lik bir z-adım aralığı ile 1.22 μm (HH18) ila 2.53 μm (HH34) arasında değişti (Şekil 4). Oluşturulan yüksek çözünürlüklü görüntü yığınları, 1,30 μm düzlem içi çözünürlükte ve 1,92 μm z adım boyutunda görüntülenen HH26 (5. gün) modellerinde gösterildiği gibi in silico vasküler anatomik rekonstrüksiyon ve konuya özgü hemodinamik simülasyonlar için uygundur16. Diğer tam montaj tekniklerinde olduğu gibi, önerilen yöntem, özellikle tüm organ görüntülemesiyapılırken hayvan modellerinde kullanılabilir 5,6,7. iDISCO+ tekniği yenidoğan ve yetişkin fare kalplerineuygulanmıştır 5.
Önerilen yöntemin en büyük avantajı, floresan etiketleme için FITC etiketli poli-L-lizin ve temizleme için ECi kullanımında yatmaktadır. Poli-L-lizin, fizyolojik pH altında pozitif olarak yüklenir, bu nedenle numune boyunca perfüze edilirken vasküler endotelyuma spesifik olmayan bir şekilde bağlanır. İşlem, FITC'yi damar duvarlarına hızlı ve güvenilir bir şekilde bağlar ve bunları foto ağartmaya karşı oldukça dirençli parlak, stabil bir floresan ile etiketler. Geleneksel olarak, LSFM dahil olmak üzere tam montajlı hacimsel mikroskobik görüntüleme, numunelerin immünohistokimyasal boyama ile etiketlenmesini gerektirir. Bu prosedür pahalı antikorların kullanılmasını gerektirir ve numune hazırlama süresini 4 haftaya kadar uzatır 1,8,9. Erken embriyolar, elastin veya vasküler düz kas hücreleri gibi geleneksel vasküler belirteçleri eksprese etmez ve bu nedenle spesifik antikorlarla hedeflenmesi daha zordur. Ayrıca, temizlenmiş numuneler genellikle temizleme çözeltisine daldırılmışken görüntülenir. Klasik iDISCO+ temizleme prosedürü, görüntüleme tesislerinde genellikle izin verilmeyen tehlikeli bileşik dibenzil eteri gerektirir8. ECi, laboratuvar ortamları dışında kullanımı güvenli olan ve optik ekipmana zarar verme olasılığı daha düşük olan minimum düzeyde tehlikeli bir bileşiktir. İstenirse, önerilen teknik, seçilen spektral emisyon özelliklerinin birlikte ekspresyon deneylerine izin vermesi şartıyla, immünoboyama ile birleştirilebilir veya çoğullanabilir. Çoğullama, numune etiketleme ve hazırlama süresini artırabilir.
Önerilen protokolün bazı sınırlamaları vardır. Prosedür sadece feda edilmiş embriyolara ve eksize edilmiş dokuya uygulanabilir ve uzunlamasına çalışma olasılığını ortadan kaldırır. FITC poli-L-lizin endo-boyama, hızlı ve ekonomik olsa da, yüksek düzeyde el becerisi ve hassasiyet gerektirir. Ayrıca, boya dokuya kolayca nüfuz etmediğinden, yalnızca ulaşabileceği damar duvarlarını etiketleyecek ve küçük kılcal ağları incelemek için zorluklar ortaya çıkaracaktır. Bu tür zorluklar, poli-L-lizin uygulanırken kalbin atmasını sağlayarak ve enjekte edilen çözeltinin viskozitesini/konsantrasyonunu ayarlayarak yönetilebilir. Boyanın spesifik olmaması, kap tipleri1 arasında ayrım yapmayı zorlaştırır. Enjeksiyon işlemi sırasında damar sisteminden sızan aşırı FITC poli-L-lizin, yüzeysel cilt ve zar gibi vasküler olmayan dokulara da bağlanabilir, bu da görüntüleme sırasında aydınlatıcı ışık tabakasına müdahale edebilir ve görüntüleme kalitesini düşürebilir. Kullanıcı, sızıntıyı önlemek için poli-L-lizin enjekte ederken dikkatli olmalıdır. Mevcut protokol, majör sistemik arterleri görüntülemek için erken evre civciv embriyoları kullanılarak kapsamlı bir şekilde doğrulanmıştır. FITC poli-L-lizin enjeksiyonunun konsantrasyonu, hacmi ve fiksasyon süresinin farklı kullanım durumları için daha da optimize edilmesi gerekebilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Amerikan Kalp Derneği Kariyer Geliştirme Ödülü, Scientific Interface'de Burroughs Wellcome Fund Kariyer Ödülü, Ek Girişimler Tek Ventrikül Araştırma Fonu ve UCSD Tıp Fakültesi Mikroskopi Çekirdeği (Grant P30 NS047101) tarafından desteklenmiştir. Yazarlar, endo-boyamaya girişi için Dr. Bobby Thompson'a, UCSD Tıp Fakültesi Mikroskopi Çekirdeği'ne ve deneysel destek için Robert Porter'a (UCSD) teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #5 forceps | Fine Science Tools | 11252-30 | |
| #55-forceps | Fine Science Tools | 11295-51 | |
| 0.03 inch inner diameter silicone tubing | VWR | 32829-182 | |
| 20 μL pipette tips | VWR | 76322-134 | |
| 35 mm Petri dish | VWR | 10799-192 | |
| 5 mL plastic syringe | VWR | BD 309646 | |
| Dichloromethane (DCM) | Sigma-Aldrich | 270997 | Refer to MSDS. Stored in side cabinet under fume hood |
| Ethyl cinnamate (ECi) | Sigma-Aldrich | 112372 | Stored at 4 °C |
| Fine Curved scissors | Fine Science Tools | 14061-09 | |
| FITC-poly-L-lysine | Sigma-Aldrich | P3069 | Store at -20 °C (powder, stock solution), 4ºC (working solution) |
| Fluoresent microscope | EVIDENT SCIENTIFIC | MVX10 | |
| Glass capillary tubes (0.75 mm ID) | Sutter Instrument | FG-GB100-75-10 | |
| Lightsheet microscope | Zeiss | Z.1 system | |
| Methanol | Sigma-Aldrich | M1775 | Refer to MSDS. Stored in flammable cabinet under fume hood |
| Microforge | Narishige International USA, Inc. | MF2 | |
| Micromanipulator | World Percision Instrrument | M3301R | |
| Paraformaldehyde (PFA) 4% | Thermo Scientific | J19943.K2 | Refer to MSDS. Stored at -20 °C (powder), 4 °C (4% working solution) |
| Phosphate buffered saline (PBS) | Cytiva | SH30256.01 | Stored on benchtop |
| SimVascular | open source software www.simvascular.org | ||
| Tyrode’s Solution | Made in-house |
Referanslar
- Lindsey, S. E., Butcher, J. T., Vignon-Clementel, I. E. Cohort-based multiscale analysis of hemodynamic-driven growth and remodeling of the embryonic pharyngeal arch arteries. Development. 145 (20), dev162578 (2018).
- Lindsey, S. E., Vignon-Clementel, I. E., Butcher, J. T. Assessing early cardiac outflow tract adaptive responses through combined experimental-computational manipulations. Ann Biomed Eng. 49 (12), 3227-3242 (2021).
- Salman, H. E., et al. Effect of left atrial ligation-driven altered inflow hemodynamics on embryonic heart development: Clues for prenatal progression of hypoplastic left heart syndrome. Biomech Model Mechanobiol. 20 (2), 733-750 (2021).
- Henning, A. L., Jiang, M. X., Yalcin, H. C., Butcher, J. T. Quantitative three-dimensional imaging of live avian embryonic morphogenesis via micro-computed tomography. Dev Dyn. 240 (8), 1949-1957 (2011).
- Anbazhakan, S., et al. Blood flow modeling reveals improved collateral artery performance during the regenerative period in mammalian hearts. Nat Cardiovasc Res. 1 (8), 775-790 (2022).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nat Methods. 13 (10), 859-867 (2016).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2016).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), dev199369 (2021).
- Rios Coronado, P. E., Red-Horse, K. Enhancing cardiovascular research with whole-organ imaging. Curr Opin Hematol. 28 (3), 214-220 (2021).
- Miller, C. E., et al. Confocal imaging of the embryonic heart: How deep. Microsc Microanal. 11 (3), 216-223 (2005).
- Renier, N., et al. Mapping of brain activity by automated volume analysis of immediate early genes. Cell. 165 (7), 1789-1802 (2016).
- Lindsey, S. E., et al. Growth and hemodynamics after early embryonic aortic arch occlusion. Biomech Model Mechanobiol. 14 (4), 735-751 (2015).
- Humphrey, J. D. Constrained mixture models of soft tissue growth and remodeling-twenty years after. J Elast. 145 (1), 49-75 (2021).
- Updegrove, A., et al. SimVascular: An open-source pipeline for cardiovascular simulation. Ann Biomed Eng. 45 (3), 525-541 (2017).
- Kim, J. S., Min, J., Recknagel, A. K., Riccio, M., Butcher, J. T. Quantitative three-dimensional analysis of embryonic chick morphogenesis via microcomputed tomography. Anat Rec. 294 (1), 1-10 (2011).
- Zhang, D., Lindsey, S. Evaluation of high-resolution image accuracy for small animal vascular flow quantitation. Bull Am Phys Soc. , (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır