Method Article
Imaging rapido ad alta risoluzione a montaggio intero della vascolarizzazione di piccoli animali per studi quantitativi
In questo articolo
Riepilogo
Questo protocollo introduce un metodo rapido per l'imaging vascolare tridimensionale quantitativo a montaggio intero utilizzando la microscopia a fluorescenza a foglio luminoso. L'efficacia del metodo è dimostrata utilizzando il sistema arterioso dell'arco faringeo del modello di embrione di pollo, con forze emodinamiche quantificate tramite fluidodinamica computazionale.
Abstract
Nei piccoli modelli animali di sviluppo e malattie cardiovascolari, le simulazioni computazionali del flusso sanguigno specifiche per soggetto consentono valutazioni quantitative di metriche emodinamiche difficili da misurare sperimentalmente. Le simulazioni fluidodinamiche computazionali fanno luce sui ruoli critici della meccanica nella funzione cardiovascolare e nella progressione della malattia. L'acquisizione di immagini volumetriche di alta qualità dei recipienti di interesse è fondamentale per l'accuratezza e la riproducibilità delle misurazioni morfologiche e dei risultati della quantificazione del flusso. Questo studio propone un metodo rapido, economico e accessibile per l'imaging ad alta risoluzione a montaggio intero della vascolarizzazione di piccoli animali utilizzando la microscopia a fluorescenza a foglio luminoso. Il protocollo di preparazione del campione light-sheet iDISCO+ modificato (immunolabeling-enabled tridimensional-dimensional imaging of solvent-cleared organs) prevede (1) l'etichettatura della vascolarizzazione con un agente fluorescente, (2) la conservazione del campione e (3) la resa trasparente del campione. A differenza del classico iDISCO+, che utilizza la colorazione immunoistochimica, gli autori etichettano l'endotelio vascolare con poli-L-lisina marcata FITC, un colorante fluorescente non specifico economico e altamente resistente al foto-sbiancamento, in un processo chiamato "endo-pittura". L'etichettatura rapida riduce il tempo di preparazione del campione da circa quattro settimane a meno di 3 giorni. Inoltre, l'uso del solvente minimamente pericoloso etilcinnamato (ECi) come agente di pulizia e soluzione di imaging rende i campioni più sicuri da maneggiare e conformi a una gamma più ampia di strutture di imaging. Il protocollo proposto viene applicato per ottenere stack di immagini al microscopio a fluorescenza a foglio luminoso ad alta risoluzione del sistema cardiovascolare in embrioni di pollo che vanno dal giorno 3 (HH18) al giorno 8 (HH34). Questo studio dimostra ulteriormente l'idoneità di questo metodo per la quantificazione vascolare attraverso la ricostruzione 3D e la modellazione emodinamica computazionale di un embrione di pollo del giorno 5 (HH 26).
Introduzione
L'imaging volumetrico è necessario per studi accurati della fisiologia e delle malattie cardiovascolari. L'imaging quantitativo produce stack di immagini ad alta risoluzione con dimensioni volumetriche intatte. I campioni devono essere conservati per mantenere la loro morfologia e il volume del lume in vivo , nonché riprodotti con una capacità uniforme ad alta risoluzione. Da stack di imaging ad alta risoluzione, l'utente può generare rendering vascolari tridimensionali ad alta fedeltà che consentono una visualizzazione completa delle forme, della struttura e della connettività dei vasi1.
Le strutture cardiovascolari possiedono complesse caratteristiche anatomiche tridimensionali che non possono essere catturate con precisione quando le si esamina attraverso una lente bidimensionale e disarticolata. L'imaging morfologico a campo largo stereoscopico e le sezioni istologiche sono inadeguate nel catturare variazioni tridimensionali complesse 1,2,3. Le immagini di micro e nano-tomografia computerizzata sono il gold standard per l'imaging volumetrico quantitativo di piccoli animali 1,4, ma non sono ampiamente accessibili o adottate dalla comunità biologica. Le recenti innovazioni nella pulizia dei tessuti e nella microscopia di organi interi/piccoli animali hanno consentito applicazioni quantitative della pulizia dell'intera montatura e delle tecniche di marcatura vascolare 5,6,7. La pulizia dei tessuti lavora per omogeneizzare la dispersione della luce nei campioni di tessuto, riducendo così i ritardi nella propagazione della luce attraverso il mezzo e diminuendo la possibilità di dispersione o assorbimento della luce. L'elevata trasparenza richiede un rigoroso trattamento dei tessuti che può influire sull'antigenicità o sulla luminosità dell'etichettatura del segnale di fluorescenza8. La microscopia a foglio luminoso è emersa come uno strumento di imaging veloce e potente ampiamente adottato dai biologi9, che offre un guadagno di velocità di diversi ordini di grandezza rispetto ai microscopi a scansione e la capacità di visualizzare campioni di dimensioni superiori a 1 cm. Attraverso la microscopia a fluorescenza a foglio luminoso (LSFM), un laser illumina la sezione trasversale di un campione con maggiore velocità e profondità rispetto alla microscopia confocale; Per questo motivo, il metodo richiede un'elevata trasparenza del campione.
Qui, gli autori adattano i recenti metodi di purificazione iDISCO+, combinandoli con l'endo-pittura10 nel modello animale di embrione di pollo per mostrare l'efficacia del metodo dallo sviluppo cardiovascolare precoce a quello tardivo. iDISCO (immunolabeling-enabled three-dimensional imaging of solvent-cleared organs) è un metodo di chiarificazione organico basato su solventi che, a differenza dei metodi basati sulla chiarificazione acquosa, non è soggetto ad artefatti di imaging causati dall'evaporazione del solvente. iDISCO differisce da iDISCO+ in quanto la fase di disidratazione del tetraidrofurano del primo (iDISCO) è sostituita da una più lieve disidratazione del metanolo seguita da una fase di estrazione dei lipidi (iDISCO+). I vantaggi del metodo di chiarificazione iDISCO+ includono l'immunomarcatura di campioni adulti ed embrioni di grandi dimensioni, un basso restringimento dei tessuti e un'elevata trasparenza 8,11. È importante sottolineare che iDISCO+ consente la generazione di stack di immagini ad alta risoluzione, espandendo le tradizionali tecniche di immunomarcatura biologica per ottenere informazioni su grandi campioni di organi o su un intero embrione, piuttosto che limitarsi al campionamento di piccole regioni prive di informazioni sull'intera organizzazione a livello tissutale, come con l'istologia tradizionale9. Gli svantaggi di iDISCO+ includono il fatto che le proteine fluorescenti geneticamente codificate non vengono conservate11. Il metodo di marcatura tissutale dell'endo-pittura è stato introdotto per la prima volta come screening ad alto rendimento per difetti cardiovascolari utilizzando cuori di embrioni di pollo HH31-HH36 che sono stati perfusi con 0,5 mg/ml di FITC-poli-L-lisina nell'apice ventricolare sinistro. Il colorante è stato lasciato legare per 4 minuti prima del fissaggio e della conservazione10.
Il presente studio ha rilevato che la stessa concentrazione di FITC-poli-L-lisina potrebbe essere utilizzata per una gamma più ampia di embrioni (HH18 - HH34), ma ha riscontrato che il tempo di fissazione ideale varia (da 5 a 10 minuti) per garantire vasi marcati in modo brillante. Gli utenti dell'attuale tecnica endo-DISCO potrebbero voler regolare la concentrazione del colorante (diminuendo di 0,1 mg/mL alla volta) nel caso in cui la soluzione si rivelasse troppo viscosa per etichettare tutti i vasi desiderati, ma sono incoraggiati a regolare prima il tempo di fissazione e ottimizzare la contrazione muscolare del ventricolo sinistro prima di regolare la concentrazione del colorante. Gli autori hanno tentato l'endo-pittura con una concentrazione di 0,1 mg / mL e hanno scoperto che mentre il colorante si diffondeva più facilmente attraverso piccoli vasi, veniva più facilmente lavato via con la perfusione di PFA. Gli autori dimostrano che gli stack di imaging ad alta risoluzione generati attraverso la presente tecnica sono di qualità sufficiente per la modellazione emodinamica computazionale. I percorsi del flusso sanguigno e le corrispondenti forze emodinamiche, comprese le distribuzioni della pressione e delle sollecitazioni di taglio della parete, si verificano in modelli localizzati complessi che possono essere risolti solo attraverso simulazioni di flusso computazionale 1,12. Queste forze biomeccaniche influenzano il comportamento dei tessuti cardiovascolari adiacenti e innescano l'adattamento, la crescita e il rimodellamento vascolare13. La comprensione dei valori della forza emodinamica locale getta una luce critica sui regolatori meccanicistici della funzione cardiovascolare e dell'inizio o della progressione della malattia2.
Protocollo
L'Office of Laboratory Animal Welfare interpreta la politica del Servizio Sanitario Pubblico come applicabile al modello di pulcino come "animale vertebrato" solo dopo la schiusa. Questi embrioni sono allo stesso modo esenti dalla giurisdizione del Comitato Istituzionale per la Cura e l'Uso degli Animali (IACUC). Le domande frequenti del National Institutes of Health sono disponibili all'indirizzo: http://grants.nih.gov/grants/olaw/faqs.htm#ApplicabilityofthePHSPolicy.
1. Raccolta, etichettatura e fissazione degli embrioni
- Fashion ha estratto aste capillari di vetro con diametro interno di 0,75 in microaghi tagliati utilizzando una microforgia 1,12.
NOTA: La dimensione della punta richiesta dipende dall'età/portata desiderata dell'animale. Il microago può essere tagliato in alternativa utilizzando pinze per microdissezione o forbici con una precisione notevolmente ridotta. - Scaldare la soluzione di Tyrode a circa 38°C.
- Sciogliere il solido di poli-L-lisina FITC nella soluzione di Tyrode per preparare una soluzione madre da 0,5 mg/mL.
NOTA: Questa concentrazione è ottimizzata per la marcatura delle arterie embrionali di pollo. La concentrazione ottimale per altri tipi di tessuto può variare. La soluzione madre in eccesso deve essere conservata a -20 °C. - Sezionare l'embrione aviario (che va da HH18 (giorno 3) a HH34 (giorno 8) per il presente studio cardiaco del pulcino) dal tuorlo d'uovo tagliando intorno all'embrione con forbici a punta curva e utilizzando una pipetta di trasferimento o una spatola per trasferire l'embrione in una capsula di Petri da 35 mm riempita con soluzione calda di Tyrode.
- Rimuovere con cautela le membrane coriali e allantoiche che avvolgono l'embrione e la membrana del pericardio attorno al cuore con una pinza a punta fine, praticando piccole incisioni (~0,1 mm) nelle membrane ed estraendole dall'embrione.
- Trasferisci l'embrione in una nuova capsula di Petri pulita riempita con la soluzione calda di Tyrode per mantenere il cuore pulsante.
- Riempire una siringa di plastica da 5 ml con la soluzione calda di Tyrode. Tagliare l'estremità larga di un puntale per pipetta in plastica da 0-20 μL e fissarlo al puntale piatto della siringa. La siringa è stata ora estesa fino al diametro fine della punta della pipetta.
- Costruire una "linea di iniezione", collegando un segmento di tubo in silicone con diametro interno di 0,03 pollici all'apparato della punta della pipetta-siringa appena fissato (passaggio 1.7). Collegare un microago capillare di vetro all'estremità opposta del tubo.
- Montare il microago sul supporto per microiniezione collegato a un micromanipolatore. Spurgare il tubo di silicone e il microneedle dalle bolle d'aria.
- Utilizzando il micromanipolatore, inserire l'ago nell'apice del cuore e perfondere l'embrione 1,12 iniettando lentamente la soluzione di Tyrode nel cuore. Continuare a perfondere l'embrione fino a quando non è completamente ripulito dal sangue.
- Utilizzare il micromanipolatore per estrarre l'ago e la linea di iniezione dal sito di inserimento e orientare l'ago in modo che non venga disturbato durante la preparazione della linea di iniezione successiva. Rimuovere il tubo in silicone dall'ago e dalla siringa.
NOTA: Alcuni utenti potrebbero trovare ottimale mantenere l'ago attaccato al cuore, nel qual caso l'utente deve rimuovere il tubo di silicone tra l'ago e la siringa, mantenendo l'ago in posizione. - Eseguire l'endo-pittura per etichettare l'endotelio vascolare con fluorescenza verde.
- Utilizzando una micropipetta, caricare 20-40 μL di soluzione madre di poli-L-lisina FITC nel tubo di silicone, facendo attenzione a non creare bolle d'aria davanti alla barriera liquida FITC.
- Ricollegare la siringa riempita con la soluzione di Tyrode e utilizzare il micromanipolatore per iniettare lentamente nell'apice del cuore, reinserendo l'ago se necessario. Rimuovere l'ago dopo che la poli-L-lisina FITC è stata diffusa e prima che le bolle d'aria entrino nel cuore.
- Lasciare riposare la poli-L-lisina FITC nell'embrione per 5-10 minuti.
NOTA: (controllo qualità opzionale) Per verificare la fluorescenza, scattare una foto con uno stereo fluorescente o un macroscopio. L'immagine può essere utilizzata per aiutare a determinare un fattore di disidratazione dopo che l'eliminazione degli embrioni è stata completata.
- Riempire una siringa da 5 ml con paraformaldeide al 4% (PFA) e collegarla al tubo di iniezione del silicone per una terza fase di iniezione.
- Perfondere l'embrione 1,12 con il 4% di PFA fino a quando tutte le strutture cardiovascolari sono al massimo della capacità di volume e il tessuto inizia a diventare più opaco.
- Caricare delicatamente l'embrione in una fiala da 2-5 ml riempita con una quantità di PFA al 4% sufficiente a coprire il campione. Fare attenzione a non deformare eccessivamente l'embrione.
NOTA: Scegliere una fiala abbastanza grande per il campione di interesse per evitare di schiacciare o deformare il campione. - Incubare l'embrione per una notte a 4 °C con uno shaker.
2. Disidratazione e schiaritura dell'embrione
- Pipettare con cura il 4% di PFA.
NOTA: Da questo momento in poi, evitare il contatto diretto con l'embrione per evitare danni o deformazioni ai tessuti. - Per lavare l'embrione, incubare l'embrione in una soluzione tampone fosfato fresca (PBS) a temperatura ambiente per 30 minuti agitando delicatamente. Ripetere altre due volte per un totale di 3 lavaggi.
- Iniziare a disidratare l'embrione in una cappa aspirante. Pipettare con cura il PBS e incubare l'embrione in una serie graduata di 5 incubazioni di metanolo a temperatura ambiente per 1 ora ciascuna: 20%, 40%, 60%, 80% e 100% di concentrazione di metanolo.
- Lasciare l'embrione in metanolo fresco al 100% a temperatura ambiente per una notte.
NOTA: (Punto di arresto opzionale). Gli embrioni possono essere conservati a -20 °C in metanolo al 100% per un uso successivo fino a 6 mesi. - Nella cappa aspirante, iniziare la procedura di rimozione dei lipidi. Incubare l'embrione in una soluzione di DCM: metanolo 2:1 (da volume a volume) a temperatura ambiente per 3 ore, agitando delicatamente.
ATTENZIONE: Il DCM è tossico e deve essere maneggiato nella cappa aspirante. Prendere ulteriori precauzioni quando si lavora con DCM. I doppi guanti possono aiutare a fornire una barriera in più. - Prelevare l'etilcinnamato (ECi) da 4 °C e lasciarlo scongelare a temperatura ambiente.
- Lavare gli embrioni in DCM fresco al 100% a temperatura ambiente per 15 minuti, agitando. Ripetere il lavaggio DCM al 100% per ottenere un totale di 2 lavaggi.
- Pipettare il DCM e incubare l'embrione in ECi al 100%. Lasciare l'embrione in ECi fino a quando non si schiarisce in circa 1 ora. Agitare delicatamente il tubo se necessario.
- (Passaggio di verifica facoltativo) Esaminare la qualità della pulizia e della colorazione dei vasi con uno stereoscopio o un macroscopio fluorescente. Scatta una foto dell'embrione per determinare il fattore di scala della disidratazione specifico per stadio/età.
- Conservare l'embrione purificato a 4 °C per un massimo di 6 mesi fino al momento dell'immagine, mantenendo l'embrione al riparo dalla luce.
3. Acquisizione dei dati
- Per visualizzare gli embrioni, utilizzare un microscopio fluorescente a foglio luminoso. Fissare la testa di un embrione otticamente chiarito su un capillare di vetro utilizzando il gel supercolla.
- Montare il capillare di vetro sul portacampioni, riempire la camera di imaging con ECi e abbassare l'embrione nella camera di imaging.
- Regola i parametri ed esegui l'imaging.
4. Applicazione quantitativa: ricostruzione 3D e modellazione fluidodinamica computazionale
NOTA: In questi passaggi, le pile di immagini ad alta risoluzione generate da fogli leggeri vengono caricate nel software open source SimVascular14 per la ricostruzione anatomica 3D e la modellazione fluidodinamica computazionale. Tutorial dettagliati sono disponibili sul sito web di SimVascular (vedi Tabella dei materiali). La ricostruzione consiste nella creazione di linee di percorso nei vasi di interesse, nella creazione di segmentazioni 2D lungo le linee di percorso e nella combinazione di segmentazioni loft in un modello solido 3D. La modellazione computazionale consiste nella preparazione di una geometria mesh, nella definizione delle condizioni al contorno e nell'esecuzione di simulazioni.
- Crea un nuovo SVProject in File e carica uno stack di immagini light-sheet ad alta risoluzione facendo clic con il pulsante destro del mouse su Immagini e quindi facendo clic su Aggiungi/sostituisci immagine.
- Segui i passaggi del tutorial del software per ricostruire le anatomie vascolari in silico.
- Crea un percorso facendo clic con il pulsante destro del mouse su Percorsi e selezionando Crea percorso. Posiziona i segnavia lungo un'imbarcazione di interesse. Ripetere l'operazione per ogni recipiente di interesse.
- Per ogni linea di percorso creata, tracciare le sezioni trasversali 2D del vaso facendo clic con il pulsante destro del mouse su Segmentazioni e selezionando Crea gruppo di contorni. Seleziona il percorso dell'imbarcazione e fai doppio clic sul nome dell'imbarcazione in Segmentazione per avviare la segmentazione manuale.
- Una volta segmentate tutte le imbarcazioni, creare un modello facendo clic con il pulsante destro del mouse su Modelli e quindi selezionando Crea modello. Seleziona il tipo di PolyData , inserisci un nome per il modello, fai clic su Crea modello solido e seleziona tutte le segmentazioni che dovrebbero far parte del modello.
- Crea la mesh della geometria eseguendo il mesher Tetgen integrato in SimVascular SVMesher. Definite una dimensione massima dello spigolo ed eseguite la mesh di superficie e di volume.
NOTA: Scegliere una dimensione della maglia in grado di risolvere i dettagli geometrici fini e le variabilità emodinamiche localizzate nel vaso. Iniziare con il pulsante Stima una dimensione della mesh globale . Per finalizzare le simulazioni, potrebbe essere necessario uno studio di convergenza della mesh. - Imposta una simulazione computazionale del flusso sanguigno utilizzando il risolutore SimVascolar. Per creare i file di simulazione, fare clic con il pulsante destro del mouse su Simulazioni e selezionare Crea processo di simulazione. Regolare i parametri di base e selezionare i BC di ingresso e uscita per condizioni al contorno specifiche.
- Regolare i parametri del Risolutore, accedere alla scheda Crea file ed eseguire la simulazione, selezionare il file mesh, fare clic su Crea file di dati per la simulazione.
- Avvia la simulazione utilizzando una workstation di calcolo ad alte prestazioni o un supercomputer.
Risultati
Il protocollo di imaging rapido ad alta risoluzione a montaggio intero qui presentato (Figura 1, Tabella 1) produce lumi dei vasi chiaramente delineati, come mostrato nella Figura 2, Figura 3 e Figura 4, dove l'endotelio vascolare dell'embrione di pollo è fluorescente GFP e quindi delineato in verde in tutti gli stadi embrionali dallo sviluppo precoce a quello maturo del cuore (Figura 4). È importante trovare la giusta combinazione di concentrazione di poli-L-lisina, tempo di fissazione del colorante e uso di contrazioni ventricolari (quando applicabile) se la vascolarizzazione del campione non appare chiaramente etichettata (vedere la Figura 2 per come dovrebbero apparire gli embrioni sotto uno stereoscopio o un macroscopio fluorescente prima dell'imaging LSFM). Mantenere un cuore pulsante attraverso la soluzione calda di Tyrode e la rapida dissezione dell'embrione lontano dal sacco vitellino aiuta la diffusione della soluzione in tutto il campione/modello di piccolo animale. La viscosità della poli-L-lisina può essere controllata attraverso la concentrazione della soluzione madre. Una soluzione meno viscosa può aiutare la penetranza della fluorescenza in tutto il campione, anche se la robustezza della marcatura deve essere verificata dopo la perfusione di PFA. L'utente potrebbe voler compensare una minore concentrazione di soluzione madre di poli-L-lisina aumentando il volume iniettato e consentendo un maggiore tempo di incubazione prima di fissare l'embrione con PFA.
La Figura 5 dimostra l'idoneità del metodo presentato per la ricostruzione anatomica 3D e la modellazione computazionale. I valori di sollecitazione di taglio della parete sono in linea con i precedenti studi degli autori basati su ricostruzioni di tomografia nano-computerizzata1.

Figura 1: Impostazione della marcatura e della fissazione degli embrioni (in alto) e configurazione dell'acquisizione dei dati al microscopio a foglio luminoso (in basso). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Embrioni prima e dopo le procedure di clearing. Embrioni rappresentativi in campo chiaro e con canale GFP illuminati per campioni che hanno subito le fasi 1 (prima della clearing) e 2 (dopo la clearing) del protocollo, come visto con un macroscopio fluorescente. Si noti come l'intero embrione risplende nel canale GFP prima di schiarirsi, in particolare nel cuore per il quale sono state rimosse le membrane esterne. Tutta la vascolarizzazione desiderata è chiaramente etichettata nell'embrione eliminato dalla GFP. Barre della scala = 1 mm. Clicca qui per visualizzare una versione più grande di questa figura.
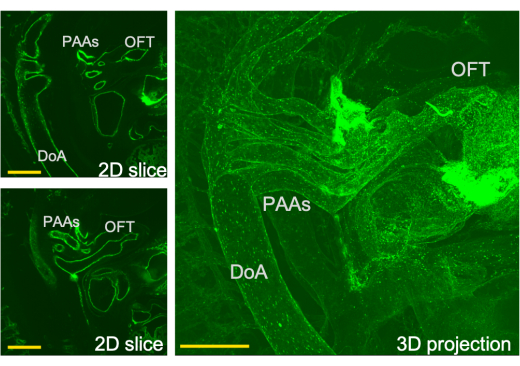
Figura 3: Vista tridimensionale del sistema di efflusso cardiaco e delle sezioni corrispondenti attraverso questa vista ottenuta da LSFM. PAA- arteria dell'arco faringeo, tratto di deflusso OFT, DoA-aorta dorsale. Barre della scala = 0,5 mm. Clicca qui per visualizzare una versione più grande di questa figura.
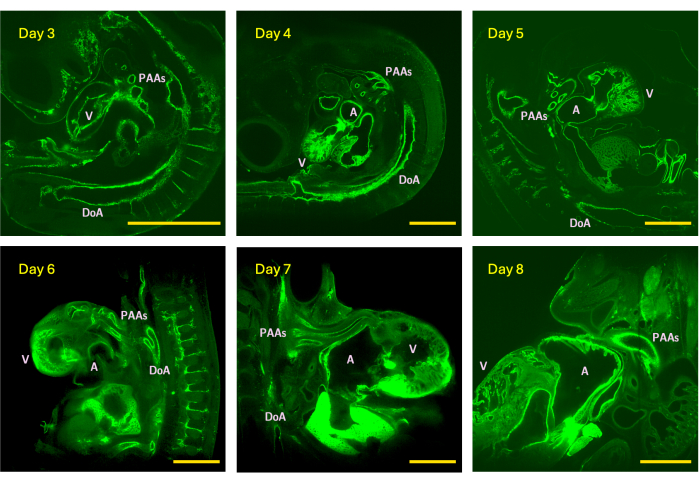
Figura 4: Esempi di z-slice da stack di immagini LSFM acquisiti dal giorno 3 (stadio HH18), 4 (HH24), 5 (HH26), 6 (HH29), 7 (HH31) e 8 (HH34) embrioni di pollo. La dimensione dell'immagine rappresenta il campo visivo massimo (senza tassellatura) del cannocchiale dotato di un obiettivo di rilevamento 5x. V - ventricolo; A - atrio; DoA - aorta dorsale; PAA - arterie dell'arco faringeo. Barre della scala = 1 mm. Clicca qui per visualizzare una versione più grande di questa figura.
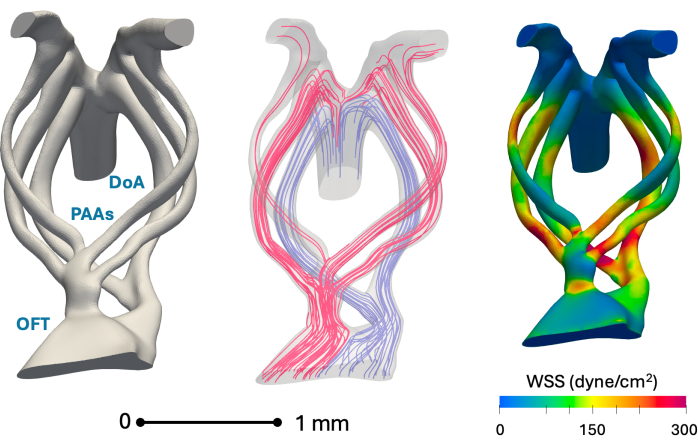
Figura 5: Ricostruzioni anatomiche rappresentative in silico dell'arco aortico del giorno 5 (stadio HH26) e risultati chiave della simulazione emodinamica. A sinistra: un modello di anatomia vascolare ricostruito che mostra il tratto di efflusso (OFT), le arterie dell'arco faringeo (PAA) e l'aorta dorsale (DoA). Al centro: linee di flusso sanguigno al picco della sistole ottenute utilizzando la simulazione del flusso sanguigno. Le linee di flusso rosse servono in gran parte le regioni craniche, mentre il blu serve le regioni caudali. A destra: Distribuzione del picco di sforzo di taglio della parete sistolica (WSS) sulla parete del vaso ottenuta utilizzando la simulazione del flusso sanguigno Fare clic qui per visualizzare una versione più grande di questa figura.
| Giorni | Passi | Ore | Temperatura |
| Giorno 1 | Prelievo di embrioni | 5-10 min/embrione | RT (da banco) |
| FITC Endo-vernice | 10-30 min/embrione | RT (da banco) | |
| Correzione della perfusione di PFA | Perfusione: 5-15 min/embrione | Perfusione: RT (da banco) Incubazione: 4 °C | |
| Incubazione: O/N | |||
| Giorno 2 | Lavaggio PBS | 90 minuti | RT (da banco) |
| Disidratazione | 5 h + O/N | RT (cappa aspirante) | |
| Giorno 3 | Rimozione dei lipidi | 3,5 h | RT (cappa aspirante) |
| Spurgo | ≥1 h | RT (da banco) |
Tabella 1: Panoramica sulla preparazione dei campioni per l'imaging rapido quantitativo con foglio di luce.
Discussione
La capacità di studiare la biologia in 3D è fondamentale per una comprensione accurata della complessità morfologica, della struttura degli organi interni e delle connessioni vascolari. Immagini vascolari 3D accurate e affidabili sono fondamentali anche per le simulazioni emodinamiche computazionali specifiche per soggetto, che sono spesso l'unico mezzo affidabile per quantificare i parametri emodinamici chiave come lo sforzo di taglio della parete e la distribuzione della pressione. Qui, gli autori introducono un metodo di preparazione del campione rapido e accessibile per l'imaging vascolare 3D ad alta risoluzione in piccoli animali utilizzando LSFM. Il metodo produce in modo affidabile stack di immagini ad alta risoluzione di embrioni di pollo da HH18 (giorno 3) a HH34 (giorno 8), che rappresentano un periodo critico dello sviluppo cardiaco. Da HH24 (giorno 4) a HH34 (giorno 8), le dimensioni totali dell'embrione aumentano da ~30-550 mm3, un aumento medio della crescita di 2 volte per un periodo di 24 ore, con le dimensioni del miocardio cardiaco che aumentano da ~1 mm3 (giorno 4) a ~17 mm3 (giorno 8)15. A causa della rapida crescita embrionale e cardiovascolare, le immagini per il presente studio sono state ottenute con una risoluzione nel piano che variava da 0,61 μm a HH18 (giorno 3) a 2,28 μm a HH34 (giorno 8) con un intervallo di passi z di 1,92-2,4 μm quando ci si concentra sul sistema arterioso dell'arco faringeo e da 1,22 μm (HH18) a 2,53 μm (HH34) con un intervallo di passi z di 1,94-3,5 μm quando si cattura l'intero embrione (Figura 4). Gli stack di immagini ad alta risoluzione generati sono adatti per la ricostruzione anatomica vascolare in silico e per le simulazioni emodinamiche specifiche del soggetto, come dimostrato dai modelli HH26 (giorno 5), che sono stati ripresi con una risoluzione nel piano di 1,30 μm e una dimensione del passo z di 1,92 μm16. Come per altre tecniche di montatura intera, il metodo proposto può essere utilizzato in tutti i modelli animali, in particolare quando si esegue l'imaging dell'intero organo 5,6,7. La tecnica iDISCO+ è stata applicata a cuori di topi neonati e adulti5.
Il principale vantaggio del metodo proposto risiede nell'uso della poli-L-lisina marcata con FITC per la marcatura fluorescente e dell'ECi per la clearing. La poli-L-lisina è caricata positivamente a pH fisiologico, quindi si lega in modo non specifico all'endotelio vascolare mentre viene perfusa attraverso il campione. Il processo attacca rapidamente e in modo affidabile il FITC alle pareti dei vasi, etichettandoli con una fluorescenza brillante e stabile altamente resistente al fotosbiancamento. Tradizionalmente, l'imaging microscopico volumetrico a montaggio intero, incluso l'LSFM, richiede che i campioni siano marcati con colorazione immunoistochimica. Questa procedura richiede l'uso di anticorpi costosi e prolunga il tempo di preparazione del campione fino a 4 settimane 1,8,9. Gli embrioni precoci non esprimono marcatori vascolari tradizionali come l'elastina o le cellule muscolari lisce vascolari e sono, quindi, più difficili da colpire con anticorpi specifici. Inoltre, i campioni ripuliti vengono spesso ripresi mentre sono immersi nella soluzione di chiarifica. La classica procedura di chiarifica iDISCO+ richiede il pericoloso composto dibenzil etere, che spesso non è consentito nelle strutture di imaging8. ECi è un composto minimamente pericoloso che è sicuro da maneggiare al di fuori degli ambienti di laboratorio ed è meno probabile che danneggi le apparecchiature ottiche. Se lo si desidera, la tecnica proposta può essere combinata o multiplexata con l'immunocolorazione, a condizione che le proprietà di emissione spettrale scelte consentano esperimenti di co-espressione. Il multiplexing può aumentare il tempo di etichettatura e preparazione del campione.
Il protocollo proposto presenta alcune limitazioni. La procedura è applicabile solo agli embrioni sacrificati e ai tessuti asportati, precludendo la possibilità di studi longitudinali. L'endoverniciatura FITC di poli-L-lisina, sebbene rapida ed economica, richiede un alto livello di destrezza e precisione. Inoltre, poiché il colorante non penetra facilmente attraverso i tessuti, etichetterà solo le pareti dei vasi che può raggiungere, presentando sfide per lo studio di piccole reti capillari. Tali sfide possono essere gestite mantenendo il battito cardiaco durante la somministrazione della poli-L-lisina e regolando la viscosità/concentrazione della soluzione iniettata. La non specificità del colorante rende difficile distinguere tra i tipi di vaso1. Un'eccessiva poli-L-lisina FITC che fuoriesce dal sistema vascolare durante il processo di iniezione può anche legarsi a tessuti non vascolari come la pelle superficiale e la membrana, che possono interferire con il foglio luminoso illuminante durante l'imaging e ridurre la qualità dell'imaging. L'utente deve essere vigile durante l'iniezione della poli-L-lisina in modo da evitare perdite. L'attuale protocollo è ampiamente convalidato utilizzando embrioni di pollo in fase iniziale per l'imaging delle principali arterie sistemiche. Potrebbe essere necessario ottimizzare ulteriormente la concentrazione, il volume e il tempo di fissazione dell'iniezione di poli-L-lisina FITC per diversi casi d'uso.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato da un American Heart Association Career Development Award, Burroughs Wellcome Fund Career Award presso la Scientific Interface, Additional Ventures Single Ventricle Research Fund e dalla UCSD School of Medicine Microscopy Core (Grant P30 NS047101). Gli autori ringraziano il Dr. Bobby Thompson per la sua introduzione all'endo-painting, l'UCSD School of Medicine Microscopy Core e Robert Porter (UCSD) per il supporto sperimentale.
Materiali
| Name | Company | Catalog Number | Comments |
| #5 forceps | Fine Science Tools | 11252-30 | |
| #55-forceps | Fine Science Tools | 11295-51 | |
| 0.03 inch inner diameter silicone tubing | VWR | 32829-182 | |
| 20 μL pipette tips | VWR | 76322-134 | |
| 35 mm Petri dish | VWR | 10799-192 | |
| 5 mL plastic syringe | VWR | BD 309646 | |
| Dichloromethane (DCM) | Sigma-Aldrich | 270997 | Refer to MSDS. Stored in side cabinet under fume hood |
| Ethyl cinnamate (ECi) | Sigma-Aldrich | 112372 | Stored at 4 °C |
| Fine Curved scissors | Fine Science Tools | 14061-09 | |
| FITC-poly-L-lysine | Sigma-Aldrich | P3069 | Store at -20 °C (powder, stock solution), 4ºC (working solution) |
| Fluoresent microscope | EVIDENT SCIENTIFIC | MVX10 | |
| Glass capillary tubes (0.75 mm ID) | Sutter Instrument | FG-GB100-75-10 | |
| Lightsheet microscope | Zeiss | Z.1 system | |
| Methanol | Sigma-Aldrich | M1775 | Refer to MSDS. Stored in flammable cabinet under fume hood |
| Microforge | Narishige International USA, Inc. | MF2 | |
| Micromanipulator | World Percision Instrrument | M3301R | |
| Paraformaldehyde (PFA) 4% | Thermo Scientific | J19943.K2 | Refer to MSDS. Stored at -20 °C (powder), 4 °C (4% working solution) |
| Phosphate buffered saline (PBS) | Cytiva | SH30256.01 | Stored on benchtop |
| SimVascular | open source software www.simvascular.org | ||
| Tyrode’s Solution | Made in-house |
Riferimenti
- Lindsey, S. E., Butcher, J. T., Vignon-Clementel, I. E. Cohort-based multiscale analysis of hemodynamic-driven growth and remodeling of the embryonic pharyngeal arch arteries. Development. 145 (20), dev162578(2018).
- Lindsey, S. E., Vignon-Clementel, I. E., Butcher, J. T. Assessing early cardiac outflow tract adaptive responses through combined experimental-computational manipulations. Ann Biomed Eng. 49 (12), 3227-3242 (2021).
- Salman, H. E., et al. Effect of left atrial ligation-driven altered inflow hemodynamics on embryonic heart development: Clues for prenatal progression of hypoplastic left heart syndrome. Biomech Model Mechanobiol. 20 (2), 733-750 (2021).
- Henning, A. L., Jiang, M. X., Yalcin, H. C., Butcher, J. T. Quantitative three-dimensional imaging of live avian embryonic morphogenesis via micro-computed tomography. Dev Dyn. 240 (8), 1949-1957 (2011).
- Anbazhakan, S., et al. Blood flow modeling reveals improved collateral artery performance during the regenerative period in mammalian hearts. Nat Cardiovasc Res. 1 (8), 775-790 (2022).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nat Methods. 13 (10), 859-867 (2016).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2016).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), dev199369(2021).
- Rios Coronado, P. E., Red-Horse, K. Enhancing cardiovascular research with whole-organ imaging. Curr Opin Hematol. 28 (3), 214-220 (2021).
- Miller, C. E., et al. Confocal imaging of the embryonic heart: How deep. Microsc Microanal. 11 (3), 216-223 (2005).
- Renier, N., et al. Mapping of brain activity by automated volume analysis of immediate early genes. Cell. 165 (7), 1789-1802 (2016).
- Lindsey, S. E., et al. Growth and hemodynamics after early embryonic aortic arch occlusion. Biomech Model Mechanobiol. 14 (4), 735-751 (2015).
- Humphrey, J. D. Constrained mixture models of soft tissue growth and remodeling-twenty years after. J Elast. 145 (1), 49-75 (2021).
- Updegrove, A., et al. SimVascular: An open-source pipeline for cardiovascular simulation. Ann Biomed Eng. 45 (3), 525-541 (2017).
- Kim, J. S., Min, J., Recknagel, A. K., Riccio, M., Butcher, J. T. Quantitative three-dimensional analysis of embryonic chick morphogenesis via microcomputed tomography. Anat Rec. 294 (1), 1-10 (2011).
- Zhang, D., Lindsey, S. Evaluation of high-resolution image accuracy for small animal vascular flow quantitation. Bull Am Phys Soc. , https://meetings.aps.org/Meeting/DFD24/Session/X03.8 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon