Method Article
Takasaki'nin Yaklaşımı ve İndosiyanin Yeşili Floresan Navigasyonu ile Laparoskopik Anatomik Hepatektomi
Bu Makalede
Özet
Burada, S4/5/7/8 rezeksiyonunda Takasaki'nin yaklaşımı ve indosiyanin yeşili floresan navigasyonu kullanılarak laparoskopik anatomik hepatektomi için bir protokol sunuyoruz.
Özet
Laparoskopik anatomik karaciğer rezeksiyonu, karaciğer kanseri için standart bir tedavi yöntemidir. S4/5/7/8'in segmental rezeksiyonu karmaşıktır ve standart prosedürlerden yoksundur, bu da yaygın komplikasyonlara yol açar. Yenilikçi teknikler, güvenliği ve sonuçları geliştirmek için çok önemlidir. Hepatit B, Child-Pugh Sınıf A karaciğer fonksiyonu, performans durumu (PS) skoru 0 ve alfa-fetoprotein (AFP) düzeyi 198.3 ng/mL olan 45 yaşında erkek hastaya, orta ve sağ hepatik venler (BCLC A) ile yakından ilişkili primer hepatosellüler karsinomu (HCC) gösteren S4/7/8'de 4 cm × 5 cm × 5 cm kitle tanısı konuldu. İndosiyanin yeşilinin (ICG) 15 dakikalık tutma oranı% 7.8 idi. Standart karaciğer hacmi (SLV) 1073 mL ve gerçek karaciğer hacmi 1345 mL idi. S4/5/8 ve parsiyel S7 segmentlerinin laparoskopik rezeksiyonunu gerçekleştirdik, orta hepatik veni (MHV) rezeke ettik ve MHV'yi tümörle çok kapalı olduğu için sağ hepatik veni (RHV) koruduk. Gelecekteki karaciğer kalıntısı (FLR) 590 mL idi ve FLR/SLV oranı %55 idi. Cerrahi prosedür, transeksiyon çizgisini belirlemek için sağ anterior hepatik pedikülü bloke etmek ve floresan boyamayı engellemek için Takasaki'nin yaklaşımını kullandı. Ameliyat 205 dakika sürdü ve tahmini 150 mL kan kaybı oldu. Hasta postoperatif komplikasyon gelişmedi ve altıncı günde taburcu edildi. Histopatoloji, net rezeksiyon sınırları olan hepatosellüler karsinomu doğruladı. Takasaki'nin yaklaşımı, ICG floresan navigasyonu ile birleştiğinde, laparoskopik anatomik hepatektomiyi önemli ölçüde iyileştirir. Bu teknik görselleştirmeyi geliştirir, komplikasyonları azaltır ve karmaşık karaciğer rezeksiyonları için yeni bir standart sunar.
Giriş
Laparoskopik anatomik hepatektomi, geleneksel açık cerrahi tekniklere minimal invaziv bir alternatif sağlayarak karaciğer hastalıklarının yönetimini dönüştürmüştür. Hepatobiliyer cerrahinin devam eden gelişimi, yeterli onkolojik ve fonksiyonel sonuçları sağlarken postoperatif morbiditeyi azaltma ihtiyacını vurgulamaktadır. Çeşitli cerrahi teknikler arasında Takasaki'nin yaklaşımı, anatomik karaciğer rezeksiyonu için umut verici bir strateji olarak öne çıkmaktadır. Kritik vasküler yapıları gözden kaçırabilen geleneksel yöntemlerin aksine, Takasaki'nin tekniği, karaciğer parankimini korumak ve segmental rezeksiyonlar sırasında cerrahi alanı optimize etmek için gerekli olan karaciğer anatomisinin ayrıntılı bir şekilde anlaşılmasına odaklanır1.
Yoğun dallı bir vasküler ve safra sistemi ile karakterize edilen karaciğerin karmaşık anatomisi, cerrahi prosedürler sırasında önemli zorluklar ortaya çıkarmaktadır. Segment 4, 5, 7 ve 8'in rezeksiyonu - karaciğer fonksiyonunu sürdürmek için kritik olan ve daha yüksek komplikasyon riskleri ile ilişkili alanlar - dikkatli bir planlama ve hassasiyet gerektirir. Takasaki'nin yaklaşımı, cerrahların bitişik karaciğer segmentlerinin vasküler beslemesini ve drenajını sistematik olarak değerlendirmesini ve korumasını sağlar, böylece iskemi ve postoperatif karaciğer yetmezliği riskini en aza indirir2.
Ayrıca, indosiyanin yeşili (ICG) floresan navigasyon teknolojisinin dahil edilmesi bu cerrahi paradigmayı geliştirmektedir. İntravenöz olarak uygulanan ICG, plazma proteinlerine bağlanarak yakın kızılötesi görüntüleme yoluyla hepatik kan akışının ve safra kanalı yapılarının görselleştirilmesine olanak tanır3. Bu gerçek zamanlı geri bildirim, cerrahlara karaciğer perfüzyonunun dinamik bir görünümünü sağlar ve kritik anatomik işaretlerin belirlenmesine yardımcı olur. Özellikle, ICG floresan navigasyonu, karmaşık rezeksiyonlar sırasında paha biçilmezdir, tümör sınırlarını etkili bir şekilde tanımlar ve vasküler anatominin değerlendirmesini iyileştirir4.
Bu çalışmada, karaciğer segmentleri S4, S5, S7 ve S8'in rezeksiyonu için Takasaki'nin yaklaşımı ile ICG floresan navigasyonu ile güçlendirilmiş laparoskopik anatomik hepatektomi uygulanmasına odaklandık. Cerrahi tekniklerimizi gösteren, floresan rehberliğinin faydalarını vurgulayan ve hasta sonuçlarını değerlendiren bir vaka sunuyoruz. Bu rapor aracılığıyla, hepatobiliyer cerrahide minimal invaziv stratejilerin ilerlemesine katkıda bulunarak bu entegre cerrahi yaklaşımın fizibilitesini ve etkinliğini göstermeyi amaçlıyoruz 5,6,7. Bu çalışmanın bulguları, hasta güvenliğini artırmak ve ameliyat sonrası iyileşmeyi iyileştirmek için titiz preoperatif planlamanın, gelişmiş görüntüleme entegrasyonunun ve cerrahi tekniklerin sürekli iyileştirilmesinin önemini vurgulamaktadır8.
Protokol
Bu çalışma, Sun Yat-Sen Üniversitesi Üçüncü Bağlı Hastanesi Etik Kurulu tarafından onaylanmıştır ve bu çalışmanın anonim retrospektif tasarımı nedeniyle bilgilendirilmiş onam gerekliliğinden feragat etmiştir.
1. Hasta seçimi
- Ameliyat endikasyonunu onaylayın.
NOT: Uzun bir hepatit B öyküsü ve karaciğer fonksiyonu olan 45 yaşında bir erkek Child-Pugh Sınıf A, PS skoru 0, AFP seviyesi 198.3 ng / mL. MRG ve CEUS, S4/7/8'de 4 cm 5 cm 5 cm'lik bir tümör gösterdi, bu da MHV ve RHV ile yakından ilişkili primer HCC'yi gösterdi (Tümör evresi BCLC A'dır). ICG'nin 15 dakikalık kalıcılık oranı %7.8'dir. SLV 1073 mL ve gerçek karaciğer hacmi 1345 mL idi. Ulusal Kapsamlı Kanser Ağı (NCCN) kılavuzlarına göre, karaciğer segmentleri S4/5/8 ve parsiyel S7'nin laparoskopik rezeksiyonu yapılarak MHV rezeksiyonu yapılarak RHV'yi koruyarak yapılmasına karar verildi. Gelecekteki karaciğer rezidü (FLR) 590 mL ve FLR/SLV %55 idi.
2. Bilgilendirilmiş onam
- Prosedürü, riskleri, faydaları ve alternatifleri hastayla tartışın. Bilgilendirilmiş onay alın.
3. Ameliyat öncesi çalışma
- Tam kan sayımı, karaciğer fonksiyon testleri ve pıhtılaşma profilleri dahil olmak üzere rutin laboratuvar testleri yapın.
- Tümörleri lokalize etmek ve karaciğer anatomisini değerlendirmek için görüntüleme çalışmaları yapın.
4. Operatif kurulum
- Standart protokollere uyarak genel anestezi uygulayın.
- Hastayı sırtüstü yatırın, hasta hafifçe sola döndürülmüş durumda.
- Trokarları yerleştirin.
- Veress iğnesi veya açık teknik kullanarak pnömoperitoneum oluşturun.
- 5 trokar yerleştirin: Göbek delikusuna bir adet 10 mm kamera trokar yerleştirin. Hepatotomi için 5 mm veya 10 mm'lik çalışma trokarlarını sol ve sağ üst kadranlara ve muhtemelen epigastrik bölgeye yerleştirin.
5. Cerrahi teknik
- Laparoskopik eksplorasyon: Herhangi bir metastatik hastalık veya abdominal komplikasyonu değerlendirmek için kapsamlı bir abdominal eksplorasyon ile başlayın.
- Kolesistektomi: Kalot üçgenini ortaya çıkarın, kistik kanalı ve kistik arteri inceleyin, ardından proksimal uçlarını çift ligate edin. Damarları ve kanalı kesin, safra kesesini karaciğer yatağından ayırın ve elektrokoter ile karaciğer yatağı yüzeyinde hemostaz elde edin.
- Bağı inceleyin.
- Karaciğerin yuvarlak baksiyonunu, falsiform ligamenti ve kısmi sağ koroner bağı incelemek için bir ultrason neşteri kullanın.
- İkinci karaciğer portalını ve hepatik venlerin kökünü (RHV, MHV ve sol hepatik ven [LHV]) ortaya çıkarın
- MHV'nin kökünü tanımlayın ve elektrokoagülasyon kancasını kullanarak sol hepatik transeksiyon çizgisini işaretleyin (falsiform ligament boyunca 1 cm sağ).
- Pringle prosedürü için ilk hepatik portal blok bandı olarak 12# kateteri önleyin.
- İntraoperatif ultrason taraması (IOUS) gerçekleştirin.
- Preoperatif olarak tespit edilmeyen lezyonları dışlamak için tüm karaciğeri tarayın. Yüksek frekanslı bir laparoskopik prob (7.5-10 MHz) seçin, ultrason konsolunu önceden ısıtın ve kazancı 50-65 dB'ye ayarlayın.
- Tümörün yerini, boyutunu ve kenarını, özellikle RHV ve MHV ile olan ilişkiyi tarayın.
- Sağ / sol glission pedikülünü ve RHV / MHV konumunu tarayın.
- Bir IOUS taraması kullanarak, rezeksiyon sınırının >1 cm olduğundan emin olarak bir elektrokoagülasyon kancası kullanarak tümör sınırını işaretleyin.
- Anatomik rezeksiyon yapın (Takasaki'nin yaklaşımı)
- Hepatik hilus akışını tıkamak için Pringle manevrasını gerçekleştirin, ardından sağ anterior hepatik pedikülü ekstraperitoneal bir yaklaşımla diseksiyon edin.
- G5'in birkaç küçük dalını bölün ve oklüzyonu kolaylaştırmak için sağ ön hepatik pedikülü orta derecede serbest bırakın (laparoskopik bulldog kullanın). Bu, sonraki karaciğer parankimi bölündükten sonra sağ ön hepatik pedikülün kesilmesini kolaylaştıracaktır.
- Oklüzyonu serbest bırakın ve karaciğer iskemi çizgisini gözlemleyin.
- Sağ anterior glissonian pedikül kapatıldıktan sonra ICG'yi intravenöz olarak (3-5 mL, 0.025 mg / mL) uygulayın. Sağ ön segmentin kapsamını gözlemlemek için floresan boyamayı kullanın.
- Falsiform ligamanın sağ tarafı boyunca, viseral yüzeyde sağ anterior hepatik pediküle doğru eğimli sol rezeksiyon çizgisini işaretleyin. Floresan boyamaya göre doğru rezeksiyon çizgisini işaretleyin.
- Karaciğer parankimi transeksiyonu yapın.
- Sınırlandırılmış çizgi boyunca parankimal transeksiyonu başlatmak için ultrasonik neşterler ve harmonik cihazlar kullanın.
- Gerektiğinde bipolar elektrokoter kullanarak hemostazı koruyun.
- Sol tarafta, G4 ve V4'ün birkaç dalını MHV'nin köküne kadar bölün.
- Sağ karaciğer parankimini ayırın ve sağ anterior hepatik pedikülü ve MHV'yi bölün.
- RHV'ye bitişik S7'deki tümörü dikkatlice inceleyin.
NOT: Tümör MHV ve RHV ile yakından ilişkili olduğundan, işlem FLR 590 mL ve FLR/SLV %55 olduğu için RHV MHV üzerinde korunmuştur.
- Rezeksiyonu tamamlayın.
- Rezeke edilen karaciğeri çevre dokulardan ayırın.
- Tüm büyük gemilerin emniyete alındığından emin olurken hedeflenen segmentleri dikkatlice inceleyin.
- Örnek alma: En büyük porttan veya gerekirse ek bir kesiden endoskopik bir alma torbası kullanarak karaciğer segmentlerini alın.
6. Ameliyat sonrası bakım
- İzleme: Postoperatif dönemde yaşamsal belirtileri, sıvı dengesini ve karaciğer fonksiyonunu izleyin.
- Ağrı yönetimi: Uygun analjezi uygulayın (belirtilirse bölgesel blokları düşünün).
- Erken mobilizasyon: İyileşmeyi artırmak için erken ambulasyonu teşvik edin.
- Takipler: Karaciğer fonksiyonunu ve iyileşmesini değerlendirmek ve ameliyat sonrası komplikasyonları ele almak için takip ziyaretleri yapın.
7. Dokümantasyon ve kalite kontrol
- Ameliyat öncesi tanı, bulgular, kullanılan tekniklerin yanı sıra intraoperatif zorluklar ve çözümleri içeren ayrıntılı bir ameliyat raporu tutun.
- Gelecekteki kalite iyileştirmesi için sonuçları ve komplikasyonları yapılandırılmış bir şekilde gözden geçirin.
Sonuçlar
Laparoskopik karaciğer rezeksiyonunda indosiyanin yeşili (ICG) floresan uygulamasından elde edilen temsili sonuçlar, özellikle prosedürler sırasında vasküler ve safra yapılarının görünürlüğünü arttırmada cerrahi sonuçlar üzerindeki önemli etkisini göstermektedir.
Karaciğer rezeksiyonu sırasında ICG navigasyonunu kullanmanın en önemli avantajlarından biri, sadece Glissonian yüzeyinde değil, aynı zamanda karaciğer parankiminin derinliklerinde de rezeksiyon sınırlarını net bir şekilde tanımlayabilmesidir. Cerrahlar, vaskülarize parankimi vaskülarize olmayan parankimden ayırt ederek, hayati yapıları korurken net diseksiyon düzlemleri ve etkili doku çıkarılması için çok önemli olan iskemik çizgileri daha doğru bir şekilde tanımlayabilir. Örneğin, Şekil 1 , Takasaki'nin sağ anterior hepatik pedikülü bloke etme yaklaşımını göstermekte ve cerrahi ekibin iskemik çizgiyi kesin olarak tanımlamasını göstermektedir.
Şekil 2, intravenöz ICG uygulamasından sonra sağ ön segmenti vurgulamakta ve karaciğer anatomisi hakkında önemli intraoperatif geri bildirim sağlamaktadır. Bu gelişmiş görselleştirme, tahmini kan kaybında 150 mL'ye kadar bildirilen azalmaya katkıda bulunur (Tablo 1), bu da floresan kılavuzluğunun daha temkinli diseksiyon uygulamalarını teşvik ettiğini ve cerrahların çevredeki damar sistemine zarar vermekten kaçınmasına yardımcı olduğunu düşündürür.
205 dakikalık genel işlem süresi, karmaşık karaciğer ameliyatları için makul bir süredir. Hasta, kanama veya safra sızıntısı gibi majör advers olaylar olmadan altıncı günde taburcu edildi ve bu tekniğin güvenliğini vurguladı (Tablo 1). Şekil 3 ve Şekil 4 , LHV, MHV, IVC ve RHV dahil olmak üzere kritik vasküler yapıların başarılı bir şekilde rezeksiyonunu doğrulayarak rezeksiyon sonrası anatomiyi daha da göstermektedir ve böylece komplikasyon riskini en aza indirmektedir.

Şekil 1: Takasaki'nin yaklaşımı. Takasaki'nin sağ anterior hepatik pedikülü bloke etme yaklaşımı (sağ anterior hepatik pedikülü bloke etmek ve iskemik çizgiyi göstermek için laparoskopik bulldog kullanarak) Bu figürün daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Sağ ön segmenti tanımlamak için floresan boyama. ICG'yi 0.025 mg / mL konsantrasyonda intravenöz olarak 3-5 mL uygulayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
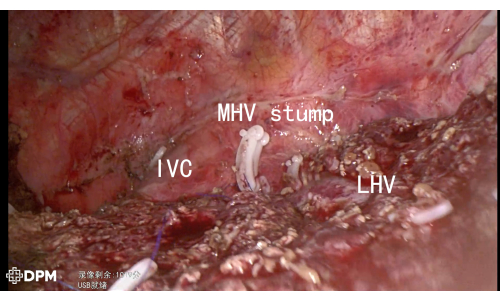
Şekil 3: Karaciğer rezeksiyonu sonrası LHV/MHV/IVC gösterildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
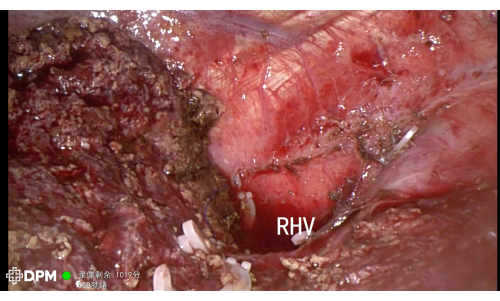
Şekil 4: Karaciğer rezeksiyonu sonrası RHV gösterildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Kan kaybı | 150 mL | |
| Süre | 205 dk | |
| Hastanede kalış | 6 gün | |
| Drenaj | 1. Gün | 200 mL |
| 4. Gün | 50 mL | |
Tablo 1: Ameliyatın detayları
Tartışmalar
Takasaki'nin yaklaşımı ve ICG floresan navigasyonu kullanılarak yapılan laparoskopik anatomik hepatektomi, optimal sonuçları sağlamak için gerekli olan birkaç kritik adımı içerir. En önemli hususlardan biri, tümörü doğru bir şekilde lokalize etmek ve karaciğer anatomisini değerlendirmek için MRI ve kontrastlı ultrason (CEUS) gibi görüntüleme çalışmalarını içeren ameliyat öncesi değerlendirmedir. Bu adım, özellikle kompleks segmental rezeksiyonlar (S4/5/7/8)9 için cerrahi yaklaşımın planlanması için hayati öneme sahiptir.
Bir diğer önemli adım ise ICG'nin uygulanmasıdır. Sağ anterior hepatik pedikülü bloke ettikten sonra ICG'nin intravenöz olarak (3-5 mL, 0.025 mg / mL) uygulanması, ameliyat sırasında hepatik kan akışının görüntülenmesini artırır. Bu floresan kılavuzu, karaciğer perfüzyonunun gerçek zamanlı değerlendirmesine olanak tanır ve kritik anatomik işaretlerinbelirlenmesine yardımcı olur 10. Ayrıca, Takasaki yaklaşımı, iskemi ve postoperatif karaciğer yetmezliği riskini en aza indiren vasküler yapıların sistematik diseksiyonu ve korunmasını vurgular11. Tümör sınırı değerlendirmesi ve vasküler anatomi doğrulaması için intraoperatif ultrasonun (IOUS) entegrasyonu da rezeksiyon çizgilerinin hassas bir şekilde çizilmesine izin verdiği, net sınırlar sağladığı ve komplikasyonları azalttığı için çok önemlidir12.
Protokol kapsamlı olacak şekilde tasarlanmış olsa da, bazı değişiklikler etkinliğini artırabilir. Örneğin, ICG uygulamasının zamanlaması hastanın karaciğer fonksiyonuna ve rezeksiyonun karmaşıklığına göre ayarlanabilir. ICG'nin kalıcılık oranının yetersiz olduğu durumlarda, cerrahlar görselleştirmeyi iyileştirmek için daha yüksek bir doz uygulamayı veya uygulama zamanlamasını ayarlamayı düşünebilir13.
Ek olarak, floresan görselleştirmesi yetersizse sorun giderme stratejileri gerekli olabilir. Floresan karaciğer anatomisini net bir şekilde tanımlamıyorsa, cerrahlar ICG'nin doğru şekilde uygulandığından ve görüntüleme sisteminin en iyi şekilde çalıştığından emin olmalıdır. Aydınlatma koşullarını veya kamera açılarını değiştirmek gibi intraoperatif ayarlamalar da floresan algılamayı iyileştirebilir. Ayrıca, beklenmedik kanama meydana gelirse, ICG tarafından görselleştirilen vasküler anatominin tam olarak anlaşılması, kanama damarlarının hızlı bir şekilde tanımlanmasına ve yönetilmesine olanak tanır10.
Avantajlarına rağmen, laparoskopik hepatektomide ICG floresan navigasyonunun kullanımının sınırlamaları vardır. Önemli bir endişe, karaciğer fonksiyonu, vasküler bütünlük ve tümör özelliklerinden etkilenebilen ICG tutma oranlarındaki değişkenliktir14. Sirozlu hastalar gibi karaciğer fonksiyonu zayıf olan hastalarda, floresan sinyali daha az güvenilir olabilir ve potansiyel olarak kritik yapıların yetersiz görselleştirilmesine yol açabilir.
Ek olarak, floresan görüntülemeye güvenmek, özellikle cerrahlar geleneksel anatomik işaretleri ihmal ederse ve rehberlik için yalnızca floresansa güvenirse, intraoperatif karar vermede aşırı güvene yol açabilir12. Cerrahların floresan görüntülerini yorumlama ve bunları cerrahi iş akışlarına entegre etme konusunda yetkin olmaları gerektiğinden, teknikle ilişkili bir öğrenme eğrisi de vardır13.
ICG floresan navigasyonunun laparoskopik anatomik hepatektomiye entegrasyonu, geleneksel yöntemlere göre önemli bir ilerlemeyi temsil etmektedir. Konvansiyonel yaklaşımlar genellikle floresan görüntülemenin sağladığı gerçek zamanlı geri bildirimden yoksundur, bu da kanama veya eksik rezeksiyonlar gibi komplikasyonların artmasına neden olabilir9. Görselleştirmeyi geliştirerek, ICG floresansı, ameliyat sonrası karaciğer fonksiyonunu sürdürmek için çok önemli olan daha hassas diseksiyonlara ve sağlıklı dokunun daha fazla korunmasına olanak tanır.
Ayrıca, ICG ile birleştirilen Takasaki yaklaşımı, çeşitli cerrahi ekiplerde prosedürleri standardize edebilen ve sonuçları iyileştirebilen segmental karaciğer rezeksiyonları için sistematik bir yöntem sunar11. Gelişmiş görüntüleme teknolojisinin bu entegrasyonu, yalnızca cerrahi güvenliği artırmakla kalmaz, aynı zamanda hepatobiliyer cerrahide minimal invaziv tekniklere yönelik daha geniş eğilimle de uyum sağlayarak daha hızlı iyileşmeyi ve hastanede kalış sürelerini azaltır12.
İleriye baktığımızda, laparoskopik karaciğer cerrahisinde ICG floresan navigasyonunun uygulanması daha fazla ilerleme için umut vaat etmektedir. Gelecekteki araştırmalar, sirotik karaciğerler veya karmaşık vasküler anatomi gibi zorlu vakalarda görselleştirmeyi iyileştirmek için ICG doz protokollerini optimize etmeye ve görüntüleme teknolojilerini geliştirmeye odaklanabilir14.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (Hibe No.82100692) ve Guangzhou Bilim ve Teknoloji Programı (Hibe No.202201011097) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Indocyanine green for injection | Dandong Yichuang Pharmaceutical Co., Ltd. | H20055881 | |
| Harmonic devices | Affacare Medical (Beijing) Co., Ltd | AH-1200 | |
| Laparoscopic bulldog | B. Braun Aesculap Co.,Ltd | https://catalogs.bbraun.com/en-01/p/PRID00004560/bulldog-clips | |
| Surgical system | Deeper Network Technologies Co., Ltd | https://www.digipmc.com/Product/info/1071 | |
| Ultrasonic scalpels | Affacare Medical (Beijing) Co., Ltd | AH-600 | |
| Ultrasound | ALOKA Co., Ltd | ARIETTA 850 | |
| Veress needle | Hangzhou Kangji Medical Instrument Co.,Ltd. | https://www.kangjimed.com/laparoscopic-instruments-/surgical-needle-or-knife-/veress-needle-.html |
Referanslar
- Takasaki, K., Yokoyama, Y. Laparoscopic anatomical liver resection: Takasaki's approach and technique. Surg Endosc. 28 (8), 2205-2212 (2014).
- D'Hondt, M., Berrevoet, W. V. P. Indocyanine green fluorescenceguided liver surgery: a review of the literature with focus on liver resection. J Hepatobiliary Pancreat Sci. 26 (8), 317-327 (2019).
- D'Angelica, M. I., Allen, P. J. The evolution of laparoscopic liver resection: going from open surgery to minimally invasive techniques. Liver Cancer. 4 (3), 163-172 (2015).
- Dufour, M., Abou Ali, E. F., Kianmanesh, R. Laparoscopic anatomical liver resection: technical aspects and clinical outcomes. World J Gastroenterol. 27 (17), 2079-2092 (2021).
- Doku, M., Ferlay, N. M. C. F. Fluorescent imaging in liver surgery: is it the future of resection technique. Surg Oncol. 35, 120-126 (2020).
- Choi, S. H., Kim, J. H., Park, K. J. The role of indocyanine green (ICG) fluorescence in laparoscopic liver surgery. J Surg Res. 221, 64-70 (2017).
- Lang, H., Liu, H. Minimally invasive liver resection: current strategies and future directions. Hepat Surg. 12 (1), 1-8 (2018).
- Nguyen, K. T., Tsung, A., Zhang, J. Current approaches in laparoscopic liver resection: evidencebased strategies. J Gastrointest Surg. 20 (9), 1592-1601 (2016).
- Klein, A., Golling, M., Schmid, M. Laparoscopic liver surgery: current status and outlook. J Minim Invasive Surg. 22 (1), 19-25 (2019).
- Kumar, R., Wong, T., Cheong, C. Use of indocyanine green fluorescence for laparoscopic liver resections: a review of the literature. Surg Endosc. 34 (6), 2373-2383 (2020).
- Takasaki, K., Shimizu, H., Matsumoto, J. The Takasaki approach for anatomical liver resection: insights into its technique and benefits. Am J Surg. 215 (4), 796-801 (2018).
- Gonzalez, M., Morton, S., Keck, T. Advances in laparoscopic liver resection: contemporary techniques and emerging technologies. Eur J Surg Oncol. 47 (3), 541-549 (2021).
- Tzeng, C. W. D., Wang, M. L., Huang, J. Optimizing indocyanine green dosage for liver surgery: impacts and clinical applications. J Surg Res. 246, 181-189 (2020).
- Matsui, Y., Nomura, T., Takai, Y. The role of indocyanine green in liver surgery: current perspectives and future directions. World J Gastroenterol. 27 (8), 599-612 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır