Method Article
Лапароскопическая анатомическая гепатэктомия с использованием подхода Такасаки и флуоресцентной навигации по индоцианину зеленого
В этой статье
Резюме
Здесь мы представляем протокол лапароскопической анатомической гепатэктомии с использованием подхода Такасаки и индоцианиновой зеленой флуоресцентной навигации при резекции S4/5/7/8.
Аннотация
Лапароскопическая анатомическая резекция печени является стандартным методом лечения рака печени. Сегментарная резекция S4/5/7/8 является сложной процедурой и не требует стандартизированных процедур, что приводит к распространенным осложнениям. Инновационные методы имеют важное значение для повышения безопасности и результатов. У 45-летнего мужчины с гепатитом В в анамнезе, функцией печени класса А по Чайлд-Пью, оценкой функционального статуса (ПС) 0 и уровнем альфа-фетопротеина (АФП) 198,3 нг/мл был диагностирован массой 4 см × 5 см × 5 см в S4/7/8, что указывает на первичную гепатоцеллюлярную карциному (ГЦК), тесно связанную со средними и правыми печеночными венами (БКЛК А). 15-минутная скорость удержания индоцианина зеленого (ICG) составила 7,8%. Стандартный объем печени (SLV) составлял 1073 мл, а фактический объем печени — 1345 мл. Мы выполнили лапароскопическую резекцию сегментов S4/5/8 и частичного S7 с резекцией средней печеночной вены (МГВ) с сохранением правой печеночной вены (РГВ), поскольку МГС была так закрыта с опухолью. Будущий остаток печени (FLR) составлял 590 мл с соотношением FLR/SLV 55%. В хирургической процедуре использовался подход Такасаки для блокировки правой передней печеночной ножки и флуоресцентное окрашивание для определения линии пересечения. Операция длилась 205 минут с предполагаемой кровопотерей 150 мл. Послеоперационных осложнений у пациента не наблюдалось, и он был выписан на 6-е сутки. Гистопатология подтвердила гепатоцеллюлярную карциному с четкими краями резекции. Подход Такасаки в сочетании с флуоресцентной навигацией ICG значительно улучшает лапароскопическую анатомическую гепатэктомию. Этот метод улучшает визуализацию, снижает количество осложнений и предлагает новый стандарт для сложных резекций печени.
Введение
Лапароскопическая анатомическая гепатэктомия изменила подход к лечению заболеваний печени, обеспечив минимально инвазивную альтернативу традиционным открытым хирургическим методам. Продолжающаяся эволюция гепатобилиарной хирургии подчеркивает необходимость снижения послеоперационной заболеваемости при обеспечении адекватных онкологических и функциональных исходов. Среди различных хирургических методов подход Такасаки выделяется как многообещающая стратегия анатомической резекции печени. В отличие от традиционных методов, которые могут упускать из виду критические сосудистые структуры, метод Такасаки фокусируется на детальном понимании анатомии печени, необходимой для сохранения паренхимы печени и оптимизации операционного поля во время сегментарных резекций.
Сложная анатомия печени, характеризующаяся густо разветвленной сосудистой и желчевыводящей системой, создает значительные проблемы во время хирургических процедур. Резекция сегментов 4, 5, 7 и 8 – областей, критически важных для поддержания функции печени и связанных с повышенным риском осложнений – требует тщательного планирования и точности. Подход Такасаки позволяет хирургам систематически оценивать и сохранять сосудистое снабжение и дренаж соседних сегментов печени, тем самым сводя к минимуму риск ишемии и послеоперационной печеночной недостаточности.
Кроме того, внедрение флуоресцентной навигационной технологии на основе индоцианина зеленого (ICG) усиливает эту хирургическую парадигму. ICG, вводимый внутривенно, связывается с белками плазмы, что позволяет визуализировать печеночный кровоток и структуры желчных протоков спомощью визуализации в ближнем инфракрасном диапазоне. Эта обратная связь в режиме реального времени предоставляет хирургам динамическое представление о перфузии печени и помогает определить критические анатомические ориентиры. В частности, флуоресцентная навигация ICG неоценима во время сложных резекций, эффективно очерчивая края опухоли и уточняя оценку анатомии сосудов4.
В этом исследовании мы сосредоточимся на реализации лапароскопической анатомической гепатэктомии с использованием подхода Такасаки, усиленного флуоресцентной навигацией ICG, для резекции сегментов печени S4, S5, S7 и S8. Мы представляем клинический случай, который иллюстрирует наши хирургические методы, подчеркивает преимущества флуоресцентного руководства и оценивает результаты лечения пациентов. С помощью этого отчета мы стремимся продемонстрировать осуществимость и эффективность этого интегрированного хирургического подхода, способствуя продвижению минимально инвазивных стратегий в гепатобилиарной хирургии 5,6,7. Результаты этого исследования подчеркивают важность тщательного предоперационного планирования, расширенной интеграции визуализации и постоянного совершенствования хирургических методов для повышения безопасности пациентов и улучшения послеоперационного восстановления8.
протокол
Данное исследование было одобрено Этическим комитетом Третьей аффилированной больницы Университета Сунь Ятсена, который отказался от требования информированного согласия в связи с анонимным ретроспективным дизайном данного исследования.
1. Отбор пациентов
- Подтвердите показания к операции.
ПРИМЕЧАНИЕ: 45-летний мужчина с длительной историей гепатита В и функцией печени класс А-Чайлд-Пью, оценка PS 0, уровень AFP 198,3 нг/мл. МРТ и КЭУЗИ показали опухоль размером 4 см 5 см 5 см в S4/7/8, что указывает на первичную ГЦК, тесно связанную с MHV и RHV (стадия опухоли - BCLC A). Коэффициент удержания ICG за 15 минут составляет 7,8%. SLV составил 1073 мл, а фактический объем печени — 1345 мл. В соответствии с рекомендациями Национальной комплексной онкологической сети (NCCN) было принято решение о проведении лапароскопической резекции сегментов печени S4/5/8 и частичной S7 путем резекции MHV с сохранением RHV. Будущий остаток печени (FLR) составил 590 мл, а FLR/SLV — 55%.
2. Информированное согласие
- Обсудите с пациентом процедуру, риски, преимущества и альтернативы. Получите информированное согласие.
3. Предоперационное обследование
- Выполняйте рутинные лабораторные анализы, включая общий анализ крови, функциональные пробы печени и профили свертываемости крови.
- Проведение визуализирующих исследований для локализации опухолей и оценки анатомии печени.
4. Оперативная настройка
- Проводят общую анестезию в соответствии со стандартными протоколами.
- Расположите пациента лежа на спине, слегка повернув его влево.
- Разместите троакары.
- Установите пневмоперитонеум с помощью иглы Вересса или открытой техники.
- Разместите 5 троакаров: Поместите один троакар с камерой 10 мм в пупок. Поместите рабочие троакары диаметром 5 мм или 10 мм в левый и правый верхний квадранты и, возможно, в эпигастральную область для гепатотомии.
5. Хирургическая техника
- Лапароскопическое исследование: Начните с тщательного обследования брюшной полости для оценки любых метастатических заболеваний или осложнений брюшной полости.
- Холецистэктомия: обнажите треугольник Калота, рассеките пузырный проток и кистозную артерию, затем дважды перевяжите их проксимальные концы. Пересеките сосуды и протоки, рассеките желчный пузырь от печеночного русла и добейтесь гемостаза на поверхности печеночного русла с помощью электрокаутеризации.
- Рассеките связку.
- С помощью ультразвукового скальпеля рассеките круглую связку печени, серповидную связку и частичную правую коронарную связку.
- Обнажите второй печеночный портал и корень печеночных вен (RHV, MHV и левая печеночная вена [LHV])
- Определите корешок MHV и отметьте линию пересечения левой печени с помощью электрокоагуляционного крючка (1 см вправо вдоль серповидной связки).
- Вытесните катетер 12# в качестве первого бандажа для блокады портала печени для процедуры Прингла.
- Проведите интраоперационное ультразвуковое сканирование (ИОИ).
- Просканируйте всю печень, чтобы исключить любые поражения, не обнаруженные до операции. Выберите высокочастотный лапароскопический датчик (7,5-10 МГц), прогрейте ультразвуковой пульт и отрегулируйте коэффициент усиления до 50-65 дБ.
- Отсканируйте расположение, размер и край опухоли, особенно связь с RHV и MHV.
- Отсканируйте правую/левую глиссионную ножку и местоположение RHV/MHV.
- С помощью сканирования ИОЗ отметьте край опухоли с помощью электрокоагуляционного крючка, обеспечив размер края резекции >1 см.
- Выполнение анатомической резекции (подход Такасаки)
- Выполните маневр Прингла для окклюзии притока ворот печени, затем рассеките правую переднюю ножку печени с помощью экстраперитонеального доступа.
- Разделите несколько небольших ветвей G5 и умеренно освободите правую переднюю ножку печени для облегчения окклюзии (используйте лапароскопический бульдог). Это облегчит отрезание правой передней печеночной ножки после того, как последующая паренхима печени будет разделена.
- Освободите окклюзию и понаблюдайте за линией ишемии печени.
- Внутривенно вводят ICG (3-5 мл, 0,025 мг/мл) после закрытия правой передней глиссониевой ножки. Используйте флуоресцентное окрашивание, чтобы наблюдать за протяженностью правого переднего сегмента.
- Отметьте левую линию резекции вдоль правой стороны серповидной связки, наклоненной к правой передней ножке печени на висцеральной поверхности. Отметьте правую линию резекции в соответствии с флуоресцентным окрашиванием.
- Выполнить транссекцию паренхимы печени.
- Используйте ультразвуковые скальпели и гармонические устройства для инициирования паренхиматозного пересечения вдоль демаркированной линии.
- При необходимости поддерживайте гемостаз с помощью биполярной электрокаутеризации.
- С левой стороны разделите несколько ветвей G4 и V4 до корня MHV.
- Разделите правую паренхиму печени и разделите правую переднюю ножку печени и MHV.
- Тщательно рассеките опухоль в S7, прилегающую к RHV.
Примечание: Поскольку опухоль была тесно связана с MHV и RHV, RHV сохранялась над MHV, поскольку FLR процедуры составляла 590 мл, а FLR/SLV - 55%.
- Завершите резекцию.
- Отделите резецированную печень от окружающих тканей.
- Тщательно рассекайте целевые сегменты, обеспечивая при этом безопасность всех основных судов.
- Забор образцов: Извлечение сегментов печени с помощью эндоскопического мешка для забора через самый большой порт или дополнительный разрез, если это необходимо.
6. Послеоперационный уход
- Мониторинг: Мониторинг жизненно важных показателей, баланса жидкости и функции печени в послеоперационном периоде.
- Обезболивание: Проводите соответствующую анальгезию (при наличии показаний рассмотрите возможность региональных блокад).
- Ранняя мобилизация: Поощряйте раннюю передвижение для ускорения выздоровления.
- Последующее наблюдение: Проведите контрольные визиты для оценки функции печени и заживления, а также устранения любых послеоперационных осложнений.
7. Документация и контроль качества
- Ведите подробный операционный отчет, включающий предоперационный диагноз, результаты, использованные методы, а также интраоперационные проблемы и решения.
- Структурированный анализ результатов и осложнений для дальнейшего повышения качества.
Результаты
Репрезентативные результаты применения флуоресценции индоцианина зеленого (ICG) в лапароскопической резекции печени демонстрируют его значительное влияние на результаты хирургического вмешательства, особенно в улучшение видимости сосудистых и желчных структур во время процедур.
Одним из наиболее заметных преимуществ использования навигации ICG при резекции печени является ее способность четко очерчивать края резекции не только на глиссоновской поверхности, но и глубоко внутри паренхимы печени. Дифференцируя васкуляризированную паренхиму от неваскуляризированной, хирурги могут более точно идентифицировать ишемизированные линии, что имеет решающее значение для обеспечения четких плоскостей диссекции и эффективного удаления тканей при сохранении жизненно важных структур. Например, на рисунке 1 показан подход Такасаки к блокировке правой передней ножки печени, демонстрирующий точную идентификацию ишемической линии хирургической бригадой.
На рисунке 2 выделен правый передний сегмент после внутривенного введения ИКГ, что обеспечивает важнейшую интраоперационную обратную связь по анатомии печени. Эта улучшенная визуализация способствует снижению предполагаемой кровопотери до 150 мл (Таблица 1), предполагая, что флуоресцентное руководство способствует более осторожной практике диссекции, помогая хирургам избежать повреждения окружающих сосудов.
Общая продолжительность процедуры 205 минут является приемлемой для сложных операций на печени. Пациент был выписан на шестой день без серьезных нежелательных явлений, таких как кровотечение или утечка желчи, что подчеркивает безопасность данной методики (Таблица 1). На рисунках 3 и 4 дополнительно показана пострезекционная анатомия, подтверждающая успешную резекцию критических сосудистых структур, включая LHV, MHV, IVC и RHV, тем самым сводя к минимуму риск осложнений.

Рисунок 1: Подход Такасаки. Подход Такасаки к блокировке правой передней печеночной ножки (с использованием лапароскопического бульдога для блокировки правой передней печеночной ножки и отображения ишемической линии) Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Флуоресцентное окрашивание для идентификации правого переднего сегмента. Вводят внутривенно ICG в дозе 3-5 мл в концентрации 0,025 мг/мл. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
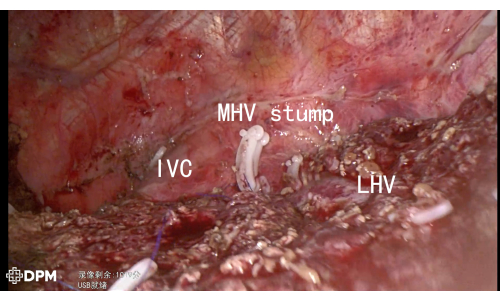
Рисунок 3: LHV/MHV/IVC продемонстрирован после резекции печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
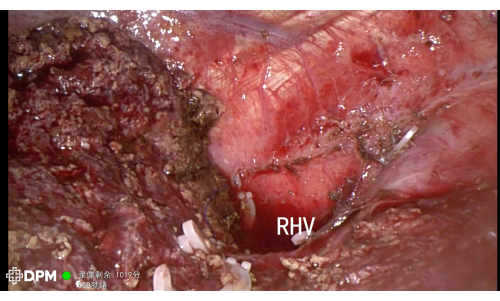
Рисунок 4: РГВ продемонстрирована после резекции печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Кровопотеря | 150 мл | |
| Длительность | 205 мин | |
| Пребывание в больнице | 6 дней | |
| Дренаж | День 1 | 200 мл |
| День 4 | 50 мл | |
Таблица 1: Детали операции
Обсуждение
Лапароскопическая анатомическая гепатэктомия с использованием подхода Такасаки и флуоресцентной навигации ICG включает в себя несколько критических этапов, которые необходимы для обеспечения оптимальных результатов. Одним из наиболее важных аспектов является предоперационная оценка, которая включает в себя визуализирующие исследования, такие как МРТ и ультразвуковое исследование с контрастным усилением (CEUS) для точной локализации опухоли и оценки анатомии печени. Этот шаг имеет жизненно важное значение для планирования хирургического подхода, особенно для сложных сегментарных резекций (S4/5/7/8)9.
Еще одним важным шагом является администрирование ICG. Внутривенное введение ИКГ (3-5 мл, 0,025 мг/мл) после блокирования правой передней ножки печени улучшает визуализацию печеночного кровотока во время операции. Это руководство по флуоресценции позволяет в режиме реального времени оценивать перфузию печени и помогает определить критические анатомические ориентиры10. Кроме того, подход Такасаки подчеркивает систематическое рассечение и сохранение сосудистых структур, что сводит к минимуму риск ишемии и послеоперационной печеночной недостаточности11. Интеграция интраоперационного ультразвукового исследования (УЗИ) для оценки края опухоли и проверки анатомии сосудов также имеет решающее значение, поскольку он позволяет точно демаркировать линии резекции, обеспечивая четкие края и уменьшая осложнения12.
Несмотря на то, что протокол разработан как всеобъемлющий, некоторые изменения могут повысить его эффективность. Например, время введения ИКГ может быть скорректировано в зависимости от функции печени пациента и сложности резекции. В случаях, когда коэффициент удержания ICG является неоптимальным, хирурги могут рассмотреть возможность введения более высокой дозы или корректировки времени введения для улучшениявизуализации.
Кроме того, если визуализация флуоресценции неадекватна, могут потребоваться стратегии устранения неполадок. Если флуоресценция не дает четкого представления об анатомии печени, хирурги должны убедиться в правильном введении ИКГ и оптимальном функционировании системы визуализации. Интраоперационные корректировки, такие как изменение условий освещения или угла наклона камеры, также могут улучшить обнаружение флуоресценции. Более того, если происходит неожиданное кровотечение, глубокое понимание анатомии сосудов, визуализируемой ICG, позволяет быстро идентифицировать и лечить кровоточащиесосуды.
Несмотря на свои преимущества, использование флуоресцентной навигации ICG при лапароскопической гепатэктомии имеет ограничения. Одной из существенных проблем является вариабельность показателей удержания ICG, на которую могут влиять функция печени, целостность сосудов и характеристики опухоли14. У пациентов с нарушенной функцией печени, например, с циррозом печени, сигнал флуоресценции может быть менее надежным, что потенциально может привести к неадекватной визуализации критических структур.
Кроме того, опора на флуоресцентную визуализацию может привести к чрезмерной уверенности в принятии интраоперационных решений, особенно если хирурги пренебрегают традиционными анатомическими ориентирами и полагаются исключительно на флуоресценциюдля руководства. Существует также кривая обучения, связанная с этой техникой, поскольку хирурги должны стать опытными в интерпретации флуоресцентных изображений и интеграции их в свой хирургический рабочийпроцесс.
Интеграция флуоресцентной навигации ICG в лапароскопическую анатомическую гепатэктомию представляет собой значительный шаг вперед по сравнению с традиционными методами. При использовании традиционных подходов часто отсутствует обратная связь в режиме реального времени, которую обеспечивает флуоресцентная визуализация, что может привести к увеличению осложнений, таких как кровотечение или неполная резекция9. Улучшая визуализацию, флуоресценция ICG позволяет проводить более точные диссекции и лучше сохранять здоровые ткани, что имеет решающее значение для поддержания функции печени после операции.
Кроме того, подход Такасаки в сочетании с ICG предлагает систематический метод сегментарной резекции печени, который может стандартизировать процедуры и улучшить результаты в различных хирургическихбригадах. Такая интеграция передовых технологий визуализации не только повышает безопасность хирургических операций, но и согласуется с более широкой тенденцией к минимально инвазивным методам гепатобилиарной хирургии, способствуя более быстрому выздоровлению исокращению продолжительности пребывания в больнице.
Заглядывая в будущее, можно сказать, что применение флуоресцентной навигации ICG в лапароскопической хирургии печени имеет перспективы для дальнейшего развития. Будущие исследования могут быть сосредоточены на оптимизации протоколов дозирования ICG и совершенствовании технологий визуализации для улучшения визуализации в сложных случаях, например, связанных с циррозом печени или сложной сосудистой анатомией.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Работа выполнена при поддержке Национального фонда естественных наук Китая (грант No 82100692) и Научно-технической программы Гуанчжоу (грант No 202201011097).
Материалы
| Name | Company | Catalog Number | Comments |
| Indocyanine green for injection | Dandong Yichuang Pharmaceutical Co., Ltd. | H20055881 | |
| Harmonic devices | Affacare Medical (Beijing) Co., Ltd | AH-1200 | |
| Laparoscopic bulldog | B. Braun Aesculap Co.,Ltd | https://catalogs.bbraun.com/en-01/p/PRID00004560/bulldog-clips | |
| Surgical system | Deeper Network Technologies Co., Ltd | https://www.digipmc.com/Product/info/1071 | |
| Ultrasonic scalpels | Affacare Medical (Beijing) Co., Ltd | AH-600 | |
| Ultrasound | ALOKA Co., Ltd | ARIETTA 850 | |
| Veress needle | Hangzhou Kangji Medical Instrument Co.,Ltd. | https://www.kangjimed.com/laparoscopic-instruments-/surgical-needle-or-knife-/veress-needle-.html |
Ссылки
- Takasaki, K., Yokoyama, Y. Laparoscopic anatomical liver resection: Takasaki's approach and technique. Surg Endosc. 28 (8), 2205-2212 (2014).
- D'Hondt, M., Berrevoet, W. V. P. Indocyanine green fluorescenceguided liver surgery: a review of the literature with focus on liver resection. J Hepatobiliary Pancreat Sci. 26 (8), 317-327 (2019).
- D'Angelica, M. I., Allen, P. J. The evolution of laparoscopic liver resection: going from open surgery to minimally invasive techniques. Liver Cancer. 4 (3), 163-172 (2015).
- Dufour, M., Abou Ali, E. F., Kianmanesh, R. Laparoscopic anatomical liver resection: technical aspects and clinical outcomes. World J Gastroenterol. 27 (17), 2079-2092 (2021).
- Doku, M., Ferlay, N. M. C. F. Fluorescent imaging in liver surgery: is it the future of resection technique. Surg Oncol. 35, 120-126 (2020).
- Choi, S. H., Kim, J. H., Park, K. J. The role of indocyanine green (ICG) fluorescence in laparoscopic liver surgery. J Surg Res. 221, 64-70 (2017).
- Lang, H., Liu, H. Minimally invasive liver resection: current strategies and future directions. Hepat Surg. 12 (1), 1-8 (2018).
- Nguyen, K. T., Tsung, A., Zhang, J. Current approaches in laparoscopic liver resection: evidencebased strategies. J Gastrointest Surg. 20 (9), 1592-1601 (2016).
- Klein, A., Golling, M., Schmid, M. Laparoscopic liver surgery: current status and outlook. J Minim Invasive Surg. 22 (1), 19-25 (2019).
- Kumar, R., Wong, T., Cheong, C. Use of indocyanine green fluorescence for laparoscopic liver resections: a review of the literature. Surg Endosc. 34 (6), 2373-2383 (2020).
- Takasaki, K., Shimizu, H., Matsumoto, J. The Takasaki approach for anatomical liver resection: insights into its technique and benefits. Am J Surg. 215 (4), 796-801 (2018).
- Gonzalez, M., Morton, S., Keck, T. Advances in laparoscopic liver resection: contemporary techniques and emerging technologies. Eur J Surg Oncol. 47 (3), 541-549 (2021).
- Tzeng, C. W. D., Wang, M. L., Huang, J. Optimizing indocyanine green dosage for liver surgery: impacts and clinical applications. J Surg Res. 246, 181-189 (2020).
- Matsui, Y., Nomura, T., Takai, Y. The role of indocyanine green in liver surgery: current perspectives and future directions. World J Gastroenterol. 27 (8), 599-612 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены